Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Untersucht die nachteiligen Effekte der Low Druck Plasmasterilisation auf das Überleben von Bacillus Subtilis Sporen mittels Live Cell Mikroskopie
In diesem Artikel
Zusammenfassung
Dieses Protokoll zeigt die wichtigen aufeinander folgenden Schritte erforderlich, um die Relevanz der Überwachung Vitalität Parameter und DNA-Reparaturprozesse in Bacillus Subtilis Sporen nach der Behandlung mit Niederdruckplasma Wiederbelebung durch tracking Fluoreszenz-markierten DNA-Reparatur Proteine über zeitaufgelösten konfokalen Mikroskopie und Rasterelektronenmikroskopie.
Zusammenfassung
Plasmasterilisation ist eine vielversprechende Alternative zu herkömmlichen Sterilisationsverfahren für Industrie-, klinische, und Raumfahrt. Niederdruck-Plasma (LPP)-Entladungen enthalten ein breites Spektrum an aktiven Spezies, die zu schnellen mikrobiellen Inaktivierung führen. Um die Effizienz und die Mechanismen der Sterilisation durch BVG zu untersuchen, verwenden wir die Testorganismen Bacillus Subtilis Sporen wegen ihrer außerordentlichen Widerstand gegen konventionelle Sterilisationen. Wir beschreiben die Herstellung von B. Subtilis Sporen Monolagen, die Sterilisation durch Niederdruck-Plasma in einem Doppel Induktiv gekoppelte Plasma-Reaktor, die Charakterisierung der Spore Morphologie mit Rasterelektronenmikroskopie (SEM), und die Analyse der Keimung und Auswuchs der Sporen durch live Zelle Mikroskopie. Ein wichtiges Ziel der Plasma-Arten ist genomic Materials (DNA) und Reparatur von Plasma-induzierten DNA-Läsionen bei Spore Wiederbelebung ist entscheidend für das Überleben des Organismus. Hier untersuchen wir die Keimfähigkeit der Sporen und die Rolle der DNA Reparatur während der Keimung der Spore und Auswuchs nach der Behandlung mit BVG durch die Verfolgung Eindringmittel gekennzeichnet DNA-Reparatur-Proteine (RecA) mit zeitaufgelösten konfokale Fluoreszenzmikroskopie. Behandelte und unbehandelte Spore Monolagen sind aktiviert für die Keimung und visualisiert mit einem invertierten konfokale live Zelle Mikroskop im Laufe der Zeit, die Reaktion der einzelnen Sporen zu folgen. Unsere Beobachtungen zeigen, dass der Anteil der Keimen und Sporen entwachsen abhängig von der Dauer der LPP-Behandlung ein Minimum erreichen ist, nach 120 RecA-YFP s. (gelbe Fluoreszenz Protein) Fluoreszenz wurde nur in paar Sporen erkannt und entwickelt in allen Zellen mit eine leichte Erhöhung im BVG-behandelten Sporen entwachsen. Darüber hinaus einige der vegetativen Bakterien aus BVG-behandelten Sporen zeigten eine Zunahme im Zytoplasma und tendenziell aufzulösen. Die beschriebenen Methoden zur Analyse der einzelnen Sporen könnte beispielhaft für das Studium anderer Aspekte der Spore Keimung und Auswuchs.
Einleitung
Ein wesentliches Ziel der Weltraumforschung ist die Suche nach Signaturen von Lebensformen und Biomolekülen auf andere Himmelskörper und Monde in unserem Sonnensystem. Die Übertragung von Mikroorganismen oder Biomoleküle irdischen Ursprungs zu kritischen Bereichen der Exploration ist besonders gefährdet, Einfluss auf die Entwicklung und die Integrität des Lebens-Erkennung Missionen auf Himmelskörper wie Mars und Europa1. Die internationalen Richtlinien der planetaren Schutz, gegründet 1967 durch Ausschuss Space Research (COSPAR) strenge Vorschriften für die bemannte und unbemannte Missionen zu anderen Planeten, deren Monde, Asteroiden und andere Himmelskörper zu verhängen und regulieren die Reinigung und Sterilisation von ein Raumschiff und kritischen Hardwarekomponenten vor, um Verunreinigung irdische Mikroorganismen zu beseitigen und zu verhindern Kreuzkontamination von Himmelskörpern2zu starten. Im letzten Jahrzehnt hat die Anwendung von nichtthermischen Plasmen breite Aufmerksamkeit in der biomedizinischen und ernährungswissenschaftliche Forschung sowie in Raumfahrt-Anwendungen3,4,5gewonnen. Plasmasterilisation ist eine vielversprechende Alternative zu herkömmlichen Sterilisationsmethoden, da sie schnelle und effiziente mikrobielle Inaktivierung6, dabei sanft, sensibel und labil Materialien Wärme bietet. Plasma-Entladungen enthalten eine Mischung aus reaktiven Substanzen wie freie Radikale, geladene Teilchen, Neutral/aufgeregt Atome, Photonen im Ultraviolett (UV) und Vakuum-Ultraviolett (VUV) Spektrum führen zu schnellen mikrobiellen Inaktivierung3. In dieser Studie verwenden wir Niederdruckplasma erzeugt durch doppelte Induktiv gekoppelte Niederdruck-Plasma (DICP) Quelle7,8 , um Bacillus Subtilis Endosporen verteilt auf Test Glasoberfläche zu inaktivieren.
Gram-positiven Bakterien der Familie Bacillaceae sind weit verbreitet in natürlichen Lebensräumen von Böden, Sedimenten und Luft sowie in außergewöhnlichen Umgebungen wie Reinraumanlagen und der internationalen Raumstation ISS9,10 ,11. Das auffälligste Merkmal der Gattung Bacillus ist die Fähigkeit, hochresistente ruhende Endosporen (nachfolgend Sporen) zu bilden, um ungünstige Bedingungen, wie z. B. Nährstoffverarmung12zu überleben. Sporen sind in der Regel wesentlich widerstandsfähiger als ihre Gegenstücke der vegetativen Zelle zu einer Vielzahl von Behandlungen und Umwelteinflüsse wie Hitze, UV, Gammabestrahlung, Austrocknung, mechanische Störungen und giftige Chemikalien, wie z. B. starken Oxidationsmitteln oder pH-Wert-Änderung Agenten (rezensiert in Referenzen13,14) und sind daher ideale Objekte zur Prüfung der Wirksamkeit von mikrobiellen Inaktivierungsverfahren. Da genomischer DNA ein wichtiges Ziel der Plasmabehandlung von Bakterien15,16, die Reparatur von Plasma-induzierten DNA-Läsionen ist (z. B. DNA-Doppelstrang Brüche) auf Spore Revival ist entscheidend für das Überleben der Bakterien13, 17.
So, wir studieren die Keimfähigkeit der Sporen und die Rolle der DNA-Reparatur während der Keimung der Spore und Auswuchs nach der Behandlung der Sporen mit Niederdruck-Argon-Plasma durch folgende einzelne Sporen und ihren Ausdruck der Fluoreszenz-markierten DNA zu reparieren RecA-Protein mit zeitaufgelösten konfokale Fluoreszenzmikroskopie. Wir geben eine Schritt für Schritt Anleitung für die Zubereitung von B. Subtilis Sporen in Monolagen zur Erreichung reproduzierbare Testergebnisse, die Behandlung von Spore Monolagen mit Niederdruck-Plasma für die Sterilisation, die Vorbereitung von Plasma behandelt Sporen für Ultrastrukturforschung Auswertung über Rasterelektronenmikroskopie (SEM) und live Zellanalyse Mikroskopie auf der Ebene der einzelnen Sporen im Konzert mit der Überwachung der aktiven DNS Reparatur Prozesse, die innerhalb der Zelle in Reaktion auf die Plasmabehandlung.
Protokoll
1. Bacillus Subtilis Sporen Herstellung und Reinigung
- Für die Produktion der Spore, übertragen eine 5 mL über Nacht Kultur des jeweiligen B. Subtilis -Stamm, ergänzt mit geeigneten Antibiotika, 200 mL Doppel-Stärke Schaeffer Sporenbildung Flüssigmedium (pro Liter 16 g Nährbouillon, KCl 2 g, 0,5 g MgSO 4* 7 H2O, 2 mL 1 M Ca (NO3)2, 2 mL 0,1 M MnCl2 * • 4 H2O, 2 mL 1 mM FeSO4, 2 mL 50 % (w/V) Glukose18) und kräftige Belüftung bei 37 ° C für 72 h oder bis > 95 % der Kultur zu pflegen hat haben. Die Sporen der folgenden Sorten verwendet: B. Subtilis PY79 (wild-Typ) B. Subtilis PY79ΔRecA:: Neo (mangelhaft DNA Reparatur Protein RecA) B. Subtilis PY79 RecA-Yfp:: Katze (RecA verschmolzen mit gelb fluoreszierendes Protein [YFP]19).
- Sporen durch Zentrifugation für 15 min bei 3.000 x g in 50 mL Röhrchen zu ernten und die Proben durch mehrmaliges Waschschritte (bis zu 15 Mal) mit sterilem destilliertem H2O und Check für Reinheit und Keimfähigkeit Status durch Phasenkontrast-Mikroskopie zu reinigen. Sicherstellen Sie, dass Spore Suspensionen bestehen aus Phase-hellen Sporen (> 99 %) und sind frei von vegetativen Zellen (Stangen), gekeimte Sporen (schwarz / grau aussehen) und Zellenrückstand, sonst weiter Mikroskopie Experimente gestört werden können. Waschen Sie die Probe, bis gewünschte Reinheit erreicht ist.
- Determinate der Spore-Titer durch Plattieren, 50 µL 10-divisibel Verdünnungsreihen auf LB-Agar (d.h.: Einsatz 30 µL Probe + 270 µL sterilem Wasser für eine 01:10 Verdünnung. Nehmen Sie 30 µL aus bestimmten Verdünnung 270 µL H2O für eine 1: 100 Verdünnung, usw.) für die Berechnung der KBE (Koloniebildenden Einheiten) und über Nacht die Platten bei 37 ° C inkubieren. Einstellen Sie nach CFU Entschlossenheit zu 109 Sporen pro mL Probe durch Konzentration oder Verdünnen mit sterilem Wasser.
2. Probenvorbereitung von Aerosol-hinterlegt Bacillus Subtilis Sporen
Hinweis: Ansammlung und Überlagerung von Sporen könnte zu Abschattungen während der Behandlung schließlich mit dem Ergebnis in gefälschten Inaktivierung Kinetik. Um dieses Problem zu minimieren, bereiten Sie Spore Proben um ein Aerosol-Abscheidung Technik20 vor. Kurz, Steuern Sie die Präzisions-zwei-Stoff-Düse mit einem elektrischen Timer, der Flüssigkeitsdurchsatz im Konzert mit dem Fluss des unter Druck stehenden Trägergas (hier N2) reguliert. Die injizierte flüssige Probe durch Düsenaustritt mit Stickstoff Gas Flow zu zerstreuen.
- Legen Sie einen Probenträger in Form von sterilisierten mikroskopische Dias (für Überleben Kinetik) oder rund 25 mm Deckgläsern (fluoreszierende Nachverfolgung der DNA-Reparatur Prozesse/cLSM; konfokale Laser-scanning-Mikroskopie) innerhalb der elektrisch betriebenen Aerosol Spritzen Einheit in Übereinstimmung mit der Düse. Die verwendeten Spore-Konzentration muss entsprechen eine Hundertfache des gewünschten Endkonzentration.
- 1 mL der Spore-Kultur auf der Düse Fluid Einlass übertragen und initiieren Spritzverfahren von 0,1 s bei einem Druck von 1,3 Bar. Die gespritzten Spore-Suspension (1 x 107) bildet einen dünnen Film auf der mikroskopischen Folie, die schnell trocknet innerhalb von Sekunden eine gleichmäßig verteilte Spore monomolekularen Film zu bilden. Lagern Sie die behandelten Probenträger in einen sterilen Behälter bei Raumtemperatur.
(3) Niederdruck-Plasma-Behandlung
- Bereiten Sie das Plasmasystem für die Behandlung von biologischen Proben und bedienen Sie das System auf 5 Pa mit Argon-Plasma bei 500 W für 5 Minuten. Dadurch werden alle Flächen im System gereinigt und erwärmt. Dadurch Verkleben der Moleküle aus der Umgebungsluft, nämlich Stickstoff, Sauerstoff und Wasser, während das System entlüften. Nach der Vorbehandlung des Systems Entlüften der Kammers und legen Sie die Proben vorsichtig in der Mitte des Reaktordruckbehälters mit Hilfe von Glasgestelle.
- Verwenden Sie mindestens drei biologische repliziert. Schließen Sie die Kammer und evakuieren unter 2 PA. Füllen Sie danach das Prozessgas in die Kammer. Regulieren den Druck im System auf 5 Pa.
- Schalten Sie nach der definierten Zeit den Strom und Gas Versorgung und entlüften Sie sorgfältig des Systems, um zu verhindern, weht die Proben aus dem Probenhalter. Entfernen Sie nach Belüftung die Proben und die Proben für den nächsten Parameter im System. Für Plasma-unbehandelten Kontrollen Proben nur Vakuum aussetzen (5 Pa) in Gegenwart des Prozessgases gleichbedeutend mit der längsten angewandte Plasma-Zeit.
4. Verwertung und Auswertung der Spore überleben
- Bereiten Sie eine Lösung von autoklaviert 10 % Polyvinylacetat (PVA) und decken die Probenträger sorgfältig mit ca. 500 µL und lassen Sie sie an der Luft trocknen für 4 Std. Streifen Sie den getrockneten PVA-Layer (jetzt mit der Spore-Probe) mit sterilen Pinzette und überträgt es auf 2 mL Reaktionsgefäß. Das Rohr 1 mL sterilem Wasser hinzufügen und Auflösen der PVA-Layer über aufschütteln. Dieses Verfahren führt zu > 95 % Wiederherstellung von Sporen und hat keinen Einfluss auf ihre Keimung Fähigkeit21.
- Verdünnen Sie die Probe seriell bei 01:10 in sterilem Wasser in eine 96-Well-Platte (d. h. 270 µL steriler H2O + 30 µL Probe/ehemalige Verdünnung). Platte aus 50 µL jeder Verdünnung auf Lysogeny Brühe Nähragar (LB), über Nacht die Platten bei 37 ° C inkubieren und Listen Sie die Anzahl der gewachsenen Kolonien (CFU).
5. live Cell Mikroskopie und Verfolgung von DNA-Reparaturprozesse in keimenden Sporen
- Für die Keimung Experimente, bereiten eine 1 mm Dicke 1,5 % LB-Agar-Pad, durch Kochen 700 µL Medium und Pipettieren es in eine Petrischale sterile Mikroskopie. Nach 10 min ein 8 x 8 mm x 1 mm LB-Agar-Pad mit einem sterilen Skalpell ausgeschnitten und transfer der Agar sorgfältig auf die Spore-Monoschichten die auf 25 mm Glasdeckgläser ruhen.
Hinweis: Dieser Schritt ist entscheidend für die Visualisierung der einzelnen Sporen und können nach ihrer Reaktion auf die Aktivierung der Keimung durch den Nähragar induziert. So, die LB-Agar dient zwei Zwecken, (1) die Sporen an der Oberfläche zu beheben die Relokalisierung entlang der Oberfläche und aus dem optischen Fokus vermeidet, und (2) für die Keimung die Spore zu aktivieren. - Nach dem abdecken der Probe mit Agar, übertragen die Glas-Deckglas schnell in einer bildgebenden Kammer und Mikroskop die Proben mit einem automatisierten konfokale Laserscanning-Mikroskop mit invertierten Optik mit einem 63 X / 1,3 Flugzeug apochromatische Öl eintauchen Ziel.
-
Führen Sie Bildgebung der Fluoreszenz (YFP) mit einer Erregung Wellenlänge von 514 nm und Emission zwischen 520 und 560 nm detektiert werden.
- Hellfeld Aufnahmen im scanning-Modus unter Verwendung eines Foto-Multiplikatoren (Durchlicht-Pfad).
- Zeitraffer-Serie mit einer Laserleistung von 2,6 % aufnehmen, und stellen Sie die konfokale Blende 5 luftigen Einheiten und bei einer Samplefrequenz von 1 Bild pro 30 s von 0 h bis 5 h, je nach dem Experiment. Es ist besonders zu beachten, dass hohe Dosen von monochromen-Beleuchtung bei 514 Laser nm vollständig hemmen Keimung (Abbildung 1A, B).
- Halten Sie die Proben bei 37 ° C (Umgebungsluft Feuchtigkeit) in eine Heizstufe während der gesamten imaging-Prozess. Verwenden Sie mindestens drei biologische Wiederholungen für jede Bedingung. Im Falle einer Spore Aggregation, vielschichtigen Spore Verteilung oder Kontamination durch Staubpartikel Sperrung der Plasmabehandlung ("shadowing") könnte auftreten und Keimung beschattet Sporen (Abbildung 1C, D) zu ermöglichen.
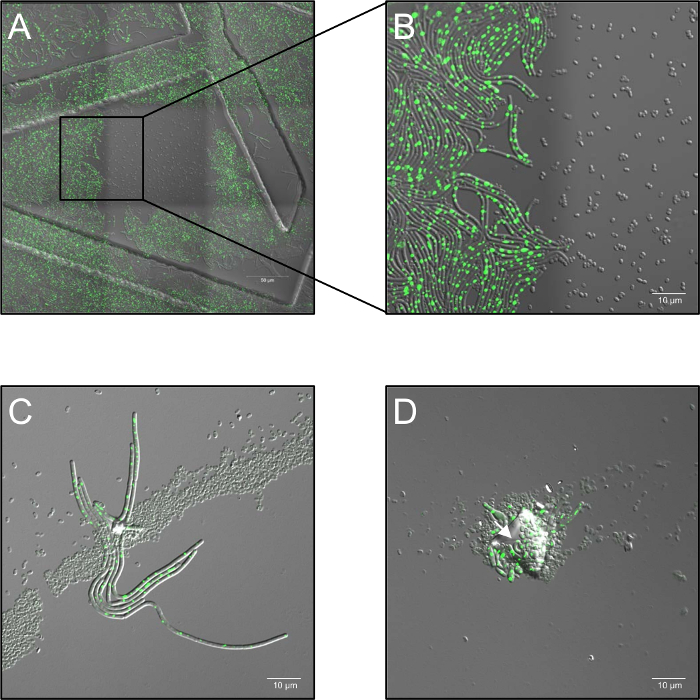
Abbildung 1: mögliche Probleme beim konfokale live Zelle Fluoreszenzmikroskopie von Plasma behandelt Sporen beobachtet. (A, B) Hemmung der Spore Keimung durch hohe Dosen von monochromatischen (514 nm) laser-Beleuchtung. (A) Übersicht (3 x 3 genähte Bilder) von B. Subtilis (LAS72, RecA-YFP) Sporen 180 min nach Beginn der Keimung. Der Rahmen in der Mitte in 30 s Intervallen zu hohe Dosen von Laserlicht (514 nm, 70 % Laserleistung) ausgesetzt war, während die umliegenden Regionen (= Frames) nicht beleuchtet waren (zusammengefügte Bild von Hellfeld Kanal und RecA-YFP Fluoreszenz; Strukturen wurden bestellt verursacht durch Verwendung von 35 mm Gerichte mit einem aufgedruckten 500 µm Raster imaging). (B) zeigt eine 4 X vergrößerte Ansicht der Grenze zwischen beleuchtete und unbeleuchtete Region zeigen, dass Sporen, die hohe Dosen von monochromatischen Laser Beleuchtung ausgesetzt wurden nicht keimen und wachsen, während Sporen unbeleuchtete Regionen erholen voll auf vegetative Bakterien helle RecA-YFP Fluoreszenz (grünes Signal) zum Ausdruck zu bringen. (C, D) Sporen fallenden Partikel Verunreinigung oder mehrere Schichten von Spore (Pfeile) scheint zu schützen zugrunde liegende Sporen vor Inaktivierung durch Plasmabehandlung und ermöglichen ihre Keimung und Auswuchs ("shadowing-Effekt"). (C) Sporen waren plasmabehandelte für 60 s und abgebildeten 180 min nach Beginn der Keimung oder (D) für 120 s und abgebildet nach 240 min. Klicken Sie bitte hier, um eine größere Version dieser Figur.
6. Rasterelektronenmikroskopie (SEM)
- Verwenden Sie Rasterelektronenmikroskopie, um über die Oberflächenmorphologie Plasma behandelt Sporen im Vergleich zu unbehandelten Kontrollen Ultrastrukturforschung Auskunft. Beschichtung von getrockneten Spore Monolagen auf Deckgläsern mit Gold-Palladium (3 nm) mithilfe eines Sputter Coater. Verwenden Sie ein Feldemission Rasterelektronenmikroskop für imaging-Proben, mit 5 kV Beschleunigungsspannung auch einen-Objektiv-Sekundär-Elektronen-Detektor, Topographie Kontrast zu offenbaren betrieben.
7. die Datenanalyse
- Bestimmen Sie die Spore Überleben aus der Quotient N/N0, wo N ist die durchschnittliche KBE behandelten Proben und N0 ist der Durchschnitt KBE der unbehandelten Vakuum Kontrollen. Plot-Spore Inaktivierung durch Argon-Plasma-Behandlung als Funktion der Zeit (in Sekunden). Bitte alle Daten als Mittelwerte und Standardabweichungen (n = 3).
- Analysieren Sie Bilder von live Cell Imaging über die imaging-Software. Den Anteil der Spore Keimung zu quantifizieren und entwachsen nach Plasmabehandlung, Graf Sporen in repräsentativen Rahmen zu Beginn des Experiments sowie nach 4 h. Zur Bestimmung der Bedeutung in Spore überleben Assays verwenden Sie One-Way ANOVA-Tests (Varianzanalyse) mit Statistiksoftware). P -Werte < 0,05 gelten als statistisch signifikant.
Ergebnisse
Überleben der plasmabehandelte B. Subtilis Sporen
Plasmabehandlung von B. Subtilis Sporen verwendet in dieser Studie zeigen einen Rückgang der überleben mit zunehmender Dauer der Plasmabehandlung (Abbildung 2). Sporen des Stammes mit dem Ausdruck der RecA-gen verschmolzen, YFP zeigte Überleben Kurven ähnlich wie Sporen der Wildtyp-Stamm, darauf hinweist, dass die gentech...
Diskussion
Sterilisation von Oberflächen mittels Niedertemperatur-Niederdruck-Plasma ist eine vielversprechende Alternative zu eher konventionelle Sterilisationsverfahren wie die Behandlung mit ionisierender Strahlung, Chemikalien (z.B. Gase wie H2O2 oder Ethylenoxid) oder trockene und feuchte Hitze23. Gewöhnliche Sterilisationsmethoden bieten meist eine effektive Sterilisation, aber sie sind dafür bekannt, die Einfluss auf des behandelten Materials und stellen ein potenziel...
Offenlegungen
Keine Interessenkonflikte erklärt.
Danksagungen
Die Autoren danken Andrea Schröder für ihre hervorragenden technischen Betreuung während Teile dieser Arbeit und Nikea J. Ulrich für ihre Unterstützung während dem Videodreh. Wir möchten auch Danke Lyle A. Simmons für seine großzügige Spende der Bacillus Subtilis Sorten: LAS72 und LAS24. Diese Arbeit wurde in Teilen durch Zuschüsse von der Deutschen Forschungsgemeinschaft (DFG) Paketantrag (PlasmaDecon PAK 728), PA (AW 7/3-1) unterstützt und der RM (MO 2023/2-1) und das DLR gewähren DLR-FuW-Projekt ISS Leben, Programm RF-FuW, Teilprogramm 475 (F.M.F, M.R. und r.m.). F.M.F. wurde durch ein Promotionsstipendium der Helmholtz-Gemeinschaft Raum Life Sciences Research School (SpaceLife) am Deutschen Aerospace Center (DLR) in Köln, Deutschland, unterstützt von der Helmholtz-Gemeinschaft (Helmholtz-Gemeinschaft) über einen Zeitraum von sechs Jahren (finanziert wurde Grant Nr. VH-Ko-300) und erhielt zusätzliche Mittel von der DLR, einschließlich Luft-und Vorstand und dem Institute of Aerospace Medicine. Die Ergebnisse dieser Studie werden in der Dissertation von Felix M. Fuchs berücksichtigt.
Materialien
| Name | Company | Catalog Number | Comments |
| Two substance nozzle (model 970-8) | Schlick | 14,404 | 230 V, 50 Hz, D 4.484/8, 0.8 mm bore diameter |
| Luria Bertani Medium | Sigma Aldrich | 70122-100G | |
| Tube connectors | Festo | n/a | G 1/8 |
| Magnetvalve DO35-3/2NC-G018-230AC | Bosch Rexroth | 820005100 | |
| PLN Polyamid tube | Festo | 558206 | d = 6 mm |
| Glass slides | VWR | 48300-026 | |
| Electric Timer 550-2-C | Gefran | F000074 | 220 V |
| attofluor cell chamber | Menzel, Fisher Ref. | 3406816 | d=25 mm, round |
| MgSO4*7 H2O | Sigma Aldrich | 13152 | |
| Ca(NO3)2 | Sigma Aldrich | 202967 | |
| MnCl2 * 4 H2O | Sigma Aldrich | 244589 | |
| FeSO4 * 7H2O | AppliChem | 13446-34-9 | |
| Glucose | Merck | 215422 | |
| KCl | Sigma Aldrich | P9541-500G | |
| Nutrient Broth (NB) | Merck | 105443 | |
| Luria-Bertani (LB) | Merck | 110283 | |
| 96-wellplate | ThermoFisher | 243656 | |
| Zeiss LSM 780, Axio Observer Z1 | Carl Zeiss Microscopy GmbH | n/a | |
| Leo 1530 Gemini | Carl Zeiss Microscopy GmbH | n/a | |
| ZEN 2 and ZEN lite 2012 (Software) | Carl Zeiss Microscopy GmbH | n/a | |
| SigmaPlot, version 13.0 (Statistic software) | Systat GmbH, Erkrath, Germany | n/a | |
| Attofluor cell chamber | Invitrogen | A7816 | |
| µ-Dish 35 mm, high Grid-500 Glass Bottom | ibidi | 81168 |
Referenzen
- Nicholson, W. L., Schuerger, A. C., Race, M. S. Migrating microbes and planetary protection. Trends Microbiol. 17, 389-392 (2009).
- COSPAR. COSPAR Planetery Protection Policy. Space Research Today, COSPAR's Information Bulletin. 193, 1-14 (2015).
- De Geyter, N., Morent, R. Nonthermal plasma sterilization of living and nonliving surfaces. Annu Rev Biomed Eng. 14, 255-274 (2012).
- Shimizu, S., et al. Cold atmospheric plasma - A new technology for spacecraft component decontamination. Planet. Space Sci. 90, 60-71 (2014).
- Lerouge, S., Fozza, A. C., Wertheimer, M. R., Marchand, R., Yahia, L. H. Sterilization by Low-Pressure Plasma: The Role of Vacuum-Ultraviolet Radiation. Plasma Polym. 5, 31-46 (2000).
- Rossi, F., Kylián, O., Rauscher, H., Gilliland, D., Sirghi, L. Use of a low-pressure plasma discharge for the decontamination and sterilization of medical devices. Pure Appl. Chem. 80, 1939-1951 (2008).
- Halfmann, H., Hauser, J., Awakowicz, P., Koller, M., Esenwein, S. A. A double inductively coupled low-pressure plasma for sterilization of medical implant materials. Biomed Tech (Berl). 53, 199-203 (2008).
- Halfmann, H., Denis, B., Bibinov, N., Wunderlich, J., Awakowicz, P. Identification of the most efficient VUV/UV radiation for plasma based inactivation of Bacillus atrophaeus spores. J. Phys. D: Appl. Phys. 40, 5907 (2007).
- Vaishampayan, P., et al. Bacillus horneckiae sp. nov., isolated from a spacecraft-assembly clean room. Int J Syst Evol Microbiol. 60, 1031-1037 (2010).
- Mandic-Mulec, I., Stefanic, P., van Elsas, J. D. Ecology of Bacillaceae. Microbiol Spectr. 3, (2015).
- Alekhova, T. A., et al. Diversity of bacteria of the genus Bacillus on board of international space station. Dokl Biochem Biophys. 465, 347-350 (2015).
- Claus, D., Bekerley, R. C. W., Sneath, P. A. Genus Bacillus Cohn 1872. Bergey's manual of systematic bacteriology. 2, 1105-1141 (1986).
- Setlow, P. Spore Resistance Properties. Microbiol Spectr. 2, (2014).
- Setlow, P. Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. J Appl Microbiol. 101, 514-525 (2006).
- Roth, S., Feichtinger, J., Hertel, C. Characterization of Bacillus subtilis spore inactivation in low-pressure, low-temperature gas plasma sterilization processes. J Appl Microbiol. 108, 521-531 (2010).
- Roth, S., Feichtinger, J., Hertel, C. Response of Deinococcus radiodurans to low-pressure low-temperature plasma sterilization processes. J Appl Microbiol. 109, 1521-1530 (2010).
- Setlow, B., Setlow, P. Role of DNA repair in Bacillus subtilis spore resistance. J Bacteriol. 178, 3486-3495 (1996).
- Schaeffer, P., Millet, J., Aubert, J. P. Catabolic repression of bacterial sporulation. Proc. Natl. Acad. Sci. 54, 704-711 (1965).
- Simmons, L. A., et al. Comparison of responses to double-strand breaks between Escherichia coli and Bacillus subtilis reveals different requirements for SOS induction. J Bacteriol. 191, 1152-1161 (2009).
- Raguse, M., et al. Improvement of Biological Indicators by Uniformly Distributing Bacillus subtilis Spores in Monolayers To Evaluate Enhanced Spore Decontamination Technologies. Appl Environ Microbiol. 82, 2031-2038 (2016).
- Horneck, G., et al. Protection of bacterial spores in space, a contribution to the discussion on Panspermia. Orig Life Evol Biosph. 31, 527-547 (2001).
- Opretzka, J., Benedikt, J., Awakowicz, P., Wunderlich, J., Keudell, A. v. The role of chemical sputtering during plasma sterilization of Bacillus atrophaeus. J. Phys. D: Appl. Phys. 40, 2826 (2007).
- Stapelmann, K., et al. Utilization of low-pressure plasma to inactivate bacterial spores on stainless steel screws. Int. J. Astrobiol. 13, 597-606 (2013).
- Raguse, M., et al. Understanding of the importance of the spore coat structure and pigmentation in the Bacillus subtilis spore resistance to low-pressure plasma sterilization. J. Phys. D: Appl. Phys. 49, 285401 (2016).
- Pandey, R., et al. Live cell imaging of germination and outgrowth of individual Bacillus subtilis spores; the effect of heat stress quantitatively analyzed with SporeTracker. PloS one. 8, e58972 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten