È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Indagando i dannosi effetti di basso pressione sterilizzazione al Plasma sulla sopravvivenza di Bacillus subtilis spore utilizzando Live Cell microscopia
In questo articolo
Riepilogo
Questo protocollo illustra i passaggi consecutivi importanti necessari per valutare la pertinenza di monitoraggio parametri di vitalità e processi di riparazione del DNA nel rilancio di spore di Bacillus subtilis dopo il trattamento con plasma a bassa pressione di rilevamento proteine tramite microscopia confocale risolta in tempo e microscopia elettronica di esame di riparazione del DNA marcato con fluorescenza.
Abstract
Sterilizzazione al plasma è una promettente alternativa ai metodi di sterilizzazione convenzionali per industriali, clinici e fini di volo spaziale. Bassa pressione del plasma (LPP) scarichi contengono un ampio spettro di specie attive, che portare alla rapida inattivazione microbica. Per studiare i meccanismi di sterilizzazione di LPP ed efficienza, usiamo spore di Bacillus subtilis il microrganismo da testare a causa della loro straordinaria resistenza contro procedure di sterilizzazione convenzionali. Descriviamo la produzione di monostrati di spore di Bacillus subtilis , il processo di sterilizzazione di plasma a bassa pressione in un doppio reattore al plasma accoppiato induttivamente, la caratterizzazione della morfologia di spore mediante microscopia elettronica a scansione (SEM) e la analisi di germinazione e di conseguenza di spore per microscopia di cellule vive. Il principale obiettivo della specie del plasma è materiale genomico (DNA) e riparazione di lesioni al DNA plasma-indotta con il ritorno di spora è cruciale per la sopravvivenza dell'organismo. Qui, studiamo la capacità di germinazione delle spore e il ruolo del DNA di riparazione durante la germinazione delle spore e la conseguenza dopo il trattamento con LPP di rilevamento delle proteine di riparazione di fluorescente etichettati DNA (RecA) con microscopia di fluorescenza confocale risolta nel tempo. Trattati e strati monomolecolari della spora non trattati sono attivati per la germinazione e visualizzati con un microscopio invertito confocale cellule vive nel tempo di seguire la reazione di spore individuali. Le nostre osservazioni rivelano che la frazione di germinazione e superando le spore dipende la durata del LPP-trattamento raggiungendo un minimo dopo 120 s. RecA-YFP fluorescenza (proteina di fluorescenza giallo) è stato rilevato soltanto in poche spore e sviluppato in tutte le superando le cellule con una leggera elevazione in spore LPP-trattati. Inoltre, alcuni dei batteri vegetativi derivato da spore LPP-trattati hanno mostrate un aumento nel citoplasma e tendeva a lyse. I metodi descritti per l'analisi delle singole spore potrebbero essere esemplari per lo studio di altri aspetti della germinazione delle spore e la conseguenza.
Introduzione
Degli obiettivi principali dell'esplorazione dello spazio è la ricerca per le firme di forme di vita e biomolecole su altri corpi planetari e lune nel nostro sistema solare. Il trasferimento di microrganismi o di biomolecole di origine terrestre nelle zone critiche di esplorazione è di particolare rischio per influenzare lo sviluppo e l'integrità delle missioni di vita-rilevazione sui corpi planetari ad esempio Marte ed Europa1. Le linee guida internazionali di protezione planetaria, fondata da comitato di ricerca spaziale (COSPAR) nel 1967, imporre norme rigorose sulle missioni con equipaggiati e robotiche per altri pianeti, le lune, asteroidi e altri corpi celesti e regolano la pulizia e sterilizzazione di un veicolo spaziale e componenti hardware critici prima di lanciare al fine di eliminare contaminanti microrganismi terrestri ed evitare la contaminazione incrociata di corpi celesti2. Nell'ultimo decennio, l'applicazione dei plasmi termici ha guadagnato ampia attenzione nella ricerca biomedica e nutrizionale, così come nel volo spaziale applicazioni3,4,5. Sterilizzazione al plasma è una promettente alternativa ai metodi di sterilizzazione convenzionali in quanto offre rapida ed efficace inattivazione microbica6, pur essendo delicato sensibili e materiali labili al calore. Gli scarichi del plasma contengono una miscela di agenti reattivi come i radicali liberi, particelle cariche, atomi neutri/eccitato, fotoni nell'ultravioletto (UV) e dello spettro ultravioletto vuoto (VUV) che portano alla rapida inattivazione microbica3. In questo studio, usiamo il plasma a bassa pressione generato dal doppio plasma accoppiato induttivamente a bassa pressione (DICP) fonte7,8 per inattivare le endospore di Bacillus subtilis distribuiti sulla superficie di prova di vetro.
Batteri Gram-positivi della famiglia Bacillaceae sono ampiamente distribuiti in habitat naturali del suolo, sedimenti e aria così come in ambienti insoliti come in camera pulita e la stazione spaziale internazionale9,10 ,11. La caratteristica più distinta del genere Bacillus è la capacità di formare endospores dormienti altamente resistente (in appresso denominato "spore") per sopravvivere in condizioni sfavorevoli, ad esempio svuotamento nutriente12. Le spore sono generalmente molto più resistenti rispetto ai loro omologhi di cellula vegetativa per una varietà di trattamenti e stress ambientali, tra cui calore, UV, raggi gamma, essiccazione, rottura meccanica e prodotti chimici tossici, quali forti ossidanti o pH-cambiando agenti (recensiti in riferimenti13,14) e sono quindi gli oggetti ideali per verificare l'efficienza dei metodi di inattivazione microbica. Poiché il DNA di genomic è il principale bersaglio del trattamento al plasma dei batteri15,16, la riparazione di lesioni del DNA indotte da plasma (es. doppio filamento di DNA si rompe) su Spora revival è cruciale per la sopravvivenza di batteri13, 17.
Quindi, studiamo la capacità di germinazione delle spore e il ruolo della riparazione del DNA durante la germinazione delle spore e la conseguenza dopo aver trattato le spore con plasma a bassa pressione dell'argon di seguenti spore individuali e riparare loro espressione di DNA marcato con fluorescenza proteina RecA con microscopia di fluorescenza confocale risolta nel tempo. Noi diamo una passo per passo le istruzioni del preparato di Bacillus subtilis spore negli strati monomolecolari per il raggiungimento di risultati di test riproducibili, il trattamento di monostrati di spora con plasma a bassa pressione per la sterilizzazione, la preparazione delle spore del plasma trattato per la valutazione ultrastrutturale mediante microscopia elettronica a scansione (SEM) e microscopia di tensione delle cellule a livello di singoli spore in concerto con il DNA attivo di monitoraggio processi che avvengono all'interno della cellula in risposta al trattamento al plasma di riparazione.
Protocollo
1. produzione di Spore di bacillus subtilis e purificazione
- Per la produzione di spore, trasferire una cultura overnight di 5ml delle rispettive Bacillus subtilis ceppo, completato con gli antibiotici adatti, per mezzo di sporulazione a Schaeffer liquido 200 mL duplice-forza (per litro di brodo nutritivo di 16G, KCl 2 g, 0,5 g MgSO 4* 7 H2O, 2 mL 1 M Ca (NO3)2, 2mL 0,1 M MnCl2 * • 4 H2O, 2 mL 1 mM FeSO4, 2mL 50% (p/v) glucosio18) e coltivarlo con vigorosa aerazione a 37 ° C per 72 h o fino a > 95% della cultura ha sporulate. Vengono utilizzate le spore dei seguenti ceppi: Bacillus subtilis PY79 (wild type) b. subtilis PY79ΔrecA:: neo (carente di proteine di riparazione del DNA RecA) b. subtilis PY79 recA-yfp:: gatto (RecA fuso con giallo proteina fluorescente [YFP]19).
- Spore di prelievo mediante centrifugazione per 15 min a 3.000 x g in provette da 50 mL e purificare i campioni di passaggi ripetuti lavaggi (fino a 15 volte) utilizzando sterile distillata H2O e controllo per lo stato di purezza e germinazione da microscopia di contrasto di fase. Assicurarsi che le sospensioni di spore consistono fuori fase-brillante spore (> 99%) e sono privi di cellule vegetative (canne), spore germinate (aspetto nero / grigio) e detriti cellulari, altrimenti ulteriori esperimenti di microscopia possono essere disturbati. Lavare il campione fino a purezza desiderato è raggiunto.
- Determinato il titolo di spora di placcatura fuori 50 µ l di 10 volte diluizioni seriali su LB-agar (cioè: uso 30 µ l di campione + 270 µ l acqua sterile per un 01:10 diluizione. Prendere 30 µ l dalla diluizione di particolare a 270 µ l H2O per una diluizione di 1: 100 e così via) per calcolare il CFU (unità formanti colonia) e incubare le piastre a 37 ° C durante la notte. Dopo la determinazione CFU, regolare il campione per 109 spore / mL di concentrazione o diluizione con acqua sterile.
2. preparazione del campione di Aerosol-depositati Bacillus subtilis spore
Nota: Accumulo e sovrapposizione delle spore potrebbe portare a effetti di ombreggiamento durante il trattamento, che si traduce nella cinetica di inattivazione falsificati. Per ridurre al minimo questo problema, è necessario preparare i campioni spora di un aerosol-deposizione tecnica20. Brevemente, controllare l'ugello di due-sostanza di alta precisione con un timer elettrico che regola la velocità di trasmissione liquido in concerto con il flusso del gas di trasporto pressurizzato (qui N2). Disperdere il campione liquido iniettato attraverso l'ugello di uscita utilizzando il flusso di gas di azoto.
- Posizionare un porta-campioni in forma di scorrevoli microscopici sterilizzati (per la cinetica di sopravvivenza) o rotondo 25 mm coprioggetti (per rilevamento fluorescente della riparazione del DNA processi/cLSM; microscopia a scansione laser confocale) all'interno dell'aerosol ad azionamento elettrico unità di spruzzatura in allineamento con l'ugello. La concentrazione di spore utilizzato deve corrispondere a un centuplo della concentrazione finale desiderata.
- Trasferire 1 mL della cultura spora in all'ingresso del fluido di ugello e avviare il processo di spruzzatura di 0,1 s ad una pressione di 1,3 bar. La sospensione di spore spruzzato (1 x 107) forma una pellicola sottile sul vetrino al microscopio che si asciuga rapidamente in pochi secondi per formare un monostrato di spora uniformemente distribuito. Conservare i vettori di campione trattato in un contenitore sterile a temperatura ambiente.
3. bassa pressione trattamento al Plasma
- Preparare il sistema al plasma per il trattamento di campioni biologici e far funzionare il sistema a 5 Pa con plasma di argon a 500 W per 5 min. In questo modo, tutte le superfici del sistema sono pulite e riscaldate. Questo riduce attaccare delle molecole dall'aria ambiente, cioè azoto, ossigeno e acqua, mentre il sistema di ventilazione. Dopo il pretrattamento del sistema, sfogare la camera e posizionare i campioni con cura nel centro del recipiente del reattore con l'aiuto di vetro rack.
- Utilizzare almeno tre replicati biologici. Chiudere la camera ed evacuare sotto 2 PA. in seguito, riempire il gas di processo nella camera. Regolare la pressione del sistema a 5 PA.
- Dopo il tempo di processo definito, spegnere l'alimentazione di energia elettrica e gas e sfiatare accuratamente l'impianto per evitare che soffia i campioni dal portacampioni. Dopo ventilazione, rimuovere i campioni e i campioni per il parametro successivo nel sistema. Per non trattato al plasma controlli espongono campioni a vuoto solo (5 Pa) in presenza di gas di processo equivalente al tempo più lungo del plasma applicata.
4. il recupero e la valutazione della sopravvivenza di Spore
- Preparare una soluzione di autoclavato 10% acetato polivinilico (PVA) e coprono il porta-campioni accuratamente con circa 500 µ l e lasciarli asciugare all'aria per 4 h. Strip off lo strato di PVA essiccato (ora contenente il campione di spora) utilizzando pinze sterili e trasferirlo in un mL 2 provetta di reazione. Aggiungere 1 mL di acqua sterile per il tubo e sciogliere lo strato PVA tramite vortex. Questa procedura porta a > 95% di recupero di spore e non influisce la loro capacità di germinazione21.
- In serie di diluire il campione alle 01:10 in acqua sterile in una piastra a 96 pozzetti (cioè 270 µ l sterile H2O + diluizione del campione/ex 30 µ l). Piastra di 50 µ l di ciascuna diluizione su agar nutriente brodo di Lisogenesi (LB), incubare le piastre a 37 ° C durante la notte ed enumerare il numero di colonie coltivate (CFU).
5. vivere microscopia cellulare e il monitoraggio dei processi di riparazione del DNA in germinazione di spore
- Per esperimenti di germinazione, preparare il blocco di un LB-agar 1 mm spessore 1,5%, facendo bollire 700 µ l medium e dispensare in una capsula di Petri sterile microscopia. Dopo 10 min, tagliare un 8 x 8 mm x 1 platorello mm LB-agar con un bisturi sterile e trasferire l'agar con attenzione sopra i monostrati di spore che si riposano su lamelle di vetro di 25 mm.
Nota: Questo passaggio è fondamentale per la visualizzazione dei singole spore e consentire seguendo la loro reazione, verso l'attivazione di germinazione indotta da agar nutriente. Così, il LB-agar serve a due scopi, (1) per fissare le spore in superficie, che evita la rilocalizzazione lungo la superficie e fuori fuoco ottico e (2) per attivare la spora per la germinazione. - Dopo aver percorso il campione con agar, trasferire il vetrino coprioggetti rapidamente in una camera di imaging e il microscopio i campioni con un microscopio a scansione laser confocale automatizzato con ottica invertita utilizzando un 63 X / 1.3 aereo apocromatico obiettivo a immersione in olio.
-
Eseguire la formazione immagine di fluorescenza (YFP) con un'eccitazione lunghezza d'onda di 514 nm ed emissione può essere rilevato tra 520 e 560 nm.
- Registrare immagini di campo chiaro nella scansione modalità utilizzando uno dei moltiplicatori di foto (percorso di luce trasmessa).
- Registrazione time-lapse serie con una potenza del laser del 2,6% e impostare l'apertura confocale a 5 unità arioso e a una frequenza di campionamento di 1 fotogramma al 30 s da 0 h a 5 h, a seconda dell'esperimento. È della nota particolare che alte dosi di monocromatico laser illuminazione a 514 nm completamente inibire la germinazione (Figura 1A, B).
- Conservare i campioni a 37 ° C (umidità dell'aria ambiente) in una fase di riscaldamento durante l'intero processo di imaging. Utilizzare almeno tre replicati biologici per ogni condizione. In caso di aggregazione di spora, distribuzione multistrato spora o contaminazione da particelle di polvere, il blocco del trattamento al plasma ("shadowing") potrebbe verificarsi e attivare la germinazione delle spore ombreggiate (Figura 1C, D).
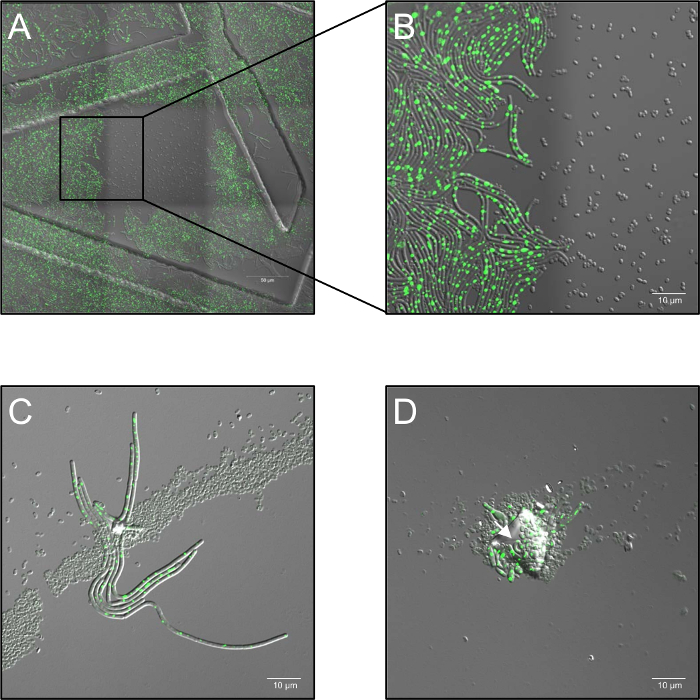
Figura 1: potenziali problemi osservati durante la microscopia a fluorescenza confocale tensione delle cellule di plasma trattato spore. (A, B) Inibizione della germinazione delle spore da alte dosi di monocromatico (514 nm) illuminazione del laser. (A) Panoramica (3 x 3 fotogrammi cucite) di b. subtilis (LAS72, RecA-YFP) spore 180 min dopo l'inizio della germinazione. Il telaio in mezzo è stato esposto a intervalli di 30 s ad alte dosi di luce laser (514 nm, potenza 70% laser), considerando che le regioni circostanti (= fotogrammi) non erano illuminate (immagine unita di campo chiaro canale e fluorescenza RecA-YFP; ordinato erano strutture causati dall'utilizzo di piatti con una griglia impresso 500 µm di imaging a 35 mm). (B) dimostra un 4 X vista ingrandita del confine tra la regione illuminato e non illuminati, mostrando che le spore, che sono stati esposti a dosi elevate di illuminazione laser monocromatico non ha fatto germogliare e crescere, mentre spore regioni non illuminato ripristino completamente ai batteri vegetativi esprimendo la fluorescenza brillante di RecA-YFP (segnale verde). (C, D) Spore coperto da particelle contaminanti o strati multipli di spore (frecce) sembra proteggere sottostante spore da inattivazione mediante trattamento al plasma e consentire loro germinazione e la conseguenza ("effetto di shadowing"). Spore (C) sono state trattate al plasma per 60 s e imaged 180 min dopo l'inizio della germinazione o (D) per 120 s e ripreso dopo 240 min Clicca qui per visualizzare una versione più grande di questa figura.
6. microscopia elettronica (SEM)
- Utilizzare microscopia elettronica per fornire informazioni ultrastrutturali su morfologia superficiale delle spore del plasma trattato rispetto ai comandi non trattati. Cappotto di monostrati di spora secchi sulle lamelle con oro-palladio (3 nm) utilizzando un velo polverizza. Utilizzare un microscopio elettronico a scansione emissione di campo per i campioni, operati a 5 kV tensione di accelerazione tra cui un rivelatore di elettroni secondari in-lente per rivelare il contrasto di topografia di imaging.
7. analisi dei dati
- Determinare la sopravvivenza di spora dal quoziente N/N0, dove N è la media CFU dei campioni trattati e N0 rappresenta la media CFU dei comandi non trattati sottovuoto. Tracciare l'inattivazione spora di trattamento del plasma dell'argon in funzione del tempo (in secondi). Tutti i dati si esprime come medie e deviazioni standard (n = 3).
- Analizzare le immagini ottenute da formazione immagine di tensione delle cellule usando il software di imaging. Quantificare la percentuale di germinazione delle spore e superando dopo trattamento al plasma, conteggio spore in rappresentante fotogrammi all'inizio dell'esperimento, così come dopo 4 h. Per la determinazione del significato nelle analisi di sopravvivenza di spora, utilizzare One-way ANOVA-test (analisi della varianza) con software statistici). Valori di P < 0,05 sono considerati come statisticamente significativo.
Risultati
Sopravvivenza del plasma-trattati Bacillus subtilis spore
Trattamento al plasma delle spore di b. subtilis utilizzati in questo studio indicano una diminuzione nella sopravvivenza all'aumentare della durata del trattamento al plasma (Figura 2). Spore del ceppo esprimendo il recA-gene fuso a YFP ha mostrato le curve di sopravvivenza simili a spore del ceppo wild-type, che indi...
Discussione
Sterilizzazione di superfici con bassa temperatura, plasma a bassa pressione è una promettente alternativa alle procedure di sterilizzazione piuttosto convenzionali come il trattamento con radiazioni ionizzanti radiazioni, sostanze chimiche (ad es. gas come H2O2 o ossido di etilene) o calore secco e umido23. Metodi di sterilizzazione ordinaria principalmente forniscono un'efficace sterilizzazione, ma essi sono noti per influenzare il materiale trattato e rappresenta...
Divulgazioni
Conflitti di interesse non dichiarati.
Riconoscimenti
Gli autori ringraziano Andrea Schröder per la sua eccellente assistenza tecnica durante le parti di questo lavoro e Nikea J. Ulrich per la sua assistenza durante le riprese video. Vorremmo anche ringraziare Lyle A. Simmons per la sua generosa donazione dei ceppi di Bacillus subtilis : LAS72 e LAS24. Questo lavoro è stato supportato in parti da sovvenzioni dalla Fondazione di ricerca tedesca (DFG) Paketantrag (PlasmaDecon PAK 728) a PA (AW 7/3-1) e RM (MO 2023/2-1) e DLR concedere DLR-FuW-Projekt ISS vita, Programm RF-FuW, Teilprogramm 475 (a Giulio, M.R. e R.M.). F.M.F. è stata sostenuta da una borsa di studio di dottorato di ricerca dell'Helmholtz spazio Life Sciences Research School (SpaceLife) presso il centro aerospaziale tedesco (DLR) a Colonia, in Germania, che è stato finanziato dall'Associazione Helmholtz (Helmholtz-Gemeinschaft) per un periodo di sei anni ( Grant No. VH-Ko-300) e ha ricevuto fondi supplementari da DLR, tra cui il Comitato esecutivo aerospaziale e l'Istituto di medicina aerospaziale. I risultati di questo studio saranno tra la tesi di dottorato di Felix M. Fuchs.
Materiali
| Name | Company | Catalog Number | Comments |
| Two substance nozzle (model 970-8) | Schlick | 14,404 | 230 V, 50 Hz, D 4.484/8, 0.8 mm bore diameter |
| Luria Bertani Medium | Sigma Aldrich | 70122-100G | |
| Tube connectors | Festo | n/a | G 1/8 |
| Magnetvalve DO35-3/2NC-G018-230AC | Bosch Rexroth | 820005100 | |
| PLN Polyamid tube | Festo | 558206 | d = 6 mm |
| Glass slides | VWR | 48300-026 | |
| Electric Timer 550-2-C | Gefran | F000074 | 220 V |
| attofluor cell chamber | Menzel, Fisher Ref. | 3406816 | d=25 mm, round |
| MgSO4*7 H2O | Sigma Aldrich | 13152 | |
| Ca(NO3)2 | Sigma Aldrich | 202967 | |
| MnCl2 * 4 H2O | Sigma Aldrich | 244589 | |
| FeSO4 * 7H2O | AppliChem | 13446-34-9 | |
| Glucose | Merck | 215422 | |
| KCl | Sigma Aldrich | P9541-500G | |
| Nutrient Broth (NB) | Merck | 105443 | |
| Luria-Bertani (LB) | Merck | 110283 | |
| 96-wellplate | ThermoFisher | 243656 | |
| Zeiss LSM 780, Axio Observer Z1 | Carl Zeiss Microscopy GmbH | n/a | |
| Leo 1530 Gemini | Carl Zeiss Microscopy GmbH | n/a | |
| ZEN 2 and ZEN lite 2012 (Software) | Carl Zeiss Microscopy GmbH | n/a | |
| SigmaPlot, version 13.0 (Statistic software) | Systat GmbH, Erkrath, Germany | n/a | |
| Attofluor cell chamber | Invitrogen | A7816 | |
| µ-Dish 35 mm, high Grid-500 Glass Bottom | ibidi | 81168 |
Riferimenti
- Nicholson, W. L., Schuerger, A. C., Race, M. S. Migrating microbes and planetary protection. Trends Microbiol. 17, 389-392 (2009).
- COSPAR. COSPAR Planetery Protection Policy. Space Research Today, COSPAR's Information Bulletin. 193, 1-14 (2015).
- De Geyter, N., Morent, R. Nonthermal plasma sterilization of living and nonliving surfaces. Annu Rev Biomed Eng. 14, 255-274 (2012).
- Shimizu, S., et al. Cold atmospheric plasma - A new technology for spacecraft component decontamination. Planet. Space Sci. 90, 60-71 (2014).
- Lerouge, S., Fozza, A. C., Wertheimer, M. R., Marchand, R., Yahia, L. H. Sterilization by Low-Pressure Plasma: The Role of Vacuum-Ultraviolet Radiation. Plasma Polym. 5, 31-46 (2000).
- Rossi, F., Kylián, O., Rauscher, H., Gilliland, D., Sirghi, L. Use of a low-pressure plasma discharge for the decontamination and sterilization of medical devices. Pure Appl. Chem. 80, 1939-1951 (2008).
- Halfmann, H., Hauser, J., Awakowicz, P., Koller, M., Esenwein, S. A. A double inductively coupled low-pressure plasma for sterilization of medical implant materials. Biomed Tech (Berl). 53, 199-203 (2008).
- Halfmann, H., Denis, B., Bibinov, N., Wunderlich, J., Awakowicz, P. Identification of the most efficient VUV/UV radiation for plasma based inactivation of Bacillus atrophaeus spores. J. Phys. D: Appl. Phys. 40, 5907 (2007).
- Vaishampayan, P., et al. Bacillus horneckiae sp. nov., isolated from a spacecraft-assembly clean room. Int J Syst Evol Microbiol. 60, 1031-1037 (2010).
- Mandic-Mulec, I., Stefanic, P., van Elsas, J. D. Ecology of Bacillaceae. Microbiol Spectr. 3, (2015).
- Alekhova, T. A., et al. Diversity of bacteria of the genus Bacillus on board of international space station. Dokl Biochem Biophys. 465, 347-350 (2015).
- Claus, D., Bekerley, R. C. W., Sneath, P. A. Genus Bacillus Cohn 1872. Bergey's manual of systematic bacteriology. 2, 1105-1141 (1986).
- Setlow, P. Spore Resistance Properties. Microbiol Spectr. 2, (2014).
- Setlow, P. Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. J Appl Microbiol. 101, 514-525 (2006).
- Roth, S., Feichtinger, J., Hertel, C. Characterization of Bacillus subtilis spore inactivation in low-pressure, low-temperature gas plasma sterilization processes. J Appl Microbiol. 108, 521-531 (2010).
- Roth, S., Feichtinger, J., Hertel, C. Response of Deinococcus radiodurans to low-pressure low-temperature plasma sterilization processes. J Appl Microbiol. 109, 1521-1530 (2010).
- Setlow, B., Setlow, P. Role of DNA repair in Bacillus subtilis spore resistance. J Bacteriol. 178, 3486-3495 (1996).
- Schaeffer, P., Millet, J., Aubert, J. P. Catabolic repression of bacterial sporulation. Proc. Natl. Acad. Sci. 54, 704-711 (1965).
- Simmons, L. A., et al. Comparison of responses to double-strand breaks between Escherichia coli and Bacillus subtilis reveals different requirements for SOS induction. J Bacteriol. 191, 1152-1161 (2009).
- Raguse, M., et al. Improvement of Biological Indicators by Uniformly Distributing Bacillus subtilis Spores in Monolayers To Evaluate Enhanced Spore Decontamination Technologies. Appl Environ Microbiol. 82, 2031-2038 (2016).
- Horneck, G., et al. Protection of bacterial spores in space, a contribution to the discussion on Panspermia. Orig Life Evol Biosph. 31, 527-547 (2001).
- Opretzka, J., Benedikt, J., Awakowicz, P., Wunderlich, J., Keudell, A. v. The role of chemical sputtering during plasma sterilization of Bacillus atrophaeus. J. Phys. D: Appl. Phys. 40, 2826 (2007).
- Stapelmann, K., et al. Utilization of low-pressure plasma to inactivate bacterial spores on stainless steel screws. Int. J. Astrobiol. 13, 597-606 (2013).
- Raguse, M., et al. Understanding of the importance of the spore coat structure and pigmentation in the Bacillus subtilis spore resistance to low-pressure plasma sterilization. J. Phys. D: Appl. Phys. 49, 285401 (2016).
- Pandey, R., et al. Live cell imaging of germination and outgrowth of individual Bacillus subtilis spores; the effect of heat stress quantitatively analyzed with SporeTracker. PloS one. 8, e58972 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon