Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Totalreflexion Absorption Spectroscopy (TIRAS) zum Nachweis von solvatisierte Elektronen an einer Plasma-Liquid-Schnittstelle
In diesem Artikel
Zusammenfassung
Dieser Artikel stellt eine Totalreflexion Absorption Spektroskopie (TIRAS) Methode zur Messung der kurzlebigen freien Radikalen an einer Plasma-Liquid-Schnittstelle. Insbesondere TIRAS wird zur Kennzeichnung verwendet solvatisierte Elektronen anhand ihrer optischen Absorption von rotem Licht in der Nähe von 700 nm.
Zusammenfassung
Die Totalreflexion Absorption Spektroskopie (TIRAS) Methode in diesem Artikel vorgestellten verwendet eine preiswerte Diodenlaser solvatisierte Elektronen produziert durch ein Niedrigtemperatur-Plasma in Kontakt mit einer wässrigen Lösung zu erkennen. Solvatisierte Elektronen sind starke Reduktionsmittel, und es wurde postuliert, dass sie eine wichtige in der Grenzflächen Chemie zwischen einem gasförmigen Plasma oder Entlastung und eine leitfähige Flüssigkeit Rolle. Sie haben jedoch aufgrund der hohen lokalen Konzentrationen von reaktiven Spezies an der Schnittstelle eine kurze durchschnittliche Lebensdauer (~ 1 µs), wodurch sie extrem schwer zu erkennen. Die TIRAS-Technik nutzt eine einzigartige Totalreflexion Geometrie kombiniert mit Amplitude moduliert Rastpositionen Verstärkung solvatisierte Elektronen Extinktion Signal vom anderen Unechte Lärmquellen zu unterscheiden. Dies ermöglicht die in Situ -Detektion von kurzlebigen Zwischenprodukten in der Grenzflächen-Region, im Gegensatz zu der Masse Messung des stabilen Produkten bei der Lösung. Dieser Ansatz ist besonders attraktiv für den Bereich der Plasma Elektrochemie, wo ein Großteil der wichtigen Chemie durch kurzlebige freie Radikale angetrieben wird. Diese experimentelle Methode wurde verwendet, um die Reduktion von Nitrit (keine2–(Aq)), Nitrat (keine3–(Aq)) zu analysieren, Wasserstoff Peroxid (H2O2(aq)) und gelöste Kohlendioxid (CO 2() AQ)) durch Plasma-solvatisierte Elektronen und wirkungsvolle Rate konstanten ableiten. Grenzen des Verfahrens ergeben sich im Beisein von unbeabsichtigten parallel Reaktionen, wie z. B. Luftverschmutzung im Plasma, und Absorption Messungen können auch durch die Fällung von reduzierten elektrochemische Produkte behindert werden. Insgesamt die TIRAS-Methode kann ein leistungsfähiges Werkzeug für das Studium der Plasma-Liquid-Schnittstelle sein, aber seine Wirksamkeit hängt von der bestimmten System und Reaktion Chemie unter Studie.
Einleitung
Plasma-Liquid Interaktionen sind ein wachsendes Interesse in der Plasma Science and engineering-Community. Die komplexe Schnittstelle zwischen Plasmen und Flüssigkeiten, die eine Vielzahl von hochreaktive freie Radikale enthält, hat Anwendungen in vielen Bereichen einschließlich der analytischen Chemie, Plasmamedizin, Wasser und Abwasserbehandlung und Nanomaterialien Synthese gefunden. 1,2,3,4,5,6. Zwar gibt es verschiedene Konfigurationen, die verwendet werden können, um ein Plasma in Kontakt mit einer Flüssigkeit7bringen, vielleicht am einfachsten ist das Plasma analog einer elektrolytischen Zelle, wobei eines standard Metall-Elektroden mit einer Plasma- oder Gas-Entlastung ersetzt 8. Plasma elektrochemische Zelle besteht aus einen Reaktorbehälter, einem untergetauchten Metall-Elektrode und eine Plasmaentladung, die als Kathode und Anode (oder beides) fungieren kann. Wenn die Plasmaentladung als eine Kathode verwendet wird, werden die Gasphase Elektronen im Plasma erzeugt die Lösung injiziert. Nachdem die Elektronen geben Sie die Lösung, ihre kinetische Energie zerstreut auf der Zeitskala von Femtosekunden9,10,11 in erster Linie durch inelastische Streuung an Lösungsmittel Moleküle. Wenn die Elektronen eine in der Nähe-thermische kinetische Energie erreicht haben, sie fangen und Solvate in einem Hohlraum von umgebenden Lösungsmittel Moleküle gebildet. Je nach Lösungsmittel und Temperatur können diese "solvatisierte" Elektronen stabil sein, bis sie mit einigen reduzierbaren Arten in die Lösung oder mit einem anderen solvatisierte Elektronen reagieren. In wässriger Lösung sind solvatisierte Elektronen auch hydratisiert Elektronen12genannt.
Dieser Prozess der Solvatation ist seit langem bekannt, und die Erkennung von hydratisierten Elektronen erzeugt durch Verfahren wie Puls Radiolyse oder Flash Photolyse ist seit den 1960er Jahren13,14,15untersucht worden. In traditionellen Radiolyse und Photolyse entstehen solvatisierte Elektronen durch Ionisation der Lösungsmittel Moleküle; Allerdings sind solvatisierte Elektronen an der Schnittstelle von Plasma-Flüssigkeit aus dem gasförmigen Plasma16injiziert. Frühere Experimente haben festgestellt, dass hydratisiert Elektronen absorbieren rotes Licht in der Nähe von 700 nm13,14,17, die ihnen erlaubt, über optische Absorption Spektroskopie experimentell untersucht werden. Andere Experimente haben ihre Verbreitung konstanten, deren Reaktionsgeschwindigkeiten mit Hunderten von chemischen Spezies, deren Radius der Drehung und ihre Ladung Mobilität, unter anderen Eigenschaften von Interesse12,18gemessen.
In der Literatur mehrere Methoden, um solvatisierte Elektronen erkennen berichtet worden, die hauptsächlich in zwei Arten getrennt werden können: Bulk Dosimetrie, wo solvatisierte Elektronen Präsenz aus der Masse chemische Analyse ihrer Reaktion Produkte abgeleitet wird, und direkte transiente Absorption Spektroskopie, wo die Elektronen Extinktion gemessen wird, wie die Reaktion stattfindet. Die letztere Kategorie, auf der die hier vorgestellte Methodik beruht, hat den Vorteil der direkten und sofortigen Nachweis sowie die Möglichkeit, zwischen Reaktionen zu überwachen.
Die Beweggründe für die Entwicklung der Totalreflexion Absorption Spektroskopie (TIRAS) Methodik wurde die Rolle der solvatisierte Elektronen an der Plasma-Liquid-Schnittstelle direkt zu studieren. Die Reflexion Geometrie wurde gewählt, weil die Produktion von solvatisierte Elektronen mit einer Plasmaentladung, im Gegensatz zu Verfahren wie Radiolyse oder Photolyse, an der Schnittstelle zwischen dem Plasma und die Flüssigkeit tritt. Wenn ein Test-Lasers die Oberfläche in einem flachen Einfallswinkel streift, ist es total reflektiert, wieder in die Lösung und in einem Detektor, weniger die kleine Menge von Licht von den Elektronen absorbiert. Ohne Licht, Flucht in das Plasma die experimentelle Technik nur misst freie Radikale in der flüssigen Phase, gerade unter der Oberfläche und ist somit ein hochsensibler Grenzflächen Messverfahren. Darüber hinaus hat das Phänomen der Totalreflexion den Vorteil der Beseitigung der Lärm aus dem anliegenden teilweise Reflexionen durch Oberfläche Schwankungen, die sonst das Signal dominieren konnte.
In diesem Artikel beschriebenen TIRAS-Protokoll hat drei wesentliche Merkmale. Das erste ist ein Plasma elektrochemische Zelle, die aus transparentem Glas Becher mit zwei optischen Fenster im Winkel von ca. 20° nach unten und eine kontrollierte Kopfraum des Argon-Gas besteht. Das zweite Merkmal ist das optische Messsystem, umfasst ein Diodenlaser, einem optischen Käfig und eine Photodiode Detektor. Der Laser bietet das Licht, das wird durch solvatisierte Elektronen absorbiert, und wird im Einklang mit einer verstellbaren Iris und einem 50 mm-Objektiv in einem optischen Käfig angebracht. Diese Anordnung ist auf ein Goniometer montiert, ermöglicht es, zu einem gewünschten Einfallswinkel gedreht werden. Die Intensität des Durchlichts wird dann durch den Photodetektor, bestehend aus einer großflächigen Fotodiode verdrahtet in einer rückwärts-Bias Leckage-Schaltung gemessen. Schließlich dringen solvatisierte Elektronen wegen ihrer hohen Reaktivität nur ~ 10 nm in die Lösung, die eine extrem kleine optische Absorption Signal von ~ 10-5 optische Dichte ergibt. Um ein ausreichend hohes Signal-Rausch-Verhältnis zu gewährleisten, ist die dritte wichtige Komponente einer Rastpositionen Verstärkersystem, bestehend aus einer Plasma-Schaltkreis und einem Lock-in-Verstärker. In den Schaltkreis moduliert eine Solid-State-Relaisschaltung den Plasmastrom zwischen einem hohen und einen niedrigen Wert auf eine Trägerfrequenz von 20 kHz eingestellt durch einen Funktionsgenerator. Dies, moduliert wiederum auch die solvatisierte Elektronen Konzentration an der Oberfläche und ihre optische Absorption. Der Lock-in-Verstärker dann nimmt das Signal aus dem Photodetektor und filtert alle Lärm draußen die Trägerfrequenz.
Die TIRAS-Methode hat großes Potenzial, wichtige chemische Prozesse im Plasma-Liquid Experimente, vor allem im Plasma Elektrochemie zu offenbaren. Die Reduktion und Oxidation Wege sind in erster Linie durch eine Vielzahl von kurzlebigen radikalen an der Schnittstelle von Plasma-Flüssigkeit angetrieben, und die Erkennung der Arten ist extrem wichtig für das Verständnis der Grenzflächen Chemie. Die in Situ Überwachungsfunktionen von TIRAS helfen ein besseres Verständnis für die wichtigen Elektron-gesteuerte Reaktionen beteiligt an der Plasma-Liquid-Schnittstelle zu etablieren. TIRAS, ermöglicht zum Beispiel die Messung von Reaktionsgeschwindigkeiten in Anwesenheit von Elektron Radikalfänger. Frühere Studien konzentrierten sich auf die Reduzierung der Nr.2–(Aq), keine3–(Aq), und H2O2(aq) Plünderer in wässriger Lösung16sowie die Reduzierung der aufgelöst aufgelöst CO2(aq)19. Andere Studien konzentrierten sich auf die Beeinflussung des Trägergases Plasma Plasma-solvatisierte Elektronen Chemie20.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Aufbau der Versuchsanordnung
Hinweis: Um dieses Experiment zu starten, montieren Sie ein System, bestehend aus einem Plasma Reaktor wo dauert die Reaktion statt, optische Komponenten für Absorption Messungen und die elektronische Sperre in Verstärkersystem, das Signal zu verarbeiten.
-
Das Plasma elektrochemische Zelle zu konstruieren.
- Herstellung einer Reaktor-Zelle, bestehend aus einem transparenten Glas Schiff, 50,8 mm (2 Zoll) im Durchmesser, mit zwei optischen Fenster in einem Winkel von ca. 20° nach unten aus dem normalen Flugzeug.
- Konstruieren Sie nicht durchlässig Deckel mit vier Öffnungen, die verwendet werden, um die Plasma-Elektrode, Platin Anode und einen kleinen Schlauch für die Spülung der Kopfraum mit Argon (Ar) einzuführen.
Hinweis: Die vierte Öffnung ermöglicht es Ar, von den Kopfraum zu lüften. - Bilden Sie die Anode durch ein Stück Platinfolie zu einem Edelstahl-Stab anbringen.
- Bilden die Kathode durch schärfen das Ende einer 1,58 mm (1/16 Zoll) Außendurchmesser, Innendurchmesser 0,178 mm (0,007 In) Edelstahl Kapillare. Verbinden Sie ein Ar-Schlauch mit dem stumpfen Ende der Kapillare mit entsprechenden Armaturen.
-
Die optische Messung Apparat zu konstruieren.
- Konstruieren einer Laserquelle, bestehend aus einem 670 nm Diodenlaser, eine verstellbare Iris und einem 50 mm Objektiv alle in einem 30 mm optische Käfig System montiert. Montieren Sie den Käfig ein Goniometer, so dass das gesamte System in einem Winkel von 19 ° werden, mit dem Laser in einem optischen Fenster der elektrochemischen Zelle geleitet gedreht kann.
Hinweis: Anderen Laser-Wellenlängen können auch verwendet werden, finden Sie unterRef 16. - Konstruieren Sie einen Photodetektor, bestehend aus einer großflächigen Fotodiode verdrahtet in eine rückwärts-Bias Leckage-Schaltung. Montieren der Photodetektor, ein Goniometer, so dass es reflektiertes Licht durch das optische Fenster der elektrochemischen Zelle gegenüber der Laserquelle erhalten kann. Zusätzlich zum Detektor montieren Sie einen Bandpassfilter entspricht die Wellenlänge des Lasers.
Hinweis: In Abbildung 1sehen ein Diagramm der Photodetektor Schaltung. Für solch eine Schaltung ist die Ausgangsspannung direkt proportional zu der Laserintensität.
- Konstruieren einer Laserquelle, bestehend aus einem 670 nm Diodenlaser, eine verstellbare Iris und einem 50 mm Objektiv alle in einem 30 mm optische Käfig System montiert. Montieren Sie den Käfig ein Goniometer, so dass das gesamte System in einem Winkel von 19 ° werden, mit dem Laser in einem optischen Fenster der elektrochemischen Zelle geleitet gedreht kann.
-
Das Plasma Schaltkreis Circuit und Lock-in Verstärker zu bauen.
Hinweis: die elektronische Bauteile enthalten eine Hochspannungsversorgung, eine hohe Spannung Schaltkreis, einen Funktionsgenerator, ein Voltmeter und einen Lock-in-Verstärker.- Die Hochspannungsversorgung zu verbinden, so dass es bei einer Gleichstrom (DC)-Neigung von ca. -2,5 anfallen kV zwischen der Plasma-Elektrode und die Anode, das Plasma zu generieren.
- Verwenden Sie einen Custom-Built Schaltkreis den Plasmastrom zwischen hohen und niedrigen Werten auf eine Trägerfrequenz von 20 kHz moduliert.
Hinweis: Eine schematische Darstellung der Schaltung ist in Abbildung 2dargestellt. Die Hochspannungs-Stromversorgung Laufwerke der Strom durch zwei Ballast Widerstände parallel geschaltet. Während ein geringer Strom kontinuierlich durch die 3 MΩ-Widerstand fließt, wird der Strom durch die 220 kΩ kontinuierlich über ein isoliertes Gate bipolar Junction Transistor (IGBT) geschaltet. Der Funktionsgenerator produziert die 20 kHz Frequenz fahren und ist an der IGBT durch ein optischer Isolator, der wodurch die Hochspannungs-Stromversorgung aus der Funktionsgenerator isoliert. - Integrieren Sie die Lock-in-Verstärker, um die Ausgabe der Photodetektor verbunden werden können.
Hinweis: Der Lock-in-Verstärker filtert Lärm außerhalb der 20 kHz-Band. Seine Ausgänge, nämlich der Amplitude und Phase des Signals Extinktion sollte von einem Computer aufgezeichnet werden. Ein hauseigenes Programm wurde verwendet, um die Ausgabe zu erfassen.
2. bereiten Sie NaClO4 -Lösung als eine leitfähige Hintergrund Elektrolyt
- Um eine 0,163 M NaClO4 Lösung vorzubereiten, die die Konzentration in diesem Experiment verwendet ist, lösen Sie 10 g NaClO4 in 500 mL entionisiertem Wasser. Hinweis: NaClO4 wurde als Elektrolyt gewählt, weil es nicht mit solvatisierte Elektronen reagiert. Die Konzentration von 0,163 M ist nur repräsentativ und verschiedene Konzentrationen eingesetzt werden, in der Regel in der Größenordnung von 0,001-0,1 M.
- Gießen Sie 60 mL NaClO4 in der Plasma-Reaktor.
3. bereiten Sie Setup für Messungen
-
Bereiten Sie die elektrochemische Zelle Aufbau und Säuberung des Reaktors.
- Einfügen der Anode durch die entsprechende Öffnung in den Deckel nicht durchlässig. Tauchen Sie teilweise die Anode unter der Oberfläche der Lösung.
- Verbinden Sie die Plasma-Elektrode (Kathode Kapillare) mit Masse Durchflussmesser mit einem Ar-Tank verbunden und legen Sie die Kapillare durch den Deckel. Die Spitze der Kapillare ca. 1-2 mm über der Oberfläche einer Lösung auszusetzen. Verwenden Sie eine Kamera zum Messen des Abstands zwischen der Kapillare und der flüssigen Oberfläche.
- Schließen Sie den kleinen Schlauch an eine Masse Durchflussmesser, verbunden mit einem Ar-Tank, und stecken Sie den Schlauch durch eine der Öffnungen im Deckel; Dies bildet die Aufräum-Linie.
- Mit der Kathode und Anode Ar bereinigen Sie Rang, sichern Sie nicht durchlässig Deckel an die Spitze der Reaktor Zelle zu.
- Schalten Sie die Ar Durchströmung der Säuberung-Linie bis ca. 250 cm3/min für mindestens 5 Minuten zu spülen, Luft aus dem Gasraum des Plasmareaktors.
Hinweis: Der Durchfluss und die Dauer der angewandten Strömung hängt das Volumen des Reaktors und das Volumen der Lösung im Reaktor; die hier verwendeten Werte sind repräsentativ. Ausfall zu spülen Luft führt zu Nebenreaktionen angetrieben von gelöstem Sauerstoff in der Lösung (siehe Ref. 21).
-
Richten Sie die Messung.
- Legen Sie der Durchströmung der Ar die Plasma-Elektrode auf etwa 10 cm3Bestellung Ausrichten des Reaktors, sodass der Laser die Plasma-Liquid-Schnittstelle trifft. Zu diesem Zweck Licht wird gestreut aus dem Grübchen durch den Gasstrom Ar zu beobachten.
- Schließen Sie den Fluss von Ar auf die Plasma-Elektrode und warten auf den Laserpunkt auf seine normale Größe zurück. Sobald dies geschieht, richten Sie den Photodetektor so aus, dass der Laser das Zentrum des Detektors trifft.
-
Messen Sie Grundlinie Signalintensität und bereiten Sie elektrische System vor.
- Schließen Sie den Photodetektor Ausgang an ein Voltmeter an und Messen Sie die Spannung, die durch den Laser gegeben. Nehmen Sie diesen Wert, wie es später verwendet wird, um die gemessene Extinktion Signal zu normalisieren.
Hinweis: Dieser Wert ist direkt proportional zu der einfallenden Intensität ich0. - Trennen Sie nach der Messung der einfallenden Intensität das Kabel aus dem Photodetektor und verbinden Sie es mit dem Eingang der Lock-in-Verstärker, mit dem Signal an die 20 kHz Trägerfrequenz zu sperren.
- Die Transistor-Transistor-Logik-Ausgabe von der Funktionsgenerator an den Frequenzeingang des Lock-in-Verstärker anschließen.
- Stellen Sie sicher, dass der Lock-in-Verstärker, Funktionsgenerator und Hochspannungs-Stromversorgung eingeschaltet sind.
Hinweis: Das Experiment kann nun eingeleitet werden.
- Schließen Sie den Photodetektor Ausgang an ein Voltmeter an und Messen Sie die Spannung, die durch den Laser gegeben. Nehmen Sie diesen Wert, wie es später verwendet wird, um die gemessene Extinktion Signal zu normalisieren.
4. Starten Sie Experiment und Datenerhebung
Hinweis: Ein hauseigenes Programm dient zur Datenerfassung. Darüber hinaus ist dieses System automatisiert, um sorgen für Präzision und menschliche Fehler reduzieren. Der zugrunde liegende Prozess der Automatisierung wird in den folgenden Schritten beschrieben.
- Schalten Sie den Laser und beginnen Sie Messung der Extinktion zu. Planen Sie Zeit für den Lärm auf ein ausreichend niedriges Niveau integriert werden.
- Legen Sie die Hochspannungs-Stromversorgung auf eine Spannungsdifferenz von ca. -2,5 kV um das Plasma zu entzünden.
Hinweis: Ein Foto von der Plasmaentladung in einem Abstand von 1 mm von der Flüssigkeitsoberfläche ist in Abbildung 3dargestellt. - Warten Sie ca. eine halbe Minute für die Amplitude der Lock-in-Verstärker zu einen stabilen Zustand zu erreichen, danach das Signal für ca. 2 min gemessen.
- Schalten Sie den Laser und warten auf das Lasersignal, einen stabilen Zustand zu erreichen. Anschließend messen Sie die Absorption für eine halbe Minute.
Hinweis: Diese Messung wird aus den vorherigen Extinktion Messungen für den Lärm aus dem Plasma Konto abgezogen. - Schalten Sie das Plasma durch die Hochspannungs-Stromversorgung abschalten.
- Um ein Experiment zu wiederholen, stellen Sie sicher, dass die Plasma-Elektrode noch ausgerichtet ist. Um dies zu tun, zurückziehen Sie die Plasma Elektrode mindestens 1 cm und öffnen Sie dann den Fluss der Ar durch die Kapillare. Wiederholen Sie die Schritte 3.2 bis 4,5.
- Wenn keine Experimente mehr wiederholt werden soll, deaktivieren Sie alle elektronischen Instrumenten, nehmen Sie den Deckel aus dem elektrochemische Zelle und entsorgen des NaClO4 entsprechend.
(5) Datenanalyse
Hinweis: Ausgabe der Lock-in-Verstärker enthält Informationen über die Amplituden R und Phase ϕ von 20 kHz Extinktion Signal. Dies kann durch Kosinus und Sinus-Komponenten, X und Y, bzw. dargestellt werden. Weil die Lock-in-Verstärker Maßnahmen stellen die modulierte Amplitude des Signals zwischen den hohen und niedrigen strömen am Schritt 1.3.2, die X- und Y die Unterschiede zwischen diesen beiden Signale, und werden verwendet, um den Unterschied der Absorption messen zwischen den niedrigen und hohen Staaten, Δich.
- Um die Daten zu analysieren, die X- und Y -Zeit-Vektoren zu normalisieren, indem durch die einfallende Intensität Spannung dividiert ich0.
Hinweis: Diese Spannung, die in Schritt 3.3.1 gemessen wurde, ist direkt proportional zu den optischen Intensität, da die Signalkomponenten X und Ysind. Daher sollte die X und Y durch diesen Wert dividiert dimensionslose Vektoren, die der in-Phase und Out-of-Phase Komponenten des Signals 20kHz Extinktion ergeben. - Erhalten der Mittelwert der X/ich0 und Y/ich0 von dem Moment an stationären wurde erreicht, nachdem das Plasma wurde eingeschaltet, bis der Laser abgeschaltet wurde.
Hinweis: Abbildung 4 zeigt, dass die normalisierten Extinktion RMS Größe R während des Experiments gemessen. Das Plasma wurde eingeschaltet, nach 30 s, das Absorption Signal erreicht Steady-State in einer Zeit von 50 s und das Plasma wurde abgeschaltet, in einer Zeit von 150 s. - Ebenso erhalten die durchschnittliche X/ich0 und Y/ich0 ab dem Zeitpunkt der Laser wurde deaktiviert, bis das Plasma ausgeschaltet wurde, um die Kosinus und Sinus Komponenten der Plasma Lärm zu erhalten. Hinweis: In Abbildung 4ausgeschaltet war das Plasma in einer Zeit von 150 s und der Lärmmessung war die durchschnittliche Extinktion erkannt aus einer Zeit von 170 s 200 s.
- Um die Kosinus und Sinus Komponenten der Extinktion Signal zu erhalten, subtrahieren Sie die Durchschnittswerte im Schritt 5.3 aus den Durchschnittswerten in 5.2 erhalten erhalten.
- Um die wahre Extinktion zu berechnen, berechnen Sie die Quadratwurzel aus der Summe der Quadrate der X und Y Komponenten des Signals in Schritt 5.4 erhaltenen, wie es in Gleichung 1gezeigt wird.
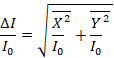 (1)
(1)
(6) Gewinnung von Parametern
- Berechnen Sie die Konzentration der solvatisierte Elektronen in der Lösung durch die Annahme einer Steady-State zwischen dem Satz an welche solvatisierte Elektronen in der Lösung durch das Plasma eingebracht werden und die Rate, mit der sie verbraucht werden.
Hinweis: Der Verbrauch von solvatisierte Elektronen, in Ermangelung anderer Reaktionen erfolgt durch die zweite Bestellung Rekombination von Elektronen wie in Gleichung 2dargestellt. (2)
(2)- Verwenden Sie Biergesetzes, wie in Gleichung 3, um die Konzentration der solvatisierte Elektronen als Funktion eines unbekannten eindringen Tiefe lzu finden, wo ε ist die molare Aussterben Koeffizienten und θ ist der Einfallswinkel (definiert als 19 ° im Schritt 1.2).
Hinweis: Der vom Aussterben bedroht-Koeffizient für das solvatisierte Elektron ist ~ 19.000 L Mol-1 cm-1 wie in Nr. 18 beschrieben.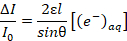 (3)
(3) - Um die unbekannte Eindringtiefe zu extrapolieren, kombinieren Sie Gleichung 3 mit Gleichung 4, die davon, dass Elektronen mit einer Rate proportional zum Strom-Dichte des Plasmas, eingeführt werden ausgeht, wo k die Reaktion Konstante des zweiten ist Bestellung Rekombination, Q ist die Elementarladung, j ist die Stromdichte und NA ist Avogadro's Nummer.
Hinweis: Faktor 2 ist in Gleichung 4 zu bezeichnen, dass zwei Elektronen durch die Reaktion in Gleichung 2verbraucht sind enthalten. (4)
(4)
Der Durchgriff Länge l und der Konzentration [(e–)Aq] ermittelt werden, aus dem gemessenen Signal mit Gleichungen 3 und 4.
- Verwenden Sie Biergesetzes, wie in Gleichung 3, um die Konzentration der solvatisierte Elektronen als Funktion eines unbekannten eindringen Tiefe lzu finden, wo ε ist die molare Aussterben Koeffizienten und θ ist der Einfallswinkel (definiert als 19 ° im Schritt 1.2).
7. Reaktion Rate Schätzung
Hinweis: Wenn Elektronen Solvate in einer Projektmappe mit reaktionsträgen Elektrolyte wie NaClO4, solvatisierte Elektronen sind nur durch die Reaktion in Gleichung 2verbraucht. Solvatisierte Elektronen haben jedoch die Fähigkeit, eine Vielzahl von kationen, Anionen und neutralen Spezies zu reduzieren. Wenn eines dieser Elektron Radikalfänger in der wässrigen Lösung aufgelöst sind, reagieren sie mit den solvatisierte Elektronen. Das senkt ihre Gleichgewicht Konzentration und führt zu einer Reduzierung der Extinktion erkannt, wodurch die TIRAS-Methodik, die Geschwindigkeitskonstanten der Reaktion dieser Reaktionen zu schätzen. Wenn eine neue Reaktion eingeführt wird, wird die Rate Balance: (5)
(5)
[(S)Aq] ist die Konzentration der Elektronen-Schnitzeljagd in der Lösung, wobei k2 ist die Reaktion Rate konstant verbunden mit seiner Reaktion. Wenn die Scavenger-Konzentration groß genug ist, kann Gleichung 5 , vereinfacht werden:
 (6)
(6)
Gleichung 3 kombinierbar dann mit Gleichung 6 , eine Beziehung zwischen Absorption und die Schnitzeljagd-Konzentration zu erhalten. (7)
(7)
- Um die Reaktion Rate konstant solvatisierte Elektronen mit einem Elektron-Schnitzeljagd zu messen, starten Sie durch Auflösen der Schnitzeljagd in der NaClO4 -Lösung, die in Schritt 1 erstellt wurde.
Hinweis: Die nicht-reaktiven NaClO4 in die Lösung sorgt für eine Lösung Leitfähigkeit hoch genug für Plasma-Stabilität. Die Konzentration der Schnitzeljagd sollte hoch genug, um mit der zweiten Bestellung Rekombination konkurrieren, andernfalls die Reaktion findet nicht statt. - Wiederholen Sie die Schritte 2.2 zu 6.1.2 mit verschiedenen Scavenger-Konzentrationen und Messen Sie den Unterschied in der Absorption im Schritt 5.5, in Bezug auf die reine NaClO4 Lösung berechnet.
- Machen Sie ein Grundstück von der Absorption als Funktion von [(S)Aq]-1.
Hinweis: Wenn die Scavenger-Konzentration groß genug für Gleichung 6 gültig ist, erbringt Plotten die Absorption als Funktion der [(S)Aq]-1 eine gerade Linie mit einer Steigung, die abhängig von der Rate Konstante k2. - Die Reaktion Rate Konstante k2 aus der Steigung der geraden zu extrapolieren.
Hinweis: Weitere Informationen sowie Beispiele dafür, wie dies die Reaktionen der keine2–(Aq), keine3–(Aq)und H2O2(aq), CO2(aq) mit solvatisierte galt Elektronen, siehe Ref. 16,19.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Wie in Schritt 5 des Verfahrens erwähnt, misst dieses Experiment der Kosinus und Sinus Komponenten der Extinktion-Signal, der Phasenwinkel zwischen ihnen und den Umfang des Signals. Ein Grundstück von der Größe des Signals und seine zwei Bestandteile ist in Abbildung 4dargestellt.
Gelegentlich werden Messungen, die möglicherweise nicht optimal oder sogar unbrauchbar. Dies ist möglicherweise au...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die Ergebnisse zeigen, dass die Messung der Absorption des Lichts an der Plasma-Liquid-Schnittstelle ist eine effektive Methode zum erkennen und messen die Konzentration von Plasma-solvatisierte Elektronen in einer wässrigen Lösung. Die anschließende Messung bei verschiedenen Wellenlängen ergibt sich bei der Messung von dem Absorptionsspektrum. Obwohl dieses Experiment in einer wässrigen Lösung der NaClO4 fertig war, sollte die Methode gültig für eine Vielzahl von anderen Flüssigkeiten vorgesehen sein...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde von der US Army Research Office unter Preis zahlen W911NF-14-1-0241 und W911NF-17-1-0119 unterstützt. DMB wird unterstützt durch die US Abteilung von Energie Office of Science, Büro der grundlegenden Energiewissenschaften unter Preis Anzahl DE-FC02-04ER1553.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Function Generator | Protek | B8055 | |
| Lock-in Amplifier | Stanford Research Systems | SR830 | |
| High-Voltage Power Supply | Stanford Research Systems | PS325 | |
| Photodetector | Self-built | ||
| Flowmeter | Key Instruments | 60310 R5 | |
| Flow controller | Omega Engineering | FMA 5400A/5500A | |
| Camera | Dino-lite | Dinocapture 2.0 | |
| Voltmeter | Amprobe | AM-510 | |
| Optical Cage System | Thorlabs | 30 mm cage system | |
| Goniometers | Thorlabs | RP01 - Ø2 | Manual rotation stage |
| Diode lasers | Thorlabs | ||
| Electrochemical cell | Adams & Chittenden Scientific Glass | Custom-made product | |
| Stainless steel capillary | Restek | 0.007 in. ID | |
| SHV Coax Cable | SRS | Custom-made product | |
| Sodium Perchlorate | Sigma-Aldrich | ACS reagent, ≥98.0% | |
| Argon | Airgas | AR UHP300 | Ultra-high purity |
| LabVIEW | National Instruments | Software used to generate in-house program used to collect data |
Referenzen
- Smoluch, M., Mielczarek, P., Silberring, J. Plasma-based ambient ionization mass spectrometry in bioanalytical sciences. Mass Spectrom. Rev. 35 (1), 22-34 (2015).
- Jamroz, P., Greda, K., Pohl, P. Development of direct-current, atmospheric-pressure, glow discharges generated in contact with flowing electrolyte solutions for elemental analysis by optical emission spectrometry. Trends Anal. Chem. 41, 105-121 (2012).
- Foster, J. Plasma-based water purification: Challenges and prospects for the future. Phys. Plasmas. 24, (2017).
- Kong, M. G., et al. Plasma medicine: an introductory review. New J. Phys. 11, (2009).
- Chen, Q., Li, J., Li, Y. A review of plasma-liquid interactions for nanomaterial synthesis. J. Phys. D: Appl. Phys. 48, (2015).
- Mariotti, D., Patel, J., Svrcek, V., Maguire, P. Plasma-liquid interactions at atmospheric pressure for nanomaterials synthesis and surface engineering. Plasma Processes Polym. 9 (11-12), 1074-1085 (2012).
- Bruggeman, P. J., et al. Plasma-liquid interactions: a review and roadmap. Plasma Sources Sci. Technol. 25 (5), (2016).
- Rumbach, P., Go, D. B. Perspectives on plasmas in contact with liquids for chemical processing and materials synthesis. Top. Catal. , (2017).
- Mozumder, A. Fundamentals of Radiation Chemistry. , Academic Press. (1999).
- Kai, T., Yokoya, A., Ukai, M., Fujii, K., Higuchi, M., Watanabe, R. Dynamics of low-energy electrons in liquid water with consideration of coulomb interaction with positively charged water molecules induced by electron collision. Radiat. Phys. Chem. 102, 16-22 (2014).
- Kai, T., Yokoya, A., Ukai, M., Fujii, K., Watanabe, R. Thermal equilibrium and prehydration processes of electrons injected into liquid water calculated by dynamic Monte Carlo method. Radiat. Phys. Chem. 115, 1-5 (2015).
- Hart, E. J., Anbar, M. The hydrated electron. , Wiley-Interscience. (1970).
- Hart, E. J., Boag, J. W. Absorption spectrum of the hydrated electron in water and in aqueous solutions. J. Am. Chem. Soc. 84 (21), 4090-4095 (1962).
- Boag, J. W., Hart, E. J. Absorption spectra in irradiated water and some solutions. Nature. 197 (4862), 45-47 (1963).
- Matheson, M. S., Mulac, W. A., Rabani, J. Formation of the hydrated electron in the flash photolysis of aqueous solutions. J. Phys. Chem. 67 (12), 2613-2617 (1963).
- Rumbach, P., Bartels, D. M., Sankaran, R. M., Go, D. B. The solvation of electrons by an atmospheric-pressure plasma. Nat. Commun. 6 (7248), (2015).
- Anbar, M., Hart, E. J. The effect of solvent and of solutes on the absorption spectrum of solvated electrons. J. Phys. Chem. 69 (4), 1244-1247 (1965).
- Buxton, G. V., Greenstock, C. L., Helman, W. P., Ross, A. B. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O-) in aqueous solution. J. Phys. Chem. Ref. Data. 17 (2), 513-886 (1988).
- Rumbach, P., Xu, R., Go, D. B. Electrochemical production of oxalate and formate from CO2 by solvated electrons produced using an atmospheric-pressure plasma. J. Electrochem. Soc. 163 (10), 1157-1161 (2016).
- Rumbach, P., Bartels, D. M., Sankaran, R. M., Go, D. B. The effect of air on solvated electron chemistry at a plasma/liquid interface. J. Phys. D: Appl. Phys. 48 (42), (2015).
- Rumbach, P., Witzke, M., Sankaran, R. M., Go, D. Decoupling interfacial reactions between plasmas and liquids: Charge transfer vs plasma neutral reactions. J. Am. Chem. Soc. 135, 16264-16267 (2013).
- Richmonds, C., Sankaran, R. M. Plasma-liquid electrochemistry: Rapid synthesis of colloidal metal nanoparticles by microplasma reduction of aqueous cations. Appl. Phys. Lett. 93, (2008).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten