É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Espectroscopia de absorção de reflexão interna total (TIRAS) para a detecção de Solvated elétrons em uma Interface Plasma-líquido
Neste Artigo
Resumo
Este artigo apresenta um método de espectroscopia (TIRAS) de absorção de reflexão interna total de medição de curta duração os radicais livres em uma interface plasma-líquido. Em particular, TIRAS é usado para identificar solvated elétrons baseados sua absorvância óptica da luz vermelha perto de 700 nm.
Resumo
O método de espectroscopia (TIRAS) de absorção de reflexão interna total apresentado neste artigo usa um laser de diodo barato para detectar solvated elétrons produzidos por uma TV de plasma de baixa temperatura em contato com uma solução aquosa. Solvated elétrons são poderosos agentes redutores, e foi postulado que desempenham um papel importante na química interfacial entre um plasma gasoso ou descarga e um líquido condutor. No entanto, devido as altas concentrações locais de espécies reactivas na interface, eles têm um curto tempo de vida médio (~ 1 µs), que os torna extremamente difícil de detectar. A técnica TIRAS usa uma geometria única reflexão interna total combinada com amplitude modulada baseadas na amplificação para distinguir o sinal de absorbância dos solvated elétrons de outras fontes de ruído espúrio. Isto permite a detecção em situ de curta duração intermediários na região interfacial, em oposição a medição do volume de produtos estáveis na solução. Essa abordagem é especialmente atraente para o campo da eletroquímica de plasma, onde grande parte a química importante é dirigida pela curta duração dos radicais livres. Esse método experimental tem sido usado para analisar a redução de nitrito (há2–(aq)), nitrato (há3–(aq)), hidrogênio (H2O.2(aq)) do peróxido e dissolvido dióxido de carbono (CO2 ( AQ)) por plasma-solvated elétrons e deduzir constantes de taxa efetiva. Limitações do método podem surgir na presença de reações paralelas não intencionais, como a contaminação do ar no plasma, e medidas de absorvância também podem ser prejudicadas pela precipitação de redução eletroquímicas produtos. No geral, o método TIRAS pode ser uma poderosa ferramenta para estudar a interface plasma-líquido, mas sua eficácia depende da particular sistema e reação química sob estudo.
Introdução
Interações de plasma-líquido representam uma área de interesse crescente na Comunidade de engenharia e ciência de plasma. A complexa interface entre plasmas e líquidos, que contém uma variedade de radicais livres altamente reativos, tem encontrado aplicações em muitas áreas, incluindo a química analítica, medicina de plasma, água e tratamento de águas residuais e síntese de nanomateriais 1,2,3,4,5,6. Embora existam várias configurações que podem ser usadas para trazer uma TV de plasma em contacto com um líquido7, talvez o mais simples é o plasma analógico de uma célula eletrolítica, onde um dos eletrodos metálicos padrão é substituído com uma descarga de plasma ou gás 8. a célula eletroquímica plasma consiste em uma embarcação de reator, um eletrodo de metal submerso e uma descarga de plasma, que pode funcionar como o cátodo ou ânodo (ou ambos). Quando a descarga de plasma é usada como um cátodo, os elétrons gasoso gerados no plasma são injetados para a solução. Depois os elétrons entre a solução, sua energia cinética dissipa-se na escala de tempo de femtoseconds9,10,11 , principalmente através da dispersão inelástica fora as moléculas de solventes. Uma vez que os elétrons atingiram uma energia cinética de perto-thermal, prendem e dissolve em uma cavidade formada, envolvendo moléculas de solventes. Dependendo do solvente e da temperatura, esses elétrons "solvated" podem ser estáveis até que reagem com algumas espécies redutíveis na solução ou com outro solvated elétrons. Em solução aquosa, solvated elétrons são também referidos como elétrons hidratados12.
Este processo de solvatação tem sido conhecido, e a detecção de elétrons hidratados gerados por procedimentos como radiolise de pulso ou fotólise de flash tem sido estudada desde a década de 1960,13,14,15. No tradicional Radiolise e fotólise, solvated elétrons são produzidos através da ionização das moléculas do solventes; no entanto, solvated elétrons na interface plasma-líquido são injetados de plasma gasoso16. Experiências anteriores determinaram que elétrons hidratados absorvem luz vermelha perto de 700 nm13,14,,17, que lhes permite ser estudados experimentalmente através de espectroscopia de absorção óptica. Outros experimentos têm medido suas constantes de difusão, suas taxas de reação com centenas de espécies químicas, seu raio de giração e sua mobilidade de carga, entre outras propriedades de interesse12,18.
Dentro da literatura, foram relatados vários métodos para detectar solvated elétrons, que podem ser separadas em dois tipos: dosimetria em massa, onde a presença de solvated elétrons é inferida da análise química de seus produtos de reação em massa, e espectroscopia de absorção transitória direto, onde a absorvância dos elétrons é medida como a reação ocorre. A última categoria, na qual se baseia a metodologia apresentada aqui, tem a vantagem de prova directa e imediata, bem como a capacidade de monitorar reações intermediárias.
A lógica por trás do desenvolvimento da metodologia de espectroscopia (TIRAS) de reflexão interna total absorção foi estudar diretamente o papel do solvated elétrons na interface plasma-líquido. A geometria de reflexão foi escolhida, porque a produção de solvated elétrons usando uma descarga de plasma, ao contrário de métodos como Radiolise ou fotólise, ocorre na interface entre o plasma e o líquido. Quando um laser sonda correr na superfície em um ângulo de incidência superficial, é totalmente refletida de volta para a solução e irem para um detector, menos a pequena quantidade de luz absorvida pelos elétrons. Com nenhuma luz escapar para o plasma, a técnica experimental apenas medidas radicais livres na fase líquida, logo abaixo da interface e, portanto, é uma técnica de medição interfacial altamente sensíveis. Além disso, o fenômeno de reflexão interna total tem a vantagem de eliminar o ruído desde a mudança das reflexões parciais devido a flutuações de superfície, que caso contrário poderiam dominar o sinal.
O protocolo TIRAS descrito neste artigo tem três características essenciais. A primeira é uma célula eletroquímica de plasma, que consiste de uma proveta de vidro transparente, com duas janelas ópticas em ângulos de aproximadamente 20° virada para baixo e um headspace controlada de gás argônio. A segunda característica é o sistema de medição óptica, que inclui um laser de diodo, uma gaiola de óptica e um detector de fotodiodo. O laser fornece a luz que é absorvida por solvated elétrons e é montada em consonância com uma íris ajustável e uma lente de 50mm em uma gaiola de óptica. Este arranjo é montado sobre um goniômetro, que lhe permite ser girados a um ângulo de incidência desejado. A intensidade da luz transmitida é então medida pelo fotodetector, que consiste em um fotodiodo de grande área com fio em um circuito de polarização reversa escapamento. Finalmente, por causa de sua alta reatividade, solvated elétrons penetram somente ~ 10 nm na solução, que produz um sinal extremamente pequena absorção óptica de ~ 10-5 densidade óptica. Para garantir uma relação sinal-ruído suficientemente elevada, o terceiro componente essencial é um sistema de baseadas na amplificação, que consiste em um circuito de comutação de plasma e um amplificador de fechamento-em. No circuito de comutação, um circuito de relé de estado sólido modula o plasma atual entre um alto e um baixo valor em uma frequência de portador de 20kHz, definido por um gerador de função. Este, por sua vez, também modula a concentração de elétrons solvated na interface e a sua absorvância óptica. O amplificador de bloqueio-no então pega o sinal do fotodetector e filtra todo barulho lá fora a frequência portadora.
O método TIRAS tem um grande potencial para revelar importantes processos químicos em experimentos de plasma-líquido, particularmente em eletroquímica de plasma. As vias de oxidação e redução são conduzidas principalmente por uma variedade de radicais de curta duração na interface plasma-líquido, e a detecção das espécies é extremamente importante para a compreensão da química interfacial. O em situ recursos de TIRAS de monitoramento ajudará a estabelecer uma maior compreensão das importantes orientados para o elétron reações envolvidas na interface plasma-líquido. TIRAS, por exemplo, possibilita a medição de taxas de reação na presença de catadores de elétron. Estudos anteriores concentraram-se na redução do n º2–(aq), não há3–(aq), e H2O2(aq) os catadores dissolvidos em solução aquosa16, bem como a redução de dissolvido CO2(aq)19. Outros estudos têm-se centrado sobre o efeito do gás plasma transportadora em plasma-solvated elétrons química20.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. construir a instalação Experimental
Nota: Para executar este experimento, monte um sistema que consiste em um reator de plasma onde a reação terá lugar, componentes ópticos para medidas de absorvância e o sistema electrónico baseadas na amplificação para processar o sinal.
-
Construa a célula eletroquímica do plasma.
- Fabricar uma célula de reator, constituído por um recipiente de vidro transparente, 50,8 mm (2 pol.) de diâmetro, com duas janelas ópticas em ângulos de aproximadamente 20° para baixo do avião normal.
- Construa uma tampa não-permeável contendo quatro orifícios, que serão usados para introduzir uma pequena mangueira para nivelar o espaço de cabeça com argônio (Ar), um ânodo de platina e o eletrodo de plasma.
Nota: O quarto orifício permitirá Ar para ventilação do espaço da cabeça. - Forma o ânodo, anexando um pedaço de folha de platina para uma haste de aço inoxidável.
- Formar o cátodo por afiar o fim de 1,58 mm (1/16) de diâmetro exterior, 0,178 mm (0,007 pol.) diâmetro interno inox capilar. Conecte uma mangueira de Ar à extremidade sem corte do capilar usando acessórios adequados.
-
Construa o aparato de medição óptica.
- Construa uma fonte de laser consiste em um laser de diodo 670 nm, uma íris ajustável e uma lente de 50mm todo montado em um sistema de gaiola óptico de 30 mm. Monte a gaiola de um goniômetro, para que todo o sistema pode ser girado em um ângulo de ° 19 com o laser direcionado para uma das janelas ópticas da célula eletroquímica.
Nota: Outro laser de comprimentos de onda também podem ser usados, consulte16 Ref. - Construa um fotodetector, consistindo de um fotodiodo de grande área com fio em um circuito de polarização reversa escapamento. Monte o fotodetector de um goniômetro para que ele pode receber a luz refletida pela janela óptica da célula eletroquímica, em frente a fonte de laser. Além disso, monte o detector de um filtro passa-banda, correspondente ao comprimento de onda do laser.
Nota: Um diagrama de circuito da célula fotoeléctrica pode ser visto na Figura 1. Para tal um circuito, a tensão de saída é diretamente proporcional à intensidade do laser.
- Construa uma fonte de laser consiste em um laser de diodo 670 nm, uma íris ajustável e uma lente de 50mm todo montado em um sistema de gaiola óptico de 30 mm. Monte a gaiola de um goniômetro, para que todo o sistema pode ser girado em um ângulo de ° 19 com o laser direcionado para uma das janelas ópticas da célula eletroquímica.
-
Construa o plasma de comutação de circuito e bloquear em circuito de amplificador.
Nota: os componentes eletrônicos incluem uma fonte de alimentação de alta tensão, um circuito de comutação de alta tensão, um gerador de função, um voltímetro e um amplificador de fechamento-em.- Conecte a fonte de alimentação de alta tensão, de modo que pode aplicar um viés de corrente contínua (CC) de aproximadamente-2.5 kV entre o eléctrodo de plasma e o anodo para gerar o plasma.
- Use um circuito de comutação custom-built para modular o plasma atual entre os valores de altas e baixas em uma frequência de portadora de 20 kHz.
Nota: Um diagrama esquemático do circuito é mostrado na Figura 2. A alimentação de alta tensão de unidades da corrente em dois resistores de lastro conectada em paralelo. Enquanto uma pequena corrente flui continuamente através do resistor MΩ 3, a corrente através do kΩ 220 continuamente é trocada por um transistor de junção bipolar de porta isolada (IGBT). O gerador de função produz a 20 kHz frequência de condução e está conectado para o IGBT através de um isolador óptico, que isola a fonte de alimentação de alta tensão do gerador de função. - Integre o bloqueio-no amplificador para permitir a saída do fotodetector para ser conectado a ele.
Nota: O amplificador de bloquear em filtrará ruído fora da banda de 20 kHz. Suas saídas, ou seja, a amplitude e fase do sinal de absorbância, devem ser registadas por um computador. Um programa in-house foi usado para gravar a saída.
2. preparar a solução de NaClO4 como um eletrólito condutor fundo
- Para preparar uma solução de4 NaClO 0,163 M, que é a concentração utilizada neste experimento, dissolva 10 g de NaClO4 em 500 mL de água desionizada. Nota: NaClO4 foi escolhido como um eletrólito porque não reagir com solvated elétrons. A concentração de 0,163 M é o único representante, e diferentes concentrações podem ser usadas, normalmente na ordem de 0,001-0.1 M.
- 60 mL de NaClO4 despeje o reator de plasma.
3. preparar a instalação para medições
-
Preparar a instalação de células eletroquímicas e purgar o reator.
- Inserir a tampa não permeável ao ânodo através do orifício apropriado. Mergulhe parcialmente o ânodo abaixo da superfície da solução.
- Se conectar o eletrodo de plasma (cátodo capilar) a um medidor de fluxo de massa conectado a um tanque de Ar e inserir o capilar através da tampa. Suspenda a ponta do capilar aproximadamente 1-2 mm acima da superfície de uma solução. Use uma câmera para medir a distância entre o capilar e a superfície líquida.
- Ligue o tubo pequeno com um medidor de fluxo de massa conectado a um tanque de Ar e insira a mangueira através de um dos orifícios da tampa; Isto dá forma a linha de purga.
- Com o cátodo, ânodo e linha de purga de Ar no lugar, fixe a tampa não permeável à parte superior da célula de reator.
- Liga o fluxo de Ar através do tubo de purga para aproximadamente 250 cm3/min durante pelo menos 5 minutos retirar o ar do headspace do reator de plasma.
Nota: A taxa de fluxo e a duração do fluxo aplicada dependem do volume do reator e o volume de solução no reator; os valores usados aqui são representativos. Falha para retirar o ar vai levar a reações colaterais, conduzidas pelo oxigênio dissolvido na solução (ver ref. 21).
-
Alinhe a medição.
- Defina o fluxo de Ar através do eletrodo de plasma de aproximadamente 10 cm3/min. alinhar o reator para que o laser atinge a interface plasma-líquido. Faça isso, observando a luz sendo espalhadas fora a covinha pelo fluxo de gás de Ar.
- Fechar o fluxo de Ar para o eletrodo de plasma e esperar o ponto do laser retornar ao seu tamanho normal. Quando isso acontecer, alinhe o fotodetector para que o laser atinge o centro do detector.
-
Medir a intensidade de sinal de linha de base e preparar o sistema elétrico.
- Conecte a saída de célula fotoeléctrica de um voltímetro e medir a tensão indicada pelo laser. Grave esse valor, como será usado mais tarde para normalizar o sinal de absorbância medidos.
Nota: Esse valor é diretamente proporcional à intensidade incidente 0. - Depois de medir a intensidade incidente, desconecte o cabo do fotodetector e conectá-lo à entrada do bloqueio-no amplificador para bloquear o sinal com a frequência de portadora de 20 kHz.
- Conecte a saída de lógica transistor-transistor do gerador de função para a entrada de frequência do amplificador fechamento-em.
- Certifique-se que o bloqueio no amplificador, gerador de função e fonte de alimentação de alta tensão estão ativadas.
Nota: O experimento está agora pronto para ser iniciado.
- Conecte a saída de célula fotoeléctrica de um voltímetro e medir a tensão indicada pelo laser. Grave esse valor, como será usado mais tarde para normalizar o sinal de absorbância medidos.
4. Inicie o experimento e coleta de dados
Nota: Um programa interno é usado para coleta de dados. Além disso, este sistema é automatizado para garantir precisão e reduzir o erro humano. O processo subjacente desta automatização é descrito nas etapas a seguir.
- Ligar o laser e começar a medir a absorvância. Prazo para o barulho ser integrado a um nível suficientemente baixo.
- Definir a fonte de alimentação de alta tensão a uma diferença de tensão de aproximadamente-2.5 kV para inflamar o plasma.
Nota: Uma fotografia da descarga de plasma a uma distância de 1 mm da superfície do líquido é mostrada na Figura 3. - Espere cerca de meio minuto para a amplitude medido pelo amplificador de fechamento-em chegar a um estado estacionário e, posteriormente, gravar o sinal por aproximadamente 2 min.
- Desligue o laser e aguardar o sinal do laser alcançar um estado estacionário. Posteriormente, medir a absorvância por meio minuto.
Nota: Esta medida será subtraída as medições anteriores de absorvância para dar conta do barulho do plasma. - Desligue o plasma desligando a fonte de alimentação de alta tensão.
- Para repetir um experimento, certifique-se que o eletrodo de plasma ainda é alinhado. Para fazer isso, retrair o plasma eletrodo pelo menos 1 cm e em seguida, abra o fluxo de Ar através do capilar. Repita as etapas de 3,2 a 4,5.
- Se não mais experiências serão repetidas, desligar todos os instrumentos eletrônicos, tire a tampa da célula eletroquímica e dispose do NaClO4 apropriadamente.
5. análise de dados
Nota: Saída do amplificador bloquear em contém informações sobre a amplitude R e fase ϕ do sinal de absorbância de 20 kHz. Isto pode ser representado por cosseno e componentes de seno, X e Y, respectivamente. Porque as medidas de bloqueio-no amplificador da amplitude modulada do sinal entre as correntes de altas e baixas, definido na etapa 1.3.2, o X e Y representam as diferenças entre estes dois sinais e são usados para medir a diferença de absorvância entre os Estados altos e baixos, Δeu.
- Para analisar corretamente os dados, normalizar os vetores X e Y do tempo dividindo-os pela tensão de intensidade incidente 0.
Nota: Esta tensão, que foi medido na etapa 3.3.1, é diretamente proporcional à intensidade óptica, como os componentes de sinal X e Y. Portanto, dividir-se por este valor de X e Y deve produzir vetores adimensionais que representa os componentes em fase e fora de fase do sinal de absorbância de 20 kHz. - Obter a média de X/0 e Y/0 desde o momento em estado estacionário foi alcançado depois que o plasma foi ativado até que o laser foi desligado.
Nota: A Figura 4 mostra que a magnitude do RMS normalizado absorvância R medidos durante todo o experimento. O plasma foi ligado após 30 s, o sinal de absorbância atingido o estado estacionário numa altura de 50 s e o plasma foi desligado em um momento de 150 s. - Da mesma forma, obter a média de X/0 e Y/0 a partir do momento o laser foi desligado até que o plasma foi desligado para obter os componentes cosseno e seno do ruído do plasma. Nota: Na Figura 4, o plasma foi desligado em um momento de 150 s e a medição de ruído foi a absorvância média detectada a partir de uma altura de 170 s para 200 s.
- Para obter os cosseno e seno componentes do sinal de absorbância, subtrai as médias obtidas na etapa 5.3 das médias obtidas em 5.2.
- Para calcular a absorbância de verdade, calcule a raiz quadrada da soma dos quadrados dos componentes X e Y do sinal obtido na etapa 5.4 como é mostrado na equação 1.
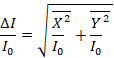 (1)
(1)
6. extração de parâmetros
- Calcule a concentração de solvated elétrons na solução, assumindo um estado estável entre a taxa na qual solvated elétrons são introduzidos a solução pelo plasma e a taxa em que eles são consumidos.
Nota: O consumo de solvated elétrons, na ausência de outras reações, ocorre através da recombinação de segunda ordem de elétrons, conforme mostrado na equação 2. (2)
(2)- Usar a lei de Beer, conforme mostrado na equação 3, para encontrar a concentração de solvated elétrons em função de um desconhecido penetração profundidade l, onde ε é o coeficiente de extinção molar, e θ é o ângulo de incidência (definido como 19 ° etapa 1.2).
Nota: É o coeficiente de extinção do elétron solvated ~ 19.000 L mol-1 cm-1 conforme descrito em ref. 18.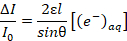 (3)
(3) - Para extrapolar a profundidade de penetração do desconhecido, combinar 3 equação com a equação 4, que assume que os elétrons são introduzidos em uma taxa proporcional à densidade do plasma, onde k é a constante de reação da segunda corrente recombinação de ordem, q é a carga elementar, j é a densidade de corrente e NA é o número de Avogadro.
Nota: Um fator de 2 está incluído na equação 4 para denotar que dois elétrons são consumidos pela reação na equação 2. (4)
(4)
A penetração de comprimento l e a concentração [(e–)aq] pode ser determinada a partir do sinal medido usando equações 3 e 4.
- Usar a lei de Beer, conforme mostrado na equação 3, para encontrar a concentração de solvated elétrons em função de um desconhecido penetração profundidade l, onde ε é o coeficiente de extinção molar, e θ é o ângulo de incidência (definido como 19 ° etapa 1.2).
7. estimativa de taxa de reação
Nota: Quando elétrons solvente em uma solução com eletrólitos ́ como NaClO4, solvated elétrons só são consumidos pela reação na equação 2. No entanto, solvated elétrons têm a capacidade de reduzir uma ampla variedade de cátions e ânions espécies neutras. Quando qualquer um dos catadores elétrons são dissolvidos em solução aquosa, reagem com os elétrons solvated. Isto reduz a concentração de equilíbrio e leva a uma redução da absorvância detectada, que permite que a metodologia TIRAS estimar as constantes de velocidade de reação destas reações. Quando é introduzida uma nova reação, o equilíbrio da taxa torna-se: (5)
(5)
onde [(S)aq] é a concentração do limpador de elétrons na solução, e k2 é a constante de velocidade de reação associada com sua reação. No entanto, se a concentração ao tesouro é suficientemente grande, a equação 5 pode ser simplificada para:
 (6)
(6)
Equação 3 pode ser então combinada com a equação 6 para obter uma relação entre a absorvância e a concentração ao tesouro. (7)
(7)
- Para medir a constante de velocidade de reação de solvated elétrons com um limpador de elétron, comece dissolvendo o limpador na solução NaClO4 , que foi elaborada na etapa 1.
Nota: O não-reativo de NaClO4 na solução garante uma condutividade de solução altamente bastante para a estabilidade do plasma. A concentração do limpador deve ser alta o suficiente para competir com a segunda recombinação de ordem, caso contrário, a reação não ocorrerá. - Repita as etapas de 2.2 para 6.1.2 com concentrações diferentes ao tesouro e medir a diferença de absorvância calculada na etapa 5.5, no que diz respeito a solução de4 NaClO pura.
- Fazer um gráfico da absorvância em função do [aqdo (S)]-1.
Nota: Se a concentração ao tesouro é suficientemente grande para a equação 6 ser válido, plotando a absorvância em função do [aqdo (S)]-1 irá produzir uma linha reta com uma inclinação depende da taxa constante k2. - Extrapolar a reação taxa constante k2 da inclinação da linha.
Nota: Para obter detalhes adicionais, bem como exemplos de como isto foi aplicado para as reações de há2–(aq)há3–(aq)e H2O2(aq), CO2(aq) com solvated elétrons, ver ref. 16,19.
Access restricted. Please log in or start a trial to view this content.
Resultados
Como mencionado na etapa 5 do procedimento, este experimento mede os componentes cosseno e seno do sinal de absorbância, o ângulo de fase entre eles e a magnitude do sinal. Um enredo a amplitude do sinal e seus dois componentes é mostrado na Figura 4.
Ocasionalmente, haverá medidas que podem não ser ideal, ou mesmo inutilizável. Isto pode ser devido um desalinhamento do laser com o feixe de pl...
Access restricted. Please log in or start a trial to view this content.
Discussão
Os resultados mostram que a medição da absorvância da luz na interface plasma-líquido é um método eficaz para detectar e medir a concentração de plasma-solvated elétrons em solução aquosa. A medição subsequente em comprimentos de onda diferentes resultados na medição do espectro de absorção. Embora esta experiência foi feita em uma solução aquosa de4 NaClO, a metodologia deve ser válida para uma grande variedade de outros líquidos, desde que os elétrons podem solvatar no líquido.
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado pelo Instituto de pesquisa dos EUA exército sob números de prêmio W911NF-14-1-0241 e W911NF-17-1-0119. DMB é suportado pelos E.U. departamento de energia escritório de ciência, escritório de energia ciências básicas sob prêmio DE número-FC02-04ER1553.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Function Generator | Protek | B8055 | |
| Lock-in Amplifier | Stanford Research Systems | SR830 | |
| High-Voltage Power Supply | Stanford Research Systems | PS325 | |
| Photodetector | Self-built | ||
| Flowmeter | Key Instruments | 60310 R5 | |
| Flow controller | Omega Engineering | FMA 5400A/5500A | |
| Camera | Dino-lite | Dinocapture 2.0 | |
| Voltmeter | Amprobe | AM-510 | |
| Optical Cage System | Thorlabs | 30 mm cage system | |
| Goniometers | Thorlabs | RP01 - Ø2 | Manual rotation stage |
| Diode lasers | Thorlabs | ||
| Electrochemical cell | Adams & Chittenden Scientific Glass | Custom-made product | |
| Stainless steel capillary | Restek | 0.007 in. ID | |
| SHV Coax Cable | SRS | Custom-made product | |
| Sodium Perchlorate | Sigma-Aldrich | ACS reagent, ≥98.0% | |
| Argon | Airgas | AR UHP300 | Ultra-high purity |
| LabVIEW | National Instruments | Software used to generate in-house program used to collect data |
Referências
- Smoluch, M., Mielczarek, P., Silberring, J. Plasma-based ambient ionization mass spectrometry in bioanalytical sciences. Mass Spectrom. Rev. 35 (1), 22-34 (2015).
- Jamroz, P., Greda, K., Pohl, P. Development of direct-current, atmospheric-pressure, glow discharges generated in contact with flowing electrolyte solutions for elemental analysis by optical emission spectrometry. Trends Anal. Chem. 41, 105-121 (2012).
- Foster, J. Plasma-based water purification: Challenges and prospects for the future. Phys. Plasmas. 24, (2017).
- Kong, M. G., et al. Plasma medicine: an introductory review. New J. Phys. 11, (2009).
- Chen, Q., Li, J., Li, Y. A review of plasma-liquid interactions for nanomaterial synthesis. J. Phys. D: Appl. Phys. 48, (2015).
- Mariotti, D., Patel, J., Svrcek, V., Maguire, P. Plasma-liquid interactions at atmospheric pressure for nanomaterials synthesis and surface engineering. Plasma Processes Polym. 9 (11-12), 1074-1085 (2012).
- Bruggeman, P. J., et al. Plasma-liquid interactions: a review and roadmap. Plasma Sources Sci. Technol. 25 (5), (2016).
- Rumbach, P., Go, D. B. Perspectives on plasmas in contact with liquids for chemical processing and materials synthesis. Top. Catal. , (2017).
- Mozumder, A. Fundamentals of Radiation Chemistry. , Academic Press. (1999).
- Kai, T., Yokoya, A., Ukai, M., Fujii, K., Higuchi, M., Watanabe, R. Dynamics of low-energy electrons in liquid water with consideration of coulomb interaction with positively charged water molecules induced by electron collision. Radiat. Phys. Chem. 102, 16-22 (2014).
- Kai, T., Yokoya, A., Ukai, M., Fujii, K., Watanabe, R. Thermal equilibrium and prehydration processes of electrons injected into liquid water calculated by dynamic Monte Carlo method. Radiat. Phys. Chem. 115, 1-5 (2015).
- Hart, E. J., Anbar, M. The hydrated electron. , Wiley-Interscience. (1970).
- Hart, E. J., Boag, J. W. Absorption spectrum of the hydrated electron in water and in aqueous solutions. J. Am. Chem. Soc. 84 (21), 4090-4095 (1962).
- Boag, J. W., Hart, E. J. Absorption spectra in irradiated water and some solutions. Nature. 197 (4862), 45-47 (1963).
- Matheson, M. S., Mulac, W. A., Rabani, J. Formation of the hydrated electron in the flash photolysis of aqueous solutions. J. Phys. Chem. 67 (12), 2613-2617 (1963).
- Rumbach, P., Bartels, D. M., Sankaran, R. M., Go, D. B. The solvation of electrons by an atmospheric-pressure plasma. Nat. Commun. 6 (7248), (2015).
- Anbar, M., Hart, E. J. The effect of solvent and of solutes on the absorption spectrum of solvated electrons. J. Phys. Chem. 69 (4), 1244-1247 (1965).
- Buxton, G. V., Greenstock, C. L., Helman, W. P., Ross, A. B. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O-) in aqueous solution. J. Phys. Chem. Ref. Data. 17 (2), 513-886 (1988).
- Rumbach, P., Xu, R., Go, D. B. Electrochemical production of oxalate and formate from CO2 by solvated electrons produced using an atmospheric-pressure plasma. J. Electrochem. Soc. 163 (10), 1157-1161 (2016).
- Rumbach, P., Bartels, D. M., Sankaran, R. M., Go, D. B. The effect of air on solvated electron chemistry at a plasma/liquid interface. J. Phys. D: Appl. Phys. 48 (42), (2015).
- Rumbach, P., Witzke, M., Sankaran, R. M., Go, D. Decoupling interfacial reactions between plasmas and liquids: Charge transfer vs plasma neutral reactions. J. Am. Chem. Soc. 135, 16264-16267 (2013).
- Richmonds, C., Sankaran, R. M. Plasma-liquid electrochemistry: Rapid synthesis of colloidal metal nanoparticles by microplasma reduction of aqueous cations. Appl. Phys. Lett. 93, (2008).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados