Method Article
Dünnen Film Composite Silikon Elastomere für Zellkultur und Haut Anwendungen: Herstellung und Charakterisierung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Ein Protokoll für die Herstellung von Polymeren Dünnschicht Verbundstrukturen besitzen unterschiedliche Youngs Moduli oder dicken wird vorgestellt. Filme sind für fortgeschrittene Zelle Kulturwissenschaft oder als Haut Klebstoffe hergestellt.
Zusammenfassung
In diesem Protokoll präsentieren wir Methoden, um dünne Elastomer Verbundfolien für fortgeschrittene Zelle Kultur Anwendungen und für die Entwicklung der Haut Klebstoffe zu fabrizieren. Zwei verschiedene Poly--(dimethyl siloxanes) (PDMS und weiche Haut Klebstoff (SSA)), werden seit in tiefe Untersuchung von biologischen Wirkungen und Hafteigenschaften. Die Verbundfolien bestehen aus einer flexiblen Trägerschicht und eine selbstklebende Deckschicht. Beide Schichten wurden durch Arzt Klinge Applikationstechnik hergestellt. In der vorliegenden Untersuchung ist der Klebstoffe Verhalten der Verbundfolien als Funktion der Schichtdicke oder eine Variation des Elastizitätsmoduls der obersten Ebene untersucht worden. Der Elastizitätsmodul des PDMS wurde geändert durch Variation der Ausgangspunkt, um Vernetzer Mischungsverhältnis. Darüber hinaus die Dicke der SSA Filmen variierte von ca. 16 µm bis ca. 320 µm. Scanning Electron Microscopy (SEM) und optische Mikroskopie für Dickenmessung verwendet worden. Die Hafteigenschaften der Elastomer-Filme hängen stark von der Schichtdicke, der Elastizitätsmodul von Polymeren und Oberflächeneigenschaften. Also, normale Haftung dieser Filme auf Glassubstraten mit glatten und rauen Oberflächen untersucht worden ist. Abziehen-Stress und Arbeit der Trennung sind abhängig von dem Mischungsverhältnis von Siliconelastomeren.
Außerdem variierte die Dicke der weiche Hautkleber auf eine Unterstützende Trägerschicht platziert um Patches für Haut Anwendungen zu produzieren. Zytotoxizität, Verbreitung und zelluläre Adhäsion L929 murine Fibroblasten auf PDMS Filme (Mischungsverhältnis 10:1) und SSA-Filme (Verhältnis 50: 50 mischen) wurden durchgeführt. Wir haben hier zum ersten Mal die Gegenüberstellung von zusammengesetzten Dünnfilmen beide Polymere hergestellt gezeigt und die Untersuchung ihrer biologischen und Klebstoff Eigenschaften präsentieren.
Einleitung
In diesem Protokoll werden detaillierte Methoden für die Herstellung von dünnen Elastomer Filme vorgestellt. Die allgemein verfügbaren Arzt Klinge Technik wurde für die Herstellung von dünnen Verbundfolien eingesetzt. Die Herstellungstechnik wurde auf Polyethylenterephtalate (PET) Folien, spätere Produktion dieser Filme in großem Maßstab durchgeführt. Schwerpunkt dieses Protokolls ist die Bewertung der Reproduzierbarkeit, präzise Herstellung von den verschiedenen Schichten der Verbundfolien und Bestimmung der biologischen und Adhäsion Eigenschaften des endgültigen zusammengesetzte Patches. Die Silikon-Elastomer-poly-(dimethylsiloxane) (PDMS) wird weitgehend verwendet in der biomedizinischen Technologie, einschließlich der Herstellung von Haut-Klebstoffen, Mikrofluidik Anwendungen und zusätzliche Forschung Felder1,2,3 ,4. Vor kurzem, eine andere Unterklasse von PDMS, so genannte weiche Haut Klebstoffe (SSAs) wurden eingeführt, insbesondere für sanfte Haut kleben und de-bonding.
Silikon-SSAs sind Vinyl funktionalisiert Elastomere, abweichend von Analog Polymere durch den Mangel an Kieselsäure5zu stärken. Ähnlich wie bei anderen PDMS, SSA kann Elastizitätsmodul in einem breiten Spektrum von modulierenden Vernetzer Konzentration oder heilende Zeit6,7,8angepasst werden. Diese Veränderung des Elastizitätsmoduls von Siliconelastomeren die klebtechnischen Eigenschaften des Materials erheblich beeinträchtigt und hat auch tiefgreifende Auswirkungen auf die prokaryotischen und eukaryotischen Zellen kultiviert auf der Oberfläche9,10 , 11. auf der Zellebene biologische wurde gezeigt, daß Eukaryotische Zellen reagieren auf den Signalpegel Transduktion zu einer Modulation der Matrix Elastizität oder Dicke der Oberfläche9,10,12 ,13,14. Daher ein breites Interesse in Zelle Kultur Anwendungen von Polymeren mit einstellbaren mechanischen Eigenschaften vorhanden. Wichtig ist, bietet intrinsisch niedrige Oberflächenenergie von Siliconelastomeren basiert nicht optimale Bedingungen für die Zellkultur von eukaryotischen Zellen. Sauerstoff-Plasma-Behandlung ist eine weit verbreitete Technik, PDMS niedrige Oberflächenenergie vorübergehend, führt zu einer Steigerung der Haftzugfestigkeit erhöhen verringerte Oberfläche Adsorption von Molekülen, während parallel Anlage, Verbreitung zu fördern und Verbreitung von eukaryotischen Zellen15,16,17,18.
Neben den Materialeigenschaften beeinträchtigt der Oberflächentopographie erheblich, zelluläre Adhäsion und die selbstklebende Interaktion zwischen zwei Materialien19,20,21,22. Rauheit der Oberfläche hat verschiedene Auswirkungen auf die Kontakt zwischen zwei Flächen: Reduktion der Kontaktfläche, hohe gespeicherte elastische Energie rund um Unebenheiten sowie Einfluss auf die Rissausbreitung Haftfestigkeit23, verändern kann 24. Haftung von selbstklebenden Folien auf die menschliche Haut ist ein aufstrebendes Gebiet der Anwendung, z. B. Wundauflagen, Fixierung der EKG-Elektroden oder andere tragbare elektronische Geräte25,26,27, 28. Um den Klebstoff Leistungsmessung von selbst-Klebstoffen in Bezug auf Topographie können Glassubstrate mit unterschiedlichem Grad der Rauheit im normalen Adhäsion Messungen8,21verwendet werden. Hier wurden zwei Glassubstraten ausgewählt, um die Hafteigenschaften von Polymerfolien untersuchen. Zeichneten sich erste, zusammengesetzte Filme mit einer Trägerschicht PDMS im Mischungsverhältnis 10: 1 Gewicht Teile mit unterschiedlichen Mischungsverhältnis von PDMS abgedeckt. In einem zweiten Schritt wurde eine Klebeschicht SSA mit gleichem Gewicht Mengen beider Komponenten und mit unterschiedlichen Schichtdicken auf PDMS Vorfilm vorbereitet.
Protokoll
Achtung: Bitte konsultieren Sie alle relevanten Sicherheitsdatenblätter (SDB) vor dem Gebrauch. Einige der in diesem Protokoll verwendeten Chemikalien sind Reizstoffe, akut giftig oder krebserzeugend. Nutzen Sie alle entsprechenden Sicherheitsmaßnahmen beim Umgang mit diesen Chemikalien. Dies beinhaltet die Nutzung der Technik (chemische Schrank) und persönliche Schutzausrüstung (Schutzbrille, Handschuhe, Kittel, voller Länge Hosen und geschlossene Schuhe). Teile der folgenden Verfahren beinhalten die Kultur einer Tierzelle-Linie. Bitte folgen Sie daher die spezifische biologische Sicherheit Regelungen. Chemische und biologische Abfälle muss entsprechend den spezifischen nationalen und institutionellen Regeln und Empfehlungen zu entsorgen.
1. Vorbereitung von Silicon Elastomeren Dünnschicht-Verbundkonstruktionen
-
Vorbereitung von Polymeren
- Zur Vorbereitung von 1,1 g PDMS im Verhältnis 10:1 mischen Sie 1,0 g der Verbindung A mit 0,1 g Verbindung B.
- Mix und Degase die Pre-Polymere in einem Geschwindigkeit-Mischer bei 2350 u/min unter 3 min Vakuum.
- Ändern Sie die Massenverhältnisse zwischen zusammengesetzten A und Verbindung B 45: 1 und 70: 1. Bereiten sie ähnlich der Methode in 1.1.2 beschrieben.
- Bereiten Sie 1 g weiche Haut Klebstoff (SSA) im Verhältnis von 50: 50. Daher mischen Sie 0,5 g der Verbindung A und 0,5 g Verbindung B wie in 1.1.2 beschrieben.
-
Vorbereitung der Poly--(vinyl alcohol) (PVA) beschichtete PET-Folie
- Eine 18 % (w/w) PVA Lösungin Wasser durch Zugabe von PVA in entionisiertem Wasser zubereiten und mischen über Nacht mit einem Magnetrührer. Speichern Sie diese Lösung bei 4 ° C.
- Bereiten Sie Dünnschichten eine effektive Dicke von 15 µm mit der Arzt Klinge Anwendung Maschine 100 µm Spalt der Klinge und eine Geschwindigkeit von ca. 2,0 mm/s ausstellen.
- Legen Sie die Filme in einem Ofen bei 95 ° C für 15 Minuten.
-
Vorbereitung der Trägerschicht des PDMS 10:1 Mischungsverhältnis von Arzt-Messer-Technik
- Verwenden Sie eine automatisch gesteuerte Arzt Klinge Anwendung Maschine zur Herstellung von dünnen Schichten.
- Reinigen Sie die PET-Folie mit 100 % Isopropanol und legen Sie es auf der Oberfläche des Anwendungsbereichs, Arzt Klinge.
- Legen Sie die Rakel auf die Folie und Zähflüssigkeit des mit der Micro Schrauben Positionierung. Gelten Sie für die Herstellung der nassen Schichten dicken von 60 µm, 100 µm, 200 µm und 500 µm.
- Füllen Sie das PDMS-10:1-Polymer im Schritt 1.1 in das Reservoir der Rakel mit einer Einweg-Spritze vorbereitet. Beginnen Sie Bewegung des Messers mit einer Geschwindigkeit von ca. 2,0 mm/s.
- Entfernen Sie PET-Folien mit der aufgebrachten Beschichtung 10:1 aus dem Gerät und legen Sie sie in einem Ofen für 1 h bei 95 ° C, befindet sich in einem Raum ausstellen Luftfeuchtigkeit zwischen 40 % und 65 %.
- Reinigen Sie die Rakel mit Isopropanol und Papierhandtücher.
- Wiederholen Sie diesen Vorgang für alle erforderlichen stärken.
-
Vorbereitung der oberen Schicht des PDMS in verschiedene Mischungsverhältnisse von Arzt-Messer-Technik
- Dünne Streifen von der Länge Seiten der zugrunde liegenden Folie mit einem Skalpell oder einer Rasierklinge zu Platzierung zu ermöglichen und gleiten die Rakel auf den PET-Folie zu entfernen.
- 1.3.3 zu 1.3.6 Protokoll Schritte. Nasse Dicke angewendet für den Film ist 160 µm.
- Wiederholen Sie diesen Vorgang für die Produktion von zwei unabhängigen Filme mit einem anderen Mischungsverhältnis der PDMS-Komponenten (45: 1 und 70: 1). Speichern der Filme bei Raumtemperatur (ca. 22 ° C und eine Luftfeuchtigkeit zwischen 40 und 65 %) in quadratische Petrischalen um sie vor Verschmutzung und Staub zu verhindern.
-
Vorbereitung der dünne Verbundfolien mit unterschiedlichen Dicken der SSA-50: 50-Schicht
- Bereiten Sie PDMS 10:1 Filme als eine Trägerschicht, wie zuvor in Schritt 1.3 beschrieben.
- Führen Sie Protokoll Schritte 1.4.1 und 1.4.2, diese Filme zu produzieren. SSA im Mischungsverhältnis von 50: 50 zu verwenden und einen Film mit einer nassen Dicke von 40 µm herzustellen.
- Wiederholen Sie den Vorgang für die zusätzliche Feuchte Mächtigkeiten: 120 µm, 300 µm, 500 µm.
2. normale Adhäsion Messungen mit Substraten mit unterschiedlichen Oberflächenrauheit
-
Herstellung und Charakterisierung von Glassubstraten mit unterschiedlicher Oberflächenrauheit
- Verwenden Sie einen Glaszylinder mit 2 mm Durchmesser als "glatte Substrat".
- Die "grobe Substrat" Verbrauchsteuern mit einem Glasschneider ein Stück mit der Dimension von ca. 4 x 4 mm aus einer Milchglas-Folie herzustellen. Verwenden Sie eine abrichtdiamant Hand Pad, um eine kreisförmige Fläche von ca. 3 mm Durchmesser zu erhalten.
- Legen Sie das Glas auf eine Aluminium-Konus mit UV-Kleber und in der UV-Beleuchtung-Kammer für 3 min zu beleuchten.
- Den Radius der Fläche des Substrats mit einem optischen Mikroskop zu bestimmen. Berechnen Sie die Fläche nach der Formel A = πr2.
- Bestimmung der Rauheit R-Parameterein und RZ (nach: DIN EN ISO 4287, ASME B46.1) mit einem Stift Profilometer.
- Befestigen Sie das Substrat auf der Probe-Bühne des die Profilometer und bringen die Spitze (Diamant, standard: 2 µm/60 °) in Kontakt mit der Probe.
- Notieren Sie das Rauheitsprofil mit einer Geschwindigkeit von 0,3 mm/s und einer Länge von 1 mm.
- Messen Sie um die Oberflächentopographie zu analysieren, eine Fläche von genau 1 mm2 mit einem Stift Profilometer, betrieben von der zugehörigen Software.
Hinweis: Die Profilometer wird von einem externen Computer betrieben. Der Halter ist um 0,001 mm in y-Richtung verschoben, nachdem eine Verschiebung von 1 mm in x erreicht ist Richtung. Die aufgezeichneten. RS3-Datei wird in Surfcom Karte Expert Software zur Erstellung von 3D Bilder importiert.
-
Normale Adhäsion Messung dünner Schichten hergestellt von PDMS oder SSA
- Verwenden Sie eine Rasierklinge, schneiden Sie die Filme auf die PET-Folie in kleine Stücke mit einer Fläche von ca. 4,0 cm2 und Ort, die sie auf ein Glas mit UV-Kleber schieben. Mit UV-Licht für 3 min zu beleuchten.
- Montieren Sie die Polymere Probe auf dem Probenhalter.
- Reinigen Sie das Substrat Oberfläche sanft mit Ethanol und trocken mit Stickstoffgas.
- Befestigen Sie das Glassubstrat, montiert auf Aluminium-Kegel mit der Wägezelle.
- Anhand der kippbaren Tabelle (Winkelmesser) die Flächen ausrichten genau durch die Anpassung des Neigungswinkel des Substrats nähert sich des Polymeren Films. Um dies zu tun, bringen Sie das Substrat manuell in Kontakt mit dem Film. Ändern des Neigungswinkels, bis eine völlig parallele Ausrichtung der beiden Flächen zueinander, visualisiert durch die Kameras Bilder erzielt wird.
Hinweis: Die Wägezelle ist an den kippbaren Tisch verbunden. Ein Glasprisma befindet sich unterhalb der Probe, wie in Abbildung 4, Visualisierung der Kontaktfläche mit zwei Kameras erlauben und ermöglichen die Ausrichtung des Substrats auf dem Polymerfilm gezeigt. - Bewegen Sie das Substrat an der filmoberfläche von Polymeren bis eine Vorspannung Stress von 13 ± 5 kPa ist erreicht (Abbildung 4).
- Starten Sie das benutzerdefinierte programmierten Software-Paket geschrieben in LabView zu kontrollieren, dass die erforderlichen Messparameter wie Zeit und Ansatz/Rücknahme Geschwindigkeit halten. 1 Sekunde, der Ansatz ist das halt mal thalten und Loslösung Geschwindigkeit beträgt 30 µm/s bzw. 10 µm/s.
- Durchführen Sie Adhäsion Messungen, auf drei unabhängigen hergestellten Proben und an sechs verschiedenen Orten auf jeder filmoberfläche.
-
Datenanalyse und Berechnung der mechanischen Schlüsselfaktoren: abziehen Stress und Arbeit der Trennung.
- Berechnen Sie den Stress
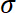 durch die Aufteilung der aufgezeichneten erzwingen, indem Bereich Substrat AS.
durch die Aufteilung der aufgezeichneten erzwingen, indem Bereich Substrat AS.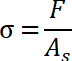
- Bestimmen Sie die Pull-off Spannung, die als der maximale Wert der Normalspannung beschrieben wird.
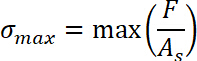
- Erhalten Sie die Verschiebung Δs durch Subtraktion der Startposition des Zug-Regimes0 aus der Probe Position sEnde wo de-bonding abgeschlossen wurde. Definieren Sie den Start des Zug-Regimes als s0 = 0.
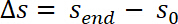
- Korrigieren Sie die gemessenen Werte von den Probenort vom System Compliance C nach folgender Gleichung:
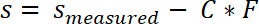
- Die Stress-Weg-Verlauf zwischen s0 und sEnde zu integrieren, um die Arbeit der Trennung zu berechnen.

- Berechnen Sie den Stress
-
Berechnung der mechanischen Schlüsselfaktoren mit mathematischen computing-Software Herkunft.
- Importieren Sie die aufgezeichneten .dat-Datei aus einer einzigen Adhäsion-Messung in einer Quelltabelle. Zeit, Probenort und Kraft sind die Parameter, die aufgezeichnet werden. Legen Sie diese Parameter in den Spalten A (Zeit), B (Probenposition) und C (Kraft).
- Um die leeren Wert ermitteln, durchschnittlich etwa 20 Messwerte der Kraft vor der Kontaktaufnahme mit der Polymerfolie. Nennen Sie dieser Durchschnittswert FVersatz zu, und fügen Sie ihn in Spalte D.
- Berechnen Sie den Hintergrund korrigiert Kraft F * nach der folgenden Gleichung

und legen Sie diese Gleichung wie folgt, in Spalte E.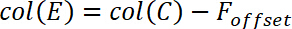
- Definieren Sie den Start des Zug-Regimes als NULL Verschiebung, d. h., s0 = 0. Daher bestimmen Sie s0 und subtrahieren sie von der Verschiebung in Spalte B und speichern Sie sie in Spalte F:
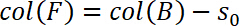
- Darüber hinaus korrigieren Sie die Probenposition, indem die Konformität der Maschine. Diese Korrektur wird in Spalte G. Legen Sie die folgende Formel in Spalte G durchgeführt.
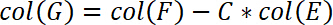
- Berechnen Sie die Spannung in der nächsten Spalte H. Deshalb teilen Sie die Kraft durch die Substrat-Fläche. Fügen Sie die folgende Formel
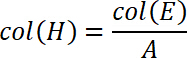
wobei A die Fläche der Glassubstrate in mm2 (bestimmt in 2.1) ist. - Die Arbeit der Trennung von der Spannung und Verschiebung Werte zu berechnen. Daher zeichnen Sie die Verschiebung entlang der x-Achse und den Stress auf der y-Achse. Integrieren Sie dieses Diagramm von s0 bis sEnde wo sEnde , als die Verschiebung auf die Zugspannung wird auf Null zurückgesetzt definiert ist, d. h. vollständige Ablösung stattgefunden hat. Um das Diagramm zu integrieren, wählen Sie die Funktion integrieren. Fügen Sie die berechneten Werte in Spalten hinzu, I und J.
3. Charakterisierung der Filme durch Scannen Rasterelektronenmikroskopie (SEM) und optischen Mikroskopie
-
Optische Mikroskopie
- Mit einer Rasierklinge kleinschneiden des Polymeren Films (ca. 0,25 cm2) und legen sie auf ein Glas-Folie-Rand. Ort der Objektträger vertikal orientierte unter einem aufrechten Mikroskop und Messen Sie die Dicke des Films Querschnitts.
Hinweis: Verwenden Sie ein 20 X Objektiv (NA = 0,45, theoretische Auflösung bei 800 nm von 1,1 µm), Film Dicke Werte von ca. ≤ 20 µm zu messen. Für einen Film verwenden Sie Dicke im Bereich von 20 µm bis 50 µm 10 X-Objektiv (NA = 0,30, theoretische Auflösung bei 800 nm von 1,6 µm) und für einen Film verwenden Sie Dicke ≥ 50 µm eine 5 X Objektiv (NA = 0,15, theoretische Auflösung bei 800 nm von 3,3 µm).
- Mit einer Rasierklinge kleinschneiden des Polymeren Films (ca. 0,25 cm2) und legen sie auf ein Glas-Folie-Rand. Ort der Objektträger vertikal orientierte unter einem aufrechten Mikroskop und Messen Sie die Dicke des Films Querschnitts.
-
SEM-Untersuchung
- Schneiden Sie die PET-Folie und legen Sie eine Stichprobe von ca. 2 cm2 auf einen Glasobjektträger und legen Sie sie senkrecht auf der Klemm-Mechanismus im Inneren der Probe Halter ≤ 2 mm unterhalb der Oberseite des Halters.
- Wählen Sie eine Beschleunigungsspannung von 10 kV, die rückgestreute Elektronen Detektor (BSD) und niedrigen Vakuumbedingungen (60 Pa).
- Stellen Sie den Fokus, Vergrößerung, Helligkeit und Kontrast der Bilder.
- Wählen Sie eine Bild-Erfassungszeit von 28 s mit einer Auflösung von 1024 x 2048 Pixel.
- Der Probenhalter aus SEM entfernen
4. biologische Untersuchungen
- Routinemäßige Zelle Kultur L929 Zellen
- Verwenden Sie die murine Fibroblasten-Zelllinie L929 zur Untersuchung. Kultur der Zellen in eine Park Memorial Institute (RPMI) 1640 basal Medium, ergänzt mit 10 % fötalen Rinderserum und Penicillin Und Streptomycin bei 37 ° C, 5 % CO2 in T75 Zelle Kulturflaschen. Die Passage der Zellen an einer Einmündung von ca. 70 % bis 80 %.
- Für Zelle passagierung, entfernen Sie das Medium durch Absaugen und Waschen mit Kalzium und Magnesium frei Phosphatpuffer (DPBS- / -) für 30 s unter einem Laminar-Flow Kabinett. Danach die Zellen mit 2 mL des Accutase, eine Enzymlösung mit proteolytischen inkubieren und Collagenolytic Tätigkeit für bis zu 5 min bei 37 ° C, 5 % CO2.
- Loslösung der Zellen von der Zelloberfläche Kultur Kolben mit einem Phase-Kontrast-Mikroskop zu überprüfen.
- Fügen Sie 8 mL Serum-haltige Mittel in die Küvette und Übertragung der Zellsuspension auf eine 15 mL Reaktionsgefäß.
- Nehmen Sie eine 10 µL Probe aus der Zellsuspension und mischen mit 10 µL Trypan blau.
- Bestimmen Sie die Handy-Nummer mit einer Neubauer-Kammer und berechnen Sie die Gesamtzahl der Zellen.
Achtung: Trypan blau ist giftig, daher Beratung MSDS, nach den obligatorischen Verfahren in der MSDS beschrieben, tragen von geeigneter persönlicher Arbeitschutz und Abwicklung unter einem chemischen Schrank erforderlich ist. Sammeln Sie Abfall für chemische Abfälle Abscheidung.
Hinweis: Trypan blau positive Zellen sind, unter Angabe nicht intakte Zellmembranen blau. - Für den nächsten Durchgang, Kultur 5 x 105 Zellen in eine neue sterile Zelle-Kultur-Flasche mit 10 mL des neuen Mediums. Für die experimentellen Bedingungen, Kultur 3 x 105 in 6-well-Platten und 6 x 104 Zellen in jede Vertiefung der 24-well-Platte mit Polymeren Proben (Protokoll Schritt 4.2).
- Vorbereitung von Verbundfolien für Zellexperimente Kultur.
- Verbrauchsteuern Einzelstücke der Filme von den gewünschten Abmessungen hergestellt im Protokoll Schritt 1.4 und 1.5 aus dem PET unterstützende Layer mit einem Skalpell und Ort mit einer Pinzette auf der Oberfläche von Glas Deckel rutscht mit einem Durchmesser von 12 mm. Legen Sie die Proben in den Vertiefungen der a 2 4 Teller gut.
- Entfernen Sie für die Bestimmung der Zytotoxizität und Zellzählung die Filme nicht aus der PET-Folie. Schneiden ca. 9,4 cm2Kreisflächen, Einbau ordentlich in die einzelnen Vertiefungen der eine 6-well-Platte aus den Filmen in 1.4 und 1.5 produziert und legen Sie sie in die Vertiefungen einer Zellplatte Kultur.
- Tauchen die Polymerproben in entionisiertem H2O für ≥ 30 min.
Hinweis: Die Polymeren Proben könnten durch Autoklavieren sterilisiert werden. Daher entfernen Sie alle enthaltenden Polymerproben aus der Zelle Kultur Gerichte und legen Sie sie in ein Glas Petrischale. Sterilisation erfolgt im Autoklav bei 2,05 Bar für 20 Minuten bei einer Temperatur von 121 ° C.
- Plasmabehandlung von Polymeren
- Platzieren Sie die Filme, die zugeordnet sind, auf PET-Folie oder auf Runde Glas Deckel rutscht (hergestellt in 4.2.1) in die Reaktionskammer des Plasma-Gerätes.
- Schließen Sie den Deckel und evakuieren Sie, bis ein Druck von 1,6 x 10-2 Mbar erreicht ist.
- Durchführen Sie Plasmabehandlung für 3 min.
- Lüften Sie die Reaktionskammer und Proben in 24 gut oder 6 auch Gerichte für weitere Untersuchungen der Zelle-Kultur.
- Verwenden Sie eine Probe für Kontaktwinkel Wasserbestimmung mit einem Goniometer. Daher bewegen Sie die Spritze in der Nähe der Polymere Oberfläche, mit dem Softwarepaket und geben Sie einen Tropfen 3 µL Wasser auf der Oberfläche. Berechnung des statischen Wasser Kontaktwinkels mit Goniometer Software.
- Färbung und Mikroskopie
- Bereiten Sie Zellen, wie in Schritt 4.1.7 und Kultur für 3 d bei 37 ° C und 5 % CO2beschrieben.
- Phase Kontrast Aufnahmen von Zellen, die für drei Tage auf unberührten kultiviert- und Plasma behandelt Filme kurz vor Fixierung.
- Bereiten Sie PBS ergänzt mit 0,2 % Triton X-100. Langsam pipette 200 µL der Stammlösung in 100 mL PBS (PBS-T).
- Bereiten Sie eine 4 % Paraformaldehyd/PBS-Lösung (PFA/PBS-T).
Achtung: Paraformaldehyd ist giftig, daher Beratung MSDS, nach den obligatorischen Verfahren beschrieben in der MSDS und tragen von geeigneter persönlicher Arbeitschutz und Handhabung unter einem chemischen Schrank erforderlich ist. - Bereiten Sie eine 5 % BSA/PBS-T-Lösung.
- Entfernen Sie das Medium, durch Absaugen unter der Lamina-Flow Kabinett. Fügen Sie PBS in die Vertiefungen, mittlere Rückstände zu entfernen.
- Die Platte auf einem chemischen Schrank übertragen und PBS für 25 Minuten bei Raumtemperatur mit 400 µL der PFA/PBS-Lösung zu ersetzen.
- Entfernen Sie die PFA/PBS-Lösung aus den einzelnen Brunnen, sorgfältig waschen mit PBS viermal. Warten Sie 3 Minuten zwischen jedem Waschschritt und sammeln Sie die Lösungen für die Entsorgung von chemischen Abfällen zu. Verwenden Sie die Platte direkt oder bei 4 ° c Lagern
- 5 % Rinderserumalbumin (BSA) hinzufügen / PBS-T in die Vertiefungen und inkubieren Sie für 60 min bei RT, unspezifischen Bindungsstellen blockieren.
- Aspirieren Sie die Lösung und ersetzen Sie es mit einem Phalloidin konjugiert, Alexa-488 (Verdünnung 1: 160) / PBS-T-Lösung ergänzt mit 0,2 % Triton X-100.
Achtung: Phalloidin-488 ist giftig, daher Beratung MSDS, nach den obligatorischen Verfahren beschrieben in der MSDS und tragen von geeigneter persönlicher Arbeitschutz und Handhabung unter einem chemischen Schrank erforderlich ist. - Die Platte mit Alufolie abdecken und 3 h bei RT inkubieren oder über Nacht bei 4 ° C.
- Aspirieren Sie die Lösung und waschen Sie dreimal mit PBS. Warten Sie 3 Minuten zwischen jedem Waschschritt. Die Lösungen für die Entsorgung von chemischen Abfällen zu sammeln.
- Bereiten Sie eine Lösung von 1 µL Farbstoff Hoechst 33342 (Lager Lösung 1 mg/mL). Für eine Verdünnung von 1: 1000 Pipette 1 µL Hoechst 3334 bis 1 mL PBS-T zu färben und gut mischen. Die Brunnen 300 µL der Hoechst 33342 Farbstofflösung hinzu und 10 min bei RT im Dunkeln inkubieren.
Achtung: Farbstoff Hoechst 33342 ist ein DNA-intercalating-Reagenz und daher potenziell Mutagene, daher Beratung MSDS, nach den obligatorischen Verfahren beschrieben im Muskel-und Skeletterkrankungen und tragen von geeigneter persönlicher Arbeitschutz und Umgang mit unter eine chemischen Kabinett ist erforderlich. - Aspirieren Sie die Lösung und waschen Sie die Proben viermal mit PBS. Warten Sie 3 Minuten zwischen jedem Waschschritt. Die Lösung für die Entsorgung von chemischen Abfällen zu sammeln.
- Für die Einbettung, sorgfältig entfernen Sie die Filme von der Kultur-Oberfläche zu und legen Sie sie auf einen Glas-Objektträger. Der Film 20 bis 40 µL Wasser lösliche einbetten Medium hinzu, und fügen Sie eine neue Runde Glas-Deckglas an der Spitze mit leichtem Druck.
- Durchführen Sie Bildgebung mit einem Fluoreszenzmikroskop. Filter für die Beleuchtung benötigt: Alexa-488 hat eine maximale Erregung bei 496 nm und maximale Emission erfolgt bei 519 nm. Daher ist die Emissionsfarbe grün. Hoechst 33342 Farbstoff Trihydrochlorid Trihydrate komplexiert mit DNA hat eine Anregung bei 355 nm und maximalen maximale DNA Komplex Emission erfolgt bei 465 nm.
- Bestimmung der Zytotoxizität und Bestimmung der Anzahl von Zellen
- Führen Sie das Experiment mit Zellen gewachsen in den 6 well-Platten in Schritt 4.3 vorbereitet und Zellen, die in Schritt 4.1.7 vorbereitet. Kulturzellen Sie für 3 Tage bei 37 ° C und 5 % CO2. Verwenden Sie für die positive Kontrolle Zellen, die auf eine Kultur behandelt Polystyrol Zelloberfläche, enthält keine Polymere Filme angebaut wurden. Erhalten Sie für Hintergrund-Bestimmung (negative Bedingung) Mittel aus einem Brunnen ohne Zellen.
Hinweis: Medium kann auch die gut enthaltenden Zellen kultiviert auf der Zelloberfläche Kultur behandelt Polystyrol entnommen werden. - Je nach Anzahl der experimentellen Proben Label 15 mL Röhrchen.
- Die Positivkontrolle 40 µL einer 0,9 % Triton x-100 mit PBS-Lösung hinzu und mischen Sie kräftig mit 1000 µL Spitze. Ca. 3 min. warten.
- Ohne Beseitigung der Zellen an der Oberfläche befestigt, Aspirieren Sie das Medium aus allen Proben, einschließlich Proben in 4.5.3 vorbereitet und übertragen Sie das Medium auf 15 mL-Tuben. Fügen Sie 3 mL des DPBS- / - in die einzelnen Vertiefungen und speichern Sie die Platten unter Laminar-Flow-Schaltschrank für die Bestimmung der zellulären Anzahl wie in 4.5.9 beschrieben.
- Für 3 Minuten auf 200 X g zentrifugieren und 1 mL der Überstand für die LDH-Aktivität-Bestimmung zu entfernen. Speichern Sie die 15 mL Röhrchen enthält Zellen und verbleibenden Medium unter Laminar-Flow Kabinett.
- Für den Test sind eine schwarze 96-well-Platten mit flachem Boden verwendet. 50 µL Reagenz CytoTox-ONE hinzufügen 50 µL der Probe Medium und Mix gut für 30 s.
- Die Platte mit Alufolie abdecken und für 10 min bei RT speichern
- Fügen Sie 25 µL der Stopplösung in jede Vertiefung hinzu und nehmen Sie der Fluoreszenzintensität mit einem Fluoreszenz-Platte-Leser auf. Schütteln Sie die Platte für 10 s und erkennen das Fluoreszenzsignal mit einer Erregung Wellenlänge von 520 nm und einer Emissionswellenlänge von 560 nm. Vermeiden Sie Luftblasen.
- Zur Bestimmung der Zelle Nummer aufziehen des DPBS- / - aus den Quellen der Kultur Platte aus Protokoll Schritt 4.5.4 und fügen Sie die Lösungen zu den 15 mL Reaktionsgefäße, enthält die Überstände in Protokoll-Nummer 4.5.5 gesammelt.
- Zentrifugieren Sie die 15 mL Reaktionsgefäß bei 200 X g für 3 min und Aspirieren Sie überstand. 0,5 mL Trypsin/EDTA zugeben und 10 min bei 37 ° c inkubieren
- Die Vertiefungen der Platte 2 mL Trypsin/EDTA bei hinzu und inkubieren Sie für ca. 10 min bei 37 ° C, Zellen aus den Polymeren Filmen zu trennen.
- Die Zellsuspension ist das 15 mL Reaktionsgefäß aus Schrittnummer 4.6.10 übertragen. Darüber hinaus waschen Sie die Platten kräftig mit Serum mit Medium.
- Zentrifugieren Sie die Proben bei 200 X g für 3 min, Aspirieren Sie überstand und fügen Sie Serum mit Mittel-bis das Rohr hinzu.
- Bestimmen Sie die Handy-Nummer wie in den Schritten 4.1.5 und 4.1.6 beschrieben.
- Führen Sie das Experiment mit Zellen gewachsen in den 6 well-Platten in Schritt 4.3 vorbereitet und Zellen, die in Schritt 4.1.7 vorbereitet. Kulturzellen Sie für 3 Tage bei 37 ° C und 5 % CO2. Verwenden Sie für die positive Kontrolle Zellen, die auf eine Kultur behandelt Polystyrol Zelloberfläche, enthält keine Polymere Filme angebaut wurden. Erhalten Sie für Hintergrund-Bestimmung (negative Bedingung) Mittel aus einem Brunnen ohne Zellen.
Ergebnisse
Bei den ersten Versuchen wurden PDMS Filme mit unterschiedlicher Dicke und Konstante Mischungsverhältnis 10:1 auf PET-Folien (Abbildung 1) hergestellt. Weil die Dicke der Trägerschicht erheblich beeinflussen kann die Steifigkeit und handling-Eigenschaften des gesamten Verbundfolien, in den ersten Experimenten waren einzelne Filme 13 ± 2 µm bis 296 ± 13 µm hergestellt (Abbildung 1). Es ist bekannt, dass während der heilende Prozess Schrumpfung von Polymerfolien auftritt. Für die dünnsten Filme beobachteten wir eine Differenz von 78 % ± 3,1 % zwischen nassen und geheilt. Für die dicksten Filme erkannt Schrumpfung von 40,9 % ± 2,6 % wurde (Abbildung 1).
Für die Anwendungen, die in diesem Protokoll vorgelegt Filme aus der PET-Folie manuell entfernt werden müssen. Wir erkannt, dass vor allem Dünnfilme schwierig sind zu handhaben mit Pinzette und werden oft während dieses Prozesses zerstört. Daher untersuchten wir den Einfluss eines dünnen Poly (Vinyl-Alkohol) als unterstützende Schicht Beschichtung. PVA besitzt eine hohe Steifigkeit und kann leicht entfernt werden, aufgrund ihrer Wasserlöslichkeit in downstream-Anwendungen. Die angewandte PVA-Beschichtung hat eine Dicke von ca. 17 µm und PDMS Filme auf dieser Schicht beschichtet sind daher etwas dünner im Vergleich zu Filmen ohne die PVA-Beschichtung (Daten nicht gezeigt). Vor allem die Konzentration auf die Verarbeitungseigenschaften, schließen wir, dass nur der dünnste Film erfordert eine unterstützende PVA-Folie für die Entfernung aus der PET-Folie.
Für alle weiteren Experimenten wurde eine effektive Schichtdicke von etwa 40 µm gewählt. Für die Herstellung von Verbundfolien war das Mischungsverhältnis von PDMS variiert von 10:1, 45: 1 bis 70: 1 und auf der zuvor polymerisierten PDMS-Film mit der Arzt-Messer-Technik (Abbildung 2A) aufgetragen. Mit Ausnahme von dem Verhältnis 10:1 könnte die verschiedenen Filme durch optische Mikroskopie mit entsprechenden Präzision deutlich unterschieden werden. Für die mikroskopische Analyse wurden die Filme mit einem Skalpell geschnitten und an ein Glas-Folie-Rand. Die höheren Mischungsverhältnisse der oberen Schicht erschien optisch heller auf die mikroskopischen Aufnahmen im Vergleich zu den 10:1-Verhältnis von der Trägerschicht (Abb. 2 b). Darüber hinaus wurde, Rasterelektronenmikroskopie zur Bild-Proben bei einer Vergrößerung von etwa 860 X (Abbildung 2). Ein klar erkennbare Unterschied in der Helligkeit zwischen den beiden PDMS-Filmen, in höheren Mischverhältnisse hergestellt wurde erkannt, im Gegensatz zu dem Verhältnis 10:1. Der Schneidvorgang hinterlässt Spuren, sichtbar in die SEM-Bilder (Abb. 2 b). Basierend auf diesen Ergebnissen wurde die durchschnittliche Gesamtstärke der Verbundfolien 112 µm ± 5,0 µm (Abb. 2D).
In weiteren Experimenten wurden die Haftungseigenschaften dieser Filme mit Normalkraft Adhäsion Messungen mit zwei verschiedenen Glassubstraten (Abbildung 3) ermittelt. Die "glatte Substrat" besitzt eine Oberflächenstruktur mit eine arithmetische mittlere Rauheit Reine von 0,013 ± 0,0002 µm und eine mittlere Gipfel-Tal RZ von 0,12 ± 0,004 µm (Abb. 3A). Substrat 2 (GS2, als Rough bezeichnet) ausgestellt Rauigkeiten von 0,338 ± 0,021 (Rein) µm und 2.055 ± 0,017 µm (R-Z) (Abb. 3 b). Mit dem Mittelwert wurde erwarb 2.1.4 war die Oberfläche des Substrates "glatt" 3,2 mm2 und für die "grobe" Substrat eine Fläche von 6,07 mm2 Radius berechnet.
Mit diesen beiden Substrate wurde der Klebstoffe Verhalten der verschiedenen Filme bestimmt. Zwei Parameter werden ausgewählt, um die Hafteigenschaften der Filme beschreiben: Pull-off Spannung σmax und die Arbeit der Trennung WSep. Während des gesamten Prozesses der Verklebung und de-Verklebung der Probenort s und der Normalkraft F aufgezeichnet. Die Ergebnisse sind in einem Stress-Weg-Verlauf (Abbildung 4) vertreten.
Für die richtige Interpretation der Versuchsergebnisse ist es wichtig, das Substrat an der filmoberfläche von Polymeren genau ausrichten. Auch muss die Maschine Einhaltung Messgerät berücksichtigt werden, um die Verschiebung zu korrigieren. Während der Messung wirkt die einwirkende Kraft nicht nur auf die Probe, sondern auch auf andere Teile der Prüfeinrichtung. Daher wird jede der beiden Substrate gegen einen Objektträger mit einer Druckspannung von 13 ± 5 kPa gedrückt. Um die Einhaltung zu messen, ist die Lastkurve z.B. berücksichtigt, der Bestandteil der Kraft-Weg-Kurve wo kommen die beiden Oberflächen in Kontakt bis zum Beispiel Position, wo die genaue Vorspannkraft erreicht wird. Die gegenseitige Neigung der Kurve entspricht der Maschine Compliance C. Der berechnete Wert für C ist 0,12 µm/mN.
Im ersten Experiment wurden Filme mit verschiedene Mischungsverhältnisse von PDMS analysiert (Abbildung 5). Für die Verbundfolien war die Dicke und das Mischungsverhältnis der Trägerschicht, hergestellt von PDMS 10:1 konstant gehalten. Die Dicke der Deckschicht wurde auch mit einem Wert von 65 µm konstant gehalten. Die höchste Spannung zum Abziehen von 109 ± 27,6 kPa wurde mit dem glatten Glas-Substrat auf dem PDMS 10:1 Film (Abbildung 5A) bestimmt. Eine Erhöhung des Mischungsverhältnisses führt zu einer Abnahme der Belastung abziehen, 76,7 ± 17 kPa für 45: 1 Mischungsverhältnis und 41.4 ± 17 kPa für das Verhältnis von 70: 1. Mit dem rauen Glas Substrat ein Pull-off Stress von 22 ± war 2.2 kPa auf dem PDMS 10:1 Film bestimmt. Im Allgemeinen war die Arbeit der Trennung vergleichbar zwischen beiden Glassubstrate, zB., 1,4 ± 0,6 J/m2 auf dem dünnsten Film mit glatten Untergrund und 1,84 ± 0,7 J/m2 auf dem dünnsten Film erhalten erhalten mit dem rauen Untergrund ( Abbildung 5 b).
Als Nächstes untersucht die Produktion von dünnen Filmen für Haut-Anwendungen und für die Zellkultur, die Anwendungen wurden (Abbildung 6). SSA 50: 50 wurde für die obere Schicht-Produktion von der Verbundfolien eingesetzt. In einem 01:10 Mischungsverhältnis mit einer Dicke von ca. 40 µm PDMS wurde als eine Trägerschicht verwendet. Im Gegensatz zu den früheren Experimenten in Abbildung 5dargestellt, die Dicke der Deckschicht war vielfältig, während das Mischungsverhältnis konstant gehalten wurde (Abb. 6A). SSA hat wegen seiner Klebeeigenschaften in Anwendungen, bei denen Anhaftung an Oberflächen mit hohe Oberflächenrauhigkeit, vor allem die menschliche Haut, ausgewählt mit der Hersteller-Empfehlung der mischenden Verhältnis 50: 505,8. Menschliche Epidermis besitzt eine hohe Oberflächenrauhigkeit. Je nach Alter und anatomische berichtet Region zwischen 48 µm und 71 µm Tiefe mittlere Oberflächenrauhigkeit (R-Z) wurde29. Sichere und sanfte Haut Adhäsion ist wichtig, Besonderheit für die empfindliche Haut von Neugeborenen oder kaum regenerierende Haut älterer Menschen. Unterschiedliche nassen dicken von 40 µm, 120 µm, 300 µm bis 500 µm angewendet wurden (Abb. 6A). Abhängig von der Feuchte Dicke variiert die Gesamtdicke der Verbundfolien 51 µm bis 344 µm (Abb. 6 b). Nach dem Aushärten sind die Composite, ein freiwilliger Handrücken (Abbildung 6) befestigt. Die verschiedenen Filme dicken zeigen deutlich Unterschiede in ihren Eigenschaften der Anpassung an die Rauheit der Haut (Abbildung 6). Dünnfilme (50 µm und 100 µm Gesamtdicke) zeigen eine hohe Rate der Anpassung an die Hautfalten, die im Vergleich zu den dickeren Schichten (220 µm und 340 µm Gesamtdicke). Diese Ergebnisse zeigen, dass Verbundfolien mit einer breiten Palette von dicken genau mit der angewandten Arzt-Klinge-Technik hergestellt werden können.
Adhäsion Experimente wurden mit diesen Verbundfolien (Abbildung 7) durchgeführt. Abhängig von der Dicke der Oberfolie SSA haben wir eine Abnahme der Belastung abziehen mit zunehmender Schichtdicke beobachtet. Die höchste Abzugskraft von 133 ± 36,6 kPa wurde auf dem glatten Untergrund (Abb. 7A) gemessen. Der niedrigsten ziehen aus Stress von 18 ± 4 kPa wurde mit dem rauen Untergrund auf dem dicksten Film erhalten. Interessanterweise zeigt ein Vergleich zwischen beiden Substrate einen 2,7 Falte Unterschied auf die dünnsten Folien (Abb. 7A). Mit zunehmender Schichtdicke war vor allem auf die dicksten Filme keine bemerkenswerten Unterschied zu beobachten (Abb. 7A). Mit dem glatten Untergrund ein Werk der Trennung von 1,8 ± 0,8 J/m2 auf dem Film mit einer Gesamtdicke von ca. 100 µm erkannt wurde gefolgt von einem Film Dicke abhängigen Abnahme (220 µm Dicke: 1,6 ± 0,6 J/m2 und 330 µm: 1,3 ± 0,4 J/m2 (Abb. 7 b)). Die Arbeit der Trennung mit den rauen Substraten gemessen wurde im allgemeinen etwas niedriger im Vergleich auf dem glatten Untergrund (100 µm Dicke: 1,63 ± 0,6 J/m2, 220 µm Dicke: 1,1 ± 0,6 J/m2 und 330 µm: 1,0 ± 0,2 J/m2 (Abbildung 7 b )).
Darüber hinaus verzeichnete die Ablösung Mechanismus während der Messungen (Abbildung 7). Wenig Kavitation wurde auf dem dünnsten Film beobachtet, während das Aussehen der Finger wie Risse auf die dickeren Schichten (Abbildung 7 war).
Innerhalb eines Monats nach der Herstellung der Filme wurden Messungen durchgeführt. Stabilität und Erhaltung der mechanischen Eigenschaften der elastischen Filme könnte jedoch durch Umweltfaktoren wie Temperatur und Luftfeuchtigkeit beeinflusst werden. Wie im Protokoll Schritt 1.4.3 beschrieben, wurden die Filme bei Raumtemperatur und einer Luftfeuchtigkeit von 40-65 % gespeichert. Um zu verhindern wurden sie vor Verschmutzung und Staub, die Filme in Kunststoff Petrischalen im Dunkeln hinterlegt. 50: 50 Filme wurden zur Untersuchung der Langzeitstabilität, Adhäsion Messungen und Bestimmung der Dicke der SSA ca. vier Monate nach der Herstellung durchgeführt. Nach der Lagerung wurde keinen großen Einfluss auf die Schichtdicke, abziehen Stress und Arbeit der Trennung festgestellt. Zum Beispiel war abziehen Stress von der SSA-Verbundfolien mit einer nassen Dicke von 120 µm SSA und eine nasse Dicke von 100 µm PDMS gefertigt 46,6 ± 6 kPa und die Arbeit der Trennung 1627 ± 592 mJ/m2 nach der Herstellung. Ca. vier Monate nach der Herstellung, wurde eine Belastung abziehen von 48,8 ± 5.4 kPa und ein Werk der Trennung von 1666 ± 723 mJ/m2 bestimmt. Darüber hinaus kurz nach Fertigung, die Gesamtstärke dieser Filme 103,3 13,9 ± µm wurde und nach der Lagerung 98,1 ± 9,1 µm.
In weiteren Experimenten PDMS 10:1 und SSA-50: 50-Verbundfolien mit einer Gesamtdicke von ca. 105 µm verwendet worden als Zell Kultursubstrate (Abbildung 8). Verbundfolien hergestellt im Protokoll Schrittnummer 1 können leicht aus der PET-Folie entfernt und schneiden im erforderlichen Maße und geometrischen Formen. Darüber hinaus bei die Filmen um eine starre Einhaltung Oberfläche, für Beispiel Glas, mehrere Filme anzeigen verschiedene Youngs Moduli nebeneinander angebracht werden können und in einem einzigen Brunnen eine Zellplatte Kultur platziert werden könnte. Filme können die Polystyrol Oberfläche direkt, ohne eine zusätzliche Deckglas beizufügen. Auch könnte Filme an verschiedenen Oberflächen und geometrischen Struktur, wie Tuben oder Ringe, so dass weitere Studien mit konventionellen Zelle Kultur Materialien nicht erreicht werden können angepasst werden. In den durchgeführten Experimenten in Abbildung 8 dargestellten Verbundfolien auf PET-Folie direkt in Kultur Zellplatten platziert wurden, oder Filme aus der PET-Folie entfernt und auf Glas Deckel rutscht platziert wurden. Für die experimentellen Bedingungen wurden manche Polymere mit Luft-Plasma zu erhöhen Sie ihre freien Oberflächenenergie behandelt. In der Regel PDMS besitzt einen Kontaktwinkel von Wasser von ca. 115° vor der Plasmabehandlung und wird hoch hydrophilen (Wasser Kontaktwinkel < 30°) Nachbehandlung8. Plasmabehandlung rendert die Oberfläche biokompatibel und erleichtert das Anbringen von eukaryotischen Zellen. Je nach Behandlungszeit und Intensität der Polymeroberfläche verändert, ein höheres Maß an Rauheit anzeigen und auch Riss erscheinen könnte. Unmittelbar nach der Behandlung ist eine hydrophobe Recovery-Prozess zu beobachten. Wie unter Protokoll Schritt 4.3.5 war ein Goniometer verwendet, um die statische Wasser Kontaktwinkel bestimmen. Daher wurden Polymere, die in DdH2O 1 h nach der Luft-Plasma-Behandlung gebracht wurden anschließend analysiert. Plasmabehandlung den Kontaktwinkel von Wasser deutlich reduziert (PDMS unberührten: 117,0 ± 2,2 °; SSA unberührten: 127.9 ± 5,6 °; PDMS Plasma: 18,0 ± 7,2 °; SSA-Plasma: 29,3 ± 11,5 °).
Für Probe Einbetten einer wässrigen Montage ist Medium angewendet worden. Wenn die Proben zu jedem Zeitpunkt wieder entfernt werden müssen, können die Proben in einer Petrischale über Nacht mit Wasser platziert werden. Schließlich kann das Deckel rutscht für weitere Analysen entfernt werden.
Die Anlage Verhalten und Morphologie der L929 Zellen ausgesät für 3 Tage auf PDMS und SSA 50: 50-Verbundfolien festgestellt wurde durch Phasenkontrastmikroskopie und nach der Färbung mit Fluoreszenz konjugiert Phalloidin-488 und Farbstoff Hoechst 33342 (Abbildung 8). Bildaufnahme mit Phasenkontrastmikroskopie wird dringend empfohlen, vor allem für Polymere, die nicht mit Plasma behandelt. Durch die schwache zelluläre Adhäsion an diesen Polymeren Oberflächen werden Einzelzellen oder Aggregate leicht getrennt und erschweren die korrekte Interpretation der nachfolgenden Analyse-Methoden.
Zellen auf den unberührten Polymeren ausgesät angezeigt schlechte Anlage und Mobilfunk Verbreitung Verhalten (Abbildung 8A1 und C1) während einer konfluierende Monoschicht wurde für Zellen kultiviert auf Plasma behandelt Oberflächen (Abbildung 8B1 und D1) beobachtet . Die Bildung der zellulären Aggregate und Loslösung von der Oberfläche war auf unberührten Flächen stärker ausgeprägt. Visualisierung der actinfilamente nach Fixierung mit 4 % Paraformaldehyd ergab nur wenige Zellen in der Peripherie der zellulären Aggregate und Emanation von Lamellipodia Ausbuchtungen auf unberührten PDMS und SSA 50: 50-Verbundfolien (Abbildung 8A2 migrieren und C2, Pfeile). Keine wesentlichen qualitativen Unterschiede konnte beobachtet werden, während des Vergleichs beider Polymere Werkstoffe. Als Randbemerkung, scheint es, dass ein weniger Menge an zellulären Aggregate auf SSA 50: 50 im Vergleich zu PDMS anwesend waren. Außerdem erschien die Aggregate befestigt an den Oberflächen auf SSA 50: 50 mehr abgeflacht (Abbildung 8 1). Wie erwartet, verbesserte Behandlung mit Luftplasma zellulären Anlage und Verbreitung auf beiden Flächen deutlich, führt zur Bildung von bemerkenswerten Lamellipodia Vorsprünge und eine konfluierende Monolayer (Abbildung 8 b2 und 8-2).
Freisetzung von LDH nach 3 Tagen der Kultur wurde als Indikator zur zytotoxische Wirkungen (Abbildung 9A) zu bestimmen. Im allgemeinen waren LDH Niveau vergleichbarer Zellen kultiviert auf beide Polymere Werkstoffe, mit weniger als 5 % Zytotoxizität (unberührte PDMS: 2,8 ± 2,0 %; unberührten SSA 50: 50: 4,5 ± 3,6 %; Plasma behandelt PDMS: 3,4 ± 1,5 %; Plasma behandelt SSA 50: 50: 3,4 ± 1,6 %). Diese Ergebnisse sind vergleichbar mit Daten in unsere bisher veröffentlichten Studie mit Schwerpunkt auf der Untersuchung von beiden Elastomeren. 8 um die Ergebnisse der LDH-Assay weiter zu überprüfen, wurde ein Trypan blau Ausschluss Test durchgeführt. Zusätzlich wurde die gesamten Zellpopulation bestimmt, um Unterschiede in der Verbreitung Aktivität (Abbildung 9 b) anzuzeigen. In der Regel weniger als 5 % Trypan blau positive Zellen gezählt wurden (unberührte PDMS: 2,4 ± 0,3 %; unberührten SSA 50: 50: 3,8 ± 2,5 %; Plasma behandelt PDMS: 0,74 ± 1,3 % Plasma behandelt SSA 50: 50: 0,95 ± 1,6 %).
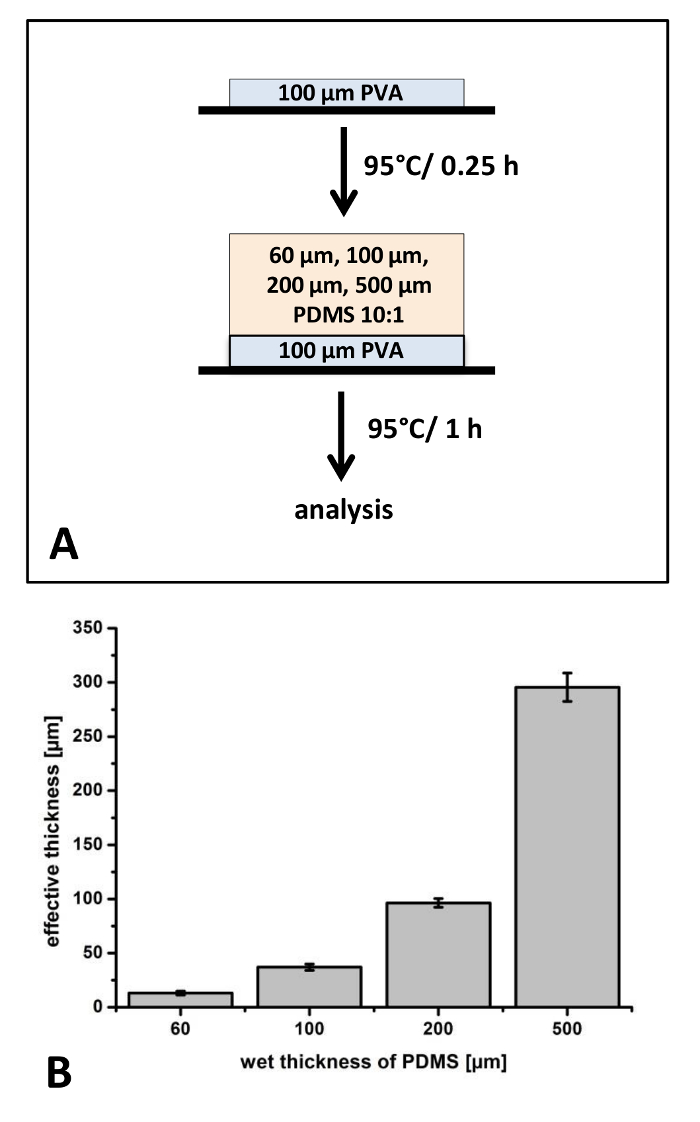
Abbildung 1: Vorbereitung der PDMS-Filme auf Poly--(vinyl alcohol) (PVA) beschichtete PET-Folie: Das Verfahren zur Herstellung von PDMS Filme mit unterschiedlicher Stärke auf eine PET-Folie wurde angewandt, um die Reproduzierbarkeit und Fahrverhalten (A) zu bestimmen. Die dicken der PDMS-Filme wurden mit optischen Mikroskopie nach der Aushärtung bei 95 ° C (B) analysiert. N = 3 unabhängig voneinander hergestellten Filme wurden analysiert. Von jedem Film, wurden drei verschiedene Standorte ausgewählt, Schnitt und 3 Positionen auf jede Probe wurden analysiert (k = 27). Fehlerbalken darzustellen Standardabweichung. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Herstellung von Verbundfolien PDMS in verschiedene Mischungsverhältnisse vorbereitet: Verbundfolien präsentiert verschiedene Mischungsverhältnisse der Basis (Komponente A), Vernetzer (Komponente B) des PDMS wurden von Arzt-Messer-Technik hergestellt. Die oberste Schicht, bestehend aus PDMS im Verhältnis 10:1 (Komponente b), wurden 45: 1 und 70: 1 auf eine bereits ausgehärtete PDMS 10:1 Film (A) eingesetzt. Nach dem anschließenden Aushärten bei 95 ° C wurde Dicke der Verbundfolien optische Mikroskopie (B) und Rasterelektronenmikroskopie (C) analysiert. N = 3 unabhängige Experimente wurden durchgeführt und analysiert mit optischen Mikroskopie (D). Jeder unabhängige hergestellten Film bilden, drei verschiedene Standorten wurden ausgewählt, Schnitt und 3 Positionen auf einzelnen Proben wurden analysiert (k = 27). Fehlerbalken darzustellen Standardabweichung. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Bestimmung der topographischen Oberflächenrauhigkeit der beiden Substrate für die Adhäsion Messungen verwendet: Zeichneten sich zwei Glassubstraten besitzen unterschiedliche Rauheit der Oberfläche. Drei dimensionale Profilometric Analyse der Oberfläche wurde auf der "glatt" Substrat GS (A1) und die "grobe" Substrat GR (B1) durchgeführt. Entsprechenden Zeile Kurven sind in A2 und B2 dargestellt). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Prinzip der normalen Adhäsion Messungen: Eine benutzerdefinierte Build-Setup wurde verwendet, um die Haftungseigenschaften der Polymerproben charakterisieren. Der Messaufbau ist in (A) dargestellt und Details werden in (B) dargestellt. Für die Messung Analyse wurde Stress aus einem Stress-Zeit-Kurve (C) bestimmt. Arbeit der Trennung wurde durch eine Integration von Stress-Weg-Verlauf zwischen sEnde und s0 (D) bestimmt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5: Bestimmung der Hafteigenschaften von Verbundfolien mit verschiedene Mischungsverhältnisse von PDMS: Pull-off Stress (A) und der Trennung (B) die Verbundfolien aus PDMS in mischenden Verhältnis 10:1, 45: 1 und 70: 1 hergestellt wurden gemessen. Für die Analyse, eine "glatte" Glas-Substrat (GS) ausstellen ein Ra = 0,013 µm und eine "grobe" Glassubstrat (GR) mit Rein = 0.338 µm verwendet wurden. N = 3 unabhängig voneinander hergestellten Filme wurden analysiert. Von jedem Film, zwei Stücke wurden ausgewählt und drei verschiedene Positionen auf jede Probe analysiert wurden (k = 18). Fehlerbalken darzustellen Standardabweichung. Bitte klicken Sie hier für eine größere Version dieser Figur.
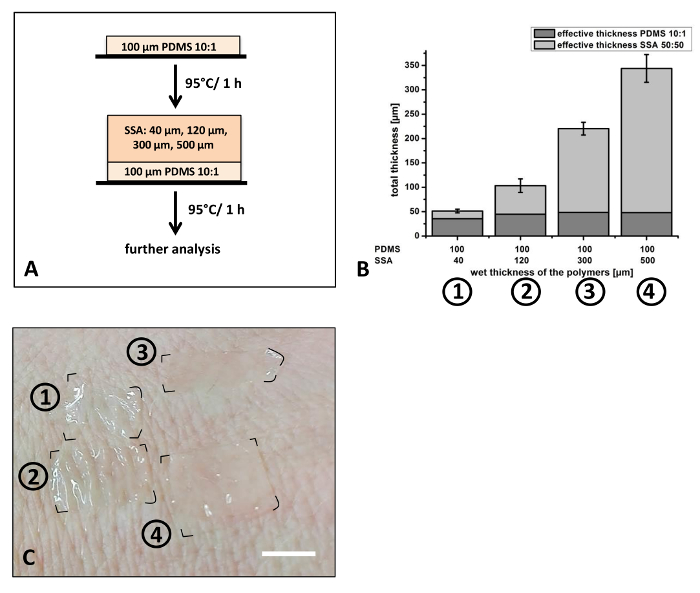
Abbildung 6: Vorbereitung der SSA-Verbundfolien mit unterschiedlicher Stärke: SSA 50: 50 war über eine bereits ausgehärtete PDMS 10:1 Film (A) aufgebracht. Unterschiedliche nassen dicken dieser Schicht von 40 bis 500 µm wurden angewandt und die Dicke nach dem Aushärten mit optischen Mikroskopie (B) untersucht. Befestigung der Filme auf der Rückseite von einem freiwilligen Hand angezeigt, dass Filme mit einer Gesamtdicke von ca. 100 µm (Film #2) gut auf die Rauheit der Haut (C) entsprach. Dicke der einzelnen Schichten und die Gesamtdicke der Verbundfolien sind in Abbildung 6dargestellt. Für die Analyse n = 3 unabhängig voneinander hergestellte Proben wurden mit optischen Mikroskopie gemessen. Von jedem Film, wurden drei verschiedene Standorte ausgewählt, Schnitt und 3 Positionen auf jede Probe wurden analysiert (k = 27). Fehlerbalken darzustellen Standardabweichung. Maßstabsleiste in 6C zeigt ca. 1 cm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 7: Ermittlung der Hafteigenschaften von Verbundfolien des Klebers weiche Haut: Dünne Verbundfolien SSA als oberste Schicht und PDMS 10:1 als Trägerschicht hergestellt wurden. Die Dicke der Deckschicht wurde variiert zwischen 50 und 330 µm. abziehen Stress (A) und Arbeit der Trennung (B) die Verbundfolien mit zwei verschiedenen Glassubstrate gemessen wurden analysiert (ein "glatt" Glassubstrat (GS) mit einem Rein = 0,013 µm und eine "grobe" Glassubstrat (GR) mit Rein = 0.338 µm). Beispielhafte Bilder der Ablösung Mechanismen werden in Cvisualisiert. Für Daten-Analyse-n = 3 unabhängig voneinander hergestellten Experimente wurden analysiert. Von jedem Film, zwei Stücke wurden ausgewählt und drei verschiedene Positionen auf jede Probe analysiert wurden (k = 18). Fehlerbalken darzustellen Standardabweichung. Maßstabsbalken in 7C zeigen 0,5 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.
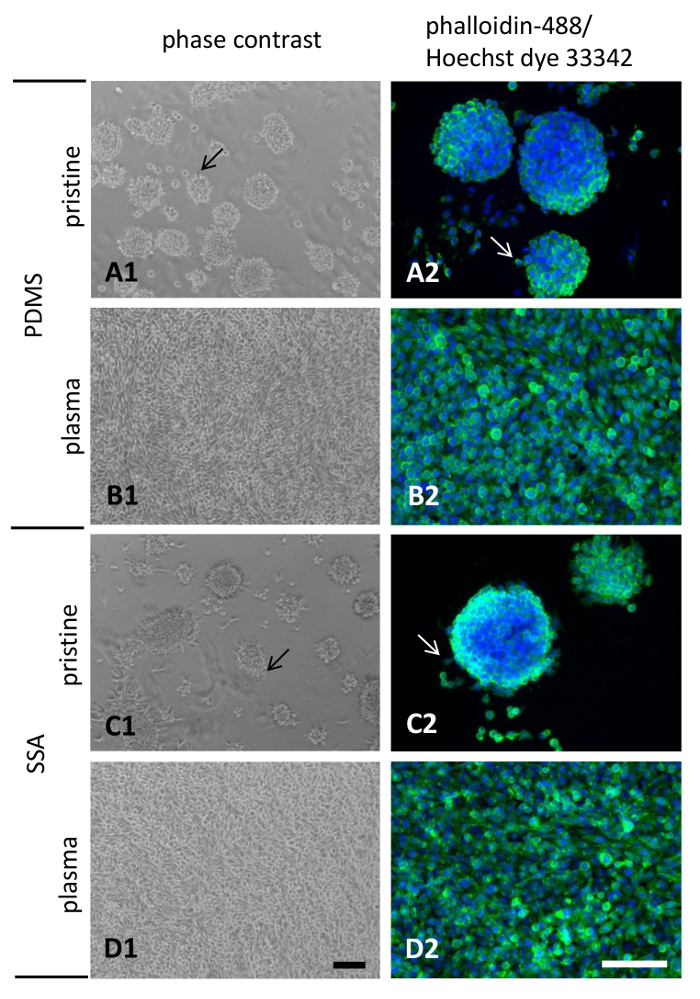
Abbildung 8: zellulären Morphologie der L929 Fibroblasten kultiviert auf dünne Folien: L929 murine Fibroblasten waren für 3 Tage auf der dünnen Schichten hergestellt aus PDMS (A1, A2, B1, B2) oder SSA (C1, C2, D1, D2) kultiviert. Hydrophilie der Oberflächen erhöhen Luft-Plasma-Behandlung wurde durchgeführt (B1, B2, D1, D2). Maßstabsbalken in D1 und D2 zeigen 100 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
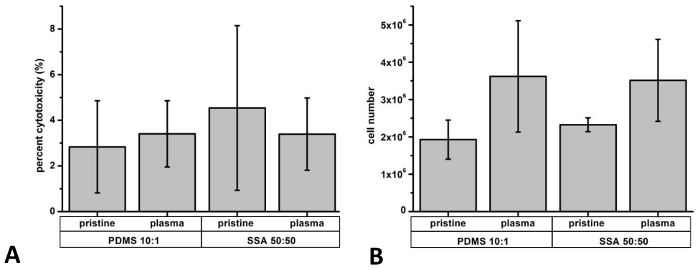
Abbildung 9: Bestimmung der Zytotoxizität und zelluläre Proliferation: Zur Bestimmung der zytotoxischen Wirkungen und Zellproliferation wurden für drei Tage auf PDMS 10:1 und SSA-50: 50-Verbundfolien L929 Zellen ausgesät. Freisetzung von Laktat-Dehydrogenase (LDH) wurde durch eine LDH-Aktivität-Assay bestimmt und weniger als 5 % offenbart Zytotoxizität (A). Insgesamt Handynummer mit Ablauf der Anbau wurde nach manuellen Zählung der Einzelzellen mit einer Neubauer-Kammer (B) bewertet. N = 3 selbstständig Experimente durchgeführt wurden analysiert. Fehlerbalken darzustellen Standardabweichung. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Das Design der composite-Strukturen ermöglicht die einfache Anpassung der Materialeigenschaften, wie des Elastizitätsmoduls oder die Dicke der Proben. Elastizitätsmodul von PDMS kann effektiv in einem breiten Spektrum durch das Mischungsverhältnis zwischen den beiden Komponenten zu verändern oder die Herstellung der Mischungen mit einem unterschiedlichen Silikon Elastomer30,31geändert werden. Die beschriebenen Methoden sind nicht beschränkt auf die PDMS in dieser Untersuchung verwendet, aber vor allem die selbstklebende Leistung hängt stark von der spezifischen Art verwendet. Ein wichtiger Schritt innerhalb dieses Protokolls ist der Herstellungsprozess von Verbundfolien (Abbildung 1). Es zeigte sich, dass die Dicke der Filme erheblich beeinträchtigt die Haftung Verhalten der Filme auf verschiedenen Substraten, einschließlich Haut (Abbildung 5 und Abbildung 6). Neben der Foliendicke Zeit und Temperatur während des Trocknungsprozesses wirkt sich die Materialeigenschaften32. Parameter wie die Dicke der Polymeren Schichten müssen daher sorgfältig angepasst und überprüft werden.
Analyse der selbstklebenden Eigenschaften dünner Schichten erfolgte mit Normalkraft Adhäsion Messungen mit zwei Glassubstraten mit verschiedenen Rauheit der Oberfläche bis zu Ra = 0.338 µm (Abbildung 3). Im Allgemeinen wirkt Rauheit deutlich die Haftung von Oberflächen, insbesondere von elastischen Materialien33,34. Die Rauheit des Glases kann leicht variiert werden, durch Schleifen mit Schleifpapier verschiedener Schroffheit Größen, daher erlauben die Herstellung von Substraten, die höhere Rauheit Werte21ausstellen. Darüber hinaus andere Materialien, z.B. Epoxidharz für die Herstellung von Substraten15,35einsetzbar. Dies könnte eine wichtige Modifikation Strategie des vorliegenden Protokolls sein. Zum Beispiel wenn Substrate mit verschiedenen Oberflächen freie Energien benötigt oder spezielle sind Topographien erforderlich. Hier wurden abziehen Stress und der Trennung von den Dünnschichten des PDMS und SSA hergestellt mit einem maßgeschneiderten Setup (makroskopische Adhäsion Messgerät (MAD, Abbildung 4)) analysiert. 36 optische Ausrichtung des Substrats und Eindringkörper ist ein entscheidender Schritt für die Analyse der Messergebnisse. Einstellung des Neigungswinkels muss daher mit dem Goniometer, so präzise wie möglich durchgeführt werden. Dies kann mit ausreichender Genauigkeit erreicht werden, indem Sie manuell das Substrat in Kontakt mit der filmoberfläche bis ein horizontale Kontakt entsteht.
Das aktuelle Protokoll wurde die Haltezeit auf eine Sekunde (Abbildung 5 und Abbildung 7) konstant gehalten. Vor allem für die Untersuchung der Klebstoff Leistung einen elastischen Film auf eine grobe Substratoberfläche stellt eine Erweiterung der Haltezeit Zusatzinformationen. Zum Beispiel wurde eine Zunahme der abziehen Stress mit zunehmendem Haltezeit gemeldeten8. Neben der Messungen in das aktuelle Protokoll, andere Methoden könnte zum Beispiel Peel Tests durchgeführt werden ermöglicht eine umfassendere Untersuchung der Haftung Leistung37.
Die Hafteigenschaften von Verbundfolien ausstellen anderen Film, die Dicke des Klebers weiche Haut ermittelt wurden (Abbildung 7). Unsere Ergebnisse sind in Übereinstimmung mit veröffentlichten Daten zeigen, dass eine Abnahme der Film Dicke führen zu einer Erhöhung der Belastung abziehen wie die Entbindung, d.h., das Verhältnis zwischen Durchmesser und Film Substratdicke, erhöht38,39 . Basierend auf diesen Ergebnissen und die Daten, die in Abbildung 7dargestellt, schließen wir, dass Verbundfolien mit einer Gesamtdicke von ca. 100 µm (Dicke der SSA-Schicht von ca. 60 µm aufgetragen zu einem PDMS-Film mit einer Dicke von ca. 40 µm) günstige Adhäsion p ausstellen Roperties auf rauen Oberflächen.
Als nächstes Experimente im Zusammenhang mit der biologischen Charakterisierung auf unberührten Verbundfolien durchgeführt wurden und Plasma behandelt Verbundfolien (Abbildung 8). Plasmabehandlung von Silikon-Elastomeren ist eine häufig angewandte, vielseitige Technik, um die hydrophilen Eigenschaften von Oberflächen und Förderung der zellulären Anlage und Mobilfunk Verbreitung40,41zu erhöhen. Silikone sind bekannt für ihre geringe Toxizität und hohe-Kompatibilität aber enthält möglicherweise Restmonomere oder Katalysatoren, die physiologische Prozesse, was auch zu Zytotoxizität42,43beeinflussen könnten. In die Experimente, die wir beobachtet haben, weniger als 5 % Zytotoxizität mit LDH Version als Indikator und ein Trypan blau-Ausschluss-Assay. Im vorgestellten Protokoll der gesamten zellulären Bevölkerung getrennt zellulären Aggregate einschließlich Form, die die Oberfläche für die Verbreitung Analyse (Abbildung 9 b) analysiert wurde. Eine Änderung des Protokolls könnte mehr differenzierte Ergebnisse produzieren. Für jede Probe konnte der Überstand mit freistehenden zellulären Aggregate auf einem separaten Reaktionsgefäß übertragen und nicht in Kombination mit der Zellen enzymatisch aus der Polymeroberfläche entfernt. Dies ermöglicht die genaue Beurteilung der Zellen an der Oberfläche befestigt und schließlich offenbaren eine genauere Bestimmung des Einflusses der Polymere auf die zelluläre Klebevorgang. Neben den hier vorgestellten Immunocytochemical Methoden möglicherweise Zellen für die Untersuchung mit Immunoblot Methoden, so dass eine detaillierte quantitative Bewertung der Proteinexpression geerntet werden.
Zusammenfassend haben wir Herstellungsbedingungen für die Herstellung von dünnen Elastomeren Verbundfolien für Anwendungen in der fortgeschrittenen Kultur Zellforschung etabliert. Darüber hinaus besitzen diese Dünnfilme hohen Anpassungsfähigkeit auf Haut, Rauheit, anspruchsvolles Design der Haut Klebstoffe ermöglichen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Martin Danner ist bekannt für seine Hilfe bei der Vorbereitung von Proben und Definition der Zelle Kultur Verfahren anerkannt. Die Autoren möchten Biesterfeld Spezialchemie GmbH (Hamburg, Deutschland), vor allem Robert Radsziwill für kontinuierliche Unterstützung und Diskussionen zu danken. Die Forschung führt zu diesen Ergebnissen wird finanziell vom European Research Council unter EU Fp7 (FP/2007-2013) ERC Grant Agreement n. 340929.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-Propanol, 97% | Stockmeier Chemie | 1000452610000 | Isopropanol |
| Abrasive diamnod hand pad | Bohle | MO 5007522 | Grit: 220 |
| Accutase | Capricorn Scientific | ACC-1B | |
| Albumin Fraktion V | Roth | 0163.2 | BSA |
| Alexa Fluor 488 Phalloidin | ThermoFischer Scientific | A12379 | highly toxic |
| Aquamount | Polysciences | 18606-20 | water soluble mounting medium |
| CytoTox-ONE Homogeneous Membrane Integrity Assay | Promega | G7890 | |
| DPBS, without Ca2+, Mg2+ | ThermoFischer Scientific | 14190094 | |
| Fetal bovine serum gold | GE Health Care Life Science | A15-151 | FBS |
| Goniometer OCA35 | Dataphysics | for the determination of the static water contact angle | |
| Hoechst Dye 33342 | Sigma-Aldrich | B1155-100MG | bisBenzimide H 33342 trihydrochloride, highly toxic |
| Microscope Axiovert 25 | Zeiss | Microscope used for cell culture documentation | |
| Microscope Eclipse LV100ND | Nikon | Microscope used for film thickness determination | |
| Paraformaldehyde, aqueous solution 16% | Electron Microscopy Sciences | RT 15710 | electron microscopy grade |
| penicillin und streptomycin solution | Sigma-Aldrich | P4333-100ML | |
| Phenom XL Scanning Electron Microscope (SEM) | Phenom | ||
| Poly-(vinyl alcohol) 4-88, MW 31000 | Sigma-Aldrich | 81381-1KG | Mowiol 4-88 |
| Poly-dimethyl siloxanes, Sylgard 184 | Dow Corning | (400)000108351397 | PDMS |
| RPMI 1640 basal medium | ThermoFischer Scientific | 21875034 | |
| soft skin adhesive (SSA) | Dow Corning | (400)000108251792 | MG 7-9800 Soft Skin Adhesive (SSA) |
| speed mixer DAC 600.2 VAC-P | Hauschild | ||
| stylus profilomter | Zeiss | Model: SURFCOM 1500SD3 | |
| Tecan Infinite M200 pro | Tecan | fluorescence plate reader | |
| Triton X 100 | Calbiochem | 648466 | |
| Trypan Blue solution | Sigma-Aldrich | T8154-100ML | highly toxic |
| Trypsin/EDTA solution | PAN-Biotech | P10-023500 | 0.05% Trypsin, 0.02% EDTA in PBS |
| UV glue | Bohle | BO MV76002 | medium viscosity |
Referenzen
- Lloyd, A. W., Faragher, R. G. A., Denyer, S. P. Ocular biomaterials and implants. Biomaterials. 22, 769-785 (2001).
- Zhang, M., Wu, J., Wang, L., Xiao, K., Wen, W. A simple method for fabricating multi-layer PDMS structures for 3D microfluidic chips. Lab Chip. 10, 1199-1203 (2010).
- Kwak, M. K., Jeong, H. E., Suh, K. Y. Rational design and enhanced biocompatibility of a dry adhesive medical skin patch. Adv. Mater. 23, 3949-3953 (2011).
- Gun Park, D., Chul Shin, S., Won Kang, S., Tae Kim, Y. Development of flexible self adhesive patch for professional heat stress monitoring service. Conf. Proc. IEEE Eng. Med. Biol. Soc. 4, 3789-3792 (2005).
- Thomas, X. Silicone Adhesives in Healthcare Applications. Dow corning Lit. , (2013).
- Fuard, D., Tzvetkova-Chevolleau, T., Decossas, S., Tracqui, P., Schiavone, P. Optimization of poly-di-methyl-siloxane (PDMS) substrates for studying cellular adhesion and motility. Microelectron. Eng. 85, 1289-1293 (2008).
- Wang, Z., Volinsky, A. A., Gallant, N. D. Crosslinking effect on polydimethylsiloxane elastic modulus measured by custom-built compression instrument. J. Appl. Polym. Sci. 131, 41050 (2014).
- Fischer, S. C. L., Kruttwig, K., Bandmann, V., Hensel, R., Arzt, E. Adhesion and cellular compatibility of silicone-based skin adhesives. Macromol. Mater. Eng. , 1-11 (2017).
- Martina, D., Creton, C., Damman, P., Jeusette, M., Lindner, A. Adhesion of soft viscoelastic adhesives on periodic rough surfaces. Soft Matter. 8, 5350-5357 (2012).
- Brown, X. Q., Ookawa, K., Wong, J. Y. Evaluation of polydimethylsiloxane scaffolds with physiologically-relevant elastic moduli: Interplay of substrate mechanics and surface chemistry effects on vascular smooth muscle cell response. Biomaterials. 26, 3123-3129 (2005).
- Song, F., Ren, D. Stiffness of cross-linked poly(dimethylsiloxane) affects bacterial adhesion and antibiotic susceptibility of attached cells. Langmuir. 30, 10354-10362 (2014).
- Buxboim, A., Rajagopal, K., Brown, A. E. X., Discher, D. E. How deeply cells feel: methods for thin gels. J. Phys. Condens. Matter. 22, 194116 (2010).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix Elasticity Directs Stem Cell Lineage Specification. Cell. 126, 677-689 (2006).
- Roth, J., et al. Surface functionalization of silicone rubber for permanent adhesion improvement. Langmuir. 24, 12603-12611 (2008).
- Thiébaud, P., Lauer, L., Knoll, W., Offenhäusser, A. PDMS device for patterned application of microfluids to neuronal cells arranged by microcontact printing. Biosens. Bioelectron. 17, 87-93 (2002).
- Tourovskaia, A., Figueroa-Masot, X., Folch, A. Differentiation-on-a-chip: a microfluidic platform for long-term cell culture studies. Lab Chip. 5, 14-19 (2005).
- Peterson, S. L., McDonald, A., Gourley, P. L., Sasaki, D. Y. Poly(dimethylsiloxane) thin films as biocompatible coatings for microfluidic devices: Cell culture and flow studies with glial cells. J. Biomed. Mater. Res. - Part A. 72, 10-18 (2005).
- Wan, Y., et al. Nanotextured substrates with immobilized aptamers for cancer cell isolation and cytology. Cancer. 118, 1145-1154 (2012).
- Ross, A. M., Jiang, Z., Bastmeyer, M., Lahann, J. Physical aspects of cell culture substrates: Topography, roughness, and elasticity. Small. 8, 336-355 (2012).
- Barreau, V., et al. Fibrillar Elastomeric Micropatterns Create Tunable Adhesion Even to Rough Surfaces. Adv. Funct. Mater. 26, 4687-4694 (2016).
- Briggs, G. A. D., Briscoe, B. J. The effect of surface topography on the adhesion of elastic solids. J. Phys. D. Appl. Phys. 10, 2453-2466 (1977).
- Dapp, W. B., Lücke, A., Persson, B. N. J., Müser, M. H. Self-affine elastic contacts: Percolation and leakage. Phys. Rev. Lett. 108, 1-4 (2012).
- Putignano, C., Carbone, G., Dini, D. Mechanics of rough contacts in elastic and viscoelastic thin layers. Int. J. Solids Struct. 69, 507-517 (2015).
- Laulicht, B., Langer, R., Karp, J. M. Quick-release medical tape. Proc. Natl. Acad. Sci. 109, 18803-18808 (2012).
- Kim, T., Park, J., Sohn, J., Cho, D., Jeon, S. Bioinspired, Highly Stretchable, and Conductive Dry Adhesives Based on 1D-2D Hybrid Carbon Nanocomposites for All-in-One ECG Electrodes. ACS Nano. 10, 4770-4778 (2016).
- Adamietz, I. A., et al. Effect of self-adhesive, silicone-coated polyamide net dressing on irradiated human skin. Radiat. Oncol. Investig. 2, 277-282 (1994).
- White, R. Evidence for atraumatic soft silicone wound dressing use. Wounds UK. 1, 104-109 (2005).
- Quan, M. B., Edwards, C., Marks, R. Non-invasive in vivo techniques to differentiate photodamage and ageing in human skin. Acta Derm. Venereol. 77, 416-419 (1997).
- Brown, X. Q., Ookawa, K., Wong, J. Y. Evaluation of polydimethylsiloxane scaffolds with physiologically-relevant elastic moduli: Interplay of substrate mechanics and surface chemistry effects on vascular smooth muscle cell response. Biomaterials. 26, 3123-3129 (2005).
- Palchesko, R. N., Zhang, L., Sun, Y., Feinberg, A. W. Development of Polydimethylsiloxane Substrates with Tunable Elastic Modulus to Study Cell Mechanobiology in Muscle and Nerve. PLoS One. 7, e51499 (2012).
- Johnston, I. D., McCluskey, D. K., Tan, C. K. L., Tracey, M. C. Mechanical characterization of bulk Sylgard 184 for microfluidics and microengineering. J. Micromechanics Microengineering. 24, 35017 (2014).
- Persson, B. N. J., Gorb, S. The effect of surface roughness on the adhesion of elastic plates with application to biological systems. J. Chem. Phys. 119, 11437 (2003).
- Peressadko, A. G., Hosoda, N., Persson, B. N. J. Influence of surface roughness on adhesion between elastic bodies. Phys. Rev. Lett. 95, 1-4 (2005).
- Purtov, J., et al. Measuring of the hardly measurable: adhesion properties of anti-adhesive surfaces. Appl Phys A. 111, 183-189 (2013).
- Kroner, E., Blau, J., Arzt, E. Note: An adhesion measurement setup for bioinspired fibrillar surfaces using flat probes. Rev. Sci. Instrum. 83, 16101 (2012).
- Sun, S., Li, M., Liu, A. A review on mechanical properties of pressure sensitive adhesives. Int. J. Adhes. Adhes. 41, 98-106 (2013).
- Webber, R. E., Shull, K. R., Roos, A., Creton, C. Effects of geometric confinement on the adhesive debonding of soft elastic solids. Phys. Rev. E. 68, 21805 (2003).
- Creton, C., Lakrout, H. Micromechanics of flat-probe adhesion tests of soft viscoelastic polymer films. J. Polym. Sci. Part B Polym. Phys. 38, 965-979 (2000).
- Tan, S. H., Nguyen, N. -. T., Chua, Y. C., Kang, T. G. Oxygen plasma treatment for reducing hydrophobicity of a sealed polydimethylsiloxane microchannel. Biomicrofluidics. 4, 32204 (2010).
- Kim, B., Peterson, E. T. K., Papautsky, I. Long-term stability of plasma oxidized PDMS surfaces. Conf. Proc. IEEE Eng. Med. Biol. Soc. 7, 5013-5016 (2004).
- Briganti, E., et al. Silicone based polyurethane materials: A promising biocompatible elastomeric formulation for cardiovascular applications. J. Mater. Sci. Mater. Med. 17, 259-266 (2006).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9, 2132 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten