Method Article
Fina película composta de silício elastômeros para aplicações de pele e cultura de pilha: fabricação e caracterização
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
É apresentado um protocolo para o processo de fabricação de estruturas de compósitos poliméricos de película fina possuindo Young diferente módulos ou espessuras. Filmes são produzidos para estudos de cultura celular avançado ou como adesivos de pele.
Resumo
Neste protocolo, apresentamos métodos para fabricar filmes composto de elastômero fino para aplicações de cultura celular avançado e para o desenvolvimento de adesivos de pele. Dois-(dimethyl siloxanes) diferentes poli (PDMS e adesivo de pele macia (SSA)), têm sido utilizados numa investigação de profundidade de efeitos biológicos e características adesivas. Os filmes compostos consistem de uma camada de revestimento protetor flexível e um revestimento adesivo superior. Ambas as camadas foram fabricadas pela técnica de aplicação de lâmina de doutor. No presente inquérito, o comportamento adesivo dos filmes compostos foi investigado como uma função da espessura da camada ou uma variação do módulo de Young de camada superior. O módulo de Young de PDMS foi alterado, variando a base para a relação de mistura crosslinker. Além disso, a espessura dos filmes de SSA tem variada de aproximadamente 16 µm para aproximadamente 320 µm. Scanning microscopia eletrônica de varredura (MEV) e microscopia óptica foram usados para as medições de espessura. As propriedades adesivas de filmes de elastômero dependem fortemente a espessura da película, o módulo de Young dos polímeros e características de superfície. Portanto, foi investigada aderência normal desses filmes em substratos de vidro exibindo superfícies lisas e ásperas. Puxe-fora o stress e o trabalho de separação dependem da relação de mistura de elastômeros de silicone.
Além disso, a espessura de pele macia adesivo colocado no topo de uma camada de apoio solidário tem sido variada para produzir patches para aplicações de pele. Citotoxicidade, a proliferação e a adesão celular de fibroblastos de murino L929 em filmes PDMS (relação 10:1 de mistura) e SSA (mistura proporção 50: 50) foram realizados. Nós temos mostrado aqui, pela primeira vez, a comparação lado a lado de filmes finos de compósitos fabricados de ambos os polímeros e apresentar a investigação das suas propriedades biológicas - e adesivo.
Introdução
Neste protocolo, são apresentados métodos detalhados para fabricação de filmes finos elastômero. A técnica de lâmina de doutor amplamente disponível tem sido usada para a produção de filmes finos compostos. A técnica de fabricação foi realizada em folhas de polyethylenterephtalate (PET), permitindo a produção subsequente desses filmes em grande escala. A ênfase do presente protocolo é a avaliação da reprodutibilidade, precisa de fabricação as diferentes camadas de filmes de compostos e determinação das propriedades biológicas e aderência do patch do composto final. O poly-(dimethylsiloxane) de elastômero de silicone (PDMS) é usado extensivamente em tecnologia biomédica, incluindo a produção de adesivos de pele, aplicações de microfluídica e pesquisa adicional campos1,2,3 ,4. Recentemente, outra subclasse de PDMS, chamados adesivos de pele macia (SSAs) foram introduzidas, em especial para a pele delicada de ligação e de ligação.
SSAs do silicone são elastômeros de vinil acrescido, diferindo de polímeros análogos pela ausência de sílica5de reforço. Semelhante a do outros PDMS, SSA módulo de Young pode ser adaptado em uma ampla gama por modulação cross-linker concentração ou cura tempo6,7,8. Essa alteração no módulo de Young de elastómeros de silicone afeta as propriedades adesivas do material significativamente e tem também consequências profundas em células procarióticas e eucarióticas cultivadas na superfície9,10 , 11. a nível biológico celular, foi demonstrado, que células eucarióticas respondem ao nível de transdução de sinal para uma modulação da elasticidade a matriz ou a espessura da superfície9,10,12 ,13,14. Portanto, existe um amplo interesse em aplicações de cultura de células de polímeros com propriedades mecânicas ajustáveis. Importante, a energia de superfície intrinsecamente baixa de elastómeros de silicone com base não oferece condições ideais para cultura celular de células eucarióticas. Tratamento de plasma de oxigênio é uma técnica amplamente utilizada para aumentar o PDMS baixa energia de superfície temporariamente, levando a um aumento de sua resistência pull-off, diminuição da superfície adsorção das moléculas, enquanto paralelamente promover a penhora, espalhando e proliferação de células eucarióticas15,16,17,18.
Além das propriedades de materiais, a topografia da superfície afeta significativamente a adesão celular e a adesiva interação entre dois materiais19,20,21,22. Rugosidade da superfície tem vários efeitos sobre a formação de contato entre duas superfícies: redução da área de contato, alta armazenado energia elástica em torno de asperezas, bem como influência a propagação de rachadura pode alterar a força adesiva23, 24. Adesão de películas autocolantes a pele humana é um campo emergente de aplicativo, por exemplo, curativos, fixação de eletrodos de ECG ou outros dispositivos electrónicos wearable25,26,27, 28. Para medir o desempenho adesivo de autoadesivos em relação à topografia da superfície, substratos de vidro com diferentes graus de aspereza podem ser usados em medições de aderência normal8,21. Aqui, foram selecionados dois substratos de vidro para investigar as propriedades adesivas de filmes de polímero. Filmes de primeiras, compostos com uma camada de revestimento protetor de PDMS na proporção de mistura de partes de peso de 10 para 1 cobertas por PDMS com relação de mistura diferente foram caracterizados. Em um segundo passo uma camada adesiva de SSA foi preparada com quantidades de peso igual de ambos os componentes e com diferentes espessura de película em cima de um filme PDMS apoio.
Protocolo
Atenção: Por favor consulte todas as fichas de dados de segurança (MSDS) antes do uso. Alguns dos produtos químicos utilizados no presente protocolo são irritantes, agudamente tóxicos e/ou cancerígenos. Por favor, use todas as práticas de segurança adequadas ao manusear estes produtos químicos. Isto inclui o uso de engenharia (Gabinete de química) e pessoal equipamento de proteção (óculos de segurança, luvas, jaleco, calça comprida e sapatos fechados). Porções dos seguintes procedimentos envolvem a cultura de uma linhagem de células animais. Portanto, por favor, siga as normas de biossegurança específicas. Resíduos químicos e biológicos precisa ser descartado de acordo com as regras nacionais e institucionais específicas e recomendações.
1. preparação de estruturas compostas de silicone elastomérico de película fina
-
Preparação de polímeros
- Para preparar 1,1 g de PDMS na proporção de 10:1, misturar 1,0 g de um composto com 0,1 g do composto B.
- Mix e degase pré-polímeros em um misturador de velocidade a 2350 rpm sob vácuo por 3 min.
- Altere as proporções em massa entre A compostos e B composto de 45: 1 e 70:1. Prepará-los semelhantes ao método descrito em 1.1.2.
- Prepare-se 1 g do adesivo de pele macia (SSA) na proporção de 50: 50. Portanto, misture 0,5 g do composto A e 0,5 g de composto B conforme descrito em 1.1.2.
-
Preparação de-(vinyl alcohol) poli (PVA) revestido de folha de PET
- Preparar uma solução PVA de 18% (w/w) em água, adicionando o PVA com água desionizada e misturar durante a noite com um agitador magnético. Armazene esta solução a 4 ° C.
- Prepare filmes finos exibindo uma espessura efectiva de 15 µm com a máquina de aplicação de lâmina de doutor, usando 100 µm lacuna da lâmina e uma velocidade de aproximadamente 2,0 mm/s.
- Coloca os filmes em um forno a 95 ° C por 15 min.
-
Preparação da camada de revestimento protetor de PDMS 10 mistura: 1 pela técnica da lâmina de doutor
- Use uma máquina de aplicação de lâmina de médico controlado automaticamente para a preparação dos filmes finos.
- Limpar a folha de PET com 100% de isopropanol e coloque-o sobre a superfície da área de aplicação de lâmina de doutor.
- Coloque a lâmina na parte superior da folha e ajustar a espessura com o micro parafusos de posicionamento. Para a fabricação das camadas molhadas, aplica espessuras de 60 µm e 100 µm, 200 µm, 500 µm.
- Preencha o polímero de 10:1 PDMS preparado no passo 1.1 no reservatório da lâmina médico com uma seringa de utilização única. Inicie o movimento da lâmina com uma velocidade de aproximadamente 2,0 mm/s.
- Retire a película de PET com o revestimento aplicado de 10:1 da máquina e coloque-o no forno por 1h a 95 ° C, localizada em uma sala exibindo umidade entre 40% e 65%.
- Limpe a lâmina com toalhas de papel e isopropanol.
- Repita este procedimento para todas as espessuras necessárias.
-
Preparação da camada superior de PDMS em diferentes proporções de mistura pela técnica da lâmina de doutor
- Remova listras finas dos lados comprimento do filme subjacente com um bisturi ou lâmina de barbear para permitir a colocação e o deslizamento da lâmina médico na película de PET.
- Siga os passos do protocolo 1.3.3 para 1.3.6. Espessura úmida aplicada para o filme é 160 µm.
- Repita este procedimento para a produção de dois filmes independentes com outra relação de mistura dos componentes PDMS (45: 1 e 70:1). Armazene os filmes à temperatura ambiente (aprox. 22 ° C e em uma umidade entre 40% e 65%) em pratos de Petri quadrados para impedir a contaminação e poeira.
-
Preparação de filmes finos compostos, exibindo diferentes espessuras da camada de 50: 50 do SSA
- Prepare filmes PDMS 10:1 como uma camada de apoio, como descrito anteriormente na etapa 1.3.
- Siga os passos do protocolo 1.4.1 e 1.4.2 para produzir estes filmes. Usar SSA na proporção de mistura de 50: 50 e fabricar um filme com uma espessura molhada de 40 µm.
- Repita o procedimento para as espessuras úmidas adicionais de: 120 µm, 300 µm, 500 µm.
2. normal de adesão medições utilizando substratos com diferente rugosidade da superfície
-
Preparação e caracterização de substratos de vidro com diferente rugosidade da superfície
- Use um cilindro de vidro com 2 mm de diâmetro, como um substrato' suave'.
- Para fabricar o imposto especial de consumo de 'substrato duro' com um cortador de vidro um pedaço com a dimensão de cerca de 4 x 4 mm da placa de vidro fosco. Use uma almofada de mão diamante abrasivo para obter uma área circular de aproximadamente 3 mm de diâmetro.
- Anexar o vidro para um cone de alumínio com colagem UV e iluminá-lo na câmara de iluminação UV para 3 min.
- Determine o raio da superfície do substrato com microscópio óptico. Calcular a área de acordo com a fórmula A = πr2.
- Determinar a rugosidade parâmetro Rum e Rz (de acordo com: DIN EN ISO 4287, ASME B46.1) com um caneta perfilômetro.
- Apor o substrato no palco do perfilômetro amostra e ponha a ponta (diamante, padrão: 2 µm/60 °) em contacto com a amostra.
- Registre o perfil de rugosidade com uma velocidade de 0,3 mm/s e um comprimento de 1 mm.
- Para analisar a topografia da superfície, medir uma área de exatamente 1 mm2 com um estilete perfilômetro, operado pelo software associado.
Nota: O perfilômetro é operado por um computador externo. O titular é deslocado por 0,001 mm na direção y, após um deslocamento de 1 mm é atingido em x direção. O gravado. RS3 arquivo é importado no Surfcom mapa Expert Software para criar imagens em 3D.
-
Medição de aderência normal de filmes finos fabricados de PDMS ou SSA
- Use uma lâmina de barbear para cortar os filmes sobre a folha de PET em pequenos pedaços com uma área de cerca de 4,0 cm2 e lugá-los em um vidro deslize com colagem UV. Ilumine com UV luz por 3 min.
- Monte a amostra polimérica no porta-amostra.
- Limpe o substrato de superfície suavemente com etanol e seco com gás nitrogênio.
- Anexe o substrato de vidro, montado para o cone de alumínio, para a célula de carga.
- Use a tabela inclinável (goniômetro) para alinhar as superfícies precisamente ajustando o ângulo de inclinação do substrato se aproximando do filme polimérico. Para fazer isso, trazer o substrato manualmente em contacto com o filme. Mude o ângulo de inclinação até um alinhamento totalmente paralelo de ambas as superfícies para o outro, visualizadas com as imagens de câmeras, é obtido.
Nota: A célula de carga é conectada à mesa inclinável. Um prisma de vidro está localizado abaixo da amostra conforme mostrado na Figura 4, permitindo a visualização da área de contato com duas câmeras e o alinhamento do substrato do filme de polímero. - Mova o substrato para a superfície de película polimérica até um stress pré-carga de 13 ± 5 kPa é alcançado (Figura 4).
- Inicie o pacote de software programado personalizado escrito em LabView para controlar que os parâmetros de medição necessários tais como segurar a velocidade do tempo e abordagem/retração. O tempo espera tsegurar é 1 segundo, a abordagem e a velocidade de desprendimento é 30 µm/s e 10 µm/s respectivamente.
- Realize medições de adesão em três amostras independentes de manufaturados e em seis locais diferentes em cada superfície do filme.
-
Análise de dados e cálculo dos factores-chave mecânicas: puxe-fora o stress e o trabalho de separação.
- Calcular o estresse
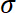 dividindo o gravado força pela área de substrato umS.
dividindo o gravado força pela área de substrato umS.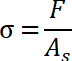
- Determine o stress pull-off, que é descrito como o valor máximo da tensão normal.
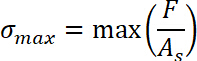
- Obter o Δs de deslocamento por subtração da posição inicial do regime elásticos0 da amostra s posiçãofinal onde a ligação foi concluída. Definir o início do regime elástico como s0 = 0.
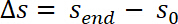
- Corrigi os valores medidos da posição da amostra, a conformidade do sistema C de acordo com a seguinte equação:
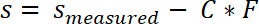
- Integre a curva do stress-deslocamento entre s0 e sfim a fim de calcular o trabalho de separação.

- Calcular o estresse
-
Cálculo dos fatores-chave mecânicas usando software de computação matemática origem.
- Importe o arquivo. dat gravado de uma medida única de adesão em uma tabela de origem. Os parâmetros que são registrados são tempo, posição de amostra e força. Inserir esses parâmetros nas colunas A (tempo), B (posição de amostra) e C (força).
- Para determinar o valor em branco, cerca de 20 medição, os valores médios da força antes de entrar em contato com o filme de polímero. Nomeie esse valor médio Fdeslocamento e colá-lo na coluna D.
- Calcular o fundo força F * de acordo com a seguinte equação

e inserir esta equação, como mostrado abaixo, na coluna E.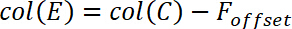
- Definir o início do regime elástico como zero deslocamento, ou seja, s0 = 0. Portanto, determinar s0 e ele subtrair o deslocamento na coluna B e salve-o na coluna f:
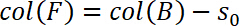
- Além disso, corrigi a posição da amostra a conformidade da máquina. Esta correção é realizada na coluna G. Insert a seguinte equação na coluna G
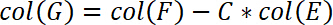
- Calcular o estresse na próxima coluna H. Portanto, divida a força pela área de substrato. Inserir a seguinte equação
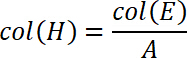
onde A é a área da superfície dos substratos de vidro em mm2 (determinado no ponto 2.1). - Calcule o trabalho de separação dos valores estresse e deslocamento. Portanto, traça o deslocamento ao longo do eixo x e o estresse ao longo do eixo y. Integre este gráfico de s0 sfinal onde sfinal é definido como o deslocamento em que stress tênsil retorna para zero, ou seja, o completo desapego teve lugar. Para integrar o gráfico, escolha a função de integrar. Adicionar os valores calculados nas colunas I e J.
3. caracterização dos filmes de varredura, microscopia eletrônica de varredura (MEV) e microscopia óptica
-
Microscopia óptica
- Com uma lâmina de barbear, cortar o filme polimérico em pedaços pequenos (aproximadamente 0,25 cm2) e anexá-los à borda de uma lâmina de vidro. A lâmina de vidro verticalmente orientado sob um microscópio vertical e medir a espessura da secção transversal do filme.
Nota: Use um objectivo X 20 (at = 0,45, resolução teórica em 800 nm de 1.1 µm) para medir valores de espessura de filme de aprox ≤ 20 µm. Para um filme de espessura na faixa de 20 µm até 50 µm usar um objectivo X 10 (at = 0,30, resolução teórica em 800 nm de 1,6 µm) e para um filme de espessura ≥ 50 µm usar um objectivo X 5 (at = 0,15, resolução teórica em 800 nm de 3,3 µm).
- Com uma lâmina de barbear, cortar o filme polimérico em pedaços pequenos (aproximadamente 0,25 cm2) e anexá-los à borda de uma lâmina de vidro. A lâmina de vidro verticalmente orientado sob um microscópio vertical e medir a espessura da secção transversal do filme.
-
Investigação SEM
- Cortar a folha de PET e anexar uma amostra de aproximadamente 2 cm2 para uma lâmina de vidro e coloque-o na vertical para o mecanismo de fixação dentro do amostra titular ≤ 2 mm abaixo da superfície superior do titular.
- Selecione uma tensão de aceleração de 10 kV, o detector de elétrons retroespalhados (BSD) e baixas condições de vácuo (60 Pa).
- Ajuste o foco, ampliação, brilho e contraste das imagens.
- Escolher um tempo de aquisição de imagem de 28 s com uma resolução de 1024 x 2048 pixels.
- Retire o porta-amostras do SEM.
4. biológica investigação
- Células de cultura de L929 rotina celular
- Use a linha de celular de murino fibroblastos L929 para investigação. Cultura de células em meio basal Rosewell Park Memorial Institute (RPMI) 1640, suplementado com 10% de soro fetal bovino e estreptomicina und de penicilina a 37 ° C, 5% de CO2 em T75 frascos de cultura de células. Passagem das células em uma confluência de cerca de 70% a 80%.
- Para passagem de célula, remover o meio por aspiração e lave com cálcio e magnésio livre tampão fosfato (DPBS- / -) para 30 s sob um fluxo laminar. Depois disso, Incube as celulas com 2 mL de Accutase, uma solução de enzima com proteolíticas e atividade collagenolytic para até 5 min. a 37 ° C, 5% de CO2.
- Verificar o desprendimento das células da superfície celular de frasco de cultura com um microscópio de contraste de fase.
- Adicione 8 mL de soro contendo médio no balão e transferência da suspensão de células para um tubo de reação de 15 mL.
- Tomar uma amostra de 10 µ l da suspensão de células e misturar com 10 µ l de Trypan azul.
- Determinar o número de celular com uma câmara de Neubauer e calcular o número total de células.
Cuidado: Azul Trypan é tóxico, portanto consultoria o MSDS, seguindo os procedimentos obrigatórios descritos o MSDS, vestindo-se de proteção de segurança pessoal apropriado e manipulação sob um armário químico são necessária. Recolha resíduos destinados a deposição de resíduos químico.
Nota: Células positivas Trypan azul são de cor azuis, indicando as membranas celulares não-intacta. - Para a próxima passagem, células de cultura 5 x 105 em um frasco de cultura nova célula estéril com 10 mL de meio de novo. Para condições experimentais, cultura 3 x 105 células bem 6 placas e 6 x 104 células em cada poço da placa bem 24, contendo amostras de polímeros (etapa de protocolo 4.2).
- Elaboração de filmes compostos de experiências de cultura de pilha.
- Peças avulsas de impostos especiais de consumo dos filmes das dimensões desejadas, fabricadas na etapa de protocolo 1.4 e 1.5 da camada de apoio de PET com um bisturi e um lugar com uma pinça para a superfície de lamínulas de vidro, exibindo um diâmetro de 12 mm. colocar as amostras em poços de um 2 4 placa de bem.
- Para determinação de citotoxicidade e contagem de células, não remova os filmes da película de PET. Recortar áreas circulares de aproximadamente 9,4 cm2, caber ordenadamente em único poços de uma placa bem 6, dos filmes produzidos em 1.4 e 1.5 e colocá-los em poços de uma placa de cultura de células.
- Mergulhe as amostras de polímero em desionizada H2O para ≥ 30 min.
Nota: As amostras poliméricas podem ser esterilizadas em autoclave. Portanto, remova todas as amostras contendo polímero os pratos de cultura celular e colocá-las dentro de um prato de Petri de vidro. Esterilização é realizada em autoclave 2.05 bar por 20 min em uma temperatura de 121 ° C.
- Tratamento de plasma de polímeros
- Coloque os filmes que estão anexados na folha de PET ou de vidro redonda lamínulas (fabricadas em 4.2.1) dentro da câmara de reação do dispositivo plasma.
- Feche a tampa e evacuar até atingir uma pressão de 1,6 x 10-2 mbar.
- Realize o tratamento de plasma por 3 min.
- Ventilar a câmara de reação e colocar as amostras em 24 bem ou 6 pratos bem para investigações de cultura celular.
- Use uma amostra para determinação do ângulo de contato de água com um goniômetro. Portanto, mover a seringa perto da superfície polimérica, usando o pacote de software e coloque uma gota de 3 µ l água sobre a superfície. Calcule o ângulo de contato de água estático com o software do goniômetro.
- Microscopia e coloração
- Prepare células conforme descrito na etapa 4.1.7 e cultura para 3-d em 37 ° C e 5% de CO2.
- Capturar imagens de contraste de fase de células cultivadas durante três dias na intocada- e plasma tratados filmes pouco antes da fixação.
- Preparar o PBS suplementado com 0,2% Triton X-100. Lentamente, pipete 200 µ l da solução estoque para 100 mL de PBS (PBS-T).
- Prepare uma solução de paraformaldeído/PBS de 4% (PFA/PBS-T).
Cuidado: Paraformaldehyde é tóxico, portanto consultoria o MSDS, seguindo os procedimentos obrigatórios descritos o MSDS e vestindo de proteção de segurança pessoal apropriado e manipulação sob um armário químico é necessária. - Prepare uma solução a 5% BSA/PBS-T.
- Remova o meio por aspiração sob o fluxo da lâmina do armário. Adicione PBS nos poços para remover resíduos de médio.
- A placa de transferência para um gabinete de químico e substituir PBS com 400 µ l da solução de PFA/PBS por 25 minutos em temperatura ambiente.
- Remova a solução PFA/PBS dos poços simples, Lave cuidadosamente com PBS quatro vezes. Espere 3 minutos entre cada etapa de lavagem e coletar as soluções para a eliminação de resíduos química. Utilize a placa diretamente, ou armazená-lo em 4 ° C.
- Adicionar 5% albumina de soro bovino (BSA) / PBS-T aos poços e incubar por 60 min em RT para bloquear sites de ligação inespecíficos.
- Aspirar a solução e substituí-lo com uma faloidina conjugada com Alexa-488 (diluição 1:160) / solução de PBS-T suplementado com 0,2% Triton X-100.
Cuidado: Faloidina-488 é tóxico, portanto consultoria o MSDS, seguindo os procedimentos obrigatórios descritos o MSDS e vestindo de proteção de segurança pessoal apropriado e manipulação em um gabinete de químico é necessária. - Cubra o prato com papel alumínio e incube-3h no RT ou overnight a 4 ° C.
- Aspirar a solução e lavar três vezes com PBS. Espere 3 minutos entre cada etapa de lavagem. Recolha as soluções para a eliminação de resíduos química.
- Preparar uma solução de 1 µ l de corante Hoechst 33342 (solução de 1 mg/mL). Para uma diluição de 1: 1000 pipeta 1 µ l de Hoechst tingir 3334 para 1 mL de PBS-T e misture bem. Adicionar 300 µ l da solução corante Hoechst 33342 aos poços e incubar durante 10 minutos a RT no escuro.
Cuidado: Corante Hoechst 33342 é um reagente intercalante de DNA e, portanto, potencialmente mutagénicas, consultoria, portanto, o MSDS, seguindo os procedimentos obrigatórios descritos no MSDS e vestindo de proteção de segurança pessoal apropriado e manipulação sob uma Gabinete de química é necessária. - Aspirar a solução e lavar as amostras quatro vezes com PBS. Espere 3 min entre cada etapa de lavagem. Recolha a solução para a eliminação de resíduos química.
- Para a incorporação, cuidadosamente para eliminar os filmes da cultura e colocá-los em uma lâmina de vidro de microscópio. Adicionar 20 a 40 µ l de meio de encastre solúvel em água para o filme e anexar um novo deslizamento da tampa vidro circular por cima aplicando uma ligeira pressão.
- Execute a imagem com um microscópio de fluorescência. Filtros necessários para a iluminação: Alexa 488 tem um máximo de excitação em 496 nm e máximo de emissão ocorre em 519 nm. Portanto, a emissão de cor é o verde. Hoechst 33342 de tintura trihydrochlorid trihydrate complexado com DNA tem uma excitação máxima a 355 nm e máxima emissão de complexo de DNA ocorre em 465 nm.
- Determinação de citotoxicidade e determinação do número de células
- Realizar o experimento com células cultivadas nas 6 pratos bem preparados na etapa 4.3 e as células preparadas na etapa 4.1.7. Cultura das células durante 3 dias a 37 ° C e 5% de CO2. Para o controlo positivo, use células que foram cultivadas em uma superfície de poliestireno cultura tratada célula, não contendo nenhum filmes poliméricos. Para determinação de plano de fundo (condição negativa), obter o meio de um poço sem células.
Nota: Médio também será recolhido as células contendo bem cultivadas na superfície celular cultura tratada poliestireno. - De acordo com o número de tubos de 15 mL de rótulo de amostras experimentais.
- Adicionar 40 µ l de uma solução de PBS contendo 0,9% Triton X-100 para o controle positivo e misture vigorosamente com ponta 1000 µ l. Espere cerca de 3 min.
- Sem remover as células ligadas à superfície, Aspire o meio de todas as amostras, incluindo amostras preparadas em 4.5.3 e transferir o meio para os tubos de 15 mL. Adicionar 3 mL de DPBS- / - os único poços e armazenar as placas sob o fluxo laminar para determinação do número celular conforme descrito em 4.5.9.
- Centrifugar a 200 x g durante 3 minutos e retire 1 mL do sobrenadante para a determinação de atividade LDH. Armazene os tubos de 15 mL contendo células e restantes médio sob o fluxo laminar.
- Para o ensaio são utilizados um preto 96 placas bem com fundo plano. Adicionar 50 µ l de reagente CytoTox-um de 50 µ l de amostra médio e misture bem por 30 s.
- Cubra o prato com papel alumínio e armazenar durante 10 minutos a RT
- Adicione 25 µ l da solução de paragem em cada poço e gravar a intensidade de fluorescência com um leitor de placa de fluorescência. Agitar a placa por 10 s e detectar o sinal de fluorescência com um comprimento de onda de excitação de 520 nm e um comprimento de onda de emissão de 560 nm. Evite bolhas de ar.
- Para determinação do aspirado de número de célula DPBS- / - dos poços da placa de cultura de protocolo passo 4.5.4 e adicionar as soluções para os tubos de reação de 15 mL contendo os sobrenadantes coletados em número de protocolo passo 4.5.5.
- Centrifugar o tubo de reação de 15 mL em 200 x g durante 3 minutos e aspire o sobrenadante. Adicionar 0,5 mL de tripsina/EDTA e incubar durante 10 minutos a 37 ° C.
- Adicionar 2 mL de tripsina/EDTA aos poços da placa e incubar durante cerca de 10 min a 37 ° C para separar as células dos filmes poliméricos.
- A suspensão de células é transferida para o tubo de reação de 15 mL do passo número 4.6.10. Além disso, lave vigorosamente as placas com soro contendo meio.
- Centrifugar as amostras a 200 x g, durante 3 min, aspirar o sobrenadante e adicionar soro contendo meio ao tubo.
- Determine o número de celular conforme descrito nas etapas 4.1.5 e 4.1.6.
- Realizar o experimento com células cultivadas nas 6 pratos bem preparados na etapa 4.3 e as células preparadas na etapa 4.1.7. Cultura das células durante 3 dias a 37 ° C e 5% de CO2. Para o controlo positivo, use células que foram cultivadas em uma superfície de poliestireno cultura tratada célula, não contendo nenhum filmes poliméricos. Para determinação de plano de fundo (condição negativa), obter o meio de um poço sem células.
Resultados
Nos primeiros experimentos, filmes PDMS com diferentes de espessura e constante relação de 10:1 de mistura foram fabricados em filmes PET (Figura 1). Porque a espessura da camada de revestimento protetor pode influenciar significativamente a rigidez e manipular as propriedades dos filmes de todo compostos, nos experimentos iniciais único filmes entre 13 ± 2 µm e 296 ± 13 µm foram fabricados (Figura 1). É bem conhecido, que durante o encolhimento de processo cura dos filmes de polímero ocorre. Para os filmes mais finos, observamos uma diferença de 78% ± 3,1% entre condições húmidas e curadas. Para os filmes mais espessos, encolhimento de 40,9% ± 2,6% foi detectada (Figura 1).
Para as aplicações apresentadas neste protocolo, filmes precisam ser removido manualmente da folha de PET. Reconhecemos que filmes especialmente finos são difíceis de lidar com a pinça e muitas vezes são destruídos durante este processo. Portanto, nós investigamos a influência de um fino poli (álcool vinílico) revestimento como uma camada de apoia. PVA possui uma elevada rigidez e pode ser facilmente removido devido a sua solubilidade em água em aplicações a jusante. O revestimento de PVA aplicado tem uma espessura de aproximadamente 17 µm e, portanto, filmes PDMS revestidos em cima desta camada são ligeiramente mais fino comparados a filmes sem o revestimento de PVA (dados não mostrados). Especialmente focando as propriedades de manipulação, concluímos, que só o filme mais fino requer um apoio filme PVA para a remoção da película de PET.
De espessura de filme eficaz de cerca de 40 µm foi selecionada para tudo mais experiências. Para a produção de filmes de compostos, a relação de mistura de PDMS foi variou de 10:1 a 45: 1 e a 70:1 e aplicada em cima do filme PDMS anteriormente polimerizado com a técnica de lâmina de doutor (Figura 2A). Com excepção a proporção de 10:1, os filmes diferentes poderiam ser claramente distinguidos por microscopia óptica com a precisão adequada. Para a análise microscópica dos filmes foram cortados com um bisturi e anexados à borda de uma lâmina de vidro. As percentagens mais elevadas de mistura de camada superior apareceram visualmente mais brilhantes nas imagens microscópicas em comparação com a proporção de 10:1 da camada de revestimento protetor (Figura 2B). Além disso, a microscopia eletrônica foi usado para imagem amostras em uma ampliação de cerca de 860 X (Figura 2). Uma diferença claramente observável de brilho entre os dois filmes PDMS, fabricado em percentagens mais elevadas de mistura foi reconhecida, em contraste com a proporção de 10:1. O procedimento de corte deixa marcas, visíveis nas fotos SEM (Figura 2B). Com base nestes resultados, a espessura média geral dos filmes compostos foi 112 µm ± 5,0 µm (Figura 2D).
Em experimentos mais as propriedades de adesão desses filmes foram determinadas com medições de adesão de força normal usando dois substratos de vidro diferentes (Figura 3). O substrato' suave' possui uma superfície de textura com uma rugosidade média aritmética Rum de 0,013 ± 0,0002 µm e uma média de pico-a-vale Rz de 0,12 ± 0,004 µm (Figura 3A). Carcaça 2 (GS2, designado como bruto) exibiram valores de rugosidade de 0,338 ± 0.021 (Rum) µm e 2.055 ± 0,017 µm (Rz) (Figura 3B). Com a média foi calculado raio Obtido em 2.1.4 que a área da superfície do substrato 'suave' foi 3,2 mm2 , enquanto para o substrato 'bruto', uma área de 6,07 mm2 .
Com estes dois substratos, determinou-se o comportamento adesivo dos filmes diferentes. Dois parâmetros são escolhidos para descrever as propriedades adesivas dos filmes: o pull-off stress σmáx e o trabalho de separação Wsep. Durante todo o processo de ligação e de ligação a posição de amostra s e a força normal F são registrados. Os resultados são representados em uma curva de estresse-deslocamento (Figura 4).
Para a correta interpretação dos resultados experimentais, é de importância para alinhar com precisão o substrato para a superfície da película polimérica. Também, a conformidade da máquina do dispositivo de medição deve ser considerado para corrigir o deslocamento. Durante a medição da força aplicada age não apenas sobre a amostra, mas também em outras partes do dispositivo de teste. Portanto, cada um dos dois substratos é pressionado contra uma lâmina de vidro com uma tensão de compressão de 13 ± 5 kPa. Para medir a conformidade, a curva de carga é levada em conta, ou seja, a parte da curva de força-deslocamento onde duas superfícies entram em contato até a posição de amostra, onde a força exata de pré-carga é alcançada. A recíproca inclinação da curva é igual à conformidade da máquina C. O valor calculado para C é 0.12 µm/mN.
No primeiro experimento, analisaram-se filmes com diferentes proporções de mistura de PDMS (Figura 5). Para os filmes de compósitos, a espessura e a relação de mistura da camada de revestimento protetor, fabricada de PDMS 10:1 foi mantida constante. A espessura da camada superior também foi mantida constante com um valor de 65 µm. O estresse de tração maior de 109 ± 27,6 kPa foi determinado com o substrato de vidro liso sobre o filme de 10:1 PDMS (Figura 5A). Aumento do rácio da misturando leva a uma diminuição do stress pull-off para 76.7 ± 17 kPa para 45: 1 relação de mistura e 41,4 ± 17 kPa para a relação de 70:1. Com o stress de substrato um pull-off de vidro bruto de 22 ± 2.2 kPa foi determinado, para o filme de 10:1 do PDMS. Em geral, o trabalho de separação foi comparável entre ambos os substratos de vidro, por exemplo., 1,4 ± 0,6 J/m2 no filme mais fino obtido com o substrato liso e 1,84 ± 0,7 J/m2 no filme mais fino obtido com o substrato duro ( Figura 5B).
Em seguida, a produção de filmes finos para aplicações de pele e de cultura celular de aplicações têm sido exploradas (Figura 6). 50: 50 do SSA tem sido utilizado para a produção de camada superior dos filmes compostos. PDMS em um 01:10 relação de mistura com uma espessura de cerca de 40 µm tem sido usada como uma camada de revestimento protetor. Em contraste com as experiências anteriores, representadas na Figura 5, a espessura da camada superior era variada, enquanto a relação de mistura foi mantida constante (figura 6A). SSA foi selecionado por causa de suas propriedades adesivas em aplicações que envolvem acessório às superfícies com elevada rugosidade da superfície, especialmente a pele humana, usando a recomendação de fabricantes da mistura proporção 50: 505,8. Epiderme humana possui uma elevada rugosidade da superfície. Dependendo da idade e anatômicas região que uma profundidade média rugosidade da superfície (RZ) entre 48 µm e 71 µm tem sido relatado29. Adesão de seguro e suave da pele é importante, particularidade para a pele sensível dos neonatos ou mal regenerando a pele dos idosos. Foram aplicadas diferentes espessuras molhadas variando de 40 µm, 120 µm, 300 µm a 500 µm (figura 6A). Dependendo da espessura molhada, a espessura total dos filmes compostos varia entre 51 µm e 344 µm (Figura 6B). Após a cura, o compósito foram anexados na parte de trás da mão do voluntário (Figura 6). As espessuras diferentes filmes mostram claramente as diferenças em suas propriedades de adaptação para a aspereza da pele (Figura 6). Filmes finos (50 µm e 100 µm espessura total) exibem uma taxa elevada de adaptação para as rugas da pele em comparação com os filmes mais grossos (220 µm e espessura total de 340 µm). Estes resultados indicam que compostos filmes com uma ampla gama de espessuras podem ser produzidos precisamente com a técnica de lâmina de doutor aplicada.
Foram realizados experimentos de aderência com estes filmes compostos (Figura 7). Dependendo da espessura do filme top SSA, observamos uma diminuição do stress pull-off, com aumento de espessura de película. A maior força de 133 ± 36,6 kPa foi medida no substrato liso (Figura 7A). O mais baixo puxe-fora-stress de 18 ± 4 kPa foi obtido com o substrato duro na película mais grossa. Curiosamente, uma comparação entre ambos os substratos revela uma diferença de 2,7 vezes nas películas mais finas (Figura 7A). Com espessura de película crescente, especialmente nos filmes mais espessos nenhuma diferença notável era observável (Figura 7A). Com o substrato liso um trabalho de separação de 1,8 ± 0,8 J/m2 foi detectado no filme exibindo uma espessura total de aproximadamente 100 µm, seguido de um decréscimo de dependentes de espessura de filme (220 µm de espessura: 1,6 ± 0,6 J/m2 e 330 µm: 1,3 ± 0,4 J/m2 (Figura 7B)). O trabalho de separação medido com os substratos difíceis em geral foi ligeiramente mais baixo comparado ao substrato liso (100 µm de espessura: 1,63 ± 0,6 J/m2; 220 µm de espessura: 1,1 ± 0,6 J/m2 e 330 µm: 1,0 ± 0,2 J/m2 (Figura 7B )).
Além disso, o mecanismo de desprendimento foi gravado durante as medições (Figura 7). Observou-se uma pequena cavitação no filme mais fino, enquanto a aparência do dedo como rachaduras era observável nas películas mais espessas (Figura 7).
As medidas foram executadas dentro de um mês após a fabricação dos filmes. No entanto, estabilidade e preservação das propriedades mecânicas dos filmes elásticos podem ser afetados por fatores ambientais, incluindo a temperatura e umidade. Conforme descrito na etapa de protocolo 1.4.3, os filmes foram armazenados a temperatura e uma humidade de 40-65%. Para evitar-lhes de contaminação e poeira, os filmes foram armazenados em placas de Petri plástico no escuro. Para investigar a estabilidade a longo prazo, a medições de adesão e a determinação de espessura de SSA 50: 50 filmes foram realizados cerca de quatro meses após a fabricação. Sem grande influência sobre a espessura da película, puxe-fora o stress e trabalho de separação foi detectada após o armazenamento. Por exemplo, o stress de pull-off dos filmes SSA compostos fabricado com uma espessura molhada de 120 µm SSA e uma espessura molhada de 100 µm PDMS foi 46.6 ± 6 kPa e o trabalho de separação 1627 ± 592 mJ/m2 após a fabricação. Aproximadamente quatro meses após a fabricação, foi determinados um stress de pull-off de 48.8 ± 5,4 kPa e um trabalho de separação de 1666 ± 723 mJ/m2 . Além disso, logo após a fabricação, a espessura total desses filmes foi 103,3 ± 13,9 µm e depois armazenamento 98,1 ± 9,1 µm.
Em experimentos mais PDMS 10:1 e filmes compostos de SSA 50: 50 com uma espessura total de cerca de 105 µm têm sido utilizados como substratos de cultura (Figura 8) da pilha. Filmes compostos fabricados em número de protocolo passo 1 podem ser facilmente removidos da película de PET e cortar nas dimensões exigidas e formas geométricas. Além disso, quando aderindo os filmes para uma rígida superfície, para o vidro do exemplo, vários filmes mostrando o módulo de Young diferentes podem ser anexados ao lado e podem ser colocados dentro de um único poço de uma placa de cultura de células. Filmes podem ser anexados à superfície poliestireno diretamente sem uma lamela adicional. Além disso, filmes podem ser adaptados a diferentes superfícies e estrutura geométrica, como tubos ou anéis, permitindo que mais estudos não realizáveis com materiais de cultura de células convencional. Nos experimentos realizados retratados na Figura 8 filmes compostos na folha de PET foram colocados diretamente em placas de cultura de células ou filmes foram retirados da folha de PET e colocados em lamínulas de vidro. Para as condições experimentais, alguns polímeros foram tratados com plasma de ar para aumentar a sua energia livre de superfície. Em geral, PDMS possui um ângulo de contato de água de aproximadamente 115° antes do tratamento de plasma e torna-se altamente hidrofílico de pós-tratamento (água ângulo de contato < 30°)8. Tratamento de plasma processa a superfície biocompatível e facilita a fixação de células eucarióticas. Dependendo da intensidade e tempo de tratamento na superfície do polímero é alterada, mostrando um maior grau de aspereza e também rachadura pode aparecer. Imediatamente após o tratamento, observa-se um processo de recuperação hidrofóbicas. Como descrito no passo protocolo 4.3.5 goniômetro foi usado para determinar os ângulos de contato de água estático. Portanto, polímeros que foram colocados em ddH2O por 1h após o tratamento de plasma de ar foram posteriormente analisados. Tratamento de plasma significativamente reduzido o ângulo de contato de água (PDMS imaculadas: 117.0 ± 2,2 °; SSA Imaculada: 127,9 ± 5,6 °; Plasma PDMS: 18.0 ± 7,2 °; Plasma de SSA: 29,3 ± 11,5 °).
Para a amostra, incorporando uma montagem aquosa médio tem sido aplicado. Se em qualquer ponto do tempo, as amostras precisam ser removidas novamente, os espécimes podem ser colocados em uma água contendo placa de Petri durante a noite. Eventualmente, as lamínulas podem ser removidas para análise adicional.
O comportamento de apego e a morfologia das células L929 semeado por 3 dias em PDMS e SSA filmes compostos de 50: 50, foi determinado por microscopia de contraste de fase e depois da coloração com fluorescência conjugada faloidina-488 e corante Hoechst 33342 (Figura 8). Aquisição de imagens com microscopia de contraste de fase é altamente recomendada, especialmente para polímeros não tratados com plasma. Devido a fraca adesão celular para estas superfícies poliméricas células únicas ou agregados são facilmente separados, complicando a interpretação correta de métodos de análise posterior.
Células semeadas em polímeros imaculados exibido anexo pobre e celular espalhando comportamento (Figura 8A1 e C1) enquanto uma monocamada confluente foi observada para as células cultivadas em superfícies tratada de plasma (Figura 8B1 e D1) . A formação de agregados celulares e desprendimento da superfície foi mais pronunciada em superfícies imaculadas. Visualização dos filamentos de actina após fixação com paraformaldeído 4% revelou poucas células migrando para a periferia dos agregados celulares e emanação de lamellipodia saliências na intocada PDMS e SSA 50: 50 compostos filmes (Figura 8A2 e C2, setas). Não há grandes diferenças qualitativas podem ser observadas ao comparar ambos os materiais poliméricos. Como uma nota lateral, parece que um menos quantidade de agregados celulares estavam presentes em 50: 50 do SSA comparado com PDMS. Também, os agregados anexados às superfícies na proporção 50: 50 do SSA apareceram que mais achatada (8 Figura 1). Como esperado, o tratamento com plasma de ar melhorado celular acessório e se espalhando em ambas as superfícies significativamente, levando à formação de saliências lamellipodia notável e uma monocamada confluente (Figura 8B2 e 2 de 8).
Liberação de LDH após 3 dias de cultura foi usada como um indicador para determinar efeitos citotóxicos (Figura 9A). Em geral, os níveis LDH foram comparáveis para células cultivadas em ambos os materiais poliméricos, com menos de 5% citotoxicidade (PDMS imaculadas: 2,8 ± 2.0%; 50: 50 de SSA imaculadas: 4,5 ± 3,6%; plasma tratados PDMS: 3,4 ± 1,5%; plasma Tratado SSA 50: 50: 3,4 ± 1,6%). Estes resultados são comparáveis com os dados apresentados em nosso estudo publicado anteriormente, com foco na investigação de ambos os elastômeros. 8 para validar ainda mais os resultados do ensaio LDH, foi realizado um teste de exclusão azul trypan. Além disso, determinou-se a população de toda a célula para exibir diferenças na atividade de proliferação (Figura 9B). Em geral, menos de 5% células positivas Trypan azul foram contadas (PDMS imaculadas: 2.4 ± 0,3%; imaculadas 50: 50 do SSA: 3,8 ± 2,5%; plasma tratados PDMS: 0,74 ± 1,3% plasma tratados 50: 50 do SSA: 0.95 ± 1,6%).
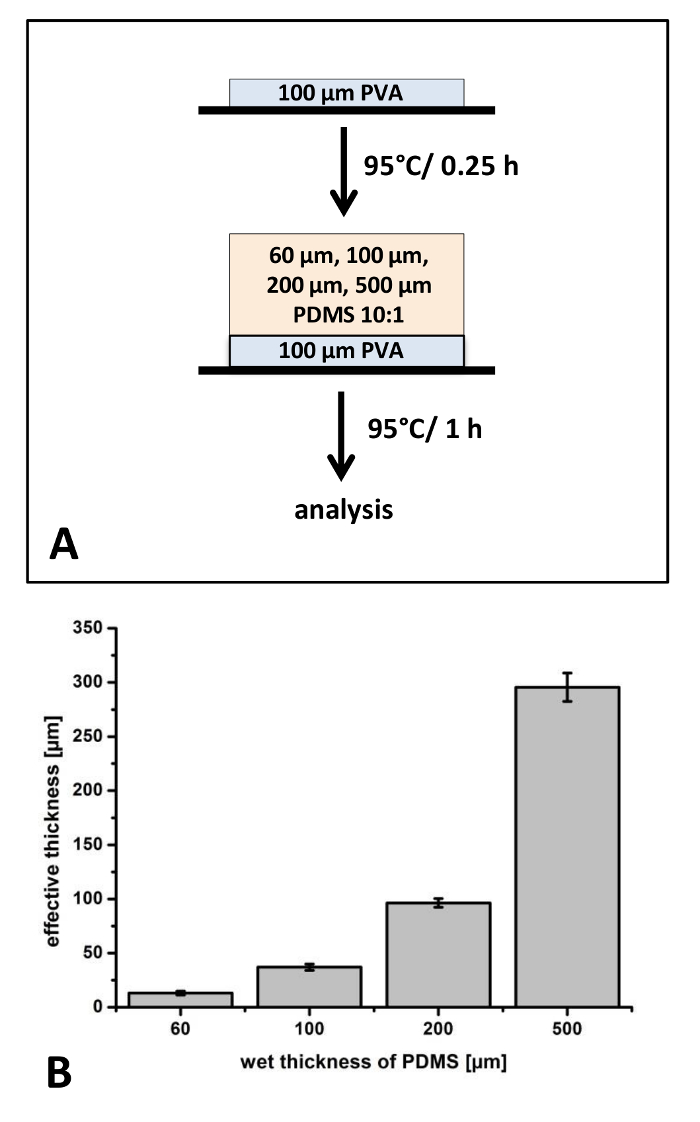
Figura 1: preparação de filmes PDMS na poli-(vinyl alcohol) (PVA) revestido de folha de PET: O processo para a fabricação de filmes PDMS com espessura variando em uma folha de PET foi aplicado para determinar a reprodutibilidade e a manipulação do desempenho (A). As espessuras dos filmes PDMS foram analisadas com microscopia óptica após a cura a 95 ° C (B). N = 3 independentemente fabricado filmes foram analisados. De cada filme, foram escolhidos três locais diferentes, corte e 3 posições em cada amostra foram analisadas (k = 27). Barras de erro representam o desvio padrão. Clique aqui para ver uma versão maior desta figura.

Figura 2: preparação dos filmes compostos de PDMS preparado em diferentes proporções de mistura: Filmes compostos exibindo diferentes proporções de mistura da base (componente A) para crosslinker (componente B) de PDMS foram fabricados pela técnica de lâmina de doutor. A camada superior, consistindo de PDMS nas relações 10:1 (componente A:B), 45: 1 e 70:1 foram aplicados em cima de um filme de 10:1 PDMS anteriormente curado (A). Após a cura subsequente a 95 ° C espessura dos filmes compostos foi analisada por microscopia óptica (B) e microscopia eletrônica (C). N = 3 experimentos independentes foram realizados e analisados com microscopia óptica (D). Formam cada filme independente fabricado, foram escolhidos três locais diferentes, corte e 3 posições em cada amostras foram analisadas (k = 27). Barras de erro representam o desvio padrão. Clique aqui para ver uma versão maior desta figura.

Figura 3: determinação da rugosidade da superfície topográfica dos dois substratos utilizados para as medições de adesão: Dois substratos de vidro, possuindo a aspereza de superfície diferente foram caracterizados. 3 análise dimensional profilometria da superfície foi realizada sobre o substrato 'suave' GS (A1) e o substrato 'bruto' GR (B1). Correspondentes curvas de linha única são retratadas em A2 e B2). Clique aqui para ver uma versão maior desta figura.

Figura 4: princípio das medições de aderência normal: Uma configuração de compilação personalizada foi usada para caracterizar as propriedades de adesão das amostras de polímero. A instalação de medição é descrita na alíneaAe detalhes são mostrados em (B). Para a análise de medição, stress determinou-se uma curva de tempo de estresse (C). Trabalho de separação foi determinado por uma integração da curva de estresse-deslocamento entrefinal de s e s0 (D). Clique aqui para ver uma versão maior desta figura.

Figura 5: determinação das propriedades aderência de filmes de compostos com diferentes proporções de mistura de PDMS: Pull-off stress (A) e o trabalho de separação (B) dos filmes compósitos fabricados de PDMS na mistura rácios de 10:1, 45: 1 e 70:1 foram medidos. Para a análise, de uma 'suave' vidro substrato (GS), exibindo um Ra = 0,013 µm e um substrato de vidro 'bruto' (GR) com Ruma = 0,338 µm foram usados. N = 3 independentemente fabricado filmes foram analisados. De cada filme, foram escolhidos dois pedaços e três posições diferentes em cada amostra foram analisadas (k = 18). Barras de erro representam o desvio padrão. Clique aqui para ver uma versão maior desta figura.
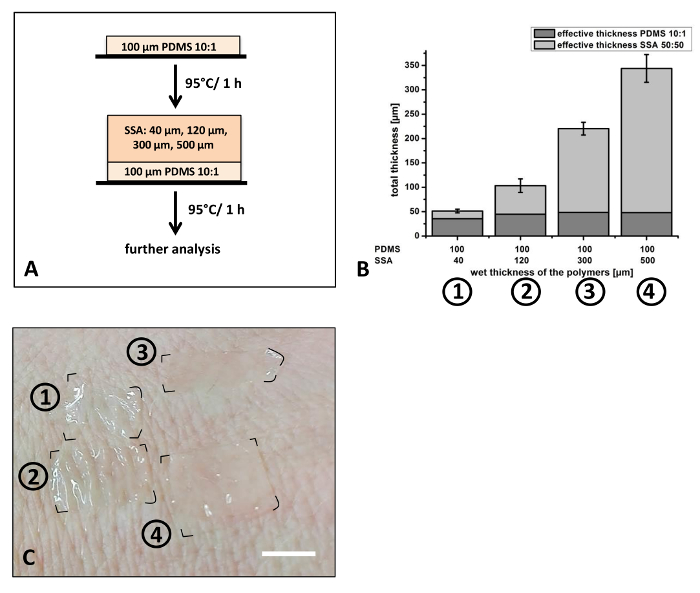
Figura 6: preparação dos filmes compostos de SSA com espessura variável: 50: 50 do SSA foi aplicado em cima de um filme de 10:1 PDMS anteriormente curado (A). Foram aplicadas diferentes espessuras molhadas desta camada que varia de 40 a 500 µm e a espessura após a cura investigado com microscopia óptica (B). Fixação dos filmes na parte de trás de um voluntários mão exibido que filmes com uma espessura total de aproximadamente 100 µm (filme #2) conformados bem com a aspereza da pele (C). Espessura das camadas simples e a espessura total dos filmes compósitos são mostrados na Figura 6B. Para a análise n = 3 independentemente fabricadas amostras foram medidas com microscopia óptica. De cada filme, foram escolhidos três locais diferentes, corte e 3 posições em cada amostra foram analisadas (k = 27). Barras de erro representam o desvio padrão. Barra de escala em 6C retrata aproximadamente 1 cm... por favor clique aqui para ver uma versão maior desta figura.

Figura 7: determinação das propriedades de aderência dos filmes compostos do adesivo de pele macia: Filmes finos compostos de SSA, como uma camada superior e PDMS 10:1 como camada de revestimento protetor foram fabricados. A espessura da camada superior era variada entre 50 e 330 µm. Pull-off stress (A) e trabalho de separação (B) dos filmes compostos medidos com dois substratos de vidro diferentes foram analisados (uma carcaça de vidro 'suave' (GS), exibindo um Rum = 0,013 µm e um substrato de vidro 'bruto' (GR) com Ruma = 0.338 µm). Fotos exemplares dos mecanismos de destacamento são visualizadas em C. Para dados análise n = 3 independentemente manufacturados experimentos foram analisados. De cada filme, foram escolhidos dois pedaços e três posições diferentes em cada amostra foram analisadas (k = 18). Barras de erro representam o desvio padrão. Barras de escala em 7C retratam 0,5 mm. clique aqui para ver uma versão maior desta figura.
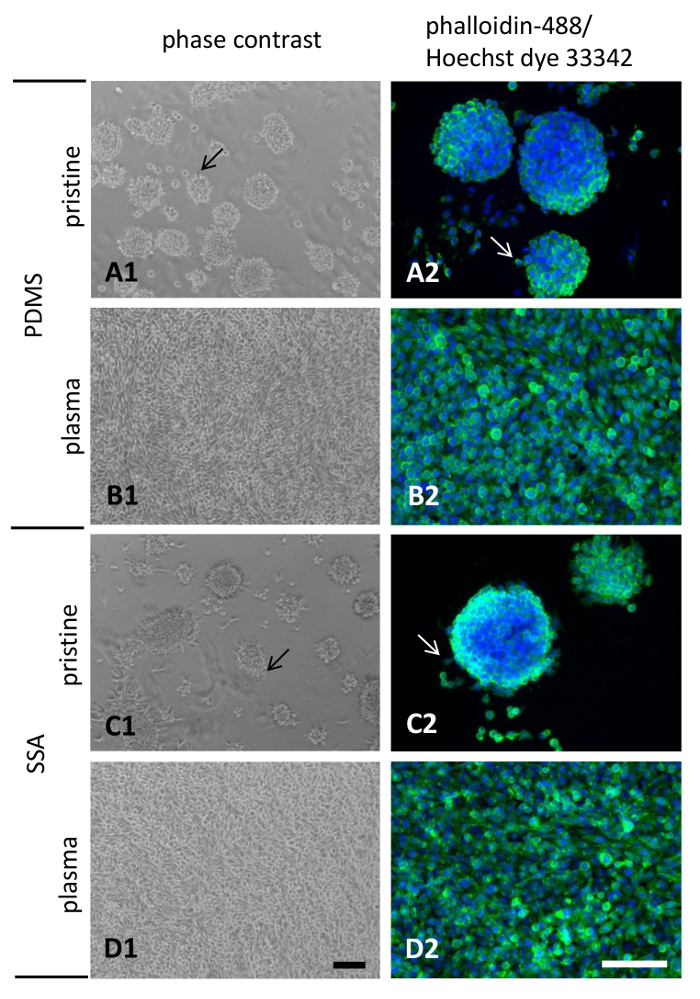
Figura 8: morfologia celular de fibroblastos L929 cultivadas em filmes finos: Murino fibroblastos L929 foram cultivados por 3 dias sobre os filmes finos fabricados a partir de PDMS (A1, A2, B1, B2) ou SSA (C1, C2, D1, D2). Para aumentar a Hidrofilia da superfície de tratamento de ar plasma foi realizada (B1, B2, D1, D2). Barras de escala em D1 e D2 retratam 100 µm. clique aqui para ver uma versão maior desta figura.
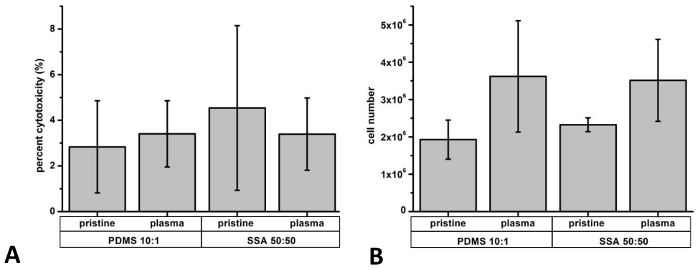
Figura 9: determinação da proliferação celular e citotoxicidade: Para a determinação dos efeitos citotóxicos e proliferação celular, células L929 foram semeadas por três dias no PDMS 10:1 e filmes compostos de 50: 50 de SSA. Liberação de lactato desidrogenase (LDH) foi determinada por um ensaio de atividade LDH e revelou a menos de 5% a citotoxidade (A). Número total de células após o período de cultivo foi avaliado após manual de contagem de células únicas com uma câmara de Neubauer (B). N = 3 independente realizou experimentos foram analisados. Barras de erro representam o desvio padrão. Clique aqui para ver uma versão maior desta figura.
Discussão
O projeto de estruturas compósitas permite que o simples ajuste de propriedades materiais, tais como o módulo de Young ou a espessura das amostras. O módulo de Young de PDMS pode ser efetivamente alterado em uma ampla gama por alterando a relação de mistura entre os dois componentes ou fabricação de misturas usando um elastômero de silicone diferentes30,31. Os métodos descritos não são limitados do PDMS usado no presente inquérito, mas especialmente o desempenho adesivo depende fortemente do tipo específico usado. Um passo crítico no âmbito do presente protocolo é o processo de fabricação dos filmes compostos (Figura 1). Foi demonstrado que a espessura dos filmes afeta significativamente o comportamento de adesão dos filmes em diferentes substratos, incluindo pele (Figura 5 e Figura 6). Além da espessura da película, tempo e temperatura durante o processo de cura afeta as propriedades do material32. Portanto, parâmetros como a espessura das camadas poliméricas precisam ser cuidadosamente adaptada e verificou.
Análise das propriedades adesivas dos filmes finos foi realizada com medições de adesão de força normal usando dois substratos de vidro com diferente rugosidade da superfície até Ra = 0.338 µm (Figura 3). Em geral, rugosidade impacta significativamente a adesão de superfícies, especialmente de materiais elásticos33,34. A rugosidade de vidro pode ser facilmente variada por moagem com lixa de tamanhos diferentes de aspereza, permitindo a fabricação de substratos exibindo mais elevados valores de rugosidade21. Além disso, outros materiais, por exemplo a resina epóxi pode ser usada para a produção de substratos15,35. Isso pode ser uma estratégia importante modificação do protocolo apresentado. Por exemplo, se exibindo diferentes energias de superfície livre de substratos são necessários ou específico topografias são necessárias. Aqui, puxe-fora o stress e o trabalho de separação dos filmes finos fabricados de PDMS e SSA foram analisados com uma configuração Custom-Built (dispositivo de medição de aderência macroscópica (MAD, Figura 4)). 36 o alinhamento óptico de substrato e do indenter é um passo crítico para a análise dos resultados da medição. Portanto, o ajuste do ângulo de inclinação precisa ser executada com o goniômetro, tão preciso quanto possível. Isto pode ser conseguido com uma precisão suficiente manualmente trazendo o substrato em contato com a superfície da película até um contato horizontal seja alcançado.
No protocolo atual o tempo de espera foi mantido constante em um segundo (Figura 5 e Figura 7). Especialmente para a investigação do desempenho de um filme elástico para uma superfície áspera substrato adesivo, uma extensão do tempo de preensão fornece informações adicionais. Por exemplo, um aumento no estresse puxe-fora com o aumento do tempo de espera tem sido relatado8. Além das medições realizadas no protocolo atual, outros métodos, por exemplo casca de testes podem ser executadas, permitindo uma investigação mais abrangente do desempenho de adesão37.
As propriedades adesivas de filmes compostos exibindo filme diferente espessuras do adesivo pele macia foram determinadas (Figura 7). Nossos resultados estão em consonância com os dados publicados, mostrando que uma diminuição de chumbo de espessura de filme para um aumento do stress pull-off como o confinamento, ou seja, a relação entre espessura diâmetro e filme de substrato, aumenta38,39 . Baseado nestes resultados e os dados descritos na Figura 7, podemos concluir que filmes compostos com uma espessura total de aproximadamente 100 µm (espessura da camada de SSA de aproximadamente 60 µm, aplicado a um filme PDMS com uma espessura de cerca de 40 µm) apresentam aderência favoráveis p roperties sobre superfícies ásperas.
Em seguida, foram realizados experimentos relacionados com a caracterização biológica em filmes compostos imaculadas e plasma tratados filmes compostos (Figura 8). Tratamento de plasma de elastômeros de silicone é uma técnica versátil, muitas vezes aplicada para aumentar as propriedades hidrófilas de superfícies e promover a ligação celular e celular espalhando40,,41. Silicones são bem conhecidos por sua baixa toxicidade e alta biostability, mas podem conter monómeros residuais ou catalisadores que possam influenciar os processos fisiológicos, levando também a citotoxicidade42,43. No conduzido experimentos observamos, inferior a 5% citotoxicidade usando liberação LDH como um indicador e um ensaio de exclusão Trypan azul. O protocolo apresentado, toda a população celular, incluindo agregados celulares desanexado forma que a superfície da terra foram analisada para análise de proliferação (Figura 9B). Uma modificação do protocolo poderia produzir resultados mais diferenciados. Para cada amostra, o sobrenadante contendo desanexados agregados celulares poderia ser transferido para um tubo de reação separada e não combinado com as células enzimaticamente removidas da superfície do polímero. Isso permitiria a avaliação exata das células ligado à superfície e eventualmente revelar uma determinação mais detalhada da influência dos polímeros sobre o processo de adesão celular. Além dos métodos de immunocytochemical aqui apresentados, as células podem ser colhidas para investigação com métodos immunoblot, permitindo uma avaliação quantitativa detalhada da expressão da proteína.
Em resumo, nós temos estabelecido condições de fabricação para a produção de filmes finos de composto elastoméricos para aplicações na pesquisa de cultura de células avançado. Além disso, estes filmes finos possuem alta adaptabilidade para aspereza, permitindo design sofisticado de adesivos de pele a pele.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Martin Danner é reconhecida por sua assistência na preparação de amostras e estabelecimento de procedimentos de cultura de células. Os autores gostaria de agradecer Biesterfeld Spezialchemie GmbH (Hamburgo, Alemanha), especialmente Robert Radsziwill para suporte contínuo e discussões. A pesquisa que conduz a estes resultados recebeu financiamento do Conselho Europeu de investigação no âmbito acordo de subvenção do sétimo programa-quadro (FP/2007-2013) ERC n. da União Europeia, 340929.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-Propanol, 97% | Stockmeier Chemie | 1000452610000 | Isopropanol |
| Abrasive diamnod hand pad | Bohle | MO 5007522 | Grit: 220 |
| Accutase | Capricorn Scientific | ACC-1B | |
| Albumin Fraktion V | Roth | 0163.2 | BSA |
| Alexa Fluor 488 Phalloidin | ThermoFischer Scientific | A12379 | highly toxic |
| Aquamount | Polysciences | 18606-20 | water soluble mounting medium |
| CytoTox-ONE Homogeneous Membrane Integrity Assay | Promega | G7890 | |
| DPBS, without Ca2+, Mg2+ | ThermoFischer Scientific | 14190094 | |
| Fetal bovine serum gold | GE Health Care Life Science | A15-151 | FBS |
| Goniometer OCA35 | Dataphysics | for the determination of the static water contact angle | |
| Hoechst Dye 33342 | Sigma-Aldrich | B1155-100MG | bisBenzimide H 33342 trihydrochloride, highly toxic |
| Microscope Axiovert 25 | Zeiss | Microscope used for cell culture documentation | |
| Microscope Eclipse LV100ND | Nikon | Microscope used for film thickness determination | |
| Paraformaldehyde, aqueous solution 16% | Electron Microscopy Sciences | RT 15710 | electron microscopy grade |
| penicillin und streptomycin solution | Sigma-Aldrich | P4333-100ML | |
| Phenom XL Scanning Electron Microscope (SEM) | Phenom | ||
| Poly-(vinyl alcohol) 4-88, MW 31000 | Sigma-Aldrich | 81381-1KG | Mowiol 4-88 |
| Poly-dimethyl siloxanes, Sylgard 184 | Dow Corning | (400)000108351397 | PDMS |
| RPMI 1640 basal medium | ThermoFischer Scientific | 21875034 | |
| soft skin adhesive (SSA) | Dow Corning | (400)000108251792 | MG 7-9800 Soft Skin Adhesive (SSA) |
| speed mixer DAC 600.2 VAC-P | Hauschild | ||
| stylus profilomter | Zeiss | Model: SURFCOM 1500SD3 | |
| Tecan Infinite M200 pro | Tecan | fluorescence plate reader | |
| Triton X 100 | Calbiochem | 648466 | |
| Trypan Blue solution | Sigma-Aldrich | T8154-100ML | highly toxic |
| Trypsin/EDTA solution | PAN-Biotech | P10-023500 | 0.05% Trypsin, 0.02% EDTA in PBS |
| UV glue | Bohle | BO MV76002 | medium viscosity |
Referências
- Lloyd, A. W., Faragher, R. G. A., Denyer, S. P. Ocular biomaterials and implants. Biomaterials. 22, 769-785 (2001).
- Zhang, M., Wu, J., Wang, L., Xiao, K., Wen, W. A simple method for fabricating multi-layer PDMS structures for 3D microfluidic chips. Lab Chip. 10, 1199-1203 (2010).
- Kwak, M. K., Jeong, H. E., Suh, K. Y. Rational design and enhanced biocompatibility of a dry adhesive medical skin patch. Adv. Mater. 23, 3949-3953 (2011).
- Gun Park, D., Chul Shin, S., Won Kang, S., Tae Kim, Y. Development of flexible self adhesive patch for professional heat stress monitoring service. Conf. Proc. IEEE Eng. Med. Biol. Soc. 4, 3789-3792 (2005).
- Thomas, X. Silicone Adhesives in Healthcare Applications. Dow corning Lit. , (2013).
- Fuard, D., Tzvetkova-Chevolleau, T., Decossas, S., Tracqui, P., Schiavone, P. Optimization of poly-di-methyl-siloxane (PDMS) substrates for studying cellular adhesion and motility. Microelectron. Eng. 85, 1289-1293 (2008).
- Wang, Z., Volinsky, A. A., Gallant, N. D. Crosslinking effect on polydimethylsiloxane elastic modulus measured by custom-built compression instrument. J. Appl. Polym. Sci. 131, 41050 (2014).
- Fischer, S. C. L., Kruttwig, K., Bandmann, V., Hensel, R., Arzt, E. Adhesion and cellular compatibility of silicone-based skin adhesives. Macromol. Mater. Eng. , 1-11 (2017).
- Martina, D., Creton, C., Damman, P., Jeusette, M., Lindner, A. Adhesion of soft viscoelastic adhesives on periodic rough surfaces. Soft Matter. 8, 5350-5357 (2012).
- Brown, X. Q., Ookawa, K., Wong, J. Y. Evaluation of polydimethylsiloxane scaffolds with physiologically-relevant elastic moduli: Interplay of substrate mechanics and surface chemistry effects on vascular smooth muscle cell response. Biomaterials. 26, 3123-3129 (2005).
- Song, F., Ren, D. Stiffness of cross-linked poly(dimethylsiloxane) affects bacterial adhesion and antibiotic susceptibility of attached cells. Langmuir. 30, 10354-10362 (2014).
- Buxboim, A., Rajagopal, K., Brown, A. E. X., Discher, D. E. How deeply cells feel: methods for thin gels. J. Phys. Condens. Matter. 22, 194116 (2010).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix Elasticity Directs Stem Cell Lineage Specification. Cell. 126, 677-689 (2006).
- Roth, J., et al. Surface functionalization of silicone rubber for permanent adhesion improvement. Langmuir. 24, 12603-12611 (2008).
- Thiébaud, P., Lauer, L., Knoll, W., Offenhäusser, A. PDMS device for patterned application of microfluids to neuronal cells arranged by microcontact printing. Biosens. Bioelectron. 17, 87-93 (2002).
- Tourovskaia, A., Figueroa-Masot, X., Folch, A. Differentiation-on-a-chip: a microfluidic platform for long-term cell culture studies. Lab Chip. 5, 14-19 (2005).
- Peterson, S. L., McDonald, A., Gourley, P. L., Sasaki, D. Y. Poly(dimethylsiloxane) thin films as biocompatible coatings for microfluidic devices: Cell culture and flow studies with glial cells. J. Biomed. Mater. Res. - Part A. 72, 10-18 (2005).
- Wan, Y., et al. Nanotextured substrates with immobilized aptamers for cancer cell isolation and cytology. Cancer. 118, 1145-1154 (2012).
- Ross, A. M., Jiang, Z., Bastmeyer, M., Lahann, J. Physical aspects of cell culture substrates: Topography, roughness, and elasticity. Small. 8, 336-355 (2012).
- Barreau, V., et al. Fibrillar Elastomeric Micropatterns Create Tunable Adhesion Even to Rough Surfaces. Adv. Funct. Mater. 26, 4687-4694 (2016).
- Briggs, G. A. D., Briscoe, B. J. The effect of surface topography on the adhesion of elastic solids. J. Phys. D. Appl. Phys. 10, 2453-2466 (1977).
- Dapp, W. B., Lücke, A., Persson, B. N. J., Müser, M. H. Self-affine elastic contacts: Percolation and leakage. Phys. Rev. Lett. 108, 1-4 (2012).
- Putignano, C., Carbone, G., Dini, D. Mechanics of rough contacts in elastic and viscoelastic thin layers. Int. J. Solids Struct. 69, 507-517 (2015).
- Laulicht, B., Langer, R., Karp, J. M. Quick-release medical tape. Proc. Natl. Acad. Sci. 109, 18803-18808 (2012).
- Kim, T., Park, J., Sohn, J., Cho, D., Jeon, S. Bioinspired, Highly Stretchable, and Conductive Dry Adhesives Based on 1D-2D Hybrid Carbon Nanocomposites for All-in-One ECG Electrodes. ACS Nano. 10, 4770-4778 (2016).
- Adamietz, I. A., et al. Effect of self-adhesive, silicone-coated polyamide net dressing on irradiated human skin. Radiat. Oncol. Investig. 2, 277-282 (1994).
- White, R. Evidence for atraumatic soft silicone wound dressing use. Wounds UK. 1, 104-109 (2005).
- Quan, M. B., Edwards, C., Marks, R. Non-invasive in vivo techniques to differentiate photodamage and ageing in human skin. Acta Derm. Venereol. 77, 416-419 (1997).
- Brown, X. Q., Ookawa, K., Wong, J. Y. Evaluation of polydimethylsiloxane scaffolds with physiologically-relevant elastic moduli: Interplay of substrate mechanics and surface chemistry effects on vascular smooth muscle cell response. Biomaterials. 26, 3123-3129 (2005).
- Palchesko, R. N., Zhang, L., Sun, Y., Feinberg, A. W. Development of Polydimethylsiloxane Substrates with Tunable Elastic Modulus to Study Cell Mechanobiology in Muscle and Nerve. PLoS One. 7, e51499 (2012).
- Johnston, I. D., McCluskey, D. K., Tan, C. K. L., Tracey, M. C. Mechanical characterization of bulk Sylgard 184 for microfluidics and microengineering. J. Micromechanics Microengineering. 24, 35017 (2014).
- Persson, B. N. J., Gorb, S. The effect of surface roughness on the adhesion of elastic plates with application to biological systems. J. Chem. Phys. 119, 11437 (2003).
- Peressadko, A. G., Hosoda, N., Persson, B. N. J. Influence of surface roughness on adhesion between elastic bodies. Phys. Rev. Lett. 95, 1-4 (2005).
- Purtov, J., et al. Measuring of the hardly measurable: adhesion properties of anti-adhesive surfaces. Appl Phys A. 111, 183-189 (2013).
- Kroner, E., Blau, J., Arzt, E. Note: An adhesion measurement setup for bioinspired fibrillar surfaces using flat probes. Rev. Sci. Instrum. 83, 16101 (2012).
- Sun, S., Li, M., Liu, A. A review on mechanical properties of pressure sensitive adhesives. Int. J. Adhes. Adhes. 41, 98-106 (2013).
- Webber, R. E., Shull, K. R., Roos, A., Creton, C. Effects of geometric confinement on the adhesive debonding of soft elastic solids. Phys. Rev. E. 68, 21805 (2003).
- Creton, C., Lakrout, H. Micromechanics of flat-probe adhesion tests of soft viscoelastic polymer films. J. Polym. Sci. Part B Polym. Phys. 38, 965-979 (2000).
- Tan, S. H., Nguyen, N. -. T., Chua, Y. C., Kang, T. G. Oxygen plasma treatment for reducing hydrophobicity of a sealed polydimethylsiloxane microchannel. Biomicrofluidics. 4, 32204 (2010).
- Kim, B., Peterson, E. T. K., Papautsky, I. Long-term stability of plasma oxidized PDMS surfaces. Conf. Proc. IEEE Eng. Med. Biol. Soc. 7, 5013-5016 (2004).
- Briganti, E., et al. Silicone based polyurethane materials: A promising biocompatible elastomeric formulation for cardiovascular applications. J. Mater. Sci. Mater. Med. 17, 259-266 (2006).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9, 2132 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados