Method Article
Automatisierung eines Positronen-Emissions-Tomographie (PET) Radiotracer Synthese Protokolls für klinische Herstellung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Positronen-Emissions-Tomographie (PET) imaging Websites, die mehrere frühen klinischen Studien beteiligt sind brauchen robuste und vielseitige Radiotracer Fertigungskapazitäten. Mit Hilfe der Radiotracer [18F] Clofarabin als Beispiel, wir zeigen, wie die Synthese von einem Radiotracer mit einer flexiblen, Kassetten-basierte Radiosynthesizer zu automatisieren und die Synthese für die klinische Anwendung zu validieren.
Zusammenfassung
Die Entwicklung der neuen Positronen-Emissions-Tomographie (PET) Tracer ermöglicht Forschern und Klinikern, eine zunehmend breite Palette an biologischen Zielen und Prozesse abzubilden. Die zunehmende Zahl von verschiedenen Tracern erstellt jedoch Herausforderungen für ihre Produktion auf Radiopharmacies. Während historisch es praktisch wurde zu einer individuell konfigurierten Radiosynthesizer und heisse Zelle für die wiederholte Produktion jedes einzelnen Tracer zu widmen, wird es notwendig, diesen Workflow zu ändern. Den letzten kommerziellen Radiosynthesizers basierend auf Einweg-Kassetten/Kits für jede Tracer vereinfachen die Produktion von mehreren Tracer mit einer Reihe von Geräten durch den Wegfall der Notwendigkeit für benutzerdefinierte Tracer-spezifische Änderungen. Darüber hinaus erlauben einige dieser Radiosynthesizers dem Operator zu entwickeln und optimieren ihre eigene Synthese Protokolle neben dem Einkauf im Handel erhältlichen Kits. In diesem Protokoll wir beschreiben die allgemeine Vorgehensweise für wie die manuelle Synthese von eine neue PET-Tracer auf eines dieser Radiosynthesizers automatisiert werden kann und für die Herstellung von klinischen Grade Tracer validiert. Als Beispiel verwenden wir die ELIXYS Radiosynthesizer, eine flexible Kassette-basierte Radiochemie-Tool, das PET-Tracer-Entwicklungsbemühungen sowie routinemäßige klinische Sonde Fertigung auf dem gleichen System zu produzieren [18F] unterstützen kann Clofarabin ([ 18 [F] CFA), eine PET-Tracer, in Vivo Deoxycytidine Kinase (dCK)-Enzym-Aktivität zu messen. Übersetzen einer manuellen Synthesis bezieht Abbau der synthetischen Protokoll in grundlegenden Radiochemie Prozesse, die intuitive Chemie "Unit Operations" von der Synthesizer-Software unterstützt dann übersetzt werden. Diese Operationen können dann schnell in eine automatische Sprachsynthese-Programm umgewandelt werden, durch die Montage mit der Drag-and-Drop-Schnittstelle. Nach grundlegenden Tests erfordern die Synthese und Reinigung Verfahren Optimierung um den gewünschten Ertrag und Reinheit zu erreichen. Sobald die gewünschte Leistung erreicht wird, ist eine Validierung der Synthese durchgeführt, um ihre Eignung für die Herstellung von Radiotracer für die klinische Anwendung zu bestimmen.
Einleitung
Eine wachsende Reihe von biologischen Zielen dynamisch visualisiert werden in lebenden Probanden über die molekulare bildgebende Modalität PET. PET bietet in-Vivo -Tests spezifische biologische, biochemische und pharmakologische Prozesse mithilfe von bestimmten Radiotracer (Moleküle mit Positronen emittierende Radionuklide beschriftet), die sich mit dem Thema vor imaging1injiziert werden. Der verstärkte Einsatz von PET, eine Vielzahl dieser Prozesse in Grundlagenforschung und klinische Forschung2,3,4und in der Entdeckung, Entwicklung und klinische Anwendung von Drogen in der Patientenversorgung5, zu studieren 6, führt zu einer wachsenden Nachfrage nach vielfältigen Radiotracer7,8. Strahlenbelastung der Radiochemiker zu vermeiden und um eine reproduzierbare Produktion von diesen kurzlebigen Tracern sicherzustellen, werden sie in der Regel hergestellt unter Verwendung eines automatisierten Radiosynthesizer innerhalb einer "heißen Zelle" operieren. Den letzten Radiosynthesizers verwenden eine Einweg-Kassette/Kit-Architektur, um die Vereinfachung der Einhaltung der klinischen hochwertige Fertigung und gleichzeitig die Flexibilität, um mehrere Arten von Radiotracer bereiten einfach durch austauschen Kassetten9 . In frühen klinischen Stadien sind jedoch in der Regel keine handelsüblichen Kassetten/Kits, die automatisierte Radiosynthese durchzuführen; Daher kämpfen PET Medikament Produktionsstätten, Systeme zur Umsetzung der cGMP-Grade Tracer Produktionsmöglichkeiten in einem geeigneten Zeitraum und zu einem vernünftigen Preis anzupassen. So wurden Radiosynthesizers entwickelt, die die Kassette/Kit-Architektur mit Funktionen zur Erleichterung der Entwicklung und Optimierung von Tracern kombinieren.
ELIXYS FLEX/CHEM (ELIXYS) ist ein Beispiel für eine flexible Kassette-basierte Radiosynthesizer mit einer breiten Reagenz, Lösungsmittel und Reaktion Temperatur Kompatibilität10. Es hat drei Reaktionsgefäße und verwendet einen Roboter-Mechanismus, um dynamisch die Flüssigkeiten Weg Bedarf jeder besondere Synthese Protokoll11konfigurieren. Die Synthesizer-Software ermöglicht die Erstellung von Syntheseprogramme (Sequenzen) für verschiedene Tracer per Drag & Drop Grundoperationen wie Trap Isotop Eluieren Isotop, Fügen Reagenz, reagieren, und verdampfen12. Jeder Betrieb hat eine Vielzahl von programmierbaren Parameter dem Betreiber, wie Dauer, Temperaturoder inertes Gas fahren Druck (Druck) zur Verfügung. Durch das Verständnis der Art der jeweiligen Einheit Maßnahme, eine manuelle Synthese kann leicht in eine Abfolge von Grundoperationen übersetzt werden und dann bei der Optimierung des Protokolls13geändert werden. In Kombination mit dem Modul ELIXYS PURE/FORM führen das integrierte System auch eine automatische Reinigung und Formulierung von PET-Tracer. Mit Hilfe dieses Radiosynthesizer, haben wir bereits die automatisierte Synthese von 24 verschiedenen 18F-markierten Tracer und prosthetischen Gruppen11,14,15,16, als berichtet sowie die automatisierte enzymatische Radiofluorination von Biomolekülen17, indem Sie einfach Reagenzien und nicht die Konfiguration des Systems. Andere haben gezeigt, dass die automatisierte Synthese von [18F] RO6958948 für die Darstellung der Tau neurofibrillären Verwicklungen18, die automatisierte Synthese der prosthetischen Gruppe [18F] F-Py-TFP eine spätere Zuschreibung von Peptiden19 , und die automatisierte Synthese von [18F] AM580 für die Darstellung der Phosphodiesterase 10a (PDE10A)20. Darüber hinaus mehrere Gruppen haben gezeigt die Produktion von Tracern geeignet für den klinischen Gebrauch, einschließlich 4-[18F] Fluorobenzyl-Triphenylphosphonium ([18F] FBnTP) für die Darstellung der Mitochondrien-Membran potenzielle21, [ 18 F] DCFPyL für die Darstellung der Membran Prostata-spezifisches Antigen (PSMA)22und [18F] THK-5351 für die Bildgebung von Tau23.
In diesem Papier, wir nutzen unsere Erfahrung mit [18F] CFA zu veranschaulichen, wie eine manuelle Radiosynthetic-Prozedur in eine automatisierte Synthese geeignet für routinemäßige Produktion nach cGMP Richtlinien unkompliziert und schnell umgesetzt werden kann. Der Tracer [18F] CFA wurde für die Darstellung der dCK Aktivität entwickelt. Die manuelle Radiosynthese [18F] CFA wurde ursprünglich von Shu Et Al. beschrieben 24 als ein Verfahren mit zwei Reaktionsgefäße, fortgeschrittene Kieselsäure Patrone Reinigung und eine endgültige HPLC-Reinigung Schritt (siehe Zusatzmaterial, 1. Abschnitt für Details). Aktuelle in-vitro- und präklinische Studien haben die außergewöhnliche Besonderheit dieser Tracer, dCK gezeigt, und First-in-Human Studien günstige Bioverteilung25. Es gibt ein unmittelbares Interesse an breiter angelegte klinische Studien bestätigen die Empfindlichkeit [18F] CFA Tier Variationen in dCK Aktivität und ein längerfristiges Interesse an die klinischen Einsatzmöglichkeiten dieser Tracer-26. Es ist möglicherweise ein nützlicher Biomarker für Therapien, die T-Zell-Aktivierung auslösen, DNA-Schäden verursachen oder verlassen sich auf dCK-abhängige Nukleosid analoge Prodrugs. Insbesondere [18F] CFA kann die Stratifizierung von Patienten für eine mögliche Reaktion auf die Behandlung mit Clofarabin ermöglichen. [18F] CFA könnte auch erleichtern, die Erforschung und Entwicklung von dCK-Inhibitoren, die in Richtung klinische Studien vorantreiben. Da diese Tracer manuell traditionell synthetisiert worden, alle diese Studien voran erfordert eine zuverlässige, automatisierte Synthese [18F] CFA für den klinischen Einsatz geeignet.
Obwohl wir bereits eine automatisierte Synthese von [18F] berichtet CFA für präklinische Studien16, dieses Protokoll baut weiter auf diese Bemühungen und beschreibt zusätzliche Änderungen für die klinische Produktion dieser Tracer benötigt einschließlich der Integration der vollautomatische Reinigung und Formulierung, Protokoll-Validierung und Qualitätskontrolle zu testen. Hier beschriebenen allgemeinen Vorgänge beschränken sich nicht auf die Entwicklung einer automatisierten und klinisch geeignet Synthesis [18F] CFA aber verallgemeinert werden können, auf einfache Weise, geeignet für den klinischen Einsatz von anderen automatisierten Synthesen zu entwickeln Radiotracer mit Fluor-18 gekennzeichnet.
Protokoll
1. allgemeines Verfahren für die Automatisierung und Validierung eines Radiosynthese Protokolls für klinische Herstellung
-
Analysieren Sie die Förderfähigkeit der manuellen Synthese Regelung für klinische Herstellung
- Risikoanalyse der Produktkontamination mit keine unerwünschten Rückständen Chemikalien.
- Vermeiden Sie Klasse 1 Lösungsmittel wie Benzol und ersetzen Sie sie durch geeignete alternative Lösungsmittel (Klasse 2 oder Klasse 3).
- Vermeiden Sie Chemikalien, die schwierig, in der endgültigen Formulierung als mögliche verbleibende Verunreinigungen zu erkennen wäre.
- Wählen Sie nur Chemikalien, die in hohen Reinheitsgrad (der USP oder Einhaltung. Klasse gewünscht) im Handel erhältlich und verfügen über ein Analysezertifikat.
- Verfeinern Sie die Synthese-Regelung, wenn unerwünschte Chemikalien oder Lösungsmittel von der Risikoanalyse erkannt werden und Abschnitt 1.1 zu wiederholen, bis keine bleiben.
- Risikoanalyse der Produktkontamination mit keine unerwünschten Rückständen Chemikalien.
-
Automatisieren Sie die Synthese-Protokoll
- Wenn ein automatisiertes Protokoll für die Tracer unter Verwendung des gleichen Synthesizers bereits erstellt und in einem Online-Repository hochgeladen wurde, herunterladen Sie eine Kopie der Sprachsynthese-Programm.
- Wenn eine automatische Sprachsynthese-Programm nicht vorhanden ist, erstellen.
- Mit Papier und Stift, die manuelle Synthese in allgemeinen Schritte unterteilen (z. B. Trocknung/Aktivierung [18F] Fluorid, Heizung Erleichterung radiochemische Reaktion, Durchführung einer Reinigungsstufe, etc..). Weitere brechen die allgemeinen Schritte in diskreten, grundlegende Prozesse, die erforderlich sind. Als Beispiel der Synthese-Schema [18F] CFA ist in Abbildung 1dargestellt, die Identifizierung der grundlegenden Schritte ist in Abbildung 2Agezeigt und die Aufteilung in Prozesse ist in Abbildung 2 bdargestellt.
- Mit Papier und Stift, ordnen Sie jeden Prozess in den einzelnen Grundoperationen der Synthesizer-Software. Als Beispiel, eine Analyse der Zuordnung der grundlegenden Prozesse bei der Synthese von [18F] CFA zu geeigneten Grundoperationen in der Synthesizer-Software-13 ist in Abbildung 2dargestellt.
- Über die Radiosynthesizer-Programmierschnittstelle, erstellen Sie ein leere Programm und fügen Sie einzelnen identifizierten Einheit Vorgänge nacheinander durch Klicken auf die Menü -Taste (oben links) und Sequenzenauswählen, und dann auf der neu Sequenz Taste. Ziehen Sie für jede Einheit Operation identifiziert in Schritt 1.2.2.2 den Betrieb der Einheit aus der verfügbaren Vorgänge in die Filmstreifen-Ansicht und klicken Sie auf oder füllen Sie den gewünschten Wert der einzelnen Parameter für den Betrieb der Einheit. Abbildung 3 zeigt ein Beispiel für die Oberfläche wenn alle Operationen zu synthetisieren [18F] CFA besiedelt, und der Benutzer die ersten reagieren Betrieb Parameterwerte bearbeiten ausgewählt hat. Die endgültige Sprachsynthese-Programm für [18F] CFA bezeichnet man im Zusatzmaterial, Tabellen S1 und S2.
- Das Sprachsynthese-Programm zu überprüfen.
- Führen Sie einen Probelauf. Richten Sie ein und führen Sie das Programm wie in den Schritten 2,1-2,3, verwenden alle Reagenzien und Lösungsmitteln als Radionuklid (z. B. [18F] Fluorid), um erwartete Verhalten zu überprüfen.
- Passen Sie ggf. die Werte je Einheit Betrieb Parameter im Programm (z. B. die Zeit oder treibende Druck vollständig übertragen ein Reagenz, die Zeit/Temperatur verdampfen ein Lösungsmittels auf die gewünschte Ebene, etc.), und testen Sie erneut. Anpassen der Parameterwerte zunächst zurück in den Bearbeiten -Modus durch die Wahl von Sequenzen aus dem Hauptmenü (links oben) und wählen Sie das neu erstellte Programm. Als nächstes klicken Sie auf die gewünschte Operation in die Filmstreifen-Ansicht (unten auf dem Bildschirm), navigieren Sie zu der gewünschten Parameter, und wählen Sie oder geben Sie den neuen Wert.
- Führen Sie einen Low-Aktivität (< 370 MBq) Test ausgeführt, um das Produkt zu testen.
- Optimieren Sie die automatisierte Synthese durch Anpassung der Parameterwerte, um die Ausbeute, Synthese, Wiederholbarkeit, und jedes andere gewünschte messbare Ergebnis verbessern.
-
Qualitätskontrolle (QC) Testverfahren zu entwickeln
- Mit nicht-radioaktiven Referenz des Endprodukts und Beispiele für mögliche chemische Verunreinigungen, entwickeln Sie eine analytische HPLC-Radio bzw. dünnen Sie Radio-Schicht Chromatographie (Radio-TLC) Methode mit ausreichender Trennung der Arten für die Bestimmung der chemische Reinheit, molare Aktivität, radiochemische Reinheit und radiochemische Identität. Überprüfen Sie die analytische Verfahren für Wiederholbarkeit und Linearität und bestimmen Sie die Erkennung und Quantifizierung Grenzen zu.
- In ähnlicher Weise, Entwicklung und Validierung einer Gas-Chromatographie-Methode zur Analyse flüchtiger Verunreinigungen (z.B. Restmengen von Lösungsmitteln, die während der Synthese verwendet werden).
- Entwicklung und Validierung von analytischen Tests, mit denen die Erkennung und Quantifizierung von möglichen Verunreinigungen (z.B., Cryptand 222 über die Standardfarbe spot Test).
- Verwenden Sie standard-Verfahren zur Bestimmung der Sterilität, pH-Wert, radionuclidic Identität, radionuclidic Reinheit, Konzentration der Radioaktivität, Produktmenge und Endotoxin-Ebenen.
-
Synthese-Überprüfung durchführen
- Standardarbeitsanweisungen (SOPs) für die Synthese und QC Testverfahren zu etablieren und integrieren eine Materialien und Ausrüstung-Tracking-System kompatibel mit aktuellen guten Fertigung Praxisbedarf (cGMP).
- Die Syntheseverfahren, die über drei unabhängige und in Folge auf dem gleichen Niveau von Radioaktivität Produktionsläufe bestimmungsgemäß für klinische Herstellung nach der SOPs zu validieren. Dokumentieren Sie die Synthese-Leistungen und Ergebnisse der QC zu testen.
- Alle aufeinander folgenden Validierung läuft müssen die voreingestellten QC Grenzen bestehen. Wenn eine Validierung fehlschlägt ausführen, wiederholen Sie die ganze Validierung nach entsprechend adressieren die Ursache des Fehlers.
2. Beispiel: Automatisierte Synthese von [18F] CFA für den klinischen Einsatz
- Vorbereiten der radiosynthesizer
- Schalten Sie die Radiosynthesizer.
- Stellen Sie sicher die Inertgaszufuhr mit ausreichendem Druck eingeschaltet ist und, dass die notwendigen Ventile geöffnet sind, so dass die Radiosynthesizer an die Gasversorgung angeschlossen ist.
- Installieren Sie neue Einweg-Kassetten in den Reaktor #1 und #2 Positionen und fügen Sie Reaktionsgefäßen mit magnetischen rühren Bars. Stellen Sie sicher, dass jede Kassette Transfer Tauchrohr gerade nach unten gerichtet ist.
- Bereiten Sie Reagenz Fläschchen vor und installieren Sie sie in die Kassetten entsprechend dem Diagramm in Abbildung 4.
- Installieren Sie ein leeres [18O] H2O Recovery Fläschchen in der W1 -Position der Kassette #1.
- Aktivieren eine quartären Methylammonium (QMA) Patrone zuerst vorbei 12 mL einer 1 M KHCO3 Lösung durch, gefolgt von 12 mL entionisiertem Wasser. Zustand einer Kieselsäure Sep-Pak-Patrone indem man 5 mL Ethylacetat durch sie.
- Schließen Sie die Patronen und machen Sie alle Schlauchverbindungen der Kassette zu, wie in Abbildung 5Adargestellt. Stellen Sie sicher, dass keine Kassette Schläuche (einschließlich ungenutzte Schlauch) im Innenraum hängt wo es Roboter Bewegungen stören können.
- Schließen Sie die Quellzeile [18F] Fluorid aus dem Zyklotron an [18F] Fluorid Eingabezeile auf Kassette #1.
- Stellen Sie sicher, dass der Behälter leer ist. Platz Abfall Linien vom Teilsystems Reinigung/Formulierung zu den Abfallbehälter (d.h., Probe 1 Abfälle Ringlinie, HPLC-Subsystem Abwasserlinie und Abfall Pumpenleitung Spritze).
- Schließen Sie die Eingangsleitungen HPLC. Ort HPLC mobilen Phase Eingang Linie "A" in einem Behälter mit 25 mM Ammoniumacetat und HPLC mobilen Phase Eingabezeile "B" in einen Behälter mit EtOH.
- Equilibrate Reinigung/Formulierung Subsystem und HPLC-Säule.
- Öffnen Sie die Control-Seite für die Reinigung/Formulierung-Modul in der Software durch HPLC im Hauptmenü (links oben) auswählen. Standardmäßig ist die Registerkarte " Reinigung " bereits ausgewählt. (Diese Seite ist in Abbildung 6dargestellt.)
- Die Durchflussmenge auf 5,0 mL/min bei definierten Lösungsmittel Komposition und wählen Sie die Spaltenposition die Reinigung Spalte in installiert ist. Schalten Sie die HPLC-Pumpe im isokratischen Modus mindestens 10 min lang.
- Spülen Sie die Produktlinie und alle Kollektionen der Bruch mit der mobilen Phase, jeweils für 1 min.
- Spülen Sie jedes Probenschleife HPLC und HPLC-Schleife Probentransfer Schläuche mit 10 mL der mobilen Phase mit einer Spritze aus.
- Reinigung/Formulierung Subsystem Spritze Pumpe ein-Leitungen anschließen. Verwendung konzentriert Natriumchlorid (90 mg/mL) für die Elute Linie und 0,9 % Kochsalzlösung für die Linie wiederherzustellen .
- Erstklassige Teilsystems Formulierung.
- Navigieren Sie zu der Registerkarte " Formulierung " die Reinigung/Formulierung-Control-Seite.
- Um die konzentrierte Natriumchlorid (90 mg/mL) prime, wählen Sie die Registerkarte " Elute " Presse zu initialisieren , die Spritzenpumpe zu initialisieren. 5 mL zu verzichten.
- Wählen Sie um 0,9 % Kochsalzlösung prime, rekonstruieren tab. verzichten 5 mL.
- Verbinden Sie die Produkt- und Endprodukt Linien von der Vorderseite des Teilsystems Reinigung/Formulierung in einen T-Anschluss. Verbinden Sie den Ausgang der T-Verbindung zu einem sterilen Filter (0,22 µm), die wiederum auf das Endprodukt sterile Fläschchen verbunden ist. Nadel Vent mit einem sterilen Filter in den Kopfraum des Endprodukts Fläschchen. Ein Foto von der letzten Systemkonfiguration ist in Abbildung 5 bgezeigt.
- Die Kühlfalle Trockeneis und EtOH oder MeOH hinzufügen.
- Das Sprachsynthese-Programm ausführen
- Navigieren Sie zu der Liste der Programme, indem Sie Sequenzen aus dem Hauptmenü-Taste (oben links). Wählen Sie [18F] CFA Programm und starten Sie das Programm durch Drücken der Schaltfläche " Ausführen ".
- Sorgfältig jedes Element auf der vor dem Rechenlauf Checkliste durchgehen Sie und Haken Sie sie ab, sobald sie fertiggestellt sind. Teil des Bildschirms vor dem Rechenlauf Checkliste ist in Abbildung 7dargestellt.
- Klicken Sie auf weiter zur Bestätigung, dass das Setup abgeschlossen ist, und dazu führen, dass die automatisierte Synthese zu beginnen.
- Auf Wunsch überwachen die Synthese in Echtzeit über visuelles Feedback (Reaktor-Kameras), Sensor-Werte (z. B. Temperatur, Druck, Vakuum, Strahlung lesen, etc.) und Countdown-Timer. Ein repräsentativer Screenshot ist in Abbildung 8dargestellt.
- Während der Reinigung Einheit Operation wählen Sie Produkt , wenn die Produkt-Gipfel begonnen hat, auf die Strahlung Detektor Chromatogramm erscheinen. Ein repräsentativer Screenshot während dieses Vorgangs Einheit (mit einem Chromatogramm der UV-Detektor und Strahlungsdetektor Ausgang) ist in Abbildung 9gezeigt.
- Sobald die Strahlung Detektor Chromatogramm Spitze zur Grundlinie zurückgekehrt ist, wählen Sie verschwenden den Fließweg des Teilsystems HPLC, Abfallbehälter abzulenken.
- Richten Sie ein und führen Sie das Programm der Formulierung
- Öffnen Sie aus der Liste der Programme (Sequenz -Bildschirm), die [18F] CFA Formulierung Programm.
- Passen Sie die Parameter der Formulierung Einheit Operation.
- Berechnen Sie das Volumen der erfassten Produkt Bruch (VBruchteil) basierend auf der HPLC-Pumpe-Volumenstrom und die Dauer der Bruchteil Collection.
- Berechnen Sie das Volumen der zusätzlichen Natriumchlorid (90 mg/mL) benötigt, um zu erreichen Isotonicity und berechnen die Höhe der zusätzlichen Kochsalzlösung erforderlich, die EtOH-Konzentration unter 10 % zu verdünnen.
- Ändern Sie das Programm mit diesen Werten. Das Volumen der Natrium-Chlorid (90 mg/mL) ist für den Elute Schritt eingegeben und das Volumen der Saline für rekonstruieren Schritt eingegeben. (Die Berechnungen sind im Zusatzmaterial, Abbildung S2beschrieben.)
- Speichern Sie das Programm.
- Führen Sie das Programm. Das System wird verdünnen den gesammelten gereinigtes Produkt Bruch mit Natriumchlorid und Kochsalzlösung, die Isotonicity der Formulierung zu gewährleisten und durch eine Sterilisation Filter in das Fläschchen steriles Produkt liefern.
- Sammeln formuliert [18F] CFA für Qualitätskontrolle und Versand
- Entfernen Sie das formulierte [18F] CFA-Produkt aus der heißen Zelle.
- Verwendung von sterilen Arbeitstechniken, zurückziehen Sie, zwei Proben (300 µL) zur Durchführung von Qualitätskontrollen.
- Verwenden Sie die erste Probe auf Sterilität der endgültigen Formulierung testen durch impfen Fluid Thioglykolat Medien- und tryptic Soja Brühe für 14d ohne kein Wachstum zu beobachten.
- Verwenden Sie die zweite Probe um Qualitätskontrolle nach den Verfahren in Schritt 1.3 entwickelt durchzuführen. An der UCLA Ahmanson biomedizinische Zyklotron Anlage gemäß der US-Pharmakopöe festgelegten Verfahren werden nachfolgend beschrieben.
- Bewerten Sie Erscheinungsbild durch visuelle Inspektion.
- Mit einem Indikatorpapier pH zu beurteilen.
- Bakteriellen Endotoxin-Inhalte mit einer kinetischen chromogenen bakteriellen Endotoxin Test (Einsatz) zu beurteilen.
- Bewerten Sie radiochemische Identität mit analytischen Radio-HPLC durch Co Elution der radioaktiven Probe und nicht radioaktiv Referenz Verbindung überprüfen.
- Bewerten Sie radiochemische Reinheit mit analytischen Radio-HPLC, indem Sie mit der AUC, das gewünschte Produkt entspricht der Fläche unter der Kurve (AUC) von radioaktiven Verunreinigungen in den Gamma-Detektor-Chromatogramm zu vergleichen.
- Bewerten Sie chemischen Reinheit mit analytischen HPLC durch die Bestimmung der AUC in der UV-Detektor-Chromatogramm alle UV-aktive Verunreinigungen.
- Bewerten Sie molare Aktivität und Träger Masse mit analytischen Radio-HPLC durch die Bestimmung der AUC, das gewünschte Produkt in der UV-Detektor-Chromatogramm entspricht.
- Die Halbwertszeit der Sonde durch Messung der Aktivität an zwei verschiedenen Zeitpunkten und Montage einer Karies-Kurve zu beurteilen.
- Bewerten Sie Lösungsmittel Restgehalt der Formulierung durch Gaschromatographie.
- Die Radionuklid-Energie mit einem Gamma-Spektrometer zu beurteilen.
- Die Cryptand 222-Inhalte mit einem TLC-spot Test zu bewerten.
- Wenn alle Tests erfolgreich verlaufen, lassen Sie die Sonde Formulierung für den Versand an die klinischen imaging Website.
- Nachlauf und System Herunterfahren
- Spülen Sie die HPLC-Reinigung-Säule und alle Schläuche für Produkt-Kollektion mit 70 % (V/V) EtOH in Wasser. Dies sollte PURE/Formular-Steuerelement auf der Seite Schritt 2.1.12 ähnlich.
- Herunterfahren der Radiosynthesizer über die Power -Taste auf die Software. Ein Popup-Fenster wird angezeigt, wenn die Stromversorgung des Systems deaktiviert werden kann.
- Schalten Sie die Druckluft und Inertgas liefert durch die Schließung der entsprechenden Absperrventile.
- Verbleibende Radioaktivität in die heisse Zelle (in der Regel über Nacht) verfallen lassen.
- Reinigen Sie die radiosynthesizer
- Entfernen Sie und entsorgen Sie alle Kassetten, Kartuschen, Reaktor Fläschchen und Reagenz Fläschchen während der Synthese verwendet.
- Leeren Sie den Inhalt der Kühlfalle.
- Reinigen Sie die Reinigung Subsystem flüssige Pfade.
- Öffnen Sie eine vorhandene Reinigungsprogramm oder erstellen Sie ein neues Programm enthält eine Reinigung Betrieb in Reinigung-Modus (d. h. mit dem Clean -Kontrollkästchen ausgewählt). Ergänzendes Material, Gestalt S9 ein Beispiel zu sehen.
- Auf der Konfigurationsseite Parameter wählen Sie die Spalte, die verwendet wurde, für die Reinigung und die HPLC mobilen Phase Eingabezeile, die an eine Flasche mit 70 % EtOH im Wasser. Programmieren eine Durchflussmenge von 2 mL/min, eine Spülung Dauer für jede Injektionsschleife von 5 min und eine Spülung Dauer für jedes Produkt und Bruchteil Leistung von 30 s. wählen Linien und Programmdauer von 30 s.
- Legen Sie alle Bruchteil-Line-Ausgänge in einem großen Abfallbehälter.
- Führen Sie das Programm.
- Entleeren Sie nach der Fertigstellung den Abfall Behälter.
- Reinigen Sie die Formulierung Subsystem flüssige Pfade.
- Öffnen Sie ein vorhandenes Programm oder erstellen Sie ein neues Programm enthält eine Formulierung Betrieb in Reinigung-Modus (d. h. mit dem Clean Kontrollkästchen ausgewählt unter der Registerkarte " Clean "). Ergänzendes Material, Abbildung S10 ein Beispiel zu sehen.
- Füllen Sie ein sauberes Verdünnung Reservoir (an der Vorderseite des Teilsystems Reinigung/Formulierung) mit 100 mL EtOH.
- Legen Sie die Reinigung/Formulierung Subsystem Elute Eingabezeile in eine EtOH-Stausee (mit > 50 mL EtOH).
- Platzieren Sie die spülen und rekonstruieren Eingangsleitungen in einem Abfallbehälter zusammen mit dem Endprodukt Schaltzeichen.
- Führen Sie das Programm.
- Entleeren Sie nach der Fertigstellung den Abfall Behälter.
Ergebnisse
Eine Methode, um die Produktion von [18F] automatisieren CFA wurde entwickelt und drei Validierung Chargen wurden synthetisiert. Synthese, Reinigung und Formulierung von [18F] CFA gelang in 90 ± 5 min (n = 3) und die nicht-Verfall-korrigierte radiochemische Ausbeute war 8.0 ± 1,4 % (n = 3). Die Aktivität Erträge der drei Läufe waren 3.24 GBq, 2,83 GBq und 3.12 GBq, ausgehend von 34,3 GBq, 41,8 GBq und 41,1 GBq bzw.. Die erhaltenen [18F] CFA Formulierungen bestanden alle Qualitätskontrollen (Tabelle 1). Das automatisierte Protokoll wird derzeit für die Herstellung von klinischen-Klasse [18F] CFA verwendet, um klinische Studien zu unterstützen.
| Qualitätskontrolle-Daten | Validierung-Lauf 1 | Laufen 2 Validierung | Laufen 3 Validierung |
| [Voraussetzung für "Pass"] | |||
| Aussehen | Pass | Pass | Pass |
| [klar, farblos, frei von Feinstaub] | |||
| Radioaktivität-Konzentration bei EOS | 213 MBq/mL | 210 MBq/mL | 180 MBq/mL |
| [≤ 740 MBq/mL @ EOS] | |||
| pH | 6 | 5.8 | 6 |
| [5.0-8.0] | |||
| Half-Life | 115 min. | 108 min. | 112 min. |
| [105 – 115 min.] | |||
| Radiochemische Reinheit | 99 % | 99 % | 99 % |
| [> 95 %] | |||
| Radiochemische Identität von relativen Retentionszeit (RRT) | 1.01 | 1.01 | 1.01 |
| [1,00 < RRT < 1.10] | |||
| Molaren Aktivität | 314 GBq/µmol | > 370 GBq/µmol | > 370 GBq/µmol |
| [≥ 3,7 GBq/µmol] | |||
| Gesamten Träger Masse im Endprodukt | 3.1 µg | < 1 µg | < 1 µg |
| [≤ 50 µg/Dosis] | |||
| Insgesamt Unreinheit Masse im Endprodukt | ND | ND | ND |
| [≤ 1 µg / Dosis] | |||
| Maximal zulässige Einspritzmenge basierend auf insgesamt Träger Masse ≤ 50 µg/Dosis und total Unreinheit Masse ≤ 1 µg/Dosis | Ganze Stapel | Ganze Stapel | Ganze Stapel |
| EtOH Restgehalt von GC | 8,90 % | 9,50 % | 9,60 % |
| [≤ 10 %] | |||
| EtOAc Restgehalt von GC | < 1 ppm | < 1 ppm | < 1 ppm |
| [≤ 5000 ppm] | |||
| MeCN Restgehalt von GC | < 1 ppm | < 1 ppm | < 1 ppm |
| [≤ 410 ppm] | |||
| Verbleibende K222 durch vor Ort Farbtest | Pass | Pass | Pass |
| [< 50 µg/mL] | |||
| Filter Membran Integritätstest | Pass | Pass | Pass |
| [Blase Punkt ≥ 50 Psi] | |||
| Bakterielle Endotoxine | Pass | Pass | Pass |
| [≤ 175 EU/Charge] | |||
| Radionuclidic Reinheit durch Gamma-Spektroskopie | Pass | Pass | Pass |
| [> 99,5 %] | |||
| Sterilität | Pass | Pass | Pass |
| [Anforderungen Sie USP < 71 >] |
Tabelle 1: Zusammenfassung für drei Validierung Chargen Qualitätskontrolle (QC) Testdaten. EOB = Ende der Bombardierung; EOS = Ende der Synthese; ND = nicht erkannt.
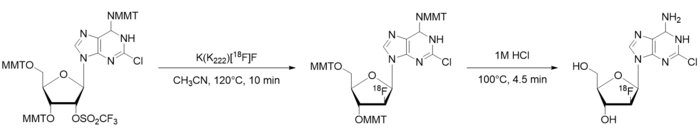
Abbildung 1: [18F] CFA Radiosynthese Schema. MMT = Monomethoxytrityl. Bitte klicken Sie hier für eine größere Version dieser Figur.
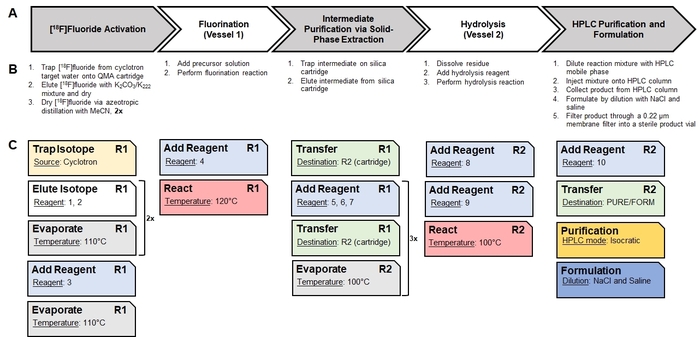
Abbildung 2: Übersetzung einer manuellen Synthese in eine automatische Abfolge von Grundoperationen. (A) dieser Bereich gibt einen Überblick über die grundlegenden Schritte bei der manuellen Synthese von [18F] CFA. (B) dieses Panel zeigt die grundlegenden Verfahren erforderlich, um die allgemeinen Schritte durchführen. (C) Radiosynthesizer-spezifische Grundoperationen verwendet, um die grundlegenden Verfahren durchzuführen sind als Karten angezeigt. Jeder Betrieb hat seinen eigenen Satz von Parameterwerten (als unterstrichen dargestellt), die über die Software konfiguriert sind. Die Notation "R1" und "R2" zeigen die Reaktionsgefäße #1 und #2, beziehungsweise. In Abbildung 4sind die Reagenzien entsprechend die Reagenz Zahlen identifiziert. Die Serie von Grundoperationen ist als eine Sequenz gespeichert und ausgeführt von der Software, die automatisierte Synthese durchzuführen. Bitte klicken Sie hier für eine größere Version dieser Figur.
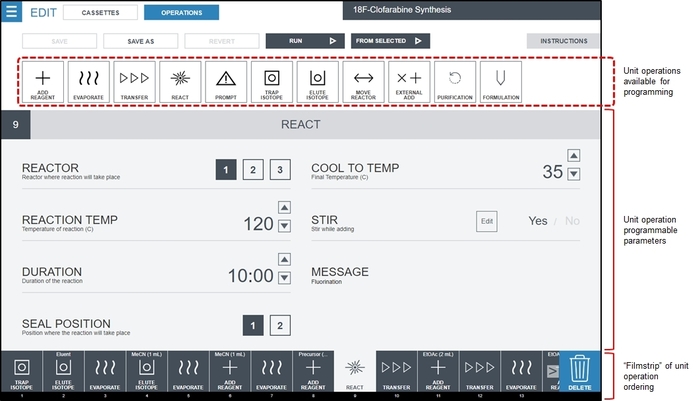
Abbildung 3: Screenshot von Radiosynthesizer (ELIXYS)-Software-Schnittstelle um eine Sprachsynthese-Programm zu erstellen. Grundoperationen werden in der gewünschten Reihenfolge im Filmstreifen mit einer Drag-and-Drop-Schnittstelle platziert. In diesem Screenshot ein reagieren Betrieb ausgewählt ist, und seine bearbeitbare Parameterwerte werden im Hauptteil des Bildschirms angezeigt. In diesem Beispiel wird die Fluorierung Reaktion im Reaktionsgefäß #1 (versiegelt) bei 120 ° C für 10 min mit aktiven Rühren durchgeführt werden. Das Schiff wird auf 35 ° C gekühlt werden, nach Ablauf der Reaktionszeit. Details der Parameterwerte, die für andere Grundoperationen programmiert werden können entnehmen Sie bitte dem Zusatzmaterial, Abschnitt 3. Bitte klicken Sie hier für eine größere Version dieser Figur.
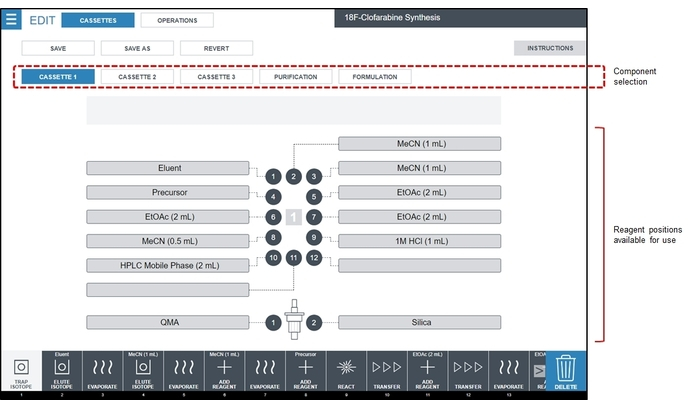
Abbildung 4: Screenshot des Bildschirms Reagenzien Konfiguration. Für die CFA-Synthesesequenz [18F] werden alle Reagenzien in Einweg-Kassette #1, geladen, die im Bereich Komponente Auswahl hervorgehoben angezeigt wird. Für die hier beschriebenen [18F] CFA Synthese Laufmittel ist 1,0 mg K2CO3 + 5,0 mg K222 in 0,4 mL H2O/0.5 mL MeCN, Vorläufer ist 6 mg des CFA Vorläufer in 0,6 mL MeCN und HPLC Mobile Phase ist 85:15 v / v 25 mM Ammonium Acetat: Ethanol. Bitte klicken Sie hier für eine größere Version dieser Figur.
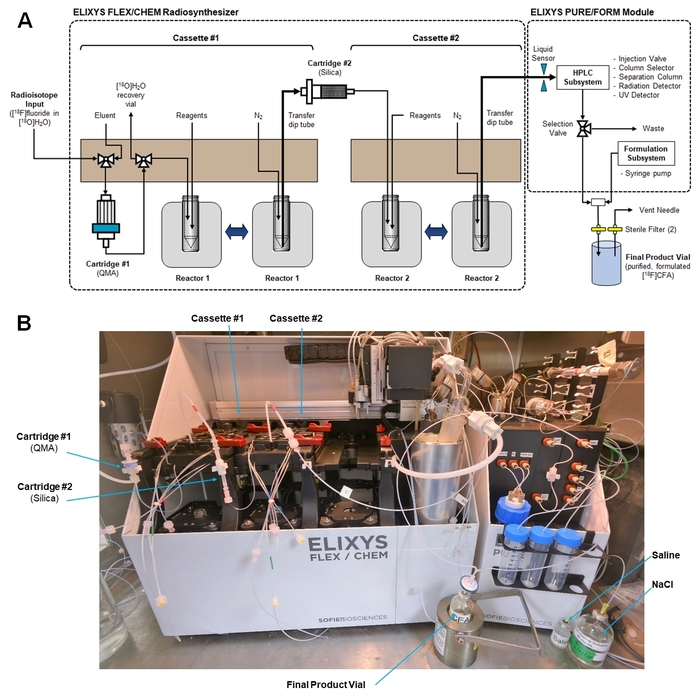
Abbildung 5: Radiosynthesizer Set-up für die Synthese von [18F] CFA. (A) Dies ist eine schematische Darstellung zeigt Kassette Fluid Wege, Verbindungen zu Patronen und die Verbindung übertragen Rohöl Endprodukt aus dem Radiosynthese-Modul das Modul Reinigung/Formulierung. (Beide Module sind mit einem einzigen Computer und Software-Schnittstelle gesteuert.) (B) Dies ist ein Foto von der Radiosynthesizer in einer heißen Zelle nach der Vorbereitung [18F] CFA Synthese. Bitte klicken Sie hier für eine größere Version dieser Figur.
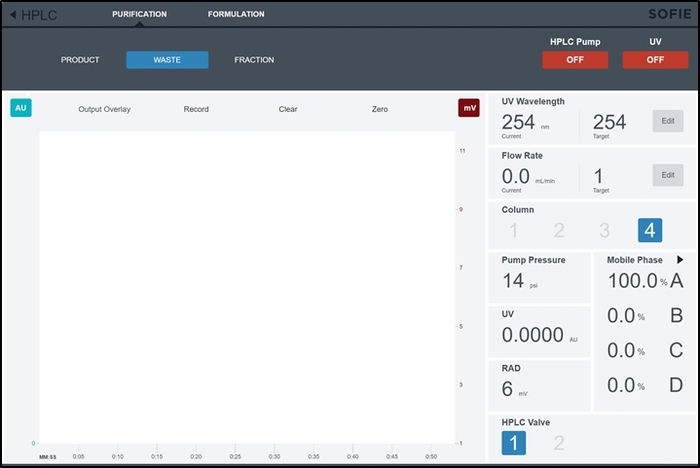
Abbildung 6: Screenshot von der Reinigung/Formulierung Modul Steuerschnittstelle. Dieser Bildschirm erfolgt durch den Betreiber der HPLC und Formulierung Subsysteme während der Synthese-Installation manuell zu steuern. Bitte klicken Sie hier für eine größere Version dieser Figur.
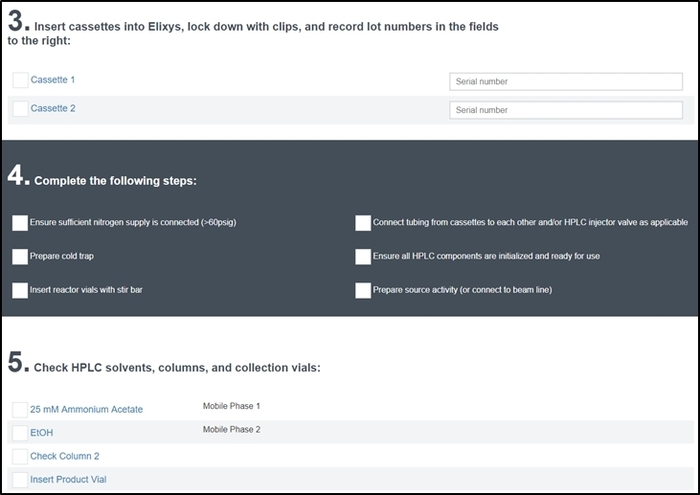
Abbildung 7: vor dem Rechenlauf Checkliste Bildschirm. Der Betreiber tritt die Seriennummer der Kassetten im System installiert und muss jedes Element zu gewährleisten, wurde das System richtig konfiguriert und bereit für die Synthese abhaken. Neben diesen Abschnitten der Bediener wird auch aufgefordert, einen Namen und eine Beschreibung der Synthese laufen (Abschnitt 1) und viel zahlen für alle verwendeten Reagenzien (Abschnitt 2) und wird aufgefordert, alle Reaktor-video-Feeds korrekt funktionieren zu überprüfen (Abschnitt 6). Bitte klicken Sie hier für eine größere Version dieser Figur.
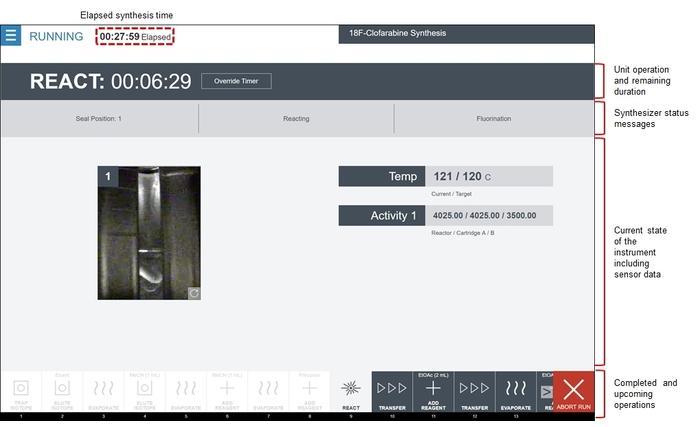
Abbildung 8: Screenshot der Software während der Ausführung der Synthesesequenz [18F] CFA Radiosynthesizer. Die Software zeigt die Reihenfolge der Grundoperationen im Bereich Filmstreifen. Abgeschlossene Vorgänge sind ausgegraut und weiß hervorgehoben, der aktuelle Vorgang ist grau unterlegt und anstehende Operationen sind in dunkelgrau dargestellt. Die mittleren Bereich des Bildschirms zeigt den Status der aktiven Einheit Operation, einschließlich dem Unterbefehl ausgeführt wird, sowie den aktuellen Systemstatus (Reaktor-video-Feeds und Sensor-Daten). Diese besondere reagieren Bedienung des Geräts ist die Fluorierung Reaktion. Im Bereich Temp zeigt die aktuelle Temperatur des Reaktors neben die Zieltemperatur (programmiert). Darunter zeigt das Tätigkeitsgebiet der Strahlung-Sensor-Werte der drei Sensoren der Reaktionsschritt zugeordnet. Schließlich zeigt eine Video-feed auf der linken Seite einen live-Blick auf das Reaktor-Fläschchen. Bitte klicken Sie hier für eine größere Version dieser Figur.
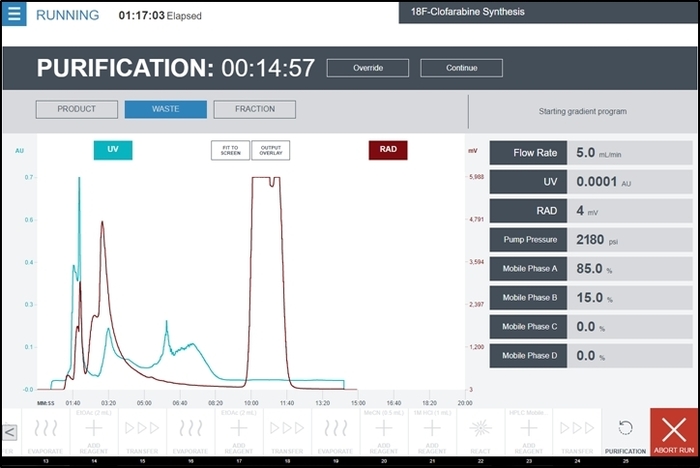
Abbildung 9: Screenshot der Radiosynthesizer Benutzeroberfläche während der Ausführung der Reinigung Betrieb während der Synthese [18F] CFA. Der UV-Detektor und Strahlungsdetektor Ausgänge des Moduls Reinigung/Formulierung auf der zentralen Grafik in Echtzeit angezeigt werden. Zusätzliches Feedback von den Detektoren und HPLC-Pumpe werden auf der rechten Seite des Bildschirms angezeigt. Der Betreiber sammelt die Produkt-Spitze vorübergehend Produktauswahl, wenn der Gipfel beginnt zu erscheinen und dann Zurückschalten auf Abfall , nachdem die komplette Spitze gesehen hat. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Dieses Protokoll definiert die grundlegenden Schritte, die für die Herstellung von klinischen Grade Tracer Formulierung zu erzielen bei der Automatisierung eines manuellen Synthese-Protokolls ergriffen werden sollten. Der gesamte Entwicklungszyklus, einschließlich Qualitätskontrolle Entwicklung wird durch die Radiotracer [18F] illustriert CFA (für die Bildgebung von dCK-Aktivität). Besondere Aufmerksamkeit wurde geachtet, ändern die automatisierte Synthese, der Tracer Eignung für den klinischen Einsatz. Die Synthese beinhaltet grundlegende Prozesse wie die Aktivierung von [18F] Fluorid, Radiofluorination der Vorläufer-Molekül, mittlere Patrone Reinigung, Schutz-Gruppe entfernen und semi-präparative HPLC-Reinigung und Formulierung für die Injektion. Diese grundlegenden Prozesse umfassen eine standard-Repertoire, das für die Synthese der großen Mehrheit von 18F-Label PET-Tracer ausreicht.
Beim Entwerfen der Synthesis, ist die Wahl von Reagenzien und Qualitätssicherung von besonderer Bedeutung für den klinischen Einsatz. Sicherstellung der korrekten Programmierung und korrekte Verbindungen durch Ausführen einer mock Synthesis (nur Lösungsmittel) ist zwingend notwendig, um unerwartete Fehler zu beseitigen, wenn die Synthese mit Radioaktivität durchgeführt wird. Die anschließende Synthese-Optimierungen (Lösungsmittel, Volumen, Mengen, Temperaturen, Reaktionszeiten und Reinigung Bedingungen) richten sich nach den speziellen PET-Tracer in der Entwicklung. Während dieser Experimente sollte besonderes Augenmerk auf die chemischen und radiochemische Reinheit des Endprodukts, das erreicht werden kann, glänzte werden, diese strenge Regeln für den klinischen Einsatz erfüllen müssen. Eine Synthese, die zuverlässig ein reines Produkt in niedriger aber ausreichender Aktivität Erträge produziert ist eine ertragreichere Prozess, der eine Gefahr für die sporadisch fehlschlagen hat in der Regel vorzuziehen. Sobald die Synthese ausreichend optimiert wurde, muss der letzte Prozess Validierungstests (eine regulatorische Anforderung), klinische Eignung unterziehen. Die validierten Synthese-Methode lässt dann die PET-Tracer für die klinische Anwendung zu produzieren. Wenn eine PET-Tracer nach einer validierten Methode synthetisieren, sollten den Standardarbeitsanweisungen sorgfältig befolgt werden. Zur Sicherstellung der Compliance ist die Software programmiert, der Betreiber der Abschluss der wichtigsten Schritte über eine vor dem Rechenlauf Checkliste nach einem Klick auf Ausführen , um die Synthese zu starten bestätigen. Während das System die Synthese in einer automatisierten Weise durchgeführt werden, erfordert die Reinigungsstufe manuellen Eingriffe. Der Betreiber muss daher die chromatographischen Bildschirm genau zu beobachten, während die HPLC Reinigungsstufe und manuell eingeben in Echtzeit, wann man starten und stoppen den Produkt-Bruch zu sammeln.
Innerhalb unserer Automatisierung und Optimierung Bemühungen für die CFA-Synthese [18F] haben wir die semi-präparative HPLC-Reinigung-Methode von der Produkt-Gemisch gestrafft, mit einem injizierbaren Lösungsmittel-System bestehend aus Ammonium-Acetat-Lösung und EtOH ; Unsere bisherigen Methode benötigt einen zusätzlichen Schritt, das Lösungsmittel nach Reinigung16auszutauschen. Die nachfolgende Formulierung zu verarbeiten, so muss nur verringern den EtOH-Inhalt der gesammelten Fraktion erlaubten Höchstwerte und seine Isotonicity zu gewährleisten, die durch Verdünnung erreicht werden können. Die Formulierung Schritt erfolgte mittels ein zweites Programm, bestehend aus einem Arbeitsgang Formulierung Einheit ermöglicht Variable Volumen Ergänzungen der NaCl-Lösungen der gereinigten Produkt Bruchteil über die Formulierung-Modul, um die Variable zu berücksichtigen Volumen nach HPLC-Reinigung erhalten. Die gesammelten Produktvolumen Bruchteil wurde eingestellt, stattdessen konstant zu sein, könnte die Formulierung Einheit Vorgang in die wichtigsten Sprachsynthese-Programm, vermeiden die Notwendigkeit für ein eigenständiges Programm einbezogen werden. Ein alternativer Ansatz zur manuellen Eingriff zu vermeiden wäre, die volle Funktionalität des Moduls Formulierung zu verwenden (z. B.die gereinigte Tracer mit Wasser zu verdünnen, Falle auf eine C18-Festphasen-Extraktion-Patrone, waschen Sie es, mit einem festen Volumen von EtOH eluieren und schließlich mit einem festen Volumen von Kochsalzlösung verdünnen).
Die Technik für die Automatisierung und Validierung ein Synthese-Protokoll für den klinischen Einsatz hier vorgestellten soll ziemlich allgemein sein. Durch die Wahl der Radiosynthesizer (ELIXYS) kann eine Vielzahl von Synthesen automatisiert und validiert werden. Dazu gehören komplexe 3-Topf-Synthesen oder Synthesen mit hohen Temperaturen von flüchtigen Lösungsmitteln. Optimierung einer Synthesis kann erreicht werden, indem die Parameter des Softwareprogramms. Der Synthesizer hat Eigenschaften, die Auswirkungen der Änderungen, z. B. Positionierung die Reaktionsgefäße für die Entfernung von Proben für die Radio-TLC oder Radio-HPLC Analyse zu überwachen. Ohne System-Modifikationen, das System derzeit nicht lässt, für den Umgang mit sehr niedrigen Reagenz Bände (~ 5-20 µL), Zwischenprodukt Destillation oder die Handhabung von [18F] AlF, 68Ga, oder andere Radiometals. Wenn die manuelle Synthese zu automatisierende solche Schritte enthält und sie können nicht umgangen werden, Automatisierung und-Validierung mit einer anderen Radiosynthesizer-Plattform können angebracht sein.
Obwohl diese Arbeit auf die Entwicklung eines Protokolls für die automatisierte Produktion von [18F] konzentriert hat CFA für den klinischen Einsatz, die Synthese von vielen anderen PET-Tracer konnte automatisiert werden in einer Weise, die geeignet für klinische Produktion, nach der gleichen Logik und Methoden. Im Anschluss an die hier vorgestellte Methode haben wir auch die automatisierte Synthese von 9-angepasst (4-[18F] Fluoro - 3-[macht] Butyl) Guanin ([18F] FHBG) und für den klinischen Einsatz validiert. Benutzer etablierte Protokolle können hochgeladen werden und von SOFIE Probe Network, ein Web-Portal für den Austausch von Syntheseprogramme heruntergeladen und verbundene Dokumentation unter verschiedenen Radiopharmazie Seiten27. Dies kann eine Doppelarbeit in der Gemeinschaft vermeiden und multizentrische klinische Studien mit PET-Bildgebung erleichtern.
Offenlegungen
Die Regenten von der University of California haben lizenzierte Technologie, SOFIE, die von Jeffrey Collins und R. Michael van Dam erfunden wurde und Eigenkapital in SOFIE im Rahmen der Lizenzierung Transaktion genommen haben. Darüber hinaus ist R. Michael van Dam, Gründer und Berater von SOFIE. Die Bedingungen dieser Vereinbarung haben überprüft und genehmigt von der University of California, Los Angeles gemäß ihrer Interessenkonflikt Politik wurde. Eric Schopf und Christopher Drake sind Mitarbeiter und Aktionäre von SOFIE.
Danksagungen
Diese Arbeit wurde teilweise durch das National Cancer Institute (R44 CA216539) und der UCLA-Stiftung aus einer Spende von Ralph und Marjorie Crump für das UCLA-Crump-Institut für molekulare Bildgebung unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| ELIXYS FLEX/CHEM | Sofie (Culver City, CA, USA) | 1010001 | Radiosynthesizer |
| Radiosynthesizer cassette | Sofie (Culver City, CA, USA) | 1861030400 | Cassette for ELIXYS FLEX/CHEM |
| ELIXYS PURE/FORM | Sofie (Culver City, CA, USA) | 1510001 | Radiosynthesizer purification module |
| [O-18]H2O | IBA RadioPharma Solutions (Reston, VA, USA) | IBA.SP.065 | >90% isotopic purity |
| [F-18]fluoride in [O-18]H2O | UCLA | N/A | Produced in a cyclotron (RDS-112; Siemens; Knoxville, TN, USA) by the (p,n) reaction of [O-18]H2O. Bombardment at 11 MeV using a 1 mL tantalum target with havar foil. |
| Deionized water | UCLA | N/A | Purified to 18 MΩ and passed through 0.1 µm filter |
| Acetonitrile (MeCN) | Sigma-Aldrich (St. Louis, MO, USA) | 271004 | Anhydrous, 99.8% |
| Ethanol (EtOH) | Decon Laboratories, Inc. (King of Prussia, PA, USA) | 2701 | Anhydrous, 200 proof |
| Sodium hydroxide (NaOH) solution | Merck (Burlington, MA, USA) | 1.09137.1000 | 1M solution |
| Hydrochloric acid (HCl) solution | Fisher Chemical (Hampton, NH, USA) | SA48-500 | 1M solution |
| Ethyl acetate (EtAc) | Fisher Chemical (Hampton, NH, USA) | E195SK-4 | HPLC grade |
| Sodium chloride (NaCl) | Fisher Chemical (Hampton, NH, USA) | S-640-500 | USP grade |
| Ammonium acetate | Fisher Chemical (Hampton, NH, USA) | A639-500 | HPLC grade |
| Potassium carbonate (K2CO3) | Fisher Chemical (Hampton, NH, USA) | P-208-500 | Certified ACS |
| CFA precursor | CalChem Synthesis (San Diego, CA, USA) | N/A | Custom synthesis |
| Cryptand 222 (K222; Kryptofix 2.2.2) | ABX Advanced Biochemical Compounds (Radeberg, Germany) | 800.1000 | >99% |
| Sodium chloride (NaCl) solution (saline) | Hospira (Lake Forest, IL, USA) | 0409-4888-02 | 0.9%, for injection, USP grade |
| Silica cartridge | Waters (Milford, MA, USA) | WAT051900 | Sep-pak Classic |
| Quaternary methylammonium (QMA) cartridge | Waters (Milford, MA, USA) | WAT023525 | Sep-pak Light Plus |
| Sterile syringe filter (0.22 µm) | Millipore Sigma (Burlington, MA, USA) | SLGSV255F | Millex-GV |
| Glass V-vial (5 mL) | Wheaton (Millville, NJ) | W986259NG | Used for reaction vessels |
| Septa | Wheaton (Millville, NJ) | 224100-072 | Used for reagent vials |
| Crimp cap | Wheaton (Millville, NJ) | 224177-01 | Used for reagent vials |
| Amber serum vial (2 mL) | Voigt (Lawrence, KS, USA) | 62413P-2 | Used for reagent vials |
| Magnetic stir bar | Fisher Scientific (Hampton, NH, USA) | 14-513-65 | Used for reaction vessels |
Referenzen
- Phelps, M. E. Positron emission tomography provides molecular imaging of biological processes. Proceedings of the National Academy of Sciences. 97 (16), 9226-9233 (2000).
- Kitson, S., Cuccurullo, V., Ciarmiello, A., Salvo, D., Mansi, L. Clinical Applications of Positron Emission Tomography (PET) Imaging in Medicine: Oncology, Brain Diseases and Cardiology. Current Radiopharmaceuticalse. 2 (4), 224-253 (2009).
- Sengupta, D., Pratx, G. Imaging metabolic heterogeneity in cancer. Molecular Cancer. 15, 4 (2016).
- Rabinovich, B. A., Radu, C. G. Imaging Adoptive Cell Transfer Based Cancer Immunotherapy. Current Pharmaceutical Biotechnology. 11 (6), 672-684 (2010).
- Matthews, P. M., Rabiner, E. A., Passchier, J., Gunn, R. N. Positron emission tomography molecular imaging for drug development. British Journal of Clinical Pharmacology. 73 (2), 175-186 (2012).
- Hargreaves, R. The Role of Molecular Imaging in Drug Discovery and Development. Clinical Pharmacology & Therapeutics. 83 (2), 349-353 (2008).
- Keng, P. Y., Esterby, M., van Dam, R. M., Hsieh, C. -. H. Emerging Technologies for Decentralized Production of PET Tracers. Positron Emission Tomography - Current Clinical and Research Aspects. , 153-182 (2012).
- Lazari, M., Irribarren, J., Zhang, S., van Dam, R. M. Understanding temperatures and pressures during short radiochemical reactions. Applied Radiation and Isotopes. , 82-91 (2016).
- Lazari, M., et al. ELIXYS - a fully automated, three-reactor high-pressure radiosynthesizer for development and routine production of diverse PET tracers. European Journal of Nuclear Medicine and Molecular Imaging (EJNMMI) Research. 3 (1), 52 (2013).
- Claggett, S. B., Quinn, K., Lazari, M., Esterby, J., Esterby, M., van Dam, R. M. A new paradigm for programming and controlling automated radiosynthesizer. Journal of Nuclear Medicine. 53 (suppl. 1), 1471-1471 (2012).
- Claggett, S. B., Quinn, K. M., Lazari, M., Moore, M. D., van Dam, R. M. Simplified programming and control of automated radiosynthesizers through unit operations. European Journal of Nuclear Medicine and Molecular Imaging (EJNMMI) Research. 3, 53 (2013).
- Lazari, M., et al. Fully Automated Production of Diverse 18F-Labeled PET Tracers on the ELIXYS Multireactor Radiosynthesizer Without Hardware Modification. Journal of Nuclear Medicine Technology. 42 (3), 203-210 (2014).
- Lazari, M., et al. Fully-automated synthesis of 16β-18F-fluoro-5α-dihydrotestosterone (FDHT) on the ELIXYS radiosynthesizer. Applied Radiation and Isotopes. 103, 9-14 (2015).
- Collins, J., et al. Production of diverse PET probes with limited resources: 24 18F-labeled compounds prepared with a single radiosynthesizer. Proceedings of the National Academy of Sciences. 114 (43), 11309-11314 (2017).
- Drake, C., et al. Enzymatic Radiofluorination of Biomolecules: Development and Automation of Second Generation Prosthetic on ELIXYS Radiosynthesizer. Journal of Nuclear Medicine. 58 (supplement 1), 1 (2017).
- Gobbi, L. C., et al. Identification of Three Novel Radiotracers for Imaging Aggregated Tau in Alzheimer's Disease with Positron Emission Tomography. Journal of Medicinal Chemistry. 60 (17), 7350-7370 (2017).
- Ippisch, R., Maraglia, B., Sutcliffe, J. Automated production of [18F]-F-Py-peptides. Journal of Nuclear Medicine. 57, 275 (2016).
- Chen, H., et al. AMG 580: A Novel Small Molecule Phosphodiesterase 10A (PDE10A) Positron Emission Tomography Tracer. Journal of Pharmacology and Experimental Therapeutics. 352 (2), 327-337 (2015).
- Waldmann, C. M., et al. An Automated Multidose Synthesis of the Potentiometric PET Probe 4-[18F]Fluorobenzyl-Triphenylphosphonium ([18F]FBnTP). Molecular Imaging and Biology. 20 (2), 205-212 (2018).
- Ravert, H. T., et al. An improved synthesis of the radiolabeled prostate-specific membrane antigen inhibitor, [18F]DCFPyL. Journal of Labelled Compounds and Radiopharmaceuticals. 59 (11), 439-450 (2016).
- Betthauser, T. J., et al. Characterization of the radiosynthesis and purification of [18F]THK-5351, a PET ligand for neurofibrillary tau. Applied Radiation and Isotopes. 130, 230-237 (2017).
- Shu, C. J., et al. Novel PET probes specific for deoxycytidine kinase. Journal of Nuclear Medicine. 51 (7), 1092-1098 (2010).
- Kim, W., et al. [18F]CFA as a clinically translatable probe for PET imaging of deoxycytidine kinase activity. Proceedings of the National Academy of Sciences. 113 (15), 4027-4032 (2016).
- Barrio, M. J., et al. Human Biodistribution and Radiation Dosimetry of 18F-Clofarabine, a PET Probe Targeting the Deoxyribonucleoside Salvage Pathway. Journal of Nuclear Medicine. 58 (3), 374-378 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten