Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
O-Kresol-Konzentration Online-Messung basierend auf Nahinfrarot-Spektroskopie über partielle kleinste quadratische Regression
In diesem Artikel
Zusammenfassung
Das Protokoll beschreibt eine Methode zur Vorhersage der O-Kresol-Konzentration während der Produktion von Polyphenylenether mittels Nahinfrarotspektroskopie und partieller Regression der kleinsten Quadrate. Um den Prozess klarer und vollständiger zu beschreiben, wird ein Beispiel für die Vorhersage der O-Kresol-Konzentration während der Produktion von Polyphenylen verwendet, um die Schritte zu klären.
Zusammenfassung
Im Gegensatz zu makroskopischen Prozessvariablen liefert die Nahinfrarotspektroskopie Prozessinformationen auf molekularer Ebene und kann die Vorhersage der Komponenten in industriellen Prozessen deutlich verbessern. Die Fähigkeit, Spektren für feste und flüssige Proben ohne Vorbehandlung aufzuzeichnen, ist vorteilhaft und das Verfahren ist weit verbreitet. Zu den Nachteilen der Analyse hochdimensionaler Nahinfrarot-Spektraldaten gehören jedoch Informationsredundanz und Multikollinearität der Spektraldaten. Daher schlagen wir vor, partielle Regressionsmethode für kleinste Quadrate zu verwenden, die traditionell verwendet wurde, um die Datendimensionalität zu reduzieren und die Kollinearität zwischen den ursprünglichen Features zu beseitigen. Wir implementieren die Methode zur Vorhersage der O-Kresol-Konzentration bei der Herstellung von Polyphenylenether. Der vorgeschlagene Ansatz bietet die folgenden Vorteile gegenüber Komponentenregressionsvorhersagemethoden: 1) Die partielle Regression der kleinsten Quadrate löst das Multikollinearitätsproblem der unabhängigen Variablen und vermeidet effektiv eine Überanpassung, die in einem Regressionsanalyse aufgrund der hohen Korrelation zwischen den unabhängigen Variablen; 2) Die Verwendung der Nahinfrarotspektren führt zu hoher Genauigkeit, da es sich um eine zerstörungsfreie und umweltverschmutzende Methode handelt, um Informationen in mikroskopischen und molekularen Maßstäben zu erhalten.
Einleitung
Die Nahinfrarotspektroskopie (NIRS) hat sich als schnelle, effiziente, zerstörungsfreie und umweltschädliche moderne Analysetechnologie durchgesetzt; Das Verfahren wurde in den letzten Jahren zur Produktqualitätserkennung und -analyse sowie zur Messung chemischer Komponenten in industriellen Prozessen eingesetzt. Die wichtigste Spezialität der Methode ist ihre Fähigkeit, Spektren für feste und flüssige Proben ohne Vorverarbeitung aufzuzeichnen, was NIRS besonders für die direkte und schnelle Detektion und Analyse natürlicher und synthetischerProdukte1,2. Im Gegensatz zu herkömmlichen Sensoren, die Prozessvariablen (z. B. Temperatur, Druck, Flüssigkeitsstand usw.) im makroskopischen Maßstab messen und unweigerlich äußere Geräusche und Hintergrundstörungen erleiden, erkennt NIRS die strukturellen Informationen der chemischen Zusammensetzung in mikroskopischen und molekularen Maßstäben. So können wesentliche Informationen genauer und effektiver gemessen werden als mit anderen Methoden3,4.
Polyphenylether, als einer der technischen Kunststoffe, sind weit verbreitet aufgrund seiner Hitzebeständigkeit, Flammschutzmittel, Isolierung, elektrische Eigenschaften, Dimensionsstabilität, Schlagfestigkeit, Kriechfestigkeit, mechanische Festigkeit und andere Eigenschaften5. Noch wichtiger ist, dass es ungiftig und harmlos im Vergleich zu anderen technischen Kunststoffen ist. Derzeit ist 2,6-Xylol einer der Grundrohstoffe für die Synthese von Polyphenylenether, und es wird in der Regel durch katalysierte Alkylielung von Phenol mit Methanol-Methode6hergestellt. Es gibt zwei Hauptprodukte dieser Zubereitungsmethode, O-Cresol und 2,6-Xylol. Nach einer Reihe von Trenn- und Extraktionsschritten wird 2,6 Xylol zur Herstellung von Polyphenylenether verwendet. Spuren von O-Kresol verbleiben jedoch in 2,6-Xylol. O-Kresol beteiligt sich nicht an der Synthese von Polyphenylenether und verbleibt im Polyphenylenetherprodukt, was zu einer Abnahme der Produktqualität oder sogar des Unterstandards führt. Derzeit analysieren die meisten Unternehmen noch die Zusammensetzungen komplexer organischer Gemische wie flüssige Phasenpolyphenyletherprodukte, die Verunreinigungen (z. B. O-Kresol) enthalten, durch physikalische oder chemische Trennanalyse wie Chromatographie7,8. Das Trennungsprinzip der Chromatographie ist die Verwendung des Mischungsders von Kompositionen in der festen Phase und der Strömungsphase in der Auflösung, Analyse, Adsorption, Desorption oder anderen Affinität der geringfügigen Leistungsunterschiede. Wenn sich die beiden Phasen relativ zueinander bewegen, werden die Kompositionen in den beiden Phasen wiederholt durch die oben genannten Aktionen getrennt. Je nach Objekt dauert es in der Regel einige Minuten bis ein paar Dutzend Minuten, um eine komplexe Materialtrennung abzuschließen. Es zeigt sich, dass die Messeffizienz gering ist.
Heute ist die Messung der Produktqualität und die fortschrittliche Steuerungstechnik auf Basis dieser Analyse für die moderne Feinprozesschemieindustrie die schlüsselfertige Richtung, um die Produktqualität weiter zu verbessern. In der Prozessindustrie der Polyphenyletherproduktion ist die Echtzeitmessung des O-Kresolgehalts in Polyphenylenether von großer Entwicklungsbedeutung. Chromatographische Analysen können eindeutig nicht den Anforderungen fortschrittlicher Steuerungstechnik für die Echtzeitmessung von Stoffen und Signalrückmeldungen gerecht werden. Daher schlagen wir die partielle Regressionsmethode (PLSR) vor, um ein lineares Modell zwischen den NIRS-Daten und der O-Kresol-Konzentration zu erstellen, die die Online-Messung des O-Kresol-Gehalts im flüssigen Polyphenylenetherprodukt des Auslaufs realisieren. .
Die Vorverarbeitung für NIRS spielt vor der multivariaten statistischen Modellierung die wichtigste Rolle. NIRS-Wellenzahlen im NIR-Spektrum und die Partikelgrößen biologischer Proben sind vergleichbar, so dass sie für unerwartete Streueffekte bekannt sind, die Einfluss auf die aufgezeichneten Probenspektren haben. Durch die Durchführung geeigneter Vorverarbeitungsmethoden lassen sich diese Effekte leicht weitgehend eliminieren9. Die am häufigsten verwendeten Vorverarbeitungstechniken in NIRS werden als Streuungskorrektur- und Spektralderivate-Methoden kategorisiert. Die erste Gruppe von Methoden umfasst multiplikative Streuungskorrektur, Detrending, normale Standard-Variattransformationen und Normalisierung. Die spektralen Ableitungsmethoden umfassen die Verwendung des ersten und zweiten Derivats.
Vor der Entwicklung eines quantitativen Regressionsmodells ist es wichtig, die unsystematischen Streuungsvariationen aus den NIRS-Daten zu entfernen, da sie einen erheblichen Einfluss auf die Genauigkeit des Vorhersagemodells, seine Komplexität und Parsimonie haben. Die Auswahl einer geeigneten Vorverarbeitungsmethode sollte immer vom nachfolgenden Modellierungsschritt abhängen. Wenn der NIR-Spektraldatensatz nicht dem Lambert-Bier-Gesetz folgt, kompensieren andere Faktoren das nicht ideale Verhalten der Vorhersage für vorhergesagte Komponenten. Der Nachteil, dass solche unnötigen Faktoren existieren, führt zu einer Zunahme der Modellkomplexität, selbst wahrscheinlich erweise zu einer Verringerung der Robustheit. Daher ist die Anwendung von Spektralderivaten und eine konventionelle Normalisierung auf die Spektraldaten ein wesentlicher Bestandteil der Methode.
Nach der spektralen Vorverarbeitung werden die NIRS-Daten mit einem hohen Signal-Rausch-Verhältnis und geringen Hintergrundstörungen ermittelt. Die moderne NIRS-Analyse ermöglicht die schnelle Erfassung großer Absorptionsmengen über einen geeigneten Spektralbereich. Die chemische Zusammensetzung der Probe wird dann durch Extraktion der relevanten Variablen unter Verwendung der in der Spektralkurve enthaltenen Informationen vorhergesagt. Im Allgemeinen wird NIRS mit multivariaten Analysetechniken für qualitative oder quantitative Analysen10kombiniert. Eine multivariate lineare Regressionsanalyse (MLR) wird häufig für die Entwicklung und Mining der mathematischen Beziehung zwischen den Daten und den Komponenten in industriellen Prozessen verwendet und wurde in der NIRS-Analyse weit verbreitet.
Bei der Implementierung eines MLR für vorverarbeitete NIRS-Daten gibt es jedoch zwei grundlegende Probleme. Ein Problem ist die variable Redundanz. Die hohe Dimensionalität der NIRS-Daten macht die Vorhersage einer abhängigen Variablen oft unzuverlässig, da Variablen enthalten sind, die keine Korrelation mit den Komponenten aufweisen. Diese redundanten Variablen reduzieren die Informationseffizienz der Spektraldaten und beeinflussen die Genauigkeit des Modells. Um die variable Redundanz zu eliminieren, ist es wichtig, die Korrelation zwischen den NIRS-Daten und den vorhergesagten Komponenten zu entwickeln und zu maximieren.
Ein weiteres Problem ist die Frage der Multikollinearität in den NIRS-Daten. Eine der wichtigen Annahmen mehrerer linearer Regressionsmodelle ist, dass es keine lineare Beziehung zwischen einer der erklärenden Variablen des Regressionsmodells gibt. Wenn diese lineare Beziehung besteht, wird nachgewiesen, dass das lineare Regressionsmodell multikollinear ist und die Annahme verletzt wird. Bei mehreren linearen Regressionen, z. B. einer gewöhnlichen Regression der kleinsten Quadrate (OLSR), wirken sich mehrere Korrelationen zwischen den Variablen auf die Parameterschätzung aus, erhöhen den Modellfehler und beeinflussen die Stabilität des Modells. Um die multilineare Korrelation zwischen den NIR-Spektraldaten zu eliminieren, verwenden wir variable Selektionsmethoden, die die inhärente Variabilität der Samples maximieren.
Hier schlagen wir vor, die PLSR zu verwenden, die eine Verallgemeinerung der multiplen linearen Regression ist, die im Bereich von NIRS11,12weit verbreitet ist. Die PLSR integriert die Grundfunktionen der MLR, der kanonischen Korrelationsanalyse (CCA) und der Hauptkomponentenanalyse (PCA) und kombiniert die Prognoseanalyse mit einer nicht modellalen Datenkonnotationsanalyse. Die PLSR kann in zwei Teile unterteilt werden. Der erste Teil wählt die Komponenten der Merkmalsvariablen und die vorhergesagten Komponenten durch partielle Analyse der kleinsten Quadrate (PLS) aus. PLS maximiert die inhärente Variabilität der Hauptkomponenten, indem die Kovarianz der Hauptkomponenten und vorhergesagten Komponenten beim Extrahieren der Hauptkomponenten so groß wie möglich wird. Als nächstes wird das OLSR-Modell der O-Kresolkonzentration für die ausgewählten Hauptkomponenten festgelegt. PLSR eignet sich zur Analyse von lauten Daten mit zahlreichen unabhängigen Variablen, die stark kollinear und stark korreliert sind, sowie zur gleichzeitigen Modellierung mehrerer Antwortvariablen. Außerdem extrahiert PLSR die effektiven Informationen der Probenspektren, überwindet das Problem der Multikollinearität und hat die Vorteile einer starken Stabilität und hohen Vorhersagegenauigkeit13,14.
Das folgende Protokoll beschreibt den Prozess der Verwendung des PLSR-Modells zur Messung der O-Kresol-Konzentration mit NIR-Spektraldaten. Die Zuverlässigkeit und Genauigkeit des Modells werden quantitativ anhand des Bestimmungskoeffizienten ( ), des Vorhersagekorrelationskoeffizienten (
anhand des Bestimmungskoeffizienten ( ), des Vorhersagekorrelationskoeffizienten (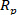 ) und des mittleren quadratischen Vorhersagefehlers der Kreuzvalidierung (MSPECV) bewertet. Um die Vorteile der PLSR intuitiv aufzuzeigen, werden die Auswertungsindikatoren in mehreren Diagrammen für eine qualitative Analyse visualisiert. Schließlich werden Die Auswertungsindikatoren eines Experiments im Tabellenformat dargestellt, um die Zuverlässigkeit und Genauigkeit des PLSR-Modells quantitativ zu veranschaulichen.
) und des mittleren quadratischen Vorhersagefehlers der Kreuzvalidierung (MSPECV) bewertet. Um die Vorteile der PLSR intuitiv aufzuzeigen, werden die Auswertungsindikatoren in mehreren Diagrammen für eine qualitative Analyse visualisiert. Schließlich werden Die Auswertungsindikatoren eines Experiments im Tabellenformat dargestellt, um die Zuverlässigkeit und Genauigkeit des PLSR-Modells quantitativ zu veranschaulichen.
Protokoll
1. NIR-Spektrum-Datenerfassung mit Fourier transform (FT)-NIR Prozessspektrometer
- Installieren Sie die flüssige Phasen-Lichtwellenleitersonde des Nahinfrarotspektrometers am Ausgang des Polyphenyletherprodukts. Und öffnen Sie die OPUS-Software auf dem oberen Computer, der mit dem Gerät verbunden ist, und beginnen Sie mit der Konfiguration der Messung.
- Anschließen an Spektrometer
- Wählen Sie im Menü Messen den Befehl Optisches Setup und Dienst aus, oder klicken Sie auf das Symbol in der Symbolleiste.
- Klicken Sie im geöffneten Dialogfeld auf die Registerkarte Optical Bench .
- Überprüfen Sie, ob die Einstellungen des Spektrometers in Ordnung sind. Wenn ja, schließen Sie das Dialogfeld. Wenn nein, fahren Sie mit Schritt 4 fort.
- Wählen Sie in der Dropdown-Liste Konfiguration den jeweiligen Spektrometertyp aus.
- Geben Sie die IP-Adresse des Spektrometers in das URL-Eingabefeld "Optical Bench" ein.
- Klicken Sie auf die Schaltfläche Verbinden.
- Einrichten von Messparametern
- Wählen Sie im Menü Messen den Befehl Messen aus, oder klicken Sie auf das Symbol in der Symbolleiste.
- Definieren Sie im geöffneten Dialog die Messparameter auf den verschiedenen Registerkarten.
HINWEIS: Details zu den einzelnen Messparametern sind im OPUS-Referenzhandbuch beschrieben. - Klicken Sie auf die Schaltfläche Akzeptieren & Beenden.
- Speichern der Experimentdatei
- Wählen Sie im Menü Messen den Befehl Erweiterte Messung aus. Klicken Sie dann auf die Registerkarte Erweitert.
- Definieren Sie im geöffneten Dialog die Auflösung als 4 cm-1.
- Definieren Sie die Anzahl der Scans als 16 Scans in den Eingabefeldern Sample/Background Scan Time.
- Definieren Sie den Pfad, um die Messdaten automatisch von 4.000 cm-1-12.500 cm-1 zuspeichern.
- Bestimmen Sie den Datentyp für das Ergebnisspektrum als Absorption.
- Klicken Sie auf die Schaltfläche Speichern.
- Definieren Sie in dem geöffneten Dialogfeld einen Namen für die Experimentdatei, und speichern Sie diesen Namen.
- Messung des Hintergrundspektrums
- Wählen Sie im Menü Messen den Befehl Erweiterte Messung aus.
- Klicken Sie auf die Registerkarte "Optik".
- Klicken Sie im geöffneten Dialogfeld auf die Dropdown-Liste der Option "Aperture", und wählen Sie denselben Wert aus, der zum Abrufen eines Stichprobenspektrums verwendet wird.
- Klicken Sie auf die Registerkarte Basic.
- Klicken Sie im geöffneten Dialogfeld auf die Schaltfläche Hintergrund für den einzelnen Kanal.
- Messung des Probenspektrums
- Legen Sie die Probe in den optischen Pfad des Spektrometers. Die Art und Weise, wie dies geschieht, hängt von der Konfiguration des Spektrometers ab.
- Wählen Sie im Menü Messen den Befehl Erweiterte Messung aus.
- Klicken Sie auf die Registerkarte Basic.
- Definieren Sie in dem geöffneten Dialogfeld die Beispielbeschreibung und das Beispielformular im jeweiligen Eingabefeld. Diese Informationen werden zusammen mit dem Spektrum gespeichert.
- Klicken Sie auf die Schaltfläche Einkanalbeispiel, um die Onlinemessung zu starten. Und speichern Sie das NIR-Spektrum jedes Scans als OPUS-Datei.
- Sammeln Sie die Polyphenylenproben alle 6 h und testen Sie die O-Kresol-Konzentration mit Flüssigchromatographie im Labor der Industrie, um einen chemischen Referenzwert zu erhalten.
ANMERKUNG: Labormitarbeiter der Industrie nehmen jede Polyphenyletherprobe aus dem Auslass des flüssigen Phasenpolyphenylethers. Der O-Kresolgehalt in jeder Probe wurde dreimal durch Flüssigkeitschromatographie gemessen. Dann wurde der Mittelwert der Ergebnisse der dreifachen Analyse als Referenzwert des O-Cresol-Gehalts genommen, um den versehentlichen Fehler zu reduzieren. - Erhalten Sie 600 chemische Referenzwerte der O-Kresol-Konzentration im Labor. Der Kalibrierbereich der O-Kresol-Konzentration reicht von 42,1063 mg/1 g Polyphenylether-Produkt bis 51,6763 mg/1 g Polyphenylether-Produkt.
- Kombinieren Sie die NIR-Spektren zu den angegebenen Prüfzeiten mit den chemischen Referenzwerten der O-Kresol-Konzentration.
- Verwenden Sie die Software OPUS, um den ursprünglichen Spektralsatz zu lesen, wie in Abbildung 1dargestellt.
- Klicken Sie im Menü Datei auf den Befehl Datei laden.
- Wählen Sie im geöffneten Dialog die jeweilige Spektrumdatei aus.
- Klicken Sie auf die Schaltfläche Öffnen. Das Spektrum wird im Spektrumfenster angezeigt.
2. NIR-Spektroskopiedaten vorverarbeitung
- Mit der spektralen Vorverarbeitungsfunktion erhalten Sie spektrale Datensätze, die mit der Ableitung erster Ordnung vorverarbeitet werden.
- Öffnen Sie Den Unscrambler, bei dem es sich um eine multivariate Datenanalyse- und experimentelle Entwurfssoftware handelt, wählen Sie den Befehl Importieren unter Dateiaus. Importieren Sie die OPUS-Datei als ursprüngliches NIR-Spektral-Dataset.
- Wählen Sie Unter Ändernden Befehl Transformieren aus. Und wählen Sie die Savitzky Golay Derivate unter Derivate.
- Definieren Sie die Samples und Variablen als Alle Samples und Alle Variablen im Bereich. Und definieren Sie die Anzahl der Glättungspunkte als 13 und das Derivat als 1St Derivat in Parametern.
- Klicken Sie auf OK, um die Ableitung zu starten.
VORSICHT: Die Erhöhung der Glätte kann die starken Schwankungen der Kurve reduzieren, den Rauscheffekt reduzieren, aber auch die Eigenschaften der Kurve schwächen und die Kurve verzerren. Daher wird die entsprechende Glätte entsprechend der Beobachtung der tatsächlichen Schwankungsintensität der Kurve und des Effekts nach der Verarbeitung ausgewählt.
- Führen Sie eine Vektornormalisierung der Probenspektren durch, um den Wert der Absorption zu normalisieren.
- Wählen Sie den Befehl Normalisierung unter Ändernaus.
- Definieren Sie die Samples und Variablen als Alle Samples und Alle Variablen im Bereich.
- Wählen Sie Vektornormalisierung im Typ aus.
- Klicken Sie auf OK, um die Vektornormalisierung durchzuführen.
3. Erstellung des PLSR-Modells
- Erstellung des NIR-Spektraldatensatzes
- Öffnen Sie Uncrambler. exe, wählen Sie Unter Datei mit den Matlab-Dateien exportieren aus, um den vorverarbeiteten Spektraldatensatz in .mat File zu exportieren und den Spektraldatensatz X automatisch mit 2203 Variablen zu erhalten.
- Erhalten Sie ein vollständiges NIR-Spektral-Dataset X (eine Matrix aus 600 Zeilen und 2203 Spalten) und die entsprechenden chemischen Referenzwerte Y (ein Vektor von 600 Zeilen) in Form einer .mat-Datei für die nachfolgende Analyse und Modellierung.
- Auswahl der entsprechenden Anzahl von Hauptkomponenten
- Öffnen Sie Matlab, und importieren Sie die .mat-Datei mit den vorverarbeiteten Nahinfrarot-Spektraldaten in den Arbeitsbereich, indem Sie die .mat-Datei in den Arbeitsbereich ziehen.
HINWEIS: Die .mat-Datei speichert die Nahinfrarot-Spektraldaten X als unabhängige Variable und den O-Kresol-Gehalt des Produkts als abhängige Variable in Form von zwei Matrizen. - Öffnen Sie die programmierte .m-Datei im Editor. Klicken Sie unter der Option Editor auf Öffnen, wählen Sie die kompilierte .m-Datei im Dateispeicherverzeichnis aus, und klicken Sie dann auf Bestätigen.
- Extrahieren Sie 15 Hauptkomponenten gemäß dem Optimierungsziel von Gleichung 1 und dem OLSR-Modell zwischen den extrahierten Hauptkomponenten und den vorhergesagten Werten der O-Kresol-Konzentration mit dem Programm, das den Befehl plsregress() in Matlabenthält.
[XL, YL, XS, YS, BETA, PCTVAR, MSE] = plsregress(X,Y,ncomp,'CV',k);
Konsultieren Sie das MATLAB-Hilfedokument, um die Nutzungsdetails und den Rückgabewert zu erhalten.
ANMERKUNG: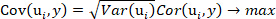 Gleichung 1
Gleichung 1
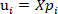 und
und  ist die hauptbestandteile der NIR-Spektraldaten;
ist die hauptbestandteile der NIR-Spektraldaten; ist die Projektion der ith Hauptkomponenten der NIR-Spektraldaten;
ist die Projektion der ith Hauptkomponenten der NIR-Spektraldaten; ist der Pearson-Korrelationskoeffizient für die Hauptkomponenten und die O-Kresol-Konzentration.
ist der Pearson-Korrelationskoeffizient für die Hauptkomponenten und die O-Kresol-Konzentration. - Erhalten
 Sie den Wert der NIR-Spektraldaten und die vorhergesagten Werte für die verschiedenen Hauptkomponenten mithilfe von Gleichung 2.
Sie den Wert der NIR-Spektraldaten und die vorhergesagten Werte für die verschiedenen Hauptkomponenten mithilfe von Gleichung 2.
ANMERKUNG: Gleichung 2
Gleichung 2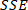 ist die Summe der Quadrate aufgrund von
ist die Summe der Quadrate aufgrund von 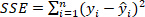 Fehlern und wird als definiert;
Fehlern und wird als definiert;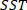 ist die Gesamtsumme der Quadrate
ist die Gesamtsumme der Quadrate 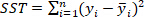 und wird als definiert als ;
und wird als definiert als ; ist der Referenzwert der O-Kresolkonzentration des Testdatensatzes;
ist der Referenzwert der O-Kresolkonzentration des Testdatensatzes;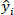 ist der vorhergesagte Wert der O-Kresol-Konzentration des Testdatensatzes;
ist der vorhergesagte Wert der O-Kresol-Konzentration des Testdatensatzes; ist der Mittelwert des Referenzwerts der O-Kresolkonzentration des Testdatensatzes;
ist der Mittelwert des Referenzwerts der O-Kresolkonzentration des Testdatensatzes; ist die Anzahl der Beispiele des Test-Datasets.
ist die Anzahl der Beispiele des Test-Datasets. - Bestimmen
 Sie die Werte und den Trend mit zunehmender Anzahl von Hauptkomponenten, wie in Abbildung 2dargestellt. Wählen Sie 10 als entsprechende Anzahl
Sie die Werte und den Trend mit zunehmender Anzahl von Hauptkomponenten, wie in Abbildung 2dargestellt. Wählen Sie 10 als entsprechende Anzahl  von Hauptkomponenten mit dem Wert 0,9917 aus.
von Hauptkomponenten mit dem Wert 0,9917 aus.
ANMERKUNG: Der Wert ist der Anteil der Varianz in der abhängigen Variablen, der durch die unabhängigen Variablen vorhersagbar ist. Je höher
Der Wert ist der Anteil der Varianz in der abhängigen Variablen, der durch die unabhängigen Variablen vorhersagbar ist. Je höher  der Wert ist, desto höher ist die Güte der Anpassung und umgekehrt.
der Wert ist, desto höher ist die Güte der Anpassung und umgekehrt.
- Öffnen Sie Matlab, und importieren Sie die .mat-Datei mit den vorverarbeiteten Nahinfrarot-Spektraldaten in den Arbeitsbereich, indem Sie die .mat-Datei in den Arbeitsbereich ziehen.
- Validierung der Passgenauigkeit und Genauigkeit des PLSR-Modells mit 10 Hauptkomponenten mithilfe des Befehls plsregress().
- Wiederholen Sie den Modellierungsprozess mit 10 Hauptkomponenten in den Schritten 3.2.1-3.2.5 mit 10 Hauptkomponenten.
- Bewerten Sie das Modell anhand einer 10-fachen Kreuzvalidierung anhand der Diagramme der prozentualen Varianz, die in den NIR-Spektraldaten, den Residuen und dem MSPECV erläutert werden.
- Zeichnen Sie die prozentuale Varianz, die in NIR-Spektraldaten, den Residuen und dem MSPECV als Abbildungen 3, 4 und 5erklärt wird.
- Tabellarisch sind
 die
die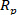 Bewertungsindikatoren von , , und die MSPE der 10-fachen Kreuzvalidierung für das PLSR-Modell für eine quantitative Analyse, wie in Tabelle 1dargestellt.
Bewertungsindikatoren von , , und die MSPE der 10-fachen Kreuzvalidierung für das PLSR-Modell für eine quantitative Analyse, wie in Tabelle 1dargestellt.
ANMERKUNG: Die Gleichungen von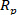 und MSPE werden als Gleichung 3 und Gleichung 4dargestellt.
und MSPE werden als Gleichung 3 und Gleichung 4dargestellt. Gleichung 3
Gleichung 3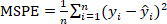 Gleichung 4
Gleichung 4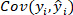 ist die Kovarianz des Referenzwerts und des vorhergesagten Wertes der O-Kresolkonzentration;
ist die Kovarianz des Referenzwerts und des vorhergesagten Wertes der O-Kresolkonzentration; 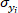 ist die Standardabweichung des Referenzwerts der O-Kresolkonzentration;
ist die Standardabweichung des Referenzwerts der O-Kresolkonzentration; ist die Standardabweichung des vorhergesagten Wertes der O-Kresolkonzentration.
ist die Standardabweichung des vorhergesagten Wertes der O-Kresolkonzentration.
Ergebnisse
Der vorhergesagte Wert der O-Kresol-Impurität in Polyphenylether-Produkten wird durch PLSR-basierte Nahinfrarotspektroskopie ermittelt. Abbildung 2 und Abbildung 3 zeigen die Zuverlässigkeit des Verfahrens in der Merkmalsauswahlphase aus der Kurve des Entscheidungskoeffizienten und den Prozentsatz der Fehlerinterpretation, der mit der Anzahl der Hauptkomponenten zunimmt.
Bitte beachten Sie ins...
Diskussion
Dieses Protokoll beschreibt den Prozess der Messung der PLSR bei der Messung der O-Kresol-Konzentration, die im flüssigen Produkt von Polyphenylenether mit NIRS verbleibt.
Die beiden entscheidenden Schritte in diesem Prozess sind die Vorverarbeitung der ursprünglichen NIR-Spektraldaten und die Variablenauswahl der hochdimensionalen NIR-Spektraldaten.
Im Allgemeinen führt die nicht-systematische Hintergrundinterferenz zur nicht-systematischen Streuabweichung oder ...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde von der National Natural Science Foundation of China (Grant Nos. 61722306 und 61473137) und dem National First-Class Discipline Program of Light Industry Technology and Engineering (LITE2018-025) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| MPA II Multi Purpose FT-NIR Analyzer | Bruker | 1 | |
| Fiber Optic Probes(Liquid phase) | Bruker | 1 | |
| Liquid chromatography analyzer | / | 1 | |
| Laboratory Equipment and Supplies(e.g. test tube, etc.) | / | ||
| MATLAB | MathWork | 1 | |
| OPUS | Bruker | 1 | |
| Principal computer | DELL | 1 | |
| The Unscrambler | CAMO | 1 |
Referenzen
- Nicolai, B. M., et al. Nondestructive measurement of fruit and vegetable quality by means of NIR spectroscopy: A review. Postharvest Biology and Technology. 46 (2), 99-118 (2007).
- Chang, C. W., Laird, D. A., Mausbach, M. J., Hurburgh, C. R. Near-infrared reflectance spectroscopy-principal components regression analyses of soil properties. Soil Science Society of America Journal. 65 (2), 480-490 (2001).
- Chen, Y., et al. Near-infrared spectroscopy for rapid evaluation of different processing products of Sophora japonica. L. Spectroscopy Letters. 51 (1), 37-44 (2018).
- Cayuela, J. A., Garcia, J. F. Nondestructive measurement of squalene in olive oil by near infrared spectroscopy. LWT-FOOD SCIENCE AND TECHNOLOGY. 88, 103-108 (2018).
- Joaquim, M., Rudnick, R. L., Shubkin, R. L. Polyphenyl Ether Lubricants. Synthetic Lubricants and High-performance Functional. , 239 (1999).
- Grabowska, H., Kaczmarczyk, W., Wrzyszcz, J. Synthesis of 2,6-Xylenol by Alkylation of Phenol with Methanol. Applied Catalysis. 47 (2), 351-355 (1989).
- Jeon, D. B., et al. Determination of volatile organic compounds, catechins, caffeine and theanine in Jukro tea at three growth stages by chromatographic and spectrometric methods. FOOD CHEMISTRY. 219, 443-452 (2016).
- Davidyuk, E. I., Demchenko, V. F., Klisenko, M. A. Rapid group separation and identification of chlorinated organic compounds by high performance liquid chromatography. JOURNAL OF ANALYTICAL CHEMISTRY. 52 (11), 1058-1065 (1997).
- Rinnan, A., Berg, F., Engelsen, S. B. Review of the most common pre-processing techniques for near-infrared spectra. TrAC Trends in Analytical Chemistry. 28 (10), 1201-1222 (2009).
- Zou, X. B., Zhao, J. W., Povey, M. J. W., Holmes, M., Mao, H. P. Variables selection methods in near-infrared spectroscopy. Analytica Chimica Acta. (1-2), 14-32 (2010).
- Dunn, B. W., Beecher, H. G., Batten, G. D., Ciavarella, S. The potential of near-infrared reflectance spectroscopy for soil analysis - a case study from the Riverine Plain of south-eastern Australia. Australian Journal of Experimental Agriculture. 42 (5), 607-614 (2002).
- Wang, C. K., Zhang, T. L., Pan, X. Z. Potential of visible and near-infrared reflectance spectroscopy for the determination of rare earth elements in soil. Geoderma. 306, 120-126 (2017).
- Gatius, F., Miralbes, C., David, C., Puy, J. Comparison of CCA and PLS to explore and model NIR data. Chemometrics and Intelligent Laboratory Systems. , 76-82 (2017).
- Wold, S., Sjostrom, M., Eriksson, L. PLS-regression: a basic tool of chemometrics. Chemometrics & Intelligent Laboratory. 58 (2), 109-130 (2001).
- Douglas, R. K., Nawar, S., Alamar, M. C., Mouazen, A. M., Coulon, F. Rapid prediction of total petroleum hydrocarbons concentration in contaminated soil using vis-NIR spectroscopy and regression techniques. SCIENCE OF THE TOTAL ENVIRONMENT. 616, 147-155 (2017).
- Grassi, S., Alamprese, C. Advances in NIR spectroscopy applied to process analytical technology in food industries. CURRENT OPINION IN FOOD SCIENCE. 22 (SI), 17-21 (2018).
- Trung, T., Downes, G., Meder, R., Allison, B. Pulp mill and chemical recovery control with advanced analysers - from trees to final product. APPITA. 68 (1), 39-46 (2015).
- Vann, L., Sheppard, J. Use of near-infrared spectroscopy (NIRs) in the biopharmaceutical industry for real-time determination of critical process parameters and integration of advanced feedback control strategies using MIDUS control. Journal of Industrial Microbiology& Biotechnology. 44 (12), 1589-1603 (2017).
- Modrono, S., Soldado, A., Martinez-Fernandez, A., de la Roza-Delgado, B. Handheld NIRS sensors for routine compound feed quality control: Real time analysis and field monitoring. TALANTA. 162, 597-603 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten