Method Article
Röntgenbeugung von intakten Murine Skelettmuskel als Werkzeug zur Untersuchung der strukturellen Basis von Muskelerkrankungen
In diesem Artikel
Zusammenfassung
Wir präsentieren detaillierte Protokolle für die Durchführung von Kleinwinkel-Röntgenbeugungsexperimenten mit intakten Mausskelettmuskeln. Mit der breiten Verfügbarkeit von transgenen Mausmodellen für menschliche Krankheiten kann diese experimentelle Plattform ein nützliches Prüffeld für die Aufklärung der strukturellen Grundlagen genetischer Muskelerkrankungen bilden.
Zusammenfassung
Transgene Mausmodelle waren wichtige Werkzeuge für die Untersuchung der Beziehung des Genotyps zum Phänotyp für menschliche Krankheiten, einschließlich der skelettierten Muskeln. Es hat sich gezeigt, dass der Skelettmuskel der Maus hochwertige Röntgenbeugungsmuster auf Synchrotronstrahllinien der dritten Generation erzeugt, die die Möglichkeit bieten, Veränderungen auf der Ebene des Genotyps mit funktionellen Phänotypen in Gesundheit und Krankheit zu verknüpfen, indem die strukturellen Folgen genetischer Veränderungen. Wir präsentieren detaillierte Protokolle für die Vorbereitung von Proben, das Sammeln der Röntgenmuster und das Extrahieren relevanter struktureller Parameter aus den Röntgenmustern, die Experimentatoren helfen können, die solche Experimente selbst durchführen möchten.
Einleitung
Synchrotron-Kleinwinkel-Röntgenbeugung ist die Methode der Wahl, um die nm-Skalastruktur von aktiv anklebenden Muskelpräparaten unter physiologischen Bedingungen zu untersuchen. Wichtig ist, dass strukturelle Informationen aus lebenden oder gehäuteten Muskelpräparaten synchron mit physiologischen Daten wie Muskelkraft- und Längenänderungen gewonnen werden können. Das Interesse an der Anwendung dieser Technik ist gestiegen, um die strukturelle Nerbbasis von erblichen Muskelerkrankungen zu untersuchen, die ihre Grundlage in Punktmutationen in sarkomischen Proteinen haben. Die Muskelbiophysik-Gemeinschaft war sehr aktiv bei der Generierung transgener Mausmodelle für diese menschlichen Erkrankungen, die ideale Testbetten für Strukturstudien bieten könnten. Jüngste Veröffentlichungen aus unserer Gruppe1,2,3 und andere4,5 haben gezeigt, dass die Röntgenmuster aus dem Mausextensor digitorum longus (EDL) und soleus Muskeln alle Beugungsinformationen von traditionelleren Modellorganismen wie Frosch- und Kaninchenpsoas Skelettmuskel. Ein Vorteil der Maus Skelettmuskelvorbereitung ist die einfache Zerlegung und Durchführung grundlegender membranintakter, ganzer muskelphysiologischer Experimente. Die Abmessungen des sezierten Muskels haben genügend Masse, um sehr detaillierte Muskelmuster in sehr kurzen Röntgenbelichtungszeiten (Millisekunde pro Frame) auf Röntgenstrahllinien der dritten Generation zu ergeben.
Muskel-Röntgen-Beugungsmuster bestehen aus den äquatorialen Reflexionen, den Meridionalreflexionen sowie den Schichtlinienreflexionen. Das äquatoriale Intensitätsverhältnis (Verhältnis der Intensität der äquatorialen Reflexionen 1,1 und 1,0, I11/I10), ist eng korreliert mit der Anzahl der angebrachten Querbrücken, die proportional zur Kraft ist, die im Skelettmuskel der Maus erzeugt wird. 2. Die Meridionalreflexionen, die Periodizitäten innerhalb der dicken und dünnen Filamente melden, können verwendet werden, um die Erweiterbarkeit des Filaments1,3,6,7zu schätzen. Beugungsmerkmale, die nicht am Meridian und am Äquator liegen, werden Schichtlinien genannt, die aus den etwa helisch geordneten Myosinköpfen auf der Oberfläche des dicken Filamentrückgrats sowie den etwa helisch geordneten dünnen Filamenten entstehen. Die Intensität der Myosin-Schichtlinien ist eng mit dem Grad der Reihenfolge der Myosinköpfe unter verschiedenen Bedingungen2,8verbunden. Alle diese Informationen können verwendet werden, um das Verhalten von sarkomischen Proteinen in situ bei Gesundheit und Krankheit zu untersuchen.
Synchrotron-Röntgenbeugung des Muskels wurde in der Vergangenheit von Teams von hochspezialisierten Experten durchgeführt, aber Fortschritte in der Technologie und die Verfügbarkeit neuer Datenreduktionstools zeigen, dass dies nicht immer der Fall sein muss. Die BioCAT Beamline 18ID an der Advanced Photon Source, Argonne National Laboratory verfügt über engagierte Mitarbeiter und Support-Einrichtungen für die Durchführung von Muskel-Röntgen-Beugungsexperimenten, die Neuankömmlingen auf dem Gebiet helfen können, mit diesen Techniken zu beginnen. Viele Benutzer entscheiden sich für eine formelle Zusammenarbeit mit BioCAT-Mitarbeitern, aber immer mehr Anwender finden, dass sie die Experimente und Analysen selbst durchführen können, um die Belastung des Beamline-Personals zu verringern. Das primäre Ziel dieses Papiers ist es, Schulungen anzubieten, die potenziellen Experimentatoren die Informationen liefern, die sie benötigen, um Experimente am Skelettmuskelsystem der Maus entweder an der BioCAT-Beamline oder an anderen Hochflussstrahllinien um die Welt, in der diese Experimente möglich wären.
Protokoll
Alle Tierversuchsprotokolle wurden vom Illinois Institute of Technology Institutional Animal Care and Use Committee (Protokoll 2015-001, Genehmigungsdatum: 3. November 2015) genehmigt und folgten dem NIH "Guide for the Care and Use of Laboratory Animals"9 .
1. Vorbereitung vor dem Experiment
- Bereiten Sie 500 ml Ringer-Lösung (enthält: 145 mM NaCl, 2,5 mM KCl, 1,0 mM MgSO4, 1,0 mM CaCl2, 10,0 mM HEPES, 11 mM Glukose, pH 7,4) frisch für jeden Tag des Experiments.
- 200 ml Ringer-Lösung in einer Sprühflasche füllen und im 4 °C-Kühlschrank aufbewahren. Füllen Sie eine Petrischale (10 cm Durchmesser) mit Ringer-Lösung und durchdringen Sie mit 100% Sauerstoff, indem Sie das Rohr von einem Sauerstoffzylinder mit einem Aquarienluftstein verbinden. Die Petri-Gerichte ("Sezierende Gerichte") wurden zuvor mit einer Elastomerverbindung beschichtet, um das Einsetzen von Stiften während der Sezierung zu ermöglichen.
- Bereiten Sie Metall-Montagehaken vor. Schneiden Sie zwei Stücke von Edelstahldraht, 0,5 mm im Durchmesser, auf die entsprechende Länge und biegen Sie den Draht an beiden Enden, um Haken zu bilden. Ordnen Sie alle Sezieren Werkzeuge, Schere, Naht binden Zange, Mikro-Schere praktisch für den Einsatz.
HINWEIS: Das Hakenteil sollte ca. 3 mm lang sein. Der längere Draht (Endin einem Haken) sollte ca. 5 cm lang sein, und der kürzere Draht (auch in einem Haken enden) sollte etwa 1 cm lang sein, um die bei BioCAT verwendeten kundenspezifischen Kammern zu passen und einen ausreichenden Bewegungsbereich für den Wandlerarm zu ermöglichen. -
Schließen Sie alle Geräte an und schalten Sie sie ein. Dazu gehören ein kombinierter Motor-/Kraftaufnehmer, ein Motor-/Kraftaufnehmerregler, ein leistungsstarker biphasischer Stromstimulator und ein computergesteuertes Datenerfassungs-/Steuerungssystem.
- Schalten Sie das Datenerfassungssystem ein und kalibrieren Sie es, bevor Sie mit dem Experiment10beginnen. Kurz gesagt, die Kalibrierung der Kraft durch Hinzufügen einer Reihe bekannter Gewichte, Abdeckung von bis zu 50% der maximalen Kraft, die durch den Kraftwandler in einer linearen Progression gemessen wird, auf dem Kraftwandler und Aufzeichnung der Ausgangsspannungsänderungen. Kalibrieren Sie die Länge, indem Sie einen Satz bekannter Ausgangsspannung auf den Hebelarm anwenden und die Längenänderung des Arms messen.
- Schließen Sie die Schläuche aus dem Thermoblock am Probenhalter an ein gekühltes Umlaufbad an und stellen Sie die Temperatur ein, um die gewünschte Temperatur in der Kammer auf 10 °C bis 40 °C zu halten. Bestimmen Sie dies empirisch im Voraus, indem Sie das Zirkulierende Bad auf einen Temperaturbereich einstellen und die Temperatur in der Kammer mit einem Thermoelement messen.
2. Muskelvorbereitung
-
Euthanisieren der Maus
- Euthanisieren Sie die Maus durch Kohlendioxid-Inhalation gefolgt von Zervix-Dislokation.
- Sprühen Sie die Haut auf die Hinterbeine mit kalter Ringer-Lösung, um zu verhindern, dass Haare in das Präparat blasen. Entfernen Sie die Haut, indem Sie sie um den Oberschenkel mit einer feinen Sezierschere abschneiden und ziehen Sie die Haut schnell mit #5 Zangen nach unten, um die Muskeln freizulegen.
- Amputieren Sie die Hintergliedmaße und übertragen Sie sie auf eine Sezierende Schale, die mit sauerstoffhaltiger Ringer-Lösung gefüllt wurde, und legen Sie sie dann unter ein binokulares Sezierenmikroskop.
-
Vorbereitung eines Sosoleusmuskels
- Stecken Sie die Hintergliedmaße in der SezierenderSchale mit dem Gastrocnemius-Muskel nach oben. Schneiden Sie die distale Sehne der Gastrocnemius/Soleus Muskelgruppe und heben Sie die Muskeln sanft und langsam, indem Sie die Faszie auf beiden Seiten des Gastrocnemius-Muskels mit einer feinen Schere abschneiden. Isolieren Sie die Gastrocnemius/Soleus Muskelgruppe von der Gliedmaße, nachdem Sie die proximale Sehne des Sohlenmuskels befreit haben.
- Pin die Muskelgruppe mit dem Magen-Darm-Muskel und der distalen Sehne nach unten in der Sezieren Schale. Heben Sie den Sosolesmuskel sanft über die proximale Sehne und trennen Sie ihn vom Magen-Darm-Muskel und lassen So viel von der Sohlensehne intakt wie möglich.
-
Vorbereitung eines Extensor-Digitoriumlongus -Muskels (EDL)
- Stecken Sie die Hintergliedmaße in der SezierenderSchale mit dem tibialis vorderen Muskel nach oben. Schneiden Sie die Faszie entlang des tibialis anterior (TA) Muskels und ziehen Sie es klar mit Zangen. Identifizieren und schneiden Sie die distale Sehne des TA-Muskels. Heben Sie den TA-Muskel an und schneiden Sie ihn sorgfältig aus, ohne den EDL-Muskel zu ziehen.
- Schneiden Sie die seitliche Seite des Knies und setzen Sie die beiden Sehnen aus. Schneiden Sie die proximale Sehne, so dass so viel von der Sehne wie möglich noch am Muskel befestigt, und heben Sie den EDL-Muskel (medialen Muskel) durch sanftes Ziehen der Sehne. Schneiden Sie die distale Sehne, sobald sie ausgesetzt ist.
-
Montage des Muskels
- Pin den Muskel über die Sehnen, und trimmen Sie alle zusätzlichen Fett, Faszien und Sehnen so viel wie möglich weg. Legen Sie eine Sehne in einen vorgebundenen Knoten und binden Sie die Naht fest mit Nahtbinden Zangen. Binden Sie den zweiten Knoten um den Metallhaken.
- Wiederholen Sie das gleiche Verfahren mit dem langen Haken am anderen Ende der Sehne. Stellen Sie sicher, dass keiner der Körper des Muskels durch die Nähte kontaktiert wird. Dies wird die Vorbereitung beschädigen.
- Befestigen Sie den kurzen Haken an der Unterseite der Versuchskammer und den langen Haken am Dual-Mode-Kraftwandler/Motor. Blase die Lösung in der Versuchskammer mit 100% Sauerstoff.
-
Optimierung von Stimulationsprotokollen und Muskellänge
- Dehnen Sie den Muskel, indem Sie die am Wandler/Motor befestigten Mikromanipulatoren anpassen, um eine Ausgangsspannung zwischen 15 und 20 mN zu erzeugen, bevor Sie die besten Stimulusparameter finden. Stellen Sie die Stimulationsspannung auf 40 V ein. Der Stimulationsstrom wird systematisch erhöht, bis keine zusätzliche Erhöhung der Zuckkraft erfolgt. Der höchste gefundene Strom wird um ca. 50% erhöht, um eine übermaximale Aktivierung zu gewährleisten.
- Finden Sie die optimale Länge, L0, definiert als die Muskellänge, die maximale Zuckkraft geben, indem Sie die Muskellänge erhöhen und den Muskel mit einem einzigen Zucken aktivieren, bis die aktive Kraft (Spitzenkraft minus Grundlinienkraft) aufhört zu erhöhen.
- Führen Sie eine kurze tetanische Kontraktion (1 s Aktivierung) durch, um die Montage zu testen und den Muskel bei Bedarf wieder auf optimale Grundkraft zu dehnen. Nehmen Sie die Muskellänge in mm mit einem digitalen Bremssattel auf.
3. Röntgenbeugung
HINWEIS: Die folgende Beschreibung gilt für Röntgenbeugungsexperimente, die mit dem Kleinwinkel-Röntgenbeugungsgerät an der BioCAT-Beamline 18ID am Advanced Photon Source, Argonne National Laboratory durchgeführt wurden, aber ähnliche Methoden könnten auf anderen Beamlines angewendet werden. wie ID 02 beim ESRF (Frankreich) und BL40XU bei SPring8 (Japan). Beamline 18ID wird mit einer festen Röntgenstrahlenergie von 12 keV (0,1033 nm Wellenlänge) mit einem einfallenden Fluss von 1013 Photonen pro Sekunde im Vollstrahl betrieben.
- Wählen Sie eine Probe nach Detektorabstand (Kameralänge). Verwenden Sie eine Kameralänge von 1,8 m für Experimente, die die 2,7 nm Actin- und High-Order-Myosinreflexionen wie 2,8 nm Meridionalreflexionen untersuchen. Verwenden Sie eine 4-6 m Kamera für andere Experimente, bei denen man sich vor allem für feine Details auf den Meridian- und Schichtlinien interessiert
-
Optimierung der Position der Probe im Strahl
- Bestimmen Sie die Strahlposition, indem Sie ein Röntgenpapier verwenden, das als Reaktion auf Röntgenstrahlen einen dunklen Fleck erzeugt ("eine Verbrennung"). Verwenden Sie dann einen Video-Fadenhaargenerator, um ein Fadenkreuz zu erstellen, das mit der Brennmarkierung auf dem Papier ausgerichtet ist, oder machen Sie einfach eine Markierung auf dem Videobildschirm mit einem Markerstift.
- Verwenden Sie die von BioCAT bereitgestellte grafische Benutzeroberfläche zum Sample-Positionierer, um den Muskel zu bewegen, der auf der Balkenposition zentriert werden soll. Oszillieren Sie die Probenkammer bei 10-20 mm/s, indem Sie die Probenstufe bewegen, um die Röntgendosis während der Exposition über den Muskel zu verteilen. Beobachten Sie die Probe, während sie sich bewegt, um große Bereiche der Faszien zu vermeiden (enthält Kollagen, das die Beugungsmuster verschmutzt) und um sicherzustellen, dass es während des gesamten Weges seiner Reise beleuchtet bleibt.
HINWEIS: Die genauen Schritte in den Abschnitten 3.3 und 3.4 erforderlich, um die erforderlichen Einstellungen und Aktionen mit der von Beamline bereitgestellten grafischen Benutzeroberfläche zu machen, werden beamline und detektorspezifisch sein. Fragen Sie die Mitarbeiter von beamline, wie diese Vorgänge ausgeführt werden sollen.
-
Einrichten des CCD-Detektors (Ladegekoppeltes Gerät) für hochauflösende Muster aus dem Muskel in definierten statischen Zuständen (Ruhe oder während der isometrischen Kontraktion)
- Richten Sie die Belichtungszeit und den Belichtungszeitraum in der grafischen Benutzeroberfläche der Steuerungssoftware ein. Nehmen Sie ein dunkles Hintergrundbild auf, bevor Sie die Belichtung nehmen, und wiederholen Sie diesen Vorgang alle 2 Stunden oder nach Änderung der Belichtungszeit, um jede Drift in der Detektorausleseelektronik zu korrigieren.
- Dämpfen Sie den Röntgenstrahl auf den gewünschten Wert für die Belichtung. Dann nehmen Sie ein Bild. Es ist nicht möglich, Sequenzen von Bildern mit diesem Detektor zu nehmen. Der CCD-Detektor benötigt auch mehrere Sekunden, um ein einzelnes Bild auszulesen.
-
Einrichten des Pixel-Array-Detektors für ein zeitaufgelöstes Experiment
- Richten Sie die Anzahl der Bilder, belichtungszeit, Belichtungszeitraum in der grafischen Benutzeroberfläche ein. Der hier verwendete Pixel-Array-Detektor benötigt mindestens 1 ms zum Auslesen. Die maximale Rahmenfrequenz für Photonenzähldetektor enden bei 500 Hz. Verwenden Sie das Ausgabesignal des Photonzählmelders, um den Röntgenauslöser zu steuern.
- Dämpfen Sie den Strahl auf die gewünschte Intensität. Bewaffnen Sie den Detektor und warten Sie auf den Auslöser aus dem Datenerfassungssystem. Synchronisieren Sie die mechanischen Daten und Röntgendaten, indem Sie sie gleichzeitig auslösen. Die Röntgenmuster werden kontinuierlich während des Protokolls und mit einer Belichtungszeit von 1 ms und einer Belichtungszeit von 2 ms gesammelt.
HINWEIS: Die genaue Expositionszeit und die Expositionsdauer sollten von Fall zu Fall für die gewünschten Informationen und die beobachtete Lebensdauer der Probe im Strahl bestimmt werden. Dämpfen Sie den Strahl, um nicht mehr Röntgenstrahl zu verwenden, als erforderlich ist, um in der gewählten Expositionsperiode analysierbare Daten bereitzustellen.
4. Muskelbehandlung nach dem Experiment
- Erholen und wiegen Sie den Muskel nach jedem mechanischen und Röntgenexperiment. Berechnen Sie den Querschnittsbereich des Muskels unter Verwendung der gemessenen Muskellänge und der Muskelmasse11 unter der Annahme einer Muskeldichte von 1,06 g/mL12.
- Dehnen Sie den Muskel auf die experimentelle Länge und fixieren Sie den Muskel in 10% Formalin für 10 min. Trennen Sie den festen Muskel in eine Reihe von Faserbündeln von Standorten im gesamten Muskelquerschnitt ausgewählt3.
- Messen Sie die Sarcomere-Länge mit einem Video-Sarcomere-Längenmesssystem.
Ergebnisse
Isometrische tetanische Kontraktion. Jede Art von klassischen muskelmechanischen Experimenten, wie isometrische oder isotonische Kontraktionen, kann bei gleichzeitiger Erfassung von Röntgenmustern durchgeführt werden. Abbildung 1 A zeigt den Versuchsaufbau für mechanische und Röntgenexperimente. Eine Beispielkraftspur für eine isometrische tetanische Kontraktion ist in Abbildung 1Bdargestellt. Der Muskel wurde bei der Ruhe für 0,5 s gehalten, bevor für 1 s aktiviert. Die mechanische Aufnahme stoppt 1 s nach dem Stimulus. Die Röntgenmuster wurden kontinuierlich während des Protokolls bei 1 ms Belichtungszeit bei 500 Hz gesammelt.
Röntgenbeugungsmuster. Das Muskel-Röntgen-Beugungsmuster kann Nanometer-Auflösung strukturelle Informationen von Strukturen innerhalb des Sarcomere geben. Muskel-Röntgen-Beugungsmuster bestehen aus vier äquivalenten Quadranten geteilt durch den Äquator und den Meridian. Das äquatoriale Muster ergibt sich aus der Myofilament-Verpackung innerhalb des Sarcomeres senkrecht zur Faserachse, während die Meridionalmuster strukturelle Informationen aus den Myofilamenten entlang der Muskelachse melden. Die übrigen Reflexionen, die nicht auf dem Äquator oder dem Meridian stehen, werden Als Schichtlinien bezeichnet. Schichtlinien (z. B. Merkmale mit den Bezeichnungen MLL4 und ALL6 in Abbildung 2A) ergeben sich aus der annähernd-helischen Anordnung molekularer Untereinheiten innerhalb des Myosins, das dicke Filamente und den Aktin mit dünnen Filamenten enthält. Die myosinbasierten Schichtlinien sind stark und scharf in Mustern aus ruhenden Muskeln (Abbildung 2A), während aktinbasierte Schichtlinien in Mustern aus der Ankiskung von Muskelgruppen stärker hervortreten (Abbildung 2B). Differenzmuster, die durch Subtraktion des Ruhemusters vom Kontraktusmuster (Abbildung 2C) gewonnen werden, können Licht auf strukturelle Veränderungen während der Kraftentwicklung bei gesunden und kranken Muskeln werfen. Durch die Verfolgung dieser strukturellen Veränderungen auf der Millisekunden-Zeitskala der molekularen Ereignisse während der Muskelkontraktion können die Röntgenbeugungsmuster wesentliche strukturelle Informationen offenbaren (Abbildung 2D).
Datenanalyse mit MuscleX. Hier ist ein Beispiel für äquatoriale Reflexionsanalysen mit der "Äquator"-Routine im MuscleX-Paket (Abbildung 3). MuscleX ist ein Open-Source-Analyse-Softwarepaket, das bei BioCAT13entwickelt wurde. Das äquatoriale Intensitätsverhältnis (I1,1/I1,0) ist ein Indikator für die Nähe von Myosin zu Actin im ruhenden Muskel (Abbildung 3A), während es eng mit der Anzahl der angebrachten Querbrücken in der Kontraktion korreliert ( Abbildung 3B) muriner Skelettmuskel2. Das Intensitätsverhältnis, I1,1/I1,0, beträgt etwa 0,47 im ruhenden Muskel und etwa 1,2 bei der Muskelkontraktion. Der Abstand zwischen den beiden 1,0 Reflexionen (2*S1,0) hängt umgekehrt mit dem Zwischenfilamentabstand zusammen. Ausführliche Dokumentationen und Handbücher für MuscleX sind online verfügbar13.
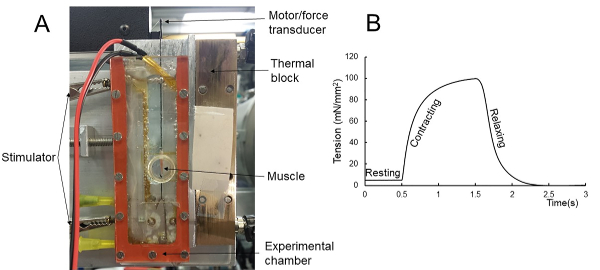
Abbildung 1 : Mechanische und Röntgenexperiment Setup und Protokoll. (A) Der Muskel ist an einem Ende an einem Haken innerhalb der Versuchskammer und am anderen Ende an einem Dual-Mode-Motor/Kraftwandler befestigt. Es wird zwischen zwei Kapton-Filmfenstern gehalten, damit die Röntgenstrahlen passieren können. Die Kammer wird mit Ringer-Lösung gefüllt, die während des Experiments mit 100% Sauerstoff durchsetzt ist. (B) Das mechanische Protokoll für Röntgenexperimente an einem Muskel während der tetanischen Kontraktion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
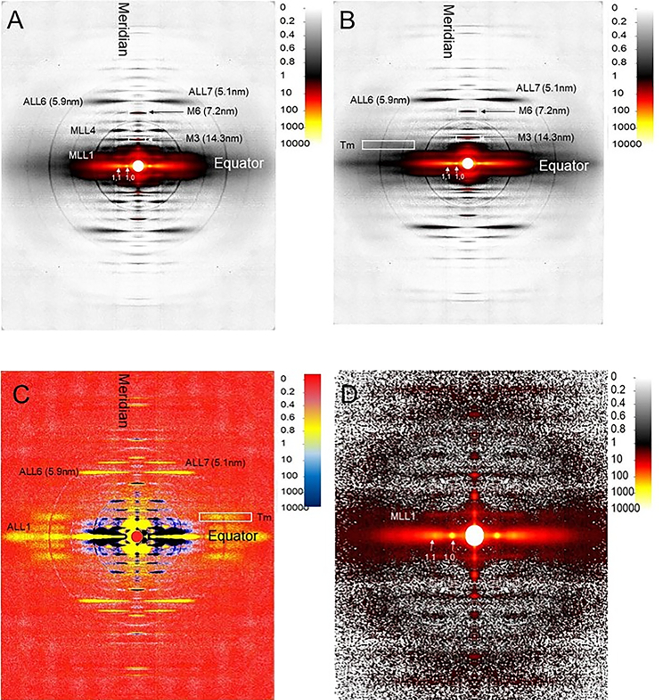
Abbildung 2 : EDL-Röntgenbeugungsmuster. EDL Muskel Röntgen beugung Muster aus der Ruhe (A) und Kontraktion (B) Muskel. (C) Das Unterschiedsmuster zwischen Ruhe- und Kontraktmuster. Der blaue Bereich zeigt eine hohe Intensität im Ruhemuster an, während der gelbe Bereich eine hohe Intensität im Kontraktmuster darstellt. (D) Röntgenbeugungsmuster aus einer 1 ms Exposition mit EDL-Muskel. MLL1 = Myosin-Layer-Linie erster Ordnung; MLL4 = Vierte Reihenfolge Myosin-Layer-Linie; ALL1 = Aktin-Layer-Linie erster Ordnung ALL6 = Aktin-Layer-Linie sechster Ordnung; ALL7 = Aktin-Layer-Linie siebter Ordnung; Tm = Tropomyosin-Reflexion (angezeigt durch eine weiße Box); M3 = Meridionalreflexion dritter Ordnung; M6 = Meridionalreflexion der sechsten Ordnung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3 : Datenanalyse äquatorialer Muster mit MuscleX. Das im Hintergrund subtrahierte äquatoriale Intensitätsverhältnisprofil (während Fläche) und die ersten fünf Orders (grüne Linien) waren geeignet, die Intensität jedes Peaks zu berechnen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Jüngste Veröffentlichungen unserer Gruppe zeigten, dass Röntgenmuster aus dem Mausskelettmuskel verwendet werden können, um lichtdurcht sarkomische Strukturinformationen aus Der muskuehrlichen Gesundheit und Krankheit1,2,3 vor allem mit die erhöhte Verfügbarkeit genetisch veränderter Mausmodelle für verschiedene Myopathien. Hochauflösende mechanische Studien an einzelnen Fasern oder kleinen Bündeln in Kombination mit Röntgenbeugung werden am besten von Experten durchgeführt. Wenn jedoch bescheidenere mechanische Informationen für Ihre Zwecke ausreichen, ermöglicht die gesamte Muskelvorbereitung das Sammeln detaillierter Röntgenmuster aus einer einfachen Zubereitung.
Eine saubere Sezierung ist der Schlüssel zu einem erfolgreichen kombinierten mechanischen und Röntgenexperiment. Es ist sehr wichtig, nicht auf dem Zielmuskel sowie andere Muskeln mit dem Sohle oder EDL Muskeln während der Zerlegung verbunden ziehen, da dies Teile des Muskels reißen und zu reduzierter Kraft führen könnte. Es kann auch zu beschädigten inneren Struktur führen, die die Röntgenmuster verschlechtern wird. Da alles im Röntgenstrahl streuen wird, ist es wichtig, jedes zusätzliche Fett, das Kollagen in Faszien sowie alle Haare oder lose Teile des Gewebes zu reinigen, während das folgende Protokoll zu tun. Um die zusätzliche Compliance in der Muskelvorbereitung zu reduzieren, ist es auch wichtig, die Sehnen sicher an die Haken zu binden, so nah wie möglich am Muskelkörper, ohne ihn zu beschädigen.
Verschiedene Röntgenbelichtungszeiten können verschiedene Arten von Informationen aus dem gleichen Muskel liefern. Mit dem Vollstrahl auf 18ID kann ein analyzierbares äquatoriales Muster in einer 1 ms Exposition erhalten werden (siehe Abbildung 2D). Für eine analyzierbare erste Myosin-Schicht-Linienreflexion ist in der Regel eine Gesamtbelichtungszeit von 10 ms erforderlich. Um Merireflexionen höherer Ordnung wie m15 (2,8 nm Myosin-Merireflexion) und 2,7 nm Aktin-Merireflexion zu sammeln, ist in der Regel mindestens 1 s Gesamtbelichtung erforderlich, aber mehr als 2 s Gesamtbelichtung wird für hohe Genauigkeit empfohlen Messungen.
Die Wahl des optimalen Röntgendetektors für das Experiment ist wichtig. Für die detailliertesten Röntgenmuster kann ein kundenspezifischer CCD-Detektor, wie der bei BioCAT mit ca. 40-m-Pixeln und Punktstreufunktionen von ca. 65 m im Phosphor, Muster mit hohem Dynamikumfang und guter räumlicher Auflösung liefern, kann aber jeweils nur einen Frame aufnehmen. Für zeitaufgelöste Experimente kann der Photonenzählpixel-Array-Detektor bei BioCAT Röntgenmuster bei 500 Hz sammeln. Die 172-mm-Pixelgröße mit diesem Detektor bietet jedoch keine ausreichende räumliche Auflösung für detaillierte Untersuchungen des inneren Teils des Meridians, ist aber für die meisten anderen Zwecke ausreichend. BioCAT erwarb einen hochauflösenden Photonenzähldetektor mit einer realen Auflösung von 75 m bei einer maximalen Bildrate von 9.000 Hz. Ähnliche Detektoren dieses Typs sollen in den nächsten Jahren Stromdetektoren für Muskelstudien verdrängen.
Angesichts der sehr hohen Röntgenströme bei Synchrotronen der dritten Generation ist eine Strahlenschädigung ein ernstes Problem. Es ist immer eine gute Wahl, den Strahl zu dämpfen, um nicht mehr Strahl zu liefern, als benötigt wird, um die gewünschten Beugungsmerkmale zu beobachten. Die gleiche Gesamt-Röntgenexposition kann erreicht werden, indem die Belichtungszeit von einem abgeschwächten Strahl verlängert wird. Ein Vorteil von Photonenzählpixel-Array-Detektoren ist, dass einzelne Frames ohne Rauschstrafe zusammengefasst werden können. Auch dann sind Strahlenschäden möglich. Anzeichen von Strahlungsschäden sind Tropfen der maximalen Kraft der Kontraktion, Verschmieren von SchichtLinie Reflexionen, sogar Änderung der Muskelfarbe.
Eine der Einschränkungen der intakten Maus Skelettmuskelvorbereitung ist die Schwierigkeit, Sarcomere Länge aus dem intakten Muskel während der Experimente zu erhalten. Die Muskeln sind zu dick für Videomikroskopie und Laserbeugung. Während es bei zukünftigen Entwicklungen möglich sein könnte, die Sarcomere-Länge direkt aus den Beugungsmustern14abzuschätzen, besteht kurzfristig die einzige Möglichkeit darin, sie nach dem Hier beschriebenen Experiment zu messen.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Diese Forschung nutzte Ressourcen der Advanced Photon Source, einer Us-Energieabteilung (DOE) Office of Science User Facility, die für das DOE Office of Science von Argonne National Laboratory unter Vertrag Nr. DE-AC02-06CH11357. Dieses Projekt wurde durch das Stipendium P41 GM103622 vom National Institute of General Medical Sciences der National Institutes of Health unterstützt. Die Verwendung des Pilatus 3 1M Detektors erfolgte durch Zuschuss 1S10OD018090-01 von NIGMS. Der Inhalt liegt allein in der Verantwortung der Autoren und spiegelt nicht unbedingt die offizielle Meinung des National Institute of General Medical Sciences oder der National Institutes of Health wider.
Materialien
| Name | Company | Catalog Number | Comments |
| #5 forceps | WPI | 500342 | |
| 4/0 surgical suture | Braintree Sci | SUT-S 108 | |
| Aquarium air stone | uxcell | a regular air stone from a pet store would be fine | |
| CaCl2 | Sigma-Aldrich | C5670 | |
| CCD detector | Rayonix Inc | MAR 165 CCD | |
| Data acquisition system | Aurora Scientific Inc | 610A | |
| Elastomer compound | Dow Corning | Sylgard 184 | |
| Glucose | Sigma-Aldrich | G8270 | |
| HEPES | Sigma-Aldrich | H3375 | |
| High resolution photon counting detector | Dectris Inc | EIGER X 500K | |
| High-power bi-phasic current stimulator | Aurora Scientific Inc | 701 | |
| Iris Scissors | WPI | 501263-G | |
| KCl | Sigma-Aldrich | P9541 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Micro scissor | WPI | 503365 | |
| Motor/force transducer | Aurora Scientific Inc | 300C-LR | |
| NaCl | Sigma-Aldrich | S9888 | |
| Petri dish | Sigma-Aldrich | CLS430167 | |
| Photon counting detector | Dectris Inc | Pilatus 3 1M | |
| Stainless Steel wire | McMaster-carr | 8908K21 | |
| Suture Tying Forceps | WPI | 504498 | |
| Video sarcomere length measuring system | Aurora Scientific Inc | 900B |
Referenzen
- Ma, W., et al. Thick-Filament Extensibility in Intact Skeletal Muscle. Biophysical Journal. 115 (8), 1580-1588 (2018).
- Ma, W., Gong, H., Irving, T. Myosin Head Configurations in Resting and Contracting Murine Skeletal Muscle. International Journal of Molecular Sciences. 19 (9), (2018).
- Kiss, B., et al. Nebulin stiffens the thin filament and augments cross-bridge interaction in skeletal muscle. Proceedings of the National Academy of Sciences of the United States of America. 115 (41), 10369-10374 (2018).
- Ochala, J., Gokhin, D. S., Iwamoto, H., Fowler, V. M. Pointed-end capping by tropomodulin modulates actomyosin crossbridge formation in skeletal muscle fibers. Federation of American Societies for Experimental Biology Journal. 28 (1), 408-415 (2014).
- Lindqvist, J., Iwamoto, H., Blanco, G., Ochala, J. The fraction of strongly bound cross-bridges is increased in mice that carry the myopathy-linked myosin heavy chain mutation MYH4(L342Q). Disease Models & Mechanisms. 6 (3), 834-840 (2013).
- Huxley, H. E., Stewart, A., Sosa, H., Irving, T. X-ray diffraction measurements of the extensibility of actin and myosin filaments in contracting muscle. Biophysical Journal. 67 (6), 2411-2421 (1994).
- Wakabayashi, K., et al. X-ray diffraction evidence for the extensibility of actin and myosin filaments during muscle contraction. Biophysical Journal. 67 (6), 2422-2435 (1994).
- Anderson, R., et al. Mavacamten stabilizes a folded-back sequestered super-relaxed state of β-cardiac myosin. Proceedings of the National Academy of Sciences of the United States of America. , (2018).
- National Research Council. Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide for the care and use of laboratory animals. Institute for Laboratory Animal Research (U.S.) & National Academies Press (U.S.). , National Academies Press. (2011).
- Rand, C. How to Calibrate Your Dual-Mode Lever System Using DMC. , Available from: https://aurorascientific.com/how-to-calibrate-your-dual-mode-lever-system-using-dmc/ (2017).
- Alexander, R. M. V. A. The dimensions of knee and ankle muscles and the forces they exert. Journal of Human Movement Studies. 1, 115-123 (1975).
- Burkholder, T. J., Fingado, B., Baron, S., Lieber, R. L. Relationship between Muscle-Fiber Types and Sizes and Muscle Architectural Properties in the Mouse Hindlimb. Journal of Morphology. 221 (2), 177-190 (1994).
- Jiratrakanvong, J., et al. MuscleX: software suite for diffraction X-ray imaging V1.13.1. , (2018).
- Reconditi, M., et al. Myosin filament activation in the heart is tuned to the mechanical task. Proceedings of the National Academy of Sciences of the United States of America. 114 (12), 3240-3245 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten