Method Article
Einsatz eines drahtlosen Video-EEG-Systems zur Überwachung von epileptiforlen Entladungen nach lateraler Fluid-Percussion-induzierter traumatischer Hirnverletzung
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll vor, um schweres TBI mit dem lateralen Fluid Percussion Injury (FPI) Modell bei erwachsenen, männlichen Wistar Ratten zu induzieren. Wir zeigen auch den Einsatz eines drahtlosen Telemetriesystems, um kontinuierliche Video-EEG-Aufnahmen zu sammeln und epileptiforme Entladungen zu überwachen, die mit der posttraumatischen Epileptogenese übereinstimmen.
Zusammenfassung
Das Modell der lateralen Fluid Percussion Injury (FPI) ist etabliert und wurde zur Untersuchung von TBI und posttraumatischer Epilepsie (PTE) verwendet. Es wurden jedoch erhebliche Unterschiede bei den spezifischen Parametern gemeldet, die in verschiedenen Studien verwendet wurden, die dieses Modell verwendet haben, was es schwierig macht, die Ergebnisse zwischen Laboratorien zu harmonisieren und zu interpretieren. Zum Beispiel wurde eine Variabilität bezüglich der Größe und Lage der Kraniektomie, wie die Luer-Schleusennbenabe relativ zur Kraniektomie platziert wird, der atmosphärische Druck, der auf die Dura ausgeübt wird, und die Dauer des Druckimpulses berichtet. Jeder dieser Parameter kann sich auf die Schwere der Verletzungen auswirken, die direkt mit der Inzidenz von PTE korreliert. Dies hat sich als eine breite Palette von Sterblichkeitsraten manifestiert, die Reflexzeiten und die Inzidenz von Krampfanfällen, die berichtet werden, richtig machen. Hier stellen wir ein detailliertes Protokoll für die Methode zur Verfügung, die wir verwendet haben, um die Harmonisierung zwischen den Studien zu erleichtern. Wir verwendeten FPI in Kombination mit einem drahtlosen EEG-Telemetriesystem, um kontinuierlich auf elektrografische Veränderungen zu überwachen und Anfallsaktivitäten zu erkennen. FPI wird durch die Schaffung einer 5 mm Kraniektomie über der linken Hemisphäre, zwischen dem Bregma und Lambda und neben dem seitlichen Kamm induziert. Eine Luer-Verriegelungsnabe ist über der Kraniektomie auf dem Schädel befestigt. Diese Nabe ist mit dem FPI-Gerät verbunden, und ein 20-Millisekunden-Druckimpuls wird direkt an die intakte Dura über Druckschläuche geliefert, die über einen Drehverschlussanschluss mit der Nabe verbunden sind. Nach der Genesung werden Ratten erneut anästhesiert, um den Hub zu entfernen. Fünf EEG-Elektrodenschrauben aus Edelstahl aus 0,5 mm werden durch den Schädel mit der Dura in Berührung gebracht und dienen als vier Aufnahmeelektroden und eine Referenzelektrode. Die Elektrodendrähte werden in einem Sockelverbinder gesammelt, der mit Knochenzement befestigt ist. Kontinuierliche Video-/EEG-Aufnahmen werden bis zu 4 Wochen nach TBI gesammelt.
Einleitung
In einem Bericht an den Kongress aus dem Jahr 2015 berichteten die Centers for Disease Control, dass etwa 2,5 Millionen Menschen pro Jahr traumatische Hirnverletzungen (TBI) in den USA erleiden1. Es wird geschätzt, dass TBI 20% der symptomatischen Epilepsien und 5% aller Epilepsien2,3,4verursacht. Darüber hinaus entwickeln etwa 20% der TBI-Patienten eine posttraumatische Epilepsie5. Wichtig ist, chronische, wiederkehrende Anfälle, die als Folge von TBI auftreten, sind oft pharmakoresistent, was die Belastung der Krankheit erhöht6. Die genauen Mechanismen, die zu posttraumatischer Epilepsie (PTE) führen, bleiben unklar. Mehrere wichtige epidemiologische Studien haben jedoch die Inzidenz und das potenzielle Risiko der Entwicklung einer posttraumatischen Epilepsie (PTE)untersucht 2,4,7,8,9 ,10,11. Diese epidemiologischen Studien verstärkten jeweils die Korrelation der Verletzungsschwere mit dem Risiko einer Epileptogenese.
Aktuelle Methoden, die ausgiebig zur Identifizierung neuartiger Anti-Epilepsie-Therapien eingesetzt wurden, haben sich stark auf Modelle verlassen, die Chemokonvulsiva oder elektrische Surlepsie verwenden, um Epilepsie zu induzieren12. Angesichts der hohen Inzidenz von Pharmakoresistenz entwinnen und fachlichen Mitteln, die in diesen Modellen von TBI-Patienten entwickelt wurden, gehen wir davon aus, dass sich TBI-induzierte Anfälle von Chemokonvulsiva oder entzündeten Epileleptogenese. Daher kann ein TBI-Modell besser für die Entwicklung von Behandlungen geeignet sein, die effektiver sind, um posttraumatische Epileleptogenese zu verhindern.
Das Fluid Percussion Injury (FPI) Modell von TBI wird seit Jahrzehnten verwendet und ist eine etablierte Methode, um sowohl TBI als auch PTE13,14,15,16,17, 18. Wie wir jedoch kürzlich überprüft haben, gibt es eine hohe Variabilität der FPI-Methoden, die in den Laboratorien gemeldet werden19,20. Dieser Mangel an Konsistenz zwischen Laboratorien verhindert die Reproduzierbarkeit präklinischer Befunde und macht die Interpretation der Ergebnisse zu einer Herausforderung. Infolgedessen wurden das Interesse und die Bemühungen um eine stärkere Harmonisierung dieser Studienartenverstärkt21,22,23,24.
In dem Bestreben, die Konsistenz und Harmonisierung zwischen Laboratorien, die sich auf die Untersuchung der posttraumatischen Epileleptogenese konzentrieren, weiter zu erhöhen, stellen wir hier eine detaillierte Methodik unseres Ansatzes zur Verfügung. Wir haben zuvor eine 60%ige Inzidenz von Krampfanfällen innerhalb von sechs Wochen nach schweren TBI20berichtet. Wir verwenden diesen Ansatz nun, um Ratten zu überwachen, die den Tag der Verletzung beginnen, und sie kontinuierlich 24 Stunden am Tag für bis zu 4 Wochen zu verfolgen. Wir haben uns für ein drahtloses Telemetriesystem entschieden, das mehrere Vorteile bietet. Erstens können sich Ratten frei um ihren Käfig bewegen und reduzieren so Stress. Zweitens eine Reduzierung des Signalrauschens, da die Ratte als Boden dient. Darüber hinaus verwendet unser aktuelles System einen Beschleunigungsmesser, der schnelle Bewegungen in allen drei Ebenen (X, Y und Z) erkennt und hilfreich sein kann, um krampfhafte Anfallsereignisse zu identifizieren. Schließlich ermöglicht das drahtlose Telemetriesystem ein einfacheres Management von Ratten wie zusätzliche Saline-Injektionen, Wiegen und Durchführen von neurologischen Schweregraden, was kompliziert ist, wenn Ratten an einem Tether befestigt sind. Dieser Ansatz hat jedoch auch mehrere Einschränkungen. Erstens können die anfänglichen Kosten eines Systems, das von bis zu acht Ratten gleichzeitig erfasst wird, im Bereich von 60.000 US-Dollar liegen. Zweitens wird die Stromversorgung durch eine Batteriequelle begrenzt. Dies erfordert eine tägliche Überwachung und den Austausch von Batterien. Die zwischen den Batteriewechseln benötigte Zeit kann durch die Abtastrate beeinflusst werden. Bei einer Abtastrate von 1000 Hz werden Batterien jedoch in der Regel einmal pro Woche gewechselt. Die begrenzte Stromversorgung beschränkt das System auch auf die Aufzeichnung von nur vier EEG-Signalen. Schließlich ist das Signalaussetzer begrenzt, tritt aber gelegentlich auf. Dieser Ansatz bietet jedoch eine konsistente und zuverlässige Methode zur Überwachung der posttraumatischen Epileptogenese und kann bei der Identifizierung neuartiger therapeutischer Behandlungen helfen.
Protokoll
Alle Verfahren wurden von der University at Buffalo Institutional Animal Care and Use Committee genehmigt und befolgten diese.
1. Flüssigkeits-Percussion-Verletzung
- Tragen Sie einen Labormantel oder ein chirurgisches Kleid, eine chirurgische Maske, chirurgische Handschuhe und eine Kopfbedeckung und sterilisieren Sie alle Werkzeuge und Materialien, die den chirurgischen Standort kontaktieren.
- Anästhetisieren Sie eine 10-12 Wochen alte, männliche Wistar-Ratte (350-400 g) mit 3% Isofluran und 1 L/min Sauerstoff in einer Induktionskammer von geeigneter Größe für Ratten. Entfernen Sie die Ratte aus der Induktionskammer und bewegen Sie sie in den Vorbereitungsbereich, sobald sie bewusstlos ist. Setzen Sie die sterile ophthalmologische Salbe in beide Augen.
- Rasieren Sie das Haar auf dem Kopf der Ratte mit elektrischen Clippers mit einer #40 Klinge von knapp über den Augen bis zur kaudalen Basis der Ohren, um genügend chirurgisches Feld zu produzieren. Entfernen Sie lose, abgeschnittene Haare von der Website.
- Reinigen Sie die chirurgische Stelle, indem Sie 2% Chlorohexidinpeeling auf die rasierte Kopfhaut auftragen, gefolgt von 70% Ethanol. Beginnen Sie in der Mitte und bewegen Sie sich in konzentrischen Kreisen von der Einschnittstelle nach außen. Wiederholen Sie diesen Vorgang 3 Mal. Tragen Sie Betadine Lösung auf die Website in der gleichen Weise und zum Trocknen erlaubt.
- Die anästhesierte Ratte in den stereotaxic-Rahmen geben und die Anästhesie bei 2-3% Isofluran-1 L/min Sauerstoff über Nosecone aufrechterhalten. Prüfen Sie auf Verlust des Entzugsreflexes des Hinterbleibs und verlustdes des palpebralen Reflexes, um sicherzustellen, dass sich die Ratte in einer chirurgischen Anästhesieebene befindet.
- Überwachen Sie die Atemfrequenz, Herzfrequenz, Körpertemperatur und Sauerstoffsättigung während der gesamten Operation. Halten Sie die Herzfrequenz zwischen 300-400 bpm und SpO2 über 90%.
HINWEIS: Ein Pulssoximeter, das an einem hinteren Fuß befestigt ist, kann verwendet werden, um die konstante Auslesung der Herzfrequenz und SpO2zu gewährleisten. Eine Herzfrequenz über 400 bpm zeigt an, dass die Ratte nicht ausreichend beästhesiert ist. Ein selbstregulierendes Wärmepolster, gekoppelt an ein Rektales Thermometer, das auf 37 °C eingestellt ist, kann während der gesamten Operation unter der Ratte positioniert werden, um die Körpertemperatur aufrechtzuerhalten. Ein Stereomikroskop mit einer Lichtquelle in Kombination mit einer Lichtfaserlampe ist hilfreich, um das Verfahren zu visualisieren. - Verwenden Sie eine 23 g Nadel, um 0,5% Bupivacain-Hydrochlorid intradermally in die Kopfhaut an der Einschnittstelle für lokale Analgesie 10 - 15 Minuten vor einem Schnitt zu injizieren.
- Machen Sie einen 1,5-2,5 cm Mittellinienschnitt durch die Haut und den Muskel der Kopfhaut mit einem #10 Skalpellblatt. Ziehen Sie die Haut und den Muskel zurück, um den Schädel freizulegen und bieten Sie ein klares operationsesopes Feld. Reflektieren Sie die darunter liegende Faszien- und Fettgewebe mit sterilen Wattestäbchen vom Knochen weg.
HINWEIS: Eine elektrische Kauter-Einheit ist nützlich, um eine schnelle Hämostase zu erzielen. - Rasieren Sie den seitlichen Grat des linken Parietalknochens mit einer chirurgischen Kurette, um eine glatte flache Oberfläche zu erzeugen, so dass die Basis der weiblichen-weiblichen Luer-Verriegelungsnabe bündig mit dem Schädel ruhen kann.
- Bewässern Sie die Schädeloberfläche und das umgebende Gewebe mit 2,0 mg/ml Gentamicinlösung in steriler Saline. Überschüssige Lösung mit sterilen Tupfern abblasen.
- Tragen Sie 3% Wasserstoffperoxid auf den Schädel auf, um den Knochen zu trocknen.
HINWEIS: Wenn der Knochen nicht ausreichend trocken ist, haftet der Zahnzement nicht richtig und bildet eine feste Dichtung. - Erstellen Sie eine Kraniektomie-Site mit einem Durchmesser von 5 mm durch den linken Parietalknochen.
HINWEIS: Ein Trephinbit, das in einen Bohrer gelegt wird, der am stereotaktischen Rahmen befestigt ist, kann hilfreich sein, um die Kraniektomie zu initiieren. Verwenden Sie einen Handbohrer mit einem Trephin mit einem Durchmesser von 5 mm, um die Kraniektomie durch den verbleibenden Knochen langsam zu beenden. Wenn Sie kurz vor dem Abschluss der Kraniektomie stehen, drehen Sie das Trephin rückwärts, um einen Bruch des zugrunde liegenden Dura mater zu verhindern. Es wird eine Ausdünnung des Schädels um den Umfang der Scheibe und die Schädelklappe wird sich locker fühlen, wenn leicht gedrückt. - Entfernen Sie die Knochenklappe mit der chirurgischen Kurette und glatten Gewebezangen.
HINWEIS: Es kann zu einigen Blutungen kommen, aber Hämostase kann schnell erreicht werden, indem man sanften Druck mit sterilen Wattestäbchen ausübt. - Verwenden Sie ein Stereomikroskop und Beleuchtung, um die Dura visuell auf Anzeichen von Bruch zu untersuchen. Ein dünner Knochenrand bleibt um den Umfang der Kraniektomie-Stelle herum. Entfernen Sie diese Felge vorsichtig mit glatten Gewebezangen, wobei darauf geachtet wird, die Dura nicht zu brechen.
- Den Schädel mit 70% Ethanol abwischen, um Knochenstaub zu entfernen und den Schädel zu trocknen.
- Tragen Sie eine dünne Schicht Cyanoacrylat-Gelkleber um den unteren Rand der Luer-Verriegelungsnabe auf und sichern Sie sie am Schädel über die Kraniektomie, ohne die Öffnung zu behindern. Seien Sie vorsichtig, um den Kleber nicht in Kontakt mit der Dura zu bringen. Versiegeln Sie das Luer-Schloss mit einer zusätzlichen dünnen Leimschicht um die Außenbasis der Nabe.
- Bereiten Sie eine Gülle aus Zahnzement vor. Tragen Sie den Zement auf die Oberfläche des Schädels um und über die Basis der Luer-Schleusennbenabe auf, um ihn an Ort und Stelle zu sichern.
- Füllen Sie die Luer-Verriegelungsnabe mit einer sterilen konservierungsstofffreien künstlichen Cereberal-Rückenmarksflüssigkeit (CSF) Lösung (pH 7.4) mit einer Spritze und einer Nadel, so dass ein konvexer Bolus Kochstoff über der Felge zu sehen ist.
HINWEIS: Die Lösung hält die Dura feucht, da der Zahnzement trocknet, und dient als Hinweis auf die Integrität der Dichtung. Wenn die Lösungsstufe überhaupt fällt, ist dies ein Hinweis auf ein Leck im System und die Luer-Sperre muss entfernt und ersetzt werden. - Sobald der Zahnzement vollständig ausgehärtet ist, beenden Sie die Gasanästhesie und entfernen Sie die Ratte aus dem stereotaxic Rahmen.
- Platzieren Sie die Ratte auf einer Plattform neben dem FPI-Gerät.
- Das FPI-Gerät verfügt über eine gekrümmte Metallspitze, die sich vom Druckaufnehmer am Ende des Flüssigkeitsbehälters erstreckt. Sichern Sie eine 12 cm lange Druckschläuche am Ende der gekrümmten Spitze mit dem gegenüberliegenden Ende in einem 2 cm männlichen Luer Lock Twist Stecker. Sichern Sie die Ratte mit dem FPI-Gerät, indem Sie das weibliche Ende der Nabe am Schädel der Ratte mit dem männlichen Stecker verbinden.
HINWEIS: Stellen Sie sicher, dass die Verbindung fest gesichert ist und dass alle Luftblasen aus dem System entfernt wurden. - Das Tier in die Brusthöhe legen und wiederholt auf Rücknahmereflex überprüfen. Sobald die Ratte den Entzugsreflex wiedererlangt, aber immer noch sediert ist, lassen Sie das Pendel des FPI-Geräts los, um einen einzelnen Druckimpuls von 20 ms zu verursachen und Verletzungen auszulösen.
HINWEIS: Es ist wichtig, die Verletzung nicht zu induzieren, während das Tier tief anästhesiert ist, da dies dazu neigt, eine erhöhte Sterblichkeit aufgrund neurogener Lungenödeme zu verursachen. Alle Geräte weisen Variabilität auf. Auf dem für dieses Experiment verwendeten Gerät erzeugt jedoch eine 17°-Winkelplatzierung des Hammers einen atmosphärischen Druckimpuls von 2,2 - 2,3. Unverletzt, Scheintiere durchlaufen alle die gleichen Verfahren mit Ausnahme des tatsächlichen Flüssigkeitsimpulss zu den induzieren Verletzungen. - Trennen Sie die Ratte sofort von der FPI-Vorrichtung nach einer Verletzung, legen Sie sie in die Brustruhe und liefern Sie zusätzlichen Sauerstoff (1 L/min) über einen Nasenkegel, bis die spontane Atmung zurückkehrt. Apnoe ist eine vorweggenommene Folge der Verletzung. Falls erforderlich, geben Sie regelmäßige manuelle Atemzüge über eine Beutelventilmaske an, bis die Ratte spontan auf sich allein zu atmen beginnt.
HINWEIS: In der Regel dauert die Apnoe weniger als 2 min. Unmittelbar nach Der Verabreichung des Druckimpulses aufgrund eines Katecholaminausbruchs wird unmittelbar nach der Verabreichung des Druckimpulses ein vorübergehender schneller Anstieg der Herzfrequenz (>500 bpm) beobachtet. Dies kann mit einem Pulsoximeter am Fuß der Ratte überwacht werden und kann als möglicher Indikator dafür dienen, dass eine schwere Verletzung aufgetreten ist. - Überwachen Sie die Ratte kontinuierlich und erfassen Sie die Zeit der Rückkehr des Rechtenreflexes (stabile Ambulation an allen vier Gliedmaßen).
- Die Größe des atmosphärischen Druckimpulses für jede Ratte sollte innerhalb von 0,05 Atmosphären liegen. Vergewissern Sie sich, dass jeder Druckimpuls ein glattes Signal auf dem Oszilloskop mit konsistenter Amplitude und Dauer erzeugt.
HINWEIS: Ein lautes Signal kann auf Luftblasen im System hinweisen, die vor der Übergabe des Verletzungsimpulses entfernt werden müssen. Atmosphärische Druckimpulse, die in diesem Experiment eine schwere Verletzung verursachen, sind solche, die typischerweise zu Tierrechten von 30-60 min führen. Dieser Bereich der Richtigen ist mit einer Sterblichkeitsrate von etwa 40-50%) verbunden. - 10 ml vorgewärmte Saline subkutan als unterstützende Pflege verabreichen.
- Bringen Sie die Ratte in ihren Hauskäfig zurück und lassen Sie sie sich für mindestens 4 h erholen.
HINWEIS: Die erhöhte Sterblichkeit wurde beobachtet, wenn die Ratten sofort wieder unter Anästhesie gestellt werden.
2. Implantation kortikaler EEG-Elektroden und Video-EEG-Aufzeichnung
- Um 4 h nach verletzungsbedingter Behandlung der Ratte wie zuvor beschrieben und wieder in den stereotaktischen Rahmen legen, um die Luer-Verriegelungsnabe und den Zahnzement zu entfernen.
HINWEIS: Die Nabe und der Zement werden leicht mit moderatem Druck abgefangen. Wenn Sie die Nabe entfernen, überprüfen Sie sorgfältig auf Einen Bruch oder eine Beschädigung der Dura. Sofort einschläfern jedes Tier mit Schäden an der Dura. - Tragen Sie an jedem der Orte, an denen 5 Pilotbohrungen gebohrt werden sollen, einen kleinen Tropfen von 0,5 % Bupivacainhydrochlorid auf den Schädel auftragen (siehe Abbildung 1).
- Bohren Sie Pilotlöcher durch den Schädel mit einem handgehaltenen 0,1 mm Bohrer.
- Befestigen Sie eine Elektrodenschraube aus Edelstahl in jedes Pilotloch an folgenden Stellen: Eine Referenzschraube wird kaudal zum Lambda über das Kleinhirn gelegt. Aufnahmeelektroden werden platziert: 1) über der Hemisphäre ipsilateral und rostral zur Kraniektomie; 2) über die Hemisphäre ipsilateral und kaudal zur Kraniektomie; 3) über die Hemisphäre kontralateral und rostral zur Kraniektomie; 4) über die Hemisphäre kontralateral und kaudal zur Kraniektomie.
- Den Schädel mit 70% Ethanol abwischen, um Knochenstaub zu entfernen.
- Bedecken Sie die Kraniektomie-Stelle mit einer dünnen Schicht sterilen Knochenwachs, um die freiliegende Dura zu bedecken.
- Schließen Sie ein Elektrodenarray an die 5 EEG-Elektroden an, indem Sie das freiliegende Ende eines farbcodierten Elektrodendrahts eng um die dafür vorgesehene Edelstahl-Elektrodenschraube wickeln.
HINWEIS: Die entgegengesetzten Enden jedes Elektrodendrahtes werden an einer bestimmten, bestimmten Stelle innerhalb des Sockelsteckers positioniert. - Bereiten Sie eine Gülle aus Knochenzement vor.
- Sammeln Sie die Elektrodendrähte in eine Spule unter dem Sockel und sichern Sie die Drähte und den Sockel mit Knochenzement an Ort und Stelle. Halten Sie den Sockel in Position, bis der Knochenzement ausgehärtet ist.
HINWEIS: Der Knochen muss besonders trocken und ohne Restblut sein, um eine ordnungsgemäße Haftung zu erreichen und eine vorzeitige Entfernung des Senders zu verhindern. - Befestigen Sie den Funksender mit frischen Batterien am Sockel, bevor Sie das Tier aus dem stereotaktischen Rahmen entfernen.
- Legen Sie das Tier in seinen Käfig und legen Sie den Käfig in der Nähe des Empfängers und in Sichtweite einer bestimmten Videokamera. Initiieren Sie die Video-/EEG-Aufnahme.
3. Sammlung von Video-EEG-Aufnahmen
- Vor dem Sammeln von EEG-Signalen, machen Sie einen Frequenz-Sweep des Raumes, in dem Ratten für die EEG-Sammlung untergebracht werden, um mögliche störende Frequenzen zu identifizieren, um die Erfassung von EEG-Aufnahmen mit jeder Frequenz mit Hintergrundgeräuschen zu verhindern.
- Stellen Sie alle Sender auf bestimmte Frequenzen ein, die frei von Interferenzen sind.
- Stellen Sie die Abtastfrequenz und den Eingangsbereich jedes programmierbaren Senders ein.
HINWEIS: Dies kann mit einem intelligenten Tool erfolgen, das vom Systemhersteller bereitgestellt wird. Sender können mit einer maximalen Rate von 1000 Hz und einem maximalen Eingangsbereich von 10 mV abtasten. In diesem Experiment wurden EEG-Aufnahmen zwischen 0,5 Hz und 30 Hz analysiert. Daher wurde die Abtastrate auf 250 Hz festgelegt. Wir beobachten in der Regel Amplituden von weniger als 1 mV. Daher lag der eingestellte Eingangsbereich bei 2 mV. - Verwenden Sie die vom Hersteller bereitgestellte EEG-Sammlungssoftware, um Video-EEG ab dem Tag der Verletzung kontinuierlich aufzuzeichnen, das jeden drahtlosen Sender über eine eindeutige Frequenz mit einem bestimmten Empfänger verbindet.
HINWEIS: Jedes Senderempfängerpaar ist in der Lage, 4 monopolare EEG-Kanäle und Beschleunigungen in den Ebenen X, Y und Z zu überwachen. EEG-Daten können auf einen Speicherserver geschrieben werden. Die Videodaten sollten auf einem NAS-Gerät gespeichert werden, das mit dem Speicherserver verknüpft ist. Die EEG-Analysesoftware synchronisiert die Video- und EEG-Aufzeichnung basierend auf der vom Speicherserver verwalteten Zeit. - Verwenden Sie die Videosammlungssoftware, um Videos jeder Ratte mit einer eigenen Kamera mit 2 MP Auflösung (1920 x 1080) aufzunehmen, die für die Aufnahme mit 30 Bildern/s konfiguriert ist.
HINWEIS: Jede Kamera verfügt über eine eigene Infrarotbeleuchtung für die Videosammlung in der Nacht. - Konfigurieren Sie das System so, dass alle Video- und EEG-Aufnahmen alle 24 Stunden automatisch auf einem Speicherserver gespeichert werden. Die Videos produzieren ziemlich große Dateien.
4. Video-/EEG-Analyse
- Synchronisieren Sie das Video mit jeder EEG-Aufnahme mit 1/10 s Auflösung. Dazu verwenden Sie die Video-/EEG-Analysesoftware des Systemherstellers, die eine Metadatei mit dem Stempel der genauen Zeit sowohl des EEG als auch des Videos erstellt.
- Überprüfen Sie manuell EEG-Aufzeichnungen, um Indexereignisse zu identifizieren, die die Anfallsaktivität definieren.
- Erstellen Sie mithilfe der Video-/EEG-Analysesoftware und des Index-EEG-Ereignisse eine Konfigurationsdatei, die Schlüsselparameter verwendet (d. h. Leistung in bestimmten Frequenzbändern, Verhältnis von Frequenzbändern zur Gesamtleistung, Beschleunigungsschwelle usw.), um die Merkmale zu definieren. der potenziellen Anfallsereignisse.
- Führen Sie die EEG-Analysesoftware aus, um potenzielle Regionen der EEG-Aufzeichnung zu identifizieren, die sich basierend auf den in der Konfigurationsdatei ausgewählten Parametern qualifizieren.
HINWEIS: Die EEG-Analysesoftware ermöglicht die automatische Anfallserkennung und hebt Interessensbereiche für die EEG-Signale hervor und bietet eine FFT-Leistungsspektrumanalyse über das Signal hinweg. - Bestätigen Sie mögliche krampfhafte Anfälle mithilfe von Videoaufzeichnungen, die während der Erfassung gesammelt wurden und die mit den jeweiligen EEG-Aufnahmen der jeweiligen Ratte synchronisiert werden.
Ergebnisse
Mit diesem Modell induzierten wir schwere SBBI in erwachsene, männliche, Wistar Ratten. Unter den Bedingungen, die wir hier beschreiben, beobachten wir in der Regel Sterblichkeitsraten von 40-50%, und die Richtigereflexzeiten von 30 - 60 min wie zuvor beschrieben20. Wir konnten Ab dem Tag der Verletzung 24 stunden/Tag Video-/EEG-Aufnahmen sammeln. Abbildung 1A zeigt ein Diagramm, das die Lage von vier monopolaren EEG-Elektroden und einer einzigen Referenzelektrode zeigt. Bilder, die den Ort und das Aussehen der zu erwartenden TBI-Läsionen mit den hier beschriebenen Bedingungen veranschaulichen, sind in Abbildung 1B-Ddargestellt. Unter den hier beschriebenen Bedingungen beobachten wir konsequent delta Verlangsamung innerhalb der ersten drei Tage nach TBI. Weniger schwer verletzte Ratten weisen einseitige, intermittierende Deltaverlangsamung auf (Abbildungen 2C-D). Im Gegensatz dazu wird eine kontinuierliche, bilaterale Deltaverlangsamung nach schwereren Verletzungen beobachtet (Abbildung 3C-D). Ein gewisser Grad der Deltaverlangsamung wurde konsequent bei allen TBI-Ratten beobachtet, aber nicht bei Schein-Kontrollratten (nur Kraniektomie) festgestellt(Abbildungen 2A-B; 3A-B). In den ersten drei Tagen nach der Verletzung wurde bei den meisten TBI-Ratten eine weitgehende Verlangsamung des Deltas beobachtet. Interessanterweise zeigen Ratten in der Regel ausgeprägte Gewichtsverlust während der ersten drei Tage nach der Verletzung. Nicht krampfhafte Anfälle werden gelegentlich in der ersten Woche nach TBI beobachtet (Abbildung 4 C-D). Klinische Anfälle, die als Spike-Cluster im Zusammenhang mit aufzucht und fallen sowie Unterarm-Klonus dargestellt werden können, können nach 1-Woche nach TBI beobachtet werden (Abbildung 5C-D). Schließlich zeigt Abbildung 6 repräsentative Bilder von gelegentlichen intermittierenden Signalausfällen und Signalverlusten aufgrund eines Batterieausfalls.
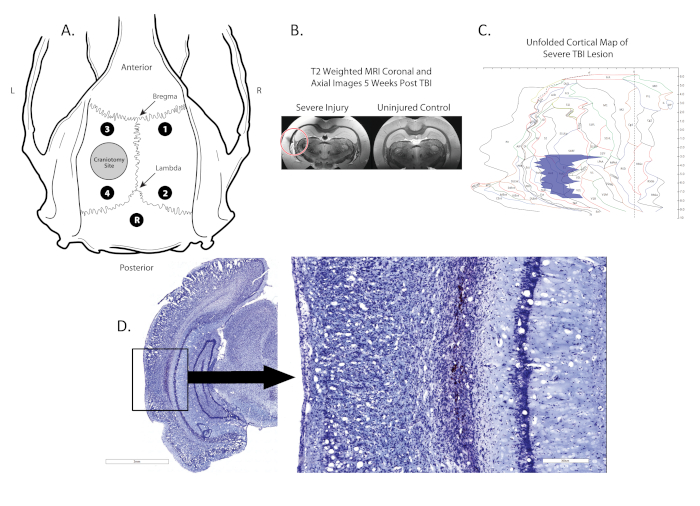
Abbildung 1 . Ort der Kraniektomie, Elektrodenplatzierung und Läsion. (A) zeigt ein schematisches Diagramm des Rattenschädels mit den Positionen der Kraniektomie (grauer Kreis in der linken Hemisphäre), vier Monopolelektroden (Schwarze Punkte; 1,2,3,4) zwischen Bregma und Lambda und einer Referenzelektrode (Schwarzer Punkt, R) platzierte Mittellinie, hinter dem Lambda; (B) zeigt koronare post-mortem T2-MRT-Scans mit der Stelle der Läsion, die durch einen roten Kreis identifiziert wird; (C) zeigt eine 2D-Karte des Kortex, wo die Lage und Größe der Läsion identifiziert wird (blaue Region). (D) zeigt einen Nissl-gefärbten koronalen Abschnitt mit der Läsion, die Läsion ist 100-fach vergrößert im Bild rechts. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2 . Einseitige, intermittierende Deltaverlangsamung, die am Tag eines moderaten TBI gesammelt wurde. (A) zeigt eine 90 s EEG-Spur einer scheinoperierten, unverletzten Kontrollratte am Tag der Operation. Alle vier Kanäle werden vorgestellt. Eine 10 s lange Spur (aus dem boxed Bereich) wurde aus dem 3. Kanal extrahiert, um das Basis-EEG-Muster besser zu visualisieren. Ein 2048 ms EPOC-Abschnitt davon wurde dann ausgewählt, um in der entsprechenden FFT analysiert zu werden. (B) FFT-Analyse von 2048 ms ausgewählte EPOC aus dem unverletzten Schein-operierten Tier am Tag der Operation. (C) zeigt eine 90 s EEG-Spur, die das intermittierende, einseitige Delta-Verlangsamungsmuster eines mittelschwer verletzten Tieres am Tag der Verletzung zeigt. Eine 10 s lange Spur (aus dem boxed Bereich) wurde aus dem 3. Kanal extrahiert, um das Delta-Verlangsamungs-EEG-Muster besser zu visualisieren. Ein 2048 ms EPOC-Abschnitt davon wurde dann ausgewählt, um in der entsprechenden FFT analysiert zu werden. (D) FFT-Analyse von 2048 ms wählte EPOC aus dem mittelschweren TBI-Tier am Tag der Verletzung. 90 s EEG-Spuren, von oben nach unten sind Biopotentiale 1, 2, 3, 4, entsprechend ihren Standorten rund um die Kraniektomie-Site, wie in Abbildung 1zu sehen . Graue vertikale Markierungen definieren 1 s Intervalle auf den EEG-Spuren. Alle EEG-Spuren werden auf einer Skala von 500 V dargestellt. Innerhalb der FFT-Analysediagramme betrug der insgesamt analysierte Frequenzbereich 0,5-30 Hz. Dies wurde weiter in 4 separate Frequenzbänder von Delta (Gelb, 0,5-4 Hz), Theta (Purple, 4-8 Hz), Alpha (Red, 8-12 Hz) und Beta (Grün, 12-30 Hz) unterteilt. % (Leistung) Diagramm in der FFT-Analyse zeigt, welcher Prozentsatz der Gesamtleistung im analysierten EPOC stammt aus jedem zuvor angegebenen Frequenzband, so dass eine weitere mathematische Charakterisierung der EEG-Wellenformmuster ermöglicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
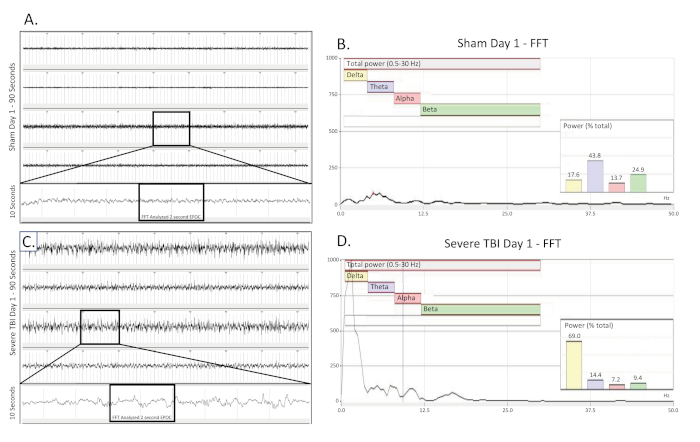
Abbildung 3 . Bilaterale, kontinuierliche Deltaverlangsamung, die am Tag eines schweren TBI gesammelt wurde. (A) zeigt eine 90 s EEG-Spur einer scheinoperierten, unverletzten Kontrollratte am Tag der Operation. Alle vier Kanäle werden vorgestellt. Eine 10 s lange Spur (aus dem boxed Bereich) wurde aus dem 3. Kanal extrahiert, um das Basis-EEG-Muster besser zu visualisieren. Ein 2048 ms EPOC-Abschnitt davon wurde dann ausgewählt, um in der entsprechenden FFT analysiert zu werden. (B) FFT-Analyse von 2048 ms ausgewählte EPOC aus dem unverletzten Schein-operierten Tier am Tag der Operation. (C) zeigt eine 90 s EEG-Spur, die das kontinuierliche, bilaterale Delta-Verlangsamungsmuster eines schwer verletzten Tieres am Tag der Verletzung zeigt. Eine 10 s lange Spur (aus dem boxed Bereich) wurde aus dem 3. Kanal extrahiert, um das Delta-Verlangsamungs-EEG-Muster besser zu visualisieren. Ein 2048 ms EPOC-Abschnitt davon wurde dann ausgewählt, um in der entsprechenden FFT analysiert zu werden. (D) FFT-Analyse von 2048 ms wählte EPOC aus dem schweren TBI-Tier am Tag der Verletzung. 90 s EEG-Spuren, von oben nach unten sind Biopotentiale 1, 2, 3, 4, entsprechend ihren Standorten rund um die Kraniektomie-Site, wie in Abbildung 1zu sehen . Graue vertikale Markierungen definieren 1 s Intervalle auf den EEG-Spuren. Alle EEG-Spuren werden auf einer Skala von 500 V dargestellt. Innerhalb der FFT-Analysediagramme betrug der insgesamt analysierte Frequenzbereich 0,5-30 Hz. Dies wurde weiter in 4 separate Frequenzbänder von Delta (Gelb, 0,5-4 Hz), Theta (Purple, 4-8 Hz), Alpha (Red, 8-12 Hz) und Beta (Grün, 12-30 Hz) unterteilt. % (Leistung) Diagramm in der FFT-Analyse zeigt, welcher Prozentsatz der Gesamtleistung im analysierten EPOC stammt aus jedem zuvor angegebenen Frequenzband, so dass eine weitere mathematische Charakterisierung der EEG-Wellenformmuster ermöglicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
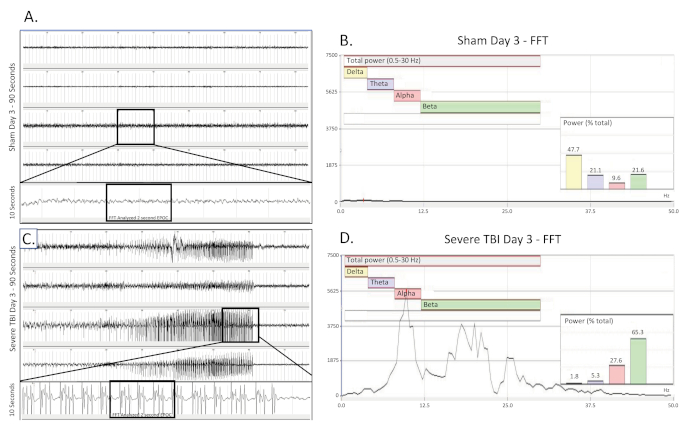
Abbildung 4 . Nicht konvulsive elektrografische Anfall gesammelt 3 Tage nach schweren TBI. (A) zeigt eine 90 s EEG-Spur von einer Schein-operierten, unverletzten Kontrollratte 3 Tage25 nach der Operation. Alle vier Kanäle werden vorgestellt. Eine 10 s lange Spur (aus dem boxed Bereich) wurde aus dem 3. Kanal extrahiert, um das Basis-EEG-Muster besser zu visualisieren. Ein 2048 ms EPOC-Abschnitt davon wurde dann ausgewählt, um in der entsprechenden FFT analysiert zu werden. (B) FFT-Analyse von 2048 ms wählte EPOC aus dem unverletzten Schein-operierten Tier am Tag drei25 nach der Operation. (C) zeigt eine 90 s EEG-Spur drei 25 Tage nach schwerer Verletzung. Diese Show Gebäude, schnelle Spiking Muster präsentieren bilateral und über alle 4 Sammelkanäle. Eine 10 s lange Spur (aus dem Box-Bereich) wurde aus dem 3. Kanal extrahiert, um das spiking EEG-Muster besser zu visualisieren. Ein 2048 ms EPOC-Abschnitt davon wurde dann ausgewählt, um in der entsprechenden FFT analysiert zu werden. (D) FFT-Analyse von 2048 ms wählte EPOC aus dem schweren TBI-Tier am Tag der Verletzung. 90 s EEG-Spuren, von oben nach unten sind Biopotentiale 1, 2, 3, 4, entsprechend ihren Standorten rund um die Kraniektomie-Site, wie in Abbildung 1zu sehen . Graue vertikale Markierungen definieren 1 s Intervalle auf den EEG-Spuren. Alle EEG-Spuren werden auf einer Skala von 500 V dargestellt. Innerhalb der FFT-Analysediagramme betrug der insgesamt analysierte Frequenzbereich 0,5-30 Hz. Dies wurde weiter in 4 separate Frequenzbänder von Delta (Gelb, 0,5-4 Hz), Theta (Purple, 4-8 Hz), Alpha (Red, 8-12 Hz) und Beta (Grün, 12-30 Hz) unterteilt. % (Leistung) Diagramm in der FFT-Analyse zeigt, welcher Prozentsatz der Gesamtleistung im analysierten EPOC stammt aus jedem zuvor angegebenen Frequenzband, so dass eine weitere mathematische Charakterisierung der EEG-Wellenformmuster ermöglicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
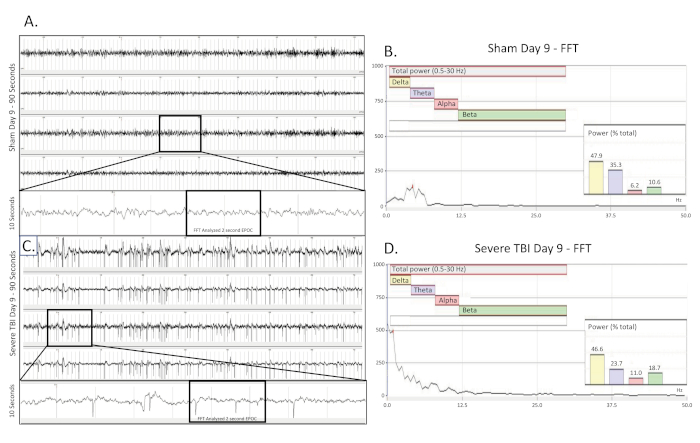
Abbildung 5 . Konvulsive elektrografische Anfall gesammelt 9 Tage nach TBI. (A) zeigt neun (9) Tage nach der Operation eine 90 s EEG-Spur einer scheinoperierten, unverletzten Kontrollratte. Alle vier Kanäle werden vorgestellt. Eine 10 s lange Spur (aus dem boxed Bereich) wurde aus dem 3. Kanal extrahiert, um das Basis-EEG-Muster besser zu visualisieren. Ein 2048 ms EPOC-Abschnitt davon wurde dann ausgewählt, um in der entsprechenden FFT analysiert zu werden. (B) FFT-Analyse von 2048 ms wählte EPOC aus dem unverletzten Schein-operierten Tier am Tag neun (9) nach der Operation. (C) zeigt eine 90 s EEG-Spur neun (9) Tage nach schwerer Verletzung. Diese Show Gebäude, schnelle Spiking Muster präsentieren bilateral und über alle 4 Sammelkanäle. Eine 10 s lange Spur (aus dem Box-Bereich) wurde aus dem 3. Kanal extrahiert, um das spiking EEG-Muster besser zu visualisieren. Ein 2048 ms EPOC-Abschnitt davon wurde dann ausgewählt, um in der entsprechenden FFT analysiert zu werden. (D) FFT-Analyse von 2048 ms ausgewählte EPOC aus dem schweren TBI-Tier neun (9) Tage nach der Verletzung. 90 s EEG-Spuren, von oben nach unten sind Biopotentiale 1, 2, 3, 4, entsprechend ihren Standorten rund um die Kraniektomie-Site, wie in Abbildung 1zu sehen . Graue vertikale Markierungen definieren 1 s Intervalle auf den EEG-Spuren. Alle EEG-Spuren werden auf einer Skala von 500 V dargestellt. Innerhalb der FFT-Analysediagramme betrug der insgesamt analysierte Frequenzbereich 0,5-30 Hz. Dies wurde weiter in 4 separate Frequenzbänder von Delta (Gelb, 0,5-4 Hz), Theta (Purple, 4-8 Hz), Alpha (Red, 8-12 Hz) und Beta (Grün, 12-30 Hz) unterteilt. %(Power)-Diagramm, das in der FFT-Analyse dargestellt wird, zeigt, welcher Prozentsatz der Gesamtleistung im analysierten EPOC aus jedem zuvor angegebenen Frequenzband stammt, was eine weitere mathematische Charakterisierung der EEG-Wellenformmuster ermöglicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
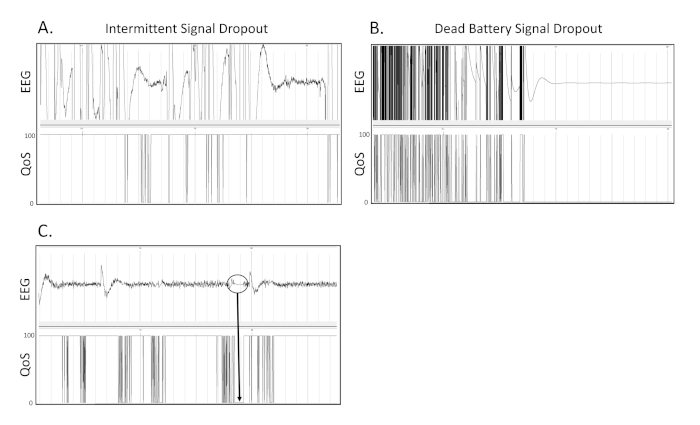
Abbildung 6 . Signal-Drop-out. Dies sind 3 separate Beispiele dafür, welches Signal aufgrund von Sender- oder Empfängerproblemen wie bei der EEG-Aufzeichnung ausfällt. (A) Dies ist ein Beispiel für den intermittierenden Ausfall des EEG-Signals auf einer Aufzeichnung. (B) Dies ist ein Beispiel für das Aussetzen aufgrund von Batterieausfällen während der kontinuierlichen drahtlosen Telemetrie erscheint wie bei einer EEG-Ablaufverfolgung. (C) Innerhalb des eingekreisten Bereichs kann man sehen, dass die EEG-Ablaufverfolgung abgeflacht und bei 0 V stagniert, wenn die Signalqualität (QoS) von 100 auf 0 sinkt. Graue vertikale Markierungen definieren 1 s Intervalle auf den EEG-Spuren. Alle EEG-Spuren werden auf einer Skala von 500 V dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Es wurden erhebliche Unterschiede zwischen Laboratorien hinsichtlich der spezifischen Parameter und Methoden des FPI TBI-Modells 14,26,27,28berichtet. Diese Inkonsistenzen haben zu widersprüchlichen Ergebnissen geführt und erschweren die Harmonisierung der Bemühungen und Ergebnisse zwischen den Labors. Hier haben wir eine detaillierte Methodik vorgestellt, die unseren Ansatz zur langfristigen, kontinuierlichen Aufzeichnung von Video/EEG zur Überwachung posttraumatischer epileptiformer Aktivität beschreibt. Eine Reihe von Schritten sind entscheidend, um reproduzierbare Ergebnisse mit der beschriebenen Methode zu generieren.
Erstens, da die Inzidenz von posttraumatischer Epilepsie mit der Schwere der Verletzung korreliert, gelten Bedingungen, die zu den schwersten TBI führen. Verwenden Sie insbesondere eine 5 mm Kraniektomie, um sicherzustellen, dass eine ausreichend große Dura-Fläche freigelegt wird. Darüber hinaus sichern Sie eine weiblich-weibliche Luer-Verriegelung auf der Oberfläche des Schädels, wobei die Öffnung direkt über der Kraniektomie platziert wird. Dies unterscheidet sich von anderen Labors, die eine kleinere Kraniektomie (3 mm) verwendet und/oder eine modifizierte Nadelnbenabe in die Kraniektomie gelegt haben, was die Öffnungsgröße effektiv reduziert. Durch platzieren des Luer-Schlosses außerhalb der Kraniektomie wird die 5mm-Öffnung beibehalten. Diese spezifischen Parameter wirken sich auf die Gesamtkraft aus, die auf die Dura angewendet wird. Der atmosphärische Druck, der auf die Dura ausgeübt wird, hat auch einen großen Einfluss auf die Schwere der beobachteten Verletzung. Leider ist der Luftdruck sehr variabel und scheint geräteabhängig zu sein. Einige Labore haben berichtet, einen Druckimpuls von 8 - 10 ms18anzuwenden. Im Gegensatz dazu ergibt die hier beschriebene Methode einen Druckimpuls von 20 ms. Dies stimmt mit anderen Labors überein, die schwerere Verletzungen zu verursachen scheinen 14,28. Es ist klar, dass der verletzungsfördernde Druckimpuls ein Parameter ist, der eine erhebliche Variabilität zwischen Laboren zeigt und empirisch definiert werden muss. Die Schwere der Verletzung kann jedoch auf der Grundlage einer Kombination von Sterblichkeitsraten (40-50%), der Richtigen Reflexzeiten (>30 min)26bestimmt werden. Es ist auch wichtig, dass nur Tiere mit einer intakten Dura in die Studie einbezogen werden. Darüber hinaus, wenn die Kraniektomie durch einen Klebstoff oder Zement so okkludieren, dass ein Teil der Dura unter der Kraniektomie nicht der vollen Kraft des Flüssigkeitsdruckimpulses ausgesetzt ist, dann sollte das Tier aus der Studie eliminiert werden. Auch überschüssiger Kleber unter dem Luer-Schloss kann an der Dura haften und mit der Zementkappe auch nach einer erfolgreichen Verletzung entfernen. Schließlich gibt die glatte Form der Druckimpulskurve auf der Oszilloskopspur den Hinweis, dass sich keine Luftblasen in der Flüssigkeitskammer befinden, und zeigt an, dass sich der Kolben ohne Impedanz bewegt.
Anästhesie ist ein weiterer kritischer Faktor, der kontrolliert werden muss. Isoflurane Exposition sollte auf den niedrigsten Niveau möglich gehalten werden, um eine chirurgische Ebene der Anästhesie zu halten. Ratten, die höheren Isofluran- oder längeren Dauern ausgesetzt sind, entwickeln eher neurogen-induzierte Lungenödeme. Die Vorbereitung des Schädels stellt einen weiteren kritischen Aspekt der Methode dar. Insbesondere das Trocknen des Schädels und das Entfernen von Knochenstaub hilft, die Ratten daran zu hindern, den Sender vorzeitig zu entfernen.
Die Platzierung der Schrauben und der Anschluss der EEG-Drähte sind offensichtlich entscheidend für die Produktion konsequent reproduzierbarer Aufnahmen. Es ist wichtig, dass die Schrauben nicht zu tief platziert werden, um eine Läsion auf dem Gehirn zu induzieren. Die Knochenklappe, die von der Kraniektomie der erwachsenen (12 Wochen alten) männlichen Wistar-Ratten geborgen wurde, ist durchweg 2 mm dick. Verwenden Sie EEG-Elektrodenschrauben mit einer 2,5 mm Welle. Es ist hilfreich, die Spitzen der gekrümmten Mückenhämostatik Zange als Abstandser zu verwenden, um sicherzustellen, dass die Schrauben nur bis zur Basis des Knochens reichen und nicht in das Gehirn ragen.
Der hier vorgestellte Ansatz hat einige Einschränkungen. Die Batterien müssen regelmäßig gewechselt werden. Die Häufigkeit von Batteriewechseln hängt von der Abtastrate ab. Batterien werden in der Regel einmal pro Woche bei einer Abtastrate von 1000 Hz gewechselt. Dieser Zeitrahmen kann durch eine Reduzierung der Abtastrate verlängert werden. Das System beschränkt sich auch auf die Aufzeichnung von vier monopolaren EEG-Elektroden. Dies bietet jedoch zwei Kanäle pro Hemisphäre und kann zwischen fokalen und verallgemeinerten Ereignissen unterscheiden und zwischen vorderen und hinteren Veränderungen unterscheiden. Trotz dieser Einschränkungen bietet dieser Ansatz eine vernünftige Methode zur kontinuierlichen Video-/EEG-Überwachung und Detektion von epilepptiformen Veränderungen nach schweren TBI-Änderungen.
Die hier beschriebene Methode führt sowohl zu elektrografischen als auch zu krampfhaften Anfällen innerhalb eines Monats nach TBI. Daher bietet dieser Ansatz einen angemessenen Zeitrahmen, in dem potenzielle Therapeutika zur Vorbeugung von Epileptogenese nach schwerem TBI untersucht werden können. Dieser Ansatz bietet auch eine Methode zur Untersuchung der molekularen Mechanismen im Zusammenhang mit PTE und kann zur Identifizierung potenzieller Biomarker führen, die verwendet werden können, um Patienten zu identifizieren, die am meisten von der Entwicklung von PTE betroffen sind.
Offenlegungen
Chelasea R Richardson ist Mitarbeiterin von emka Scientific, dem Anbieter dieses beschriebenen drahtlosen Telemetriesystems.
Danksagungen
Wir danken Paul Dressel für seine unschätzbare Unterstützung bei der grafischen Gestaltung und Erstellung von Figuren.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.00 mm Drill Bits | Drill Bit City: New Carbide Tools | 05M200 | |
| 3M ESPE Durelon Carboxylate Cement | 3M , Neuss Germany | 38019 | Dental Cement |
| 4-0 Suture | Ethicon, Sommerville, NJ | K831H | 4-0 Ethicon Perma-hand Silk, 26mm 1/2c Taperpoint, 30" (75cm), Black Braided non-absorbable suture |
| 5 mm outer diameter trephine | Fine Science Tools | 18004-50 | |
| Bonewax | Medline Industries, Mendelcin, IL | REF DYNJBW25 | |
| Buprenorphine HCL, Injection (0.3 mg/mL) 1 mL vial | Par Pharmalogical, Chestnut Ridge NY | 3003706 | NDC 42023-179-01 |
| Dumont #6 Forceps | Fine Science Tools | 11260-20 | |
| Dumont #7b Forceps | Fine Science Tools | 11270-20 | |
| ecgAUTO | EMKA Technologies, Falls Church, VA | ||
| Female Luer Thread Style Coupler Clear Polycarbonare | Cole-Palmer instrument | SKO#45501-22 | Order lot #214271 |
| Foot Power Drill | Grobet USA, Carlstadt, NJ | Model C-300 | |
| GentaMax 100 (Gentamicin, Sulfate Solution) | Phoenix, Manufactured by Clipper Distributing Company LLC, St. Joseph, MO | NDC 57319-520-05 | |
| Hill's Prescription Diet a/d Canine/Feline | Hill's Pet Nutrition, Inc. , Topeka, KS | ||
| IOX2 Software | EMKA Technologies, Falls Church, VA | ||
| Isoflorane, USP | Piramal Enterprise Limited, Andhra, India | NDC 66794-013-25 | |
| IsoTech Anesthesia machine | SurgiVet | WWV9000 | |
| Lateral FPI device | AmScien | 302 | curved tip, with pressure tubing extension. connected via screw lock connector (Cole-Palmer; #4550-22) |
| Leica A60 Stereomicroscope | Leica Biosystems, Richmond, VA | PN: 10 450 488 | |
| Marcaine (0.5%) Bupivacaine hcl injection usp 5 mg/mL | Hospira, Lake Forest, IL | CA-3627 | 50mL multiple dose vial; NDC 0409-1610-50 |
| Micro-Adson Forceps | Fine Science Tools | 11018-12 | |
| Olsen-Hegar Needle Holders with Suture Cutters | Fine Science Tools | 12002-14 | |
| PALACOS R+G bone cement with gentamicin | Heraeus, | REF: 5036964 | Radiopaque bone cement containing 1 x 0.5g Gentamicin |
| Physio Suite | Kent Scientific, Terrington, CT | ||
| Povidone-iodine solution | Betadine | ||
| Puralube Vet Ointment | Dechra Veterinary Products, Overland Park KS | NDC 17033-211-38 | |
| Scalpel blade (#10) and holder | Integra Miltex, York, PA | REF: 4-110 | |
| Scalpel Handle - #4 | Fine Science Tools | 10004-13 | |
| Sickle Knife | Bausch + Lomb Storz Instruments | N1705 HM | 5mm curved blade. Round handle. Overall length 168mm, 6.6 inches. |
| Silverstein Micro Mirror | Bausch + Lomb Storz Instruments | N1706 S8 | 3mm diameter. Angled 45 degrees. Overall length 180mm, 7.2 inches |
| Storage NAS | Synology Inc. | DS3615xs | |
| Synology Assistant | Synology Inc. | ||
| Thermal Cautery Unit | Geiger Medical Technology, Delasco Council Bluffs, IA | Model NO: 150 | |
| Vetivex | Dechra Veterinary Products, Overland Park KS | Veterinary pHyLyteTM Injection pH 7.4 (Multiple Electrolytes Injection, Type 1, USP) | |
| Video Cameras | TRENDnet, Torrance, CA | TV-IP314PI | Indoor/Outdoor 4MP H.265 WDR PoE IR Bullet Network Cameral |
| Video NAS | Synology Inc. | DS916 | |
| Wistar IGS rats | Charles River | strain code 003 | 12 wk old at the time of injury |
| Wullstein Retractor | Fine Science Tools | 17018-11 |
Referenzen
- Flanagan, S. R. Invited Commentary on Centers for Disease Control and Prevention Report to Congress: Traumatic Brain Injury in the United States: Epidemiology and Rehabilitation. Archives of Physical Medicine and Rehabilitation. 96, 1753-1755 (2015).
- Annegers, J. F., Coan, S. P., Hauser, W. A., Leestma, J., Duffell, W., Tarver, B. Epilepsy, vagal nerve stimulation by the NCP system, mortality, and sudden, unexpected, unexplained death. Epilepsia. 39, 206-212 (1998).
- Lowenstein, D. H. Epilepsy after head injury: an overview. Epilepsia. 50, 4-9 (2009).
- Englander, J., et al. Analyzing risk factors for late posttraumatic seizures: a prospective, multicenter investigation. Archives of Physical Medicine and Rehabilitation. 84, 365-373 (2003).
- Faul, M. X. L., Wald, M. M., Coronado, V. G. Traumatic Brain Injury in the United States: Emergency Department Visits, Hospitalizations and Deaths 2002-2006. Centers for Disease Control and Prevention, National Center for Injury Prevention and Control. , (2010).
- Herman, S. T. Epilepsy after brain insult: targeting epileptogenesis. Neurology. 59, 21-26 (2002).
- Annegers, J. F., Coan, S. P. The risks of epilepsy after traumatic brain injury. Seizure. 9, 453-457 (2000).
- Christensen, J., Pedersen, M. G., Pedersen, C. B., Sidenius, P., Olsen, J., Vestergaard, M. Long-term risk of epilepsy after traumatic brain injury in children and young adults: a population-based cohort study. Lancet. 373, 1105-1110 (2009).
- Webb, T. S., Whitehead, C. R., Wells, T. S., Gore, R. K., Otte, C. N. Neurologically-related sequelae associated with mild traumatic brain injury. Brain Injury. 29, 430-437 (2015).
- Mahler, B., Carlsson, S., Andersson, T., Adelow, C., Ahlbom, A., Tomson, T. Unprovoked seizures after traumatic brain injury: A population-based case-control study. Epilepsia. 56, 1438-1444 (2015).
- Wang, H., et al. Post-traumatic seizures--a prospective, multicenter, large case study after head injury in China. Epilepsy Research. 107, 272-278 (2013).
- Simonato, M., French, J. A., Galanopoulou, A. S., O'Brien, T. J. Issues for new antiepilepsy drug development. Current Opinion in Neurology. 26, 195-200 (2013).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injury. Nature Review Neuroscience. 14, 128-142 (2013).
- Kharatishvili, I., Nissinen, J. P., McIntosh, T. K., Pitkanen, A. A model of posttraumatic epilepsy induced by lateral fluid-percussion brain injury in rats. Neuroscienc. 140, 685-697 (2006).
- McIntosh, T. K., et al. Traumatic brain injury in the rat: characterization of a lateral fluid-percussion model. Neuroscience. 28, 233-244 (1989).
- Thompson, H. J., et al. Lateral fluid percussion brain injury: a 15-year review and evaluation. Journal of Neurotrauma. 22, 42-75 (2005).
- Curia, G., Eastman, C. L., Miller, J. W., D'Ambrosio, R., Laskowitz, D., Grant, G. Modeling Post-Traumatic Epilepsy for Therapy Development. Translational Research in Traumatic Brain Injury. , (2016).
- D'Ambrosio, R., Fairbanks, J. P., Fender, J. S., Born, D. E., Doyle, D. L., Miller, J. W. Post-traumatic epilepsy following fluid percussion injury in the rat. Brain. 127, 304-314 (2004).
- Saatman, K. E., et al. Classification of traumatic brain injury for targeted therapies. Journal of Neurotrauma. 25, 719-738 (2008).
- Smith, D., Brooke, D., Wohlgehagen, E., Rau, T., Poulsen, D. Temporal and Spatial Changes in the Pattern of Iba1 and CD68 Staining in the Rat Brain Following Severe Traumatic Brain Injury. Modern Research in Inflammation. 4, 9-23 (2015).
- Ndode-Ekane, X. E., et al. Harmonization of lateral fluid-percussion injury model production and post-injury monitoring in a preclinical multicenter biomarker discovery study on post-traumatic epileptogenesis. Epilepsy Research. 151, 7-16 (2019).
- Ciszek, R., et al. Informatics tools to assess the success of procedural harmonization in preclinical multicenter biomarker discovery study on post-traumatic epileptogenesis. Epilepsy Research. 150, 17-26 (2019).
- Immonen, R., et al. Harmonization of pipeline for preclinical multicenter MRI biomarker discovery in a rat model of post-traumatic epileptogenesis. Epilepsy Research. 150, 46-57 (2019).
- Kamnaksh, A., et al. Harmonization of pipeline for preclinical multicenter plasma protein and miRNA biomarker discovery in a rat model of post-traumatic epileptogenesis. Epilepsy Research. 149, 92-101 (2019).
- Redell, J. B., Moore, A. N., Ward, N. H., Hergenroeder, G. W., Dash, P. K. Human traumatic brain injury alters plasma microRNA levels. Journal of Neurotrauma. 27, 2147-2156 (2010).
- Smith, D., et al. Convulsive seizures and EEG spikes after lateral fluid-percussion injury in the rat. Epilepsy Research. 147, 87-94 (2018).
- Eastman, C. L., Fender, J. S., Temkin, N. R., D'Ambrosio, R. Optimized methods for epilepsy therapy development using an etiologically realistic model of focal epilepsy in the rat. Experimental Neurology. 264, 150-162 (2015).
- Shultz, S. R., et al. Can structural or functional changes following traumatic brain injury in the rat predict epileptic outcome. Epilepsia. 54, 1240-1250 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten