Method Article
Utilisation d'un système vidéo-EEG sans fil pour surveiller les décharges épileptiformes à la suite d'une lésion cérébrale traumatique induite par le fluide latéral
Dans cet article
Résumé
Ici nous présentons un protocole pour induire TBI grave avec le modèle latéral de percussion de fluide (FPI) modèle dans les rats adultes et mâles de Wistar. Nous démontrons également l'utilisation d'un système de télémétrie sans fil pour recueillir des enregistrements vidéo-EEG continus et surveiller les décharges épileptiformes compatibles avec l'épileptogenèse post-traumatique.
Résumé
Le modèle des lésions latérales des percussions de liquide (FPI) est bien établi et a été utilisé pour étudier le TBI et l'épilepsie post-traumatique (TP). Cependant, une variabilité considérable a été signalée pour les paramètres spécifiques utilisés dans les différentes études qui ont utilisé ce modèle, ce qui rend difficile l'harmonisation et l'interprétation des résultats entre les laboratoires. Par exemple, la variabilité a été rapportée en ce qui concerne la taille et l'emplacement de la craniectomie, la façon dont le moyeu de verrouillage de Luer est placé par rapport à la craniectomie, la pression atmosphérique appliquée à la dura et la durée de l'impulsion de pression. Chacun de ces paramètres peut avoir un impact sur la gravité des blessures, ce qui est directement corrélé avec l'incidence de l'ETC. Ceci s'est manifesté comme un large éventail de taux de mortalité, des temps réflexes de redressement et l'incidence des saisies convulsives rapportées. Nous fournissons ici un protocole détaillé pour la méthode que nous avons utilisée pour faciliter l'harmonisation entre les études. Nous avons utilisé FPI en combinaison avec un système de télémétrie Sans fil EEG pour surveiller en permanence les changements électrographiques et détecter l'activité de saisie. FPI est induit par la création d'une craniectomy de 5 mm au-dessus de l'hémisphère gauche, entre le Bregma et Lambda et adjacent à la crête latérale. Un moyeu de serrure de Luer est fixé sur le crâne au-dessus de la craniectomie. Ce moyeu est connecté à l'appareil FPI, et une impulsion de pression de 20 millisecondes est livrée directement à la dura intacte par le tube de pression connecté au moyeu via un connecteur de verrouillage de torsion. Après la récupération, les rats sont ré-anesthésiés pour enlever le moyeu. Cinq vis d'électrode EEG en acier inoxydable de 0,5 mm sont placées en contact avec la dura à travers le crâne et servent de quatre électrodes d'enregistrement et d'une électrode de référence. Les fils d'électrodes sont recueillis dans un connecteur de piédestal qui est fixé en place avec du ciment osseux. Les enregistrements vidéo/EEG continus sont recueillis jusqu'à 4 semaines après TBI.
Introduction
Dans un rapport de 2015 au Congrès, les Centers for Disease Control ont signalé qu'environ 2,5 millions de personnes par an souffrent de lésions cérébrales traumatiques (TBI) aux États-Unis1. On estime que tBI cause 20% des épilepsies symptomatiques et 5% de toutes les épilepsies2,3,4. En outre, environ 20% des patients atteints de TBI développent une épilepsie post-traumatique5. Fait important, les crises chroniques et récurrentes qui se produisent à la suite de tBI sont souvent pharmacorésistantes, augmentant le fardeau de la maladie6. Les mécanismes exacts qui mènent à l'épilepsie post-traumatique (PTE) restent peu clairs. Cependant, plusieurs études épidémiologiques clés ont examiné l'incidence et le risque potentiel de développer l'épilepsie post-traumatique (PTE)2,4,7,8,9 ,10,11. Ces études épidémiologiques ont chacune renforcé la corrélation de la sévérité des blessures avec le risque d'épileptogénèse.
Les méthodes actuelles qui ont été largement utilisées pour identifier de nouvelles thérapies anti-épilepsie se sont largement appuyées sur des modèles qui utilisent des chimio-convulsivants ou des allumers électriques pour induire l'épilepsie12. Étant donné l'incidence élevée de pharmacorésistance aux médicaments développés dans ces modèles par les patients atteints de TBI, nous émettons l'hypothèse que les crises induites par l'ITC peuvent être différentes des crises de chimioconvulsant ou induites par l'allumeur et peuvent impliquer des voies ou des processus différents de l'épileptogenèse. Par conséquent, un modèle tBI peut être mieux adapté pour le développement de traitements qui sont plus efficaces pour prévenir l'épileptogenèse post-traumatique.
Le modèle de blessure de percussion fluide (FPI) de TBI a été employé pendant des décennies et est une méthode bien établie pour étudier le TBI et le PTE13,14,15,16,17, 18. Cependant, comme nous l'avons récemment examiné, il existe un degré élevé de variabilité dans les méthodes FPI signalées dans les laboratoires19,20. Ce manque de cohérence entre les laboratoires empêche la reproductibilité des résultats précliniques et rend l'interprétation des résultats un défi. En conséquence, un intérêt et des efforts accrus ont été déployés pour établir une plus grande harmonisation de ces types d'études21,22,23,24.
Dans un effort pour augmenter davantage la cohérence et l'harmonisation entre les laboratoires axés sur l'étude de l'épileptogenèse post-traumatique, nous fournissons ici une méthodologie détaillée de notre approche. Nous avons précédemment rapporté une incidence de 60% des saisies convulsives dans un délai de six semaines après TBIgrave 20. Nous utilisons maintenant cette approche pour surveiller les rats à partir de la journée de blessure et de les suivre en permanence 24 heures par jour pendant un pas jusqu'à 4 semaines. Nous avons choisi d'utiliser un système de télémétrie sans fil qui offre plusieurs avantages. Tout d'abord, les rats sont capables de se déplacer librement sur leur cage, et réduit ainsi le stress. Deuxièmement, une réduction du bruit du signal que le rat sert de sol. En outre, notre système actuel utilise un accéléromètre qui détecte le mouvement rapide dans les trois plans (X, Y et Z) et peut être utile pour identifier les événements de crise convulsive. Enfin, le système de télémétrie sans fil permet une gestion plus facile des rats tels que les injections salines supplémentaires, la pesée et la conduite des scores de gravité neurologique, ce qui est compliqué lorsque les rats sont attachés à une attache. Cependant, cette approche comporte également plusieurs limites. Tout d'abord, le coût initial d'un système d'enregistrement de jusqu'à huit rats simultanément peut être de l'ordre de 60 000 $. Deuxièmement, la puissance est limitée par une source de batterie. Cela nécessite une surveillance quotidienne et le remplacement des batteries. Le temps requis entre les changements de batterie peut être influencé par le taux d'échantillonnage. Cependant, pour un taux d'échantillonnage de 1000 Hz, les piles sont généralement changées une fois par semaine. L'alimentation limitée limite également le système à l'enregistrement à partir de seulement quatre signaux EEG. Enfin, le décrochage du signal est limité, mais se produit occasionnellement. Cependant, cette approche fournit une méthode cohérente et fiable pour surveiller l'épileptogenèse post-traumatique et peut aider à l'identification de nouveaux traitements thérapeutiques.
Protocole
Toutes les procédures ont été approuvées et suivies des lignes directrices du comité de l'Université de Buffalo Institutional Animal Care and Use.
1. Blessure de percussion de fluide
- Portez une blouse de laboratoire ou une blouse chirurgicale, un masque chirurgical, des gants chirurgicaux et un couvre-chef et stérilisez tous les outils et matériaux qui communiquent avec le site chirurgical.
- Anesthésiez un rat Wistar de 10 à 12 semaines (350-400 g) avec 3 % d'isoflurane et 1 L/min d'oxygène dans une chambre d'induction de taille appropriée pour les rats. Retirez le rat de la chambre d'induction et déplacez-le vers la zone de préparation une fois qu'il est inconscient. Mettez l'onduleur ophtalmique stérile dans les deux yeux.
- Raser les cheveux sur la tête du rat avec des tondeuses électriques avec une lame #40 juste au-dessus des yeux à la base caudale des oreilles pour produire suffisamment de champ chirurgical. Retirez les cheveux lâches et coupés du site.
- Nettoyez le site chirurgical en appliquant 2% de gommage à la chlorohexidine sur le cuir chevelu rasé suivi de 70% d'éthanol. Commencez au centre et déplacez-vous vers l'extérieur en cercles concentriques loin du site d'incision. Répétez ce processus 3 fois. Appliquer la solution Betadine sur le site de la même manière et laisser sécher.
- Placez le rat anesthésié dans le cadre stéréotaxique et maintenez l'anesthésie à 2-3% d'isoflurane-1 L/min d'oxygène par le cône de nez. Vérifiez la perte du réflexe de retrait du membre postérieur et la perte du réflexe palpébral pour s'assurer que le rat est dans un plan chirurgical d'anesthésie.
- Surveillez la fréquence respiratoire, la fréquence cardiaque, la température corporelle et la saturation en oxygène tout au long de la chirurgie. Maintenir la fréquence cardiaque entre 300-400 bpm, et SpO2 au-dessus de 90%.
REMARQUE: Un oxymètre d'impulsion attaché à un pied arrière peut être utilisé pour fournir la lecture constante de la fréquence cardiaque et SpO2. Une fréquence cardiaque supérieure à 400 bpm indique que le rat n'est pas suffisamment anesthésié. Un tampon de réchauffement autorégulateur, couplé à un thermomètre rectal, fixé à 37 oC, peut être placé sous le rat tout au long de la chirurgie pour maintenir la température corporelle. Un stéréomicroscope avec une source de lumière en combinaison avec une lampe à fibres optiques sont utiles pour visualiser la procédure. - Utilisez une aiguille de 23 g pour injecter 0,5 % d'hydrochlorure de bupivacaine intraderde dans le cuir chevelu au site d'incision pour l'analgésie locale 10 - 15 minutes avant de faire une incision.
- Faire une incision de 1,5 à 2,5 cm à travers la peau et le muscle du cuir chevelu à l'aide d'une lame de scalpel #10. Retirez la peau et le muscle pour exposer le crâne et fournir un champ chirurgical clair. Réfléchissez le fascia sous-jacent et le tissu adipeux loin de l'os avec des cotons-tiges stériles.
REMARQUE : Une unité de cautérisation électrique est utile pour réaliser l'hémostasie rapide. - Raser la crête latérale de l'os pariétal gauche à l'aide d'une curette chirurgicale pour produire une surface plate lisse de sorte que la base de la femelle-femelle Luer plaque tournante de verrouillage peut reposer rincé avec le crâne.
- Irriguer la surface du crâne et les tissus environnants avec une solution de gentamicine de 2,0 mg/mL en salin stérile. Solution d'excès de blot avec un écouvillon stérile.
- Appliquer 3% de peroxyde d'hydrogène sur le crâne pour sécher l'os.
REMARQUE : Si l'os n'est pas suffisamment sec, le ciment dentaire n'adhère pas correctement et forme un joint solide. - Créer un site craniectomy de 5 mm de diamètre par l'os pariétal gauche.
REMARQUE : Un morceau de trephine placé dans une perceuse de puissance attachée au cadre stéréotaxique peut être utile pour initier la craniectomy. Utilisez une perceuse à main avec une trephine de 5 mm de diamètre pour terminer lentement la craniectomy à travers l'os restant. Lorsque vous êtes près de terminer la craniectomy, faites pivoter la trephine à l'envers pour éviter la rupture de la dura mater sous-jacente. Il y aura un amincissement du crâne autour du périmètre du disque et le rabat du crâne se sentira lâche lorsqu'il est pressé légèrement. - Enlever le lambeau osseux avec la curette chirurgicale et les forceps tissulaires lisses.
REMARQUE : Certains saignements peuvent se produire, mais l'hémostase peut être rapidement atteinte en appliquant une pression douce avec des cotons-tiges stériles. - Utilisez un stéréomicroscope et un éclairage pour inspecter visuellement la dura pour détecter tout signe de rupture. Une fine jante d'os restera autour de la circonférence du site craniectomy. Retirez délicatement cette jante avec des forceps de tissu lisses en prenant soin de ne pas rompre la dura.
- Élonger le crâne avec 70% d'éthanol pour enlever toute poussière osseuse et pour sécher le crâne.
- Appliquer une fine couche de colle de gel de cyanoacrylate autour du bord inférieur du moyeu de serrure de Luer et le fixer au crâne au-dessus de la craniectomy sans obstruer l'ouverture. Faites preuve de prudence pour ne pas mettre la colle en contact avec la dura. En outre, scellez la serrure Luer en place avec une fine couche supplémentaire de colle autour de la base extérieure du moyeu.
- Préparer une boue de ciment dentaire. Appliquer le ciment à la surface du crâne autour et au-dessus de la base du moyeu de serrure de Luer pour le fixer en place.
- Remplissez le moyeu de serrure de Luer avec un bol de cérage artificiel stérile de conservation libre de cérage (CSF) solution (pH 7.4) utilisant une seringue et une aiguille de sorte qu'un bolus convexe de salin puisse être vu au-dessus du dessus de la jante.
REMARQUE : La solution gardera le dura humide pendant que le ciment dentaire sèche aussi bien qu'il sert d'indication de l'intégrité du joint. Si le niveau de solution tombe du tout, c'est une indication d'une fuite dans le système et le verrou Luer doit être enlevé et remplacé. - Une fois que le ciment dentaire est complètement guéri, cesser l'anesthésie gazeuse et retirer le rat du cadre stéréotaxique.
- Placez le rat sur une plate-forme à côté de l'appareil FPI.
- Le dispositif FPI a une pointe métallique incurvée qui s'étend du transducteur de pression à l'extrémité du réservoir de fluide. Fixez une longueur de 12 cm de tubes de pression jusqu'à l'extrémité de la pointe incurvée avec l'extrémité opposée se terminant dans un connecteur de torsion de serrure luer mâle de 2 cm. Fixez le rat à l'appareil FPI en connectant l'extrémité femelle du moyeu sur le crâne du rat au connecteur masculin.
REMARQUE : Assurez-vous que la connexion est bien sécurisée et que toutes les bulles d'air ont été retirées du système. - Placez l'animal dans la charge sternale et vérifiez à plusieurs reprises pour le retour du réflexe de sevrage. Dès que le rat retrouve le réflexe de sevrage mais est toujours sous sédatif, relâchez le pendule de l'appareil FPI pour provoquer une seule impulsion de pression de 20 ms et provoquer des blessures.
REMARQUE : Il est important de ne pas induire la blessure tandis que l'animal est profondément anesthésié car ceci tend à causer la mortalité accrue due à l'oedème pulmonaire neurogène-induit. Tous les appareils présentent une variabilité. Cependant, sur l'appareil utilisé pour cette expérience, un placement d'angle de 17 degrés du marteau produit une impulsion de pression atmosphérique de 2,2 à 2,3. Les animaux imcifs, indemnes, subissent toutes les mêmes procédures, à l'exception de l'impulsion de liquide réelle à la blessure induire. - Déconnectez immédiatement le rat du dispositif FPI après une blessure, placez-le dans la charge sternale, et fournissez l'oxygène supplémentaire (1 L/min) par l'intermédiaire d'un cône de nez jusqu'à ce que la respiration spontanée revienne. L'apnée est une conséquence prévue de la blessure. Si nécessaire, fournir des respirations manuelles périodiques via un masque de valve sac jusqu'à ce que le rat commence à respirer spontanément sur ses propres.
REMARQUE : En général, l'apnée dure moins de 2 min. Une augmentation rapide transitoire de la fréquence cardiaque (500 bpm) est observée immédiatement après l'administration du pouls de pression dû à une explosion de catécholamine. Ceci peut être surveillé avec un oxymètre d'impulsion attaché au pied du rat et peut servir d'indicateur possible qu'une blessure grave s'est produite. - Surveillez le rat en permanence et enregistrez l'heure de retour du réflexe de redressement (déambulation stable sur les quatre membres).
- L'ampleur de l'impulsion de pression atmosphérique pour chaque rat doit être dans une atmosphère de 0,05 l'une de l'autre. Confirmez que chacune des impulsions de pression produit un signal lisse sur l'oscilloscope avec une amplitude et une durée constantes.
REMARQUE : Un signal bruyant peut indiquer des bulles d'air dans le système qui doivent être enlevées avant de délivrer l'impulsion de blessure. Les impulsions de pression atmosphérique qui produisent une blessure grave, dans cette expérience, sont celles qui ont généralement comme conséquence des temps de correction d'animal de 30-60 min. Cette plage de temps de rectissement est associée à un taux de mortalité d'environ 40-50%. - Administrer 10 ml de saline préchauffée sous-cutanée comme un soin de soutien.
- Remettre le rat dans sa cage d'origine et lui permettre de récupérer pendant au moins 4 h.
REMARQUE : On a observé une augmentation de la mortalité lorsque les rats sont immédiatement remis sous anesthésie.
2. Implantation d'électrodes Corticales EEG et enregistrement vidéo-EEG
- À 4 h après la blessure, anesthésiez le rat tel qu'il a été décrit précédemment et placez-le de nouveau dans le cadre stéréotaxique pour enlever le moyeu de serrure de Luer et le ciment dentaire.
REMARQUE : Le moyeu et le ciment s'enclencheront facilement avec une pression modérée. Lors de la suppression du moyeu, vérifiez soigneusement toute rupture ou dommage à la dura. Euthanasier immédiatement tout animal avec des dommages à la dura. - Appliquer une petite goutte d'hydrochlorure de bupivacaine de 0,5 % sur le crâne à chacun des endroits où 5 trous pilotes doivent être percés (voir la figure 1).
- Percer les trous du pilote dans le crâne à l'œil d'un foret de 0,1 mm tenu à la main.
- Fixez une vis d'électrode en acier inoxydable dans chaque trou pilote aux endroits suivants : une vis de référence est placée caudale à l'lambda au-dessus du cervelet. Des électrodes d'enregistrement sont placées : 1) au-dessus de l'hémisphère ipsilateral et rostral à la craniectomy ; 2) au-dessus de l'hémisphère ipsilateral et caudal à la craniectomy ; 3) au-dessus de l'hémisphère contralatéral et rostral à la craniectomy ; 4) au-dessus de l'hémisphère contralatéral et caudal à la craniectomy.
- Élonger le crâne avec 70% d'éthanol pour enlever toute poussière osseuse.
- Couvrir le site craniectomy avec une fine couche de cire stérile d'os pour couvrir le dura exposé.
- Connectez un réseau d'électrodes aux 5 électrodes EEG en enveloppant l'extrémité exposée d'un fil d'électrode codé en couleur étroitement autour de sa vis d'électrode en acier inoxydable désignée.
REMARQUE : Les extrémités opposées de chaque fil d'électrode sont placées dans un endroit spécifique et désigné dans le connecteur de piédestal. - Préparer une boue de ciment osseux.
- Recueillir les fils d'électrodes dans une bobine sous le piédestal et fixer les fils et le piédestal en place avec du ciment osseux. Maintenez le piédestal en position jusqu'à ce que le ciment osseux ait durci.
REMARQUE : L'os doit être particulièrement sec et vide de tout sang résiduel afin d'obtenir une bonne adhérence et d'empêcher l'ablation prématurée de l'émetteur. - Fixez l'émetteur sans fil avec des piles fraîches au piédestal avant de retirer l'animal du cadre stéréotaxique.
- Placez l'animal dans sa cage d'origine et placez la cage à proximité du récepteur et en vue d'une caméra vidéo désignée. Démarrer l'enregistrement vidéo/EEG.
3. Collection d'enregistrements vidéo-EEG
- Avant de recueillir les signaux D'EEG, faites un balayage de fréquence de la pièce où les rats seront logés pour la collecte d'EEG afin d'identifier toutes les fréquences d'interférence potentielles pour empêcher la collecte de l'enregistrement d'EEG avec n'importe quelle fréquence qui a le bruit de fond.
- Définir tous les émetteurs sur des fréquences spécifiques exemptes d'interférences.
- Définir la fréquence d'échantillonnage et la plage d'entrée de chaque émetteur programmable.
REMARQUE: Cela peut être fait à l'aide d'un outil intelligent fourni par le fabricant du système. Les émetteurs peuvent échantillonner à un taux maximum de 1000 Hz, et une plage d'entrée maximale de 10 mV. Dans cette expérience, des enregistrements d'EEG entre 0.5 Hz à 30 Hz ont été analysés. Par conséquent, le taux d'échantillonnage a été fixé à 250 Hz. Nous observons généralement amplitudes de moins de 1 mV. Par conséquent, la plage d'entrée de l'ensemble était de 2 mV. - Utilisez le logiciel de collecte EEG fourni par le fabricant pour enregistrer en continu la vidéo-EEG à partir du jour du dommage reliant chaque émetteur sans fil via une fréquence unique à un récepteur spécifique.
REMARQUE : Chaque paire de récepteurs d'émetteur est capable de surveiller 4 canaux eEG monopolaires et d'accélérer dans les avions X, Y et Z. Les données EEG peuvent être écrites sur un serveur de stockage. Les données vidéo doivent être enregistrées sur un appareil NAS lié au serveur de stockage. Le logiciel d'analyse EEG synchronise la vidéo et l'enregistrement EEG en fonction du temps maintenu par le serveur de stockage. - Utilisez le logiciel de collecte vidéo pour enregistrer la vidéo de chaque rat avec sa propre caméra de résolution 2 MP (1920 x 1080) configurée pour enregistrer à 30 images/s.
REMARQUE: Chaque appareil a sa propre illumination infrarouge pour la collecte vidéo la nuit. - Configurez le système pour enregistrer automatiquement tous les enregistrements vidéo et EEG sur un serveur de stockage tous les 24 h. Les vidéos produisent des fichiers assez volumineux.
4. Analyse vidéo/EEG
- Synchronisez la vidéo avec chaque enregistrement EEG à 1/10 s résolution. Pour ce faire, en utilisant le logiciel d'analyse vidéo/EEG des fabricants de systèmes qui crée un métafichier avec le timbre de l'heure précise de l'EEG et de la vidéo.
- Passer un écran manuel à travers les enregistrements EEG pour identifier les événements d'index qui définissent l'activité de saisie.
- À l'aide du logiciel d'analyse vidéo/EEG et des événements d'EEG index, créez un fichier de configuration qui utilise des paramètres clés (c.-à-d. puissance dans des bandes de fréquences spécifiques, rapport des bandes de fréquences à la puissance totale, seuil d'accélération, etc.) pour définir les caractéristiques des événements de saisie potentiels.
- Exécuter le logiciel d'analyse EEG pour identifier les régions potentielles de l'enregistrement EEG qui se qualifient en fonction des paramètres sélectionnés dans le fichier de configuration.
REMARQUE : Le logiciel d'analyse Deg) permet la détection automatique des saisies et met en évidence les régions d'intérêt pour les signaux EEG et fournit une analyse du spectre de puissance DE la FFT à travers le signal. - Confirmer les crises convulsives potentielles en utilisant des enregistrements vidéo recueillis lors de l'acquisition, qui sont synchronisés avec les enregistrements EEG respectifs de chaque rat.
Résultats
Avec ce modèle, nous avons induit tBI grave dans les rats adultes, mâles, Wistar. Dans les conditions que nous décrivons ici, nous observons généralement des taux de mortalité de 40-50%, et des temps réflexes de redressement de 30 - 60 min comme précédemment décrit20. Nous avons pu recueillir des enregistrements vidéo/EEG 24 h/jour à partir du jour de la blessure. Un diagramme montrant l'emplacement de quatre électrodes eEG monopolaires et d'une seule électrode de référence est montré dans la figure 1A. Les images qui démontrent l'emplacement et l'apparence des lésions TBI attendues avec les conditions décrites ici sont montrées dans la figure 1B-D. Dans les conditions décrites ici, nous observons constamment le ralentissement du delta dans les trois premiers jours après tBI. Les rats moins gravement blessés présentent un ralentissement unilatéral et intermittent du delta (figures2C-D). En revanche, on observe un ralentissement continu et bilatéral du delta après des blessures plus graves (figure3C-D). Un certain degré de ralentissement de delta a été uniformément observé dans tous les rats de TBI mais n'a pas été détecté dans n'importe quel faux actionné (craniectomy seulement) rats témoins (figures2A-B ; 3A-B). Un ralentissement étendu du delta a été observé de façon constante au cours des trois premiers jours après une blessure chez la plupart des rats TBI. Fait intéressant, les rats montrent généralement une perte de poids prononcée au cours des trois premiers jours après la blessure. Des convulsions non convulsives sont occasionnellement observées au cours de la première semaine suivant l'ITC (figure4 C-D). Les crises cliniques, présentant comme des grappes de pointe associées à l'élevage et à la chute ainsi qu'un clonus avant-bras, peuvent être observées après une semaine après l'ITC (figure5C-D). Enfin, la figure 6 présente des images représentatives d'un signal intermittent occasionnel et d'une perte de signal due à une défaillance de la batterie.
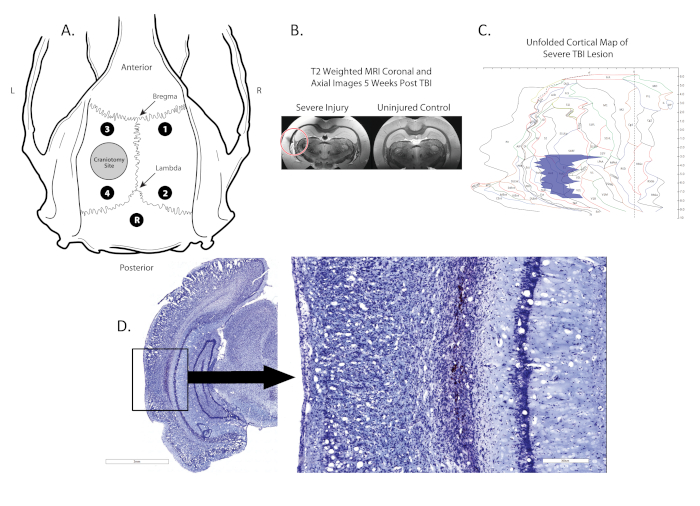
Figure 1 . Emplacement de craniectomy, placement d'électrode, et lésion. (A) montre un diagramme schématique du crâne du rat avec les emplacements de la craniectomie (cercle gris dans l'hémisphère gauche), quatre électrodes monopolaires (points noirs; 1,2,3,4) situées entre le Bregma et Lambda et une électrode de référence (point noir, R) placé midline, postérieur à la lambda; (B) montre les IRM t2 post mortem coronales avec l'emplacement de la lésion identifiée par un cercle rouge; (C) montre une carte 2D du cortex où l'emplacement et la taille de la lésion sont identifiés (région bleue). (D) montre une section coronale tachée Nissl avec la lésion en boîte, la lésion est 100x magnifié dans l'image à droite. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 . Ralentissement unilatéral et intermittent de delta recueilli le jour d'un TBI modéré. (A) montre une trace d'EEG de 90 s d'un rat de contrôle opéré par une feinte, indemne le jour de la chirurgie. Les quatre canaux sont présentés. Une trace de 10 s (prise de la région en boîte) a été extraite du 3ème canal pour mieux visualiser le modèle de base d'EEG. Une section EPOC de 2048 ms a ensuite été sélectionnée pour être analysée dans la FFT correspondante. (B) L'analyse de la FFT de 2048 ms a sélectionné l'EPOC à partir de l'animal opéré par faux non blessé le jour de la chirurgie. (C) montre une trace d'EEG de 90 s, qui démontre le modèle intermittent et unilatéral de ralentissement de delta d'un animal modérément blessé le jour de la blessure. Une trace de 10 s (prise de la région en boîte) a été extraite du 3ème canal pour mieux visualiser le modèle d'EEG de ralentissement de delta. Une section EPOC de 2048 ms a ensuite été sélectionnée pour être analysée dans la FFT correspondante. (D) L'analyse FFT de 2048 ms a sélectionné l'EPOC de l'animal TBI modéré le jour de la blessure. 90 s EEG trace, de haut en bas sont des biopotentiels 1, 2, 3, 4, correspondant à leur emplacement autour du site craniectomy comme vu dans la figure 1. Les marques verticales grises définissent les intervalles de 1 s sur les traces d'EEG. Toutes les traces d'EEG sont montrées sur une échelle de (500 euros). Dans les graphiques d'analyse ffT, la plage de fréquence analysée globale était de 0,5 à 30 Hz. Cela a été divisé en 4 bandes de fréquences distinctes de Delta (Jaune, 0,5-4 Hz), Theta (Purple, 4-8 Hz), Alpha (Rouge, 8-12 Hz), et Beta (Vert, 12-30 Hz). % (Power) graphique montré dans l'analyse FFT indique quel pourcentage de la puissance totale dans l'EPOC analysé provient de chaque bande de fréquence précédemment spécifiée, permettant une caractérisation mathématique plus poussée des modèles de forme d'onde EEG. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
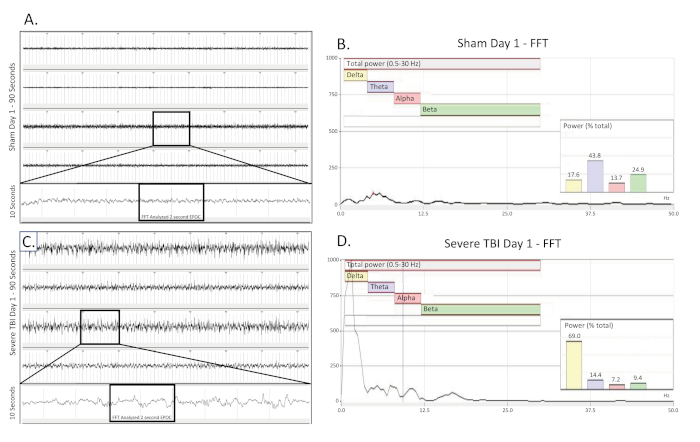
Figure 3 . Ralentissement bilatéral et continu de delta recueilli le jour d'un TBI grave. (A) montre une trace d'EEG de 90 s d'un rat de contrôle opéré par une feinte, indemne le jour de la chirurgie. Les quatre canaux sont présentés. Une trace de 10 s (prise de la région en boîte) a été extraite du 3ème canal pour mieux visualiser le modèle de base d'EEG. Une section EPOC de 2048 ms a ensuite été sélectionnée pour être analysée dans la FFT correspondante. (B) L'analyse de la FFT de 2048 ms a sélectionné l'EPOC à partir de l'animal opéré par faux non blessé le jour de la chirurgie. (C) montre une trace d'EEG de 90 s, qui démontre le modèle continu et bilatéral de ralentissement de delta d'un animal grièvement blessé le jour de la blessure. Une trace de 10 s (prise de la région en boîte) a été extraite du 3ème canal pour mieux visualiser le modèle d'EEG de ralentissement de delta. Une section EPOC de 2048 ms a ensuite été sélectionnée pour être analysée dans la FFT correspondante. (D) L'analyse DE la FFT de 2048 ms a sélectionné l'EPOC à partir de l'animal TBI sévère le jour de la blessure. 90 s EEG trace, de haut en bas sont des biopotentiels 1, 2, 3, 4, correspondant à leur emplacement autour du site craniectomy comme vu dans la figure 1. Les marques verticales grises définissent les intervalles de 1 s sur les traces d'EEG. Toutes les traces d'EEG sont montrées sur une échelle de (500 v). Dans les graphiques d'analyse ffT, la plage de fréquence analysée globale était de 0,5 à 30 Hz. Cela a été divisé en 4 bandes de fréquences distinctes de Delta (Jaune, 0,5-4 Hz), Theta (Purple, 4-8 Hz), Alpha (Rouge, 8-12 Hz), et Beta (Vert, 12-30 Hz). % (Power) graphique montré dans l'analyse FFT indique quel pourcentage de la puissance totale dans l'EPOC analysé provient de chaque bande de fréquence précédemment spécifiée, permettant une caractérisation mathématique plus poussée des modèles de forme d'onde EEG. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
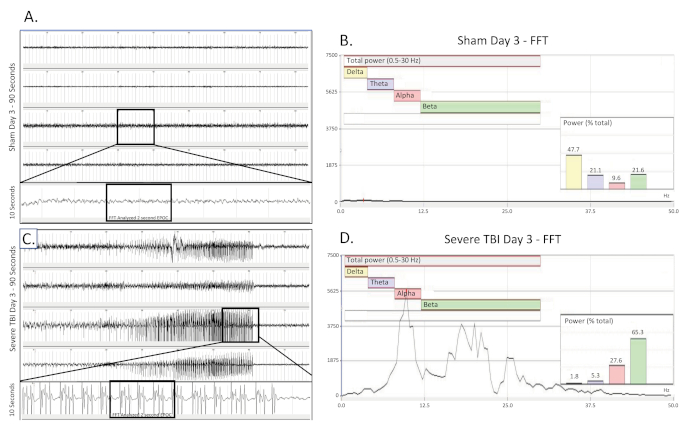
Figure 4 . Saisie électrographique non convulsive recueillie 3 jours après TBI grave. (A) montre une trace d'EEG de 90 s d'un faux opéré, rat de contrôle indemne 3 jours25 après la chirurgie. Les quatre canaux sont présentés. Une trace de 10 s (prise de la région en boîte) a été extraite du 3ème canal pour mieux visualiser le modèle de base d'EEG. Une section EPOC de 2048 ms a ensuite été sélectionnée pour être analysée dans la FFT correspondante. (B) L'analyse de la FFT de 2048 ms a sélectionné l'EPOC à partir de l'animal opéré par imposture non blessé le jour trois25 après la chirurgie. (C) montre une trace d'EEG de 90 s trois 25 jours après des blessures graves. Ce bâtiment d'exposition, modèle de pointe rapide présent bilatéralement et à travers tous les 4 canaux de collecte. Une trace de 10 s (prise de la région en boîte) a été extraite du 3ème canal pour mieux visualiser le modèle d'EEG. Une section EPOC de 2048 ms a ensuite été sélectionnée pour être analysée dans la FFT correspondante. (D) L'analyse DE la FFT de 2048 ms a sélectionné l'EPOC à partir de l'animal TBI sévère le jour de la blessure. 90 s EEG trace, de haut en bas sont des biopotentiels 1, 2, 3, 4, correspondant à leur emplacement autour du site craniectomy comme vu dans la figure 1. Les marques verticales grises définissent les intervalles de 1 s sur les traces d'EEG. Toutes les traces d'EEG sont montrées sur une échelle de (500 v). Dans les graphiques d'analyse ffT, la plage de fréquence analysée globale était de 0,5 à 30 Hz. Cela a été divisé en 4 bandes de fréquences distinctes de Delta (Jaune, 0,5-4 Hz), Theta (Purple, 4-8 Hz), Alpha (Rouge, 8-12 Hz), et Beta (Vert, 12-30 Hz). % (Power) graphique montré dans l'analyse FFT indique quel pourcentage de la puissance totale dans l'EPOC analysé provient de chaque bande de fréquence précédemment spécifiée, permettant une caractérisation mathématique plus poussée des modèles de forme d'onde EEG. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
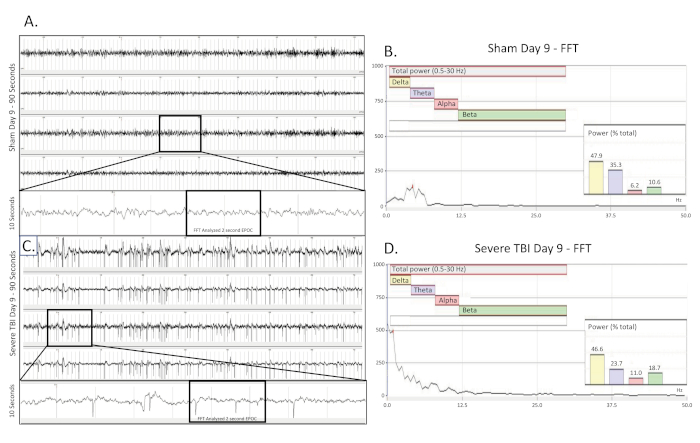
Figure 5 . Saisie électrographique convulsive a rassemblé 9 jours après TBI. (A) montre une trace d'EEG de 90 s d'un faux opéré, rat de contrôle indemne neuf (9) jours après la chirurgie. Les quatre canaux sont présentés. Une trace de 10 s (prise de la région en boîte) a été extraite du 3ème canal pour mieux visualiser le modèle de base d'EEG. Une section EPOC de 2048 ms a ensuite été sélectionnée pour être analysée dans la FFT correspondante. (B) L'analyse de la FFT de 2048 ms a sélectionné l'EPOC à partir de l'animal opéré par imposture non blessé le jour 9 (9) après la chirurgie. (C) montre une trace d'EEG de 90 s neuf (9) jours après blessure grave. Ce bâtiment d'exposition, modèle de pointe rapide présent bilatéralement et à travers tous les 4 canaux de collecte. Une trace de 10 s (prise de la région en boîte) a été extraite du 3ème canal pour mieux visualiser le modèle d'EEG. Une section EPOC de 2048 ms a ensuite été sélectionnée pour être analysée dans la FFT correspondante. (D) L'analyse FFT de 2048 ms a sélectionné l'EPOC à partir de l'animal TBI grave neuf (9) jours après la blessure. 90 s EEG trace, de haut en bas sont des biopotentiels 1, 2, 3, 4, correspondant à leur emplacement autour du site craniectomy comme vu dans la figure 1. Les marques verticales grises définissent les intervalles de 1 s sur les traces d'EEG. Toutes les traces d'EEG sont montrées sur une échelle de (500 v). Dans les graphiques d'analyse ffT, la plage de fréquence analysée globale était de 0,5 à 30 Hz. Cela a été divisé en 4 bandes de fréquences distinctes de Delta (Jaune, 0,5-4 Hz), Theta (Purple, 4-8 Hz), Alpha (Rouge, 8-12 Hz), et Beta (Vert, 12-30 Hz). % (Puissance) graphique montré dans l'analyse FFT indique quel pourcentage de la puissance totale dans l'EPOC analysé provient de chaque bande de fréquence précédemment spécifiée, permettant une caractérisation mathématique plus approfondie des modèles de forme d'onde EEG. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
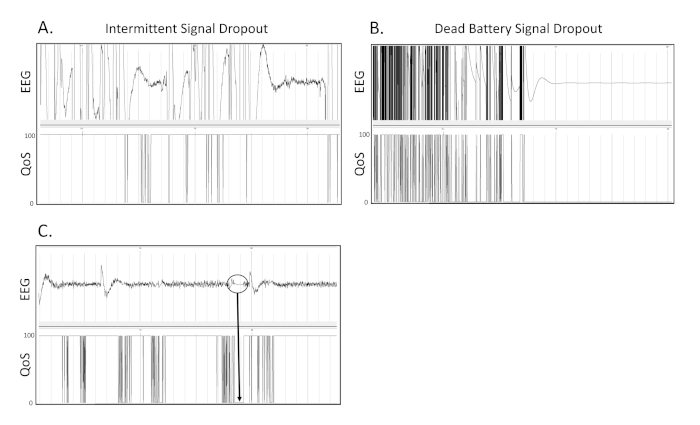
Figure 6 . Baisse du signal. Il s'agit de 3 exemples distincts de ce que le signal de chute en raison de problèmes d'émetteur ou de récepteur apparaît comme sur l'enregistrement EEG. (A) Il s'agit d'un exemple de décrochage intermittent du signal EEG sur un enregistrement. (B) Il s'agit d'un exemple de décrochage dû à une défaillance de la batterie pendant la télémétrie sans fil continue apparaît comme sur un tracé EEG. (C) Dans la région encerclée, on peut voir que lorsque la qualité du signal (QoS) passe de 100 à 0, le tracé de l'EEG s'aplatit et stagne à 0 V. Les marques verticales grises définissent les intervalles de 1 s sur les traces d'EEG. Toutes les traces d'EEG sont montrées sur une échelle de (500 v). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Une variabilité considérable a été signalée entre les laboratoires en ce qui concerne les paramètres et les méthodes spécifiques utilisés pour le modèle FPI TBI 14,26,27,28. Ces incohérences ont donné lieu à des résultats contradictoires et rendent difficile l'harmonisation des efforts et des résultats entre les laboratoires. Ici, nous avons présenté une méthodologie détaillée décrivant notre approche à long terme, enregistrement continu de la vidéo / EEG pour surveiller l'activité épileptiforme post-traumatique. Un certain nombre d'étapes sont essentielles pour générer des résultats reproductibles avec la méthode décrite.
Tout d'abord, étant donné que l'incidence de l'épilepsie post-traumatique est en corrélation avec la gravité des blessures, appliquer des conditions qui se traduisent par le TBI le plus grave. Plus précisément, utilisez une craniectomie de 5 mm pour s'assurer qu'une zone suffisamment grande de dura est exposée. En outre, fixer un dispositif de verrouillage luer femelle-femelle sur la surface du crâne, avec l'ouverture placée directement au-dessus de la craniectomie. Cela diffère des autres laboratoires qui ont utilisé une craniectomie plus petite (3 mm) et / ou placé un moyeu d'aiguille modifié à l'intérieur de la craniectomy, ce qui réduit efficacement la taille d'ouverture. En plaçant la serrure Luer à l'extérieur de la craniectomie, l'ouverture de 5 mm est maintenue. Ces paramètres spécifiques ont un impact sur la force globale appliquée à la dura. La pression atmosphérique appliquée à la dura a également un impact majeur sur la gravité des blessures observées. Malheureusement, la pression atmosphérique est très variable et semble dépendre de l'appareil. Certains laboratoires ont signalé l'application d'une impulsion de pression de 8 à 10 ms18. En revanche, la méthode décrite ici donne une impulsion de pression de 20 ms. Ceci est compatible avec d'autres laboratoires qui semblent générer des blessures plus graves 14,28. Il est clair que l'impulsion de pression induisant des blessures est un paramètre qui montre une variabilité considérable entre les laboratoires et doit être défini empiriquement. Cependant, la gravité des blessures peut être déterminée en fonction d'une combinaison des taux de mortalité (40-50%), des temps réflexes de redressement (-gt;30 min)26. Il est également essentiel que seuls les animaux ayant une dure intacte soient inclus dans l'étude. En outre, si la craniectomy est occluded par n'importe quelle colle ou ciment de telle sorte qu'une partie de la dura sous la craniectomy n'est pas exposée à la pleine force du pouls de pression liquide, alors l'animal devrait être éliminé de l'étude. En outre, l'excès de colle sous la serrure Luer peut adhérer à la dura et l'enlever avec le bouchon de ciment, même après une blessure réussie. Enfin, la forme lisse de la courbe d'impulsion de pression sur la trace de l'oscilloscope donne l'indication qu'il n'y a pas de bulles d'air dans la chambre fluide et indique que le piston se déplace sans entrave.
L'anesthésie est un autre facteur critique qui doit être contrôlé. L'exposition à l'isoflurane doit être maintenue aux niveaux les plus bas possibles pour maintenir un plan chirurgical d'anesthésie. Les rats exposés à des niveaux plus élevés d'isoflurane ou pendant de longues durées sont plus susceptibles de développer un oedème pulmonaire induit par la neurogène. La préparation du crâne représente un autre aspect critique de la méthode. En particulier, le séchage du crâne et l'élimination de la poussière osseuse aide à empêcher les rats d'enlever l'émetteur prématurément.
Le placement des vis et la connexion des fils EEG sont évidemment essentiels à la production d'enregistrements reproductibles de façon cohérente. Il est important que les vis ne soient pas placées trop profondément pour induire une lésion sur le cerveau. Le rabat osseux récupéré de la craniectomy des rats mâles adultes (12 semaines) de Wistar est uniformément 2 mm d'épaisseur. Utilisez des vis d'électrode EEG avec un arbre de 2,5 mm. Il est utile d'utiliser les pointes des forceps hémostatiques incurvés de moustique comme espaceur pour s'assurer que les vis s'étendent seulement à la base de l'os et ne dépassent pas dans le cerveau.
L'approche présentée ici comporte certaines limites. Les piles doivent être changées régulièrement. La fréquence des changements de batterie dépend du taux d'échantillonnage. Les piles sont généralement changées une fois par semaine pour un taux d'échantillonnage de 1000 Hz. Ce délai peut être prolongé en réduisant le taux d'échantillonnage. Le système se limite également à l'enregistrement à partir de quatre électrodes eEG monopolaires. Cependant, cela fournit deux canaux par hémisphère et peut différencier entre les événements focaux et les événements généralisés et peut différencier entre les changements antérieurs et postérieurs. Malgré ces limites, cette approche fournit une méthode raisonnable pour effectuer la surveillance vidéo/EEG continue et la détection des changements épileptiformes suivant tBI grave.
La méthode décrite ici a comme conséquence les saisies électrographiques et convulsives dans un mois suivant TBI. Par conséquent, cette approche fournit un délai raisonnable dans lequel étudier les thérapies potentielles pour empêcher l'épileptogenèse suivant tBI grave. Cette approche fournit également une méthode pour étudier les mécanismes moléculaires associés à l'ETP et peut conduire à l'identification de biomarqueurs potentiels qui peuvent être utilisés pour identifier les patients les plus à risque de développer l'ETP.
Déclarations de divulgation
Chelasea R Richardson est un employé d'emka Scientific, le fournisseur de ce système de télémétrie sans fil décrit.
Remerciements
Nous tenons à remercier Paul Dressel pour son soutien inestimable dans la conception graphique et la préparation des chiffres.
matériels
| Name | Company | Catalog Number | Comments |
| 1.00 mm Drill Bits | Drill Bit City: New Carbide Tools | 05M200 | |
| 3M ESPE Durelon Carboxylate Cement | 3M , Neuss Germany | 38019 | Dental Cement |
| 4-0 Suture | Ethicon, Sommerville, NJ | K831H | 4-0 Ethicon Perma-hand Silk, 26mm 1/2c Taperpoint, 30" (75cm), Black Braided non-absorbable suture |
| 5 mm outer diameter trephine | Fine Science Tools | 18004-50 | |
| Bonewax | Medline Industries, Mendelcin, IL | REF DYNJBW25 | |
| Buprenorphine HCL, Injection (0.3 mg/mL) 1 mL vial | Par Pharmalogical, Chestnut Ridge NY | 3003706 | NDC 42023-179-01 |
| Dumont #6 Forceps | Fine Science Tools | 11260-20 | |
| Dumont #7b Forceps | Fine Science Tools | 11270-20 | |
| ecgAUTO | EMKA Technologies, Falls Church, VA | ||
| Female Luer Thread Style Coupler Clear Polycarbonare | Cole-Palmer instrument | SKO#45501-22 | Order lot #214271 |
| Foot Power Drill | Grobet USA, Carlstadt, NJ | Model C-300 | |
| GentaMax 100 (Gentamicin, Sulfate Solution) | Phoenix, Manufactured by Clipper Distributing Company LLC, St. Joseph, MO | NDC 57319-520-05 | |
| Hill's Prescription Diet a/d Canine/Feline | Hill's Pet Nutrition, Inc. , Topeka, KS | ||
| IOX2 Software | EMKA Technologies, Falls Church, VA | ||
| Isoflorane, USP | Piramal Enterprise Limited, Andhra, India | NDC 66794-013-25 | |
| IsoTech Anesthesia machine | SurgiVet | WWV9000 | |
| Lateral FPI device | AmScien | 302 | curved tip, with pressure tubing extension. connected via screw lock connector (Cole-Palmer; #4550-22) |
| Leica A60 Stereomicroscope | Leica Biosystems, Richmond, VA | PN: 10 450 488 | |
| Marcaine (0.5%) Bupivacaine hcl injection usp 5 mg/mL | Hospira, Lake Forest, IL | CA-3627 | 50mL multiple dose vial; NDC 0409-1610-50 |
| Micro-Adson Forceps | Fine Science Tools | 11018-12 | |
| Olsen-Hegar Needle Holders with Suture Cutters | Fine Science Tools | 12002-14 | |
| PALACOS R+G bone cement with gentamicin | Heraeus, | REF: 5036964 | Radiopaque bone cement containing 1 x 0.5g Gentamicin |
| Physio Suite | Kent Scientific, Terrington, CT | ||
| Povidone-iodine solution | Betadine | ||
| Puralube Vet Ointment | Dechra Veterinary Products, Overland Park KS | NDC 17033-211-38 | |
| Scalpel blade (#10) and holder | Integra Miltex, York, PA | REF: 4-110 | |
| Scalpel Handle - #4 | Fine Science Tools | 10004-13 | |
| Sickle Knife | Bausch + Lomb Storz Instruments | N1705 HM | 5mm curved blade. Round handle. Overall length 168mm, 6.6 inches. |
| Silverstein Micro Mirror | Bausch + Lomb Storz Instruments | N1706 S8 | 3mm diameter. Angled 45 degrees. Overall length 180mm, 7.2 inches |
| Storage NAS | Synology Inc. | DS3615xs | |
| Synology Assistant | Synology Inc. | ||
| Thermal Cautery Unit | Geiger Medical Technology, Delasco Council Bluffs, IA | Model NO: 150 | |
| Vetivex | Dechra Veterinary Products, Overland Park KS | Veterinary pHyLyteTM Injection pH 7.4 (Multiple Electrolytes Injection, Type 1, USP) | |
| Video Cameras | TRENDnet, Torrance, CA | TV-IP314PI | Indoor/Outdoor 4MP H.265 WDR PoE IR Bullet Network Cameral |
| Video NAS | Synology Inc. | DS916 | |
| Wistar IGS rats | Charles River | strain code 003 | 12 wk old at the time of injury |
| Wullstein Retractor | Fine Science Tools | 17018-11 |
Références
- Flanagan, S. R. Invited Commentary on Centers for Disease Control and Prevention Report to Congress: Traumatic Brain Injury in the United States: Epidemiology and Rehabilitation. Archives of Physical Medicine and Rehabilitation. 96, 1753-1755 (2015).
- Annegers, J. F., Coan, S. P., Hauser, W. A., Leestma, J., Duffell, W., Tarver, B. Epilepsy, vagal nerve stimulation by the NCP system, mortality, and sudden, unexpected, unexplained death. Epilepsia. 39, 206-212 (1998).
- Lowenstein, D. H. Epilepsy after head injury: an overview. Epilepsia. 50, 4-9 (2009).
- Englander, J., et al. Analyzing risk factors for late posttraumatic seizures: a prospective, multicenter investigation. Archives of Physical Medicine and Rehabilitation. 84, 365-373 (2003).
- Faul, M. X. L., Wald, M. M., Coronado, V. G. Traumatic Brain Injury in the United States: Emergency Department Visits, Hospitalizations and Deaths 2002-2006. Centers for Disease Control and Prevention, National Center for Injury Prevention and Control. , (2010).
- Herman, S. T. Epilepsy after brain insult: targeting epileptogenesis. Neurology. 59, 21-26 (2002).
- Annegers, J. F., Coan, S. P. The risks of epilepsy after traumatic brain injury. Seizure. 9, 453-457 (2000).
- Christensen, J., Pedersen, M. G., Pedersen, C. B., Sidenius, P., Olsen, J., Vestergaard, M. Long-term risk of epilepsy after traumatic brain injury in children and young adults: a population-based cohort study. Lancet. 373, 1105-1110 (2009).
- Webb, T. S., Whitehead, C. R., Wells, T. S., Gore, R. K., Otte, C. N. Neurologically-related sequelae associated with mild traumatic brain injury. Brain Injury. 29, 430-437 (2015).
- Mahler, B., Carlsson, S., Andersson, T., Adelow, C., Ahlbom, A., Tomson, T. Unprovoked seizures after traumatic brain injury: A population-based case-control study. Epilepsia. 56, 1438-1444 (2015).
- Wang, H., et al. Post-traumatic seizures--a prospective, multicenter, large case study after head injury in China. Epilepsy Research. 107, 272-278 (2013).
- Simonato, M., French, J. A., Galanopoulou, A. S., O'Brien, T. J. Issues for new antiepilepsy drug development. Current Opinion in Neurology. 26, 195-200 (2013).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injury. Nature Review Neuroscience. 14, 128-142 (2013).
- Kharatishvili, I., Nissinen, J. P., McIntosh, T. K., Pitkanen, A. A model of posttraumatic epilepsy induced by lateral fluid-percussion brain injury in rats. Neuroscienc. 140, 685-697 (2006).
- McIntosh, T. K., et al. Traumatic brain injury in the rat: characterization of a lateral fluid-percussion model. Neuroscience. 28, 233-244 (1989).
- Thompson, H. J., et al. Lateral fluid percussion brain injury: a 15-year review and evaluation. Journal of Neurotrauma. 22, 42-75 (2005).
- Curia, G., Eastman, C. L., Miller, J. W., D'Ambrosio, R., Laskowitz, D., Grant, G. Modeling Post-Traumatic Epilepsy for Therapy Development. Translational Research in Traumatic Brain Injury. , (2016).
- D'Ambrosio, R., Fairbanks, J. P., Fender, J. S., Born, D. E., Doyle, D. L., Miller, J. W. Post-traumatic epilepsy following fluid percussion injury in the rat. Brain. 127, 304-314 (2004).
- Saatman, K. E., et al. Classification of traumatic brain injury for targeted therapies. Journal of Neurotrauma. 25, 719-738 (2008).
- Smith, D., Brooke, D., Wohlgehagen, E., Rau, T., Poulsen, D. Temporal and Spatial Changes in the Pattern of Iba1 and CD68 Staining in the Rat Brain Following Severe Traumatic Brain Injury. Modern Research in Inflammation. 4, 9-23 (2015).
- Ndode-Ekane, X. E., et al. Harmonization of lateral fluid-percussion injury model production and post-injury monitoring in a preclinical multicenter biomarker discovery study on post-traumatic epileptogenesis. Epilepsy Research. 151, 7-16 (2019).
- Ciszek, R., et al. Informatics tools to assess the success of procedural harmonization in preclinical multicenter biomarker discovery study on post-traumatic epileptogenesis. Epilepsy Research. 150, 17-26 (2019).
- Immonen, R., et al. Harmonization of pipeline for preclinical multicenter MRI biomarker discovery in a rat model of post-traumatic epileptogenesis. Epilepsy Research. 150, 46-57 (2019).
- Kamnaksh, A., et al. Harmonization of pipeline for preclinical multicenter plasma protein and miRNA biomarker discovery in a rat model of post-traumatic epileptogenesis. Epilepsy Research. 149, 92-101 (2019).
- Redell, J. B., Moore, A. N., Ward, N. H., Hergenroeder, G. W., Dash, P. K. Human traumatic brain injury alters plasma microRNA levels. Journal of Neurotrauma. 27, 2147-2156 (2010).
- Smith, D., et al. Convulsive seizures and EEG spikes after lateral fluid-percussion injury in the rat. Epilepsy Research. 147, 87-94 (2018).
- Eastman, C. L., Fender, J. S., Temkin, N. R., D'Ambrosio, R. Optimized methods for epilepsy therapy development using an etiologically realistic model of focal epilepsy in the rat. Experimental Neurology. 264, 150-162 (2015).
- Shultz, S. R., et al. Can structural or functional changes following traumatic brain injury in the rat predict epileptic outcome. Epilepsia. 54, 1240-1250 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon