Method Article
Funktionelle und physiologische Methoden zur Beurteilung der medianen Nervenregeneration in der Ratte
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Präsentiert wird ein Protokoll, um verschiedene Arten von Mediannerven (MN) Läsionen und Reparatur in der Ratte zu produzieren. Darüber hinaus zeigt das Protokoll, wie die funktionelle Erholung des Nervs anhand mehrerer nichtinvasiver Verhaltenstests und physiologischer Messungen bewertet werden kann.
Zusammenfassung
Das Hauptziel dieser Untersuchung ist es, zu zeigen, wie verschiedene Arten von Mediannerven (MN) Läsionen in der Ratte zu erstellen und zu reparieren. Darüber hinaus werden verschiedene Methoden zur Simulation der postoperativen Physiotherapie vorgestellt. Mehrere standardisierte Strategien werden verwendet, um die motorische und sensorische Erholung mit einem MN-Modell der peripheren Nervenläsion und -reparatur zu bewerten, was einen einfachen Vergleich der Ergebnisse ermöglicht. Mehrere Optionen sind enthalten, um Ratten, die MN-Verletzungen erlitten haben, eine postoperative physiotherapeutische Umgebung zur Verfügung zu stellen. Schließlich bietet das Papier eine Methode zur Bewertung der Erholung des MN mit mehreren nichtinvasiven Tests (z. B. Greifprüfung, Nadelstichtest, Leiterstufen-Walking-Test, Seilklettertest und Walking-Track-Analyse) und physiologischen Messungen (Infrarot-Thermographie, Elektroneneuromyographie, Flexionsfestigkeitsauswertung und Flexor-Carpi-Radialis Muskelgewichtsbestimmung). Daher scheint dieses Modell besonders geeignet, ein klinisches Szenario zu replizieren, was die Extrapolation der Ergebnisse auf die menschliche Spezies erleichtert.
Obwohl der Ischiasnerv der am meisten untersuchte Nerv in der peripheren Nervenforschung ist, bietet die Analyse der Ratte MN verschiedene Vorteile. So gibt es beispielsweise eine geringere Inzidenz von Gelenkkontrakturen und Automutilierung der betroffenen Gliedmaße in MN-Läsionsstudien. Darüber hinaus ist das MN nicht von Muskelmassen bedeckt, was seine Zerlegung einfacher macht als die des Ischiasnervs. Darüber hinaus wird die MN-Erholung früher beobachtet, da der MN kürzer ist als der Ischiasnerv. Außerdem hat der MN einen parallelen Pfad zum Ulnarnerv im Arm. Daher kann der Ulnarnerv leicht als Nerventransplantat zur Reparatur von MN-Verletzungen verwendet werden. Schließlich befindet sich das MN bei Ratten im Vorderglied, ähnlich dem menschlichen oberen Glied; beim Menschen ist die obere Extremität der Ort der meisten peripheren Nervenläsionen.
Einleitung
Periphere Nervenläsionen treten regelmäßig als Folge von Trauma, Infektion, Vaskulitis, Autoimmunität, Malignität und/oder Strahlentherapie1,2auf. Leider stellt die periphere Nervenreparatur weiterhin klinisch unvorhersehbare und häufig enttäuschende Ergebnisse3,4dar. Es besteht ein breiter Konsens darüber, daß noch erhebliche Grundlagen- und Übersetzungsforschung erforderlich ist, um die Aussicht der Betroffenen zu verbessern4,5,6,7.
Die Ratte MN weist große Ähnlichkeiten mit denen von Menschen8,9 ( Abbildung1). Dieser Ausstoß aus dem Brachialplexus im Axillary-Bereich senkt sich in den medialen Aspekt des Arms, erreicht den Ellenbogen und verzweigt sich auf die Mehrheit der Muskeln im ventralen Unterteil des Unterarms. Das MN erreicht die Hand, wo es die Thenarmuskeln und die ersten beiden lumbricalen Muskeln sowie einen Teil der Handhaut der Ratte9 (Abbildung 1) innerviert.
Mit der Ratte MN ist es möglich, periphere Nervenläsionen beim Menschen angemessen zu replizieren10,11,12. Dieser Nerv hat mehrere potenzielle Forschungsvorteile im Vergleich zum üblicherweise verwendeten Ischiasnerv. Da sich das MN im Vorderglied von Ratten befindet (ähnlich wie die menschlichen oberen Gliedmaßen), kann es experimentell mit einem viel geringeren Einfluss auf das Wohlbefinden der Ratte geschädigt werden, verglichen mit dem Ischiasnerv, der einen wesentlichen Teil der Beckenglied13innerviert. Zusätzlich treten beim Menschen die meisten klinischen Läsionen in der oberen Extremität auf, was dem Vorderglied der Ratte10,11,12,14,15,16entspricht.
Dieses Papier zeigt, wie man verschiedene Arten von MN-Läsionen in der Ratte produziert. Darüber hinaus werden verschiedene Möglichkeiten zur Simulation der postoperativen Physiotherapie vorgestellt. Schließlich werden Tests zur Bewertung der funktionellen Wiederherstellung des MN beschrieben. Es stehen mehrere standardisierte Strategien zur Verfügung, um die motorische und sensorische Erholung mit einem MN-Modell der peripheren Nervenläsion und -reparatur zu bewerten, was einen einfachen Vergleich der Ergebnisse ermöglicht. Das MN-Modell eignet sich besonders, um das klinische Szenario zu replizieren und die Extrapolation der Ergebnisse auf die menschliche Spezies zu erleichtern.
Protokoll
Alle Verfahren, die tierische Themen betreffen, wurden vom Institutional Animal Care and Use Committee und dem Ethical Committee an der Nova University Medical School, Lissabon, Portugal (08/2012/CEFCM) genehmigt.
1. Mediane Nervenchirurgie
HINWEIS: Folgen Sie der aseptischen Technik während der Operation. Verwenden Sie persönliche Schutzinstrumente (PPE) und tragen Sie ein steriles OP-Kleid17. Autoklav alle erforderlichen chirurgischen Instrumente vor der Operation (siehe Tabelle der Materialien).
- Verwenden Sie 12 Wochen alte Wistar-Ratten. Geben Sie ihnen ad libitum Nahrung und Wasser mit 12 h hell-dunklen Zyklen 7 Tage vor der Operation. Vor der Anästhesie die Ratte wiegen, um die benötigte Menge an Anästhetikum zu bestimmen.
- Anästhesisieren Sie die Ratte mit einer intraperitonealen Injektion einer Mischung aus Ketamin (40–80 mg/kg Körpergewicht) und Xylazin (5–10 mg/kg Körpergewicht). Überprüfen Sie die Tiefe der Anästhesie durch das Fehlen der Reaktion auf eine Zehenklemme und durch die Beobachtung der Atmungsrate während des gesamten Verfahrens18,19. Zusätzliche Analgesie bereitstellen, wenn eine Atemfrequenz über 110 Zyklen/min oder eine motorische Reaktion auf Zehenkneifen beobachtet wird18,20.
- Injizieren Sie 1 mg/kg Meloxicam subkutan, um präventive Analgesie20,21zu bieten.
- Um Hornhautabrieb während der Operation zu vermeiden, tragen Sie ophthalmologisches Gel auf beide Augen auf.
- Verwenden Sie eine Enthaarungscreme, um das Haar über den medialen Aspekt auf der rechten Seite zu entfernen. Einmal fertig, waschen Sie mit warmer Wäsche, um die Creme zu entfernen17.
- Legen Sie die Ratte in Supine-Position auf einem Heizkissen. Tragen Sie ein Jod- oder Chlorhexidin-basiertes chirurgisches Peeling über die operative Stelle auf. Lassen Sie es für mindestens 15 s und dann mit Ethanol abwischen. Wiederholen Sie die Anwendung 3x. Stellen Sie sicher, dass das Peeling mindestens 2 min lang mit der Haut in Kontakt ist, bevor Sie mit der Operation fortfahren.
HINWEIS: Wenden Sie sich an die Infektionskontrollbehörde Ihrer Forschungseinheit für alternative Protokolle, um eine Infektion des chirurgischen Standorts zu verhindern19. - Drapieren Sie den operationsfolgenden Bereich17.
HINWEIS: Führen Sie alle Verfahren unter strengen aseptischen Bedingungen19durch. - Incise die Haut im medialen Aspekt des rechten Arms und Brustbereich auf die tiefe Faszienebene, mit einer Nummer 15 Skalpellklinge. Sorgfältig alle blutenden Gefäße mit einem elektrischen Kautere kauterisieren.
- Teilen Sie vorsichtig die Brachialfaszie, die als weißliche Hülle präsentiert, die die Muskeln bedeckt, mit einer Thermokauterie oder einer stumpfen Schere, wobei darauf geachtet wird, die Gefäß- und Nervenstrukturen im medialen Aspekt des Arms nicht zu beschädigen.
- Öffnen Sie eine Schere unverblümt unter der terminalen Einfügung des Hauptmuskels pectoralis, um diesen Muskel von der darunter liegenden Achselhöhle und Vene sowie von den Endzweigen des Brachialplexus weg zu necken.
- Teilen Sie die Einfügung des Pectoralis Hauptmuskels mit einem elektrischen Kauter. Expose und Abschnitt der pectoralis Minor Muskel.
- Sezieren Sie das MN unverblümt von den Brachialgefäßen und vom Ulnarnerv vom Axillary-Bereich bis zum Ellenbogen. Dies ermöglicht die Exposition der verschiedenen Terminalzweige des Brachialplexus, nämlich des Medians, des Ulnars, des Radials, des Axillarys und der muskukulären Nerven (Abbildung 2).
- Trennen Sie verschiedene experimentelle Gruppen, wie unten beschrieben.
- Erstellen Sham Sie die Sham-Gruppe, indem Sie nur die MN sezieren.
- Erstellen Sie die Crush-Gruppe, indem Sie den MN im mittleren Teil des Arms für 15 s mit einer Anzahl von 5 MikrochirurgieZangen oder einem ähnlichen Instrument22,23komprimieren.
- Erstellen Sie die Exzisionsgruppe mit einer Mikrochirurgieschere, um ein 10 mm langes Segment aus dem mittleren Teil des MN im Arm zu verbrauchen. Ligate den proximalen Stumpf des Nervs mit einer 8/0 Nylon Naht, um axonales Wachstum zu verhindern.
- Erstellen Sie die Graft-Gruppe mit dem im letzten Schritt beschriebenen 10 mm-Langsegment des MN und drehen Sie ihn um 180°. Die proximalen und distalen Stümpfe des geschnittenen MN mit unterbrochenen 10/0 Nylonstichen an das Nerventransplantat annähen.
- Schließen Sie die Hautwunde mit unterbrochenen 5/0 Nylonstichen10,24.
- Stellen Sie postoperative Analgesie mit 7 ml acetaminophen mit Kirschgeschmack gemischt mit 43 ml Leitungswasser25, um eine Konzentration von 4,48 mg/ml in 50 ml Kunststoff-Wasserflaschen zu erhalten, die den Ratten ad libitum für 3 Tage25zur Verfügung gestellt werden.
2. Wohnen und Physiotherapie
- Erlauben Sie Ratten, 2-4 Wochen vor der Operation mit den Physiotherapiegeräten in Kontakt zu treten, um eine einfachere und schnellere Anpassung an die Übungseinstellungen zu gewährleisten. Führen Sie die Übungen durch, indem Sie die unten aufgeführten Verfahren befolgen.
- Legen Sie einmal am Tag jede Ratte in eine individuelle Physiotherapiesphäre und legen Sie die Kugel anschließend in einen Raum mit wenigen Hindernissen. Lassen Sie die Ratte ambulate und erkunden Sie den Raum frei für eine halbe Stunde.
- Die Ratten einzeln in einsamen Käfigen mit eingebauten Laufrädern unterbringen, um ihnen beim Trainieren zu helfen.
- Bilden Sie Gruppen von 4-5 Tieren und beherbergen diese Gruppen in personalisierten Käfigen. Personalisieren Sie die Käfige, indem Sie Leitern, Seile, Laufräder und andere Umweltanreicherungselemente einschließen.
- Bringen Sie einzelne Ratten am Tag nach der Operation in personalisierte Käfige zurück.
- Nehmen Sie Physiotherapie-Übungen 3 Tage nach der Operation fort.
3. Funktionstests
- Eine Woche vor Beginn der funktionellen Tests, machen Sie die Ratten mit den Lebensmitteln behandelt als positive Verstärkung verwendet werden. Stellen Sie diese Verstärkung nach dem erfolgreichen Abschluss jedes Tests vor und nach der Operation zur Verfügung. Nach der ersten Trainingszeit von 3 Wochen, nehmen Sie alle Tests 1 Woche nach der Operation.
- Führen Sie die Tests am Abend durch, wenn die Ratten natürlich aktiver sind. Setzen Sie die Tests 1 Woche nach der Operation fort.
- Führen Sie den Grasping-Test durch, indem Sie die Ratte auf ein Gitter legen und sie an ihrem Schwanz anheben, so dass sie das Gitter mit ihren Vorderpfotenpackt 11,26. Weisen Sie eine "Positive" Punktzahl zu, wenn die Ratte das Raster mit beiden Vorpaws greifen kann. Weisen Sie eine "Negative" Punktzahl zu, wenn die Ratte das Gitter nicht mit der verletzten Pfote greifen kann.
HINWEIS: Ein positiver Greiftest zeigt an, dass die Motorkomponente des MN16,27funktioniert. - Führen Sie einen Pin Prick Test28,29.
- Machen Sie eine Kunststoffplattform mit einem 4 mm x 4 mm quadratischen Rastermuster. Unterstützen Sie dieses Gitter mit einem 21 cm langen Metallrahmen.
- Legen Sie die Ratte auf die Plattform und bedecken Sie das Gitter mit einer 15,5 cm x 15,5 cm x 11 cm transparenten Kunststoffbox. Warten Sie einige Minuten, bis normale Aktivitäten (z. B. explorative und Hauptpflege) nachlassen.
- Starten Sie den Test, wenn die Ratte stationär ist und auf ihren vier Pfoten steht.
- Mit Hilfe eines Spiegels ein Ästhesiometer (z.B. Nummer 4 Von Frey Haar mit einer Biegekraft von 25 g) durch das Netz einfügen und den palmar Aspekt der Vorderpfote in das Hautgebiet des MN (Abbildung 1) stechen Wiederholen Sie die Bewertung 5x auf jedem Vorpaw alternativ, warten Sie ein paar Sekunden nach jeder Bewertung.
- Prüfen Sie die Biegung des Von Frey Filaments30 auf die korrekte Auswertung. Notieren Sie die Entzugsreaktionen wie folgt: "0" für keine Entzugsreaktion, "1", wenn die Ratte langsam die Pfote aus dem Filament entfernt, "2", wenn die Ratte schnell auf den Reiz reagiert und die Pfote entfernt oder die Pfote leckt.
HINWEIS: Wenn Ambulation und Beißen des Filaments beobachtet werden, wiederholen Sie den Reiz, da diese als mehrdeutige Reaktionen betrachtet werden.
- Schulungen
HINWEIS: Trainieren Sie die Ratten täglich für 3 Wochen, bevor Sie die Operation am Abend in einer Umgebung bei schwachem Licht durchführen. Die Trainingseinheiten werden speziell für die Seilkletter-, Leiterstufen- und Walking-Walking-Tests empfohlen. Diese können in der zuvor vorgestellten Reihenfolge durchgeführt werden, beginnend mit der Seilkletterprüfung, Leiterrung und schließlich Wanderstreckenprüfung. Lassen Sie das gleiche Tier ein paar Minuten Ruhe vor einem neuen Test.- Legen Sie die Ratte in der ersten Woche auf das letzte Drittel der Leiter/Seil/Korridor, in der Nähe des Kasteneingangs. Konditionieren Sie das Tier, um sich in Richtung der Boxöffnung zu bewegen, indem Sie die Schwanzspitze sanft berühren und/oder ziehen. Geben Sie der Ratte ein Lebensmittel, sobald sie die Box betritt, so dass sie einige Sekunden Ruhe vor der Wiederholung des Tests. Wiederholen Sie es 5x jeden Tag für 5 Tage.
- Legen Sie das Tier in der zweiten Woche auf das zweite Drittel der Leiter/Seil/Korridor Wiederholen Sie die Schritte in 3.5.1.
- Legen Sie die Ratte in der dritten Woche auf die Unterseite der Leiter/Seil/Korridor, auf der gegenüberliegenden Seite des Kasteneingangs. Wiederholen Sie die Schritte in 3.5.1, belohnen Sie das Tier jedoch nur, wenn es den Test ordnungsgemäß abschließt.
- Führen Sie den Ladder Rung-Test durch.
HINWEIS: Dieser Test wird zur Beurteilung der Vorderbeinenfestigkeit, Destretung, Platzierung und Koordination31verwendet.- Legen Sie die Ratte an den Boden der Leiter (120 cm x 9 cm x 2 cm mit 18 Stufen 1,5 cm dick, 4 cm voneinander entfernt) und berühren Sie sanft den Schwanz der Ratte. Stellen Sie sicher, dass die Leiter mit einer Neigung von 10° platziert wird und zu einer Öffnung von 13,20 cm x 11 cm auf einem dunklen 31,5 cm x 35 cm x 35 cm großen Kasten führt.
- Starten Sie den Timer, sobald die Ratte beginnt, die Leiter zu erklimmen, und stoppen Sie den Timer, sobald die Schnarbe der Ratte den Eingang der Box überquert.
- Zeichnen Sie die Zeit auf und wiederholen Sie den Test 3x, die jeweils mindestens um 1 min voneinander getrennt sind.
- Seilklettern
HINWEIS: Dieser Test dient zur Beurteilung der Greiffestigkeit, die von der MN-Wiederherstellung32abhängt.- Legen Sie die Ratte an den Boden des Seils und überzeugen Sie sie, durch sanftes Berühren des Schwanzes zu klettern. Starten Sie den Timer, sobald das Tier zu klettern beginnt, und stoppen Sie ihn, sobald die Schnarbe der Ratten den Eingang der Plattform überquert.
- Zeichnen Sie für jeden Test die Zeit auf, die für den Aufstieg auf die Plattform und die Anzahl der Ausrutscher der verletzten Pfote genommen wird, während die Ratte das Seil hinaufklettert. Halten Sie den Test für gültig, wenn das Tier während der Aufgabe nicht zögert oder nicht aufhört zu klettern. Geben Sie der Ratte einen Snack, nachdem Sie die Aufgabe richtig ausgeführt haben.
- Zeichnen Sie die Zeit auf und wiederholen Sie den Test 3x, die jeweils um ein Intervall von 1 Minute getrennt sind.
- Walking Tracks
HINWEIS: Dieser Test wird für die Bewertung der Vorderbeinmotor-Rückgewinnung33,34verwendet.- Stellen Sie ein Gerät auf, das aus einem begrenzten Gehweg von 16,5 cm Höhe x 8,7 cm Breite x 43 cm Länge besteht. Achten Sie darauf, dass dies zu einer rechteckigen Öffnung von 8,8 cm x 8,2 cm in einer der Wände eines schwarzen 23 cm x 36 cm x 28 cm Großen Kastens führt. Schließen Sie eine vertikale Schiebetür ein, um den Eingang der Box schnell zu schließen. Fügen Sie ein abnehmbares Oberteil ein, das zum Abrufen der Ratte33,34verwendet werden soll.
- Legen Sie ein Blatt Graphenpapier auf den Boden des Korridors. Schnappen Sie sich die Ratte am Schwanz und lassen Sie sie einen in Methylenblau getränkten Pinsel halten. Positionieren Sie die Ratte am Eingang des Korridors, damit sie in den Kasten geht. Entfernen Sie das Graphenpapier aus dem Boden des Korridors und wiederholen Sie den Test, bis ein guter repräsentativer Eindruck von beiden Vorpaws gewonnen ist.
- Wählen Sie aus den erhaltenen Drucken einen mit klaren aufeinanderfolgenden Vorpaw-Drucken aus, fotografieren Sie sie im Tiff- oder JPEG-Format und messen Sie die folgenden Parameter mit der Open-Access-Software FIJI35.
ANMERKUNG: Kalibrieren Sie zunächst jedes Bild mit den Markierungen im Diagrammpapier (Analysieren | Maßstab festlegen) Zweitens, konvertieren Sie jedes Bild in ein 8-Bit-Format (Bild | Typ | 8-Bit). Anschließend verwenden Sie das rechteckige Auswahlwerkzeug, um den Pfotendruck auszuwählen. Zuschneiden dieses Teils des Bildes(Bild | Ernte). Markieren Sie in jedem Bild die Pfotenabdrücke, und entfernen Sie den Hintergrund, indem Sie das Bild(Bild | Anpassen | Schwellenwert).- Messen Sie den Haltungsfaktor, indem Sie die Pfotenabdruckfläche messen. Verwenden Sie das Rechteckige Auswahlwerkzeug, um den Pfotendruck auszuwählen und die Taste Control + Mzu drücken.
- Messen Sie den Drucklängenfaktor, indem Sie die längste Länge des Pfotenabdrucks messen (für die Schritte 3.8.3.2–3.8.3.6 verwenden Sie das Straight-Line Selection Tool, um die beiden am weitesten entfernten Punkte auszuwählen und Control + Mzu drücken).
- Messen Sie den Fingerstreufaktor, indem Sie die breiteste Breite des Pfotenabdrucks messen.
- Messen Sie den Zwischenfingerstreufaktor, indem Sie die breiteste Breite zwischen dem zweiten und dritten Finger messen.
- Messen Sie die Schrittlänge, indem Sie den Abstand zwischen homologen Punkten aufeinanderfolgender Pfotenabdrücke auf einer bestimmten Seite messen.
- Messen Sie die Basis der Stütze, indem Sie den senkrechten Abstand zwischen dem zentralen Teil des Pfotenabdrucks und der Bewegungsrichtung29,33,36messen.
HINWEIS: Führen Sie die letzten beiden Messungen in zwei Paaren repräsentativer aufeinander folgender bilateraler Pfotenabdrücke33durch.
4. Physiologische Messungen
- Infrarot-Thermographie (IRT)37,38,39.
- Stellen Sie sicher, dass die Temperatur des Raumes, in dem die Messungen durchgeführt werden, mit einem normalen digitalen Hydrothermometer mit einer thermischen Auflösung von 0,1 °C zwischen 18 °C und 25 °C liegt. Stellen Sie sicher, dass keine signifikanten Wärmequellen (z. B. Computer oder Kühlschränke) vorhanden sind.
- Akklimatisieren Sie die Ratten, indem Sie sie 2 h vor der Auswertung in den Bewertungsraum bringen. Bevor Sie mit dem Experiment beginnen, beanten Sie die Ratte wie oben beschrieben (Schritte 1.3–1.6) oder folgen Sie dem Protokoll der Institution. Überprüfen Sie, ob die Antwort auf eine Zehenklemme fehlt, bevor Sie mit dem Experiment beginnen.
- Schalten Sie die Infrarot-Thermokamera 15 min vor der Erfassung ein und schalten Sie sie während der Auswertungen nicht aus. Stellen Sie den Emissivitätsparameter der Kamera so ein, dass er mit dem der Haut der Ratte übereinstimmt (= 0,98)37,40,41.
- Die Ratte auf ihre Dorsum auf eine saubere und stabile Oberfläche mit einem Polyethylenschwamm legen. Stellen Sie sicher, dass keine reflektierenden Materialien und andere mögliche Quellen von Artefakten vorhanden sind. Fix seine Vorpaws sorgfältig in Supination mit doppelten Gesicht Klebeband. Legen Sie ein digitales Thermometer 2 cm in das Rektum ein, um die zentrale Temperatur der Ratte bei allen Auswertungen zu überwachen.
- Halten Sie die thermografische Kamera in einem 90°-Winkel und 30 cm Abstand von der Ratte. Konzentrieren Sie die Kamera auf den Körper des ganzen Tieres. Erhalten Sie drei Infrarot-Thermographiebilder im Abstand von 30 s.
- Übertragen Sie die erworbenen Thermogramme auf einen Computer und analysieren Sie sie mit Analysesoftware. Definieren Sie die Temperatur der Plantaroberfläche beider Vorpaws anhand eines festen rechteckigen Bereichs von Interesse (z. B. 9 x 11 Pixel) im Plantargebiet des MN, z. B. in der Mitte des ersten metakarpalen Fußpolsters (Abbildung 1). Wählen Sie mit der kostenlosen FLIR Tools Software die Thermografie durch Doppelklick darauf aus. Wählen Sie auf der linken Werkzeugleiste die Schaltfläche"Feldmesswerkzeug hinzufügen" und zeichnen Sie ein Rechteck von 9*11 Pixeln über den Plantarbereich beider Vorpaws. Beim Anpassen des Rechtecks kann seine Bemaßung in Pixel bestätigt werden. Führen Sie es auf beiden Vorpaws. Auf der rechten Seite des Bildes finden Sie die maximalen, minimalen und durchschnittlichen Temperaturen.
- Klicken Sie über den zuvor gezeichneten ROI mit der rechten Maustaste auf den Export. Die mittleren, maximalen und minimalen Temperaturen sowie eine Matrix der Temperaturen des ROI werden dann in ein .csv-Dokument exportiert. Diese Daten können später mit Datenanalysesoftware untersucht werden.
- Elektroneuromyographische (ENMG) Bewertung
- Richten Sie einen elektrischen Stimulator ein. Klebe ein Paar Einweg-Akupunkturnadeln (0,25 mm x 25 mm) mit einer vernachlässigbaren Impedanz [<1 n]) und 25 mm dazwischen, um Elektroden zur Stimulation zu erzeugen. Verbinden Sie nun den Stimulator und die Elektrode mit einer Datenerfassungseinheit, um die eingehenden Signale zu nehmen und in digitale Signale umzuwandeln, die mit der Computersoftware verarbeitet werden können.
- Führen Sie die Auswertungen im selben Raum und immer unter den gleichen kontrollierten Umgebungsbedingungen42,43,44. Pinch die Vorderpfote, um sicherzustellen, dass die Ratten tief beästhetisiert werden, bevor Sie mit der Datenerfassung beginnen.
HINWEIS: Eine tiefe Anästhesie ist von größter Bedeutung, um die Variabilität im Zusammenhang mit spontanen freiwilligen und/oder unfreiwilligen Bewegungen der Ratten zu minimieren43. - Setzen Sie den MN beidseitig unter dem Operationsmikroskop aus, wie in den Schritten 1.8–1.13 beschrieben. Verwenden Sie eine Skalpellklinge mit der Nummer 15, um die brachialen Einschnitte in die Unterarme mit einem ventralen Mittellinienschnitt zu verlängern.
- Setzen Sie den oberflächlichen Aspekt der Flexor digitorum sublimis Muskeln aus, indem Sie die darüber liegende antebrachiale Faszie mit einer Irisschere unverblümt trennen. Setzen Sie die Bodennadel in den Quadriceps femoris Muskel des linken Hinterglieds ein, um den Signal-Bodenstecker zu verbinden.
- Beginnen Sie mit dem rechten Vorderpfote und legen Sie die Aufnahmeelektroden in den Flexor digitorum sublimis Muskelbauch des Vorderpfoes und die Stimulationselektrode proximal an die Läsionsstelle im MN. Befeuchten Sie diese Elektroden mit Salzlinie.
- Stellen Sie sicher, dass die Software wie folgt eingestellt ist: Kanaleingangsanschluss 1 (CH1) – Stimulator auf 0–10 V; und Kanaleingangsanschluss 2 (CH2) - EMG bis 30–1.000 Hz. Beginnen Sie mit einer Stimulationsamplitude von 10 mV und erfassen Sie die zusammengesetzten Muskeleinwirkungspotentiale CMAPs Abtastrate von 50 kHz für eine Dauer von 40.000 ms. Schrittweise erhöhen Sie die Stimulationsamplitude in 10 mV Schritten bis zu erreichen 2.000 mV. Wiederholen Sie dasselbe für die linke Pfote42,43,44.
HINWEIS: Das Signal wird auf 1.000x verstärkt und mit einem 30–1.000 Hz-Band gefiltert. Der Stimulationsausgang wird für einen einzelnen Impuls mit einer Dauer von 1 ms42,43,44eingestellt. - Öffnen Sie die aufgezeichnete Datei in der Software des Aufnahmegeräts.
HINWEIS: Standardmäßig zeigt der Bildschirm Abschleppfenster oben in Rot, der Stimulator pulsiert, und unten in blau die Recorder ENMGs. Das Verschieben der horizontalen Bildlaufleiste unter die Zeitskala ermöglicht die Visualisierung des vollständigen Datensatzes. Die beiden Hauptwerkzeuge, Zoom Zoom-Werkzeug und I-Beam-Werkzeug, befinden sich auf der unteren rechten Seite des Panels. Mit dem Zoom-Toolist es möglich, die Visualisierung der CMAPs zu optimieren und die Grafiken zu erkunden. Zoom Um eine gute Passform auf dem Visualisierungsbildschirm zu gewährleisten, kann es erforderlich sein, die Anzeige nach dem Zoomen anzupassen. Wählen Sie dazu Anzeigen| Automatische Skalierung Waveforms. Das I-Strahl-Werkzeug ermöglicht die Auswahl bestimmter Bereiche der Graphen und die Leistung der gewünschten Messungen. Über den Diagrammen befinden sich drei kleine Fenster, in denen die Messungen angezeigt werden. P-P zeigt den durchschnittlichen Amplitudenwert des ausgewählten Bereichs in Volt (sowohl im Stimulatordatensatz als auch in ENMGs), während Delta-T das Zeitintervall dieser Auswahl anzeigt. - Messen Sie die Parameter des zusammengesetzten Muskelwirkungspotentials (CMPAs, beschrieben in Tabelle 1) mit den gleichnamigen Messwerkzeugen aus dem Software-Plug-in "Toolbox für die unbeaufsichtigte Klassifizierung von MUAPs und Aktionspotentialen in EMG"45.
- Bestimmen Sie für jede Ratte einen minimalen Wert der Stimulationsspannung, nach dem die CMAPs-Amplitude nicht weiter ansteigt. Beginnen Sie mit einem 0,05 mV Stimulus und geben Sie sukzessive steigende Reize in inkrementellen Spannungen von 0,05 mV.
- Wenden Sie einen Stimulus 20% über dieser Spannung an, um einen supramaximalen Stimulationswert zu erhalten.
- Nachdem der letztgenannte Wert ermittelt und der entsprechende Stimulus angewendet wurde, erfassen Sie die nächsten CMAPs-Parameter.
- Flexionsstärkebewertung
- Verwenden Sie die gleichen Stimulator- und Stimulationselektroden, um das MN elektrisch zu stimulieren wie in Schritt 4.2. Stellen Sie den Eingangskanal CH1 als Stimulator (0–10 V) und die Ausgangseinstellungen für Reize von 30 s mit Impulsen von 1 ms Dauer und 1 Hz-Frequenz ein. Verknüpfen Sie einen Dynamometer mit einer Auflösung von d = 0,001 N mit einem Computer.
HINWEIS: Die Echtzeit-Visualisierung von Daten kann durch Erstellen eines Kraftdiagramms pro Zeit (N/s) mithilfe der zuvor auf dem Computer installierten und mit einem Dynamometer46verknüpften Software erreicht werden. - Platzieren Sie die Ratte wie in Schritt 4.1.4 beschrieben. Legen Sie eine 5/0 Seidennahtschleife durch den zweiten interosseous Raum der beiden Vorpaws. Befestigen Sie die Nahtschleife am Haken des Dynamometers und am Vorderpfupfot, der am Dynamometer ausgerichtet ist, ohne die Nahtlinie übermäßig zu belasten.
- Befestigen Sie die kontralaterale Pfote mit Klebeband, um falsche Bewegungsstörungen in den Dynamometer-Lesungen zu vermeiden.
- Stellen Sie den Prüfstand auf Null, indem Sie auf die Schaltfläche ZERO klicken.
- Stellen Sie den Stimulator auf eine supramaximale Amplitudenstimulation von 1,5 V ein, indem Sie den Spannungsknoten einstellen.
- Öffnen Sie auf dem PC die Software AFH-01. Öffnen Sie das Trennzeichen "Gerät" und wählen Sie das Gerät FH5. Erstellen Sie eine neue Datei ("Measurements1" ist der standardmäßig angegebene Name) und benennen Sie die Datei um.
- Legen Sie die Elektrode auf den proximalen Teil des MN, klicken Sie auf Spiel am unteren Rand des Programms, nehmen Sie den Zug auf dem Dynamometer für 30 s auf.
- Importieren Sie die erhaltenen Werte in eine Datenanalysesoftware. Berechnen Sie die maximalen und durchschnittlichen Kraftwerte und die Fläche unter der Kurve (AUC) für das Festigkeits-x-Zeitdiagramm für jede Auswertung.
- Wiederholen Sie dies für die linke Vorderpfote.
- Verwenden Sie die gleichen Stimulator- und Stimulationselektroden, um das MN elektrisch zu stimulieren wie in Schritt 4.2. Stellen Sie den Eingangskanal CH1 als Stimulator (0–10 V) und die Ausgangseinstellungen für Reize von 30 s mit Impulsen von 1 ms Dauer und 1 Hz-Frequenz ein. Verknüpfen Sie einen Dynamometer mit einer Auflösung von d = 0,001 N mit einem Computer.
- Muskelgewicht
- Euthanisieren Sie die Ratten unter Vollnarkose durch Exsanguination47,48.
- Ernten Sie den Flexor carpi radialis Muskel von beiden Unterarmen, seziert den Muskel von seinem Ursprung bis zu seiner distalen Sehneneinfügung, mit einer Nummer 15 Skalpellklinge.
- Wiegen Sie die Muskeln mit einer Präzisionsskala9,49.
Ergebnisse
Insgesamt 34 Ratten wurden nach dem Zufallsprinzip in folgende Gruppen eingeteilt: Schein (n = 17), Exzision (n = 17) und Nerve Graft (n = 10) für die Operation. Alle Ratten überlebten die Operation und die postoperative Periode ereignislos. Eine Woche nach der Operation und für die folgenden 100 Tage wurden alle Tiere einmal pro Woche den oben beschriebenen Funktionstests unterzogen. Die repräsentativen Ergebnisse jedes dieser Tests werden im Folgenden beschrieben.
Grasping-Test
Der Prozentsatz der Ratten mit einer positiven Reaktion im Greiftest war für die Sham-Gruppe am höchsten. Dieser Wert stieg im Laufe der Zeit bei Ratten aus den Gruppen Crush und Nerve Graft allmählich an (Abbildung 3).
Pin Prick Test
Ratten aus der Sham-Gruppe hatten die besten Werte im kumulativen Nadelstichtest im Vergleich zu Ratten aus der Nerve Graft-Gruppe. Beide hatten bessere Ergebnisse als die Ratten in der Exzisionsgruppe (Abbildung 4).
Leiterlauftest
Die Geschwindigkeit der Ratten im Leiterlauftest war in der Sham-Gruppe am höchsten als bei den Ratten, die der MN-Läsion unterzogen wurden. Bei letzteren verringerte sich die Zeit für den Betrieb der Leiter im Laufe der Zeit, parallel zur MN-Erholung(Abbildung 5).
Seilprüfung
Wie beim Leiterlauftest war die Zeit, die die Ratten brauchten, um das Seil zu erklimmen, in der Sham-Gruppe kürzer als in den Gruppen, in denen die MN verletzt wurde. Die Geschwindigkeit der Ratten in diesem Test erhöhte sich, als die MN sich erholen durfte (Abbildung 6).
Walking Track Analyse
Die Analyse von Wanderwegen zeigte tendenziell Veränderungen in der Morphologie der Pfotenabdrücke (Abbildung 7). Diese Veränderungen waren bei zerquetschenden Verletzungen oft stärker ausgeprägt als bei segmentalen Nervenläsionen50.
Infrarot-Thermographie
Die Thermographie war nützlich, um Temperaturunterschiede zwischen den Vorpaws in den ersten 30 Tagen nach der Operation zu untersuchen. Die Temperaturunterschiede waren bei Ratten mit schwerer verletzten MN stärker zu beobachten, z. B. bei Ratten aus der Exzisionsgruppe (Abbildung 8 und Abbildung 9).
Elektroneuromyographie
Tabelle 1 fasst die biologische Bedeutung der elektroneneuromyographischen Messungen zusammen und liefert repräsentative Ergebnisse für die verschiedenen Versuchsgruppen. Verschiedene Muster wurden mit der Elektroeuromyographie beobachtet. Ein normaler CMAP war typisch für eine Ratte aus der Sham-Gruppe, während ein polyphasischer CMAP mit einem variablen Läsionsgrad des MN assoziiert war, wie in der Crush und in den Nerve Graft-Gruppen (Abbildung 10). Sham In der Excision-Gruppe wurden keine CMAPs beobachtet.
Handgelenk Flexion Stärke
Da die Handgelenkbeugung hauptsächlich vom MN abhängt, wurde dieser Test zur Bewertung der motorischen Erholung im Gebiet dieses Nervs verwendet. Die Biegefestigkeit des Handgelenks war der Normalität am nächsten, als die Erholung maximal war (Abbildung 11).
Muskelgewicht und Morphologie
Das Gewicht und die Morphologie des Flexor carpis radialis Muskels waren abhängig von der MN-Erholung, da dieser Muskel ausschließlich durch die MN9,10innerviert wird. So wurden Normalgewicht und Morphologie in der Sham-Gruppe beobachtet. Ein Gewichtsverlust und Muskeltrophism wurde in den Crush, Nerve Graft, und Excision Gruppen beobachtet (Abbildung 12).
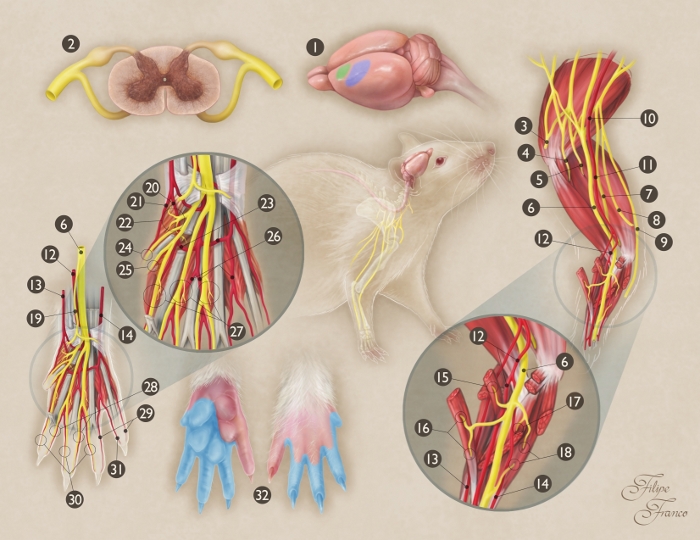
Abbildung 1: Schematische Darstellung der Anatomie des Mediannervs der Ratte.
(1) Ursprung und Beendigung des Mediannervs im Rattenhirn (grüner Bereich = primärer Motorbereich; blauer Bereich = primärer Sinnesbereich). (2) Querteil des Rückenmarks auf C7-Segmentebene; (3) Axillärnerv; (4) Muskel-Skelett-Nerven; (5) Radialnerv; (6) Mediannerv; (7) Ulnarnerv; (8) Medialer Kutanzweig des Arms; (9) Medialer Kutanzweig des Unterarms; (10) Axillary Arterie; (11) Brachialarterie; (12) Medianarterie; (13) Oberflächliche radiale Arterie; (14) Ulnararterie; (15) Motorzweig des Mediannervs zum Pronatortermuskel; (16) Motorzweig des Mediannervs zum Flexor carpis radialis Muskel; (17) Motorzweig des Mediannervs zum Flexor digitorum superficialis Muskel; (18) Motorzweig des Mediannervs zum Flexor digitorum profundus Muskel; (19) Sensorischer Zweig des Mediannervs zur Thenarregion; (20) Gemeinsame Palmarterie des ersten interossischen Raumes; (21) Radiale palmar digitale Arterie der ersten Ziffer; (22) Motorzweig des Mediannervs zu den Thenarmuskeln; (23) Palmar Arterienbogen; (24) Radial palmar digitaler Nerv der ersten Ziffer; (25) Ulnar palmar digitaler Nerv der ersten Ziffer; (26) Gemeinsame Palmarterie des dritten interossischen Raumes; (27) Motorzweige der Terminaldivisionen des Mediannervs zu den ersten drei lumbricalen Muskeln; (28) Ulnar palmar digitale Nerven der zweiten, dritten und vierten Ziffer; (29) Ulnar palmar digitale Arterien auf die vierte und fünfte Stelle; (30) Radiale palmar digitale Nerven der zweiten, dritten und vierten Ziffer; (31) Radiale palmar digitale Arterie der fünften Stelle; (32) Hautgebiet des Mediannervs in der Vorderpfote (blau schattierte Region). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
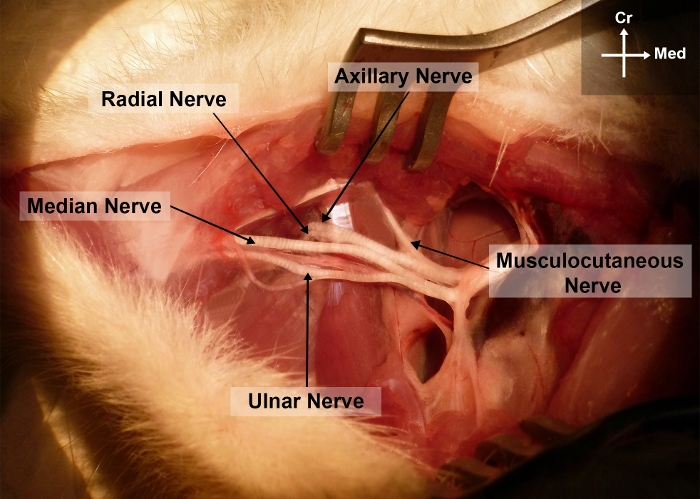
Abbildung 2: Foto des rechten Vorderbeins der Ratte, das die chirurgische Anatomie des Mediannervs in den Arm- und Achselbereichen zeigt.
Cr, kranial; Ich, medial Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
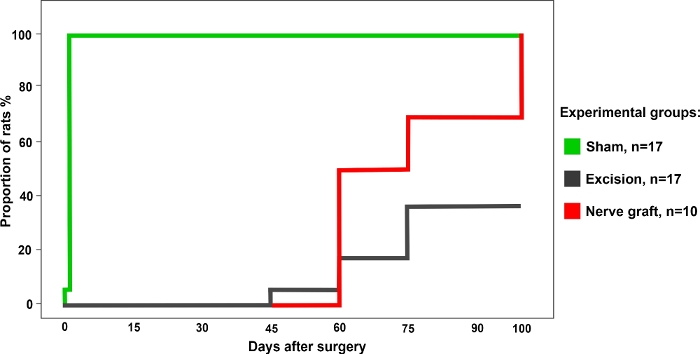
Abbildung 3: Prozentsatz der Ratten mit einem positiven Greiftest in der verschiedenen Versuchsgruppe über einen Zeitraum von 100 Tagen nach der Operation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
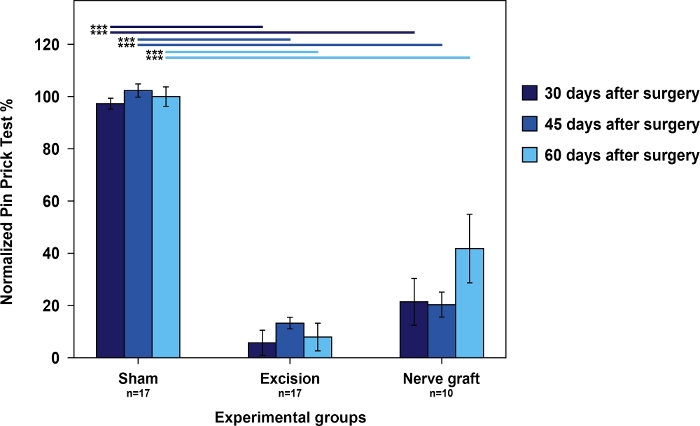
Abbildung 4: Nociception-Auswertung mit kumulativen Pin-Prick-Testergebnissen in der operierten Vorpaw normalisiert auf die kontralaterale Pfote in den verschiedenen experimentellen Gruppen.
Vertikale Balken stellen 95 % Konfidenzintervalle dar. Horizontale Linien im oberen Teil der Abbildung zeigen statistisch signifikante Unterschiede zwischen experimentellen Gruppen, ***p<0.001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
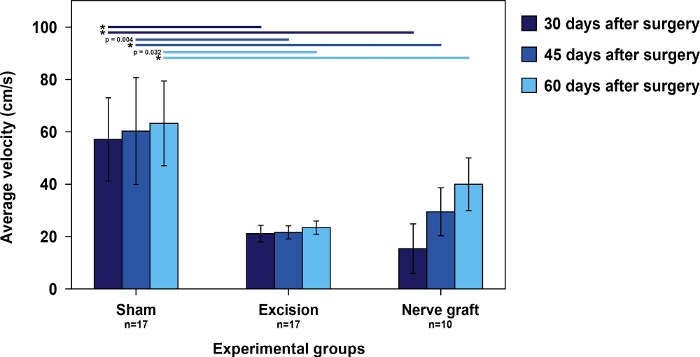
Abbildung 5: Durchschnittliche Geschwindigkeit im Leiterlauftest in den verschiedenen Versuchsgruppen.
Vertikale Balken stellen 95 % Konfidenzintervalle dar. Sternchen im oberen Teil der Abbildung zeigen statistisch signifikante Unterschiede zwischen den Gruppen, *p<0.001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
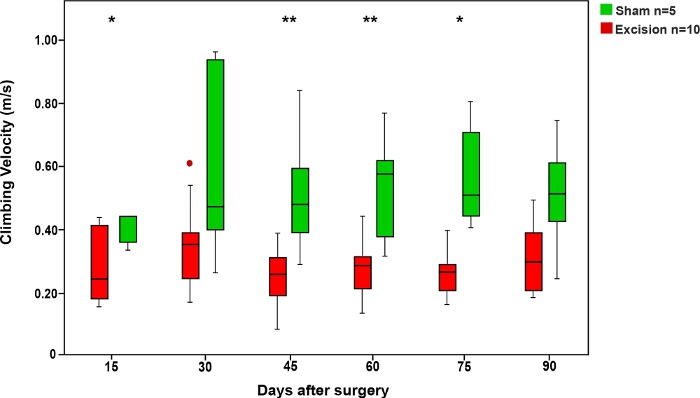
Abbildung 6: Durchschnittliche Klettergeschwindigkeit im Seiltest in den Schein- und Exzisionsgruppen.
Vertikale Balken stellen 95 % Konfidenzintervalle dar. Sternchen im oberen Teil der Abbildung zeigen statistisch signifikante Unterschiede zwischen den Gruppen, *p<0.05; **p<0.01. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
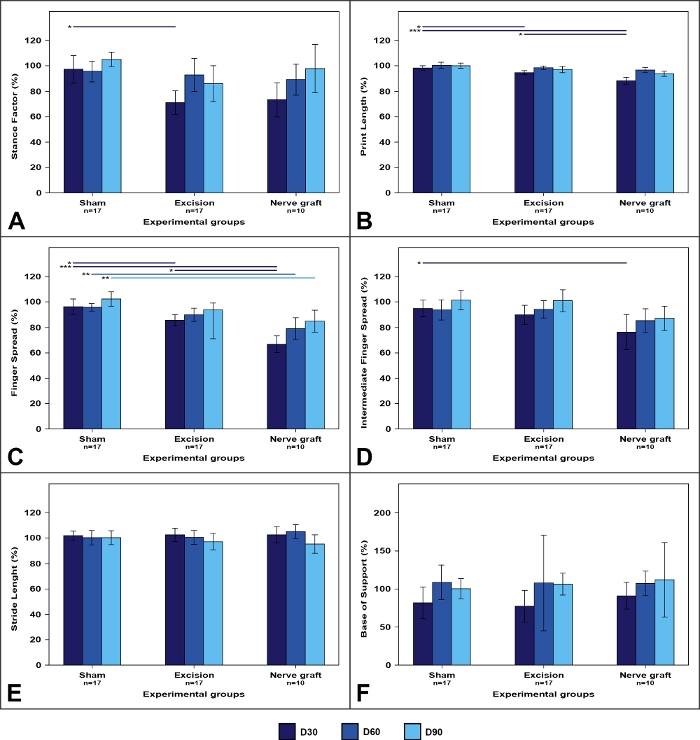
Abbildung 7: Walking-Track-Parameter in den verschiedenen experimentellen Gruppen.
Die Werte an der operierten Gliedmaße werden als Prozentsätze der mittels der normalisierten Mittel zur kontralateralen Extremität ausgedrückt. (A) Stance-Faktor; (B) Drucklänge; (C) Fingerstreufaktor; (D) Zwischenfingerstreufaktor; (E) Schrittlänge; (F) Basis der Unterstützung. Vertikale Balken stellen 95 % Konfidenzintervalle dar. Horizontale Linien im oberen Teil der Abbildung zeigen statistisch signifikante Unterschiede zwischen experimentellen Gruppen an. D30, D60, D90 = 30, 60 und 90 Tage nach der Operation, *p<0.05; **p<0.01; p<0.001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
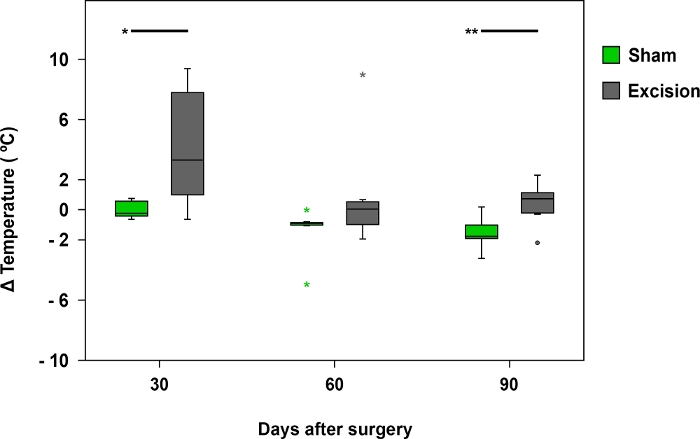
Abbildung 8: Mittlere Rinnswerttemperaturdifferenz, die durch Infrarotthermographie erfasst wird.
Die Box-Plots stellen den Temperaturunterschied zwischen dem Palmar-Bereich des Mediannervs auf der operierten Seite (rechts) und der kontralateralen Seite (links) in den Gruppen Schein (n = 17) und Exzision (n = 17) *p<0,05 dar; **p<0.01. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
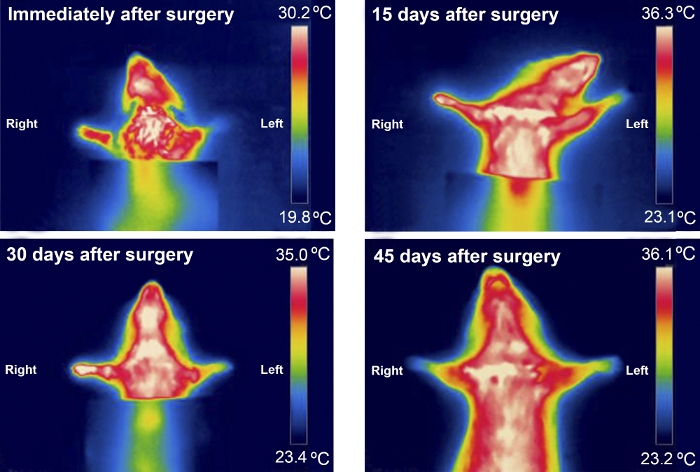
Abbildung 9: Typisches Infrarot-Thermographiemuster eines Tieres aus der Exzisionsgruppe in den ersten 45 Tagen nach der Operation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
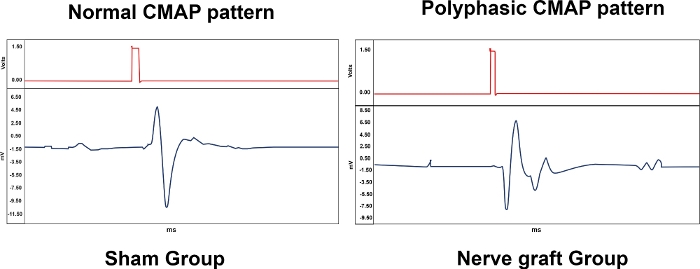
Abbildung 10: Typische Muster von Compound Muscle Action Potentials (CMAPs) von einem Tier aus den Gruppen Sham und Nerve Graft 90 Tage nach der Operation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
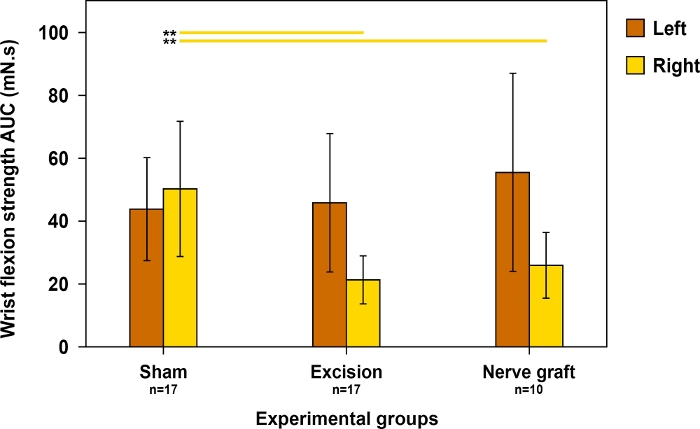
Abbildung 11: Bewertung der Handgelenksflexionsfestigkeit an beiden Vorpaws 90 Tage postoperativ in verschiedenen Versuchsgruppen.
Die Handgelenkflexionsfestigkeit wurde anhand des Bereichs unter der Kurve (AUC) über einen Zeitraum von 30 s und unter Verwendung supratetanischer Stimulation bewertet. Vertikale Linien bezeichnen 95% Konfidenzintervalle. Horizontale Linien im oberen Teil der Abbildung weisen auf statistisch signifikante Unterschiede zwischen Gruppen,*p<0,01 hervor. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
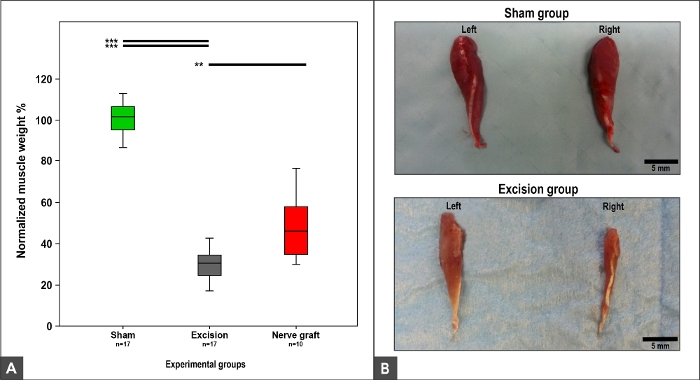
Abbildung 12: Flexor carpi radialis Muskelgewicht und makroskopisches Aussehen 100 Tage nach der Operation.
(A) Boxplots, die das normalisierte Flexor carpi radialis Muskelgewicht in verschiedenen Versuchsgruppen darstellen, **p<0.01; p<0.001. (B) Fotografien der Muskeln auf der rechten und linken Seite in den Versuchsgruppen Schein und Exzission. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Parameter | Parametersignifikus | Scheingruppe | Exzisionsgruppe | NG-Gruppe |
| Neurologische Stimulationsschwelle (%) | Bewertung der Nervenregeneration, da eine minimale Anzahl von Nervenfasern erforderlich ist, um entweder einen CMAP oder eine sichtbare Muskelkontraktion zu erzeugen12 | 281,63 € 271,65 | 5359,98 bei 3466,52 | 2108,12 € 2115,13 |
| Motorstimulationsschwelle (%) | Bewertung der Nervenregeneration, da eine minimale Anzahl von Nervenfasern erforderlich ist, um entweder einen CMAP oder eine sichtbare Muskelkontraktion zu erzeugen12 | 462,52 € 118,91 | 1694,10 bei 503,24 | 1249,50 bei 503,24 |
| Latenz (%) | Beurteilung der Nervenleitungsgeschwindigkeit in den schnellsten Nervenfasern, d.h. den größten myelinierten Fasern44 | 113,55 € 25,04 | N/A | 132,80 bei 69,95 |
| Neuromuskuläre Transduktionsgeschwindigkeit (%) | Beurteilung der Nervenleitungsgeschwindigkeit in den schnellsten Nervenfasern, d.h. den größten myelinierten Fasern44 | 92,01 € 20,88 | N/A | 91,30 € 26,51 |
| AMPlitude von CMAPs (%) | Auswertung der Anzahl der wiederbeauferten Motoreinheiten34 | 110,63 € 45,66 | N/A | 41,60 € 24,84 |
| CMAPs-Dauer (%) | Beurteilung der Synchronität der Muskelinnervation, die vom Grad der Muskelreinnervation und Myelinisierung der inneraufvierenden Motorfasern abhängt44,45 | 101,12 € 23,92 | N/A | 151,06 € 54,52 |
|
NG, Nerventransplantat CMAPs, zusammengesetzte Muskel-Wirkungspotenzial. N/A, nicht anwendbar Alle Parameter werden als Prozentsätze der durchschnittlichen kontralateralen Werte ausgedrückt. Numerische Variablen werden als durchschnittliche Standardabweichung ausgedrückt. | ||||
Tabelle 1: Elektroneneuromyographische Bewertung am Ende des Experiments.
Diskussion
Dieses Papier stellt ein Protokoll vor, um verschiedene Arten von MN-Läsionen und Reparaturen in der Ratte zu erstellen. Darüber hinaus zeigt es, wie die funktionelle Erholung dieses Nervs mit mehreren nichtinvasiven Verhaltenstests und physiologischen Messungen zu bewerten.
Insbesondere sind einige der in diesem Papier beschriebenen Funktionstests, nämlich der Leiterlauftest und der Seiltest, erheblich von der Bereitschaft der Ratte abhängig, die Aufgabe mit der Erwartung zu erfüllen, die Futterbelohnung51,52,53zu erhalten. Es sei darauf hingewiesen, daß bestimmte Rattenstämme in dieser Art von Tests51,52,53für die Ausbildung und die reproduzierbare Reproduzierbare Durchführung besser geeignet sind. Zum Beispiel schneiden Lewis Ratten in diesen Tests sowohl in der Trainingsphase als auch in der Folge51,52,53schlecht ab.
Rattengehäuse sollten im Einvernehmen mit ihrem natürlichen Sondierungsverhalten eine ausreichende Bewegungsfreiheit ermöglichen und versuchstieren nicht auch ermöglichen, sich mit einigen der in den Funktionstests vorhandenen Elemente vertraut zu machen19. Daher werden verschiedene Wohnformen gezeigt, die eine höhere Bewegungsfreiheit ermöglichen. Die großen Käfige werden mit Anreicherungselementen personalisiert, die später in den Funktionstests (z.B. Seile und Leitern) verwendet werden.
Diese anreichernden Elemente sowie die Käfige mit eingebauten Laufrädern und die einzelnen Trainingssphären bieten eine Postoperative Physiotherapie ähnlich der, die menschlichen Patienten am peripheren Nervensystem10angeboten wird.
Bezeichnenderweise, obwohl einige Autoren befürworten, die subkutanen Gewebe und Muskelfaszien stumpf oder durch sauberes Schneiden mit einer Zahl 15 Skalpell zu sezieren, wird die Verwendung von Thermokauterie bei der Sezieren dieser Strukturen empfohlen, um das Risiko von postoperativen Hämatomen zu minimieren.
Es sei darauf hingewiesen, dass zahlreiche Tests entwickelt wurden, um verschiedene Aspekte der peripheren Nervenreparatur bei der Ratte zu testen, nämlich axonale Regeneration, Zielrenervation und funktionelle Erholung, von denen einige außerhalb des Rahmens dieser Studie liegen29,54,55,56. Beispielsweise werden die kinematische Analyse29,36,55 und die histomorphometrische Bewertung29,36,57 häufig von mehreren Autoren verwendet. Darüber hinaus beinhalten mehrere dieser Tests Variationen, um die Effizienz und/oder Reproduzierbarkeit zu maximieren54. Beispielsweise kann die mechanische Algismetrie (d. h. die Bewertung von Reaktionen auf mechanische schmerzhafte Reize) qualitativ anhand eines bestimmten von Frey-Filaments, wie in diesem Papier beschrieben, oder halbquantitativ mit sukzessiv stärkeren von Frey-Filamenten oder sogar quantitativ mit elektronischen Geräten, die steigende Drücke anwenden, bis eine Entzugsreaktion beobachtetwird, 30,54.
In ähnlicher Weise, obwohl mehrere Autoren Verwenden von Walking-Track-Analyse, um Forelimb Nervenreparatur in der Ratte zu bewerten, andere Autoren argumentieren, dass einzelne MN-Läsionen häufig nicht reproduzierbare Veränderungen in Pfotenabdrücken10,58,59produzieren. Darüber hinaus haben einige erklärt, dass diese Veränderungen möglicherweise nicht proportional zur Muskelerholung10,60sein. Vor diesem Hintergrund haben einige Forscher die Verwendung von Walking-Track-Analyse in der Vorderpfote vor allem bei der Beurteilung der Erholung nach dem Zerkleinern neve Läsionen statt nach segmentalen Nerven rekonstruktion10,50,61befürwortet.
Der Grasping Test ist weit verbreitet, um die motorische Erholung der muskeln durch die MN16gesteuert27entlassen. Um die Homogenität und Reproduzierbarkeit der mit diesem Test gewonnenen Daten zu gewährleisten, wird die Anwendung des Greiftests unter Verwendung der von Bertelli et al.16 vorgeschlagenen bewährten Methodik empfohlen. Das aktuelle Protokoll unterscheidet sich jedoch dadurch, dass es die kontralaterale Pfote nicht routinemäßig immobilisiert, um übermäßigen Stress zu vermeiden11,27. Es sollte auch beachtet werden, dass andere Autoren, nach dem Immobilisieren der unverletzten Pfote, den Greiftest mit einem Dynamometer oder einer Skala27,56quantitativ bewerten. Diese quantitative Bewertung kann jedoch durch die Stärke beeinflusst werden, die der Forscher auf den Schwanz der Ratte anwendet26. Darüber hinaus ist es schwierig, zwischen der Kraft, die von den digitalen Flexormuskeln erzeugt wird (ausschließlich durch das MN in der Ratte und dem Objekt des Grasping Test9)erzeugten Festigkeit von der Festigkeit der Handgelenkflexoren zu unterscheiden, zu denen auch der Flexor carpi ulnaris gehört, der seine Innervation vom Ulnarnerv9,10,27erhält. Um zu versuchen, diese potenziellen Verzerrungen zu umgehen, verwendet dieses Protokoll eine Ordinalskala ähnlich der Medical Research Council Scale, die häufig verwendet wird, um Muskelkraft beim Menschen zu gradieren10,11,62. Alternativ haben andere Autoren eine detaillierte Bewertung des Greifens mittels Videoanalyse und einem videobasierten Bewertungssystem11,63beschrieben.
Ein potenzieller Nachteil der Verwendung des MN im Vergleich zum Ischiasnerv ist, dass eine größere Menge an Informationen über den letzteren Nerv zur Verfügung steht. Dies wiederum kann den Vergleich der mit dem MN erhaltenen Daten mit denen früherer experimenteller Arbeiten erschweren46,48,64. Zusätzlich macht die kleinere Größe des MN im Vergleich zum8Ischiasnerv chirurgische Manipulation enerther 8,12,27,56,65.
Im Gegensatz zur in diesem Papier beschriebenen Methodik kann die Elektroneuromyographie-Auswertung mit transkutanen Monopolelektroden durchgeführt werden, die im Arm und in den Narregionen51platziert sind. Obwohl diese Methode weniger invasiv ist, birgt sie das Risiko einer möglichen Verwechslung aufgrund der Möglichkeit einer Kostimulation des Ulnarnervs im Armbereich9,51.
Die meisten Autoren sind sich einig, dass nicht alle Tests, die in der Ratte verwendet werden, konkordante Ergebnisse liefern, da die periphere Nervenreparatur von einer komplexen Reihe von Faktoren abhängt, die Neuronenüberleben, axonale Dehnung und Beschnitt, Synaptogenese, erfolgreiche Rückeroberung der denervierten Sinnesorgane und Motoreinheiten sowie die Hirnplastizität7,10,50,66,67umfassen.
Schließlich ist anzumerken, dass ein wesentlicher Vorbehalt der Nagetiermodelle darin besteht, dass die peripheren Nerven der Ratte viel näher an ihren Endorganen liegen und viel kleinere Querschnittsbereiche aufweisen als die homologen menschlichen Strukturen. Dieser Größenunterschied garantiert jedoch schnellere experimentelle Daten bei Nagetieren, und bessere Gesamtergebnisse bei Ratten im Vergleich zum Menschen sind zu erwarten68. Tatsächlich warnen mehrere Autoren, dass beim Versuch, experimentelle Daten, die bei der peripheren Nervenreparatur mit Nagetieren erhalten wurden, auf Menschen extrapolieren muss, Vorsicht walten muss7,69. Primatenmodelle gelten als vergleichbarer70. Dennoch ist ihre Verwendung mit ärgerlichen ethischen, logistischen und Budgetzwängen verbunden71.
Obwohl der Ischiasnerv der am häufigsten verwendete Nerv in der peripheren Nervenforschung ist, bietet die Ratte MN mehrere Vorteile. Beispielsweise sind MN-Läsionen mit einer geringeren Inzidenz von Gelenkkontrakturen und Automutilierung der betroffenen Pfote11,12,16,56verbunden. Bezeichnenderweise betrifft die Autotomie nach der ischiasischen Nerventransektion 11–70% der Ratten. Dies kann aktuelle Auswertungen wie den Ischiasindex unmöglich machen14. Dies wiederum macht die Schätzung der Anzahl der Tiere, die erforderlich sind, um eine bestimmte statistische Leistung zu erhalten, umständlich15.
Da der MN kürzer als der Ischiasnerv ist, wird die Nervenerholung früher beobachtet58,72,73,74,75,76. Darüber hinaus ist das MN nicht von Muskelmassen bedeckt, was seine Zerlegung technisch einfacher macht als die des Ischiasnervs16. Zusätzlich hat der MN einen parallelen Pfad zum Ulnarnerv im Arm. Daher kann der Ulnarnerv leicht als Nerventransplantat zur Reparatur von MN-Verletzungen verwendet werden. Schließlich treten beim Menschen die meisten peripheren Nervenläsionen in der oberen Extremität auf, was die Verwendung dieses Nervs bei der Ratte77,78weiter unterstützt.
Vermutlich sind Nagetiere die Versuchstiere, die am häufigsten im Bereich der peripheren Nervenreparatur48,79verwendet werden. Wie gezeigt, ist die Ratte MN ein praktisches Modell der peripheren Nervenläsion und Reparatur. Tatsächlich gibt es mehrere standardisierte Strategien zur Beurteilung der motorischen und sensorischen Erholung, was einen einfacheren Vergleich der Ergebnisse36,46,60,80,81,82ermöglicht. Viele dieser Methoden sind nicht invasiv und ermöglichen eine tägliche Bewertung.
Darüber hinaus gehört die Physiotherapie zum Standard der Versorgung von Patienten, die sich von peripheren Nervenverletzungen erholen. Wie in diesem Papier gezeigt, gibt es mehrere Strategien, um eine postoperative4physiotherapieähnliche Umgebung für Ratten zu bieten, die MN-Verletzungen 4,5. Daher ist dieses Modell besonders geeignet, um das klinische Szenario zu replizieren, was die Extrapolation der Ergebnisse auf die menschliche Spezies12,27,48,56,58,83erleichtert.
Wie in diesem Artikel gezeigt, stehen mehrere standardisierte Strategien zur Verfügung, um die motorische und sensorische Rückgewinnung im MN-Modell der Ratte zu bewerten. Die meisten davon sind nichtinvasive Verfahren, die eine häufige Bewertung ermöglichen. Da die meisten peripheren Nervenläsionen bei den menschlichen Spezies in der oberen Extremität auftreten, können die erwähnten experimentellen Physiotherapie-Einstellungen die Genesung im klinischen Kontext treffender nachahmen. Vermutlich kann dies die Extrapolation der Ergebnisse auf die menschliche Spezies erleichtern und die Verwendung dieses Nervs bei der Ratte weiter validieren.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diogo Casal erhielt ein Stipendium des Programms für medizinische Weiterbildung, das von Fundaéo Calouste Gulbenkian, Fundaéo Champalimaud, Ministério da Saéde e Fundaéo para a Ciéncia e Tecnologia, Portugal, gesponsert wird. Die Autoren sind Herrn Filipe Franco sehr dankbar für die anschauliche Zeichnung in Abbildung 1. Die Autoren danken der technischen Hilfe von Herrn Alberto Severino bei der Dreh- und Bearbeitung des Videos. Abschließend möchten die Autoren Frau Sara Marques für ihre Hilfe in allen logistischen Aspekten des Tiererwerbs und der Tierpflege danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetaminophen | Amazon | https://www.amazon.com/Childrens-Tylenol-grape-flavor-ages/dp/B0051VVVZG | |
| Acland clamps | Fine Science Tools | 00398 V | http://www.merciansurgical.com/aclandclamps.pdf |
| Acland Single Clamps B-1V (Pair) | Fine Science Tools | 396 | http://www.merciansurgical.com |
| Biogel Surgical Gloves | Medex Supply | 30465 | https://www.medexsupply.com |
| BSL Analysis | BIOPAC Systems | https://www.biopac.com/ | |
| Castroviejo needle holders | Fine Science Tools | 12565-14 | http://s-and-t.ne |
| Clamp applicator | Fine Science Tools | CAF-4 | http://www.merciansurgical.com/acland-clamps.pdf |
| Constante voltage stimulator | BIOPAC Systems | STM200 | https://www.biopac.com/product/constant-voltage-stimulator-unipolar-pulse/ |
| Cutasept skin disinfectant | Bode Chemie | http://www.productcatalogue.bode-chemie.com/products/skin/cutasept_f.php | |
| Dafilon 10-0 | G1118099 | http://www.bbraun.com/cps/rde/xchg/bbraun-com/hs.xsl/products.html?prid=PRID00000816 | |
| Derf Needle Holders 12 cm TC | Fine Science Tools | 703DE12 | http://www.merciansurgical.com |
| Dry heat sterilizer | Quirumed | 2432 | http://www.quirumed.com/pt/material-de-esterilizac-o/esterilizadores |
| Dynamometer | SAUTER | FH5 | https://www.sauter.eu/shop/en/measuring-instruments/force-measurement/FH-S/ |
| Electroneuromiography setup | BIOPAC Systems | MP36 | https://www.biopac.com/product/biopac-student-lab-basic-systems/ |
| Ethilon 5-0 | W1618 | http://www.farlamedical.co.uk/ | |
| FLIR Software | FLIR | ||
| Graeffe forceps 0.8 mm tips curved | Fine Science Tools | 11052-10 | http://www.finescience.de |
| Graph paper | Ambar | ||
| Heat Lamp HL-1 | Harvard Apparatus | 727562 | https://www.harvardapparatus.com/webapp/wcs/stores/servlet/haisku3_10001_11051_39108_-1_HAI_ProductDetail_N_37610_37611_37613 |
| Heparin Sodium Solution (Heparin LEO 10000IU/ml) | Universal Drugstore | http://www.universaldrugstore.com/medications/Heparin+LEO/10000IU%2Fml | |
| High-Temperature Cautery | Fine Science Tools | AA03 | http://www.boviemedical.com/products_aaroncauteries_high.asp |
| Homeothermic Blanket System with Flexible Probe | Harvard Apparatus | 507220F | https://www.harvardapparatus.com/webapp/wcs/stores/servlet/haisku3_10001_11051_39108_-1_HAI_ProductDetail_N_37610_37611_37613 |
| Infrared camera | FLIR | E6 | http://www.flir.eu/instruments/e6-wifi/ |
| Instrapac - Adson Toothed Forceps (Extra Fine) | Fine Science Tools | 7973 | http://www.millermedicalsupplies.com |
| Iris Scissors 11.5 cm Curves EASY-CUT | Fine Science Tools | EA7613-11 | http://www.merciansurgical.com |
| Ketamine hydrochloride/xylazine hydrochloride solution | Sigma- Aldrich | K113 | https://www.sigmaaldrich.com/catalog/product/sigma/k113?lang=pt®ion=PT |
| Lacri-lube Eye Ointment 5g | Express Chemist | LAC101F | http://www.expresschemist.co.uk/lacri-lube-eye-ointment-5g.html |
| Mayo Scissors 14 cm Straight Chamfered Blades EASY-CUT | Fine Science Tools | EA7652-14 | http://www.merciansurgical.com |
| Meloxicam | Recropharma | Mobic | https://www.recropharma.com/product-pipeline/meloxicam |
| Methylene Blue solution | Sigma- Aldrich | https://www.sigmaaldrich.com/catalog/product | |
| Micro Jewellers Forceps 11 cm straight 00108 | Fine Science Tools | JF-5 | http://www.merciansurgical.com |
| Micro Jewellers Forceps 11cm angulated 00109 | Fine Science Tools | JFA-5b | http://www.merciansurgical.com |
| Micro retractor | Fine Science Tools | RS-6540 | http://www.finescience.de |
| Micro Scissors Round Handles 15 cm Straight | Fine Science Tools | 67 | http://www.merciansurgical.com |
| Micro-vessel dilators 11 cm 0.3 mm tips 00124 | Fine Science Tools | D-5a.2 | http://www.merciansurgical.com |
| Monosyn 5-0 | 15423BR | http://www.mcfarlanemedical.com.au/15423BR/SUTURE-MONOSYN-5_or_0-16MM-70CM-(C0023423)-BOX_or_36/pd.php | |
| Normal saline for irrigation | Hospira, Inc. | 0409-6138-22 | http://www.hospira.com/en/search?q=sodium+chloride+irrigation%2C+usp&fq=contentType%3AProducts |
| Operating microscope | Leica Surgical Microsystems | http://www.leica-microsystems.com/products/surgical-microscopes/ | |
| Skin Skribe Surgical Skin Marker | Moore Medical | 31456 | https://www.mooremedical.com/index.cfm?/Skin-Skribe-Surgical-Skin-Marker/&PG=CTL&CS=HOM&FN=ProductDetail&PID=1740&spx=1 |
| Snacks | Versele-Laga | Complete Crock-Berry | http://www.versele-laga.com/en/complete/products/complete-crock-berry |
| Straight mosquito forcep | Fine Science Tools | 91308-12 | http://www.finescience.de |
| Surgical drapes | Barrier | 800430 | http://www.molnlycke.com/surgical-drapes/ |
| Veet Sensitive Skin Hair Removal Cream Aloe Vera and Vitamin E 100 ml | Veet | http://www.veet.co.uk/products/creams/creams/veet-hair-removal-cream-sensitive-skin/ |
Referenzen
- Lad, S. P., Nathan, J. K., Schubert, R. D., Boakye, M. Trends in median, ulnar, radial, and brachioplexus nerve injuries in the United States. Neurosurgery. 66 (5), 953-960 (2010).
- Murovic, J. A. Upper-extremity peripheral nerve injuries: a Louisiana State University Health Sciences Center literature review with comparison of the operative outcomes of 1837 Louisiana State University Health Sciences Center median, radial, and ulnar nerve lesions. Neurosurgery. 65 (4), 11-17 (2009).
- Dy, C. J., Isaacs, J., Dy, C. J., Isaacs, J. . American Society for Surgery of the Hand surgical anatomy: nerve reconstruction Vol. 1. , (2017).
- Trehan, S. K., Model, Z., Lee, S. K. Nerve Repair and Nerve Grafting. Hand Clinics. 32 (2), 119-125 (2016).
- Boyd, K. U., Fox, I. K., Mackinnon, S. E. . Nerve surgery Vol. 1. , 75-100 (2015).
- Geuna, S., et al. Update on nerve repair by biological tubulization. Journal of Brachial Plexius Peripheral Nerve Injury. 9 (1), 3 (2014).
- Sulaiman, W., Gordon, T. Neurobiology of peripheral nerve injury, regeneration, and functional recovery: from bench top research to bedside application. Ochsner Journal. 13 (1), 100-108 (2013).
- Angelica-Almeida, M., et al. Brachial plexus morphology and vascular supply in the wistar rat. Acta Medica Portuguesa. 26 (3), 243-250 (2013).
- Bertelli, J. A., Taleb, M., Saadi, A., Mira, J. C., Pecot-Dechavassine, M. The rat brachial plexus and its terminal branches: an experimental model for the study of peripheral nerve regeneration. Microsurgery. 16 (2), 77-85 (1995).
- Casal, D., et al. Reconstruction of a 10-mm-long median nerve gap in an ischemic environment using autologous conduits with different patterns of blood supply: A comparative study in the rat. PLoS One. 13 (4), 0195692 (2018).
- Stößel, M., Rehra, L., Haastert-Talini, K. Reflex-based grasping, skilled forelimb reaching, and electrodiagnostic evaluation for comprehensive analysis of functional recovery-The 7-mm rat median nerve gap repair model revisited. Brain and Behavior. 7 (10), 00813 (2017).
- Manoli, T., et al. Correlation analysis of histomorphometry and motor neurography in the median nerve rat model. Eplasty. 14, 17 (2014).
- Ronchi, G., et al. The Median Nerve Injury Model in Pre-clinical Research - A Critical Review on Benefits and Limitations. Frontiers in Cellular Neuroscience. 13, 288 (2019).
- Weber, R. A., Proctor, W. H., Warner, M. R., Verheyden, C. N. Autotomy and the sciatic functional index. Microsurgery. 14 (5), 323-327 (1993).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. Journal of Pharmacology & Pharmacotherapeutics. 4 (4), 303-306 (2013).
- Bertelli, J. A., Mira, J. C. The grasping test: a simple behavioral method for objective quantitative assessment of peripheral nerve regeneration in the rat. Journal of Neuroscience Methods. 58 (1-2), 151-155 (1995).
- Casal, D., et al. A Model of Free Tissue Transfer: The Rat Epigastric Free Flap. Journal of Visualized Experiments. (119), e55281 (2017).
- Bertens, A. P. M. G., Van Zuthphen, L. F., Baumas, V., Beymen, A. C. Anaesthesia, analgesia and euthanasia. Principles of Laboratory Animal Science. , 277-311 (2001).
- Pritchett-Corning, K. R., Luo, Y., Mulder, G. B., White, W. J. Principles of rodent surgery for the new surgeon. Journal of Visualized Experiments. (47), e2586 (2011).
- Lee-Parritz, D. Analgesia for rodent experimental surgery. Israel Journal of Veterinary Medicine. 62 (3), 74 (2007).
- Roughan, J. V., Flecknell, P. A. Evaluation of a short duration behaviour-based post-operative pain scoring system in rats. European Journal of Pain. 7 (5), 397-406 (2003).
- Bauder, A. R., Ferguson, T. A. Reproducible mouse sciatic nerve crush and subsequent assessment of regeneration by whole mount muscle analysis. Journal of Visualized Experiments. (60), e3606 (2012).
- Ronchi, G., et al. Functional and morphological assessment of a standardized crush injury of the rat median nerve. Journal of Neuroscience Methods. 179 (1), 51-57 (2009).
- Matsumine, H., et al. Vascularized versus nonvascularized island median nerve grafts in the facial nerve regeneration and functional recovery of rats for facial nerve reconstruction study. Journal of Reconstructive Microsurgery. 30 (2), 127-136 (2014).
- Mickley, A. G., Hoxha, Z., Biada, J. M., Kenmuir, C. L., Bacik, S. E. Acetaminophen Self-administered in the Drinking Water Increases the Pain Threshold of Rats (Rattus norvegicus). Journal of the American Association for Laboratory Animal Science. 45 (5), 48-54 (2006).
- Mandillo, S., et al. Reliability, robustness, and reproducibility in mouse behavioral phenotyping: a cross-laboratory study. Physiological Genomics. 34 (3), 243-255 (2008).
- Papalia, I., Tos, P., Stagno d'Alcontres, F., Battiston, B., Geuna, S. On the use of the grasping test in the rat median nerve model: a re-appraisal of its efficacy for quantitative assessment of motor function recovery. Journal of Neuroscience Methods. 127 (1), 43-47 (2003).
- Costa, L. M., Simoes, M. J., Mauricio, A. C., Varejao, A. S. Chapter 7: Methods and protocols in peripheral nerve regeneration experimental research: part IV-kinematic gait analysis to quantify peripheral nerve regeneration in the rat. International Reviews in Neurobiology. 87, 127-139 (2009).
- Geuna, S., Varejao, A. S. Evaluation methods in the assessment of peripheral nerve regeneration. Journal of Neurosurgery. 109 (2), 360-362 (2008).
- Howard, R. F., Hatch, D. J., Cole, T. J., Fitzgerald, M. Inflammatory pain and hypersensitivity are selectively reversed by epidural bupivacaine and are developmentally regulated. Anesthesiology. 95 (2), 421-427 (2001).
- Metz, G. A., Whishaw, I. Q. Cortical and subcortical lesions impair skilled walking in the ladder rung walking test: a new task to evaluate fore- and hindlimb stepping, placing, and co-ordination. Journal of Neuroscience Methods. 115 (2), 169-179 (2002).
- Thallmair, M., et al. Neurite growth inhibitors restrict plasticity and functional recovery following corticospinal tract lesions. Nature Neuroscience. 1 (2), 124-131 (1998).
- Brown, C. J., et al. Self-evaluation of walking-track measurement using a Sciatic Function Index. Microsurgery. 10 (3), 226-235 (1989).
- Hruska, R. E., Kennedy, S., Silbergeld, E. K. Quantitative aspects of normal locomotion in rats. Life Science. 25 (2), 171-179 (1979).
- Ferreira, T., Rasband, W. ImageJ user guide. ImageJ/Fiji. 1, 155-161 (2012).
- Dijkstra, J. R., Meek, M. F., Robinson, P. H., Gramsbergen, A. Methods to evaluate functional nerve recovery in adult rats: walking track analysis, video analysis and the withdrawal reflex. Journal of Neuroscience Methods. 96 (2), 89-96 (2000).
- Ludwig, N., Formenti, D., Gargano, M., Alberti, G. Skin temperature evaluation by infrared thermography: Comparison of image analysis methods. Infrared Physics & Technology. 62, 1-6 (2014).
- Bennett, G. J., Ochoa, J. L. Thermographic observations on rats with experimental neuropathic pain. Pain. 45 (1), 61-67 (1991).
- Wakisaka, S., Kajander, K. C., Bennett, G. J. Abnormal skin temperature and abnormal sympathetic vasomotor innervation in an experimental painful peripheral neuropathy. Pain. 46 (3), 299-313 (1991).
- Muntean, M. V., et al. Using dynamic infrared thermography to optimize color Doppler ultrasound mapping of cutaneous perforators. Medical Ultrasonography. 17 (4), 503-508 (2015).
- Shterenshis, M. Challenges to Global Implementation of Infrared Thermography Technology: Current Perspective. Central Asian Journal of Global Health. 6 (1), 289 (2017).
- Wilbourn, A. J., Mackinnon, S. E. . Nerve surgery Vol. 1. , 59-74 (2015).
- Wu, Y., Martínez, M. &. #. 1. 9. 3. ;. M., Balaguer, P. O., Turker, H. . Electrodiagnosis in New Frontiers of Clinical Research. , (2013).
- Werdin, F., et al. An improved electrophysiological method to study peripheral nerve regeneration in rats. Journal of Neuroscience Methods. 182 (1), 71-77 (2009).
- Sedghamiz, H., Santonocito, D. Unsupervised Detection and Classification of Motor Unit Action Potentials in Intramuscular Electromyography Signals. 2015 E-health and Bioengineering Conference IEEE. , 1-6 (2015).
- Hadlock, T. A., Koka, R., Vacanti, J. P., Cheney, M. L. A comparison of assessments of functional recovery in the rat. Journal of the Peripheral Nervous System. 4 (3-4), 258-264 (1999).
- Carstens, E., Moberg, G. P. Recognizing pain and distress in laboratory animals. Ilar Journal. 41 (2), 62-71 (2000).
- Tos, P., et al. Chapter 4: Methods and protocols in peripheral nerve regeneration experimental research: part I-experimental models. International Reviews in Neurobiology. 87, 47-79 (2009).
- Galtrey, C. M., Fawcett, J. W. Characterization of tests of functional recovery after median and ulnar nerve injury and repair in the rat forelimb. Journal of the Peripheral Nervous System. 12 (1), 11-27 (2007).
- Giusti, G., et al. Return of motor function after segmental nerve loss in a rat model: comparison of autogenous nerve graft, collagen conduit, and processed allograft (AxoGen). Journal of Bone and Joint Surgery American. 94 (5), 410-417 (2012).
- Stossel, M., Rehra, L., Haastert-Talini, K. Reflex-based grasping, skilled forelimb reaching, and electrodiagnostic evaluation for comprehensive analysis of functional recovery-The 7-mm rat median nerve gap repair model revisited. Brain and Behavior. 7 (10), 00813 (2017).
- Nikkhah, G., Rosenthal, C., Hedrich, H. J., Samii, M. Differences in acquisition and full performance in skilled forelimb use as measured by the 'staircase test' in five rat strains. Behavioral Brain Research. 92 (1), 85-95 (1998).
- Whishaw, I. Q., Gorny, B., Foroud, A., Kleim, J. A. Long-Evans and Sprague-Dawley rats have similar skilled reaching success and limb representations in motor cortex but different movements: some cautionary insights into the selection of rat strains for neurobiological motor research. Behavioral Brain Research. 145 (1-2), 221-232 (2003).
- Navarro, X. Functional evaluation of peripheral nerve regeneration and target reinnervation in animal models: a critical overview. European Journal of Neuroscience. 43 (3), 271-286 (2016).
- Costa, L. M., Simões, M. J., Maurício, A. C., Varejão, A. S. P. . International Review of Neurobiology. 87, 127-139 (2009).
- Ronchi, G., et al. Functional and morphological assessment of a standardized crush injury of the rat median nerve. Journal of Neuroscience Methods. 179 (1), 51-57 (2009).
- Raimondo, S., et al. Chapter 5: Methods and protocols in peripheral nerve regeneration experimental research: part II-morphological techniques. International Reviews in Neurobiology. 87, 81-103 (2009).
- Bontioti, E. K. M., Dahlin, L. B. Regeneration and functional recovery in the upper extermity of rats after various types of nerve injuries. Journal of the Peripheral Nervous System. 8, 159-168 (2003).
- Schönfeld, L. M., Dooley, D., Jahanshahi, A., Temel, Y., Hendrix, S. Evaluating rodent motor functions: Which tests to choose. Neuroscience & Biobehavioral Reviews. 83, 298-312 (2017).
- Urbancheck, M. S. Rat walking tracks do not reflect maximal muscle force capacity. Journal of Reconstructive Microsurgery. 15 (2), 143-149 (1999).
- Cudlip, S. A., Howe, F. A., Griffiths, J. R., Bell, B. A. Magnetic resonance neurography of peripheral nerve following experimental crush injury, and correlation with functional deficit. Journal of Neurosurgery. 96 (4), 755-759 (2002).
- Wang, Y., Sunitha, M., Chung, K. C. How to measure outcomes of peripheral nerve surgery. Hand Clinics. 29 (3), 349-361 (2013).
- Wang, H., Spinner, R. J., Sorenson, E. J., Windebank, A. J. Measurement of forelimb function by digital video motion analysis in rat nerve transection models. Journal of the Peripheral Nervous System. 13 (1), 92-102 (2008).
- Yanase, Y., Tamai, S., Usui, M., Yoshizu, T. . Experimental and Clinical Reconstructive Microsurgery. , 44-51 (2004).
- Barton, M. J., et al. Morphological and morphometric analysis of the distal branches of the rat brachial plexus. Italian Journal of Anatomy and Embryology. 121 (3), 240-252 (2016).
- Vincent, R., Slutsky, D. J., Hentz, V. R. Adult and obstetrical brachial plexus injuries. Peripheral Nerve Surgery: Practical applications in the upper extremity. , 299-317 (2006).
- Dahlin, L. B., Slutsky, D. J., Hentz, V. R. . Peripheral Nerve Surgery: Practical Applications in the Upper Extremity. , 1-22 (2006).
- Vargel, I., et al. A comparison of various vascularization-perfusion venous nerve grafts with conventional nerve grafts in rats. Journal of Reconstructive Microsurgery. 25 (7), 425-437 (2009).
- Grinsell, D., Keating, C. Peripheral nerve reconstruction after injury: a review of clinical and experimental therapies. BioMed Research International. 2014, 698256 (2014).
- Wang, D., et al. A simple model of radial nerve injury in the rhesus monkey to evaluate peripheral nerve repair. Neural Regeneration Research. 9 (10), 1041-1046 (2014).
- Casal, D., et al. Unconventional Perfusion Flaps in the Experimental Setting: A Systematic Review and Meta-Analysis. Plastic Reconstructive Surgery. 143 (5), 1003-1016 (2019).
- Bontioti, E. . End-to-side nerve repair. A study in the forelimb of the rat. , (2005).
- Bodine-Fowler, S. C., Meyer, R. S., Moskovitz, A., Abrams, R., Botte, M. J. Inaccurate projection of rat soleus motoneurons: a comparison of nerve repair techniques. Muscle Nerve. 20 (1), 29-37 (1997).
- Valero-Cabre, A., Navarro, X. H reflex restitution and facilitation after different types of peripheral nerve injury and repair. Brain Research. 919 (2), 302-312 (2001).
- Wall, P. D., et al. Autotomy following peripheral nerve lesions: experimental anaesthesia dolorosa. Pain. 7 (2), 103-111 (1979).
- Bertelli, J. A., Taleb, M., Saadi, A., Mira, J. C., Pecot-Dechavassine, M. The rat brachial plexus and its terminal branches: an experimental model for the study of peripheral nerve regeneration. Microsurgery. 16, 77-85 (1995).
- Wood, M. J., Johnson, P. J., Myckatyn, T. M., Mackinnon, S. E., Yee, A. . Nerve Surgery Vol. 1. , 1-40 (2015).
- Rosberg, H. E. Epidemiology of hand injuries in a middle-sized city in southern Sweden - a retrospective study with an 8-year interval. Scandinavian Journal of Plastic and Reconstructive Surgery and Hand Surgery. 38, 347-355 (2004).
- Gordon, T., Borschel, G. H. The use of the rat as a model for studying peripheral nerve regeneration and sprouting after complete and partial nerve injuries. Experimental Neurology. 287, 331-347 (2017).
- Bertelli, J. A., Ghizoni, M. F. Concepts of nerve regeneration and repair applied to brachial plexus reconstruction. Microsurgery. 26 (4), 230-244 (2006).
- Bertelli, J. A., Mira, J. C. Behavioural evaluating methods in the objective clinical assessment of motor function after experimental brachial plexus reconstruction in the rat. Journal of Neuroscience Methods. 46, 203-208 (1993).
- Bertelli, J. A., Mira, J. C. The grasping test: a simple behavioral method for objective quantitative assessment of peripherla nerve regeneration in the rat. Journal of Neuroscience Methods. 58 (1-2), 151-155 (1995).
- Ronchi, G., et al. Standardized crush injury of the mouse median nerve. Journal of Neuroscience Methods. 188 (1), 71-75 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten