Method Article
Isolation und Kultur der menschlichen Reife Adipozyten mit Membran Reife Adipozyten Aggregatkulturen (MAAC)
In diesem Artikel
Zusammenfassung
Membran reife Adipozyten-Aggregatkultur (MAAC) ist eine neue Methode, um reife menschliche Adipozyten zu kultitonischen. Hier erfahren Sie, wie Adipozyten von menschlichen Fetten isoliert werden und wie MAN MAAC aufstellt.
Zusammenfassung
Die Dysregulation von Weißfettgewebe (WAT) spielt eine zentrale Rolle bei der Entwicklung von Insulinresistenz und Typ-2-Diabetes (T2D). Um neue Behandlungen für T2D zu entwickeln, sind physiologischere In-vitro-Adipozytenmodelle erforderlich. Diese Studie beschreibt eine neue Technik, um reife menschliche Adipozyten zu isolieren und zu kultiieren. Diese Methode trägt den Titel MAAC (membrane mature adipocyte aggregate culture), und im Vergleich zu anderen Adipozyten-In-vitro-Modellen besitzt MAAC eine adipogene Gensignatur, die frisch isolierten reifen Adipozyten am nächsten ist. Mit MAAC können Adipozyten von schlanken und adipösen Patienten kultiviert werden, verschiedene Fettdepots, mit verschiedenen Zelltypen kokultiviert und vor allem 2 Wochen lang in Kultur gehalten werden. Funktionelle Experimente können auch an MAAC durchgeführt werden, einschließlich Glukoseaufnahme, Lipogenese und Lipolyse. Darüber hinaus reagiert MAAC robust auf verschiedene pharmakologische Agonismus und kann verwendet werden, um adipozyten phänotypic Veränderungen zu untersuchen, einschließlich der Transdifferenzierung von weißen Adipozyten in braune Fettzellen.
Einleitung
Die weltweite Zunahme von Adipositas und Adipositas-bedingten Komorbiditäten erfordert die Entwicklung neuer Therapeutika. Weißes Fettgewebe (WAT) ist ein wichtiger Regulator des Ganzkörperstoffwechsels, der Energiehomöostase, und ist ein zentraler Akteur bei der Entwicklung von Insulinresistenz und Typ-2-Diabetes (T2D)1,2. Bei chronischem Überschuss an Kalorien vergrößern sich die Adipozyten, um den Energieüberschuss zu bewältigen. Jedoch, Adipozyten Lipid Speicherkapazität kann überschritten werden, was zu einer Erhöhung der zirkulierenden Niveaus von Fettsäuren und erhöhte Lagerung in peripheren nicht-fettigen Geweben und führt zu Lipotoxizität3,4.
Der Mangel an Adipozyten-In-vitro-Modellen mit hoher translationaler Relevanz ist eine zentrale Herausforderung bei der Entwicklung neuer Behandlungsmethoden für Adipositas und T2D. Das Ex-vivo-Explantationsmodell, bei dem kleine Fettgewebestücke kultiviert werden, ist mit schnellen Veränderungen der adipogenen Genexpression verbunden, die durch Hypoxie und Entzündung enthoniert wird5,6. Deckenkulturen (CCs), in denen reife Adipozyten schweben und an der Spitze von mediengefüllten Kolben haften, dedifferenzieren sich schnell in fibroblastenähnliche Zellen ohne Lipid7,8,9,10. Das am häufigsten verwendete Modell sind Adipozyten, die in vitro von engagierten Vorläufern unterschieden werden. Die differenzierten Zellen unterscheiden sich jedoch morphologisch von reifen Adipozyten in vivo, da sie viel kleiner sind und kein unilokulares Lipidtröpfchen haben. Weitere Einschränkungen bei diesem Modell sind die unphysiologische Notwendigkeit eines chemischen Cocktails zur Differenzierung sowie die Variabilität der Differenzierungseffizienz, die durch eine Reihe von Faktoren beeinflusst werden kann11,12,13,14.
Wir haben vor kurzem Membran reife Adipozyten-Aggregatkultur (MAAC) entwickelt, eine Methode für die langfristige Kultur von frisch isolierten reifen Adipozyten, wo Adipozyten unter durchlässigen Membranen kultiviert werden10. Die unvoreingenommene Analyse von RNA-Sequenzierungsdaten hat gezeigt, dass MAAC im Vergleich zu Fettgewebeexaten und in vitro-differenzierten Adipozyten am ehesten frisch isolierten Adipozyten ähnelt. MAAC kann verwendet werden, um reife Adipozyten zu kultivieren, die sowohl aus subkutanem als auch aus viszeralem Fettgewebe isoliert sind, sowie Adipozyten von adipösen und schlanken Probanden. Diese Methode ermöglicht die Untersuchung von langfristigen adipozyten phänotypischen Veränderungen und erleichtert die Kokultur von Adipozyten mit anderen Zelltypen. Hier stellen wir ein detailliertes Protokoll zur Isolierung von reifen Adipozyten aus menschlichem Fettgewebe und zum Aufbau des MAAC-Systems zur Verfügung.
Protokoll
Anonyme Proben von Fettgewebe wurden aus der Bauchregion weiblicher Patienten entnommen, die sich einer Elektive-Operation im Universitätskrankenhaus Sahlgrenska in Göteborg, Schweden, unterziehen. Alle Studienteilnehmer erhielten schriftliche und mündliche Informationen, bevor sie schriftlich ihre Einwilligung zur Verwendung des Gewebes erteilten. Die Studien wurden vom Regional Ethical Review Board in Göteborg, Schweden, genehmigt.
ANMERKUNG: Eine Übersicht über die Methode finden Sie in Abbildung 1.
1. Vorbereitung von Puffern, Tissue Culture Media und Kulturplatten
- Bereiten Sie einen 5x Krebbs Ringer (KR) Vorrat vor, indem Sie 35,1 g NaCl, 1,75 g KCl, 0,82 g KH2PO4und 1,48 g MgSO47H2O in 900 ml Wasser auflösen. Fügen Sie 1,84 g CaCl2,2H2O hinzu und stellen Sie die Lautstärke auf 1 L ein, indem Sie Wasser hinzufügen. Sterilfilter durch einen 0,22-mm-Filter und bei 4 °C lagern.
- Aus dem 5x KR-Bestand 1 L Puffer mit 1x KR, 25 mM HEPES, 2 mM Glukose und 2% Rinderserumalbumin (BSA) (nachfolgend als Waschpuffer bezeichnet) zubereiten. Stellen Sie den pH-Wert auf 7,4 ein.
- Bereiten Sie 500 ml Kollagenasepuffer vor, der 1x HBSS + CaCl2 + MgCl2, 2% BSA und 450 ml Wasser enthält (nachfolgend als Verdauungspuffer bezeichnet).
HINWEIS: Die Kollagenase sollte dem Verdauungspuffer erst nach dem Wiegen des Fettgewebes in Schritt 2.2 zugesetzt werden. - Stellen Sie den pH-Wert von Medium 199 auf 7.4 ein.
- Sterilfilter sowohl Puffer als auch mittlere 199 durch einen 0,22 m Filterkolben und warm auf 37 °C.
HINWEIS: Um Zeit zu sparen, können die Gewebekulturmedien vorbereitet und platten hinzugefügt werden, bevor das Fettgewebe verarbeitet wird. Für ein 24-Well-Plattenformat (Abbildung 1A) verwenden Sie 0,5 x 1 ml/Gut von Dulbeccos modifiziertem Eagle-Medium/Schinken-Nährstoffgemisch F12 (DMEM/F12), 10% fetalem Rinderserum (FBS), 1% Penicillin-Streptomycin (Penn/Strepmycin) und 20 nM Insulin. Kleine Moleküle und andere stabile pharmakologische Wirkstoffe können zu diesem Zeitpunkt auch den Medien im gewünschten Layout zugesetzt werden. Legen Sie die Platten in einen Gewebekultur-Inkubator (37 °C, 5%CO2).
2. Zerlegung des subkutanen Adipäsösen Fettgewebes
HINWEIS: Arbeiten Sie in einem biologischen Sicherheitsschrank und verwenden Sie sterile Technik während des gesamten Isolationsprozesses sowie die ausschließliche Verwendung von autoklavierten und sterilen Geräten.
- Legen Sie das menschliche Fettgewebe in eine 15 cm Petrischale und fügen Sie ein kleines Volumen von medium 199 hinzu, um es während der Zerlegung mit Feuchtigkeit zu befeuchten.
- Arbeiten Mit Fettstücken ungefähr so groß wie ein Golfball, greifen Sie große fibrotische Gefäße mit Pinzette und lösen Sie sanft die Adipozyten, indem Sie den Fett mit dem Rücken der geschlossenen Schere kratzen. Entsorgen Sie die großen Stücke von fibrotischem Gewebe. Wiegen Sie das getrimmte Fett.
3. Collagenase Behandlung
- Fügen Sie Kollagennase in den Verdauungspuffer (siehe Schritt 1.3) mit einer Konzentration von 1 mg/ml hinzu. Steriler Filter der Lösung mit einem 0,22 m sterilen Filter.
HINWEIS: Es wird empfohlen, drei ml Verdauungspuffer pro Gramm Fett zu verwenden (d. h. für 100 g Fett 300 ml Verdauungspuffer mit 300 mg Typ-2-Kollagenase vorbereiten).
VORSICHT: Typ 2 Kollagenase ist gefährlich für Augen, Haut und kann Atemwegsreizungen verursachen. Tragen Sie Handschuhe, Augenschutz und arbeiten Sie in einer belüfteten Kapuze, wenn Sie mit der Kollagenase umgehen. - Bewegen Sie ca. 10 g Fettgewebe in eine 15 cm Petrischale und zerkleinern Sie das Fett vorsichtig mit einer gekrümmten Schere, bis es zu einer glatten homogenen Mischung wird und keine großen Fettstücke mehr vorhanden sind. Wiederholen Sie den Vorgang, bis das gesamte Fett verarbeitet ist.
HINWEIS: Jede Runde sollte ca. 2 min dauern und die Fettstücke sollten klein genug sein, damit sie mit einer Breitbohrpipettenspitze pipettiert werden können. Dieser Schritt ist entscheidend, um qualitativ hochwertige Adipozyten hervorzubringen. Wenn die Stücke zu groß sind, müssen die Verdauungszeiten verlängert werden, wodurch die Zellüberbeinen beeinträchtigt werden. - Das gehackte Fett mit einem Löffel in 50 ml konische Schläuche geben. Fügen Sie 10 ml Hackfleisch und 30 ml Verdauungspuffer in jedes Rohr. Skalieren Sie auf geeignete Mengen, wenn weniger als 10 ml gehacktes Fett verfügbar ist.
- Verdauen Sie das Gewebe bei 37 °C in einem Schüttelinkubator mit konstanter Rührung bei 150 Umdrehungen pro Minute für 30 bis 45 min. Nach 30 min, überprüfen Sie den Prozess alle 5 min, um eine Überverdauung zu vermeiden.
HINWEIS: Die Verdauung ist abgeschlossen, wenn die Fettlösung homogen ist, ohne große Stücke und hat eine Aprikosenfarbe.
4. Filtration der Zellsuspension und Reinigung der reifen Adipozyten
- Legen Sie einen Trichter auf einen 1 L sterilen Kolben und legen Sie einen sterilen 250 m Netzfilter in den Trichter. Gießen Sie die verdaute Fettlösung in den Filter, um das unverdaute Gewebe zu entfernen.
- Wenn die gesamte Adipozytensuspension durch den Filter gegangen ist, drücken Sie vorsichtig den Netzfilter, um die Ausbeute von Adipozyten zu erhöhen. Gießen Sie ca. 50 x 100 ml Waschpuffer in den Filter, um ihn zu spülen und den Filter erneut zu drücken.
- Die isolierte Adipozytensuspension aus dem Kolben in einen Trenntrichter gießen und Waschpuffer hinzufügen, bis der Trichter fast vollständig gefüllt ist. Um den Trichter ein paar Mal vorsichtig umzukehren, um die Adipozytensuspension mit dem Puffer zu mischen.
- Lassen Sie die Suspension für 2 x 3 min stehen, bis es eine deutliche Trennung von 2 Schichten (Abbildung 1B), mit einer oberen gelben Schicht enthält die reifen Adipozyten und freie Lipid und eine untere Schicht enthält den Puffer und die Fettstroma Gefäßfraktion (SVF).
- Öffnen Sie die Düse am Trenntrichter und heben Sie die Bodenlösung langsam in einen sterilen Kolben (Zellen aus dem SVF können nach zentrifugieren bei 200 x g für 7 min pelletiert und gesammelt werden). Bewahren Sie die obere Schicht mit den reifen Adipozyten im Trenntrichter auf.
- Wiederholen Sie den Waschvorgang in den Schritten 4.3 x 4.5 dreimal, um die reifen Adipozyten gründlich zu waschen und die gesamte Kollagenase zu entfernen.
5. Verpackung der Reifen Adipozyten
- Öffnen Sie die Düse und sammeln Sie die gereinigte reife Adipozytensuspension in 50 ml konische Rohre.
- Die reifen Adipozyten leicht verpacken, indem Sie die Rohre bei 50 x g für 3 min drehen.
- Verwenden Sie eine 18 G Nadel und eine Spritze, um den verbleibenden Waschpuffer unterhalb der Adipozytensuspension zu entfernen.
- Entfernen Sie die freie Lipidschicht (Öl aus dem kleinen Teil der Adipozyten, die während des Isolationsvorgangs brach) schwebend auf den reifen Adipozyten mit einer Pipette.
HINWEIS: Um das Risiko zu verringern, dass die Adipozyten in Schritt 6.5 von den Membranen abtropfen, ist es wichtig, dass die Lipidschicht und der gesamte Waschpuffer entfernt wurden, wenn die reifen Adipozyten auf Membranen ausgesät werden. Aus diesem Grund sammeln Sie die Adipozyten in 3 Röhren. Die Proben, die zuletzt gesammelt werden, haben die meisten Übertragslipide und sind daher von der niedrigsten Qualität. Bei sorgfältiger Pipettierung können diese Proben jedoch verwendet werden.
6. Aussaat von reifen Adipozyten
- Öffnen Sie die Verpackung mit den durchlässigen Membraneinsätzen (Materialtabelle) und nehmen Sie die Membrankomponente heraus. Drehen Sie es auf den Kopf und legen Sie es auf eine sterile Oberfläche, so dass die Membranen zur Decke.
- Pipette 30 l verpackte reife Adipozyten auf jede der Membranen (Abbildung 1C). Vermeiden Sie es, die Membran mit der Spitze zu berühren. Verwenden Sie Breitbohrpipettenspitzen, um die Zellen auszusäen, oder schneiden Sie mit einer Schere ein kleines Stück einer Pipettenspitze ab, um sie breiter zu machen.
- Um die 50 ml-Rohre mit verpackten Adipozyten während des gesamten Säprozesses vorsichtig umzukehren, um eine gleichmäßige Verteilung von Adipozyten in verschiedenen Größen zu gewährleisten.
- Bringen Sie die vorbereiteten Multiwell-Platten mit den Medien aus dem Inkubator in den Biosicherheitsschrank und entfernen Sie die Deckel. Nehmen Sie die mit Adipozyten gesäten Membranen auf und greifen Sie sie von unten, so dass sie in Schritt 6.5 invertiert werden können.
- In einer glatten Bewegung die Membranen mit den Adipozyten oben umkehren, so dass die gesäten Adipozyten nun nach unten gerichtet sind (Abbildung 1D). Senken Sie die Platte mit Adipozyten in die Medienbrunnen (Abbildung 1E).
- Legen Sie den Deckel auf die Platte und übertragen Sie die Platte vorsichtig in einen Inkubator der Gewebekultur. Vermeiden Sie eine schnelle Bewegung der Platte, da Adipozyten zunächst leicht entfernt werden können.
HINWEIS: Es dauert ein paar Tage, bis die Zellen fester an der Membran haften.
7. Wartung von Adipozyten und Ernte zur Analyse
- Wechseln Sie die Medien mindestens alle 7 Tage. Entfernen und fügen Sie Medien über das Ausschnittloch in jedem Membraneinsatz hinzu. Um die Medien zu entfernen, verwenden Sie eine Spritze und eine Nadel, einen Saugstab oder eine Pipette mit einer p200-Spitze. Um Medien hinzuzufügen, verwenden Sie eine Pipette und langsam Pipette neue Medien in die Brunnen entlang der Seite der Wand, um zu vermeiden, stören die Adipozyten.
HINWEIS: Adipozyten wurden seit 2 Wochen mit einem Medienwechsel nach 7 Tagen kultiviert. Unterschiedliche Fettherkunften und experimentelle Fragen können jedoch von zunehmenden Medienveränderungen profitieren. - Um RNA zu ernten, entfernen Sie die Medien wie in Schritt 7.1 beschrieben, und fügen Sie 500 L Lysepuffer (Tabelle der Materialien) direkt in die Brunnen, um die Zellen zu lysieren. Um die Zellen für die Bildgebung zu fixieren, fügen Sie Formaldehyd direkt in den Brunnen mit einer Endkonzentration von 1% hinzu.
HINWEIS: Die Zellen können dann bei 4 °C gelagert werden.
Ergebnisse
Reife Adipozyten, die als MAAC kultiviert werden, bewahren ihre Funktion, den Phänotyp, und können verwendet werden, um Adipozytenreaktionen auf verschiedene pharmakologische Behandlungen zu untersuchen. Nach 1 Woche Kultur erhalten MAAC, isoliert aus subkutanem Fettgewebe, das charakteristische unilokuläre Lipidtröpfchen, das nur in reifen Adipozyten gefunden wird (Abbildung 2A). MAAC wurde für 1 Woche kultiviert, während entweder mit den PPAR-Agonisten Rosiglitazon (Rosi) und Pioglitazon (Pio) oder dem Glukokortikoidrezeptor (GR) Agonisten-Dexamethason (Dex) behandelt wurde, um zu bestimmen, ob verschiedene Atomhormonrezeptor-Agonisten (NHR) vorhergesagte Veränderungen in den nachgeschalteten Zielgenen in MAAC vorantreiben. Rosi und Pio erhöhten die Expression der PPAR-responsiven Gene FABP4 und LPL um das 4- bzw. 2-3-fache, während Dexamethason keine Wirkung hatte(Abbildung 2B). In ähnlicher Weise trieb Dexamethason die Genexpression der GR-Zielgene APOD und FKBP5 um das 13- bzw. 55-fache, während die PPAR-Agonisten keine signifikanten Auswirkungen hatten. Wir haben bereits gezeigt, dass frisch isolierte menschliche reife weiße Adipozyten in MAAC in einen braunen Phänotyp transdifferenzieren können, wenn sie mit Rosi10behandelt werden. Eine 7-tägige Behandlung mit Rosi oder Pio induzierte die Genexpression des braunen fettspezifischen Gens UCP1 um das 44-65-fache und erhöhte die Expression des braunen Fettmarkers PDK4 12-18-fach (Abbildung 2C).
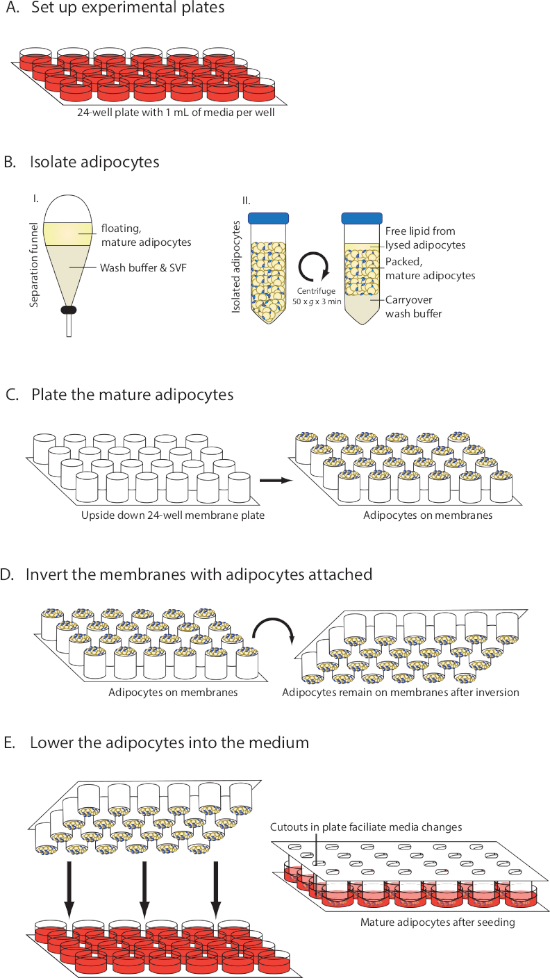
Abbildung 1: Visuelles Diagramm der MAAC-Einrichtung. (A) Vorbereitung des Mediums. (B) Isolierung und Verpackung von reifen Adipozyten. (C) Aussaat reife Adipozyten auf Membranen. (D) Umkehren von Membranen unter Beibehaltung der Apozyten. (E) Absenken der Membranen in das Medium und Ändern des Mediums. Diese Zahl wurde von Harms et al.10geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
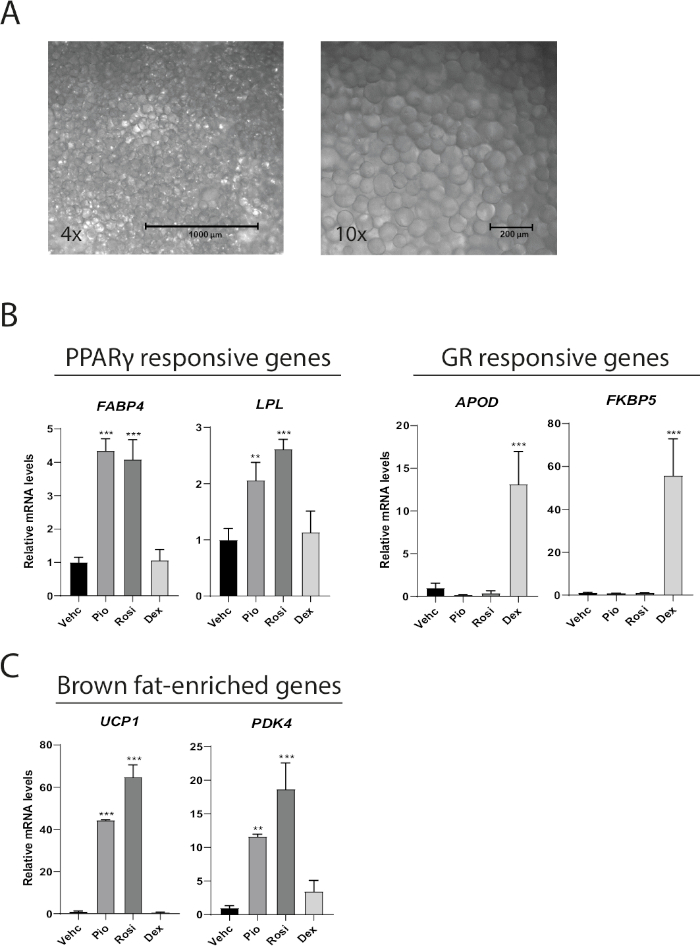
Abbildung 2: MAAC behält das unilkulare Erscheinungsbild über eine Woche bei und reagiert auf diversen pharmakologischen Agonismus. (A) Repräsentative 4x und 10x helle Feldbilder von MAAC nach einer Woche Kultur. Adipozyten, die einen durchschnittlichen Durchmesser von 100 m bei großen unilokularen Lipidtröpfchen haben, sind leicht zu erkennen. (B) mRNA-Spiegel von PPAR-Zielgenen und Glukokortikoidrezeptoren (GR) Zielgenen in MAAC nach 7 Tagen Behandlung mit Fahrzeug (Vehc), Rosiglitazon (Rosi), Pioglitazon (Pio) oder Dexamethason (Dex). Rosi, Pio und Dex wurden alle in einer Endkonzentration von 10 M. (C) mRNA-Spiegel von braunen fettangereicherten Genen in MAAC nach 7 Tagen Behandlung mit Fahrzeug (Vehc), Rosiglitazon (Rosi), Pioglitazon (Pio) oder Dexamethason (Dex) verwendet. Rosi, Pio und Dex wurden alle in einer Endkonzentration von 10 m eingesetzt. Für alle Genexpressionsdaten wurde TATA-bindendes Protein (TBP) als interne Normalisierungskontrolle verwendet. Die Statistiken wurden anhand von einwegigem ANOVA mit Tukeys Mehrfachvergleichstest berechnet. (Mittelwert sD, n = 3, *p < 0,05; **p < 0,01; ***p < 0,001). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Membranreife Adipozyten-Aggregatkultur (MAAC) ist eine neue Methode für die langfristige Kultur frisch isolierter reifer Adipozyten. Bei der Einrichtung von MAAC gibt es einige kritische Schritte im Protokoll, die sich stark auf die Ausbeute, Qualität und Lebensfähigkeit der ausgereiften Adipozyten auswirken. Es sollte viel Aufwand in das Zerlegen des Fettes in Schritt 3.2 gesteckt werden, da dieser Schritt direkt die Zeit beeinflusst, in der die Adipozyten der Kollagenase ausgesetzt sind. Wenn die Fettstücke zu groß sind, muss die Verdauungszeit verlängert werden, was sich negativ auf die Lebensfähigkeit der Zellen auswirkt. Umgekehrt kann, wenn das Gewebe zu fein mit der Schere verarbeitet wird, auch die Lebensfähigkeit beeinträchtigt werden. Für eine erfolgreiche Kultur der reifen Adipozyten als MAAC sollte man besondere Aufmerksamkeit auf die folgenden Schritte richten: Für eine erfolgreiche Aussaat der Adipozyten auf die Membranen ist es entscheidend, dass freier Lipid- und Übertragswaschpuffer aus den reifen Adipozyten entfernt wird. in den Schritten 5.3 und 5.4. Verbleibende Lipid- oder Waschpuffer reduzieren die Oberflächenspannung der Adipozyten und erhöhen das Risiko, dass Adipozyten die Membranen abtropfen, wenn sie umgedreht werden. Wenn die Adipozyten gesät werden und in den Medien, bleiben die Zellen in Kontakt mit der Membran in erster Linie durch Auftrieb, so dass eine langsame und sanfte Technik empfohlen wird, wenn Medien gewechselt werden, um Zellen nicht zu verlieren. Entfernen Sie Medien von der Unterseite der Brunnen, wie in Schritt 7.1 beschrieben, und fügen Sie Medien hinzu, indem Sie langsam Medien an den Seiten der Wände pipetieren. Schließlich ist ein zeitsparender Vorschlag, die Platten mit Medien und Behandlungen vor dem Adipozyten-Isolationsprozess vorzubereiten. Insbesondere bei komplexen Versuchskonstruktionen kann die Vorbereitung der Platten viel Zeit sparen und sorgt dafür, dass die Adipozyten mit ihren Behandlungen in medienspezifische Behandlungen platziert werden, sobald sie isoliert sind.
Ein Vorteil der Verwendung von MAAC im Vergleich zur Differenzierung von Präipozyten ist, dass die verwendeten MAAC-Medien sehr einfach sind und keinen unphysiologischen Hormoncocktail benötigen. Hier haben wir MAAC in glukosereichen Medien (DMEM/F12), 10% FBS, 1% Penn/Strep und 20 nM Insulin kultiviert. Wichtig ist, dass wir festgestellt haben, dass Insulin absolut für die Rosiglitazon/Pioglitazon-getriebene Induktion von UCP110benötigt wird. Insulin ist jedoch nicht erforderlich, um den adipogenen Phänotyp der Zellen aufrechtzuerhalten. So kann Insulin je nach experimenteller Frage aufgenommen oder weggelassen werden.
Das oben beschriebene Verfahren wurde für die Isolierung und Kultur menschlicher Adipozyten optimiert. Jedoch, Maus, und möglicherweise andere Organismen Adipozyten, kann auch als MAAC kultiviert werden. Wenn Maus-Adipozyten als MAAC kultiviert werden sollen, gibt es zusätzliche Überlegungen und Vorsichtsmaßnahmen, die im Auge behalten werden sollten. Wir haben herausgefunden, dass reife Adipozyten von Mäusen viel zerbrechlicher sind als solche von Menschen. Daher sollte die Verdauungszeit auf ein absolutes Minimum verkürzt werden, um die Zelllebensfähigkeit zu erhöhen. Wir fanden auch heraus, dass Adipozyten von jungen Mäusen (8 Wochen alt und jünger) die robustesten und reproduzierbarsten Ergebnisse lieferten. Schließlich kann Maus MAAC für bis zu einer Woche kultiviert werden, jedoch angesichts der Tatsache, dass ihr adipögener Phänotyp weniger stabil als der Mensch erscheint (der durch mindestens zwei Wochen kultiviert werden kann), empfehlen wir, Die Maus MAAC für die minimale erforderliche Zeit zu kultivieren, um experimentelle Fragen.
Da das MAAC-Modell auf der Verwendung durchlässiger Membranen basiert, besteht ein Vorteil dieser Technik darin, reife Adipozyten mit anderen Zelltypen zu kultivieren. Wir haben zuvor die Fähigkeit von reifen Adipozyten und Makrophagen demonstriert, durch den Einsatz von MAAC10zu übersprechen. Dies eröffnet Möglichkeiten, den Zusammenhang zwischen Adipositas, Insulinresistenz und Immunantworten weiter zu erforschen15,16,17. Zukünftige Experimente könnten andere Zelltypen wie Hepatozyten, Prägoipozyten, Endothelzellen oder Pankreaszellen integrieren, um die Komplexität und die translationale Relevanz des MAAC-Modells weiter zu erhöhen und Das Übersprechen zwischen mehreren Zelltypen zu untersuchen.
Obwohl sich gezeigt hat, dass MAAC bei der Aufrechterhaltung der Funktionalität und Identität der Adipozyten im Vergleich zu anderen Adipozyten-In-vitro-Modellen überlegen ist, hat es auch Einschränkungen, die berücksichtigt werden müssen. Im Vergleich zur Verwendung von Adipozyten, die sich von Vorläuferzellen unterscheiden, ist MAAC ein mühsameres und zeitaufwändigeres Modell. Platten mit Membranen sind auch teurer als normale Zellkulturplatten. Wichtig ist, dass reife Adipozyten jedes Mal bei der Aussaat frisch isoliert werden müssen und nicht in Bestände wie Vorläuferzellen erweitert oder eingefroren werden können. Dies erfordert daher den Zugang zu frischen weißen Fettgewebeproben, erhöht aber auch eine zusätzliche Komplexität, die sich aus den Variationen der Spender ergibt.
Hier haben wir ein detailliertes Protokoll zur Isolierung menschlicher reifer Adipozyten und zur Einrichtung von MAAC vorgestellt. Wir haben gezeigt, dass Adipozyten, die als MAAC kultiviert werden, über zwei Wochen lebensfähig bleiben, ihre adipogene Gensignatur erhalten bleibt und auf verschiedene pharmakologische Agonismus reagieren. Die Verwendung von MAAC ermöglicht die Untersuchung von Cross-Talk-Betweeen-Adipozyten und anderen Zelltypen und die Bewertung von langfristigen phänotypischen Veränderungen von reifen Adipozyten als Reaktion auf verschiedene Reize.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken Xiao-Rong Peng und Stefan Hallen für die Bereitstellung von Ressourcen und der Optimierung der Adipozytenisolierung, Martin Uhrbom für technische Hilfe und Daniel Olausson und Malin Lönn für die Koordination und Bereitstellung der menschlichen Fettung.
Materialien
| Name | Company | Catalog Number | Comments |
| Autoclaved scissors | |||
| Autoclaved spoons | |||
| Autoclaved tweezers | |||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A6003 | |
| Buffer RLT | QIAGEN | 79216 | Lysis buffer |
| CaCl2*2H2O | Sigma-Aldrich | C7902 | |
| Conical tubes, 50 mL | |||
| D-(+)-Glucose | Sigma-Aldrich | G7528 | |
| DMEM/F-12 | Gibco | 31331-028 | |
| Fetal bovine serum (FBS) | Gibco | 10270-106 | |
| Filter flask 0.2 µm pore size, 75 mm | Thermo Scientific | 156-4020 | 500 mL |
| Filter flask 0.2 µm pore size, 75 mm | Thermo Scientific | 158-0020 | 1000 mL |
| HBSS+CaCl2+MgCl2 | Gibco | 14065-49 | |
| HEPES buffer solution (1M) | Gibco | 15630-056 | |
| High-Capacity cDNA Reverse Transcription kit | Applied Biosystems | 4368814 | |
| Insulin (Actrapid Penfill) | Novo Nordisk A/S | ||
| KCl | Merck | 104936 | |
| KH2PO4 | Merck | 104873 | |
| Medium 199 | Gibco | 10012-011 | |
| Mesh filter (250 µM) | Sintab AB | 6111-025043 | |
| MgSO4*7H2O | Sigma-Aldrich | M1880 | |
| NaCl | Sigma-Aldrich | S7653 | |
| Needles, 18 G, 1.20 mm x 40 mm | Sterican | 613-2948 | |
| Pencillin-Streptomycin (Penn/Strep) | Gibco | 15140 | |
| Petri dishes, 150 mm x 21 mm | Thermo Scientific | 168381 | |
| Power SYBR Green PCR master mix | Applied Biosystems | 4367659 | |
| Quantstudio 7 Flex Real-Time PCR machine | Applied Biosystems | ||
| RNeasy Mini kits | QIAGEN | 74106 | |
| Separation funnel | VWR | 527-0008 | For large scale preparation |
| Separation funnel | VWR | 527-0005 | For small scale preparation |
| Shaking incubator (37 °C) | |||
| Syringes, 5 mL | Omnifix | 612-2892 | 100 st |
| Tissue culture incubator (37 °C, 5% CO2) | |||
| Transwells, 24-well (6.5 mm) | Costar | 3397 | Permeable membrane inserts |
| TRIzol reagent | Invitrogen | 10296010 | Lysis buffer |
| Type 2 Collagenase | Worthington | LS004177 |
Referenzen
- Guilherme, A., Virbasius, J. V., Puri, V., Czech, M. P. Adipocyte dysfunctions linking obesity to insulin resistance and type 2 diabetes. Nature Reviews Molecular Cell Biology. 9 (5), 367-377 (2008).
- Rosen, E. D., Spiegelman, B. M. What we talk about when we talk about fat. Cell. 156 (1-2), 20-44 (2014).
- Lotta, L. A., et al. Integrative genomic analysis implicates limited peripheral adipose storage capacity in the pathogenesis of human insulin resistance. Nature Genetics. 49 (1), 17-26 (2017).
- Gustafson, B., Hedjazifar, S., Gogg, S., Hammarstedt, A., Smith, U. Insulin resistance and impaired adipogenesis. Trends in Endocrinology and Metabolism. 26 (4), 193-200 (2015).
- Gesta, S., et al. Culture of human adipose tissue explants leads to profound alteration of adipocyte gene expression. Hormone and Metabolic Research. 35 (3), 158-163 (2003).
- Fain, J. N., Cheema, P., Madan, A. K., Tichansky, D. S. Dexamethasone and the inflammatory response in explants of human omental adipose tissue. Molecular and Cellular Endocrinology. 315 (1-2), 292-298 (2010).
- Lessard, J., et al. Characterization of dedifferentiating human mature adipocytes from the visceral and subcutaneous fat compartments: fibroblast-activation protein alpha and dipeptidyl peptidase 4 as major components of matrix remodeling. PLoS One. 10 (3), e0122065 (2015).
- Asada, S., et al. Ceiling culture-derived proliferative adipocytes retain high adipogenic potential suitable for use as a vehicle for gene transduction therapy. American Journal of Physiology - Cell Physiology. 301 (1), C181-C185 (2011).
- Shen, J. F., Sugawara, A., Yamashita, J., Ogura, H., Sato, S. Dedifferentiated fat cells: an alternative source of adult multipotent cells from the adipose tissues. International Journal of Oral Science. 3 (3), 117-124 (2011).
- Harms, M. J., et al. Mature Human White Adipocytes Cultured under Membranes Maintain Identity, Function, and Can Transdifferentiate into Brown-like Adipocytes. Cell Reports. 27 (1), 213-225 (2019).
- Wang, Q. A., Scherer, P. E., Gupta, R. K. Improved methodologies for the study of adipose biology: insights gained and opportunities ahead. Journal of Lipid Research. 55 (4), 605-624 (2014).
- Gregoire, F. M., Smas, C. M., Sul, H. S. Understanding adipocyte differentiation. Physiological Reviews. 78 (3), 783-809 (1998).
- Ruiz-Ojeda, F. J., Ruperez, A. I., Gomez-Llorente, C., Gil, A., Aguilera, C. M. Cell Models and Their Application for Studying Adipogenic Differentiation in Relation to Obesity: A Review. International Journal of Molecular Sciences. 17 (7), 1040 (2016).
- McBeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell shape, cytoskeletal tension, and RhoA regulate stem cell lineage commitment. Developmental Cell. 6 (4), 483-495 (2004).
- Lackey, D. E., Olefsky, J. M. Regulation of metabolism by the innate immune system. Nature Reviews Endocrinology. 12 (1), 15-28 (2016).
- Saltiel, A. R., Olefsky, J. M. Inflammatory mechanisms linking obesity and metabolic disease. The Journal of clinical investigation. 127 (1), 1-4 (2017).
- Lee, Y. S., Wollam, J., Olefsky, J. M. An Integrated View of Immunometabolism. Cell. 172 (1-2), 22-40 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten