Method Article
Isolamento e cultura degli adipociti maturi umani utilizzando le colture aggregate adipocite mature membrana (MAAC)
In questo articolo
Riepilogo
La coltura aggregata adipocite matura membrana (MAAC) è un nuovo metodo per coltivare adipociti umani maturi. Qui dettagliamo come isolare gli adipociti dall'adiposo umano e come impostare il MAAC.
Abstract
La disregolazione del tessuto adiposo bianco (WAT) svolge un ruolo centrale nello sviluppo dell'insulino-resistenza e del diabete di tipo 2 (T2D). Per sviluppare nuovi trattamenti per il T2D, sono necessari modelli di adipociti in vitro più rilevanti dal modo fisiologico. Questo studio descrive una nuova tecnica per isolare e la coltura matura adipociti umani. Questo metodo è intitolato MAAC (membrana matura coltura aggregata adipocito), e rispetto ad altri modelli di adipocite in vitro, MAAC possiede una firma genica adipogenica che è la più vicina agli adipociti maturi appena isolati. Utilizzando MAAC, gli adipociti possono essere coltivati da pazienti magri e obesi, diversi depositi adiposi, co-coltivati con diversi tipi di cellule e, soprattutto, possono essere tenuti in coltura per 2 settimane. Esperimenti funzionali possono essere eseguiti anche su MAAC tra cui assorbimento del glucosio, lipogenesi, e lipolisi. Inoltre, MAAC risponde robustamente all'agonia farmacologica diversificata e può essere utilizzato per studiare i cambiamenti fenotipici adipociti, compresa la transdifferenziazione degli adipociti bianchi in cellule adipose marroni.
Introduzione
L'aumento mondiale delle co-morbidità legate all'obesità e all'obesità richiede lo sviluppo di nuove terapie. Il tessuto adiposo bianco (WAT) è un importante regolatore del metabolismo di tutto il corpo, l'omeostasi energetica ed è un attore centrale nello sviluppo dell'insulino-resistenza e del diabete di tipo 2 (T2D)1,2. Durante il consumo cronico di calorie in eccesso, gli adipociti si ingrandiscono per gestire l'eccedenza di energia. Tuttavia, la capacità di stoccaggio dei lipidi adipociti può essere superata, con conseguente elevazione dei livelli circolanti di acidi grassi e aumento dello stoccaggio nei tessuti non adiposi periferici e portando alla lipotossicità3,4.
La mancanza di modelli adipociti in vitro con elevata rilevanza traslazionale è una sfida fondamentale nello sviluppo di nuovi trattamenti per l'obesità e il T2D. Il modello ex vivo ex-explant, in cui vengono coltivati piccoli pezzi di tessuto adiposo, è associato a rapide alterazioni dell'espressione genica adipogenica causate da ipossia e infiammazione5,6. Colture del soffitto (CC) dove gli adipociti maturi galleggiano e aderiscono alla parte superiore dei flaconi pieni di media, rapidamente didifferenziarsi in cellule simili a fibroblasti prive di lipidi7,8,9,10. Il modello più comunemente usato è gli adipociti differenziati in vitro dai precursori impegnati. Le cellule differenziate sono, tuttavia, morfologicamente distinte dagli adipociti maturi in vivo poiché sono molto più piccole e non hanno una goccia di lipidi unsuoculare. Altre limitazioni con questo modello includono la necessità non fisiologica di un cocktail chimico per guidare la differenziazione, così come la variabilità nell'efficienza di differenziazione che può essere influenzata da una serie di fattori11,12,13,14.
Recentemente abbiamo sviluppato la coltura aggregita adipocite a membrana matura (MAAC), un metodo per la coltura a lungo termine di adipociti maturi appena isolati, dove gli adipociti sono coltivati sotto membrane permeabili10. L'analisi imparziale dei dati di sequenziamento dell'RNA ha dimostrato che rispetto agli esoti dei tessuti adiposi e agli adipociti differenziati in vitro, il MAAC è più simile agli adipociti appena isolati. MAAC può essere utilizzato per coltura adipociti maturi isolati dal tessuto adiposo sottocutaneo e viscerale, così come adipociti da soggetti obesi e magri. Questa metodologia consente lo studio dei cambiamenti fenotipici adipociti a lungo termine e facilita la co-coltura degli adipociti con altri tipi di cellule. Qui forniamo un protocollo dettagliato per l'isolamento degli adipociti maturi dal tessuto adiposo umano e come impostare il sistema MAAC.
Protocollo
Campioni anonimi di tessuto adiposo sono stati raccolti dalla regione addominale di pazienti sottoposti a chirurgia elettiva presso l'Ospedale Universitario Sahlgrenska di Goteborg, Svezia. Tutti i soggetti dello studio hanno ricevuto informazioni scritte e orali prima di dare il consenso scritto informato per l'uso del tessuto. Gli studi sono stati approvati dal Regional Ethical Review Board di Goteborg, Svezia.
NOTA: una panoramica del metodo è disponibile nella Figura 1.
1. Preparazione di buffer, supporti di cultura dei tessuti e piastre di coltura
- Preparare uno stock 5x Krebbs Ringer (KR) sciogliendo 35,1 g di NaCl, 1,75 g di KCl, 0,82 g di KH2PO4e 1,48 g di MgSO4.7H2O in 900 mL di acqua. Aggiungere 1,84 g di CaCl2x2H 2O e regolare il volume a 1 L aggiungendo acqua. Filtro sterile attraverso un filtro da 0,22 m e conservato a 4 gradi centigradi.
- Dal titolo 5x KR, preparare 1 L di buffer contenente 1x KR, 25 mM HEPES, 2 mM di glucosio e 2% albumina siero bovina (BSA) (indicato in seguito come buffer di lavaggio). Regolare il pH a 7.4.
- Preparare 500 mL di buffer di collagenasi contenente 1x HBSS - CaCl2 - MgCl2, 2% BSA e 450 mL di acqua (indicato in seguito come buffer di digestione).
NOTA: Il collagenano non deve essere aggiunto al buffer di digestione fino a quando il tessuto adiposo non è stato pesato nel passaggio 2.2. - Regolare il pH di Medium 199 a 7.4.
- Filtro sterile sia buffer che media 199 attraverso un flacone di filtro da 0,22 m e caldo a 37 gradi centigradi.
NOTA: Per risparmiare tempo, il supporto per la coltura dei tessuti può essere preparato e aggiunto alle piastre prima di elaborare il tessuto adiposo. Per un formato a piastre a 24 pozze(Figura 1A),utilizzare 0,5/1 mL/pozza del mezzo/prosciutto modificato di Eagle's farm F12 (DMEM/F12), 10% siero bovino fetale (FBS), 1% penicillina-streptomicina (penn/strep) e 20 nM di insulina. Piccole molecole e altri agenti farmacologici stabili possono anche essere aggiunti in questo momento ai media nel layout desiderato. Collocare le piastre in un'incubatrice di coltura tissutale (37 gradi centigradi, 5% CO2).
2. Dissezione del tessuto adiposo sottocutaneo umano
NOTA: Lavorare all'interno di un mobile di sicurezza biologica e utilizzare la tecnica sterile durante tutto il processo di isolamento, nonché l'uso esclusivo di attrezzature autoclaved e sterili.
- Mettere il tessuto adiposo umano in una piastra di Petri di 15 cm e aggiungere un piccolo volume di medio 199 per mantenerlo idratato durante la dissezione.
- Lavorando con pezzi di adiposi approssimativamente delle dimensioni di una pallina da golf, afferrare grandi vasi fibroti con una pinzetta e rilasciare delicatamente gli adipociti raschiando l'adiposo con la parte posteriore delle forbici chiuse. Scartare i grandi pezzi di tessuto fibrotico. Pesare il grasso tagliato.
3. Trattamento del collagenasi
- Aggiungere il collagenase al buffer di digestione (vedere il punto 1.3) ad una concentrazione di 1 mg/mL. Filtrare sterile la soluzione utilizzando un filtro sterile da 0,22 m.
NOTA: Si raccomandano tre mL di buffer di digestione per grammo di grasso (cioè, per 100 g di grasso, preparare 300 mL di buffer di digestione con 300 mg di collagenase di tipo 2).
AVVISO: il Collagenae di tipo 2 è pericoloso per gli occhi, la pelle e può causare irritazioni respiratorie. Indossare guanti, protezione degli occhi, e lavorare in un cofano ventilato durante la manipolazione del collagenae. - Spostare circa 10 g di tessuto adiposo in una piastra di Petri di 15 cm e tritare il grasso con attenzione utilizzando un paio di forbici curve fino a quando non diventa una miscela omogenea liscia e non ci sono grandi pezzi di adipossi a sinistra. Ripetere il processo fino a quando tutto il grasso è stato elaborato.
NOTA: Ogni round dovrebbe prendere circa 2 minuti e i pezzi adipose dovrebbero essere abbastanza piccoli in modo che possano essere pipetted utilizzando una punta pipetta ampi. Questo passaggio è fondamentale per produrre adipociti di alta qualità. Se i pezzi sono troppo grandi, i tempi di digestione dovranno essere estesi, compromettendo la viabiltà cellulare. - Trasferire il grasso macinato in tubi conici da 50 mL con un cucchiaio. Aggiungere 10 mL di tessuto macinato e 30 mL di tampone di digestione ad ogni tubo. Scalabilità verso il basso a volumi appropriati se sono disponibili meno di 10 mL di grasso macinato.
- Digerire il tessuto a 37 gradi centigradi in un'incubatrice tremante con agitazione costante a 150 giri/mm per 30-45 min. Dopo 30 min, controllare il processo ogni 5 min per evitare una digestione eccessiva.
NOTA: La digestione è completa quando la soluzione adiposa è omogenea senza grandi pezzi e ha un colore albicocca.
4. Filtrazione della sospensione cellulare e purificazione degli Adipociti maturi
- Posizionare un imbuto sopra un flacone sterile da 1 L e posizionare un filtro sterile a rete da 250 m all'interno dell'imbuto. Versare la soluzione di grasso digerito nel filtro per rimuovere il tessuto non digerito.
- Quando tutte le sospensioni adipocite sono passate attraverso il filtro, stringere delicatamente il filtro mesh per aumentare la resa degli adipociti. Versare nel filtro circa 50-100 mL di tampone di lavaggio per sciacquarlo e spremere nuovamente il filtro.
- Versare la sospensione isolata dell'adipocito dal flacone in un imbuto di separazione e aggiungere il buffer di lavaggio fino a quando l'imbuto non è quasi completamente riempito. Invertire delicatamente l'imbuto un paio di volte per mescolare la sospensione adipocitico con il buffer.
- Lasciare riposare le sospensioni per 2/3 min fino a quando non vi è una netta separazione di 2 strati (Figura 1B), con uno strato giallo superiore contenente gli adipociti maturi e lipidi liberi e uno strato inferiore contenente il buffer e la frazione vascolare adiposa stroma (SVF).
- Aprire l'ugello sull'imbuto di separazione e trasformare lentamente la soluzione inferiore in un pallone sterile (le cellule della SVF possono essere incollate e raccolte dopo la centrifugaa a 200 x g per 7 min). Mantenere lo strato superiore con gli adipociti maturi nell'imbuto di separazione.
- Ripetere il processo di lavaggio nei passaggi 4.3.5 tre volte per lavare accuratamente gli adipociti maturi e rimuovere tutto il collagenae.
5. Imballaggio degli Adipociti Maturi
- Aprire l'ugello e raccogliere la sospensione adipocitica matura purificata in tubi conici da 50 ml.
- Imballare leggermente gli adipociti maturi ruotando i tubi a 50 x g per 3 min.
- Utilizzare un ago da 18 G e una siringa per rimuovere il buffer di lavaggio rimanente sotto la sospensione adipocite.
- Rimuovere lo strato lipidico libero (olio dalla piccola porzione di adipociti che si è rotto durante la procedura di isolamento) galleggiando sopra gli adipociti maturi utilizzando una pipetta.
NOTA: Per ridurre il rischio che gli adipociti gocciolino dalle membrane nel passaggio 6.5, è importante che lo strato lipidico e tutti i buffer di lavaggio siano stati rimossi quando gli adipociti maturi vengono seminati sulle membrane. Per questo motivo raccogliere gli adipociti in 3 tubi. I campioni che vengono raccolti per ultimi avranno il più lipid carryover e saranno quindi di qualità più bassa. Tuttavia, con un'attenta pipettatura questi campioni possono essere utilizzati.
6. Seeding di Adipociti Maturi
- Aprire la confezione contenente gli inserti a membrana permeabili (Tabella dei materiali) ed estrarre il componente della membrana. Capovolgere a testa in giù e posizionare su una superficie sterile in modo che le membrane si affacciano sul soffitto.
- Pipette 30 -L di adipociti maturi confezionati su ciascuna delle membrane (Figura 1C). Evitare di toccare la membrana con la punta. Utilizzare punte pipette di foro largo per semare le cellule, o utilizzare le forbici per tagliare un piccolo pezzo di una punta di pipetta per renderlo più ampio.
- Invertire delicatamente i tubi da 50 mL con adipociti confezionati più volte durante il processo di seming per garantire una distribuzione uniforme di adipociti di diverse dimensioni.
- Portare le piastre multiwell preparate contenenti il supporto dall'incubatrice all'armadio della biosicurezza e rimuovere i coperchi. Raccogliere le membrane semi con adipociti e afferrarlo dal basso in modo che possa essere invertito nel passaggio 6.5.
- In un movimento liscio invertire le membrane con gli adipociti sulla parte superiore in modo che gli adipociti semi sono ora rivolto verso il basso (Figura 1D). Abbassare la piastra con adipociti nei pozzi contenenti supporti (Figura 1E).
- Mettere il coperchio sulla piastra e trasferire con attenzione la piastra in un'incubatrice di coltura del tessuto. Evitare il rapido movimento della piastra poiché gli adipociti possono essere facilmente sloggiati inizialmente.
NOTA: Ci vogliono alcuni giorni perché le cellule aderiscano più saldamente alla membrana.
7. Manutenzione degli Adipociti e raccolta per l'analisi
- Cambiare il supporto almeno ogni 7 giorni. Rimuovere e aggiungere supporti tramite il foro di ritaglio in ogni inserto di membrana. Per rimuovere il supporto, utilizzare una siringa e un ago, una bacchetta aspirante o una pipetta con una punta p200. Per aggiungere supporti, utilizzare una pipetta e lentamente pipette nuovi supporti nei pozzi lungo il lato della parete per evitare di disturbare gli adipociti.
NOTA: Gli adipociti sono stati coltivati per 2 settimane con un cambiamento dei media dopo 7 giorni. Tuttavia, diverse origini adipose e domande sperimentali possono beneficiare di un aumento dei cambiamenti dei media. - Per raccogliere l'RNA, rimuovere il supporto come descritto al punto 7.1 e aggiungere 500 l of lysis buffer (Table of Materials) direttamente nei pozzi per lizzare le cellule. Per fissare le cellule per l'imaging, aggiungere formaldeide direttamente al pozzo ad una concentrazione finale dell'1%.
NOTA: Le celle possono quindi essere conservate a 4 gradi centigradi.
Risultati
Gli adipociti maturi coltivati come MAAC conservano la loro funzione, il fenotipo, e possono essere utilizzati per studiare le risposte adipociti a vari trattamenti farmacologici. Dopo 1 settimana di cultura MAAC isolato dal tessuto adiposo sottocutaneo mantenere la caratteristica goccia di lipidi unoculare trovato solo in adipociti maturi (Figura 2A). Il MAAC è stato coltivato per 1 settimana mentre veniva trattato con l'agonista PPARz rosiglitazone (Rosi) e pioglitazone (Pio), o con il recettore glucocorticoide (GR) agonista dexamethasone (Dex) per determinare se diversi recettori dell'ormone nucleare (NHR) guidati dagli agonisti presistessero dei cambiamenti nei bersagli a valle nel MAAC. Rosi e Pio aumentarono l'espressione dei geni reattivi PPARz FABP4 e LPL rispettivamente di 4 e 2,3 volte, mentre dexamethasone non ebbe alcun effetto (Figura 2B). Allo stesso modo, dexamethasone ha guidato in modo robusto l'espressione genica dei geni bersaglio GR APOD e FKBP5 rispettivamente di 13 e 55 volte, mentre gli agonisti del PPAR non hanno avuto effetti significativi. Abbiamo dimostrato in precedenza che gli adipociti bianchi maturi umani appena isolati possono trassicarsi in un fenotipo marrone in MAAC quando trattati con Rosi10. Un trattamento di 7 giorni con Rosi o Pio ha indotto in modo robusto l'espressione genica del gene bruno specifico del grasso CTU1 di 44-65 volte, oltre ad aumentare l'espressione del marcatore di grasso marrone PDK4 12-18(Figura 2C).
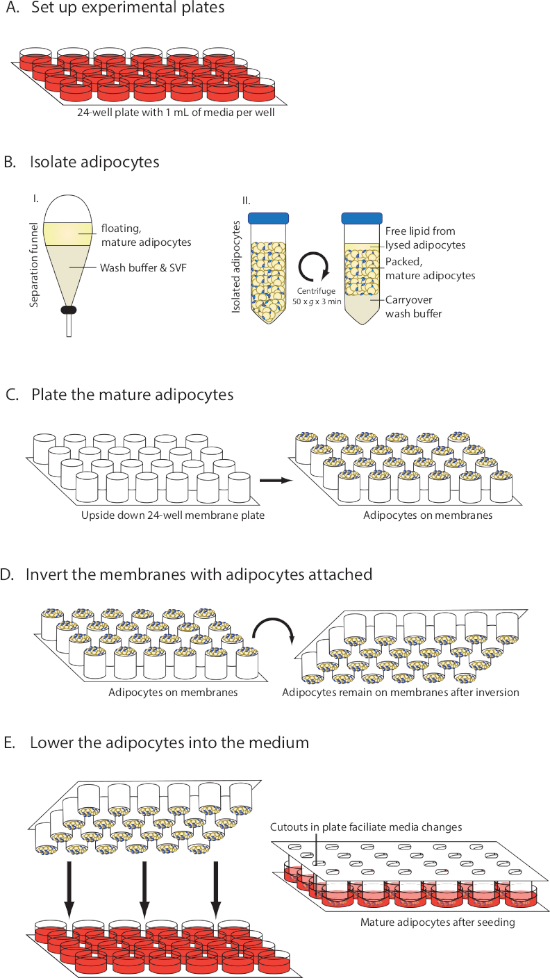
Figura 1: diagramma visivo dell'installazione di MAAC. (A) Preparazione del mezzo. (B) Isolamento e confezionamento di adipociti maturi. (C) Seeding adipociti maturi sulle membrane. (D) Invertire le membrane mantenendo gli adipociti attaccati. (E) Abbassare le membrane nel mezzo e cambiare il mezzo. Questa cifra è stata modificata da Harms et al.10. Fare clic qui per visualizzare una versione più grande di questa figura.
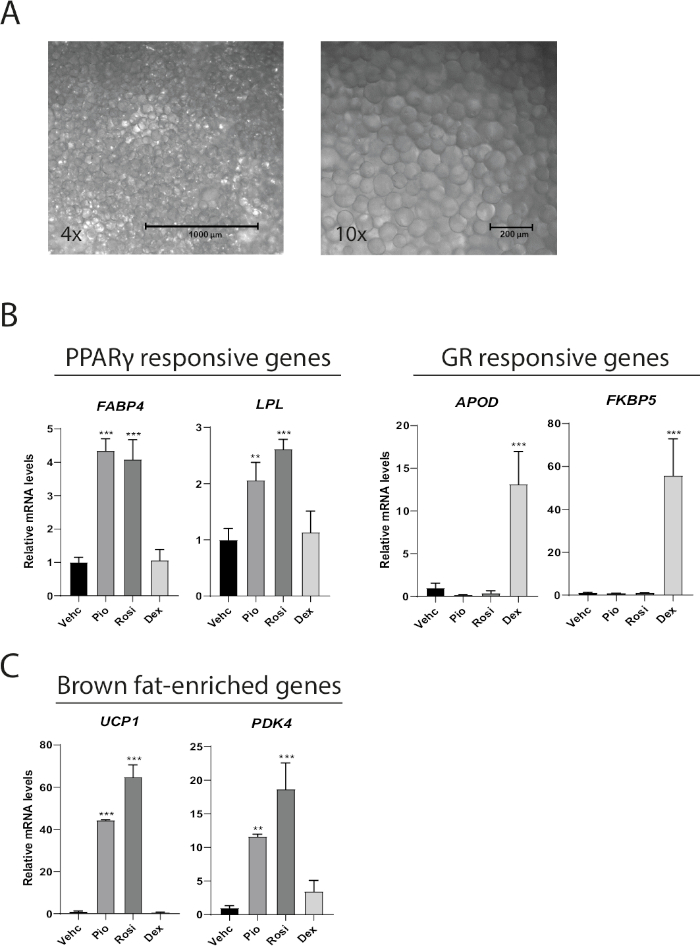
Figura 2: MAAC mantiene l'aspetto unilocular attraverso una settimana e risponde all'agonismo farmacologico diversificato. (A) Rappresentante 4x e 10 volte immagini luminose di MAAC dopo una settimana di cultura. Gli adipociti che hanno un diametro medio di 100 m con grandi goccioline di lipidi unsuoculari sono facilmente distinguibili. (B) i livelli di mRNA dei geni bersaglio PPARe e del recettore glucocorticoide (GR) nel MAAC dopo 7 giorni di trattamento con veicolo (Vehc), rosiglitazone (Rosi), pioglitazone (Pio), o dexamethasone (Dex). Rosi, Pio e Dex sono stati tutti utilizzati ad una concentrazione finale di 10 livelli di m. (C) di geni arricchiti di grasso marrone in MAAC dopo 7 giorni di trattamento con veicolo (Vehc), rosiglitazone (Rosi), pioglitazone (Pio), o dexamethasone (Dex). Rosi, Pio e Dex sono stati tutti utilizzati ad una concentrazione finale di 10 M. Per tutti i dati sull'espressione genica, la proteina legante TATA (TBP) è stata utilizzata come controllo di normalizzazione interno. Le statistiche sono state calcolate utilizzando ANOVA unidirezionale con il test di confronto multiplo di Tukey. (media : SD, n e 3, p < 0,05; .p < 0,01; .p < 0.001). Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La coltura aggregata adipocite matura membrana (MAAC) è un nuovo metodo per la cultura a lungo termine degli adipociti maturi appena isolati. Nella creazione di MAAC ci sono alcuni passaggi critici nel protocollo che influenzano notevolmente la resa, la qualità e la fattibilità degli adipociti maturi. Molto sforzo dovrebbe essere messo a mincing il grasso nel passo 3.2 dal momento che questo passaggio influenza direttamente la quantità di tempo gli adipociti sono esposti al collagenasi. Se i pezzi di adiposo sono troppo grandi, il tempo di digestione dovrà essere esteso che influisce negativamente sulla vitalità delle cellule. Al contrario, se il tessuto viene lavorato troppo finemente con le forbici, anche la vitalità può essere influenzata. Per una cultura di successo degli adipociti maturi come MAAC, si dovrebbe prestare particolare attenzione ai seguenti passaggi: per la seeding di successo degli adipociti sulle membrane, è fondamentale che il buffer di lavaggio dei lipidi e di riporto libero venga rimosso dagli adipociti maturi nei passaggi 5.3 e 5.4. Il buffer di lipidi o lavaggi rimanenti ridurrà la tensione superficiale degli adipociti e aumenterà il rischio di gocciolare adipociti delle membrane quando vengono capovolti. Quando gli adipociti sono semi e nei media, le cellule rimangono a contatto con la membrana principalmente attraverso la galleggiabilità, quindi si raccomanda una tecnica lenta e delicata quando si cambia noto multimediale per non perdere le cellule. Rimuovere i supporti dalla parte inferiore dei pozzi come descritto al punto 7.1 e aggiungere i supporti con il pipettaggio lento dei supporti lungo i lati delle pareti. Infine, un suggerimento di risparmio di tempo è quello di preparare le piastre con supporti e trattamenti prima del processo di isolamento degli adipociti. In particolare per progetti sperimentali complessi, pre-preparare le piastre può risparmiare molto tempo e garantire che gli adipociti siano collocati in supporti con i loro trattamenti non appena sono isolati.
Un vantaggio dell'utilizzo di MAAC rispetto a differenziare i preadipociti è che il supporto MAAC utilizzato è molto semplice e non richiede un cocktail di ormone non fisiologico. Qui abbiamo coltivato MAAC in supporti ricchi di glucosio (DMEM/F12), 10% FBS, 1% penn/strep e 20 nM di insulina. È importante sottolineare che abbiamo scoperto che l'insulina è assolutamente necessaria per l'induzione guidata da rosiglitazone/pioglitazone di UCP110. L'insulina, tuttavia, non è necessaria per mantenere il fenotipo adipogenico delle cellule. Pertanto, a seconda della domanda sperimentale, l'insulina può essere inclusa o omessa.
La procedura descritta sopra è stata ottimizzata per l'isolamento e la cultura degli adipociti umani. Tuttavia, il topo, e possibilmente gli adipociti di altri organismi, può anche essere coltivato come MAAC. Se gli adipociti del topo devono essere colti come MAAC ci sono ulteriori considerazioni e precauzioni che dovrebbero essere tenute a mente. Abbiamo scoperto che gli adipociti maturi dei topi sono molto più fragili di quelli provenienti dall'uomo. Di conseguenza, il tempo di digestione deve essere ridotto al minimo assoluto per aumentare la vitalità cellulare. Abbiamo anche scoperto che gli adipociti dei topi giovani (8 settimane e più giovani) fornivano i risultati più robusti e riproducibili. Infine, il topo MAAC può essere coltivato fino a una settimana, tuttavia dato che il loro fenotipo adipogenico appare meno stabile rispetto agli esseri umani (che possono essere coltivati attraverso almeno due settimane) si consiglia di coltivare il mouse MAAC per il tempo minimo richiesto per affrontare domande sperimentali.
Poiché il modello MAAC si basa sull'utilizzo di membrane permeabili, un vantaggio di questa tecnica è la possibilità di co-codificare gli adipociti maturi con altri tipi di cellule. In precedenza abbiamo dimostrato la capacità di adipociti maturi e macrofagi di incrociare attraverso l'uso di MAAC10. Questo apre opportunità per esplorare ulteriormente il legame tra obesità, insulino-resistenza e risposte immunitarie15,16,17. Esperimenti futuri potrebbero incorporare altri tipi di cellule come epatociti, preadipociti, cellule endoteliali o cellule pancreatiche per aumentare ulteriormente la complessità e la rilevanza traslazionale del modello MAAC e studiare il crosstalk tra più tipi di cellule.
Anche se MAAC ha dimostrato di essere superiore nel mantenere la funzionalità e l'identità degli adipociti rispetto ad altri modelli adipociti in vitro, ha anche limitazioni che devono essere considerate. Rispetto all'utilizzo di adipociti differenziati dalle cellule precursori, IL MAAC è un modello più laborioso e dispendioso in termini di tempo. Le piastre con membrane sono anche più costose rispetto alle normali piastre di coltura cellulare. È importante sottolineare che gli adipociti maturi devono essere appena isolati ogni volta al momento della semina e non possono essere espansi o congelati in scorte come le cellule precursori. Pertanto, questo richiede l'accesso a campioni di tessuto adiposo bianco fresco, ma aggiunge anche un livello di complessità derivante dalle variazioni donatrice a donatrice.
Qui abbiamo presentato un protocollo dettagliato per isolare gli adipociti maturi umani e la creazione di MAAC. Abbiamo dimostrato che gli adipociti coltivati come MAAC rimangono vitali per due settimane, la loro firma genica adipogenica è preservata e rispondono all'agonismo farmacologico diversificato. L'uso di MAAC consente lo studio degli adipociti del betweeen cross-talk e di altri tipi di cellule, e la valutazione dei cambiamenti fenotipici a lungo termine degli adipociti maturi in risposta a diversi stimoli.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Xiao-Rong Peng e Stefan Hallen per aver fornito risorse e ottimizzato l'isolamento degli adipociti, Martin Uhrbom per l'assistenza tecnica e Daniel Olausson e Malin L'nn per aver coordinato e fornito l'umano.
Materiali
| Name | Company | Catalog Number | Comments |
| Autoclaved scissors | |||
| Autoclaved spoons | |||
| Autoclaved tweezers | |||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A6003 | |
| Buffer RLT | QIAGEN | 79216 | Lysis buffer |
| CaCl2*2H2O | Sigma-Aldrich | C7902 | |
| Conical tubes, 50 mL | |||
| D-(+)-Glucose | Sigma-Aldrich | G7528 | |
| DMEM/F-12 | Gibco | 31331-028 | |
| Fetal bovine serum (FBS) | Gibco | 10270-106 | |
| Filter flask 0.2 µm pore size, 75 mm | Thermo Scientific | 156-4020 | 500 mL |
| Filter flask 0.2 µm pore size, 75 mm | Thermo Scientific | 158-0020 | 1000 mL |
| HBSS+CaCl2+MgCl2 | Gibco | 14065-49 | |
| HEPES buffer solution (1M) | Gibco | 15630-056 | |
| High-Capacity cDNA Reverse Transcription kit | Applied Biosystems | 4368814 | |
| Insulin (Actrapid Penfill) | Novo Nordisk A/S | ||
| KCl | Merck | 104936 | |
| KH2PO4 | Merck | 104873 | |
| Medium 199 | Gibco | 10012-011 | |
| Mesh filter (250 µM) | Sintab AB | 6111-025043 | |
| MgSO4*7H2O | Sigma-Aldrich | M1880 | |
| NaCl | Sigma-Aldrich | S7653 | |
| Needles, 18 G, 1.20 mm x 40 mm | Sterican | 613-2948 | |
| Pencillin-Streptomycin (Penn/Strep) | Gibco | 15140 | |
| Petri dishes, 150 mm x 21 mm | Thermo Scientific | 168381 | |
| Power SYBR Green PCR master mix | Applied Biosystems | 4367659 | |
| Quantstudio 7 Flex Real-Time PCR machine | Applied Biosystems | ||
| RNeasy Mini kits | QIAGEN | 74106 | |
| Separation funnel | VWR | 527-0008 | For large scale preparation |
| Separation funnel | VWR | 527-0005 | For small scale preparation |
| Shaking incubator (37 °C) | |||
| Syringes, 5 mL | Omnifix | 612-2892 | 100 st |
| Tissue culture incubator (37 °C, 5% CO2) | |||
| Transwells, 24-well (6.5 mm) | Costar | 3397 | Permeable membrane inserts |
| TRIzol reagent | Invitrogen | 10296010 | Lysis buffer |
| Type 2 Collagenase | Worthington | LS004177 |
Riferimenti
- Guilherme, A., Virbasius, J. V., Puri, V., Czech, M. P. Adipocyte dysfunctions linking obesity to insulin resistance and type 2 diabetes. Nature Reviews Molecular Cell Biology. 9 (5), 367-377 (2008).
- Rosen, E. D., Spiegelman, B. M. What we talk about when we talk about fat. Cell. 156 (1-2), 20-44 (2014).
- Lotta, L. A., et al. Integrative genomic analysis implicates limited peripheral adipose storage capacity in the pathogenesis of human insulin resistance. Nature Genetics. 49 (1), 17-26 (2017).
- Gustafson, B., Hedjazifar, S., Gogg, S., Hammarstedt, A., Smith, U. Insulin resistance and impaired adipogenesis. Trends in Endocrinology and Metabolism. 26 (4), 193-200 (2015).
- Gesta, S., et al. Culture of human adipose tissue explants leads to profound alteration of adipocyte gene expression. Hormone and Metabolic Research. 35 (3), 158-163 (2003).
- Fain, J. N., Cheema, P., Madan, A. K., Tichansky, D. S. Dexamethasone and the inflammatory response in explants of human omental adipose tissue. Molecular and Cellular Endocrinology. 315 (1-2), 292-298 (2010).
- Lessard, J., et al. Characterization of dedifferentiating human mature adipocytes from the visceral and subcutaneous fat compartments: fibroblast-activation protein alpha and dipeptidyl peptidase 4 as major components of matrix remodeling. PLoS One. 10 (3), e0122065 (2015).
- Asada, S., et al. Ceiling culture-derived proliferative adipocytes retain high adipogenic potential suitable for use as a vehicle for gene transduction therapy. American Journal of Physiology - Cell Physiology. 301 (1), C181-C185 (2011).
- Shen, J. F., Sugawara, A., Yamashita, J., Ogura, H., Sato, S. Dedifferentiated fat cells: an alternative source of adult multipotent cells from the adipose tissues. International Journal of Oral Science. 3 (3), 117-124 (2011).
- Harms, M. J., et al. Mature Human White Adipocytes Cultured under Membranes Maintain Identity, Function, and Can Transdifferentiate into Brown-like Adipocytes. Cell Reports. 27 (1), 213-225 (2019).
- Wang, Q. A., Scherer, P. E., Gupta, R. K. Improved methodologies for the study of adipose biology: insights gained and opportunities ahead. Journal of Lipid Research. 55 (4), 605-624 (2014).
- Gregoire, F. M., Smas, C. M., Sul, H. S. Understanding adipocyte differentiation. Physiological Reviews. 78 (3), 783-809 (1998).
- Ruiz-Ojeda, F. J., Ruperez, A. I., Gomez-Llorente, C., Gil, A., Aguilera, C. M. Cell Models and Their Application for Studying Adipogenic Differentiation in Relation to Obesity: A Review. International Journal of Molecular Sciences. 17 (7), 1040 (2016).
- McBeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell shape, cytoskeletal tension, and RhoA regulate stem cell lineage commitment. Developmental Cell. 6 (4), 483-495 (2004).
- Lackey, D. E., Olefsky, J. M. Regulation of metabolism by the innate immune system. Nature Reviews Endocrinology. 12 (1), 15-28 (2016).
- Saltiel, A. R., Olefsky, J. M. Inflammatory mechanisms linking obesity and metabolic disease. The Journal of clinical investigation. 127 (1), 1-4 (2017).
- Lee, Y. S., Wollam, J., Olefsky, J. M. An Integrated View of Immunometabolism. Cell. 172 (1-2), 22-40 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon