Method Article
Dreidimensionale Bildgebung der wirbelförmigen lymphatischen Vaskulatur und Drainage mit iDISCO+ und Lichtbogenfluoreszenzmikroskopie
In diesem Artikel
Zusammenfassung
Ein Protokoll wird vorgestellt, das gewebeclearing mit Derobogenfluoreszenzmikroskopie (LSFM) kombiniert, um dreidimensionale und zelluläre Auflösungsbilder der Lymphgefäße und Lymphknoten (LNs) zu erhalten, die die Zerebrospinalflüssigkeit (CSF) und die spinale Epiduralanflüssigkeit sammeln.
Zusammenfassung
Das lymphatische System, das mit dem zentralen Nervensystem (ZNS) assoziiert ist, umfasst die lymphatische Vaskulatur, die sich um das Gehirn, das Rückenmark und die zugehörigen LNs dreht. Das ZNS-assoziierte Lymphsystem ist an der Drainage von CSF-Makromolekülen und meningenalen Immunzellen in ZNS-entwässernde LNs beteiligt, wodurch die Abfallabfertigung und Immunüberwachung innerhalb von ZNS-Geweben reguliert wird. Präsentiert wird ein neuartiger Ansatz, um dreidimensionale (3D) und zelluläre Auflösungsbilder von ZNS-assoziierten Lymphatten zu erhalten und gleichzeitig die Integrität ihrer Schaltkreise innerhalb des umgebenden Gewebes zu erhalten. Das iDISCO+ Protokoll wird verwendet, um lymphatische Gefäße in entkalkten und gereinigten ganzen Mount-Präparaten der Wirbelsäule zu immunisieren, die anschließend mit Lichtblattfluoreszenzmikroskopie (LSFM) abgebildet werden. Die Technik zeigt die 3D-Struktur des lymphatischen Netzwerks, das die Meningeal- und Epiduralräume um das Rückenmark mit extravertebralen Lymphgefäßen verbindet. Zur Verfügung gestellt werden 3D-Bilder der Drainagekreise von molekularen Tracern, die zuvor entweder über die Zisterne magna oder das Thorakolumbar-Spinalparenchym in das CSF injiziert wurden. Der iDISCO+/LSFM-Ansatz bietet beispiellose Möglichkeiten, die Struktur und Funktion des ZNS-assoziierten Lymphsystems in der neurovaskulären Biologie, Neuroimmunologie, Hirn- und Wirbelkrebs oder Wirbelknochen- und Gelenkbiologie zu erforschen.
Einleitung
Das ZNS ist von dem CSF umgeben und überlagert Schichten von Meningen, Epiduralgewebe und Knochen. Insgesamt bietet das CSF physischen Schutz für das weiche Gehirn und das Rückenmark. Es wird hauptsächlich durch den Aderhautplexus und die Meningealmembranen (d.h. die Pia mater, das Arachnoid und die Dura mater) abgesondert. Der CSF-Meningealkomplex schafft auch eine funktionelle Schnittstelle zwischen dem ZNS-Gewebe und dem Rest des Körpers und trägt so zur ZNS-Homöostase bei. Zunächst dringt das CSF durch das CNS-Parenchym durch die Paraarterienräume des ZNS und interagiert dynamisch mit der interstitiellen Flüssigkeit (ISF)1 über das glymphatische (glia-lymphatische) System, das aus den paravaskulären Räumen und den Astrozyten-Endfüßen um die CNS-Gefäße2,3,4besteht. Stoffwechselabfälle und überschüssige Flüssigkeit werden dann letztlich durch intramurale perivaskuläre Drainage direkt aus dem Hirnparenchym in Richtung des systemischen Kreislaufs3, sowie die paravenösen Räume in Richtung DES CSF und über Brain-Draining Lymphgefäße, nach dem glymphatischen Modell2,4. Der CSF-Abfluss erfolgt hauptsächlich über das Lymphsystem, durch die Cribriform-Platte und die damit verbundenen extrakraniellen Lymphgefäße5,6,7, sowie durch die meningealen Lymphgefäße, die an den Braindraining LNskonvergieren 8,9,10,11,12 ( Abbildung1). Eine wichtige, wenn auch sekundäre Rolle im CSF-Abfluss spielt die Schädelarachnoid-Zotten, die in die Lücke der meningealvenösen Nebenhöhlen eindringen13.
Die CFS-Drainagekreise wurden durch experimentelle Ansätze, die auf der Injektion von farbigen/fluoreszierenden Tracern in das ZNS oder CSF basierten, ausgiebig untersucht, gefolgt von der Abbildung des Musters der Tracer im ZNS und in den gesamten Organen und Geweben des Körpers zu verschiedenen Zeitpunkten nach der Injektion13. Lange Zeit galt der Abfluss von CSF als ausschließlich und direkt von der Durchblutung übernommen, durch Arachnoidezotten, die in durale venöse Nebenhöhlen projiziert wurden13. Allerdings wird der CSF-Abfluss überwiegend durch die lymphatische Vaskulatur durchgeführt, wie kürzlich durch die dynamische Nahinfrarot-Bildgebung (NIR) des CSF-injizierten Tracertransports bei Mäusen9,10gezeigt wurde. Die CSF-entwässernden Lymphgefäße kehren dann über die rechte subklavische Vene in den Blutkreislauf zurück. Ergänzende Approchen haben sowohl extrakranielle6,7,13 als auch intrakranielle9,10,11,12 lymphatische Ausgänge von CSF-injizierten Tracern nachgewiesen und deuten darauf hin, dass das CSF von zwei lymphatischen Bahnen absorbiert wird, einer extern erund der andere innerhalb der Schädel- und Wirbelsäule. Der Hauptteil der CSF-Drainage tritt schnell durch lymphatische Gefäße rostral, außerhalb des Schädels in der Nasenschleimhaut, durch Kanäle der cribriformen Platte des Ethmoidknochens3,6,13 und, kauarisch, außerhalb von lumbosakralen Wirbelknochen durch dorsolaterale Routen, die noch nicht vollständig charakterisiert sind7,14. Darüber hinaus absorbieren lymphatische Kapillaren der Dura mater in den Hirnhäuten des Schädels direkt CSF- und Meningeal-Immunzellen in Richtung duraler Lymphkollektoren, die die Schädelknochen kreuzen und sich mit ZNS-entwässernden LNs12,14verbinden. Diese meningealen Lymphgefäße spielen eine wichtige Rolle in der ZNS Pathophysiologie, weil Gehirn Meningeal-Lymphatik enden nach dem Altern verändert und auch das Ergebnis von neurologischen Gehirnerkrankungen beeinflussen, einschließlich Neurodegeneration, Neuroinflammation, und Hirntumor15,16,17. Daher kann die CNS-assoziierte lymphatische Vaskulatur (d. h. die duralen und peripheren Lymphgefäße, die das CSF entwässern) ein vielversprechendes neues Ziel zur Bekämpfung von ZNS-Erkrankungen beim Menschen sein.
Konvergente Studien, die mit Immunohistologie und hochauflösender Magnetresonanztomographie durchgeführt wurden, zeigten, dass die meningeale lymphatische Vaskulatur auch bei Primaten existiert, einschließlich gemeinsamer Marmosetaffen und Menschen7,11,13. Darüber hinaus sind meningeale Lymphgefäße nicht auf den Schädel beschränkt, sondern erstrecken sich innerhalb der Wirbelsäule bis zur Oberfläche von Spinalganglien und Rami13,18. Dreidimensionale (3D) Bildgebung der WirbelsäuleLymphatik, die die allgemeine Anatomie der markierten Wirbel- und Wirbelsäulenproben, einschließlich überlegender Knochen, Muskeln, Bänder, sowie benachbarteviszeraler Gewebe, bewahrt, wurde vor kurzemdurchgeführt 14. Das iDISCO+ Protokoll19,20 wurde verwendet, um entkalkte und gelöschte Präparate der gesamten Wirbelsäule mit lymphatischen spezifischen Antikörpern entweder gegen den Membranrezeptor LYVE121 oder den Transkriptionsfaktor PROX122zu immunlabelieren. Anschließend wurden bildkundigte Mikroskopie (LSFM) und die Imaris-Software mit Lichtbogenfluoreszenzmikroskopie (LSFM) und der Software Imaris erfasst und analysiert. LSFM ermöglicht eine schnelle und minimalinvasive 3D-Bildgebung großer Proben durch axiale Einschließung der Beleuchtung, was zu einer reduzierten Photobleaching und Phototoxizitätführt 23.
Der iDISCO+/LSFM-Ansatz ermöglicht die Charakterisierung der unterschiedlichen Schichten von duralen und epiduralischen Lymphgefäßen und die Verbindung dieser Vaskulatur mit den extravertebralen Lymphkreisen und den LNs, die die Wirbelsäule benachbarten. Das Protokoll wurde auf Gewebe angewendet, die zuvor mit fluoreszierenden Tracern injiziert wurden, um die Wirbelkanalentwässerung zu demonstrieren. Das vorliegende Papier enthält Einzelheiten zur iDISCO+/LSFM-Methodik zur Abbildung der wirbellichen Lymphvaskulatur und veranschaulicht deren Relevanz für die Untersuchung der CSF- und Epiduralflüssigkeitsdrainage.
Protokoll
Alle in dieser Studie angewandten In-vivo-Verfahren entsprachen allen einschlägigen ethischen Vorschriften für Tierversuche und -forschung gemäß den Leitlinien der Europäischen Gemeinschaft für die experimentelle Verwendung von Tieren (L358-86/609EEC). Die Studie wurde vom Ethikausschuss des INSERM (n°20161101111126651) und dem Institutional Animal Care and Use Committee des ICM (Institut du Cerveau et de la Moelle épiniére) ethisch genehmigt.
1. Vorbereitung
- Bereiten Sie die folgenden Sezierwerkzeuge für die Chirurgie vor: Skalpell (1), Mikrozange (2), Zangen (1), Sezierschere und Michel-Nähte.Com Bereiten Sie 26 G Nadeln (0,45 mm x 13 mm), 1 ml Spritze und 10 l Mikrospritze vor.
- Ziehen Sie Mikrokapillaren mit einem einstufigen Protokoll bei 67,5 °C mit einem Glas-Mikropipette-Zieher. Bereiten Sie zwei Mikrokapillaren pro Injektion vor.
- Reagenzien für die bildgebende Lymphdrainage vorbereiten (Tabelle 1): Ovalbumin Alexa Fluor 555 Konjugat (OVA-A555, 2 mg/ml in 1x Phosphat gepufferter Saline [PBS]) und Anti-LYVE1-Antikörper (1 mg/ml in 1x PBS).
- Antikörper vorbereiten (Tabelle 1) für iDISCO+. Verwenden Sie für primäre Antikörper polyklonale Antikörper anti-LYVE1 Kaninchen (1:1.600) und Anti-PROX1-Ziegen-Polyklon-IgG-Antikörper (1:2.000). Für sekundäre Antikörper verwenden Sie Alexa Fluor Esel Anti-Kaninchen-568, Esel Anti-Kaninchen-647, und Esel Anti-Ziege-647 (1:2.000).
2. Chirurgische Eingriffe bei Intrazistern-Magna(ICM) und Thorakolumbar-Injektionen (ThLb)
- Vorbereitung des Tieres auf die Operation
- Verwenden Sie erwachsene männliche und weibliche C57BL6/J-Mäuse, 8–12 Wochen alt.
- Injizieren Sie die Maus intraperitoneal (IP) mit 0,015 mg/ml Buprenorphinlösung in 0,9% Natriumchlorid bei 0,1 mg/kg, 15 min vor der Operation verdünnt.
- Anästhetisieren Sie die Maus in einer Induktionsbox mit 2–3% Isoflurangas.
- Zubereitung eines anästhesierten Tieres zur Tracer-Injektion
- Legen Sie die anästhesierte Maus und ihr Heizkissen auf das stereotaxic Gerät. Verwenden Sie Ohrstangen, um den Kopf der Maus zu halten, und legen Sie den Körper in einem Winkel von 135° zum Kopf oder immobilisieren Sie das Rückenmark auf der ThLb-Wirbelebene (Th12-L1) mit einem Wirbelsäulenadapter. Kneifen Sie den Schwanz oder die Pfote mit dem Zangen, um die Effizienz der Anästhesie zu überprüfen.
- Injizieren Sie IP 200 l von 0,9 % Natriumchlorid für die Hydratation der Maus.
- Mit einem Skalpellklinge, machen Sie einen Hautschnitt, entweder in der okzipitalen Region in Richtung der Zervix-Region für ICM-Injektion, oder auf der ThLb Wirbelebene (Th10-L3) für die Injektion in das ThLb Spinalparenchyma.
- Tracer-Injektion
- Entsorgen Sie parazervikale und paraspinale Muskeln, die den Hals und die Säule bedecken, um die Oberfläche der Dura mater, der äußersten Schicht der Meningen, zu visualisieren.
- Sorgfältig durchschlagen den zentralen Bereich der Dura mater und unterlegenArachnoid mit einer 26 G Nadel.
- Mikrokapillarimplantation
- Schneiden Sie 2 mm der Glaskapillarspitze (siehe Schritt 1.2), und verwenden Sie dann die Mikrokapillare, die mit einer Kanüle verbunden ist, die mit einer 10-L-Spritze verbunden ist, um den OVA-A555- oder LYVE1-Antikörper zu aspirieren.
- Führen Sie die Mikrokapillare im medialen Bereich der Dura mater in einem 30°-Winkel für ICM-Injektionen oder 10° Winkel für ThLb-Spinalinjektionen ein und drücken Sie sie auf 1,5 mm unter die Dura mater.
HINWEIS: Das Band ist punktiert, aber es wird keine Laminektomie durchgeführt. - Fügen Sie 10 l chirurgischen Kleber hinzu, um den Schnitt um die Glaskapillare zu schließen und darauf zu warten, dass er trocknet.
- Injizieren Sie den fluoreszierenden Tracer langsam bei 1 l/min. Nach Der Lieferung des Injektionsvolumens halten Sie die Kapillare 1 min an Ort und Stelle. Ziehen Sie die Mikrokapillare zurück und fügen Sie chirurgischen Kleber hinzu, um das Injektionsloch zu schließen.
- Nach der Injektion, schließen Sie die Haut Schnitte mit Nahtclips. Entfernen Sie die Maus aus dem stereotaxic Apparat und legen Sie sie in eine postchirurgische Wärmekammer bei 37 °C, bis sie sich erholt.
3. Perfusion und Gewebesektion
- Bei entweder 15 min oder 45 min nach CSF Tracer-Injektion, injizieren IP eine tödliche Dosis (100 l) Natriumpentobarbital. Kneifen Sie den Schwanz oder die Pfote, um zu überprüfen, ob es keinen Reflex gibt.
- Mit einer Sezierschere die Haut schneiden und die Peritonealschicht aus dem Unterbauchbereich in Richtung Brustkäfig öffnen. Öffnen Sie den Brustkorb mit einer Schere, um Zugang zum Herzen zu haben.
- Setzen Sie die 26 G Nadel in das linke Ventricule des Herzens ein und beginnen Sie mit 20 ml eiskaltem 4% Paraformaldehyd (PFA) in 1x PBS bei 2 ml/min zu durchdringen. Verwenden Sie eine Schere, um schnell das rechte Atrium zu schneiden und den Perfusionsflüssigkeitsstrom freizusetzen.
- Entfernen Sie die Haut vollständig mit Zangen und schneiden Sie die vier Beine mit einer Schere. Entfernen Sie alle inneren Organe, aber achten Sie darauf, die LNs intakt zu erhalten.
HINWEIS: Mandibular-LNs sind oberflächlich, also achten Sie darauf, sie nicht zu entfernen, wenn Sie die Haut abschneiden. Tiefzervikale LNs (dcLNs) befinden sich auf jeder Seite der Luftröhre, in Kontakt mit der seitlichen Oberfläche der inneren Jugularvenen und in der Nähe der stereomastoiden Muskeln. - Schneiden Sie die Rippen, um die Wirbelsäule mit dem Rückenmark innen vom Gebärmutterhals bis zu den Lendensegmenten zu entfernen.
- Tauchen Sie das sezierte Gewebe in eiskalte 4% PFA in 1x PBS über Nacht (ca. 18 h) bei 4 °C in ein 50 ml Rohr ein. Waschen Sie die festen Gewebe 3x in 50 ml 1x PBS für 5 min.
4. Fluoreszenzmakroskopie eines Wirbelsegments
- Positionieren Sie die Probe unter dem Fluoreszenz-Stereozoommikroskop mit einer Kamera (Materialtabelle). Werfen Sie einen Überblick über das Beispiel oder zoomen Sie auf eine bestimmte Region.
5. Probenvorbereitung für die gesamte Mount-Immunostainierung
- Mit einer Mikrotom-Klinge schneiden Sie die Kopf- und Wirbelsäule quer auf der okzipitalen und zervikalen Ebene.
HINWEIS: Diese Sezierung ermöglicht die Isolierung des Kopfes und des Halswirbelbereichs vom Rest der Wirbelsäule. - Mit einer Mikrotom-Klinge schneiden Sie die Hals-, Thorakolumbar- und Sakralbereiche der Wirbelsäule transversal in Segmente von 2 x 4 Wirbeln, jeweils etwa 0,5 cm groß.
- Isolieren Sie jedes Segment in der Reihenfolge, in der es von der Wirbelachse getrennt wurde, entlang der gesamten Länge der Hals- und Brustbereiche der Wirbelsäule. Bewahren Sie jede Probe in einem Rohr von 2 ml 1x PBS auf.
6. iDISCO+ ganze Mount-Immunostainierung eines Wirbelsegments
HINWEIS: Die detaillierte Beschreibung des iDISCO+ Protokolls ist unter http://www.idisco.info zugänglich.
- Tag 1: Gewebeaustrocknung
- Dehydrieren Sie Wirbelgewebeproben (d. h. ein Wirbelsegment) durch aufeinanderfolgendes Eintauchen in 20%, 40%, 60%, 80% und 100% Methanol in 1x PBS für 1 h mit Rührung.
- Inkubieren Sie die Proben über Nacht in einer Lösung von 33% Methanol/66% Dichlormethan (DCM) bei Raumtemperatur (RT) mit Rührung.
- Tag 2: Gewebebleiche
- Proben 2x mit 100% Methanol für 1 h bei RT waschen. Inkubieren Sie die Proben in 5%H2O2 in Methanol (30%H2O2 und Methanol 1:5 v/v) bei 4 °C über Nacht.
- Tag 3: Entkalkungs- und Permeabilisierungsschritt
- Rehydrieren Sie die Proben schrittweise in 80%, 60%, 40%, 20% Methanol, dann in 1x PBS (1 h in jeder Lösung) bei RT mit Rührung.
- Entkalkung der Wirbel durch Inkubation von Proben in Morse-Lösung (10% Trinatriumcitrat und 45% Ameisensäure 1:1 v/v) für 30 min bei RT zur Erhaltung der Knochenstruktur.
- Spülen Sie die Proben 2x mit 1x PBS und inkubieren 2x für 1 h in PTx2-Lösung (0,2% Triton X-100 in 1x PBS, erneuern für die zweite Inkubation) bei RT mit Rührung. Dann inkubieren Sie die vorbehandelten Proben in Permeabilisationslösung (PTx2 mit 20% Dimethylsulfoxid [DMSO] und 2,3% w/v Glycin) bei 37 °C für 24 h.
- Tag 4: Blockierungsschritt
- Inkubieren Sie Proben in Blockierlösung (PTx2 mit 6% Eselsserum und 10% DMSO) bei 37 °C für 24 h.
- Tage 5-16: Ganzer Mount Immunolabeling
- Inkubieren Sie Proben in primärer Antikörper in PTwH verdünnt (1x PBS mit 0,2% Tween-20 und 0,1% Heparin bei 10 mg/ml in 1x PBS) mit 5% DMSO/3% Eselserum bei 37 °C für 6 Tage. Waschen Sie proben 4-5x in PTwH bei RT mit Aufregung über Nacht.
- Inkubieren Sie Proben in sekundären Antikörperverdünnungen in PTwH mit 3% Eselserum bei 37 °C für 4 Tage. Waschen Sie Proben in PTwH 4x 5x bei RT über Nacht unter Erregung, bevor sie gelichtet werden.
- Tage 17 und 18: iDISCO+ Geweberäumung
- Dehydrieren Sie proben schrittweise durch aufeinanderfolgendes Eintauchen in 1x PBS, dann 20%, 40%, 60%, 80% und 2x in 100% Methanol (1 h in jeder Lösung). Inkubieren Sie jede Probe über Nacht in einer Lösung von 33% Methanol/66% DCM.
- Waschen Sie 2x in 100% DCM für 15 min, um das Methanol zu entfernen. Indibenzylether (DBE) ohne Schütteln bis zum Löschen (4 h) inkubieren und dann vor der Bildgebung in DBE bei RT lagern.
7. LSFM-Bildgebung
- Bildgelöschte Proben in einer Querebene mit dem LSFM mit einem 4x/0.3 Objektiv.
- Verwenden Sie eine einseitige Drei-Blatt-Beleuchtungskonfiguration, feste x-Position (keine dynamische Fokussierung). Verwenden Sie LED-Laser auf 561 nm, 100 mW; und 639 nm, 70 mW. Stellen Sie die numerische Blende des Lichtblatts auf 30 % ein.
- Verwenden Sie verschiedene Emissionsfilter: 595/40 für Alexa Fluor-568 oder -555 und -680/30 für Alexa Fluor-647.
- Füllen Sie die Mikroskopkammer mit DBE.
- Quire Stapel mit 2,5 'm z Schritten und einer Belichtungszeit von 30 ms pro Schritt mit der Kamera (Tabelle der Materialien). Verwenden Sie den optischen x2-Zoom für eine effektive Vergrößerung von (x8), 0,8 m/Pixel, und führen Sie die Mosaik-Erfassungen mit einer 10%-Überlappung auf dem gesamten Frame durch.
- Erfassen Sie Bilder im .tif-Format mit Akquisitionssoftware und konvertieren Sie sie mit einer Dateikonvertierungssoftware in s3D-Format.
- Rekonstruieren Sie mosaiksacquisition mit Stitcher Software (Tabelle der Materialien). Öffnen Sie die Bilder, und verschieben Sie sie manuell, um das gesamte Mosaikbild zu rekonstruieren, indem Sie die 10%-Überlappung zwischen Bildern als Richtlinie verwenden.
- Verwenden Sie die 3D-Software (Tabelle der Materialien), um orthogonale Projektionen von Daten zu generieren, wie in Abbildung 1, Abbildung 2, Abbildung 3und Abbildung 4dargestellt , und fügen Sie den lymphatischen Gefäßen und den anderen angezeigten anatomischen Strukturen ein Farbcodeattribut hinzu. Stellen Sie eine Gammakorrektur von 1,47 auf die Rohdaten des LSFM gemäß den Anweisungen des Herstellers ein.
Ergebnisse
3D-Bildgebung der wirbellymphen Vaskulatur
Abbildung 1 zeigt die Schritte des iDISCO+/LSFM-Verfahrens und ein LSFM-Bild von Lymphkreisläufen innerhalb des Wirbelkanals von iDISCO+-behandelten ThLb-Wirbeln. Die Kombination von iDISCO+ mit LSFM bewahrte die Wirbelanatomie und erfasste einen Blick auf das lymphatische Gefäßnetz (d.h. die intravertebralen Gefäße, die mit den extravertebralen Gefäßen verbunden sind, die dorsal und seitlich aus dem Wirbelkörper ausscheiden) in den umgebenden Knochen, Bändern, Muskeln und Nervenganglien.
Fluoreszenz-Makroskopie-Bildgebung der dcLN-Drainage
Um die Makromoleküldrainage im ZNS-assoziierten Lymphsystem abzubilden, wurden makromolekulare Tracer in vivo durch Injektion in das CSF oder das Spinalparenchym verwaltet. Ein makromolekularer Tracer kann leicht in das CSF an der Cisterna magna abgegeben werden. Die Zisterne magna befindet sich zwischen dem Kleinhirn und der dorsalen Oberfläche der Medulla oblongata, über dem Foramen magnum. Makromolekularer Tracer kann auch durch stereotaktische Chirurgie auf verschiedenen Ebenen entlang der Wirbelsäule in das Spinalparenchym injiziert werden.
Die verwendeten makromolekularen Tracer wurden entweder direkt mit einem Fluorophor beschriftet oder durch Immunhistochemie mit spezifischen Antikörpern postmortem nachgewiesen. Abbildung 2A zeigt den Versuchsplan zur Verfolgung von OVA-A555, einem roten fluoreszierenden und kleinen Molekulargewicht-Tracer (ca. 45 kDa), der entweder in das CSF (Abbildung 2B) oder in den ThLb-Bereich des Rückenmarks injiziert wurde (Abbildung 2C).
Nach 45 min nach der makromolekularen Tracer-Injektion wurden die Mäuse geopfert, mit 4% PFA durchdrungen und verarbeitet, um sezierte Segmente des Hirnstammbereichs des Kopfes und der Wirbelsäule zu isolieren, die entkalkt und geklärt wurden. Die Makromoleküldrainage wurde dann leicht durch Fluoreszenz-Makroskopie-Bildgebung der LNs, die das CSF und epidurale Flüssigkeiten sammeln, bewertet. Wie in Abbildung 2dargestellt, führte die INJEKTION von OVA-A555 entweder in den CSF - Abbildung2B) oder den ThLb -Abbildung 2C) Bereich des Rückenmarks zu einer OVA-A555-Akkumulation in die DCLNs bei 45 min nach der Injektion. Diese Beobachtung zeigt die Aufnahme und Drainage von fluoreszierenden Tracer durch das Lymphsystem; es ist eine Voraussetzung, bevor das iDISCO+/LSFM Verfahren verfolgt wird, um die Wirbellymphdrainage abzubilden.
3D-Bildgebung der Makromoleküldrainage im Wirbellymphsystem
Basierend auf dem Nachweis der OVA-A555-Kennzeichnung in dcLNs konnte das iDISCO+/LSFM-Verfahren auf entkalkte und vorgereinigte Wirbelproben angewendet werden, die von OVA-A555-injiziertenMäusen isoliert wurden. Dieser Ansatz ermöglichte die Erstellung einer 3D-Karte der Lymphdrainage von CSF und spinaler Epiduralanflüssigkeit zu einem bestimmten Zeitpunkt nach der Tracer-Injektion. Diese 3D-Zuordnung könnte durch DieAbbildung aufeinander folgender ZNS-Segmente auf jeder Wirbelsäulenebene vom Injektionspunkt aus durchgeführt werden.
Abbildung 3A zeigt das experimentelle Design für die OVA-A555-Injektion in das ThLb-Spinalparenchyma und das resultierende 3D-Muster der OVA-A555-Verteilung in einem Hals- und einem Brustwirbelsegment in Verbindung mit der lymphatischen Vaskulatur. Nach 45 min nach der INJEKTION VON OVA-A555 wurde die OVA-A555 Akkumulation in Rückenmarksgeweben und DCLNs (weiße Pfeile in Abbildung 3B) in Übereinstimmung mit den in Abbildung 2dargestellten Mikroskopbeobachtungen nachgewiesen. Es wurde jedoch nicht in der zervikalen und thorakalen Lymphvaskulatur mit Anti-LYVE1-Antikörpern gekennzeichnet nachgewiesen. Das Fehlen eines CSF-injizierten Tracers in den wirbelförmigen Lymphgefäßen kann entweder auf eine kurze Persistenzzeit des Tracers in Lymphgefäßen oder auf eine fehlende Aufnahme des Tracers durch die Lymphgefäße zurückzuführen sein (Abbildung 3C).
Um die erste Hypothese zu testen, wurde der Kaninchen-Anti-LYVE1-Antikörper als lymphatisches Endothelzell-Tag verwendet, um ZNS-assoziierte Lymphgefäße zu binden. Der injizierte Kaninchen-Anti-LYVE1-Antikörper wurde anschließend durch Immunhistochemie mit einem Anti-Kaninchen-Sekundärantikörper nachgewiesen, während lymphatische Endothelzellen mit Anti-PROX1-Antikörpern immunmarkiert waren. Abbildung 4 zeigt die experimentelle Entwicklung der Anti-LYVE1-Injektion in das ThLb-Spinalparenchyma (Abbildung 4A) und das resultierende 3D-Verteilungsmuster von LYVE1-Antikörpern in einem ThLb-Segment in der Nähe der Injektionsstelle in Bezug auf PROX1+ Lymphatik (Abbildung 4B). Sowohl Wirbellymphatiker als auch ihre extravertebralen lymphatischen Verbindungen wurden durch injizierte Anti-LYVE1-Antikörper gekennzeichnet, die die Traceraufnahme durch Wirbellymphgefäße und die lymphatische Drainage zum extravertebralen Lymphsystem untermauerten. LNs fehlten im ThLb-Bereich und konnten daher im abgebildeten Segment nicht visualisiert werden. Darüber hinaus spiegelte das diskontinuierliche Muster des LYVE1-Markers, das entlang lymphatischer Gefäße beobachtet wurde, wahrscheinlich die diskontinuierliche Expression von LYVE1 in der lymphatischen Vaskulatur wider, wie in früheren Studien14,21berichtet. Insgesamt zeigten die Ergebnisse der vorliegenden Studie, dass nach 45 min nach der Tracer-Injektion der LYVE1-Antikörper, aber nicht OVA-A555,den Nachweis der lokalen Wirbellymphaufnahme ermöglichte und OVA-A555 als persistenter Marker der lokalen Wirbellymphdrainage bevorzugt war.
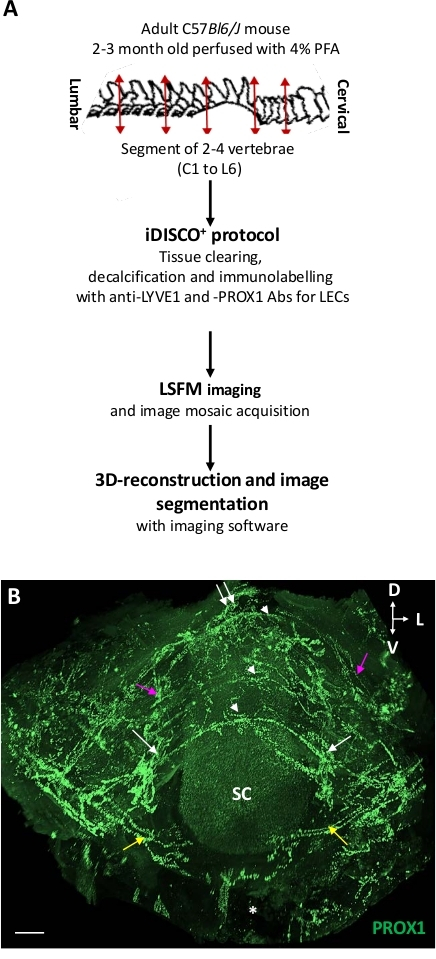
Abbildung 1: Dreidimensionale Ansicht der wirbellymphen Vaskulatur. (A) Schematische Darstellung des Protokolls. (B) Planare Projektion einer 3D-Ansicht der Wirbellymphatur ThLb aus dorsofrontaler Perspektive. Lymphgefäße wurden mit dem Anti-PROX1-Antikörper (grün) mit dem iDISCO+ Protokoll immunmarkiert und dann von LSFM abgebildet. Beachten Sie das metamerische Muster der Vaskulatur innerhalb des Wirbelkanals von drei aufeinanderfolgenden Wirbeln (weiße Pfeilspitzen). Neben halbkreisförmigen dorsalen Gefäßen (weiße Pfeilspitzen) umfasste jedes Wirbelnetz ventrale Zweige (gelbe Pfeile), bilaterale seitliche Austrittswege entlang der Spinalrami und Ganglia (weiße Pfeile) sowie eine dorsale Ausstiegsroute an der Mittellinie (weißer Doppelpfeil). Wirbelnetze wurden mit einem Längsgefäß (lila Pfeile) verbunden. Eine vollständige Beschreibung finden Sie unter Jacob L. et al.18 SC = Rückenmark; Sternchen = ventraler Wirbelkörper; D = dorsal; L = seitlich; V = ventral; Skalenbalken = 300 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
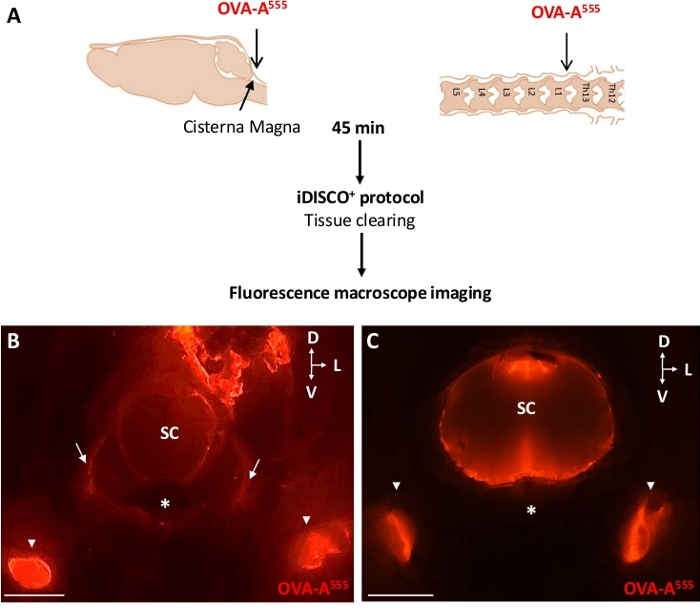
Abbildung 2: dcLNs gesammelt OVA-A555-markierte CSF-Flüssigkeiten. (A) Schema des Versuchsentwurfs. OVA-A555 wurde entweder in das ICM oder das ThLb Spinalparenchym injiziert, dann wurden Mäuse 45 min nach der Injektion geopfert. Die Proben wurden durch Fluoreszenz-Makroskop-Bildgebung (B,C) gelöscht und beobachtet. Fluoreszenz-Makroskopbilder von Halswirbeln von ICM- (B) und ThLb- (C) injizierten Mäusen. Beachten Sie, dass sich OVA-A555 in den DCLNs (B,C, weiße Pfeilspitzen), den pialen und paravaskulären Räumen des Halsrückenmarks (B,C) und nach der ICM-Injektion, in ventrolateralen Ausstiegswegen, wahrscheinlich entlang der Halsnerven (B, weiße Pfeile) angesammelt hat. SC = Rückenmark. Sternchen = ventraler Wirbelkörper; D = dorsal; L = seitlich; V = ventral; Skalieren Sie Balken in B und C = 2 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
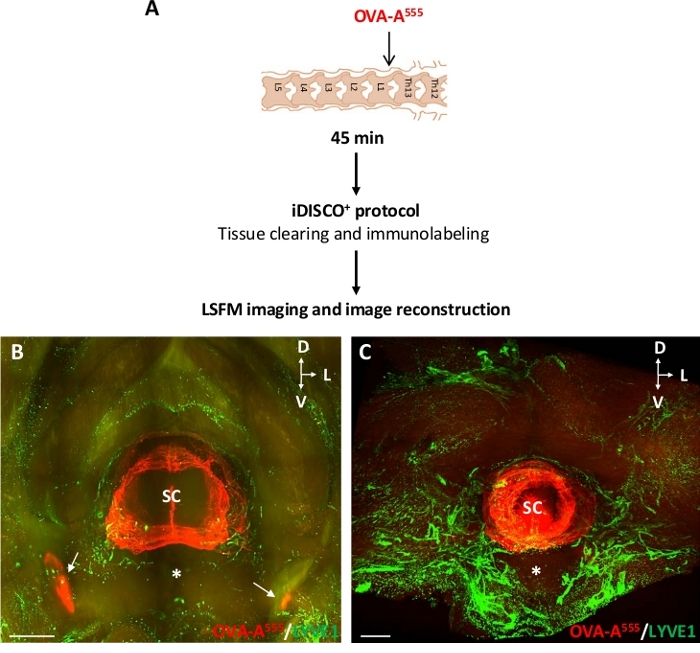
Abbildung 3: Nachweis von OVA-A555-markierten CSF-Flüssigkeiten im Wirbellymphsystem. (A) Schema des Versuchsentwurfs. OVA-A555 wurde in das ThLb Spinalparenchym injiziert, dann wurden Mäuse nach 45 min nach der Injektion geopfert. Die Proben wurden mit dem iDISCO+ Protokoll behandelt und mit einem LSFM abgebildet. (B,C) Planare Projektionen von LSFM-erfassten frontalen 3D-Ansichten von zervikalen (B) und brustförmigen (C) Wirbelsäulensegmenten. OVA-A555 Akkumulation (rot) wurde in Rückenmarksgeweben und DCLNs (B, weißer Pfeil) nachgewiesen, wie in Abbildung 2dargestellt, aber nicht in der zervikalen und thorakalen lymphatischen Vaskulatur, die hier mit Anti-LYVE1-Antikörpern (grün) immunomarkiert ist. SC = Rückenmark; Sternchen = ventraler Wirbelkörper; D = dorsal; L = seitlich; V = ventral; Skalenstäbe = 1 mm (B), 300 m (C). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
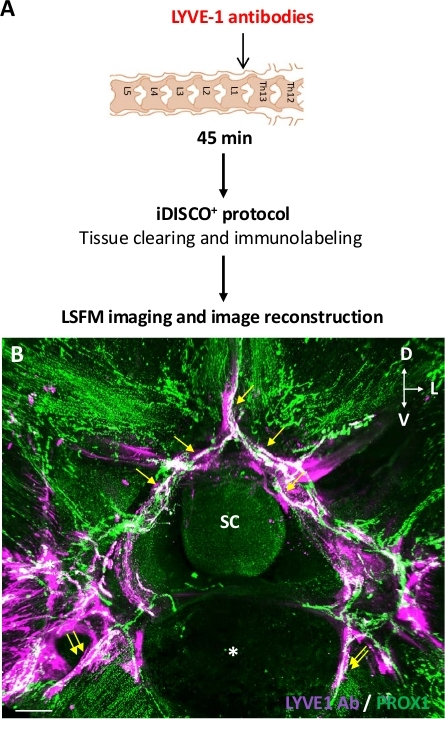
Abbildung 4: Nachweis der wirbellichen Lymphdrainage nach intraspinaler Injektion von Anti-LYVE1-Antikörpern. (A) Schema des Versuchsentwurfs. Anti-LYVE1-Antikörper wurden in das ThLb-Spinalparenchym injiziert, dann wurden Mäuse 45 min nach der Injektion geopfert. Die Proben wurden mit dem iDISCO+ Protokoll behandelt und mit einem LSFM abgebildet. (B). Planare Projektionen von frontalen 3D-Ansichten eines ThLb (B) Wirbelsäulensegments, aufgenommen mit einem LSFM. Anti-LYVE1-Antikörper wurden mit Anti-Kaninchen-Antikörpern (lila) und der lymphatischen Vaskulatur mit Anti-PROX1-Antikörpern (grün) nachgewiesen. Weiße Gefäße sind PROX1+ Lymphatiken, die mit Anti-LYVE1-Antikörpern (B) koaktiv gekennzeichnet sind. Dazu gehören Wirbel (gelbe Pfeile) und extravertebrale (doppelte gelbe Pfeile) Lymphatik. SC = Rückenmark; Sternchen = ventraler Wirbelkörper; D = dorsal; L = seitlich; V = ventral; Skalenbalken = 300 m (B). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Reagenzien | Ziel | Abbildung | Protokollschritt | Kommentar |
| OVA-A555 | CSF-Tracer | Abbildung 2 und Abbildung 3 | 2. ICM- oder ThLb-Injektion 7. LSFM-Bildgebung. | Wasserlöslich, leicht zu injizieren und hohe intensive Fluoreszenz |
| Anti-Lyve1 Antikörper | Membranmarker von LVs-Zellen | Abbildung 3 | 6. iDISCO+ ganze Halterung immnunostaining. 7. LSFM-Bildgebung. | Effizienter Antikörper gegen ganze Mount-Immnunostaining |
| Tracer-Drainage der Dural- und Epidural-LVs | Abbildung 4 | 2. ICM- oder ThLb-Injektion 6. iDISCO+ ganze Halterung immnunostaining 7. LSFM-Bildgebung | ||
| Anti-Prox1 Antikörper | Kernmarker von LVs-Zellen | Abbildung 1 und Abbildung 4 | 6. iDISCO+ ganze Halterung immnunostaining 7. LSFM-Bildgebung | Effizienter Antikörper gegen ganze Mount-Immnunostaining |
Tabelle 1: In der Studie verwendete Antikörper und Tracer.
| Problem | Möglicher Grund | Lösung | |
| Chirurgie für Tracer-Injektion | Unerwünschte ZNS-Gewebeläsion | 1. Fehlende Kontrolle der Glaskapillarinsertion 2. Falsche Tiefe der Glaskapillarinsertion | 1. Punctate mit Sorgfalt, aber vollständig, die Dura mater mit einer 26 G Nadel vor Glas Kapillarinsertion. 2. Reduzieren Sie die Tiefe der Glaskapillarinsertion (<1,5 mm von der Dura mater). 3. Reduzieren Sie den Durchmesser der Glaskapillare. |
| Unerwünschte Verunreinigung des injizierten Tracers in die epidururalen oder extravertebralen Räume | Falsche Injektion des Tracers | 1. Prüfen Sie, ob die Mikrokapillare aus Glas gut in das Punktat der Dura mater eingeführt wurde. 2. Fügen Sie chirurgischen Kleber zwischen Glas Mikrokapillare und das umgebende Gewebe vor der Injektion Tracer. | |
| Übermäßiges Volumen des injizierten Tracers | Reduzieren Sie das Volumen des injizierten Tracers (<2 l). | ||
| iDISCO+ Immunfärbung | Abwesenheit, Heterogenität oder übermäßiger Hintergrund der Etikettierung im Gewebe | 1. Probleme mit der Konzentration des Primärantikörpers 2. Unzureichende Permeabilisierung 3. Unzureichendes Waschen 4. Unzureichendes Clearing | Erhöhen Sie die Anzahl und/oder die Zeit der Inkubationsschritte: Permebilisation, Whashing, Primärantikörper und Clearing. Siehe http://www.idisco.info (FAQ UND TROUBLESHOOTING). |
| Unzureichende Entkalkung | Verwenden Sie eine strengere Entkalkungsbehandlung der Probe mit EDTA21 oder Morselösung für Kopfgewebe insbesondere. | ||
| iDISCO+ Clearing | Proben sind undurchsichtig oder braun gefärbt | Unzureichende Bleichen | Verwenden Sie frischeH2O2 Lösung, erhöhen Volumen und/oder Inkubationszeit. |
| Vorhandensein von Oxidation | Füllen Sie das Rohr vollständig, um das Vorhandensein von Luft zu vermeiden. | ||
| Unzureichende Clearing | Erhöhen Sie die Volumen- und/oder Inkubationszeit. Siehe http://www.idisco.info (FAQ UND TROUBLESHOOTING). | ||
| Tracer-Erkennung | Nicht nachweisbarer Tracer | Falsche Kombination des ausgewählten Tracers | Alexa 555, 594 und 647 Fluorchrome sind resistent gegen iDISCO+ Protokoll5,6,7,8,9,10. Dies ist jedoch nicht der Fall für FITC, GFP, RFP-Fluorchrome. |
| Opferzeitpunkt nach Injektion | Bevorzugen Sie OVA-A555 für die kurzfristige (15 min) Drainageanalyse bei lokalen Wirbellymphatiken. Für die Lymphknoten-Drainageanalyse können OVA-A555 und Lyve1 Antikörper für längerfristige (>45 min) Analysen verwendet werden. | ||
| Imaging: Erfassung und Analyse | Aufgenommene Bilder des Lymphkreislaufs sind nicht zufriedenstellend | Dissektionsproblem (Lymphknoten fehlen) | Fügen Sie sorgfältig die Wirbel /Schädel benachbarte Gewebe in Ihre sezierte Probe, nach dem Lymphkreislauf, den Sie abbilden möchten. |
| Imaging-Problem | 1. Ändern Sie die Erfassungsparameter des LSFM: Laserintensität, lichtbogennumerische Blende, Lichtschichtdicke, Lichtbogenstärke, Expositionszeit. 2. Legen Sie die Probe in den Träger, um den durch Licht durch das Gewebe zurückgelegten Weg bis zum Ziel zu reduzieren. 3. Stellen Sie sicher, dass sich während des Erwerbs keine Blasen in der Gewebeprobe befinden. |
Tabelle 2: Ratschläge zur Fehlerbehebung für jeden Schritt des Protokolls, einschließlich möglicher Probleme und Lösungen.
Diskussion
Das iDISCO+/LSFM-Protokoll bietet beispiellose 3D-Ansichten des CNS-assoziierten Lymphnetzes innerhalb seiner umgebenden Gewebe auf zellulärer Auflösungsebene. Dieses Protokoll ist gut an mittelgroße Proben angepasst, nicht exeeding 1,5 cm3, aufgrund der Einschränkungen des LSFM optischen Systems, der verringerte Arbeitsabstand, und die große Größe der kommerziellen Objektive für hochauflösende Mikroskopie23. Diese Einschränkung verhindert die Erfassung des gesamten gehirnassoziierten Lymphsystems. Es ist wichtig zu beachten, dass der Untersuchungsbereich vorsichtig abgegrenzt und das Gewebe, das das ZNS umgibt, sorgfältig seziert werden muss, um die extrakraniellen Lymphgefäße und LNs einzubeziehen, die zur gesamten Lymphschaltung beitragen (Tabelle 2).
Neben Der Größe und den anatomischen Überlegungen variiert die Komplexität der umgebenden mesenchymalen Gewebe entlang des Schädels und der Wirbelsäule, was eine Anpassung der Entkalkungs- und Vorklärungsbehandlung erfordert, um eine homogene Probenklärung zu erhalten und eine Lichtstrahlvermehrung innerhalb eines weichen isotropen biologischen Gewebes zu ermöglichen. In Ermangelung von Knochen erfordert die LFSM-Bildgebung des Gehirns oder des Rückenmarksgewebes keinen Entkalkungsschritt, und die endgültige Auflösung der aufgenommenen Bilder ist optimal19. Das oben beschriebene Protokoll, das einen leichten Entkalkungsschritt mit Morse-Lösung beinhaltet, ist gut für die LSFM-Bildgebung der Wirbelsäule geeignet, wie in Abbildung 1 und Abbildung 4dargestellt. Im Gegensatz dazu zeigt der Halsbereich eine besonders komplexe Knochenanatomie zusätzlich zu mehreren Schichten von Muskeln, Fett und Drüsengeweben, die die Qualität der erfassten LSFM-Bilder reduzieren, wie in Abbildung 3Bwidergespiegelt. Die LSFM-Bildgebung des Hals- und Gebärmutterhalsbereichs kann somit durch eine strengere Behandlung von Geweben verbessert werden; z. B. mit EDTA, wie bereits berichtet24. Der Entkalkungsschritt ist daher kritisch und die Entkalkungsbedingungen müssen zuvor für jeden verwendeten Antikörper getestet werden, bevor das vollständige iDISCO+ Protokoll (Tabelle 2) gestartet wird.
Während das iDISCO+/LSFM-Protokoll die Erzeugung einer 3D-Ansicht von Verbindungskreisen zwischen den meningealen und epidururalen Räumen und den zugehörigen LNs ermöglicht, die direkte quantitative Analyse der lymphatischen Vaskulatur aus LSFM-gefangenen Bildern ist aus folgenden Gründen nicht möglich: 1) Die Abgrenzung von Lymphgefäßkreisen ist aufgrund des diskontinuierlichen Musters der lymphatischen Markerexpression unzuverlässig, da membranar LYVE1 hierterogen verteilt ist21 und PROX1 ein Kernexpressionsmuster22aufweist; 2) das heterogene Eindringen von Antikörpern sowie die Anisotropie, die aufgrund unvollständiger und heterogener Entkalkung und Vorklärung im biologischen Gewebe fortbestehen kann. Die LSFM-Bildgebung muss daher um Virtual-Reality-Tools erweitert werden, die eine interaktive Visualisierung ermöglichen und so die Quantifizierung der lymphatischen Vaskulatur (www.syglass.io) erleichtern. Bemerkenswert ist auch, daß die genaue Beschreibung der CNS-assoziierten Schaltungen die Sicherung von LSFM-Informationen mit hochauflösenden konfokalen Daten erfordert, die durch konventionelle Immunkennzeichnung auf dünnen (5–10 m) Kryostat- oder Paraffin-eingebetteten Gewebeabschnitten gewonnen werden, insbesondere um die Position der Lymphgefäße in Bezug auf den Dura mater und das CSF genau zu lokalisieren, wie zuvor berichtet11,14,18.
Das Protokoll iDISCO+/LSFM ermöglicht eine dreidimensionale Visualisierung der makromolekularen Drainage im ZNS-assoziierten Lymphsystem, wie in Abbildung 3 und Abbildung 4dargestellt. Die funktionelle Beurteilung der Lymphdrainage erfordert jedoch zusätzlich zu den oben beschriebenen Empfehlungen zum iDISCO+/LSFM-Protokoll nach einem strengen Verfahren, da das Endergebnis von der Qualität der Injektionschirurgie, der Wahl der Abgabestelle, der Art und dem injizierten Volumen des verwendeten Makromolekülmarkers und der Zeit des Opfers nach der Verabreichung von Tracer abhängt (Tabelle 2). Aufgrund von Variationen des Tracermusters zwischen injizierten Tieren erfordert die Charakterisierung von Lymphdrainagekreisläufen große Versuchsgruppen (>10 durch Injektionsbedingung). In dem vorgestellten Protokoll 1) muss die Dura mater vor der Injektion punktiert werden, um unerwünschte Läsionen und das Eindringen in das ZNS-Gewebe zu verhindern; 2) das injizierte Volumen muss weniger als 2 l betragen, um die unerwünschte Diffusion durch das Injektionsloch entlang der Injektionskapillare in den Epiduralraum oder das extravertebrale Gewebe zu begrenzen; 3) Die Tiefe der Injektionkapillarinsertion muss auf 2 mm unter der Dura mater begrenzt werden, um ZNS-Verletzungen bzw. Fehltargeting bei ICM- bzw. Intraspinalinjektionen zu vermeiden. Beachten Sie auch, dass eine komplementäre hochauflösende konfokale Analyse benachbarter Wirbelsegmente durchgeführt werden muss, wie oben angegeben, um das Vorhandensein eines injizierten Tracers innerhalb der Lymphgefäße zu bewerten. Diese Analyse erfordert die Ermittlung der Intensitätsprofildiagramme für den Tracer und den Lymphmarker auf Querschnitten von markermarkierten Lymphgefäßen. Dieser Ansatz wurde zuvor verwendet, um die OVA555-Aufnahme durch ThLb-Lymphatik enden zu können, 15 min nach der Injektion (Supplementary Figure 5F in Jacob et al.14). Für den Anti-LYVE1-Tracer wurde in der vorliegenden Studie jedoch nicht gezeigt (Abbildung 4).
Unter den möglichen CSF-Tracern ist OVA-A555 eine ausgezeichnete Option, da es gegen die iDISCO+ Protokollbehandlungen resistent ist und eine hohe Fluoreszenz für die LSFM-Bildgebung beibehält. Beachten Sie jedoch, dass der Spurensicherungstyp gemäß dem Analysezeitpunkt (Tabelle 1 und Tabelle 2) ausgewählt werdenmuss. Wie bereits erwähnt, wird die OVA-A555-Kennzeichnung lokaler Wirbellymphgefäße nach 15 min nach Injektion14beobachtet. ALLERDINGS wird OVA-A555 in diesen lokalen Lymphkreisläufen nach 45 min nach der Injektion nicht mehr nachgewiesen (Abbildung 3) im Gegensatz zum Anti-LYVE1-Antikörper (Abbildung 4).
Abschließend möchte ich sagen, dass das iDISCO+/LSFM-Protokoll gut für die Untersuchung der 3D-Struktur und Drainage des ZNS-assoziierten Lymphsystems unter physiologischen und pathologischen Bedingungen wie ZNS- und Wirbelsäulenkrebs oder Wirbelknochen- und Gelenkerkrankungen geeignet ist. Obwohl das gesamte Verfahren lang ist und methodische Strenge erfordert, liefert es wertvolle, einzigartige Informationen, wenn es mit komplementärer Analyse mit Virtual-Reality-Tools und hochauflösender konfokaler Bildgebung verwendet wird.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde vom Institut National de la Sante et de la Recherche Medicale, Agence Nationale Recherche (ANR-17-CE14-0005-03), Federation pour la Recherche sur le Cerveau (FRC 2017), Carnot Maturation (to L.J.), Universidade Federal de Rio de Janiero (UFRJ for J.B.), NIH (R01EB016629-01) und yale School of Medicine. Wir würdigen die ICM-Plattformen: ICM-QUANT für zelluläre Bildgebung und ICM-Histomik für die Immunhistochemie. Alle Tierarbeiten wurden in der PHENO-ICMice-Anlage durchgeführt. Der Kern wird unterstützt durch 2 "Investissements d'avenir" (ANR-10- IAIHU-06 und ANR-11-INBS-0011-NeurATRIS) und die "Fondation pour la Recherche Médicale". Wir würdigen Nicolas Renier für methodische Beratung und Manuskriptlektüre.
Materialien
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| Centrifuge tubes: 0.2ml | Eppendorf | 30124359 | |
| Centrifuge tubes: 2ml | Eppendorf | 30120094 | |
| Conical centrifuge tubes: 15ml | Falcon | 352096 | |
| Conical centrifuge tubes: 50ml | Falcon | 352070 | |
| Microtome blade 80mm | Microm Microtech France | F/MM35P | |
| Needles 26G (0.45x13 mm) | Terumo | AN*2613R1 | |
| Syringe 1ml | Terumo | SS+01H1 | |
| Microscopes and imaging softwares | |||
| AxioZoom.V16 fluorescence stereo zoom microscope, equipped with an ORCA-Flash 4.0 digital sCMOS camera (Hamamatsu Photonics) or an OptiMOS sCMOS camera | Zeiss | ||
| Imspector Microscope controller software, Version v144 (acquisiton software) | Abberior instruments | ||
| Imaris File Converter x64 9.2.0(file convertion software) , Imaris stitcher software 9.2.0 (stitcher software), Imaris x64 9.2.0 (3D software) | OXFORD instruments | ||
| LED lasers (OBIS) LVBT Laser module 2nd generayion | COHERENT | ||
| Ultramicroscope II equipped with a sCMOS camera (Andor Neo) and a 4 × /0.3 objective lens (LVMI-Fluor WD6) | LaVision Biotec | ||
| Reagents | |||
| Alexa Fluor 568 Donkey anti Rabbit | Thermo Fisher | A10042 | |
| Alexa Fluor 647 Donkey anti goat | Jackson ImmunoResearch | 705-605-147 | |
| Alexa Fluor 647 Donkey anti Rabbit | Jackson ImmunoResearch | 711-605-152 | |
| Anti-LYVE1 polyclonal antibody | Angiobio | #11-034 | |
| Anti-PROX1 goat polyclonal IgG antibody | R&D systems | #AF2727 | |
| Buprenorphine Injection Ampoules (Buprecare solution, 0.3mg/ml) | Animalcare | Ampule 1ml | |
| Dibenzyl Ether 100% (DBE) | Sigma Aldrich | 108014 | |
| Dichloromethane 100% (DCM) | Sigma Aldrich | 270997 | |
| Formic acid 99% | CARLO ERBA | 405793 | |
| Glycine | Sigma Aldrich | G.7126 | |
| Heparine sodium salt from porcine | Sigma Aldrich | H4784 | |
| Hydrogen peroxide solution (H2O2 30%) | Sigma Aldrich | H1009 | |
| Isoflurane (Iso-Vet 100%) | Piramal | NDC 66794-013-10 | |
| Methanol 100% | Sigma Aldrich | 322415 | |
| Ovalbumin Alexa Fluor 555 Conjugate | Invitrogen | 11549176 | |
| Phosphate Buffer Solution PBS (stock solution 10X) | Euromedex | ET330-A | |
| Sodium Pentobarbital (Euthasol 400mg/mL) | Dechra | 08718469445110 | |
| Tri-sodium citrate | VWR | 6132-04-3 | |
| Surgical tools and equipments | |||
| Anaesthesia system | Univentor | Univentor 410 Anaesthesia Unit | |
| Glass micropipette puller | Narishige | PC-10 | |
| Heating pad | CMA Microdialysis AB | CMA 450 Temperature controller | |
| Microcapillaries (Glass Capillaries) | Harvard Apparatus | GC120-15 | |
| Microforceps, forceps,dissection scissors and Michel Suture Clips (7.5 × 1.75mm) | Fine Science Tool | 12040-01 | |
| Scalpel (sterile disposable scalpel 23) | Swann-Norton | 0510 | |
| Stereotaxic apparatus | KOPF | Model 940 | |
| Syringe Hamilton 10µl 701N | Hamilton | 28618-U | |
| Warm air System | Vet-Tech LTD | HE011 |
Referenzen
- Plog, B. A., Nedergaard, M. The Glymphatic System in Central Nervous System Health and Disease: Past, Present, and Future. Annual Review of Pathology. 13, 379-394 (2018).
- Iliff, J. J., Goldman, S. A., Nedergaard, M. Implications of the discovery of brain lymphatic pathways. The Lancet Neurology. 14 (10), 977 (2015).
- Engelhardt, B., et al. Vascular, glial, and lymphatic immune gateways of the central nervous system. Acta Neuropathologica. 132, 317-338 (2016).
- Benveniste, H., et al. The Glymphatic System and Waste Clearance with Brain Aging: A Review. Gerontology. , 1-14 (2018).
- Louveau, A., Da Mesquita, S., Kipnis, J. Lymphatics in Neurological Disorders: A Neuro-Lympho-Vascular Component of Multiple Sclerosis and Alzheimer's Disease. Neuron. 91 (5), 957-973 (2016).
- Ma, Q., Ineichen, B. V., Detmar, M., Proulx, S. T. Outflow of cerebrospinal fluid is predominantly through lymphatic vessels and is reduced in aged mice. Nature Communications. 8 (1), 1434 (2017).
- Ma, Q., Decker, Y., Müller, A., Ineichen, B. V., Proulx, S. T. Clearance of cerebrospinal fluid from the sacral spine through lymphatic vessels. The Journal of Experimental Medicine. 216 (11), 2492-2502 (2019).
- Louveau, A., et al. Understanding the functions and relationships of the glymphatic system and meningeal lymphatics. The Journal of Clinical Investigation. 127 (9), 3210-3219 (2017).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Aspelund, A., et al. A dural lymphatic vascular system that drains brain interstitial fluid and macromolecules. The Journal of Experimental Medicine. 212 (7), 991-999 (2015).
- Antila, S., et al. Development and plasticity of meningeal lymphatic vessels. The Journal of Experimental Medicine. 214 (12), 3645-3667 (2017).
- Ahn, J. H., et al. Meningeal lymphatic vessels at the skull base drain cerebrospinal fluid. Nature. 572 (7767), 62-66 (2019).
- Pollay, M. The function and structure of the cerebrospinal fluid outflow system. Cerebrospinal Fluid Research. 7, 9 (2010).
- Jacob, L., et al. Anatomy and function of the vertebral column lymphatic network in mice. Nature Communications. 10 (1), 1-16 (2019).
- Louveau, A., et al. CNS lymphatic drainage and neuroinflammation are regulated by meningeal lymphatic vasculature. Nature Neuroscience. 21 (10), 1380-1391 (2018).
- Da Mesquita, S., et al. Functional aspects of meningeal lymphatics in ageing and Alzheimer's disease. Nature. 560 (7717), 185-191 (2018).
- Song, E., et al. VEGF-C-driven lymphatic drainage enables immunosurveillance of brain tumours. Nature. 577 (7792), 689-694 (2020).
- Absinta, M., et al. Human and nonhuman primate meninges harbor lymphatic vessels that can be visualized noninvasively by MRI. eLife. 6, 29738 (2017).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Renier, N., et al. Mapping of Brain Activity by Automated Volume Analysis of Immediate Early Genes. Cell. 165 (7), 1789-1802 (2016).
- Jackson, D. G., Prevo, R., Clasper, S., Banerji, S. LYVE-1, the lymphatic system and tumor lymphangiogenesis. Trends in Immunology. 22 (6), 317-321 (2001).
- Wigle, J. T., Oliver, G. Prox1 function is required for the development of the murine lymphatic system. Cell. 98 (6), 769-778 (1999).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: a tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Jing, D., et al. Tissue clearing of both hard and soft tissue organs with the PEGASOS method. Cell Research. 28 (8), 803-818 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten