Method Article
Трехмерное изображение позвоночного лимфатического сосуда и дренажа с использованиемiDISCO и флуоресценции флуоресценции светового листа
В этой статье
Резюме
Представлен протокол, сочетающий очистку тканей с световой микроскопией флуоресценции листа (LSFM) для получения трехмерных и клеточных изображений разрешения лимфатических сосудов и лимфатических узлов (НН), собирающих спинномозговой жидкости (CSF) и спинномозговой эпидуральной жидкости.
Аннотация
Лимфатическая система, связанная с центральной нервной системой (ЦНС), включает в себя лимфатические сосуды, которые вращаются вокруг мозга, спинного мозга и связанных с ним LNs. ЦНС-ассоциированной лимфатической системы участвует в дренаже CSF макромолекулы и менингеальные иммунные клетки к ЦНС-дренажных LNs, тем самым регулируя очистку отходов и иммунного наблюдения в тканях ЦНС. Представлен новый подход для получения трехмерных (3D) и клеточного разрешения изображения CNS-ассоциированных лимфатических при сохранении целостности их схем в окружающих тканях. Протокол iDISCOиспользуется для иммунолабелевых лимфатических сосудов в декальсифицированных и очищенных целых крепостей позвоночного столба, которые впоследствии изображя с помощью светового листа флуоресценции микроскопии (LSFM). Техника показывает 3D структуру лимфатической сети, соединяющей менингеальные и эпидуральные пространства вокруг спинного мозга к внепозвоночным лимфатическим сосудам. Предусмотрены 3D-изображения дренажных схем молекулярных трассировщиков, ранее введенных либо в CSF через цистерна-магну, либо в тораколумбарную спинномозговую паронхиму. Подход iDISCO/LSFMоткрывает беспрецедентные возможности для изучения структуры и функции лимфатической системы, связанной с ЦНС, в нейрососудистой биологии, нейроиммунологии, раке мозга и позвонков, или биологии позвоночных костей и суставов.
Введение
ЦНС окружен CSF и наложения слоев очинок, эпидуральной ткани и костей. В целом, CSF обеспечивает физическую защиту мягкого мозга и спинного мозга. В основном выделяется сосудистое сплетение и менингеальные мембраны (т.е. пиа-матер, арахноид и дура-матер). CSF-менингеальный комплекс также устанавливает функциональный интерфейс между тканями ЦНС и остальной частью тела, тем самым способствуя Гомеостазу ЦНС. Во-первых, CSF проникает в СНС parenchyma через ЦНС пара-артериальных пространств и динамически взаимодействует с интерстициальной жидкости (ISF)1 через глимфатический (glia-лимфатический) системы, которая состоит из параваскулярных пространств и астроцитов конечной ноги мембраны вокруг сосудов ЦНС2,3,4. Метаболические отходы и избыток жидкости затем в конечном счете очищается от внутримурного периваскулярного дренажа непосредственно из мозга parenchyma к системной циркуляции3, а также паравенные пространства к CSF и через мозг-дренаж лимфатических сосудов, в соответствии с глимфатической модели2,4. Отток CSF в основном через лимфатическую систему, через крибриформную пластину и связанные с ними внекраниальные лимфатические сосуды5,,6,,7,а также менингеальные лимфатические сосуды, которые сходятся в мозго-дренажных LNs8,9,10,11,12 (Рисунок 1). Важную, хотя и второстепенную, роль в оттоке CSF играет черепно-мозговая арахноидная вилли, которая проникает в лакуну менингеальных венозных пазух13.
CFS дренажные цепи были тщательно исследованы с помощью экспериментальных подходов, основанных на инъекциях цветных / флуоресцентных трассировщиков в ЦНС или CSF, а затем изображением шаблона трассировщиков внутри ЦНС и по всей части органов и тканей тела в разные временные точки после инъекции13. Долгое время отток CSF считался исключительно и непосредственно принятым ответственным за кровообращение, через арахноидальную вилли, проецирующуюся в дуальные венозные пазухи13. Тем не менее, отток CSF в основном осуществляется лимфатической сосуды, как недавно показали ближнего инфракрасного (NIR) динамическое изображение CSF-инъекционных трассировщик транспорта у мышей9,10. CSF-дренажных лимфатических сосудов затем вернуть лимфы в кровоток через правую подклавиевскую вену. Дополнительные приближения обнаружили как экстракраниальные6,,7,,13 и внутричерепные9,10,11,,12 лимфатических выходов CSF-инъекционных трассировщиков и предположить, что CSF поглощается двумя лимфатическими путями, один внешний, а другой внутренний к черепу и позвоночной колонке. Основная часть дренажа CSF быстро происходит через лимфатические сосуды, расположенные ростралически, вне черепа в слизистой оболочке носа, через каналы крибриформной пластины этилоидной кости3,,6,,13 и, по-настоящему, вне люмбосакральных костей позвонков через дорсо боковой линии, которые еще не полностью охарактеризованы7,,14. Кроме того, в оболочках черепа, лимфатические капилляры dura mater directy поглощают CSF и менингеальные иммунные клетки к дуральным лимфатическим коллекторам, которые пересекают кости черепа и подключаются к ЦНС-дренажных LNs12,14. Эти менингеальные лимфатические сосуды играют важную роль в патофизиологии ЦНС, потому что менингеальная лимфатическая опухоль мозга изменяется при старении, а также влияют на исход неврологических заболеваний головного мозга, включая нейродегенерацию, нейровоспаление и рак мозга15,,16,17. Таким образом, ЦНС-ассоциированных лимфатических сосудов (т.е. дуральных и периферических лимфатических сосудов, осушенных CSF) может быть перспективным новой мишенью для борьбы с болезнями ЦНС у людей.
Конвергентные исследования, проведенные с иммуногистологией и магнитно-резонансной томографией высокого разрешения, показали, что менингеальная лимфатическая вазулатура также существует у приматов, в том числе обычных сурков и людей7,,11,13. Кроме того, менингеальные лимфатические сосуды не ограничиваются черепом, но распространяются в позвоночном столбе на поверхность спинного ганглиев и рами13,,18. Трехмерная (3D) визуализация позвоночного столба лимфатических сохранения общей анатомии помеченных образцов позвонков и позвоночника, в том числе чрезмерной костей, мышц, связок, а также соседних висцеральных тканей, недавно была выполнена14. IDISCOпротокол 19,20 был использован для иммунолабела декалцифицированных и очищенных препаратов всего позвоночного столба с лимфатическими специфическими антителами против либо мембранного рецептора LYVE121 или транскрипционного фактора PROX122. Приобретение изображений и анализ были затем проведены с помощью светового листа флуоресценции микроскопии (LSFM) и программного обеспечения Imaris. LSFM позволяет быстро и минимально инвазивных 3D изображений крупных образцов осевого заключения освещения, что приводит к снижению фотоблесы и фототоксичности23.
Подход iDISCO/LSFMпозволяет охарактеризовать различные слои дураловых и эпидуральных лимфатических сосудов, а также связь этого сосуда с внепозвоночными лимфатическими цепями и LNs, соседствующим с позвоночным столбом. Протокол был применен к тканям, ранее вводившие флуоресцентные трассировщики для демонстрации дренажа позвоночного канала. В настоящем документе содержится+подробная информация о методологии iDISCO /LSFM для изображения лимфатических сосудов позвонка и иллюстрирует его отношение к CSF и эпидуральной жидкости дренаж исследования.
протокол
Все инво-процедуры, используемые в данном исследовании, соответствовали всем соответствующим этическим нормам для тестирования и исследований на животных, в соответствии с Европейским сообществом для экспериментальных руководящих принципов использования животных (L358-86/609EEC). Исследование получило этичное одобрение Комитета по этике INSERM (n'201611111126651) и Институциональным комитетом по уходу за животными ICM (Институт дю Серво и де ла Мель Эпиньер).
1. Подготовка
- Подготовьте следующие инструменты вскрытия для хирургии: скальпель (1), микросилы (2), щипцы (1), ножницы для вскрытия и зажимы для швов Мишеля. Приготовьте 26 Г игл (0,45 мм х 13 мм), 1 мл шприца и 10 микросыля.
- Потяните микрокапилляры с одноступенчатым протоколом при 67,5 градусов по Цельсию со стеклянным шкивом микропиппетом. Подготовьте два микрокапилляра на инъекцию.
- Подготовка реагентов для визуализации лимфатического дренажа(Таблица 1): Ovalbumin Alexa Fluor 555 конъюгации (OVA-A555, 2 мг/мл в 1x фосфат буферный солевой раствор »PBS) и анти-LYVE1 антитела (1 мг/мЛ в 1x PBS).
- Подготовка антител (Таблица 1) для iDISCO. Для первичных антител используйте анти-LYVE1 поликлональные антитела кролика (1:1,600) и анти-PROX1 козы поликлональные антитела IgG (1:2,000). Для вторичных антител, используйте Alexa Fluor осла анти-кролик-568, осел анти-кролик-647, и осел анти-коза-647 (1:2,000).
2. Хирургические процедуры для внутрисистрных инъекций (ICM) и тораколумара (ThLb)
- Подготовка животного к операции
- Используйте взрослых самцов и самок C57BL6/J мышей, 8-12 недель.
- Введите мышь интраперитонально (IP) с 0,015 мг/мЛ бупренорфин раствором, разбавленным в 0,9% хлорида натрия на 0,1 мг/кг, за 15 мин до операции.
- Обезболивать мышь в индукционной коробке с 2-3% изофлуран газа.
- Приготовление обезболивающего животного для инъекции трассировщика
- Поместите анестезируемую мышь и ее гремяю на стереотаксический аппарат. Используйте ушные прутья, чтобы держать голову мыши, и сложить тело под углом 135 "к голове или обездвижить спинной мозг на уровне позвонка ThLb (Th12-L1) с спинномозговой адаптер. Pinch хвост или лапу с forcep, чтобы проверить эффективность анестезии.
- Впрысните IP 200 л 0,9% хлорида натрия для гидратации мыши.
- Используя лезвие скальпеля, сделайте разрез кожи, либо в затылочной области к области шейки матки для инъекции ICM, или на уровне позвонка ThLb (Th10-L3) для инъекций в ThLb спинного паренхима.
- Инъекция Tracer
- Откажитесь от парацервических и параспинальных мышц, покрывающих шею и колонку, чтобы визуализировать поверхность дюра-матер, внешнего слоя оболей.
- Тщательно пунктуировать центральную область дюра-матер и подледить арахноид 26 G иглой.
- Имплантация микрокапиллярий
- Вырежьте 2 мм стеклянного наконечника капилляров (см. шаг 1.2), затем используйте микрокапилляр, подключенный к канюле, связанному с 10-х мл шприца, чтобы аспирировать 2х8 л антител OVA-A555 или LYVE1.
- Введите микрокапилляр в медиальной области dura mater под углом 30 "для инъекций ICM или 10 " угол для инъекций позвоночника ThLb, и нажмите его в 1,5 мм ниже dura mater.
ПРИМЕЧАНИЕ: Связки проколоты, но ламинэктомия не выполняется. - Добавьте 10 мл хирургического клея, чтобы закрыть разрез вокруг стекло капилляра и ждать, пока он высохнет.
- Медленно введите флуоресцентный трассировщик на 1 л/мин. После того, как объем инъекций был доставлен, поддерживать капилляр на месте в течение 1 мин. Втягивайте микрокапилляр и добавьте хирургический клей, чтобы закрыть отверстие для инъекций.
- Постинджекции, закрыть разрезы кожи с швом клипы. Снимите мышь с стереотаксикозерного аппарата и поместите ее в камеру послегермегового потепления при 37 градусов по Цельсию, пока она не восстановится.
3. Перфузия и вскрытие тканей
- На 15 мин или 45 мин после инъекции трассировщика CSF, вводят ИС смертельную дозу (100 мл) пентобарбитала натрия. Pinch хвост или лапу, чтобы убедиться, что нет рефлекса.
- Ножницами вскрытия вырежьте кожу и откройте перитонеальный слой из нижней части живота в сторону грудной клетки. Откройте грудную клетку ножницами, чтобы иметь доступ к сердцу.
- Вставьте 26 G иглы в левом желудочке сердца и начать перфузыки с 20 мл ледяной 4% параформальдегида (PFA) в 1x PBS на 2 мл / мин. Используйте ножницы, чтобы быстро сократить правое предсердие и освободить поток перфузии жидкости.
- Полностью снимите кожу щипцами и вырежьте четыре ноги ножницами. Удалите все внутренние органы, но будьте осторожны, чтобы сохранить LNs нетронутыми.
ПРИМЕЧАНИЕ: Mandibular LNs являются поверхностными, поэтому заботиться, чтобы не удалить их при отрезании кожи. Глубоко шейные LNs (dcLNs) расположены по обе стороны трахеи, в контакте с боковой поверхностью внутренних яремных вен и близко к мышцам стереомастоида. - Отрежьте ребра для удаления позвоночного столба со спинным мозгом внутри от шейки матки до поясничных сегментов.
- Погрузите расчлененные ткани в ледяной 4% PFA в 1x PBS в 50 мЛ трубки на ночь (18 ч) при температуре 4 градуса Цельсия. Вымойте фиксированные ткани 3x в 50 мл 1x PBS в течение 5 мин.
4. Флуоресценция макроскопии позвоночного сегмента
- Расположите образец под флуоресценционным стереозомным микроскопом с помощью камеры(Таблица материалов). Пройдите обзор образца или увеличьте масштаб конкретного региона.
5. Образец препарата для всего крепления иммуносумирования
- Используя лезвие микротома, поперечно вырезать столб головы и позвонков на уровне затылочной и шейки матки.
ПРИМЕЧАНИЕ: Это рассечение позволяет изолировать голову и область шейного позвонка от остальной части позвоночного столба. - С помощью микротомного лезвия, вырезать шейки матки, тораколумбар, и сакральных областей позвоночного столба поперечно в сегменты 2'4 позвонков, около 0,5 см размер каждого.
- Изолировать каждый сегмент в порядке, он был отделен от оси позвонков, по всей длине шейного и грудного области позвоночника. Храните каждый образец в трубке 2 mL 1x PBS.
6. iDISCO- целый монтаж иммуносументирования позвоночного сегмента
ПРИМЕЧАНИЕ: Подробное описаниепротокола iDISCO доступно по адресу http://www.idisco.info.
- День 1: Обезвоживание тканей
- Обезвоженные образцы позвоночной ткани (т.е. сегмент позвонков) путем последовательного погружения в 20%, 40%, 60%, 80% и 100% метанола в 1x PBS на 1 ч с агитацией.
- Инкубировать образцы на ночь в растворе 33% метанола/66% дихлорметана (ДСМ) при комнатной температуре (РТ) с агитацией.
- День 2: Отбеливание тканей
- Вымойте образцы 2x со 100% метанолом на 1 ч в RT. Инкубировать образцы в 5% H2O2 в метаноле (30% H2O2 и метанола 1:5 v/v) при 4 градусах по Цельсию в одночасье.
- День 3: Шаг декальцификации и пермяки
- Регидратировать образцы постепенно в 80%, 60%, 40%, 20% метанола, затем в 1x PBS (1 ч в каждом растворе) на RT с агитацией.
- Decalcify позвонков путем инкубации образцов в растворе Морзе (10% трисодий цитрат и 45% формиановой кислоты 1:1 v/v) в течение 30 мин на RT для сохранения костной структуры.
- Промыть образцы 2x с 1x PBS и инкубировать 2x на 1 ч в растворе PTx2 (0.2% Triton X-100 в 1x PBS, возобновить для второй инкубации) на RT с агитацией. Затем инкубировать предварительно проинстреченные образцы в пермяке (PTx2 с 20% диметил сульфоксида (DMSO) и 2,3% w/v глицин) при 37 градусах по Цельсию на 24 ч.
- День 4: Блокирование шаг
- Инкубировать образцы в блокируем растворе (PTx2 с 6% сывороткой осла и 10% DMSO) при 37 градусах по Цельсию на 24 ч.
- Дни 5–16: иммуномаркирование всего крепления
- Инкубировать образцы первичных антител, разбавленных в PTwH (1x PBS, содержащий 0,2% Tween-20 и 0,1% гепарина при 10 мг/мл в 1x PBS) с 5% DMSO/3% сыворотки осла при 37 градусов по Цельсию в течение 6 дней. Вымойте образцы 4х5x в PTwH на RT с агитацией на ночь.
- Инкубировать образцы вторичного разбавления антител в PTwH с 3% сыворотки осла при 37 градусов по Цельсию в течение 4 дней. Вымойте образцы в PTwH 4'5x на RT под агитацией на ночь перед очисткой.
- Дни 17 и 18:+ iDISCO
- Обезвоживание образцов постепенно путем последовательного погружения в 1x PBS, то 20%, 40%, 60%, 80%, и 2x в 100% метанола (1 ч в каждом растворе). Инкубировать каждый образец на ночь в растворе 33% метанола/66% DCM.
- Вымойте 2x в 100% DCM в течение 15 минут, чтобы удалить метанол. Инкубировать в dibenzyl эфира (DBE) без встряхивания до очищены (4 ч), а затем хранить в DBE на RT перед визуализацией.
7. LSFM изображений
- Изображение очистили образцы в поперечном самолете с LSFM оснащен 4x/0.3 цели.
- Используйте одностороннюю конфигурацию трехлистного освещения, фиксированную позицию x (без динамической фокусировки). Используйте светодиодные лазеры, настроенные на 561 нм, 100 мВт; и 639 нм, 70 мВт. Установите числовой диафрагму светового листа до 30%.
- Используйте различные фильтры выбросов: 595/40 для Alexa Fluor-568 или -555, и -680/30 для Alexa Fluor-647.
- Заполните камеру микроскопа DBE.
- Aquire стеки с 2,5 мкм z шаги и 30 мс время экспозиции за шаг с камерой (Таблица материалов). Используйте оптический зум x2 для эффективного увеличения (x8), 0,8 мкм/пиксель, и выполняйте мозаичные приобретения с 10% перекрытием на полном кадре.
- Приобретайте изображения в формате .tif с программным обеспечением для приобретения и преобразуйте их в 3D-формат с программным обеспечением для преобразования файлов.
- Реконструкция мозаичных приобретений с стежком программного обеспечения (Таблица материалов). Откройте изображения и двигайтесь вручную, чтобы воссоздать всю мозаичную картину, используя 10% перекрытия между изображениями в качестве ориентира.
- Используйте 3D-программное обеспечение(Таблица материалов)для создания ортогональных проекций данных, как показано на рисунке 1, Рисунок 2, Рисунок 3, и рисунок 4, и добавить атрибут цветового кода лимфатических сосудов и других анатомических структур на дисплее. Установите гамма-коррекцию 1,47 к необработанным данным, полученным от LSFM в соответствии с инструкциями производителя.
Результаты
3D-изображение лимфатической сосудов позвонка
На рисунке 1 представлены шаги процедуры iDISCO/LSFMи изображение LSFM лимфатических цепей внутри позвоночного канала iDISCO-обработанные позвонки ThLb. Сочетание iDISCO+ с LSFM сохранило анатомию позвонков и захватило вид лимфатической сосудистой сети (т.е. внутрипозвонковых сосудов, соединенных с внепозвоночными сосудами, выходяными из спинной и позвоночной части) в окружающих костях, связках, мышцах и нервных ганглиях.
Флуоресценция макроскопии изображения dcLN дренаж
Для того, чтобы изображение макромолекула дренажа в ЦНС-ассоциированной лимфатической системы, макромолекулярные трассировщики были администрированы in vivo путем инъекций в либо CSF или спинного parenchyma. Макромолекулярный трассировщик может быть легко доставлен в CSF на цистерна magna. Цистерна-магна расположена между мозжечоком и спинной поверхностью продолговатой медуллы, над фораменом магнумом. Макромолекулярный трассировщик также может быть введен в спинномозговой паренхимы стереотаксической хирургии на различных уровнях вдоль позвоночника.
Используемые макромолекулярные трассировщики были либо непосредственно помечены фторфором, либо обнаружены посмертными иммуногистохимией с конкретными антителами. Рисунок 2A иллюстрирует экспериментальный план для отслеживания OVA-A555, красный флуоресцентный и небольшой молекулярный вес трассировщик (около 45 кДа), который был введен либо в CSF (Рисунок 2B) или ThLb области спинного мозга (Рисунок 2C).
На 45 мин после инъекции макромолекулярного трассировщика, мыши были принесены в жертву, проникнуты 4% PFA, и обработаны, чтобы изолировать расчлененные сегменты стволовой области мозга головы и позвоночного столба, которые были decalcified и уточнены. Макромолекуль дренаж был затем легко оценены флуоресценции макроскопии изображений LNs, которые собирают CSF и эпидуральных жидкостей. Как показано на рисунке 2, OVA-A555 инъекции либо в CSF(Рисунок 2B) или ThLb(Рисунок 2C) области спинного мозга привело к OVA-A555 накопления в dcLNs на 45 мин после инъекции. Это наблюдение указывает на поглощение и дренаж флуоресцентного трассировщика лимфатической системой; это является необходимым условием, прежде+чем проводить процедуру iDISCO /LSFM для изображения позвоночного лимфатического дренажа.
3D-изображение макромолекуле дренажа в лимфатической системе позвонков
На основании обнаружения маркировки OVA-A555 в dcLNs, процедура iDISCO/LSFMможет быть применена к декалькодистским и предварительно расчленяющим образцам позвонков, выделенным из OVA-A555-инъекционных мышей. Такой подход позволил создать 3D-карту лимфатического дренажа CSF и спинного эпидуральной жидкости в определенный момент времени после инъекции трассировщика. Это 3D-картографирование может выполняться путем визуализации последовательных сегментов ЦНС, на каждом уровне позвоночного столба, от точки инъекции.
Рисунок 3A показывает экспериментальный дизайн для инъекций OVA-A555 в спинномозговой паренхиме ThLb и результирующую 3D-модель распределения OVA-A555 в сегменте шейки матки и грудного позвонка в сочетании с лимфатической сосудокулярной системой. На 45 мин после инъекции OVA-A555, OVA-A555 накопление было обнаружено в тканях спинного мозга и dcLNs (белые стрелки на рисунке 3B), в согласии с микроскопом наблюдений, иллюстрированных на рисунке 2. Он не был обнаружен, однако, в цервикальной и грудной лимфатической сосуды помечены анти-LYVE1 антител. Отсутствие CSF-инъекционного трассировщика в лимфатических сосудах позвонков может быть связано либо с коротким временем сохранения трассировщика внутри лимфатических сосудов, либо с отсутствием поглощения трассировщика лимфатическими сосудами(рисунок 3C).
Для того чтобы испытать первую гипотезу, антитело кролика anti-LYVE1 было использовано как лимфатическая endothelial бирка клетки для того чтобы связать CNS-ассоциированные лимфатические сосуды. Впрыснутое антитело кролика anti-LYVE1 в дальнейшем было обнаружено иммуногистохимией с anti-кроликом вторичным антителом, пока лимфатические эндотелиальные клетки были immunolabeled с антителами anti-PROX1. Рисунок 4 представляет собой экспериментальную конструкцию анти-LYVE1 инъекции в ThLb спинного паренхима (Рисунок 4A), и в результате 3D распределение модели LYVE1 антител в сегменте ThLb близко к месту инъекции, в отношении PROX1и лимфатической(рисунок 4B). Оба позвонков лимфатических и их внепозвонковых лимфатических связей были помечены инъекционные анти-LYVE1 антитела, которые обосновали трассировщик поглощения позвоночных лимфатических сосудов и лимфатического дренажа к внепозвоночной лимфатической системы. В регионе ThLb отсутствовали LNs, и, таким образом, их нельзя было визуализировать в изображенный сегмент. Кроме того, прерывистая картина маркера LYVE1 наблюдается вдоль лимфатических сосудов, вероятно, отражает прерывистое выражение LYVE1 в лимфатических сосудах, как сообщалось в предыдущих исследованиях14,21. В целом, результаты настоящего исследования показали, что на 45 мин после инъекции трассировщика, антитела LYVE1, но не OVA-A555, позволили обнаружить местного позвоночного лимфатического поглощения и предпочитали OVA-A555 в качестве постоянного маркера местного позвоночного лимфатического дренажа.
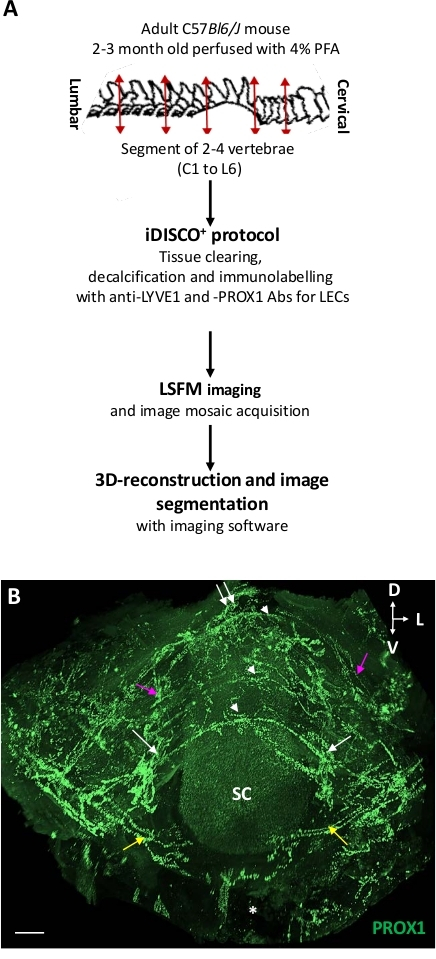
Рисунок 1: Трехмерное представление лимфатической сосуда позвонка. (A) Схемаическое представление протокола. (B) Планар проекция 3D зрения ThLb позвоночных лимфатических сосудов с дорсофронтальной точки зрения. Лимфатические сосуды были иммуномаркированные с анти-PROX1 антитела (зеленый) с использованием протоколаiDISCO, а затем изображен LSFM. Обратите внимание на метамерическую картину сосудов в позвоночном канале трех последовательных позвонков (белые наконечники стрел). В дополнение к полукруглым спинным сосудам (белые наконечники стрел), каждая позвоночная сеть включала в себя вентраальные ветви (желтые стрелки), двусторонние боковые пути выхода вдоль спинальной рамы и ганглиев (белые стрелы), а также спинной путь выхода на средней линии (белая двойная стрелка). Позвоночные сети были соединены продольным сосудом (фиолетовыми стрелками). Для полного описания см.18 Звездочка и вентральный позвоночный корпус; D и спинной; L и боковой; V - вентральный; Масштабные бары No 300 м. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
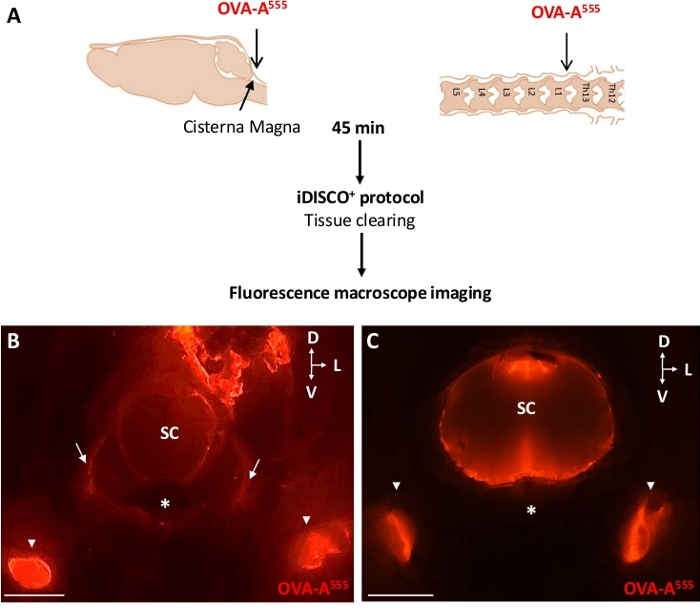
Рисунок 2: dcLNs собраны OVA-A555-помечены CSF жидкостей. (A) Схема экспериментального проектирования. OVA-A555 был введен либо в ICM или ThLb спинного паренхима, то мышей были принесены в жертву 45 минут после инъекции. Образцы были очищены и соблюдены флуоресценции макроскоп изображения (B,C). Флуоресценция макроскоп изображения цервывных позвонков из ICM- (( B) и ThLb-(C) вводили мышей. Обратите внимание, что OVA-A555 накапливается в dcLNs(B,C, белые наконечники стрел), пиальные и парасосудистые пространства шейного и параваскулярного пространства шейного мозга(B,C) и после инъекции ICM, в желудокулярных маршрутах выхода, вероятно, вдоль шейных нервов(B, белые стрелки). СК и спинной мозг. Звездочка и вентральный позвоночный корпус; D и спинной; L и боковой; V - вентральный; Масштабные бары в B и C 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
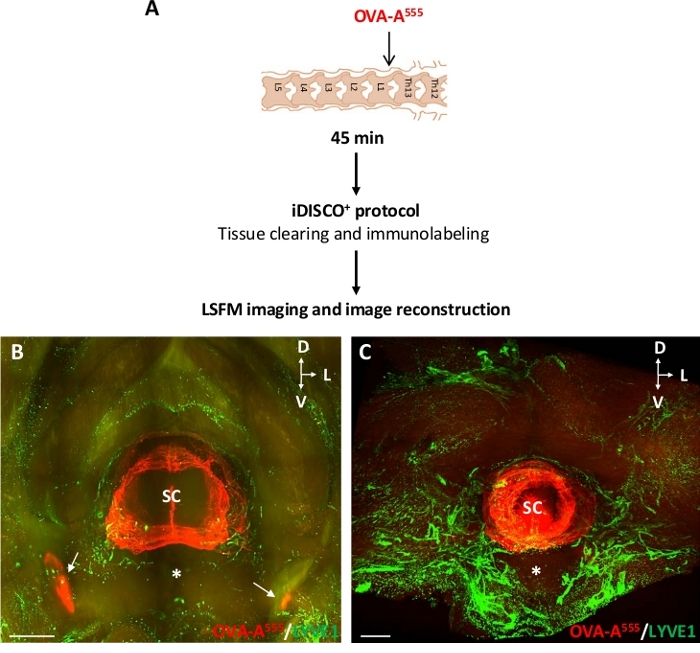
Рисунок 3: Обнаружение OVA-A555-помеченных жидкостей CSF в лимфатической системе позвонков. (A) Схема экспериментального проектирования. OVA-A555 был введен в ThLb спинного parenchyma, то мышей были принесены в жертву на 45 мин после инъекции. Образцы были обработаны с протоколом iDISCOи изображены с LSFM. (B,C) Планарные прогнозы LSFM-захваченных лобных 3D просмотров шейки матки (B) и грудной (C) сегментов позвоночника. Накопление OVA-A555 (красный) было обнаружено в тканях спинного мозга и dcLNs(B,белая стрелка), как показано на рисунке 2, но не в шейном и грудном лимфатическом сосуде иммунобеля здесь с анти-LYVE1 антитела (зеленый). СК - спинной мозг; Звездочка и вентральный позвоночный корпус; D и спинной; L и боковой; V - вентральный; Шкала баров 1 мм (B), 300 мкм (C). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
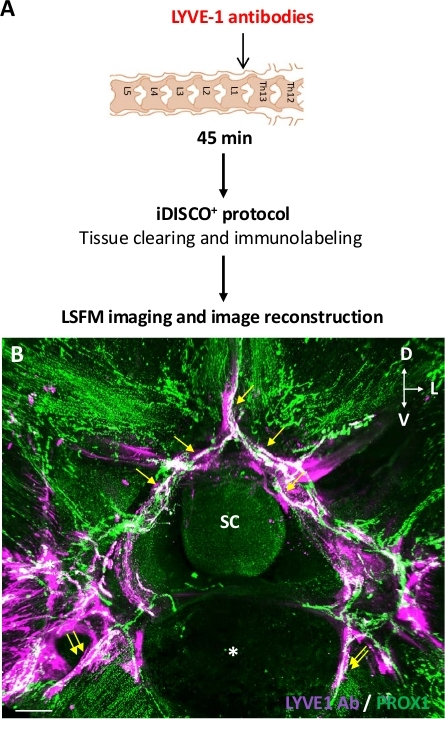
Рисунок 4: Обнаружение позвоночного лимфатического дренажа после внутриспионного введения антител против LYVE1. (A) Схема экспериментального проектирования. Анти-LYVE1 антитела были введены в ThLb спинного паренхима, то мышей были принесены в жертву 45 минут после инъекции. Образцы были обработаны с протоколом iDISCOи изображены с LSFM. (B). Планар прогнозы лобных 3D просмотров ThLb (B) позвоночника сегмента, захваченных с LSFM. Антитела против ЛИВЕ1 были обнаружены с анти-кроличьими антителами (фиолетовыми) и лимфатическими сосудами с антителами PROX1 (зелеными). Белые сосуды PROX1и лимфатические колеи с анти-LYVE1 антител (B); к ним относятся позвоночные (желтые стрелки) и экстрапозвоночные (двойные желтые стрелки) лимфатические. СК - спинной мозг; Звездочка и вентральный позвоночный корпус; D и спинной; L и боковой; V - вентральный; Масштабные батончики 300 мкм (B). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
| Реагентов | Целевой | Рисунок | Шаг протокола | Комментарий |
| OVA-A555 | Трассировщик CSF | Рисунок 2 и рисунок 3 | 2. инъекция ICM или ThLb 7. LSFM изображений. | Водорастворимый, легкий в введении и высокая интенсивная флуоресценция |
| Анти-Lyve1 антитела | Мембранный маркер LVs-клеток | Рисунок 3 | 6. iDISCO' цельная гора immnunostaining. 7. LSFM изображений. | Эффективное антитело к всему монтумнуностания |
| Трейс дренаж дуральных и эпидуральных LVs | Рисунок 4 | 2. инъекция ICM или ThLb 6. iDISCO ' весь монтаж immnunostaining 7. LSFM изображений | ||
| Антитела Anti-Prox1 | Ядерный маркер ЛВ-клеток | Рисунок 1 и рисунок 4 | 6. iDISCO ' весь монтаж immnunostaining 7. LSFM изображений | Эффективное антитело к всему монтумнуностания |
Таблица 1: Антитела и трассировщики, используемые в исследовании.
| Проблема | Возможная причина | Решение | |
| Хирургия для инъекции трассировщика | Нежелательные повреждения тканей ЦНС | 1. Отсутствие контроля над вставкой капилляров стекла 2. Неправильная глубина вставки капилляров стекла | 1. Punctate с осторожностью, но полностью, dura mater с 26 G иглы до вставки капилляров стекла. 2. Уменьшите глубину вставки капилляров (Зтт;1,5 мм от дюра-матер). 3. Уменьшить диаметр капилляров стекла. |
| Нежелательное осквернение инъекционного трассировщика в эпидуральные или экстрапозвоночные пространства | Неправильная инъекция трассировщика | 1. Проверьте, если стекло микро капилляр был хорошо вставлен в пунктуировать dura mater. 2. Добавить хирургический клей между стеклом микрокапиллярий и окруженных тканей перед введением трассировщика. | |
| Чрезмерный объем инъекционного трассировщика | Уменьшите объем вводимого трассировщика (Зтт;2 л.). | ||
| иммуносу бухгалтерское функционирование iDISCO | Отсутствие, неоднородность или чрезмерный фон маркировки в ткани | 1. Проблемы с концентрацией первичного антитела 2. Недостаточная пермяка 3. Недостаточное мытье 4. Недостаточная очистка | Увеличьте количество и/или время инкубационных шагов: проницаемости, whashing, первичного антитела и очистки. Смотрите http://www.idisco.info (ЧАСТО И TROUBLESHOOT). |
| Недостаточная декалькификация | Используйте более строгую обработку декальцификации образца с EDTA21 или Морзе решение для тканей головы особенно. | ||
| Очистка iDISCO | Образцы непрозрачны или коричневого цвета | Недостаточное отбеливание | Используйте свежий раствор H2O2, увеличьте объем и/или время инкубации. |
| Наличие окисления | Заполните трубку полностью, чтобы избежать присутствия воздуха. | ||
| Недостаточная очистка | Увеличение объема и/или инкубации. Смотрите http://www.idisco.info (ЧАСТО И TROUBLESHOOT). | ||
| Обнаружение Tracer | Необнаруживаемый трассировщик | Неправильная комбинация выбранного трассировщика | Alexa 555, 594 и 647 фторхромы устойчивы к протоколу iDISCO5,6,7,8,9,10. Однако, это не относится к FITC, GFP, флюорохром RFP. |
| Точка времени жертвоприношения после инъекции | Предпочитают OVA-A555 для краткосрочного (15 мин) дренажного анализа в местных позвоночных лимфатических. Для анализа дренажа лимфатических узлов антитела OVA-A555 и Lyve1 могут быть использованы для более длительного анализа . | ||
| Изображение: захват и анализ | Захваченные изображения лимфатической цепи не являются удовлетворительными | Проблема вскрытия (лимфатические узлы отсутствуют) | Включите тщательно позвонков / черепа соседних тканей в расчлененный образец, в соответствии с лимфатической цепи, что вы хотите изображение. |
| Проблема с изображением | 1. Изменение параметров приобретения LSFM: интенсивность лазера, световой лист численной диафрагмы, толщина светового листа, время экспозиции. 2. Поместите образец в поддержку, чтобы уменьшить путь, пройденный светом через ткани до цели. 3. Убедитесь, что есть нет пузырьков внутри образца ткани во время приобретения. |
Таблица 2: Рекомендации по устранению неполадок для каждого шага протокола, включая возможные проблемы и решения.
Обсуждение
Протокол iDISCO/LSFMобеспечивает беспрецедентное 3D-виды лимфатической сети, связанной с ЦНС, в окружающих ее тканях на клеточном уровне разрешения. Этот протокол хорошо адаптирован к образцам среднего размера, не exeeding 1,5 см3, из-за ограничений оптической системы LSFM, сокращение рабочего расстояния, и большой размер коммерческих объективных линз для микроскопии высокого разрешения23. Это ограничение предотвращает захват всей лимфатической системы, связанной с мозгом. Важно отметить, что область исследования должна быть осторожно делимитированных и тканей, окружающих ЦНС должны быть тщательно расчленены для того, чтобы включить экстракраниальных лимфатических сосудов и LNs, которые способствуют всей лимфатической схемы (Таблица 2).
В дополнение к размеру и анатомическим соображениям, сложность окружающих мезенхимальных тканей варьируется вдоль черепа и позвоночного столба, что требует адаптации декалькации и предварительной очистки для того, чтобы получить однородное уточнение образца и обеспечить распространение светового луча в мягкой изотропной биологической ткани. При отсутствии костей, LFSM визуализации тканей головного или спинного мозга не требует стадии декалькификации, и окончательное разрешение захваченных изображений является оптимальным19. Вышеупомянутый протокол, который включает в себя мягкий шаг декальцификации с решением Морзе, хорошо адаптирован для LSFM изображения позвоночного столба, как показано на рисунке 1 и рисунок 4. В отличие от этого, область шеи отображает особенно сложную анатомию костей в дополнение к нескольким слоям мышц, жира и железистых тканей, которые снижают качество захваченных изображений LSFM, как это отражено в рисунке 3B. Таким образом, LSFM-изображение области шеи и шейки матки может быть улучшено путем более строгого лечения тканей; например, с EDTA, как ранее сообщалось24. Таким образом, шаг декалькификации имеет решающее значение, и условия декалькификации должны быть предварительно протестированы для каждого антитела, используемого перед началом полногопротокола iDISCO(Таблица 2).
В то время+как протокол iDISCO /LSFM позволяет получить 3D-вид соединительных цепей между менингеальными и эпидуральными пространствами и связанными с ними LN, прямой количественный анализ лимфатических сосудов из LSFM-захваченных изображений не представляется возможным по следующим причинам: 1) разграничение лимфатических схем сосудов является ненадежным из-за прерывистой картины лимфатического маркера выражение, потому что membranar LYVE1 является ежетерогно распределены21 и PROX1 имеет ядерную модель выражения22; 2) неоднородное проникновение антител, а также анисотропии, которые могут сохраняться в биологической ткани из-за неполной и неоднородной декалькации и предварительной очистки. Таким образом, изображение LSFM должно быть расширено с помощью инструментов виртуальной реальности, которые позволяют интерактивную визуализацию и тем самым облегчают количественную оценку лимфатической сосудов (www.syglass.io). Примечательно также, что точное описание связанных с ЦНС схем требует резервного копирования информации LSFM с конфокальными данными высокого разрешения, полученными путем обычного иммуномаркирования на тонких (5-10 мкм) криостата или парафин-встроенных секций ткани, особенно для точной локализации положения лимфатических сосудов в отношении dura mater и CSF, как сообщалось ранее11,14,18.
Протокол iDISCO/LSFMпозволяет трехмерную визуализацию макромолекулярного дренажа в лимфатической системе, связанной с ЦНС, как показано на рисунке 3 и на рисунке 4. Тем не менее, функциональная оценка лимфатического дренажа требует, в дополнение к рекомендациям по iDISCO/LSFMпротокол подробно описано выше, после строгой процедуры, как конечный результат зависит от качества инъекционной хирургии, выбор места доставки, тип и вводили объем макромолекула маркера используется, и время жертвоприношения после администрирования трассировщика ( Таблица2). Из-за вариаций схемы трассировки между инъекционными животными, характеристика лимфатических дренажных схем требует больших экспериментальных групп ('gt;10 по состоянию инъекции). В представленном протоколе, 1) дюра-матер должны быть проколоты перед инъекцией, чтобы предотвратить нежелательные поражения и проникновение в ткани ЦНС; 2) вводимый объем должен быть меньше 2 мл, чтобы ограничить нежелательное диффузию через отверстие для инъекций, вдоль капилляра инъекций, в эпидуральное пространство или экстрапозвоночный ткани; 3) глубина инъекций капиллярной вставки должна быть ограничена 2 мм ниже dura mater, чтобы избежать травмы ЦНС или mistargeting в ICM и интраспинальных инъекций, соответственно. Отметим также, что для оценки наличия инъекций внутри лимфатических сосудов необходимо провести дополнительный конфокальный анализ соседних сегментов позвонков с высоким разрешением. Этот анализ требует установления интенсивности профиль участков для трассировщика и лимфатического маркера на поперечных участках маркера помечены лимфатических сосудов. Этот подход был ранее использован для демонстрации OVA555 поглощения ThLb лимфатических на 15 минут после инъекции (Дополнительный рисунок 5F в Иаков и др.14). Тем не менее, он не был проиллюстрирован для анти-LYVE1 трассировщик в настоящем исследовании (Рисунок 4).
Среди возможных трассировщиков CSF, OVA-A555 является отличным вариантом, поскольку он устойчив кпроцедуре протокола iDISCO и поддерживает высокую флуоресценцию для LSFM изображений. Однако обратите внимание, что тип трассировщика должен быть выбран в соответствии с. точкой времени анализа(Таблица 1 и Таблица 2). Как сообщалось выше, OVA-A555 маркировки местных позвонков лимфатических сосудов наблюдается на 15 мин после инъекции14. Тем не менее, OVA-A555 больше не обнаруживается в этих местных лимфатических цепях на 45 мин после инъекции(рисунок 3) в отличие от анти-LYVE1 антитела(Рисунок 4).
В заключение следует,+что протокол iDISCO /LSFM хорошо адаптирован для исследования 3D-структуры и дренажа лимфатической системы, связанной с ЦНС, в физиологических и патологических состояниях, таких как ЦНС и рак позвонков, или заболевания позвонков и суставов. Хотя полная процедура является длительной и требует методологической строгости, она предоставляет ценную, уникальную информацию при использовании с дополнительным анализом с использованием инструментов виртуальной реальности и конфоцальной визуализации высокого разрешения.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Национальным институтом Санте и де ла Рехерш Медикал, Национальное агентство Рехерче (ANR-17-CE14-0005-03), Федерация за recherche sur le Cerveau (FRC 2017), Carnot Maturation (в L.J.), Федеральный университет де Рио-де-Джаньеро (UFRJ для J.B.), NIH (R01EB016629-01) и йельский университет медицины. Мы признаем платформы ICM: ICM-КВАНТ для клеточной визуализации и ИСМ-гистамики для иммуногистохимии. Все работы с животными велись на объекте PHENO-ICMice. Ядро поддерживается 2 "Инвестиции d'avenir" (ANR-10- IAIHU-06 и ANR-11-INBS-0011-NeurATRIS) и "Фонд за recherche M'ddicale". Мы признательны Николя Ренье за методологические советы и чтение рукописей.
Материалы
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| Centrifuge tubes: 0.2ml | Eppendorf | 30124359 | |
| Centrifuge tubes: 2ml | Eppendorf | 30120094 | |
| Conical centrifuge tubes: 15ml | Falcon | 352096 | |
| Conical centrifuge tubes: 50ml | Falcon | 352070 | |
| Microtome blade 80mm | Microm Microtech France | F/MM35P | |
| Needles 26G (0.45x13 mm) | Terumo | AN*2613R1 | |
| Syringe 1ml | Terumo | SS+01H1 | |
| Microscopes and imaging softwares | |||
| AxioZoom.V16 fluorescence stereo zoom microscope, equipped with an ORCA-Flash 4.0 digital sCMOS camera (Hamamatsu Photonics) or an OptiMOS sCMOS camera | Zeiss | ||
| Imspector Microscope controller software, Version v144 (acquisiton software) | Abberior instruments | ||
| Imaris File Converter x64 9.2.0(file convertion software) , Imaris stitcher software 9.2.0 (stitcher software), Imaris x64 9.2.0 (3D software) | OXFORD instruments | ||
| LED lasers (OBIS) LVBT Laser module 2nd generayion | COHERENT | ||
| Ultramicroscope II equipped with a sCMOS camera (Andor Neo) and a 4 × /0.3 objective lens (LVMI-Fluor WD6) | LaVision Biotec | ||
| Reagents | |||
| Alexa Fluor 568 Donkey anti Rabbit | Thermo Fisher | A10042 | |
| Alexa Fluor 647 Donkey anti goat | Jackson ImmunoResearch | 705-605-147 | |
| Alexa Fluor 647 Donkey anti Rabbit | Jackson ImmunoResearch | 711-605-152 | |
| Anti-LYVE1 polyclonal antibody | Angiobio | #11-034 | |
| Anti-PROX1 goat polyclonal IgG antibody | R&D systems | #AF2727 | |
| Buprenorphine Injection Ampoules (Buprecare solution, 0.3mg/ml) | Animalcare | Ampule 1ml | |
| Dibenzyl Ether 100% (DBE) | Sigma Aldrich | 108014 | |
| Dichloromethane 100% (DCM) | Sigma Aldrich | 270997 | |
| Formic acid 99% | CARLO ERBA | 405793 | |
| Glycine | Sigma Aldrich | G.7126 | |
| Heparine sodium salt from porcine | Sigma Aldrich | H4784 | |
| Hydrogen peroxide solution (H2O2 30%) | Sigma Aldrich | H1009 | |
| Isoflurane (Iso-Vet 100%) | Piramal | NDC 66794-013-10 | |
| Methanol 100% | Sigma Aldrich | 322415 | |
| Ovalbumin Alexa Fluor 555 Conjugate | Invitrogen | 11549176 | |
| Phosphate Buffer Solution PBS (stock solution 10X) | Euromedex | ET330-A | |
| Sodium Pentobarbital (Euthasol 400mg/mL) | Dechra | 08718469445110 | |
| Tri-sodium citrate | VWR | 6132-04-3 | |
| Surgical tools and equipments | |||
| Anaesthesia system | Univentor | Univentor 410 Anaesthesia Unit | |
| Glass micropipette puller | Narishige | PC-10 | |
| Heating pad | CMA Microdialysis AB | CMA 450 Temperature controller | |
| Microcapillaries (Glass Capillaries) | Harvard Apparatus | GC120-15 | |
| Microforceps, forceps,dissection scissors and Michel Suture Clips (7.5 × 1.75mm) | Fine Science Tool | 12040-01 | |
| Scalpel (sterile disposable scalpel 23) | Swann-Norton | 0510 | |
| Stereotaxic apparatus | KOPF | Model 940 | |
| Syringe Hamilton 10µl 701N | Hamilton | 28618-U | |
| Warm air System | Vet-Tech LTD | HE011 |
Ссылки
- Plog, B. A., Nedergaard, M. The Glymphatic System in Central Nervous System Health and Disease: Past, Present, and Future. Annual Review of Pathology. 13, 379-394 (2018).
- Iliff, J. J., Goldman, S. A., Nedergaard, M. Implications of the discovery of brain lymphatic pathways. The Lancet Neurology. 14 (10), 977 (2015).
- Engelhardt, B., et al. Vascular, glial, and lymphatic immune gateways of the central nervous system. Acta Neuropathologica. 132, 317-338 (2016).
- Benveniste, H., et al. The Glymphatic System and Waste Clearance with Brain Aging: A Review. Gerontology. , 1-14 (2018).
- Louveau, A., Da Mesquita, S., Kipnis, J. Lymphatics in Neurological Disorders: A Neuro-Lympho-Vascular Component of Multiple Sclerosis and Alzheimer's Disease. Neuron. 91 (5), 957-973 (2016).
- Ma, Q., Ineichen, B. V., Detmar, M., Proulx, S. T. Outflow of cerebrospinal fluid is predominantly through lymphatic vessels and is reduced in aged mice. Nature Communications. 8 (1), 1434 (2017).
- Ma, Q., Decker, Y., Müller, A., Ineichen, B. V., Proulx, S. T. Clearance of cerebrospinal fluid from the sacral spine through lymphatic vessels. The Journal of Experimental Medicine. 216 (11), 2492-2502 (2019).
- Louveau, A., et al. Understanding the functions and relationships of the glymphatic system and meningeal lymphatics. The Journal of Clinical Investigation. 127 (9), 3210-3219 (2017).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Aspelund, A., et al. A dural lymphatic vascular system that drains brain interstitial fluid and macromolecules. The Journal of Experimental Medicine. 212 (7), 991-999 (2015).
- Antila, S., et al. Development and plasticity of meningeal lymphatic vessels. The Journal of Experimental Medicine. 214 (12), 3645-3667 (2017).
- Ahn, J. H., et al. Meningeal lymphatic vessels at the skull base drain cerebrospinal fluid. Nature. 572 (7767), 62-66 (2019).
- Pollay, M. The function and structure of the cerebrospinal fluid outflow system. Cerebrospinal Fluid Research. 7, 9 (2010).
- Jacob, L., et al. Anatomy and function of the vertebral column lymphatic network in mice. Nature Communications. 10 (1), 1-16 (2019).
- Louveau, A., et al. CNS lymphatic drainage and neuroinflammation are regulated by meningeal lymphatic vasculature. Nature Neuroscience. 21 (10), 1380-1391 (2018).
- Da Mesquita, S., et al. Functional aspects of meningeal lymphatics in ageing and Alzheimer's disease. Nature. 560 (7717), 185-191 (2018).
- Song, E., et al. VEGF-C-driven lymphatic drainage enables immunosurveillance of brain tumours. Nature. 577 (7792), 689-694 (2020).
- Absinta, M., et al. Human and nonhuman primate meninges harbor lymphatic vessels that can be visualized noninvasively by MRI. eLife. 6, 29738 (2017).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Renier, N., et al. Mapping of Brain Activity by Automated Volume Analysis of Immediate Early Genes. Cell. 165 (7), 1789-1802 (2016).
- Jackson, D. G., Prevo, R., Clasper, S., Banerji, S. LYVE-1, the lymphatic system and tumor lymphangiogenesis. Trends in Immunology. 22 (6), 317-321 (2001).
- Wigle, J. T., Oliver, G. Prox1 function is required for the development of the murine lymphatic system. Cell. 98 (6), 769-778 (1999).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: a tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Jing, D., et al. Tissue clearing of both hard and soft tissue organs with the PEGASOS method. Cell Research. 28 (8), 803-818 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены