Method Article
Ein Einzelzell-Dissoziationsansatz für die molekulare Analyse der Harnblase in der Maus nach Einer Rückenmarksverletzung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das Ziel dieses Protokolls ist es, ein optimiertes Gewebedissoziationsprotokoll auf ein Mausmodell der Rückenmarksverletzung anzuwenden und den Ansatz für die Einzelzellanalyse durch Durchflusszytometrie zu validieren.
Zusammenfassung
Wir beschreiben die Umsetzung von Rückenmarksverletzungen bei Mäusen, um Detrusor-Sphincter-Dyssynergie, eine funktionelle Blasenauslassverstopfung und anschließende Blasenwandumbau zu entlocken. Um die Beurteilung der zellulären Zusammensetzung der Blasenwand bei nicht verletzten Kontroll- und Rückenmarks-verletzten Mäusen zu erleichtern, haben wir ein optimiertes Dissoziationsprotokoll entwickelt, das eine hohe Zelllebensfähigkeit unterstützt und die Detektion diskreter Subpopulationen durch Durchflusszytometrie ermöglicht.
Rückenmarksverletzungen entstehen durch vollständige Transsektion des Brustrückenmarks. Zum Zeitpunkt der Gewebeernte wird das Tier unter tiefer Anästhesie mit phosphatgepufferter Kochsäure durchsetzt und Blasen in Tyrodes Puffer geerntet. Gewebe werden vor der Inkubation im Verdauungspuffer gehackt, der basierend auf dem Kollagengehalt der Mausblase optimiert wurde, wie durch das Verhören öffentlich zugänglicher Genexpressionsdatenbanken bestimmt. Nach der Erzeugung einer einzelzelligen Suspension wird das Material durch Durchflusszytometrie zur Beurteilung der Zelllebensfähigkeit, der Zellzahl und spezifischer Subpopulationen analysiert. Wir zeigen, dass die Methode Zellpopulationen mit mehr als 90% Lebensfähigkeit und einer robusten Darstellung von Zellen mesenchymaler und epithelialem Ursprungs ergibt. Diese Methode ermöglicht eine genaue nachgelagerte Analyse diskreter Zelltypen in der Mausblase und möglicherweise anderen Organen.
Einleitung
Störungen der normalen Harnblasenfunktion können für viele Menschen zu einer verminderten Lebensqualität führen. Um ein besseres Verständnis dafür zu erlangen, wie Verletzungen oder Krankheiten die normale Blasenfunktion entgleisen lassen, ist es wichtig, den normalen biologischen Zustand der Zellen in der Blase zu untersuchen und zu untersuchen, wie sie sich unter experimenteller Störung verändern. Bis heute sind jedoch die spezifischen Zellpopulationen, die sich in der Harnblase befinden, und wie sie sich mit Verletzungen verändern, unvollständig charakterisiert.
Einzelzell-Profilierungsmethoden wie Durchflusszytometrie oder einzellige RNA-Sequenzierung (scRNA-seq) haben das Potenzial, Licht auf bestimmte Zelltypen innerhalb der Blase zu werfen. Damit diese Ansätze jedoch informatives Gewebe sind, muss es so verdaut werden, dass die Lebensfähigkeit, die Genexpression und die repräsentativen Prozentsätze der Zellpopulation des geernteten Gewebes nicht beeinträchtigt werden. Protokolle, die enzymatische Disaggregation verwenden, können die Oberflächenmarkerexpression durch wahllose Proteaseaktivität1beeinflussen und dadurch die Zellidentifikation durch Durchflusszytometrie beeinflussen, während der Dissoziationsprozess selbst zur Induktion sofortiger früher Gene führen kann, wie kürzlich von Van den Brink und Kollegen2beschrieben. Die Autoren zeigten, dass die von der Dissoziation betroffene Subpopulation zwar gering war, aber aufgrund der hohen Expressionskonzentrationen der unmittelbaren frühen Gene ein starkes Kontaminierungssignal in Massenexpressionsstudien auslösen könnte. Darüber hinaus wirkte sich die Dauer des Dissoziationsprotokolls auf die nachgewiesenen Massenexpressionsniveaus von Genen aus, die für einige Subpopulationen eindeutig waren. Daher können Einzelzell-Datasets, die ohne Berücksichtigung der Auswirkungen des Dissoziationsprotokolls generiert werden, zu Veränderungen der Genexpression führen, die sich aus der Dissoziationsmethode ergeben, im Gegensatz zur zugrunde liegenden Biologie. Diese Beobachtungen legen nahe, dass veröffentlichte Einzelzell-Transkriptomikdaten mit Vorsicht interpretiert werden sollten und dass die Ergebnisse mit unabhängigen Methoden validiert werden sollten.
Obwohl, harte und langwierige Dissoziationsmethoden können genexpression in Zellenändern 2; eine effektive Isolierung der Zellen ist unerlässlich, um eine genaue Darstellung der vorhandenen Zelltypen zu erhalten. Da die Blase ein komplexes Organ ist, das mehrere Zelltypen umfasst, können einige Populationen wie urotheliale oder stromale Zellen relativ unterrepräsentiert sein, während andere Zelltypen wie Fibroblasten innerhalb der extrazellulären Matrix existieren und eine Herausforderung darstellen können, um zu isolieren. Die Dissoziation wird noch schwieriger, wenn die Blase eine signifikante Umgestaltung und Fibrose durchlaufen hat, wie sie bei Rückenmarksverletzungen3,4 oder Blasenauslassverstopfung 5,6beobachtet wurde.
Hier beschreiben wir eine optimierte Gewebedissoziationsmethode für die nachgeschaltete Einzelzellanalyse in der Rückenmarks-Verletzten-Mausblase. Mit Hilfe der Durchflusszytometrie verglichen wir vier enzymatische Verdauungsprotokolle für ihre Fähigkeit, eine Einzelzellsuspension zu erhalten, die Zelllebensfähigkeit zu unterstützen und den richtigen Anteil der Zellpopulationen aufrechtzuerhalten. Basierend auf dieser Analyse kommen wir zu dem Schluss, dass die Minimierung des Zelltodes, zellulärer Aggregate, nichtzellulärer Nukleinsäuren und potenzieller Inhibitoren nachgelagerter Analysen entscheidend für die Erreichung qualitativ hochwertiger Daten ist.
Protokoll
Die Verfahren wurden in strikter Übereinstimmung mit den Empfehlungen im Leitfaden für die Pflege und Verwendung von Labortieren der National Institutes of Health durchgeführt. Alle Experimente wurden vom Animal Care and Use Committee des Boston Children es Hospital genehmigt.
HINWEIS: Mäuse wurden in einer AAALAC-akkreditierten Tieranlage untergebracht, in der ad libitum Zugang zu Nahrung und Wasser hat. Für diese Experimente wurden weibliche Mäuse im Alter von 8 bis 201212 Wochen eingesetzt. Angesichts der Art der Verletzung wurde den Mäusen eine zusätzliche Ernährungsanreicherung zur Verfügung gestellt, um ihr Wohlbefinden zu gewährleisten.
1. Thoraxrückenmark-Transektion bei Mäusen
- Vorbereitung vor Rückenmarkstransektion
HINWEIS: Die für dieses Verfahren erforderlichen chirurgischen Instrumente sind mikrosezierende Federscheren, Mikrosezierende Zangen, Mikronahtnadeltreiber, Hämostate und 7-0 Polyglactin 910 Nähte. Weitere chirurgische Hilfsgüter sind chirurgische Vorhänge, sterile Platten für chirurgische Sendeflächen, Gazeschwämme, Baumwollspitzenapplikatoren und 1 ml Spritzen mit 25 G Nadeln.- Autoklavdie die chirurgischen Instrumente und Vorräte vor der Operation.
- Reinigen Sie den Operationsbereich und die Heizkissen mit Alkoholtüchern. Ein Heizkissen wird während der Operation verwendet und das andere für die sofortige postoperative Periode, um die Körpertemperatur des Tieres bis zur Wiedererlangung der vollen Aktivität zu halten.
- Verwenden Sie Lupen (2,5x oder mehr), um den chirurgischen Eingriff durchzuführen.
- Schalten Sie die Heizkissen, die Lichtquelle und den Glasperlensterilisator ein, um während des Verfahrens einsatzbereit zu sein.
- Öffnen Sie die chirurgischen Vorhänge und die Instrumente. Verwenden Sie sterile Handschuhe, um das chirurgische Feld zu drapieren und legen Sie die Instrumente in den chirurgischen Bereich.
- Zubereitung der Tiere
- Bringen Sie die Mäuse in den Verfahrensraum und bringen Sie auch einen sauberen Käfig für die Rückenmarks-verletzten Mäuse mit.
- Anästhesie verabreichen, indem Sie die Maus in die Induktionskammer mit isoflurane-Flow auf 3,0%, Sauerstoffdurchfluss bei 1 L/min und Absaugen bei 20 mmHg, bis es keine Pfoten-Pinch-Antwort gibt.
- Wiegen Sie das Tier sofort und legen Sie das Tier dann in die anfällige Position auf dem Heizkissen.
- Legen Sie den Anästhesiekegel eng über die Nase der Maus, schalten Sie den Gasstrom von der Induktionskammer auf den Nasenkegel und stellen Sie den Isofluranstrom auf 2% und den Sauerstoffstrom auf 1 L/min ein.
- Bestätigen Sie, dass das Tier angemessen betäupft ist, wenn keine Reaktion auf Pfoten-Pinch erfolgt. Kleben Sie die tierischen Gliedmaßen an das Heizkissen. Legen Sie ein gerolltes Stück Gazeschwamm unter die untere Brust, um zu erheben und biegen Sie die unteren Brustwirbel öffnen.
- Ophthalmologisches Schmiermittel auf beide Augen auftragen. Schmerzmittel (Meloxicam, 10 mg/kg, subkutan) und Antibiotika (Enrofloxacin, 5 mg/kg, subkutan) verabreichen.
HINWEIS: Endanwender sollten die Schmerzmittel und Antibiotika verwenden, die von ihrem lokalen Tierpflege- und Gebrauchsausschuss empfohlen werden. - Palpate der prominenteste spinöse Prozess in der Brustwirbelsäule, die in der Regel mit T13 spinous Prozess7entspricht. Rasieren Sie einen Längsrechteckbereich auf der Rückseite der Maus vom unteren Hals bis knapp unterhalb des markantesten Spinnprozesses (T13) und für 1 cm auf jeder Seite der Mittellinie.
- Chirurgischer Eingriff
- Den rasierten Bereich mit 10% Povidon-Jodlösung und 70% Ethanol dreimal alternativ in einer kreisförmigen Weise von der einschnittsfreien Stelle nach außen vorbereiten und dann das Tier mit sterilem 4 x 4 Gazeschwamm mit einem Fenster in der Mitte über dem Operationsfeld bedecken.
- Machen Sie 1,5 cm Schnitt in der Mittellinie des Rückens mit feiner Schere, die bei der prominentesten Spinnprozess endet (T13). Der Schnitt sollte die Haut und oberflächliche Faszien umfassen. Mit einer Schere trennen die Haut und oberflächliche Faszien auf beiden Seiten, um die spinlösen Prozesse und die umgebenden paraspinösen Muskeln zu belichten.
- Durch scharfe und stumpfe Sezierung trennen Sie die Muskeln von den spinösen Prozessen und den Laminaen der Wirbel T9, T10 und T11.
- Die Spinnbänder zwischen T9 und T10 und zwischen T10 und T11 mit feiner Schere schneiden scharf auf und verbrauchen dann den spinalen Prozess von T10 und führen sie sorgfältig T10 Laminektomie bilateral durch, um das Rückenmark freizulegen. Stellen Sie sicher, dass die Laminae vollständig ausgeschnitten sind.
- Transect das Rückenmark mit feiner Schere. Minimale Blutungen treten in der Regel an dieser Stelle aufgrund der Transektion der Rückenmarksgefäße auf. Komprimieren Sie den Blutungsbereich mit einem sterilen Baumwoll-Kippapplikator, um Eine Hämostase zu erreichen. Nach der Bestätigung der vollständigen Hämostase, schließen Sie die Haut mit 7-0 Polyglactin 910 kontinuierliche Nähte.
- 1 ml Salinelösung subkutan verabreichen, um eine postoperative Dehydrierung zu verhindern.
- Postoperative Pflege
- Legen Sie das Tier auf ein Heizkissen, bis die vollständige Genesung stattgefunden hat, und übertragen Sie es dann in einen Käfig für nur verletzte Rückenmarksmäuse.
- Die postoperative Pflege umfasst die tägliche Beobachtung und Daseinwägung der Tiere sowie die Überwachung der Einschnittstelle auf Anzeichen einer Infektion für bis zu 7 Tage. Verabreichen Sie 1 ml Salinelösung, Schmerzmittel (Meloxicam 10 mg/kg) und Antibiotikum (Enrofloxacin 5 mg/kg) alle subkutan täglich für 3 Tage.
HINWEIS: Endanwender sollten die Schmerzmittel und Antibiotika verwenden, die von ihrem lokalen Tierpflege- und Gebrauchsausschuss empfohlen werden. - Führen Sie den manuellen Blasenausdruck (Credé-Manöver) alle 12 stunden durch, bis das Tier in der Lage ist, selbst zu urinieren (in der Regel in 10 bis 14 Tagen). Halten Sie das Tier mit einer Hand und massieren Sie den Unterbauch mit der anderen Hand, dann fühlen und sanft komprimieren die distended Harnblase mit dem Zeigefinger und Daumen. Sanfte transiente Kompression sollte sich mit Entspannung abwechseln. Nach dem manuellen Ausdruck den Unterbauch mit Leitungswasser waschen und vorsichtig mit Papiertuch trocknen, ohne übermäßig zu reiben.
HINWEIS: Eine geringe Größe der Blase vor dem Beginn der Expression und Benetzung des Unterbauchs mit Urin sind Anzeichen dafür, dass das Tier die Fähigkeit erlangt hat, von selbst zu leeren. - Um den Gewichtsverlust zu minimieren, bieten Ernährungsanreicherung für Mäuse in Form von Nahrblut und andere nahrhafte Leckereien (Specksofties, Fruchtcrunchies und Veggie-Bisse) auf dem Boden des Käfigs für einfachen Zugang HINWEIS: In dieser Studie wurden Mäuse durchblutet und Blasen beschafft nach 8 Wochen nach SCI.
- Postoperative Komplikationen
- Minimieren Sie das Potenzial für einen Bruch der Blase durch übereifrige manuelle Blasenexpression, indem Sie die Blase nicht vollständig ausdrücken.
- Verhindern Sie die Excoriation der perinealen Haut vor einer kontinuierlichen Exposition gegenüber Urindribblings aus inkompetentem Schließmuskel durch Waschen der Perinealregion mit Leitungswasser. Minimieren Sie Entzündungen durch Anwendung von dreifacher Antibiotikasalbe.
HINWEIS: Urethrale Obstruktion aufgrund von Blutgerinnsel während der Zeit der transienten Hämaturie oder von Semen koagulum aufgrund retrograde Ejakulation bei männlichen Mäusen kann nach Rückenmarksverletzungen auftreten. Vollständige Harnröhrenverstopfung bei männlichen Mäusen gipfelt häufig in Blasenbruch und Tod. Nach unserer Erfahrung betrug die Häufigkeit der Harnröhrenverstopfung bei männlichen Mäusen, die zum Tod führte, 10%.
2. Perfusion und Gewebebeschaffung
HINWEIS: Für nachgeschaltete Analysen bestimmter Zelltypen wie Immunzellen in peripheren Geweben ist es von Vorteil, Blut durch Perfusion zum Zeitpunkt der Gewebeernte zu entfernen, wie unten beschrieben.
- Anästhesie, wie im chirurgischen Eingriff erwähnt (Schritt 2.2) und bestätigen, dass das Tier ausreichend betäut ist ohne Vorpaw-Pinch-Antwort (das Tier ist querschnittsgelähmt, daher haben die Hinterbeine das Gefühl vermindert und die Hindpaw-Pinch-Reaktion wird irrelevant).
- Legen Sie das Tier in die Supine-Position und wischen Sie den Bauch und die Brust mit 70% Ethanol, um das Fell zu befeuchten, um zu verhindern, dass es in die Operationsstelle gelangt.
- Führen Sie eine Mittellinien-Laparotomie vom Becken bis zum Zwerchfell durch. Schneiden Sie das Zwerchfell von den Rippen weg.
HINWEIS: Nach diesem Schritt ist Geschwindigkeit wichtig, da das Thoraxdruckdifferenzial nicht mehr existiert und die Lunge nicht aufblasen kann, so dass das Tier zu ersticken beginnt. - Schneiden Sie den Thorax entlang der Rippen auf der linken und rechten Seite nach dem Knochen-Knorpel-Rand auf einer Linie parallel zum Brustbein, beginnt am Zwerchfell und geht bis zur ersten Rippe.
- Legen Sie die komplette vordere Brustwand über den Kopf des Tieres und fixieren Sie sie an dieser Position mit Handtuchklemmen. Schneiden Sie die vordere Brustwand nicht ab, da dies zu starken Blutungen aus den beiden inneren Brustarterien führt.
- Schneiden Sie das Perikard mit einer feinen Schere ab.
- Schließen Sie eine 23 G Nadel an das Perfusionsgerät an, legen Sie sie dann in den linken Ventrikel und langsam in die Aorta ein, wobei Darauf zu achten ist, dass sie nicht durchbohrt wird.
HINWEIS: Das Perfusionsgerät besteht aus einer Perfusionspumpe und einer 50 ml Spritze, die mit intravenösen Schläuchen verbunden ist. - Starten Sie die Perfusion und machen Sie schnell einen kleinen Schnitt mit der Spitze der feinen Schere im rechten Vorhof für die Entwässerung. Achten Sie darauf, während der Flüssigkeitsinfusion keine Luftblasen einzuführen.
- Perfusion mit Phosphatgepufferter Saline (PBS) Lösung mit 15 ml/min laufen. Die Perfusion ist abgeschlossen, wenn die Drainage klar ist und die Farbe der Leber heller wird (Abbildung 1).
HINWEIS: Die durchschnittliche Durchblutungszeit betrug 3,5–4 min. Unzureichende Durchblutung manifestiert sich als langsames Fortschreiten des Blanchierens von Geweben und ist in der Regel auf eine falsche Positionierung der Nadel in der linken Herzkammer zurückzuführen. Die Einstellung der Nadel und die Verlängerung der Perfusionsdauer um 1 bis 2 min sorgen für eine ausreichende Durchblutung des Gewebes. - Beenden Sie die Perfusion und sezieren Sie die Blase frei von den vaskulären Pedikeln und Harnröhren und legen Sie sie in ein Mikrozentrifugenrohr, das die eiskalte Tyrodeslösung enthält.
3. Verdauung der Harnblase in der Kontrolle und Rückenmarksverletzte Mäuse
HINWEIS: Um eine effiziente Verdauungsmischung zu formulieren, die auf die Urinblase der Maus zugeschnitten ist, haben wir versucht, die Einheit von Enzymen anzupassen, die verwendet werden, um die vorherrschenden extrazellulären Matrixkomponenten wie Kollagene und Hyaluronsäure zu abbauen. Daher haben wir öffentlich verfügbare RNA-Sequenzierungsdaten, die im Rahmen des Projekts Mouse ENCODE (BioProject: PRJNA66167) generiert wurden, verwendet, um Lesevorgänge pro Kilobasis pro Million (RPKM) und Tabula Muris8 für die Beurteilung der räumlichen Expression innerhalb der Blase zu extrahieren. Kollagene 1, 3 und 6 waren die drei am höchsten exprimierenden Gene unter 42 verschiedenen Kollagenen (Abbildung 2A). Die Expression dieser Kollagene und Hyaluronan-Synthase 1 (Has1) wurden meist in Muskelzellen und Fibroblasten der Blasenwand beobachtet (Abbildung 2B).
- Vorbereitung von Puffern und Lösungen
- Bereiten Sie Die NatriumTyrode-Lösung gemäß Tabelle 1 in einer sauberen 500 ml Flasche vor. 300 ml ddH2O hinzufügen. Die Lösung ist nach der Zubereitung sauer. Stellen Sie den pH-Wert mit NaOH auf 7,4 ein. Volumen auf 500 ml mit doppeldestilliertemH2O bringen, dann aliquotieren und bei -20 °C lagern.
HINWEIS: Dieser Puffer hält das pH-Wert und das osmotische Gleichgewicht im Verdauungspuffer aufrecht und versorgt die Zellen mit Wasser und essentiellen anorganischen Ionen. Es enthält Magnesium, sowie Glukose als Energiequelle. Das Kalium in der Lösung bietet schützende Wirkung auf die elektromechanische Aktivität in der isolierten Zelllösung. Pulversalze sind hygroskopisch und sollten vor Feuchtigkeit geschützt werden. Der gesamte Inhalt der Mischung sollte sofort nach der Zubereitung verwendet werden. Die Herstellung einer konzentrierten Salzlösung wird nicht empfohlen, da sich Ausscheidungen bilden können. Die Sterilisation mittels Filtration (0,22 m Filter) kann durchgeführt werden, wenn die Zellen nach der Analyse kultiviert werden. - Bereiten Sie die enzymatische Verdauungslösung in einem 15 ml konischen Rohr vor, indem Sie empfohlene Mengen und Mengen für jede Komponente hinzufügen (Tabelle 2). NatriumTyrode-Lösung bis zu 2,5 ml hinzufügen. Wirbel gründlich aufzulösen.
HINWEIS: Papain ist eine Sulfhydrylprotease von Carica papaya latex. Papain hat eine breite Spezifität und es wird die meisten Proteinsubstrate abbauen9. Papain hat sich als weniger schädlich und effektiver als andere Proteasen in Zelldissoziationsprotokollen10erwiesen. Wir geben Einzelheiten zu den vier Dissoziationsprotokollen in Tabelle 2; Protokollabschnitt 3 beobachtet haben, um höchste Lebensfähigkeit zu unterstützen (93%) Zellsuspensionen aus Der Mausblase.
- Bereiten Sie Die NatriumTyrode-Lösung gemäß Tabelle 1 in einer sauberen 500 ml Flasche vor. 300 ml ddH2O hinzufügen. Die Lösung ist nach der Zubereitung sauer. Stellen Sie den pH-Wert mit NaOH auf 7,4 ein. Volumen auf 500 ml mit doppeldestilliertemH2O bringen, dann aliquotieren und bei -20 °C lagern.
- Dissoziationsverfahren und Vorbereitung der Zellsuspension
- Sammeln Sie die Blase von Mäusen nach der Perfusion.
- Punktieren Sie die Blase, um den Inhalt zu lösen, falls vorhanden.
- Fügen Sie 100 l der Tyrodes Lösung in ein leeres 1,5 ml Zentrifugenrohr und Tare ein. Legen Sie die Blase in das Rohr und wiegen Sie wieder, um ein genaues Blasengewicht zu bestimmen.
- Blase auf eine 10 cm Petrischale auf Eis legen und 100 L Tyrodes Lösung zum Zerlegen hinzufügen.
- Schneiden Sie stücke mit chirurgischer Schere so klein wie möglich, während Sie die Schnittzeit auf nicht mehr als 2-u20123 min pro Blase minimieren. Wenn Sie Blasengewebe von mehreren Tieren bündeln, hacken Sie die Blasen auf einmal.
- Übertragen Sie das gehackte Blasengewebe mit einer breitbohrenden Pipettenspitze in 2,5 ml Verdauungspuffer für jede Blase. Passen Sie die Lautstärke an, wenn mehrere Blasen gepoolt sind. Inkubieren Sie das Gewebe in Derautonlösung bei 37 °C in einem Inkubator auf einem Nutatormischer für 40 min.
- Am Ende der Inkubationszeit, entfernen Sie Verdauungsröhre aus dem Inkubator. Trituat (Pipet auf und ab) Verdauungslösung mit einer 5 ml Pipette für 1 min.
- Zentrifuge für 10 min bei 350 x g bei 4 °C. Entfernen Sie den Überstand und setzen Sie das Pellet in 1 ml Zellablösung wieder auf. In einem 37 °C-Inkubator 10 min auf Nutatormischer geben.
- Zentrifuge für 10 min bei 350 x g bei 4 °C. Entfernen Sie den Überstand und setzen Sie das Pellet in 1 ml RBC-Lysepuffer (1x) wieder auf. Inkubieren Sie für 1 min.
- Fügen Sie 9 ml PBS hinzu, um den RBC-Puffer zu verdünnen und die RBC-Lyse zu stoppen.
- Übergeben Sie zellendurch 70 m Zellsieb in 50 ml konische Röhre, mit dem Kolben aus einer Spritze, um das Zellsieb leicht zu kratzen, um den vollen Zelldurchgang zu gewährleisten. Achten Sie darauf, die Flüssigkeit zu sammeln, die durch Sieb geht, aber möglicherweise auf der Unterseite des Siebes gefangen werden.
- Zentrifuge für 10 min bei 350 x g bei 4 °C. Entfernen Sie den Überstand und setzen Sie das Pellet in 200 L Zellfärbepuffer (PBS mit 2% FBS) wieder auf.
- Zählen Sie die Zellen.
- Immunolabelierung spezifischer Zellen für die Durchflusszytometrie
HINWEIS: Um verschiedene Zelltypen in der Blase zu erkennen, haben wir ein mehrfarbiges Durchfluss-Zytometrie-Panel entwickelt. Um eine Kompensation durchzuführen und eine geeignete Gating-Strategie zu entwickeln, schließen wir ungefärbte und fluoreszenzminus one (FMO) Kontrollen ein. FMO-Kontrollen sind wichtig, um eine positive Bevölkerung zu verhindern, insbesondere wenn der positive Anteil verdeint ist. Das Färbeverfahren ist wie folgt.-
Blockierung von FC-RII/III-Rezeptoren auf Zellen
HINWEIS: Wir empfehlen, die unspezifische Bindung monoklonaler Antikörper durch Vorinkubation von Zellen mit monoklonalen Anti-Fc-Rezeptor-Antikörpern oder rekombinantem Fc-Protein zu blockieren.- Waschen Sie die Zellen durch Zentrifugation bei 350 x g für 5 min bei 4 °C und fügen Sie Zellfärbung Puffer.
- Verwerfen Sie Überstand und blockieren Sie fc-RII/III-Rezeptoren auf Zellen, um unspezifische Antikörperfärbung zu verhindern, indem Sie CD16- und CD32-Antikörper in den Zellfärbepuffer bei Verdünnung von 1:100 hinzufügen.
- 10 min auf Eis bebrüten.
HINWEIS: Es besteht keine Notwendigkeit, die Zellen zu waschen; Zellen können direkt nach diesem Stadium gefärbt werden.
-
Färbung für FMOs
HINWEIS: Eine Fluoreszenz-Minus-One-Steuerung (FMO) ist eine Röhre aller im Experiment verwendeten Fluorchrome, die alle Fluorchrome bis auf eine enthält.- Wenn man beispielsweise 4 verschiedene Fluorchrome (A, B C und D + Annexin V und Propidiumiodid (PI)) hat, bereiten Sie die FMO-Röhren wie folgt vor. FMO Tube 1: Antikörper konjugiert mit B, C, D Fluorchrome + (Annexin V und PI); FMO Tube 2: Antikörper konjugiert mit A, C, D Fluorchrome + (Annexin V und PI); FMO Tube 3: Antikörper konjugiert mit A, B, C Fluorchrome + (Annexin V und PI); FMO Tube 4: Antikörper konjugiert mit A, B, C, D Fluorchrome + (Annexin V); FMO Tube 5: Antikörper konjugiert mit A, B, C, D Fluorchrome + (PI).
- Betrachten Wir uns die Art des konjugierten Fluorchroms für den Antikörper Annexin V.
-
Färbung der blockierten Zellen mit gewünschten Antikörpern
- Blockierende Zellen mit entsprechenden Mastermischungen von fluorophorkonjugierten Antikörpern gegen die gewünschten Proteine für 20 min auf eisgeschütztem Eis inkubieren. Denken Sie daran, FMOs einzuschließen.
- Waschen Sie Zellen mit 1 ml Zellfärbepuffer zu jeder Röhre und zentrieren Sie dann wieder bei 350 x g für 5 min bei 10 °C.
- Entsorgen Sie den Überstand und setzen Sie das Zellpellet in 200 L Zellfärbepuffer wieder auf. Bleiben Sie auf Eis, bis Fluoreszenzdaten mit einem Durchflusszytometer erfasst werden können.
-
Anhang in V/ PI-Färbung auftragen.
- Bereiten Sie eine Funktionierenslösung von PI (100 g/ml) im 1x Annexin-Bindungspuffer vor, wie im Herstellerprotokoll für das Totzell-Apoptose-Kit beschrieben.
- Bestimmen Sie die Zelldichte, und notieren Sie sich den Puffer und das Volumen, in dem sie gespeichert sind.
- Zentrifugenproben bei 350 x g für 5 min, verwerfen Sie den Überstand und setzen Sie Zellen in 1x Annexin-Bindungspuffer auf eine Dichte von 1 x 106 Zellen/ml bei einem Volumen von 100 l aus.
- Fügen Sie fitC-Annexin V (5 l) und PI-Arbeitslösung (1 l) zu jeder Probe (100 l) hinzu, wie im Herstellerprotokoll beschrieben, und brüten Sie bei Raumtemperatur für 15 min.
- Fügen Sie den Proben 400 l 1x Annexin-Bindungspuffer hinzu, mischen Sie sie durch Inversion und halten Sie sie auf Eis bis zur Durchflusszytometrie.
-
Blockierung von FC-RII/III-Rezeptoren auf Zellen
- FACS-Kalibrierung
-
Durchflusszytometrie und Reinheitskontrolle
- Beginnen Sie die Strömungszytometrieanalyse, indem Sie die ungefärbten Zellen messen, um die Zellmorphologie und die Tröge der Fluorchrome abzubilden.
- Passen Sie die Seitenstreuung (SSC) und die Vorwärtsstreuung (FSC) an, indem Sie die Spannungen der einzelnen Fluoreszenzparameter ändern. Messen Sie die Fluoreszenzemission mit 530 nm (Annexin V) und >575 nm (PI).
- Definieren Sie die negative Grundgesamtheit im ersten Jahrzehnt, indem Sie die Raster auf jedem Punktdiagramm verwenden. Platzieren Sie jedes FMO-Steuerelement im Zytometer und korrigieren Sie die Spektralüberlappung, bis die medianen negativen und positiven Grundgesamtheiten ausgerichtet sind.
- 100.000 Ereignisse messen. Messen Sie Zellen, die mit bestimmten Markern befleckt sind, und erstellen Sie Tore für Zellpopulationen von Interesse.
-
Durchflusszytometrie und Reinheitskontrolle
- Datenanalyse
- Sammeln Sie die Daten aus dem Durchflusszytometer. Öffnen Sie die Software, um den Arbeitsbereich für die Analyse zu visualisieren.
- Erstellen eines Arbeitsbereichs
- Importieren Sie FCS-Dateien, indem Sie sie in den Arbeitsbereich ziehen. Dateien werden im Beispiel- und Gruppenabschnitt des Arbeitsbereichs angezeigt. Doppelklicken Sie auf den Beispielnamen, um die Datei zu öffnen.
- Verwenden Sie den seitenstreuenden Bereich (SSC-A) für die y-Achse und den Vorwärtsstreubereich (FSC-A) für die x-Achse (Abbildung 3A). Klicken Sie auf das Symbol für Polygon-Gating.
- Erstellen Sie ein Tor um die Zellenpopulation, die für das Punktdiagramm von Interesse ist, indem Sie auf einen Gate-Knoten klicken und dann fortfahren, um die Zellenpopulation zu umgehen, bis sie abgeschlossen ist. Doppelklick, um das Tor zu schließen.
- Benennen Sie das Tor nach der erfassten Grundgesamtheit (z. B. "Alle Zellen") und klicken Sie auf OK.
HINWEIS: Durch Doppelklick im Gate "Alle Zellen" wird ein neues Diagrammfenster geöffnet, in dem nur die ereignisse angezeigt werden, die in "Alle Zellen" enthalten sind. - Passen Sie die y-Achse des neuen Punktdiagramms auf SSC-H (Seitenstreuhöhe) an, indem Sie auf den schwarzen Pfeil klicken und die y-Achse ändern.
ANMERKUNG: Dieses Tor für einzelne Zellen (Singlets) und schließt Doublets oder größere Aggregate aus (Abbildung 3B). Da einzelne Zellen eine proportionale Breite und Länge aufweisen, sollten sie als Grundgesamtheit auf der Diagonale dargestellt werden. Zellen, die außerhalb dieses diagonalen Tores fallen, sind Doublets oder größere Aggregate. - Doppelklicken Sie auf das Tor, um nekrotische (PI-positive), frühe apoptotische (Annexin V-positive, PI-negative) und spätapoptotische (Annexin V-positive, PI-negative) Zellen zu analysieren (Abbildung 3C).
- Beschriften Sie die x-Achse als Annexin V und die y-Achse als PI.
HINWEIS: In einigen Fällen, in denen die Signalintensität gering ist, können Zellpopulationen als Ergebnis der Korrektur des Hintergrunds negative Fluoreszenzwerte aufweisen. In diesem Fall wird empfohlen, eine zweiexponentielle Transformation durchzuführen. Um dies zu tun, klicken Sie auf das T neben der y-Achse und wählen Sie Achse anpassen. Ändern Sie im neuen Fenster die Skala in biexponential (Biex), fügen Sie den Achsen negative Werte hinzu, indem Sie die Breitenbasis erhöhen, und klicken Sie auf Anwenden. Dadurch wird die Auflösung von Ereignissen mit geringer Signalintensität verbessert. - Daten als Zähldiagramm anzeigen. Verwenden Sie die Registerkarte Option direkt unter der x-Achse und wählen Sie Zählerdiagramm aus dem Menü.
- Zeichnen Sie ein Quat-Tor auf dem Plot, um 4 diskrete Zielpopulationen zu definieren.
- Klicken Sie oben im Fenster, um den Layout-Editor zu öffnen, indem Sie im Layout-Editor klicken und Die Grundgesamtheiten in jeden separaten Bereich ziehen.
- Platzieren Sie Plots im Layout-Editor, indem Sie Grundgesamtheiten aus dem Arbeitsbereich in das Layout-Editorfenster ziehen und ablegen.
- Visualisierung mit Histogrammen
- Wählen Sie Histogramm auf der Registerkarte Optionen aus.
- Wenden Sie ein Tor an, um Annexin V-positive Zellen auszuwählen; Alternativ können positive und negative Populationen mithilfe des Bisektor-Tools definiert werden. Der Beispielabschnitt muss nun die verschiedenen Gruppen anzeigen, die formular und ihre Hierarchie waren.
- Um Stichproben zu vergleichen, ziehen Sie alle Histogramme übereinander. klicken Sie mit der rechten Maustaste auf das Histogramm und wählen Sie im Histogramm Stagger Offset.
- Hinzufügen statistischer Analysen
- Öffnen Sie die Registerkarte Statistik, indem Sie auf die gewünschte Bevölkerung doppelklicken. Wählen Sie die anzuwendende Funktion und den beteiligten Parameter aus.
- Wiederholen Sie dies mit anderen Populationen, indem Sie das Sigma-Symbol in den Namen der Grundgesamtheit ziehen.
- Wenden Sie die Analyse auf alle Stichproben an, indem Sie die Gating-Strategie aus der Interessenprobe auswählen und in die durch den Interessenmarker definierte Gruppe ziehen, z. B. Anhang in V.
- Erstellen Sie Gates in den FMO-Kontrollstichproben und definieren Sie negative und positive Populationen; Diese Gating-Strategie wird auf das gesamte Experiment angewendet (Abbildung 3D-u2012F).
HINWEIS: Überprüfen Sie jedes Beispiel einzeln, um sicherzustellen, dass die Gating-Ierung korrekt ist, und ändern Sie sie bei Bedarf. - Wenn Zellen mit Marker-Antikörpern (z.B. CD45) gefärbt wurden, verwenden Sie den entsprechenden FMO und Gate entsprechend.
- Um das Layout zu exportieren, klicken Sie auf Datei | Export Bild | Wählen Sie das Dateiformat (z.B. jpg, pdf).
- Klicken Sie auf Tabelle erstellen, um ein Fenster mit der endgültigen Version der Tabelle zu öffnen.
- Exportieren der Tabelle durch Auswahl datei| Speichern als | Dateiname.
Ergebnisse
Chirurgischer Eingriff
Der Erfolg der thorakalen Rückenmarkstransektion wird durch die Bewertung einer Reihe von Parametern bestimmt, von denen der offensichtlichste die Hinterbleibslähmung ist. Das Tier bewegt sich nur mit seinen Vorderbeinen und zieht seine Hinterbeine. Ansonsten sind Aktivitätsniveaus, einschließlich Fütterung, Pflege und Wachsamkeit, in der Regel normal. Darüber hinaus verlieren die Tiere die volitionale Blasenkontrolle, was dazu führt, dass der Prüfer alle 12 Stunden eine manuelle Blasenexpression benötigt, bis die Reflexenkundung nach 10 bis 14 Tagen nach der Verletzung zurückkehrt. Nach der Euthanasie beziehen sich weitere Anzeichen für den Erfolg der Verletzung in erster Linie auf die Erhöhung des Blasen-Körper-Gewichtsverhältnisses, was auf eine Umgestaltung des Gewebes hindeutet. Die histologische Analyse zeigt Hyperplasie sowohl innerhalb der urotheliale als auch der glatten Muskelabteilungen3.
Vorbereitung der einzelzelligen Suspension
Anhand öffentlich zugänglicher Expressionsdaten wurde die Anreicherung von Blasengewebe für extrazelluläre Matrixproteine bestimmt (Abbildung 2) und zur Information der Formulierung des Verdauungsmixes verwendet. Da Kollagene Schlüsselkomponenten der Blasenwand11,12sind, haben wir zunächst versucht, die am häufigsten vorkommenden Kollagene in der Mausblase mithilfe von RNA-Profiling-Datensätzen zu bestimmen, die vom Mouse ENCODE-Projekt13generiert wurden. Unsere Analyse zeigte, dass Kollagen 1A1, Kollagen 3A1, Kollagen 1A2 und Kollagen 6A1 am häufigsten Kollagentypen innerhalb der Mausblase sind (Abbildung 2A). Wir verwendeten auch das Tabula Muris (ein Kompendium von einzelzelligen Transkriptomdaten aus der Maus (Mus musculus))8, um den mRNA-Expressionsgrad von Kollagenen 1, 3, 6 und Hyaluronan zu bestimmen. Die Daten ermöglichen einen direkten und kontrollierten Vergleich der Genexpression in Zelltypen, die zwischen Geweben geteilt werden. Diese Analyse ergab, dass die Expression dieser extrazellulären Matrixkomponenten bei den mesenchymalen Zelltypen häufiger ist als in Urothelium (Abbildung 2B).
Wirkung der Dissoziation auf die Lebensfähigkeit isolierter Zellen aus der Blase
Die Analyse der Durchflusszytometrie zeigte, dass die enzymatische Verdauung mit den 4 verschiedenen Protokollen eine Lebensfähigkeit von 83 %, 86 %, 93 % bzw. 90 % ergab. So wurde Protokollabschnitt 3 als am wertvollsten für die Erhaltung der Zelllebensfähigkeit angesehen. Wir beobachteten auch, dass etwa 4% der Zellen nekrotisch waren (PI+/Annexin V-) (Abbildung 4A). Diese Beobachtungen unterstreichen die Effizienz des Verdauungsprotokolls und den sich daraus ergebenden Nutzen für die Zelllebensfähigkeit.
Auswirkungen der Rückenmarksverletzung auf verschiedene Zellpopulationen in der Blase
Wir beobachteten einen signifikanten Anstieg der Gesamtzellzahl in Blasen von SCI-Mäusen im Vergleich zu Kontrollen. Das Muster der Punktdiagramme, die aus SCI-Blasen gewonnen wurden, war auch etwas anders als die laufende Organumgestaltung aufgrund von Rückenmarksverletzungen(Abbildung 4B: erste Spalte). Im Vergleich zu Kontrollen zeigten die Blasen von SCI-Tieren einen signifikanten Anstieg der CD45-positiven Zellen.
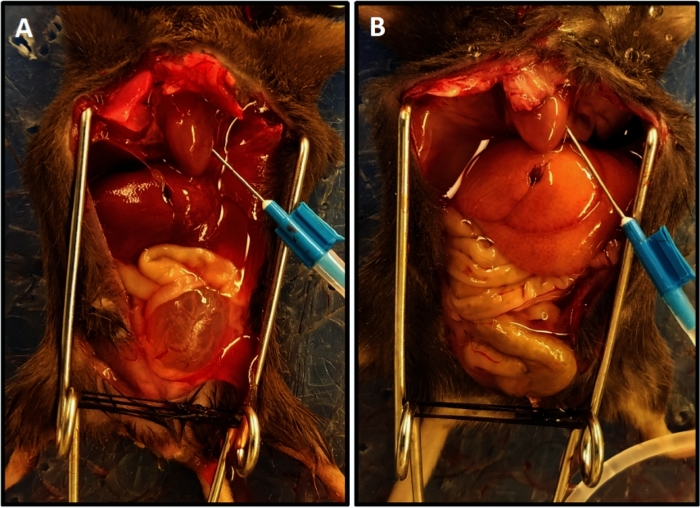
Abbildung 1: Repräsentative Perfusionsvervollständigung mit aufgehellten Farbe der Leber. (A) Zeigt die Leberfarbe zu Beginn der Perfusion. (B) Zeigt die aufgehellte Leberfarbe am Ende der Perfusion. Die Maus in (A) hatte Rückenmarkstransektion zwei Wochen vor der Perfusion, was zu Blasenhypertrophie und ihrem Vorsprung aus dem Becken im Gegensatz zur Maus in (B) führte, die keine Rückenmarksverletzung hatte; in diesem Fall ist die Blase klein und im Becken versteckt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
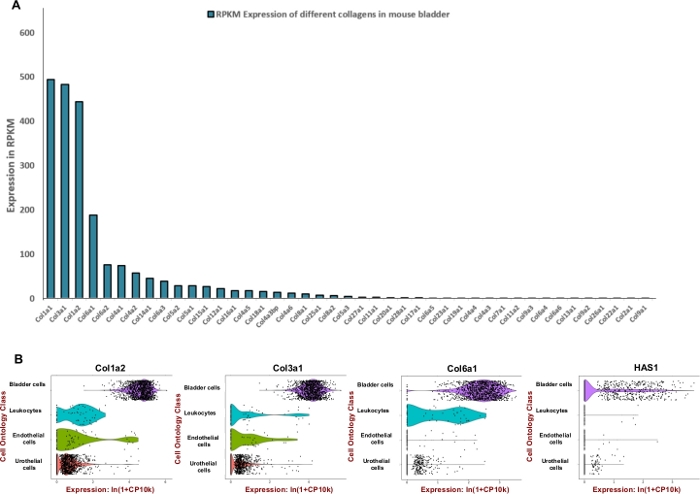
Abbildung 2: Transkriptomische Expression von komponenten der extrazellulären Matrix (ECM) in der Mausblase. (A) Balkendiagramm von 43 verschiedenen Kollagentypen. Der Ausdruck wird durch Reads Per Kilobase von Transkripten, pro Million zugeordneter Lesevorgänge (RPKM) angegeben (Daten werden aus BioProject gesammelt: PRJNA66167)14. (B) Geigenplots der Genexpression in Zelltypen, die aus mikrofluidischer Tropfen-basierter 3'-End-Zählung in einem Pool von männlichen und weiblichen dissoziierten Harnblasenproben (männlich und weiblich) gewonnen werden. Die Zählungen wurden für jede Zelle mit dem natürlichen Logarithmus von 1+ Zählungen pro Million ln (CPM+1)8protokollnormalisiert. Vor der Einnahme von Logarithmen wurde eine Pseudoanzahl von 1 CPM hinzugefügt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
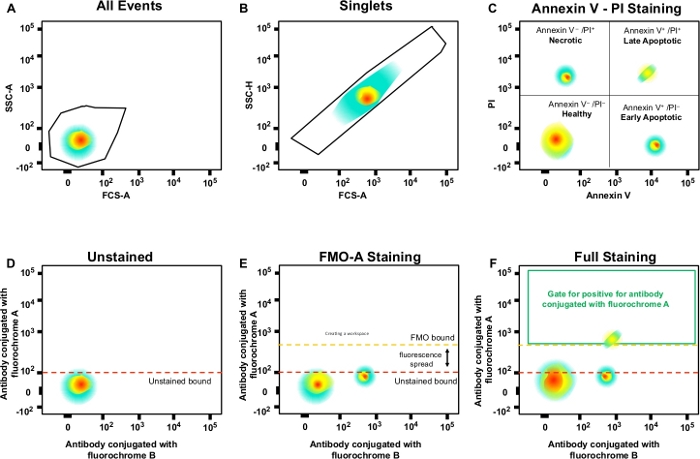
Abbildung 3: Gating-Strategie und FMO-Kontrollen zur Bestimmung der Fluoreszenzausbreitung. (A) Auswahl der Zellpopulation. (B) Gating-Strategie für Singlets. (C) Gating für nekrotische und frühe und späte apoptotische Zellen mit PI- und Annexin-V-Antikörpern. (D-u2012F) Ein schematisches Punktdiagramm aus mehrfarbiger Durchflusszytometrie (z. B. Antikörper konjugiert mit A, B, C, D Fluorochromen + (Annexin V und PI). Dies zeigt die Fluoreszenz, die sich in den Antikörper mit Fluorchrom-A-Kanal ausbreitet, der von der FMO-Steuerung im Vergleich zu einer ungefärbten Kontrolle gezeigt wird. Orange gepunktete Linie stellt FMO-Gating-Grenze im Vergleich zu unbefleckten Grenze in rot. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
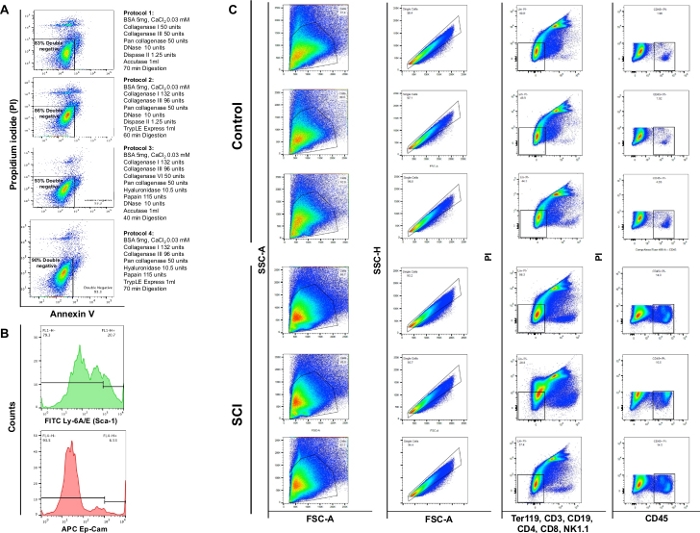
Abbildung 4: Durchflusszytometrie verschiedener Zelltypen in der Blase. (A) Anhang in V/PI Doppelfärbeflussdiagramme. Die verschiedenen Kombinationen von Enzymen und Chemikalien, die für jedes Protokoll verwendet werden, werden vor dem entsprechenden Lebensfähigkeitsdiagramm dargestellt. Diese Daten belegen die höchste Lebensfähigkeit, die mit Protokollabschnitt 3 ermittelt wurde. (B) Repräsentative Histogramme, die die Intensität von Ly-6A/E (Sca-1) und CD326 (Ep-CAM) veranschaulichen, die in einzelnen Kanälen nachgewiesen werden. (C) Wirkung von SCI auf die Zellpopulation der Mausblase. Obere Platte zeigt Ergebnisse der Färbung auf drei dissoziierten Blasen aus der Kontrolle nicht-chirurgische Mäuse und untere Panel zeigt die Ergebnisse der Färbung an drei Tieren mit SCI. Die erste Spalte ist die gesamte Zellpopulation. Die zweite Spalte zeigt die Singlet-Gating-Auswahl. Die dritte Spalte zeigt die Teilpopulation von lebenden Zellen, die für B-Zellen, T-Zellen und NK-Zellen negativ sind. Die vierte Spalte zeigt die Färbung für lebende Zellen positiv für CD45. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Komponente | Betrag (für 500 ml) | Molarität |
| Nacl | 4.091 g | 140 mM |
| Kcl | 0,186 g | 5 mM |
| MgCl2 | 0,0476 g | 1 mM |
| D-Glucose | 0,9 g | 10 mM |
| HEPES | 1,19 g | 10 mM |
Tabelle 1: Komponenten zur Vorbereitung der Tyrodes-Lösung. Die angegebenen Komponenten sind für die Vorbereitung von 500 ml Tyrodes Lösung.
| Komponente | Menge | Protokollabschnitt 1 | Protokollabschnitt 2 | Protokoll Abschnitt 3 | ProtokollAbschnitt 4 |
| Bsa | 5 mg | Ja | Ja | Ja | Ja |
| CaCl2 | 0,03 mM | Ja | Ja | Ja | Ja |
| Kollagenase Typ I | 132,5 Stück | Ja | Ja | Ja | Ja |
| Kollagenase Typ III | 96,4 Stück | Ja | Ja | Ja | Ja |
| Kollagenase Typ VI | 50 Stück | - | - | Ja | - |
| Dnase | 10 Stück | Ja | Ja | Ja | - |
| Papain | 115 Stück | - | - | Ja | Ja |
| Pan Collagenase | 50 Stück | - | - | Ja | Ja |
| Hyaluronidase | 10,5 Stück | - | - | Ja | Ja |
| Dispase II | 1,25 Stück | Ja | Ja | - | - |
| Zelldissoziationslösung | 1 ml | Ja | - | Ja | - |
| Rekombinantes Enzym | 1 ml | - | Ja | - | Ja |
Tabelle 2: Komponenten zur Herstellung des Verdauungspuffers. Die angegebenen Komponenten sind zur Herstellung von 2,5 ml Verdauungsmischung (1 U katalysiert die Hydrolyse von 1 mol pro Substrat pro Minute bei 37 °C. Siehe Produktdatenblatt für die Definition der Einheit jedes Enzyms).
Diskussion
Das hier beschriebene Modell für die Verletzung des Rückenmarks der Maus bietet eine reproduzierbare Methode, um eine funktionelle Blasenauslassverstopfung aufgrund des Koordinationsverlusts zwischen Blasenkontraktion und externer Harnröhren-Schließmuskelentspannung zu schaffen. Dies wiederum erinnert an eine tiefgreifende Umgestaltung der Blasenwand bereits 2 Wochen nach einer Verletzung, die durch die Ausdehnung der urotheliale und glatten Muskelabteilungen gekennzeichnet ist. Kritische Schritte bei der Umsetzung des SCI-Modells bei Nagetieren sind (i) die strenge Aufmerksamkeit für die manuelle Blasenexpression während der Zeit des Wirbelsäulenschocks, die sich für 10 bis 201214 Tage nach der Verletzung ergibt; ii) anreichern, um den Gewichtsverlust zu minimieren; und (iii) Abschwächung des Potenzials für Urinverbrühungen insbesondere für Experimente, die über die Rückkehr der Reflexvoidelung hinausgehen. Zu den Einschränkungen des Modells gehören das Potenzial für Harnröhrenverschluss bei Mäusen aus Blutgerinnseln während der Zeit der transienten Hämaturie und zusätzlich bei männlichen Mäusen aus Semen koagulum nach retrograde Ejakulation nach der Operation.
Der hier beschriebene Ansatz der Gewebedissoziation veranschaulicht, wie wichtig es ist, strukturelle Veränderungen in Geweben zu berücksichtigen, die sich aus der experimentellen Beleidigung ergeben, in diesem Fall eine signifikante Gewebeumgestaltung nach GG, die nachgelagerte Analysen beeinflussen kann. Mit der Zunahme der Einzelzellanalysen ist es entscheidend sicherzustellen, dass die in der Genexpression beobachteten Unterschiede nicht einfach das Ergebnis dissoziationsinduzierter Störungen sind, sondern wirklich repräsentativ für die zugrunde liegenden biologischen Veränderungen sind, die für das Krankheitsmodell relevant sind. Die Verwendung öffentlich verfügbarer Expressionsdaten ermöglichte es uns, die Formulierung von Verdauungspuffern zu modifizieren, um eine effektive Verdauung der extrazellulären Matrix zu gewährleisten und gleichzeitig die Lebensfähigkeit zu maximieren. Weitere Modifikationen, die in zukünftigen Anwendungen in Betracht gezogen werden könnten, umfassen die Hinzufügung von Actinomycin D, um die Transkription von unmittelbaren frühen Genen zu stoppen, die empfindlich auf das Dissoziationsprotokoll15reagieren.
Pipettiertechnik ist entscheidend, wenn Gewebe getrennt oder Zellen übertragen werden, die sich bereits in Suspension befinden. Um die physische Schädigung von Zellen durch Scherkräfte zu reduzieren, ist es wichtig, während der Zellresuspension sanft und langsam Pipette zu pipette. Es wird generell empfohlen, Breitbohrpipettenspitzen zu verwenden. Bei Verwendung von Standardspitzen ist es besonders wichtig, Zellsuspensionen vorsichtig zu pipetteisieren, um Scherkräfte zu vermeiden, die sonst Zellen schädigen würden. Die Verwendung von Zellsieben ist in diesem Protokoll unvermeidbar, jedoch kann die Zellkonzentration um 20 % oder mehr sinken, begleitet von einem Volumenverlust von 100 l oder mehr. Wir empfehlen, die Zellkonzentration nach der Belastung zu bestimmen, um eine genaue Zellzahl zu gewährleisten.
In der Durchflusszytometrie liefern FMO-Kontrollen ein Maß für den Hintergrund aufgrund von Signaldurchblutungen durch überlappende Emissionsspitzen. Sie sind kein Maß für unspezifische Antikörperbindung oder Hintergrundfärbung, die vorhanden sein kann, wenn ein Antikörper in diesem Kanal enthalten ist. Um die unspezifische Antikörperbindung zu berücksichtigen, muss man geeignete Isotypkontrollen einschließen; für die Hintergrundfärbung muss man negative Kontrollen einschließen. Zusammengenommen gewährleisten diese Kontrollen eine genaue Messung der Zellpopulationen.
Offenlegungen
Es wurden keine Interessenkonflikte angemeldet.
Danksagungen
Diese Arbeit wurde durch Zuschüsse der National Institutes of Health (R01 DK077195 bis R.M.A, R01 DK104641 bis R.M.A und D.R.B) unterstützt. Wir würdigen wertvolle Beiträge von Dr. Stuart Orkin in der Abteilung für Hämatologie/Onkologie, boston Children es Hospital, Department of Pediatrics, Harvard Medical School und dem Dana-Farber Cancer Institute. Wir würdigen auch die Unterstützung von Kyle Costa bei der postoperativen Pflege von Mäusen, Mary Taglienti und Dr. Habiballah Shojaeisaadi (Dr. Yang Shi Laboratory, Dept. of Pediatrics, Division of Newborn Medicine, Dept. of Pediatrics, Division of Newborn Medicine, Boston Children es Hospital, Harvard Medical School) für technische Hilfe und hilfreiche Diskussionen.
Materialien
| Name | Company | Catalog Number | Comments |
| 2.5 X Magnifying Loupes | |||
| 7-0 Vicryl suture, 6.5mm needle 3/8 circle | ETHICON | J546 | |
| 70 μm Cell Strainer | Thermofisher | 22363548 | |
| Accutase in BPBS, 0.5mM EDTA | Millipore | SCR005 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| APC anti-mouse CD326 (Ep-CAM), rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 118213 | |
| BB515 Rat Anti-Mouse CD45, rat monoclonal, IgG2b, κ, Clone 30-F11 | BD Biosciences | 564590 | |
| BONN Micro Dissecting Forceps, Straight, 1x2 teeth, 3.75" length, 0.3mm tip width, 0.12mm teeth | ROBOZ Surgical Instrument Company, Inc. | RS-5172 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Bovine Serum Albumin | Sigma | A9647-100G | |
| CaCl2 | Sigma | 2115-250ML | |
| CASTROVIEJO Micro Suturing Needle Holder, Straight with lock, 5.75" length | ROBOZ Surgical Instrument Company, Inc. | RS-6412 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Cell Counting Kit, 30 dual-chambered slides, 60 counts, with trypan blue | Biorad | 1450003 | |
| Cell Staining Buffer | BioLegend | 420201 | |
| Collagenase from Clostridium histolyticum | Sigma | C0130-1G | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Collagenase Type III | Worthington Biochemical Corporation | LS004182 | |
| Collagenase, Type 6 | Worthington Biochemical Corporation | LS005319 | |
| Dead Cell Apoptosis Kit with Annexin V Alexa Fluor 488 & Propidium Iodide (PI) | Thermofisher | V13241 | |
| Dispase II | Sigma | D4693-1G | |
| DNase | Sigma | DN25-1G | |
| Enrofloxacin (Baytril) | Bayer Health Care LLC, | NADA # 140-913 Approved by FDA. Lot No.: AH01CGP | 2.27% Injectable Solution |
| Falcon 15 ml conical centrifuge tubes | Fisher Scientific | 352096 | |
| Falcon 50 ml conical centrifuge tubes | Fisher Scientific | 352070 | |
| FITC anti-mouse Ly-6A/E (Sca-1) Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 122505 | |
| Hyaluronidase from sheep testes, Type II | Sigma | H2126 | |
| MACS SmartStrainers (100 µm) | Miltenyi Biotec, Inc. | 130-110-917 | |
| McPHERSON-VANNAS, Micro Dissecting Spring Scissors, Straight, 4" length, 0.15mm tip width | ROBOZ Surgical Instrument Company, Inc. | RS-5630 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Meloxicam | Patterson Veterinary | 07-891-7959 | |
| Papain | Worthington Biochemical Corporation | LS003119 | |
| PE/Cy5 anti-mouse CD19 Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 115509 | Dump Channel |
| PE/Cy5 anti-mouse CD3ε Antibody, Armenian hamster monoclonal, IgG, affinity purified | BioLegend | 100309 | Dump Channel |
| PE/Cy5 anti-mouse CD4 Antibody, rat monoclonal, IgG2b, κ, affinity purified | BioLegend | 100409 | Dump Channel |
| PE/Cy5 anti-mouse CD8a Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 100709 | Dump Channel |
| PE/Cy5 anti-mouse NK-1.1 Antibody, mouse monoclonal, IgG2a, κ, affinity purified | BioLegend | 108715 | Dump Channel |
| PE/Cy5 anti-mouse TER-119/Erythroid Cells Antibody, IgG2b, κ, affinity purified | BioLegend | 116209 | Dump Channel |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block), rat monoclonal, IgG2b, κ, Clone 2.4G2 | BD Biosciences | 553141 | |
| RBC Lysis Buffer (10X) | BioLegend | 420301 | |
| Red Blood Cell Lysis Buffer 1x | Biolegend | 420201 | |
| Screw-Cap microcentrifuge tubes, 1.5 ml | VWR | 89004-290 | |
| TC20 Automated Cell Counter | Biorad | 1450102 | |
| Triple antibiotic ointment (neomycin/polymyxin B/ bacitracin) | Patterson Veterinary | 07-893-7216 | skin protectant |
| TrypLE Select Enzyme (10X), no phenol red | Thermofisher | A1217701 | |
| Vetropolycin eye ointment | Dechra Veterinary Products | NADA # 065-016. Approved by FDA. | protect eyes during anesthesia |
Referenzen
- Grange, C., et al. Phenotypic characterization and functional analysis of human tumor immune infiltration after mechanical and enzymatic disaggregation. Journal of Immunological Methods. 372 (1-2), 119-126 (2011).
- van den Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Seth, A., et al. The impact of discrete modes of spinal cord injury on bladder muscle contractility. BMC Urology. 13, 24 (2013).
- Doyle, C., et al. Inosine attenuates spontaneous activity in the rat neurogenic bladder through an A2B pathway. Scientific Reports. 7, 44416 (2017).
- Gheinani, A. H., et al. Characterization of miRNA-regulated networks, hubs of signaling, and biomarkers in obstruction-induced bladder dysfunction. JCI Insight. 2 (2), 89560 (2017).
- Gheinani, A. H., et al. Concordant miRNA and mRNA expression profiles in humans and mice with bladder outlet obstruction. American Journal of Clinical and Experimental Urology. 6 (6), 219-233 (2018).
- Krishna, V., et al. A contusion model of severe spinal cord injury in rats. Journal of Visualized Experiments. (78), e50111 (2013).
- The Tabula Muris Consortium. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Gray, C. J., Boukouvalas, J., Szawelski, R. J., Wharton, C. W. Benzyloxycarbonylphenylalanylcitrulline p-nitroanilide as a substrate for papain and other plant cysteine proteinases. Biochemical Journal. 219 (1), 325-328 (1984).
- Feodorova, Y., Koch, M., Bultman, S., Michalakis, S., Solovei, I. Quick and reliable method for retina dissociation and separation of rod photoreceptor perikarya from adult mice. MethodsX. 2, 39-46 (2015).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part I: architecture, development and disease. Nature Reviews Urology. 6 (11), 596-611 (2009).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part II: regenerative applications. Nature Reviews Urology. 6 (11), 612-621 (2009).
- The ENCODE Project Consortium. An integrated encyclopedia of DNA elements in the human genome. Nature. 489 (7414), 57-74 (2012).
- Yue, F., et al. A comparative encyclopedia of DNA elements in the mouse genome. Nature. 515 (7527), 355-364 (2014).
- Wu, Y. E., Pan, L., Zuo, Y., Li, X., Hong, W. Detecting Activated Cell Populations Using Single-Cell RNA-Seq. Neuron. 96 (2), 313-329 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten