Method Article
Un approccio di dissociazione a singola cellula per l'analisi molecolare della vescica urinaria nel topo dopo la lesione del midollo spinale
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
L'obiettivo di questo protocollo è quello di applicare un protocollo di dissociazione dei tessuti ottimizzato a un modello di topo di lesione del midollo spinale e convalidare l'approccio per l'analisi a singola cellula per citometria del flusso.
Abstract
Descriviamo l'implementazione della lesione del midollo spinale nei topi per provocare la dissnergia del detrusore-sfintere, un'ostruzione funzionale dell'uscita della vescica e il successivo rimodellamento della parete della vescica. Per facilitare la valutazione della composizione cellulare della parete vescicale in topi non feriti e feriti del midollo spinale, abbiamo sviluppato un protocollo di dissociazione ottimizzato che supporta un'elevata vitalità cellulare e consente il rilevamento di sottopopolazioni discrete per citometria a flusso.
La lesione del midollo spinale è creata dalla completa trasezione del midollo spinale toracico. Al momento della raccolta dei tessuti, l'animale viene perfuso con soluzione salina tamponata da fosfati in anestesia profonda e le vesciche vengono raccolte nel tampone di Tyrode. I tessuti vengono tritati prima dell'incubazione nel tampone di digestione che è stato ottimizzato in base al contenuto di collagene della vescica del topo determinato dall'interrogazione di database di espressione genica pubblicamente disponibili. Dopo la generazione di una singola sospensione cellulare, il materiale viene analizzato dalla citometria del flusso per la valutazione della vitalità cellulare, del numero di cellule e delle sottopopolazioni specifiche. Dimostriamo che il metodo produce popolazioni cellulari con una vitalità superiore al 90% e una solida rappresentazione delle cellule di origine mesenchimale ed epiteliale. Questo metodo consentirà un'accurata analisi a valle dei tipi di cellule discrete nella vescica del topo e potenzialmente in altri organi.
Introduzione
Le perturbazioni della normale funzione della vescica urinaria possono portare a una diminuzione della qualità della vita per molti individui. Al fine di ottenere una migliore comprensione di come lesioni o malattie deragliano la normale funzione della vescica, è importante sondare il normale stato biologico delle cellule all'interno della vescica e come cambiano sotto perturbazione sperimentale. Ad oggi, tuttavia, le specifiche popolazioni cellulari che risiedono all'interno della vescica urinaria e come cambiano con la lesione, sono state incompletamente caratterizzate.
I metodi di profilazione a singola cellula come la citometria a flusso o il sequenziamento dell'RNA a singola cella (scRNA-seq) hanno il potenziale per far luce su specifici tipi di cellule all'interno della vescica. Tuttavia, affinché questi approcci siano tessuti informativi devono essere digeriti in modo da non influire sulla vitalità, sull'espressione genica e sulle percentuali rappresentative della popolazione cellulare del tessuto raccolto. I protocolli che utilizzano la disaggregazione enzimatica possono influire sull'espressione del marcatore superficiale attraverso l'attività di proteasi indiscriminata1, influenzando così l'identificazione cellulare mediante citometria del flusso, mentre il processo di dissociazione stesso può portare all'induzione di geni precoci immediati, come descritto di recente da Van den Brink e colleghi2. Gli autori hanno dimostrato che sebbene la sottopopolazione influenzata dalla dissociazione fosse piccola, poteva innescare un forte segnale contaminante negli studi di espressione alla rinfusa a causa degli alti livelli di espressione dei primi geni immediati. Inoltre, la durata del protocollo di dissociazione interessato ha rilevato livelli di espressione di massa rilevati di geni che si sono dimostrati unici per alcune sottopopolazioni. Pertanto, i set di dati a singola cellula generati senza contabilizzarsi dell'impatto del protocollo di dissociazione possono produrre cambiamenti nell'espressione genica derivanti dal metodo di dissociazione, al contrario della biologia sottostante. Queste osservazioni suggeriscono che i dati pubblicati sulla trascritomica a singola cella dovrebbero essere interpretati con cautela e che i risultati dovrebbero essere convalidati con metodi indipendenti.
Anche se, metodi di dissociazione duri e lunghi possono alterare l'espressione genica nellecellule 2; un efficace isolamento delle cellule è essenziale per ottenere una rappresentazione accurata dei tipi di cellule presenti. Poiché la vescica è un organo complesso che comprende più tipi di cellule, alcune popolazioni come le cellule uroteliali o stromali possono essere relativamente sottorappresentate, mentre altri tipi di cellule come i fibroblasti esistono all'interno della matrice extracellulare e possono essere difficili da isolare. La dissociazione diventa ancora più impegnativa se la vescica ha subito un rimodellamento significativo e fibrosi come quella osservata nella lesione del midollo spinale3,4 o nell'ostruzione dell'uscita dellavescica 5,6.
Qui descriviamo un metodo di dissociazione dei tessuti ottimizzato per l'analisi a valle di singole cellule nella vescica del topo ferita al midollo spinale. Utilizzando la citometria del flusso, abbiamo confrontato quattro protocolli di digestione enzimatica per la loro capacità di produrre una sospensione a singola cellula, supportare la vitalità cellulare e mantenere la giusta proporzione di popolazioni cellulari. Sulla base di questa analisi, concludiamo che ridurre al minimo la morte cellulare, gli aggregati cellulari, gli acidi nucleici non cellulari e i potenziali inibitori dell'analisi a valle sono fondamentali per ottenere dati di alta qualità.
Protocollo
Le procedure sono state eseguite in stretta conformità con le raccomandazioni contenute nella Guida per la cura e l'uso degli animali da laboratorio degli Istituti Nazionali di Salute. Tutti gli esperimenti sono stati approvati dal Animal Care and Use Committee del Boston Children's Hospital.
NOTA: I topi erano ospitati in una struttura animale accreditata AAALAC con accesso ad libitum a cibo e acqua. Per questi esperimenti sono stati utilizzati topi femmine a 8\u201212 settimane di età. Data la natura della lesione, è stato fornito un ulteriore arricchimento nutrizionale ai topi per garantirne il benessere.
1. Trasezione del midollo spinale a basso toracico nei topi
- Preparazione prima della trasezione del midollo spinale
NOTA: Gli strumenti chirurgici necessari per questa procedura sono le forbici a molla microsezionanti, le pini di microsezionatura, il driver dell'ago micro suturante, gli emostati e le suture di poliglatina 910 7-0. Altre forniture chirurgiche richieste sono tende chirurgiche, fogli sterili per campo chirurgico, spugne di garza, applicatori a punta di cotone e siringhe da 1 ml con aghi da 25 G.- Autoclavare gli strumenti chirurgici e le forniture prima dell'intervento chirurgico.
- Pulire l'area chirurgica e le pastiglie riscaldanti con salviette alcoliche. Una pastiglia riscaldante verrà utilizzata durante l'intervento chirurgico e l'altra per l'immediato periodo postoperatorio per mantenere la temperatura corporea dell'animale fino a riconquistare la piena attività.
- Utilizzare loupes ingrandinti (2,5x o più) per eseguire la procedura chirurgica.
- Accendere le pastiglie di riscaldamento, la fonte di luce e lo sterilizzatore di perline di vetro per essere pronti per l'uso durante la procedura.
- Aprire le tende chirurgiche e gli strumenti. Utilizzare guanti sterili per drappeggiare il campo chirurgico e posizionare gli strumenti nel campo chirurgico.
- Preparazione degli animali
- Porta i topi nella sala procedure e porta anche una gabbia pulita per i topi feriti del midollo spinale.
- Somministrare l'anestesia posizionando il mouse nella camera di induzione con flusso di isoflurane impostato al 3,0%, flusso di ossigeno a 1 L /min e aspirazione a 20 mmHg fino a quando non vi è risposta paw-pinch.
- Pesare immediatamente l'animale e quindi posizionare l'animale in posizione soggetta alla protezione sulla pastiglia riscaldante.
- Posizionare il cono anestetico comodamente sul naso del topo, passare il flusso di gas dalla camera di induzione al cono del naso e impostare il flusso di isoflurane al 2% e il flusso di ossigeno a 1 L /min.
- Confermare che l'animale è adeguatamente anestetizzato con l'assenza di risposta al paw-pinch. Nastro gli arti animali sul pad riscaldante. Posizionare un pezzo arrotolato di spugna di garza sotto il petto inferiore per elevare e flettere le vertebre toraciche inferiori.
- Applicare lubrificante oftalmico su entrambi gli occhi. Somministrare antidolorifici (Meloxicam, 10 mg/kg, per via sottocutanea) e antibiotici (Enrofloxacina, 5 mg/kg, per via sottocutanea).
NOTA: Gli utenti finali devono utilizzare i farmaci antidolorifici e gli antibiotici raccomandati dal loro comitato locale per la cura e l'uso degli animali. - Palpare il processo spinoso più prominente nella colonna vertebrale toracica che in genere corrisponde al processo spinoso T137. Radere un'area rettangolare longitudinale sul retro del mouse dal collo inferiore a appena sotto il processo spinoso più prominente (T13) e per 1 cm su ciascun lato della linea mediana.
- Procedura chirurgica
- Prepa l'area rasata con soluzione di iodio povidone al 10% e 70% di etanolo tre volte in alternativa in modo circolare partendo dal sito di incisione lavorando verso l'esterno e quindi coprire l'animale con sterile spugna di garza 4 x 4 con una finestra al centro sovrascriva il campo chirurgico.
- Fai un'incisione di 1,5 cm nella linea mediana della schiena usando forbici fini che terminano nel processo spinoso più prominente (T13). L'incisione dovrebbe includere la pelle e la fascia superficiale. L'uso di forbici separa la pelle e la fascia superficiale su entrambi i lati per esporre i processi spinosi e i muscoli paraspinosi circostanti.
- L'uso di dissezione acuta e smussata separa i muscoli dai processi spinosi e dalle laminae delle vertebre T9, T10 e T11.
- Dividere nettamente i legamenti interspinosi tra T9 e T10 e tra T10 e T11 usando forbici fini e quindi asportare il processo spinoso di T10 ed eseguire attentamente la laminectomia T10 bilateralmente per esporre il midollo spinale. Assicurarsi che le lamina siano completamente asportate.
- Traseleggi il midollo spinale usando forbici fini. Il sanguinamento minimo di solito si verifica a questo punto a causa della trasezione dei vasi del midollo spinale. Comprimere l'area di sanguinamento con un applicatore sterile con punta di cotone per ottenere l'emostasi. Dopo aver confermato l'emostasi completa, chiudere la pelle con 7-0 poliglactina 910 suture continue.
- Somministrare 1 mL di soluzione salina per via sottocutanea per prevenire la disidratazione postoperatoria.
- Cure postoperatorie
- Posizionare l'animale su una pastiglia riscaldante fino al completo recupero, quindi trasferirlo in una gabbia solo per i topi feriti del midollo spinale.
- La cura postoperatoria include l'osservazione e la pesatura quotidiana degli animali e il monitoraggio del sito di incisione per i segni di infezione per un massimo di 7 giorni. Somministrare 1 mL di soluzione salina, analgesico (meloxicam 10 mg/kg) e antibiotico (enrofloxacina 5 mg/kg) tutti per via sottocutanea al giorno per 3 giorni.
NOTA: Gli utenti finali devono utilizzare i farmaci antidolorifici e gli antibiotici raccomandati dal loro comitato locale per la cura e l'uso degli animali. - Eseguire l'espressione manuale della vescica (manovra credé) ogni 12 ore fino a quando l'animale non è in grado di urinare da solo (di solito in 10-14 giorni). Tenere l'animale con una mano e massaggiare l'addome inferiore con l'altra mano, quindi sentire e comprimere delicatamente la vescica urinaria distesa con l'indice e il pollice. Una delicata compressione transitoria dovrebbe alternarsi al rilassamento. Seguendo l'espressione manuale, lavare l'addome inferiore con acqua del rubinetto e asciugare delicatamente con un tovagliolo di carta senza strofinare esente.
NOTA: Una piccola dimensione della vescica prima dell'inizio dell'espressione e bagnatura dell'addome inferiore con urina sono indicazioni che l'animale ha acquisito la capacità di annullare da solo. - Per ridurre al minimo la perdita di peso, fornire arricchimento nutrizionale ai topi sotto forma di gel nutritivo e altre prelibatezze nutrienti (frullati di pancetta, croccanti di frutta e morsi di verdure) poste sul pavimento della gabbia per un facile accesso NOTA: In questo studio, i topi sono stati perfusi e le vesciche procurate a 8 settimane dopo SCI.
- Complicazioni postoperatorie
- Ridurre al minimo il potenziale di rottura della vescica a causa dell'espressione della vescica manuale troppo zealosa non esprimendo completamente la vescica.
- Prevenire l'escoriazione della pelle perineale dall'esposizione continua al dribbling delle urine dallo sfintere incompetente attraverso il lavaggio della regione perineale con acqua del rubinetto. Ridurre al minimo l'infiammazione attraverso l'applicazione di unguento triplo antibiotico.
NOTA: L'ostruzione uretrale dovuta al coagulo di sangue durante il periodo di ematuria transitoria o al coagulo di sperma a causa dell'eiaculazione retrograda nei topi maschi può verificarsi a seguito di lesioni del midollo spinale. L'ostruzione uretrale completa nei topi maschi spesso culmina nella rottura e nella morte della vescica. Nella nostra esperienza la frequenza dell'ostruzione uretrale nei topi maschi che ha portato alla morte è stata del 10%.
2. Approvvigionamento di perfusioni e tessuti
NOTA: Per le analisi a valle di alcuni tipi di cellule come le cellule immunitarie nei tessuti periferici è utile rimuovere il sangue per perfusione al momento della raccolta dei tessuti, come descritto di seguito.
- Somministrare l'anestesia come menzionato nella procedura chirurgica (fase 2.2) e confermare che l'animale è adeguatamente anestetizzato senza risposta forepaw-pinch (l'animale è paraplegico, quindi gli arti posteriori hanno diminuito la sensazione e la risposta del pizzico di zampe posteriori diventa irrilevante).
- Posizionare l'animale in posizione supina e tamponare l'addome e il torace con il 70% di etanolo per bagnare la pelliccia per evitare che entra nel sito operativo.
- Eseguire una laparotomia della linea mediana dal bacino al diaframma. Tagliare il diaframma lontano dalle costole.
NOTA: Dopo questo passaggio, la velocità è importante poiché il differenziale di pressione toracica non esiste più e i polmoni non possono gonfiarsi, quindi l'animale inizia a soffocare. - Tagliare il torace aperto lungo le costole sul lato sinistro e destro seguendo il bordo della cartilagine ossea su una linea parallela allo sterno, iniziando al diaframma e procedendo fino alla prima costola.
- Posizionare la parete toracica anteriore completa sopra la testa dell'animale e fissarla in questa posizione utilizzando morsetti per asciugamani. Non tagliare la parete toracica anteriore in quanto ciò causerà un grave sanguinamento dalle due arterie toraciche interne.
- Tagliare il pericardio usando forbici fini.
- Collegare un ago da 23 G all'apparato perfusionale, quindi inserirlo nel ventricolo sinistro e lentamente nell'aorta, facendo attenzione a non forarlo.
NOTA: L'apparecchio perfusione comprende una pompa perfusione e una siringa da 50 ml collegata a tubi per via endovenosa. - Inizia la perfusione e fai rapidamente un piccolo taglio con la punta delle forbici fini nell'atrio destro per il drenaggio. Fare attenzione a non introdurre bolle d'aria durante l'infusione di liquidi.
- Eseguire la perfusione con soluzione salina tamponata di fosfato (PBS) eseguita a 15 mL/min. La perfusione è completa quando si ottiene un drenaggio chiaro e schiareto del fegato (Figura 1).
NOTA: Il tempo medio per la perfusione è stato di 3,5-4 minuti. La perfusione inadeguata si manifesta come lenta progressione dello sbiancamento dei tessuti e di solito è dovuta a un posizionamento errato dell'ago nel ventricolo sinistro. La regolazione dell'ago e l'estensione della durata della perfusione da 1 a 2 minuti garantiranno un'adeguata perfusione dei tessuti. - Interrompere la perfusione e sezionare la vescica libera dai pedicoli vascolari e dall'uretra e posizionarela in un tubo di microcentrifugo contenente la soluzione di Tyrode ghiacciata.
3. Digestione della vescica urinaria in controllo e dei topi feriti dal midollo spinale
NOTA: Al fine di formulare un'efficiente miscela di digestione su misura per la vescica urinaria del topo abbiamo cercato di regolare l'unità di enzimi utilizzati per degradare i componenti predominanti della matrice extracellulare come collageni e acido ialuronico. Pertanto, abbiamo utilizzato i dati di sequenziamento dell'RNA disponibili pubblicamente generati dal progetto Mouse ENCODE (BioProject: PRJNA66167) per estrarre letture per kilobase per milione (RPKM) e Tabula Muris8 per la valutazione dell'espressione spaziale all'interno della vescica. I collageni 1, 3 e 6 sono stati i tre geni più espressi tra 42 collageni diversi (Figura 2A). L'espressione di tali collageni e ialurona sintasi 1 (Has1) è stata osservata principalmente nelle cellule muscolari e nei fibroblasti della parete vescicale (Figura 2B).
- Preparazione di tamponi e soluzioni
- Preparare la soluzione di tirodo di sodio secondo la tabella 1 in una bottiglia pulita da 500 ml. Aggiungere 300 mL di ddH2O. La soluzione è acida dopo la preparazione. Regolare il pH a 7,4 utilizzando NaOH. Portare il volume a 500 mL utilizzando H2O doppio distillato, quindi aliquota e conservare a -20 °C.
NOTA: Questo tampone mantiene il pH e l'equilibrio osmotico nel tampone di digestione e fornisce alle cellule acqua e ioni inorganici essenziali. Contiene magnesio, così come glucosio come fonte di energia. Il potassio nella soluzione fornisce effetti protettivi sull'attività elettromeccanica nella soluzione cellulare isolata. I sali in polvere sono igroscopici e devono essere protetti dall'umidità. L'intero contenuto della miscela deve essere utilizzato immediatamente dopo la preparazione. La preparazione di una soluzione salina concentrata non è raccomandata in quanto possono formarsi precipitati. La sterilizzazione mediante filtrazione (filtro da 0,22 μm) può essere eseguita se le cellule devono essere coltivate dopo l'analisi. - Preparare la soluzione enzimatica di digestione in un tubo conico da 15 ml aggiungendo volumi e quantità raccomandati per ciascun componente(tabella 2). Aggiungere la soluzione di tirodo di sodio fino a 2,5 mL. Vortice completamente da sciogliere.
NOTA: La papaina è una proteasi sulfhydryl dal lattice di Carica papaya. La papaina ha un'ampia specificità e degrada la maggior parte dei substratiproteici 9. La papaina si è dimostrata meno dannosa e più efficace di altre proteasi nei protocolli di dissociazione cellulare10. Nella tabella 2 forniamo dettagli sui quattro protocolli di dissociazione; abbiamo osservato il protocollo sezione 3 per supportare la massima vitalità (93%) delle sospensioni cellulari preparate dalla vescica del topo.
- Preparare la soluzione di tirodo di sodio secondo la tabella 1 in una bottiglia pulita da 500 ml. Aggiungere 300 mL di ddH2O. La soluzione è acida dopo la preparazione. Regolare il pH a 7,4 utilizzando NaOH. Portare il volume a 500 mL utilizzando H2O doppio distillato, quindi aliquota e conservare a -20 °C.
- Procedura di dissociazione e preparazione della sospensione cellulare
- Raccogliere la vescica dai topi dopo la perfusione.
- Forare la vescica per rilasciare il contenuto, se del caso.
- Aggiungere 100 μL della soluzione di Tyrode a un tubo di centrifuga e tara vuoti da 1,5 ml. Posizionare la vescica nel tubo e pesare di nuovo per determinare un peso preciso della vescica.
- Posizionare la vescica su una piastra di Petri di 10 cm sul ghiaccio e aggiungere 100 μL della soluzione di Tiroide per la tritatura.
- Utilizzando forbici chirurgiche, tagliare i pezzi il più piccolo possibile riducendo al minimo il tempo di tritatura a non più di 2\u20123 min per vescica. Se si raggruppa il tessuto vescicale da più animali, tritare le vesciche tutto in una volta.
- Trasferire il tessuto della vescica tritato utilizzando una punta di pipetta a foro largo in 2,5 mL di tampone di digestione per ogni vescica. Regolare il volume se più vesciche sono raggruppate. Incubare il tessuto in soluzione di digestione a 37 °C in un'incubatrice su un miscelatore di nutator per 40 minuti.
- Alla fine del periodo di incubazione, rimuovere il tubo di digestione dall'incubatore. Soluzione di digestione triturata (pipetta su e giù) utilizzando una pipetta da 5 mL per 1 min.
- Centrifuga per 10 min a 350 x g a 4 °C. Rimuovere il supernatante e rimescolare il pellet in 1 mL di soluzione di distacco cellulare. Mettere in un incubatore a 37 °C su miscelatore nutator per 10 min.
- Centrifuga per 10 min a 350 x g a 4 °C. Rimuovere il supernatante e rimescolare il pellet in 1 mL di tampone di lysis RBC (1x). Incubare per 1 minuto.
- Aggiungere 9 mL PBS per diluire il buffer RBC e arrestare la llisi RBC.
- Passare le cellule attraverso un filtro cellulare da 70 μm in un tubo conico da 50 ml, utilizzando lo stantuffo da una siringa per raschiare leggermente il filtro cellulare per garantire il passaggio completo della cella. Assicurarsi di raccogliere il liquido che passa attraverso il colino ma potrebbe essere catturato sul lato inferiore del colino.
- Centrifuga per 10 min a 350 x g a 4 °C. Rimuovere il supernatante e rimescolare il pellet in 200 μL di tampone di colorazione cellulare (PBS con FBS al 2%).
- Conta le celle.
- Immunoetichettatura di cellule specifiche per la citometria a flusso
NOTA: Per rilevare diversi tipi di cellule nella vescica, abbiamo progettato un pannello di citometria a flusso multicolore. Per eseguire la compensazione e ideare una strategia di gating appropriata, includiamo controlli non contaminati e a fluorescenza meno uno (FMO). I controlli FMO sono importanti per gateare la popolazione positiva, in particolare quando la frazione positiva è fioca. La procedura di colorazione è la seguente.-
Blocco dei recettori FcγRII/III sulle cellule
NOTA: Si consiglia di bloccare il legame non specifico degli anticorpi monoclonali mediante pre-incubazione di cellule con anticorpi recettori monoclonali anti-Fc, o proteina Fc ricombinante.- Lavare le cellule per centrifugazione a 350 x g per 5 min a 4 °C e aggiungere il tampone di colorazione cellulare.
- Scartare i recettori FcγRII/III supernatanti e bloccare sulle cellule per prevenire la colorazione di anticorpi non specifici aggiungendo anticorpi CD16 e CD32 nel tampone di colorazione cellulare a diluizione di 1:100.
- Incubare sul ghiaccio per 10 minuti.
NOTA: Non è necessario lavare le cellule; le celle possono essere macchiate direttamente dopo questa fase.
-
Colorazione per FMO
NOTA: Un controllo Fluorescence Minus One (FMO) è un tubo di tutti i fluorocromi utilizzati nell'esperimento che contiene tutti i fluorocromi tranne uno.- Ad esempio, se si dispone di 4 fluorocromi diversi (A, B C e D + Annexin V e propidio ioduro (PI)), preparare i tubi FMO come segue. FMO Tube 1: Anticorpi coniugati con fluorocromi B, C, D + (Annexin V e PI); FMO Tube 2: Anticorpi coniugati con fluorocromi A, C, D + (Annexin V e PI); FMO Tube 3: Anticorpi coniugati con fluorocromi A, B, C + (Annexin V e PI); FMO Tube 4: Anticorpi coniugati con fluorocromi A, B, C, D + (Annexin V); FMO Tube 5: Anticorpi coniugati con A, B, C, D fluorocromi + (PI).
- Si consideri la natura del fluorocromo coniugato per l'anticorpo Annexin V.
-
Colorazione delle cellule bloccate con gli anticorpi desiderati
- Incubare le cellule bloccate con apposito mix master di anticorpi coniugati con fluoroforo contro le proteine desiderate per 20 minuti su ghiaccio protetto dalla luce. Ricorda di includere le FMO.
- Lavare le celle con 1 ml di tampone di colorazione cellulare aggiunto a ciascun tubo e quindi centrifugare nuovamente a 350 x g per 5 minuti a 10 °C.
- Scartare il supernatante e rimescolare il pellet cellulare in 200 μL di tampone di colorazione cellulare. Conservare sul ghiaccio fino a quando i dati di fluorescenza non possono essere acquisiti utilizzando un citometro a flusso.
-
Applicare la macchia Annexin V/ PI.
- Preparare una soluzione funzionante di PI (100 μg/mL) in 1x tampone legante annexin come descritto nel protocollo del fabbricante per il kit di apoptosi a celle morte.
- Determinare la densità delle celle e annotare il buffer e il volume in cui sono memorizzate.
- I campioni di centrifuga a 350 x g per 5 minuti, scartano le cellule supernatanti e resuspend in 1x tampone legante l'annesso ad una densità di ~1 x10 6 celle/mL in un volume di 100 μL.
- Aggiungere fitc-annexin V (5 μL) e pi soluzione di lavoro (1 μL) a ciascun campione (100 μL), come descritto nel protocollo del produttore, e incubare a temperatura ambiente per 15 min.
- Aggiungere 400 μL di 1 tampone legante l'annesso ai campioni, mescolare per inversione e tenere sul ghiaccio fino alla citometria del flusso.
-
Blocco dei recettori FcγRII/III sulle cellule
- Calibrazione FACS
-
Citometria del flusso e controllo della purezza
- Inizia l'analisi della citometria a flusso misurando le cellule non contaminate per delineare la morfologia cellulare e i trogoli dei fluorocromi.
- Regolare la dispersione laterale (SSC) e la dispersione in avanti (FSC) modificando le tensioni di ogni parametro di fluorescenza. Misurare l'emissione di fluorescenza a 530 nm (allegato V) e >575 nm (PI).
- Definire la popolazione negativa nel primo decennio utilizzando le griglie su ogni tracciato di punti. Posizionare ogni controllo FMO nel citometro e correggere la sovrapposizione spettrale fino a quando le mediane di popolazione negative e positive non sono allineate.
- Misura 100.000 eventi. Misurare le celle macchiate con marcatori specifici e creare cancelli per le popolazioni cellulari di interesse.
-
Citometria del flusso e controllo della purezza
- Analisi dei dati
- Raccogliere i dati dal citometro di flusso. Aprire il software per visualizzare l'area di lavoro per l'analisi.
- Creazione di un'area di lavoro
- Importare file FCS trascinandoli nell'area di lavoro. I file saranno visibili nella sezione di esempio e gruppo dell'area di lavoro. Fare doppio clic nel nome di esempio per aprire il file.
- Utilizzare l'area di dispersione laterale (SSC-A) per l'asse y e l'area di dispersione in avanti (FSC-A) per l'asse x (Figura 3A). Fare clic sull'icona per la gating poligonale.
- Creare un gate attorno alla popolazione di celle di interesse nel grafico a punti facendo clic per creare un nodo gate e quindi continuare a fare clic intorno alla popolazione di celle fino al completamento; fare doppio clic per chiudere il cancello.
- Assegnare al gate il nome in base alla popolazione acquisita (ad esempio, "Tutte le celle") e fare clic su OK.
NOTA: facendo doppio clic all'interno del gate "Tutte le celle" si aprirà una nuova finestra del grafico che mostra solo gli eventi contenuti in "Tutte le celle". - Regolate l'asse y del nuovo plottaggio punti su SSC-H (altezza di dispersione laterale) facendo clic sulla freccia nera e selezionate di modificare l'asse y.
NOTA: questo è un gate per celle singole (singolette) ed esclude doppietti o aggregati più grandi (Figura 3B). Poiché le singole celle hanno larghezza e lunghezza proporzionali, dovrebbero essere rappresentate come una popolazione sulla diagonale. Le cellule che cadono al di fuori di questo cancello diagonale sono doppietti o aggregati più grandi. - Fare doppio clic sul cancello per analizzare le cellule necrotiche (PI-positive), apoptotiche precoci (Annexin V-positive, PI-negative) e tardo apoptotiche (Annexin V-positive, PI-negative)(Figura 3C).
- Etichettare l'asse x come allegato V e l'asse y come PI.
NOTA: In alcuni casi, dove l'intensità del segnale è bassa, le popolazioni cellulari possono sembrare avere valori di fluorescenza negativi, come risultato della correzione per lo sfondo. In questo caso, si consiglia di eseguire una trasformazione bi-esponenziale. A tale fine, fare clic sulla T accanto all'asse y e scegliere Personalizza asse. Nella nuova finestra modificare la scala in bie esponenziale (Biex), aggiungere valori negativi agli assi aumentando la base di larghezza e fare clic su Applica. Ciò migliorerà la risoluzione degli eventi con bassa intensità del segnale. - Mostra i dati come plottaggio di conteggio. Utilizzate la scheda Opzione (Option) appena sotto l'asse x e selezionate tracciato contatore (Counter Plot) dal menu.
- Disegna un cancello Quat sulla trama per definire 4 popolazioni bersaglio discrete.
- Fare clic nella parte superiore della finestra per aprire l'editor di layout, facendo clic in Editor layout e trascinando le popolazioni in ogni area separata.
- Inserire i tracciati nell'editor di layout trascinando e rilasciando le popolazioni dall'area di lavoro nella finestra dell'editor di layout.
- Visualizzazione con istogrammi
- Scegliere istogramma dalla scheda Opzioni.
- Applicare un cancello per selezionare l'allegato nelle celle V-positive; in alternativa, le popolazioni positive e negative possono essere definite utilizzando lo strumento bisettoriale. La sezione di esempio deve ora mostrare le diverse popolazioni che sono state formate e la loro gerarchia.
- Per confrontare i campioni, trascinare tutti gli istogrammi uno sopra l'altro; Fare clic con il pulsante destro del mouse sull'istogramma e dall'istogramma scegliere Offset sfalsato.
- Aggiungere analisi statistiche
- Aprire la scheda Statistica facendo doppio clic sulla popolazione di interesse. Selezionare la funzione da applicare e il parametro coinvolto.
- Ripeti con altre popolazioni, trascinando l'icona Sigma nel nome della popolazione.
- Applicare l'analisi a tutti i campioni selezionando la strategia di gating dal campione di interesse e trascinandolo nel gruppo definito dal marcatore di interesse, ad esempio l'allegato V.
- Creare gate nei campioni di controllo FMO e definire popolazioni negative e positive; questa strategia di gating verrà applicata all'intero esperimento (Figura 3D\u2012F).
NOTA: Controllare ogni campione singolarmente per assicurarsi che la gating sia corretta e modificarla ove necessario. - Se le cellule sono state macchiate con anticorpi marcatori (ad esempio CD45) utilizzare di conseguenza l'FMO e il gate corrispondenti.
- Per esportare il layout, fare clic su File | Esporta immagine | Selezionare il formato di file (ad esempio, jpg, pdf).
- Fare clic su Crea tabella per aprire una finestra con la versione finale della tabella.
- Esportare la tabella selezionando File | Salva con nome | Nomefile.
Risultati
Procedura chirurgica
Il successo della transezione toracica del midollo spinale è determinato dalla valutazione di una serie di parametri, il più ovvio dei quali è la paralisi dell'arto posteriore. L'animale si muove solo usando i suoi arti anteriori, trascinando i suoi arti posteriori. In caso contrario, i livelli di attività, tra cui alimentazione, toelettatura e vigilanza, sono in genere normali. Inoltre, gli animali perdono il controllo volizionale della vescica con conseguente necessità di espressione manuale della vescica da parte dello sperimentatore ogni 12 ore fino a quando l'annullamento riflesso ritorna a 10-14 giorni dopo l'infortunio. A seguito dell'eutanasia, ulteriori segni del successo della lesione riguardano principalmente l'aumento del rapporto vescica-peso corporeo, indicativo del rimodellamento dei tessuti. L'analisi istologica rivela iperplasia all'interno dei compartimenti muscolari uroteliali e lisci3.
Preparazione della sospensione a cella singola
Utilizzando i dati di espressione disponibili al pubblico, è stato determinato l'arricchimento del tessuto vescicale per le proteine della matrice extracellulare (Figura 2) e utilizzato per informare la formulazione del mix di digestione. Poiché i collageni sono componenti chiave della parete della vescica11,12, prima abbiamo cercato di determinare il collagene o i collageni più abbondanti nella vescica del topo utilizzando set di dati di profilazione dell'RNA generati dal progetto ENCODE del mouse13. La nostra analisi ha dimostrato che collagene 1A1, collagene 3A1, collagene 1A2 e collagene 6A1 sono i tipi di collagene più abbondanti all'interno della vescica del topo(Figura 2A). Abbiamo anche usato il Tabula Muris (un compendio di dati del trascritoma a singola cellula dal topo (Mus musculus))8 per determinare il livello di espressione dell'mRNA dei collageni 1, 3, 6 e ialuronan. I dati consentono un confronto diretto e controllato dell'espressione genica nei tipi cellulari condivisi tra i tessuti. Questa analisi ha rivelato che l'espressione di questi componenti della matrice extracellulare è più diffusa nei tipi di cellule mesenchimali piuttosto che nell'urotelio (Figura 2B).
Effetto della dissociazione sulla vitalità delle cellule isolate dalla vescica
L'analisi della citometria del flusso ha dimostrato che la digestione enzimatica utilizzando i 4 diversi protocolli ha prodotto una vitalità rispettivamente dell'83%, 86%, 93% o 90%. Pertanto, la sezione 3 del protocollo è stata ritenuta più preziosa per la conservazione della vitalità cellulare. La Commissione ha inoltre osservato che circa il 4% delle cellule erano necrotiche (PI+/Annexin V-)(Figura 4A). Queste osservazioni sottolineano l'efficienza del protocollo di digestione e il conseguente beneficio sulla vitalità cellulare.
Effetto della lesione del midollo spinale su diverse popolazioni di cellule nella vescica
Abbiamo osservato un aumento significativo del numero totale di cellule nelle vesciche dei topi SCI rispetto ai controlli. Anche il modello delle particelle di punti ottenute dalle vesciche SCI era leggermente diverso rispetto al rimodellamento continuo degli organi a causa della lesione del midollospinale (figura 4B: prima colonna). Rispetto ai controlli, le vesciche degli animali SCI hanno mostrato un aumento significativo delle cellule positive al CD45.
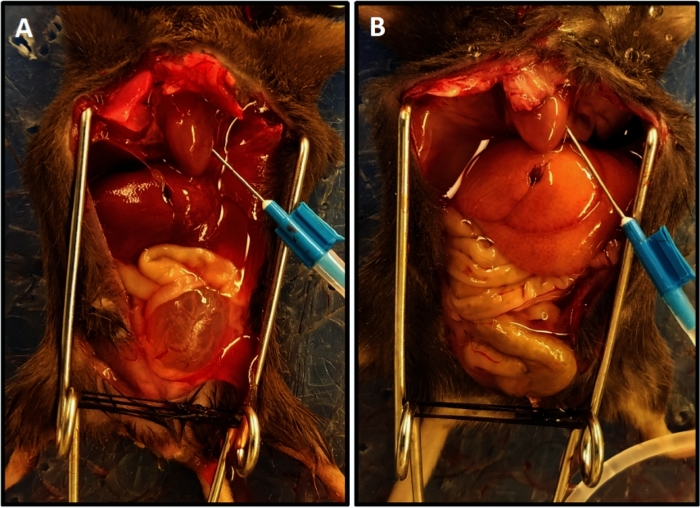
Figura 1: Completamento rappresentativo della perfusione con colore alleggerito del fegato. (A) Dimostra il colore del fegato all'inizio della perfusione. (B) Mostra il colore del fegato alleggerito alla fine della perfusione. Il topo in (A) aveva la trasezione del midollo spinale due settimane prima della perfusione con conseguente ipertrofia della vescica e la sua sporgenza dal bacino a differenza del topo in (B) che non aveva lesioni al midollo spinale; in questo caso la vescica è piccola e nascosta nel bacino. Clicca qui per visualizzare una versione più grande di questa figura.
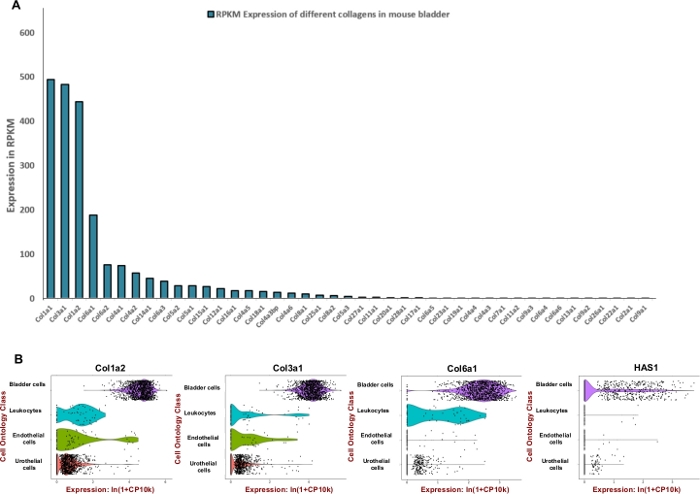
Figura 2: Espressione trascritmica dei componenti della matrice extracellulare (ECM) nella vescica del mouse. (A) Grafico a barre di 43 diversi tipi di collagene. L'espressione è indicata da Reads Per Kilobase di trascrizione, per milione di letture mappate (RPKM) (i dati vengono raccolti da BioProject: PRJNA66167)14. (B) Trame per violino di espressione genica in tipi cellulari ottenute da contagoccio a base di goccioline microfluidiche a base di 3'end in un pool di campioni di vescica urinaria dissociata maschile e femminile (maschi e femmine). I conteggi sono stati normalizzati per ogni cella utilizzando il logaritmo naturale di 1+ conteggi per milione di ln(CPM+1)8. Uno pseudocount di 1 CPM è stato aggiunto prima di prendere logaritmi. Clicca qui per visualizzare una versione più grande di questa figura.
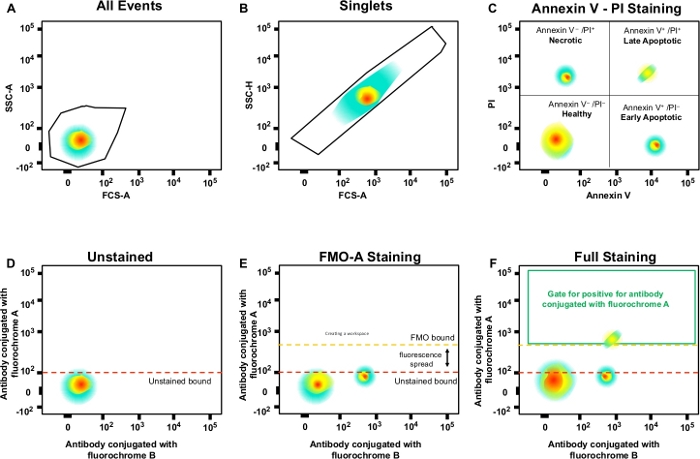
Figura 3: Strategia di Gating e controlli FMO per determinare la diffusione della fluorescenza. (A) Selezione della popolazione cellulare. (B) Strategia di Gating per i singoli. (C) Gating per cellule necrotiche e apoptotiche precoci e tardive che utilizzano anticorpi PI e Annexin V. (D\u2012F) Un grafico a punti schematico di citometria a flusso multicolore (ad esempio, anticorpi coniugati con fluorocromi A, B, C, D + (Annexin V e PI). Questo mostra la fluorescenza diffusa nell'anticorpo con canale fluorocromo A mostrato dal controllo FMO rispetto a un controllo non macchiato. La linea tratteggiata arancione rappresenta il limite di gating FMO rispetto al limite non macchiato in rosso. Clicca qui per visualizzare una versione più grande di questa figura.
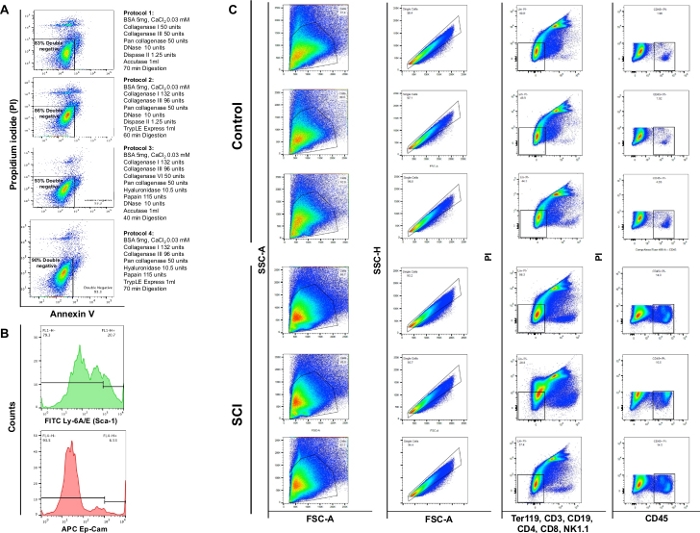
Figura 4: Citometria a flusso di diversi tipi di cellule nella vescica. (A) Allegato nei grafici a doppio flusso di colorazione V/PI. Le diverse combinazioni di enzimi e sostanze chimiche utilizzate per ogni protocollo sono rappresentate di fronte al corrispondente grafico di vitalità. Questi dati dimostrano che la massima fattibilità è stata ottenuta con il protocollo sezione 3. (B) Istogrammi rappresentativi che illustrano l'intensità di Ly-6A/E (Sca-1) e CD326 (Ep-CAM) rilevati in singoli canali. (C) Effetto dello SCI sulla popolazione cellulare della vescica del topo. Il pannello superiore mostra i risultati della colorazione su tre vesciche dissociate ottenute da topi non chirurgici di controllo e il pannello inferiore mostra i risultati della colorazione su tre animali con SCI. La prima colonna è la popolazione totale di celle. La seconda colonna mostra la selezione singlet gating. La terza colonna mostra la sottopopolazione di cellule vive negative per le cellule B, T e NK. La quarta colonna mostra la colorazione per le cellule vive positiva per CD45. Clicca qui per visualizzare una versione più grande di questa figura.
| Componente | Importo (per 500 mL) | Molarità |
| Nacl | 4,091 g | 140mm |
| Kcl | 0,186 g | 5 mM |
| MgCl2 | 0,0476 g | 1 mM |
| D-Glucosio | 0,9 g | 10 mM |
| HEPES | 1,19 g | 10 mM |
Tabella 1: Componenti per la preparazione della soluzione di Tyrode. I componenti indicati sono per la preparazione della soluzione tyrode da 500 mL.
| Componente | Quantità | Protocollo sezione 1 | Protocollo sezione 2 | Protocollo sezione 3 | Protocollo sezione 4 |
| Bsa | 5 mg | Sì | Sì | Sì | Sì |
| CaCl2 | 0,03 mM | Sì | Sì | Sì | Sì |
| Collagenasi Tipo I | 132,5 unità | Sì | Sì | Sì | Sì |
| Collagenasi Tipo III | 96,4 unità | Sì | Sì | Sì | Sì |
| Collagenasi Tipo VI | 50 unità | - | - | Sì | - |
| DNasi | 10 unità | Sì | Sì | Sì | - |
| Papaina | 115 unità | - | - | Sì | Sì |
| Pan Collagenasi | 50 unità | - | - | Sì | Sì |
| Ialuronidasi | 10,5 unità | - | - | Sì | Sì |
| Dispasi II | 1,25 unità | Sì | Sì | - | - |
| Soluzione di dissociazione cellulare | 1 mL | Sì | - | Sì | - |
| Enzima ricombinante | 1 mL | - | Sì | - | Sì |
Tabella 2: Componenti per la preparazione del tampone di digestione. I componenti indicati sono per la preparazione di 2,5 mL di digestione mix (1 U catalizza l'idrolisi di 1 μmol un substrato al minuto a 37 °C. Fare riferimento alla scheda tecnica del prodotto per la definizione di unità di ciascun enzima).
Discussione
Il modello di lesione del midollo spinale del topo qui descritto fornisce un metodo riproducibile per creare un'ostruzione funzionale dell'uscita della vescica a causa della perdita di coordinazione tra la contrazione della vescica e il rilassamento esterno dello sfintere uretrale. Questo a sua volta evoca un profondo rimodellamento della parete della vescica già 2 settimane dopo l'infortunio caratterizzato dall'espansione dei compartimenti muscolari uroteliali e lisci. Le fasi critiche nell'implementazione del modello SCI nei roditori includono (i) una rigorosa attenzione all'espressione manuale della vescica durante il periodo di shock spinale che ne consegue per 10\u201214 giorni dopo la lesione; — arricchimento nutrizionale per ridurre al minimo la perdita di peso; e (iii) mitigazione del potenziale di scottatura delle urine, in particolare per esperimenti che vanno oltre il ritorno del vuoto riflesso. Le limitazioni del modello includono il potenziale di occlusione uretrale nei topi dai coaguli di sangue durante il periodo di ematuria transitoria, e inoltre nei topi maschi dal coagulo di sperma dopo l'eiaculazione retrograda dopo l'intervento chirurgico.
L'approccio di dissociazione tissutale qui descritto illustra l'importanza di considerare i cambiamenti strutturali nei tessuti che derivano dall'insulto sperimentale, in questo caso un significativo rimodellamento tissutale a seguito di SCI che può influenzare le analisi a valle. Con l'aumento delle analisi a singola cellula è fondamentale garantire che le differenze osservate nell'espressione genica non siano semplicemente il risultato di perturbazioni indotte dalla dissociazione, ma siano realmente rappresentative dei cambiamenti biologici sottostanti rilevanti per il modello della malattia. L'uso di dati di espressione pubblicamente disponibili ci ha permesso di modificare la formulazione dei tamponi di digestione per garantire un'efficace digestione della matrice extracellulare massimizzando al contempo la vitalità. Ulteriori modifiche che potrebbero essere prese in considerazione nelle applicazioni future includono l'aggiunta di actinomicina D, per fermare la trascrizione di geni precoci immediati che sono sensibili al protocollo didissociazione 15.
La tecnica di pipettazione è fondamentale quando si dissociano i tessuti o si trasferiscono cellule già in sospensione. Per ridurre i danni fisici alle cellule derivanti dalle forze di taglio, è importante pipettare delicatamente e lentamente durante la sospensione cellulare. Si consiglia generalmente di utilizzare punte di pipetta a foro largo. Se si utilizzano punte standard, è particolarmente importante pipettare delicatamente le sospensioni delle celle per evitare forze di taglio che altrimenti danneggerebbe le cellule. L'uso di filtri cellulari è inevitabile in questo protocollo, tuttavia, la concentrazione cellulare può diminuire del 20% o più, accompagnata da una perdita di volume di 100 μL o più. Si consiglia di determinare la concentrazione cellulare dopo lo sforzo per garantire un conteggio preciso delle cellule.
Nella citometria del flusso, i controlli FMO forniscono una misura dello sfondo a causa del sanguinamento del segnale da picchi di emissione sovrapposti. Non sono una misura di legame anticorpale non specifico, o colorazione di fondo che può essere presente quando un anticorpo è incluso in quel canale. Per tenere conto del legame anticorpale non specifico, è necessario includere adeguati controlli isotipi; per la colorazione di fondo, è necessario includere controlli negativi. Nel loro insieme, questi controlli garantiscono una misurazione accurata delle popolazioni cellulari.
Divulgazioni
Nessun conflitto di interessi dichiarato.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni dei National Institutes of Health (R01 DK077195 a R.M.A, R01 DK104641 a R.M.A e D.R.B). Riconosciamo il prezioso contributo del Dr. Stuart Orkin nella Divisione di Ematologia/Oncologia, nel Boston Children's Hospital, nel Dipartimento di Pediatria, nella Harvard Medical School e nel Dana-Farber Cancer Institute. Riconosciamo anche il supporto di Kyle Costa nella cura post-operatoria dei topi, Mary Taglienti e il Dr. Habiballah Shojaeisaadi (Dr. Yang Shi Laboratory, Dipartimento di Pediatria, Divisione di Medicina Neonata, Dipartimento di Pediatria, Divisione di Medicina Neonata, Boston Children's Hospital, Harvard Medical School) per assistenza tecnica e discussioni utili.
Materiali
| Name | Company | Catalog Number | Comments |
| 2.5 X Magnifying Loupes | |||
| 7-0 Vicryl suture, 6.5mm needle 3/8 circle | ETHICON | J546 | |
| 70 μm Cell Strainer | Thermofisher | 22363548 | |
| Accutase in BPBS, 0.5mM EDTA | Millipore | SCR005 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| APC anti-mouse CD326 (Ep-CAM), rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 118213 | |
| BB515 Rat Anti-Mouse CD45, rat monoclonal, IgG2b, κ, Clone 30-F11 | BD Biosciences | 564590 | |
| BONN Micro Dissecting Forceps, Straight, 1x2 teeth, 3.75" length, 0.3mm tip width, 0.12mm teeth | ROBOZ Surgical Instrument Company, Inc. | RS-5172 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Bovine Serum Albumin | Sigma | A9647-100G | |
| CaCl2 | Sigma | 2115-250ML | |
| CASTROVIEJO Micro Suturing Needle Holder, Straight with lock, 5.75" length | ROBOZ Surgical Instrument Company, Inc. | RS-6412 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Cell Counting Kit, 30 dual-chambered slides, 60 counts, with trypan blue | Biorad | 1450003 | |
| Cell Staining Buffer | BioLegend | 420201 | |
| Collagenase from Clostridium histolyticum | Sigma | C0130-1G | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Collagenase Type III | Worthington Biochemical Corporation | LS004182 | |
| Collagenase, Type 6 | Worthington Biochemical Corporation | LS005319 | |
| Dead Cell Apoptosis Kit with Annexin V Alexa Fluor 488 & Propidium Iodide (PI) | Thermofisher | V13241 | |
| Dispase II | Sigma | D4693-1G | |
| DNase | Sigma | DN25-1G | |
| Enrofloxacin (Baytril) | Bayer Health Care LLC, | NADA # 140-913 Approved by FDA. Lot No.: AH01CGP | 2.27% Injectable Solution |
| Falcon 15 ml conical centrifuge tubes | Fisher Scientific | 352096 | |
| Falcon 50 ml conical centrifuge tubes | Fisher Scientific | 352070 | |
| FITC anti-mouse Ly-6A/E (Sca-1) Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 122505 | |
| Hyaluronidase from sheep testes, Type II | Sigma | H2126 | |
| MACS SmartStrainers (100 µm) | Miltenyi Biotec, Inc. | 130-110-917 | |
| McPHERSON-VANNAS, Micro Dissecting Spring Scissors, Straight, 4" length, 0.15mm tip width | ROBOZ Surgical Instrument Company, Inc. | RS-5630 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Meloxicam | Patterson Veterinary | 07-891-7959 | |
| Papain | Worthington Biochemical Corporation | LS003119 | |
| PE/Cy5 anti-mouse CD19 Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 115509 | Dump Channel |
| PE/Cy5 anti-mouse CD3ε Antibody, Armenian hamster monoclonal, IgG, affinity purified | BioLegend | 100309 | Dump Channel |
| PE/Cy5 anti-mouse CD4 Antibody, rat monoclonal, IgG2b, κ, affinity purified | BioLegend | 100409 | Dump Channel |
| PE/Cy5 anti-mouse CD8a Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 100709 | Dump Channel |
| PE/Cy5 anti-mouse NK-1.1 Antibody, mouse monoclonal, IgG2a, κ, affinity purified | BioLegend | 108715 | Dump Channel |
| PE/Cy5 anti-mouse TER-119/Erythroid Cells Antibody, IgG2b, κ, affinity purified | BioLegend | 116209 | Dump Channel |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block), rat monoclonal, IgG2b, κ, Clone 2.4G2 | BD Biosciences | 553141 | |
| RBC Lysis Buffer (10X) | BioLegend | 420301 | |
| Red Blood Cell Lysis Buffer 1x | Biolegend | 420201 | |
| Screw-Cap microcentrifuge tubes, 1.5 ml | VWR | 89004-290 | |
| TC20 Automated Cell Counter | Biorad | 1450102 | |
| Triple antibiotic ointment (neomycin/polymyxin B/ bacitracin) | Patterson Veterinary | 07-893-7216 | skin protectant |
| TrypLE Select Enzyme (10X), no phenol red | Thermofisher | A1217701 | |
| Vetropolycin eye ointment | Dechra Veterinary Products | NADA # 065-016. Approved by FDA. | protect eyes during anesthesia |
Riferimenti
- Grange, C., et al. Phenotypic characterization and functional analysis of human tumor immune infiltration after mechanical and enzymatic disaggregation. Journal of Immunological Methods. 372 (1-2), 119-126 (2011).
- van den Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Seth, A., et al. The impact of discrete modes of spinal cord injury on bladder muscle contractility. BMC Urology. 13, 24 (2013).
- Doyle, C., et al. Inosine attenuates spontaneous activity in the rat neurogenic bladder through an A2B pathway. Scientific Reports. 7, 44416 (2017).
- Gheinani, A. H., et al. Characterization of miRNA-regulated networks, hubs of signaling, and biomarkers in obstruction-induced bladder dysfunction. JCI Insight. 2 (2), 89560 (2017).
- Gheinani, A. H., et al. Concordant miRNA and mRNA expression profiles in humans and mice with bladder outlet obstruction. American Journal of Clinical and Experimental Urology. 6 (6), 219-233 (2018).
- Krishna, V., et al. A contusion model of severe spinal cord injury in rats. Journal of Visualized Experiments. (78), e50111 (2013).
- The Tabula Muris Consortium. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Gray, C. J., Boukouvalas, J., Szawelski, R. J., Wharton, C. W. Benzyloxycarbonylphenylalanylcitrulline p-nitroanilide as a substrate for papain and other plant cysteine proteinases. Biochemical Journal. 219 (1), 325-328 (1984).
- Feodorova, Y., Koch, M., Bultman, S., Michalakis, S., Solovei, I. Quick and reliable method for retina dissociation and separation of rod photoreceptor perikarya from adult mice. MethodsX. 2, 39-46 (2015).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part I: architecture, development and disease. Nature Reviews Urology. 6 (11), 596-611 (2009).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part II: regenerative applications. Nature Reviews Urology. 6 (11), 612-621 (2009).
- The ENCODE Project Consortium. An integrated encyclopedia of DNA elements in the human genome. Nature. 489 (7414), 57-74 (2012).
- Yue, F., et al. A comparative encyclopedia of DNA elements in the mouse genome. Nature. 515 (7527), 355-364 (2014).
- Wu, Y. E., Pan, L., Zuo, Y., Li, X., Hong, W. Detecting Activated Cell Populations Using Single-Cell RNA-Seq. Neuron. 96 (2), 313-329 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon