Method Article
Une approche de dissociation à cellule unique pour l’analyse moléculaire de la vessie urinaire chez la souris à la suite d’une lésion de la moelle épinière
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le but de ce protocole est d’appliquer un protocole optimisé de dissociation des tissus à un modèle muran de lésions médullaires et de valider l’approche pour l’analyse d’une seule cellule par cytométrie de flux.
Résumé
Nous décrivons la mise en œuvre des dommages de moelle épinière chez les souris pour obtenir la dyssynergie de detrusor-sphincter, une obstruction fonctionnelle de sortie de réservoir souple, et le remodelage ultérieur de mur de réservoir souple. Pour faciliter l’évaluation de la composition cellulaire de la paroi vésicale chez les souris blessées au contrôle non blessées et à la moelle épinière, nous avons mis au point un protocole de dissociation optimisé qui favorise la viabilité des cellules élevées et permet la détection de sous-populations discrètes par cytométrie d’écoulement.
Les lésions médullaires sont créées par une transection complète de la moelle épinière thoracique. Au moment de la récolte des tissus, l’animal est perfusé de solution saline tamponnée de phosphate sous anesthésie profonde et les vessies sont récoltées dans le tampon de Tyrode. Les tissus sont émincés avant l’incubation dans le tampon de digestion qui a été optimisé en fonction de la teneur en collagène de la vessie souris tel que déterminé par l’interrogation de bases de données d’expression génétique accessibles au public. Après la génération d’une suspension cellulaire unique, le matériau est analysé par cytométrie d’écoulement pour évaluer la viabilité cellulaire, le nombre de cellules et les sous-populations spécifiques. Nous démontrons que la méthode donne des populations cellulaires avec plus de 90% de viabilité, et une représentation robuste des cellules d’origine mésenchymale et épithéliale. Cette méthode permettra une analyse précise en aval des types de cellules discrètes dans la vessie de souris et potentiellement d’autres organes.
Introduction
Les perturbations de la fonction normale de la vessie urinaire peuvent entraîner une diminution de la qualité de vie de nombreuses personnes. Afin d’acquérir une meilleure compréhension de la façon dont les blessures ou les maladies font dérailler la fonction normale de la vessie, il est important de sonder l’état biologique normal des cellules dans la vessie et comment elles changent sous perturbation expérimentale. Jusqu’ici, cependant, les populations spécifiques de cellules qui résident dans la vessie urinaire, et comment elles changent avec des dommages, ont été incomplètement caractérisées.
Les méthodes de profilage à cellules simples telles que la cytométrie d’écoulement ou le séquençage de l’ARN unicellule (scRNA-seq) ont le potentiel de faire la lumière sur des types de cellules spécifiques dans la vessie. Toutefois, pour que ces approches soient informatives, les tissus doivent être digérés d’une manière qui n’affecte pas la viabilité, l’expression des gènes et les pourcentages représentatifs de population cellulaire du tissu récolté. Les protocoles qui emploient la désagrégation enzymatique peuvent avoir un impact sur l’expression des marqueurs de surface par l’activité indiscriminée de la protéase1,ce qui a un impact sur l’identification cellulaire par cytométrie de flux, tandis que le processus de dissociation lui-même peut conduire à l’induction de gènes précoces immédiats, comme décrit récemment par Van den Brink etses collègues 2. Les auteurs ont prouvé que bien que la sous-population dissociation-affectée était petite, elle pourrait déclencher un signal contaminant fort dans des études d’expression en vrac dues aux niveaux élevés d’expression des gènes tôt immédiats. En outre, la durée du protocole de dissociation a affecté les niveaux d’expression en vrac détectés des gènes montrés pour être uniques à certaines sous-populations. Ainsi, les ensembles de données à cellules simples générés sans tenir compte de l’impact du protocole de dissociation peuvent produire des changements d’expression génétique découlant de la méthode de dissociation, par opposition à la biologie sous-jacente. Ces observations suggèrent que les données publiées sur la transcriptomics à cellule unique doivent être interprétées avec prudence et que les résultats devraient être validés par des méthodes indépendantes.
Bien que, des méthodes de dissociation dures et longues puissent modifier l’expression des gènes dans lescellules 2; l’isolement efficace des cellules est essentiel pour obtenir une représentation précise des types de cellules présents. Puisque la vessie est un organe complexe comprenant plusieurs types de cellules, certaines populations telles que les cellules urothelial ou stromal peuvent être relativement sous-représentées tandis que d’autres types de cellules telles que les fibroblastes existent dans la matrice extracellulaire et peuvent être difficiles à isoler. La dissociation devient encore plus difficile si la vessie a subi le remodelage et la fibrose significatifs tels que celui observé dans les dommages de moelleépinière 3,4 ou obstruction de sortie de réservoir souple5,6.
Ici, nous décrivons une méthode optimisée de dissociation de tissu pour l’analyse simple en aval de cellules dans la vessie blessée de souris de moelle épinière. En utilisant la cytométrie de flux, nous avons comparé quatre protocoles de digestion enzymatiques pour leur capacité à produire une suspension cellulaire unique, soutenir la viabilité cellulaire et maintenir la proportion correcte de populations cellulaires. Sur la base de cette analyse, nous concluons que la minimisation de la mort cellulaire, des agrégats cellulaires, des acides nucléiques non cellulaires et des inhibiteurs potentiels de l’analyse en aval est essentielle à la réalisation de données de haute qualité.
Protocole
Les procédures ont été effectuées conformément aux recommandations du Guide pour le soin et l’utilisation des animaux de laboratoire des Instituts nationaux de la santé. Toutes les expériences ont été approuvées par le Comité des soins et de l’utilisation des animaux du Boston Children’s Hospital.
REMARQUE : Des souris ont été logées dans un établissement animalier accrédité par l’AAALAC avec accès ad libitum à la nourriture et à l’eau. Des souris femelles à 8\u201212 semaines d’âge ont été employées pour ces expériences. Compte tenu de la nature de la blessure, un enrichissement nutritionnel supplémentaire a été fourni aux souris pour assurer leur bien-être.
1. Transection de moelle épinière à faible thoracique chez la souris
- Préparation avant transection de la moelle épinière
NOTE : Les instruments chirurgicaux exigés pour cette procédure sont micro ciseaux de ressort disséquants, forceps de dissecting micro, conducteur d’aiguille de suturing micro, hemostats, et sutures 910 de polyglactine de 7-0. D’autres fournitures chirurgicales requises sont des rideaux chirurgicaux, des feuilles stériles pour le champ chirurgical, des éponges de gaze, des applicateurs à pointe de coton et des seringues de 1 mL avec aiguilles de 25 G.- Autoclave les instruments chirurgicaux et les fournitures avant la chirurgie.
- Nettoyez la zone chirurgicale et les coussinets chauffants avec des lingettes d’alcool. Un coussin chauffant sera utilisé pendant la chirurgie et l’autre pendant la période postopératoire immédiate pour maintenir la température corporelle de l’animal jusqu’à ce qu’il reprenne toute son activité.
- Utilisez des loupes grossissantes (2,5 x ou plus) pour effectuer l’intervention chirurgicale.
- Allumez les coussinets chauffants, la source lumineuse et le stérilisateur de perles de verre pour être prêt à l’emploi pendant la procédure.
- Ouvrez les rideaux chirurgicaux et les instruments. Utilisez des gants stériles pour draper le champ chirurgical et placer les instruments dans le champ chirurgical.
- Préparation des animaux
- Apportez les souris à la salle d’intervention et apportez également une cage propre pour les souris blessées à la moelle épinière.
- Administrer l’anesthésie en plaçant la souris dans la chambre d’induction avec un débit isoflurane fixé à 3,0 %, un débit d’oxygène à 1 L/min et une aspiration à 20 mmHg jusqu’à ce qu’il n’y ait pas de réponse de pincement des pattes.
- Pesez immédiatement l’animal, puis placez l’animal en position couchée sur le coussin chauffant.
- Placez le cône anesthésique confortablement sur le nez de la souris, passez le flux de gaz de la chambre d’induction au cône avant, et réglez le flux d’isoflurane à 2% et le flux d’oxygène à 1 L/min.
- Confirmez que l’animal est adéquatement anesthésié en l’absence de réponse au pincement des pattes. Collez les membres animaux sur le coussin chauffant. Placez un morceau roulé d’éponge de gaze sous la poitrine inférieure pour élever et fléchir les vertèbres thoraciques inférieures.
- Appliquer le lubrifiant ophtalmique sur les deux yeux. Administrer des analgésiques (Meloxicam, 10 mg/kg, sous-cutané) et des antibiotiques (Enrofloxacine, 5 mg/kg, sous-cutané).
REMARQUE : Les utilisateurs finaux devraient utiliser les analgésiques et les antibiotiques recommandés par leur comité local de soins et d’utilisation des animaux. - Palpate le processus épineux le plus important dans la colonne thoracique qui correspond généralement avec T13 processus épineux7. Raser une zone de rectangle longitudinal à l’arrière de la souris du bas du cou à juste en dessous du processus épineux le plus important (T13) et pendant 1 cm de chaque côté de la ligne médiane.
- Intervention chirurgicale
- Préparer la zone rasée avec 10% de solution d’iode povidone et 70% d’éthanol trois fois alternativement d’une manière circulaire à partir du site d’incision travaillant vers l’extérieur, puis couvrir l’animal avec stérile 4 x 4 éponge gaze avec une fenêtre dans le centre au-dessus du champ chirurgical.
- Faire une incision de 1,5 cm dans la ligne médiane du dos à l’aide de ciseaux fins qui se termine par le processus épineux le plus important (T13). L’incision doit inclure la peau et le fascia superficiel. L’utilisation de ciseaux sépare la peau et le fascia superficiel de chaque côté pour exposer les processus épineux et les muscles paraspinous environnants.
- L’utilisation d’une dissection nette et émoussée sépare les muscles des processus épineux et des laminaires des vertèbres T9, T10 et T11.
- Divisez fortement les ligaments interspinous entre T9 et T10 et entre T10 et T11 utilisant des ciseaux fins et excisez alors le processus épineux de T10 et exécutez soigneusement la laminectomy de T10 bilatéralement pour exposer la moelle épinière. Assurez-vous que les laminae sont complètement excisées.
- Transect la moelle épinière à l’aide de ciseaux fins. Le saignement minimal se produit habituellement à ce point dû à la transection des vaisseaux de moelle épinière. Compresser la zone de saignement avec un applicateur stérile à pointe de coton pour atteindre l’hémostase. Après confirmation de l’hémostase complète, fermer la peau avec 7-0 polyglactine 910 sutures continues.
- Administrer 1 mL de solution saline sous-cutanée pour prévenir la déshydratation postopératoire.
- Soins postopératoires
- Placez l’animal sur un coussin chauffant jusqu’à ce qu’il se rétablisse complètement, puis transférez-le dans une cage pour seulement les souris blessées à la moelle épinière.
- Les soins postopératoires comprennent l’observation et le pesage quotidien des animaux, et la surveillance du site d’incision pour les signes d’infection jusqu’à 7 jours. Administrer 1 mL solution saline, analgésique (meloxicam 10 mg/kg), et antibiotique (enrofloxacine 5 mg/kg) tous sous-cutanés tous les jours pendant 3 jours.
REMARQUE : Les utilisateurs finaux devraient utiliser les analgésiques et les antibiotiques recommandés par leur comité local de soins et d’utilisation des animaux. - Effectuer l’expression manuelle de la vessie (manœuvre de Credé) toutes les 12 h jusqu’à ce que l’animal soit capable d’uriner seul (généralement en 10 à 14 jours). Tenez l’animal d’une main et massez le bas-ventre avec l’autre main, puis sentez et compressez doucement la vessie urinaire distendue avec l’index et le pouce. La compression transitoire douce devrait alterner avec la relaxation. Après l’expression manuelle, laver le bas-ventre avec de l’eau du robinet et sécher doucement avec du papier absorbant sans frottement excessif.
REMARQUE : Une petite taille de la vessie avant le début de l’expression et le mouillage du bas-ventre avec de l’urine sont des indications que l’animal a gagné la capacité de vider par lui-même. - Pour minimiser la perte de poids, fournir un enrichissement nutritionnel aux souris sous forme de gel nutritif et d’autres gâteries nutritives (friandises au bacon, croquants aux fruits et morsures de légumes) placées sur le plancher de la cage pour faciliter l’accès NOTE: Dans cette étude, les souris ont été perfusées et les vessies obtenues à 8 semaines après sci.
- Complications postopératoires
- Réduisez au minimum le risque de rupture de la vessie en raison de l’expression manuelle trop zélée de la vessie en n’exprimant pas entièrement la vessie.
- Empêcher l’excoriation de la peau périnée de l’exposition continue au dribble d’urine du sphincter incompétent par le lavage de la région périnée avec l’eau du robinet. Réduisez au minimum l’inflammation grâce à l’application d’onguent antibiotique triple.
REMARQUE : L’obstruction urétrale due au caillot de sang pendant la période de l’hématurie passagère ou du coagulum de sperme dû à l’éjaculation rétrograde chez les souris mâles peut se produire après des dommages de moelle épinière. L’obstruction urétrale complète chez les souris mâles culmine fréquemment dans la rupture et la mort de réservoir souple. Dans notre expérience la fréquence de l’obstruction urétrale chez les souris mâles qui a mené à la mort était de 10%.
2. Perfusion et approvisionnement en tissus
REMARQUE : Pour les analyses en aval de certains types de cellules comme les cellules immunitaires dans les tissus périphériques, il est avantageux d’éliminer le sang par perfusion au moment de la récolte des tissus, tel que décrit ci-dessous.
- Administrer l’anesthésie comme mentionné dans l’intervention chirurgicale (étape 2.2) et confirmer que l’animal est adéquatement anesthésié sans réponse de pincement avant-goût (l’animal est paraplégique, donc les limites postérieures ont diminué la sensation et la réponse hindpaw-pinch devient hors de propos).
- Placez l’animal dans la position supine et écouvillonnez l’abdomen et la poitrine avec 70% d’éthanol pour mouiller la fourrure pour l’empêcher d’entrer dans le site d’exploitation.
- Effectuez une laparotomie médiane du bassin au diaphragme. Couper le diaphragme loin des côtes.
REMARQUE : Après cette étape, la vitesse est importante puisque le différentiel de pression thoracique n’existe plus et que les poumons ne peuvent pas se gonfler, de sorte que l’animal commence à suffoquer. - Couper le thorax ouvert le long des côtes sur le côté gauche et droit en suivant la bordure os-cartilage sur une ligne parallèle au sternum, en commençant par le diaphragme et en procédant jusqu’à la première côte.
- Placez la paroi thoracique antérieure complète sur la tête de l’animal et fixez-la dans cette position à l’aide de pinces à serviettes. Ne coupez pas la paroi thoracique antérieure car cela provoquera un saignement grave des deux artères thoraciques internes.
- Couper le péricarde à l’aide de ciseaux fins.
- Connectez une aiguille de 23 G à l’appareil de perfusion, puis insérez-la dans le ventricule gauche et lentement dans l’aorte, en prenant soin de ne pas la percer.
REMARQUE : L’appareil de perfusion comprend une pompe à perfusion et une seringue de 50 mL reliée à un tube intraveineux. - Commencez la perfusion et faites rapidement une petite coupe avec la pointe des ciseaux fins dans l’atrium droit pour le drainage. Prenez soin de ne pas introduire de bulles d’air pendant l’infusion de liquide.
- Effectuez la perfusion avec la solution saline tamponnée de phosphate (PBS) exécuté à 15 mL/min. La perfusion est complète lorsque le drainage est clair et que la couleur allégée du foie est atteinte( figure 1).
REMARQUE : Le temps moyen de perfusion était de 3,5 à 4 min. La perfusion inadéquate se manifeste par une progression lente du blanchiment des tissus et est généralement due à un mauvais positionnement de l’aiguille dans le ventricule gauche. L’ajustement de l’aiguille et l’allongement de la durée de la perfusion de 1 à 2 min assureront une perfusion adéquate des tissus. - Discontinuez la perfusion et disséquez la vessie libre des pédules vasculaires et de l’urètre et placez-la dans un tube de microcentrifugeuse contenant la solution glacée de Tyrode.
3. Digestion de la vessie urinaire chez les souris témoins et blessées à la moelle épinière
NOTE : Afin de formuler un mélange efficace de digestion qui est adapté à la vessie urinaire de souris nous avons cherché à ajuster l’unité des enzymes utilisées pour dégrader les composants extracellulaires prédominants de matrice tels que les collagènes et l’acide hyaluronique. Par conséquent, nous avons utilisé les données de séquençage de l’ARN accessibles au public générées par le projet Mouse ENCODE (BioProject: PRJNA66167) pour extraire les reads par kilobase par million (RPKM) et Tabula Muris8 pour l’évaluation de l’expression spatiale dans la vessie. Collagènes 1, 3 et 6 étaient les trois gènes les plus fortement exprimés parmi 42 collagènes différents (Figure 2A). L’expression de ces collagènes et synthase hyaluronan 1 (Has1) ont été principalement observées dans les cellules musculaires et les fibroblastes de la paroi vésicale (Figure 2B).
- Préparation de tampons et de solutions
- Préparer la solution tyrode de sodium selon le tableau 1 dans une bouteille propre de 500 mL. Ajouter 300 mL de ddH2O. La solution est acide après la préparation. Ajuster le pH à 7,4 à l’aide de NaOH. Porter le volume à 500 mL à l’aide d’un double H2O distillé, puis aliquot et conserver à -20 °C.
REMARQUE : Ce tampon maintient le pH et l’équilibre osmotique dans le tampon de digestion et fournit aux cellules de l’eau et des ions inorganiques essentiels. Il contient du magnésium, ainsi que du glucose comme source d’énergie. Le potassium dans la solution fournit des effets protecteurs sur l’activité électromécanique dans la solution cellulaire isolée. Les sels en poudre sont hygroscopiques et doivent être protégés de l’humidité. Le contenu entier du mélange doit être utilisé immédiatement après la préparation. La préparation d’une solution de sel concentré n’est pas recommandée car des précipités peuvent se former. La stérilisation à l’aide de filtration (filtre de 0,22 μm) peut être effectuée si les cellules doivent être culturenées après analyse. - Préparez la solution de digestion enzymatique dans un tube conique de 15 mL en ajoutant les volumes et les quantités recommandés pour chaque composant (tableau 2). Ajouter la solution tyrode de sodium jusqu’à 2,5 mL. Vortex complètement à dissoudre.
REMARQUE : La papaïne est une protéase sulfhydryle du latex de papaye Carica. Papain a une grande spécificité et il dégradera la plupart des substrats protéiques9. Papain s’est avéré moins dommageable et plus efficace que d’autres protéases dans les protocoles de dissociationcellulaire 10. Nous fournissons des détails sur les quatre protocoles de dissociation du tableau 2; nous avons observé l’article 3 du protocole pour assurer la plus grande viabilité (93 %) suspensions cellulaires préparées à partir de la vessie de la souris.
- Préparer la solution tyrode de sodium selon le tableau 1 dans une bouteille propre de 500 mL. Ajouter 300 mL de ddH2O. La solution est acide après la préparation. Ajuster le pH à 7,4 à l’aide de NaOH. Porter le volume à 500 mL à l’aide d’un double H2O distillé, puis aliquot et conserver à -20 °C.
- Procédure de dissociation et préparation de la suspension cellulaire
- Recueillir la vessie chez les souris après la perfusion.
- Percer la vessie pour libérer le contenu, le cas échéant.
- Ajouter 100 μL de solution tyrode à un tube de centrifugeuse vide de 1,5 mL et à de l’ivraie. Placez la vessie dans le tube et pesez à nouveau pour déterminer un poids précis de la vessie.
- Déposer la vessie sur une boîte de Pétri de 10 cm sur la glace et ajouter 100 μL de la solution tyrode pour le hachage.
- À l’aide de ciseaux chirurgicaux, couper des morceaux aussi petits que possible tout en minimisant le temps de hachage à pas plus de 2\u20123 min par vessie. Si vous misez en commun des tissus vésicaux de plusieurs animaux, hacher les vessies d’un seul coup.
- Transférer le tissu vésical haché à l’aide d’une pointe de pipet à alésage large dans 2,5 mL de tampon de digestion pour chaque vessie. Réglez le volume si plusieurs vessies sont mis en commun. Incuber le tissu dans la solution de digestion à 37 °C dans un incubateur sur un mélangeur de noix pendant 40 min.
- À la fin de la période d’incubation, retirer le tube de digestion de l’incubateur. Solution de digestion triturate (pipet de haut en bas) à l’aide d’une pipette de 5 mL pendant 1 min.
- Centrifugeuse pendant 10 min à 350 x g à 4 °C. Retirez le supernatant et réutilisez la pastille dans 1 mL de solution de détachement cellulaire. Placer dans un incubateur de 37 °C sur le mélangeur à noix pendant 10 min.
- Centrifugeuse pendant 10 min à 350 x g à 4 °C. Retirer le supernatant et réutiliser la pastille dans 1 mL de tampon de lyse RBC (1x). Incuber pendant 1 min.
- Ajouter 9 mL PBS pour diluer le tampon RBC et arrêter la lyse RBC.
- Passez les cellules à travers la passoire cellulaire de 70 μm dans le tube conique de 50 mL, en utilisant le piston d’une seringue pour gratter légèrement la passoire cellulaire pour assurer le passage complet des cellules. Assurez-vous de recueillir le liquide qui passe à travers la passoire, mais pourrait être pris sur le dessous de la passoire.
- Centrifugeuse pendant 10 min à 350 x g à 4 °C. Retirez le supernatant et resuspendez la pastille dans 200 μL de tampon de coloration cellulaire (PBS avec 2% de FBS).
- Comptez les cellules.
- Immunolabeling des cellules spécifiques pour la cytométrie d’écoulement
REMARQUE : Pour détecter différents types de cellules dans la vessie, nous avons conçu un panneau de cytométrie d’écoulement multicolore. Pour effectuer la compensation et concevoir une stratégie de gating appropriée, nous incluons les contrôles non tachés et fluorescence moins un (FMO). Les contrôles fmo sont importants pour gate population positive, en particulier lorsque la fraction positive est faible. La procédure de coloration est la suivante.-
Blocage des récepteurs FcγRII/III sur les cellules
REMARQUE : Nous recommandons de bloquer la liaison non spécifique des anticorps monoclonaux par pré-incubation des cellules avec des anticorps monoclonals de récepteur d’anti-Fc, ou protéine recombinante de Fc.- Laver les cellules par centrifugation à 350 x g pendant 5 min à 4 °C et ajouter le tampon de coloration cellulaire.
- Jetez les récepteurs supernatants et bloquez les récepteurs FcγRII/III sur les cellules pour éviter les taches non spécifiques d’anticorps en ajoutant des anticorps CD16 et CD32 dans le tampon de coloration cellulaire à la dilution de 1:100.
- Incuber sur la glace pendant 10 min.
REMARQUE : Il n’est pas nécessaire de laver les cellules; les cellules peuvent être tachées directement après cette étape.
-
Coloration pour les AFO
REMARQUE : Un contrôle de fluorescence moins un (FMO) est un tube de tous les fluorochromes utilisés dans l’expérience qui contient tous les fluorochromes sauf un.- Par exemple, si l’on a 4 fluorochromes différents (A, B C et D + Annexin V et iodure de propidium (PI)), préparez les tubes FMO comme suit. Tube FMO 1 : Anticorps conjugués avec des fluorochromes B, C, D + (Annexe V et IP); Tube FMO 2 : Anticorps conjugués avec des fluorochromes A, C, D + (Annexe V et IP); Tube FMO 3 : Anticorps conjugués à des fluorochromes A, B, C + (Annexe V et IP); Tube FMO 4: Anticorps conjugués avec A, B, C, D fluorochromes + (Annexe V); Tube FMO 5: Anticorps conjugués avec A, B, C, D fluorochromes + (PI).
- Considérez la nature du fluorochrome conjugué pour l’anticorps Annexin V.
-
Coloration des cellules bloquées avec les anticorps désirés
- Incuber les cellules bloquées avec des mélanges maîtres appropriés d’anticorps conjugués au fluorophore contre les protéines désirées pendant 20 min sur de la glace protégée de la lumière. N’oubliez pas d’inclure les AFO.
- Laver les cellules avec 1 mL de tampon de coloration cellulaire ajouté à chaque tube, puis centrifuger à nouveau à 350 x g pendant 5 min à 10 °C.
- Jetez le supernatant et resuspendez la pastille cellulaire dans 200 μL de tampon de coloration cellulaire. Conserver sur la glace jusqu’à ce que des données sur la fluorescence puissent être acquises à l’aide d’un cytomètre d’écoulement.
-
Appliquer la tache Annexin V/PI.
- Préparez une solution de travail de PI (100 μg/mL) dans le tampon 1x annexin-contraignant tel que décrit dans le protocole du fabricant pour le kit d’apoptose de cellules mortes.
- Déterminez la densité cellulaire et notez le tampon et le volume dans lesquels elles sont stockées.
- Les échantillons de centrifugeuse à 350 x g pendant 5 min, jeter les cellules supernatantes et resuspendre dans 1x Annexin-liaison tampon à une densité de ~ 1 x 106 cellules / mL dans un volume de 100 μL.
- Ajouter la solution de travail FITC-Annexin V (5 μL) et PI (1 μL) à chaque échantillon (100 μL), tel que décrit dans le protocole du fabricant, et incuber à température ambiante pendant 15 min.
- Ajouter 400 μL de tampon liant l’annexine 1x aux échantillons, mélanger par inversion et garder sur la glace jusqu’à la cytométrie du débit.
-
Blocage des récepteurs FcγRII/III sur les cellules
- Étalonnage FACS
-
Contrôle de la cytométrie et de la pureté du débit
- Commencez l’analyse de cytométrie d’écoulement en mesurant les cellules non tachées pour délimifier la morphologie cellulaire et les creux des fluorochromes.
- Ajustez la dispersion latérale (SSC) et la dispersion vers l’avant (FSC) en modifiant les tensions de chaque paramètre de fluorescence. Mesurer l’émission de fluorescence à 530 nm (Annexin V) et >575 nm (PI).
- Définissez la population négative au cours de la première décennie en utilisant les grilles sur chaque parcelle de points. Placez chaque contrôle fmo dans le cytomètre et corrigez le chevauchement spectral jusqu’à ce que les médianes négatives et positives de la population soient alignées.
- Mesurer 100 000 événements. Mesurez les cellules tachées de marqueurs spécifiques et créez des barrières pour les populations cellulaires d’intérêt.
-
Contrôle de la cytométrie et de la pureté du débit
- Analyse des données
- Recueillir les données à partir du cytomètre d’écoulement. Ouvrez le logiciel pour visualiser l’espace de travail pour analyse.
- Création d’un espace de travail
- Importez les fichiers FCS en les faisant glisser dans l’espace de travail. Les fichiers seront visibles dans la section échantillon et groupe de l’espace de travail. Double-cliquez sur le nom de l’échantillon pour ouvrir le fichier.
- Utilisez la zone de dispersion latérale (SSC-A) pour l’axe y et la zone de dispersion avant (FSC-A) pour l’axe x (figure 3A). Cliquez sur l’icône pour le polygone gating.
- Créer une porte autour de la population cellulaire d’intérêt dans la parcelle de points en cliquant pour faire un nœud de porte, puis continuer à cliquer autour de la population cellulaire jusqu’à ce que complet; double clic pour fermer la porte.
- Nommez la porte en fonction de la population capturée (p. ex., « Toutes les cellules ») et cliquez sur OK.
REMARQUE : Le double clic dans la porte « Toutes les cellules » ouvrira une nouvelle fenêtre graphique montrant uniquement les événements contenus dans « Toutes les cellules ». - Ajustez l’axe y de la nouvelle parcelle de point en SSC-H (hauteur de dispersion latérale) en cliquant sur la flèche noire et sélectionnez pour modifier l’axe y.
REMARQUE : Cette porte pour les cellules individuelles (singlets) et exclut les doublets ou les agrégats plus gros (figure 3B). Étant donné que les cellules individuelles ont une largeur et une longueur proportionnelles, elles doivent être représentées en tant que population en diagonale. Les cellules qui tombent à l’extérieur de cette porte diagonale sont des doublets ou de plus gros agrégats. - Double clic sur la porte pour analyser les cellules nécrotiques (PI-positives), apoptotiques précoces (Annexin V-positives, PI-négatives) et apoptotiques tardives (Annexin V-positives, PI-négatives)(figure 3C).
- Étiquetez l’axe x comme Annexin V et l’axe y comme PI.
REMARQUE : Dans certains cas, lorsque l’intensité du signal est faible, les populations cellulaires peuvent sembler avoir des valeurs de fluorescence négatives, à la suite de la correction de l’arrière-plan. Dans ce cas, il est recommandé d’effectuer une transformation bi-exponentielle. Pour ce faire, cliquez sur le T à côté de l’axe y et choisissez Personnaliser l’axe. Dans la nouvelle fenêtre changer l’échelle à bi-exponentielle (Biex), ajouter des valeurs négatives aux axes en augmentant la base de largeur et cliquez sur Appliquer. Cela permettra d’améliorer la résolution des événements avec une faible intensité du signal. - Afficher les données comme un tracé de comptage. Utilisez l’onglet Option juste en dessous de l’axe x et sélectionnez l’intrigue du compteur dans le menu.
- Dessinez une porte quat sur la parcelle pour définir 4 populations cibles distinctes.
- Cliquez en haut de la fenêtre pour ouvrir l’éditeur de mise en page, en cliquant sur l’éditeur Layout et faites glisser les populations dans chaque zone séparée.
- Placez les parcelles dans l’éditeur de mise en page en faisant glisser et en laissant tomber les populations de l’espace de travail dans la fenêtre de l’éditeur de mise en page.
- Visualisation à l’aide d’histogrammes
- Choisissez l’histogramme dans l’onglet Options.
- Appliquer une porte pour sélectionner les cellules v-positives annexin; alternativement, les populations positives et négatives peuvent être définies à l’aide de l’outil bisectorielle. La section échantillon doit maintenant montrer les différentes populations qui ont été formées et leur hiérarchie.
- Pour comparer les échantillons, faites glisser tous les histogrammes les uns sur les autres; clic droit sur l’histogramme et de l’histogramme choisir Stagger Offset.
- Ajouter des analyses statistiques
- Ouvrez l’onglet Statistique en cliquant deux fois sur la population d’intérêt. Sélectionnez la fonction à appliquer et le paramètre en cause.
- Répétez avec d’autres populations, en faisant glisser l’icône Sigma dans le nom de la population.
- Appliquer l’analyse à tous les échantillons en sélectionnant la stratégie de gating à partir de l’échantillon d’intérêt et en la faisant glisser dans le groupe défini par le marqueur d’intérêt, par exemple l’annexe V.
- Créer des barrières dans les échantillons de contrôle fmo et définir les populations négatives et positives; cette stratégie de gating sera appliquée à l’ensemble de l’expérience (Figure 3D\u2012F).
REMARQUE : Vérifiez chaque échantillon individuellement pour vous assurer que le gating est correct et modifiez si nécessaire. - Si les cellules ont été tachées d’anticorps marqueur (p. ex., CD45), utilisez l’OGF et la porte correspondantes en conséquence.
- Pour exporter la mise en page, cliquez sur File | Image d’exportation | Sélectionnez le format de fichier (p. ex., jpg, pdf).
- Cliquez sur Créer une table pour ouvrir une fenêtre avec la version finale de la table.
- Exportez le tableau en sélectionnant file | Enregistrer comme | Nom de fichier.
Résultats
Intervention chirurgicale
Le succès de la transection thoracique de moelle épinière est déterminé par l’évaluation d’un certain nombre de paramètres, dont le plus évident est la paralysie postérieur. L’animal ne se déplace qu’à l’aide de ses membres antérieurs, traînant ses limites postérieures. Sinon, les niveaux d’activité, y compris l’alimentation, le toilettage et la vigilance sont généralement normaux. En outre, les animaux perdent le contrôle volitionnel de réservoir souple ayant pour résultat le besoin de l’expression manuelle de réservoir souple par l’investigateur tous les 12 h jusqu’à ce que l’annulation réflexe revienne à 10 à 14 jours après blessure. Après l’euthanasie, les signes additionnels du succès de la blessure se rapportent principalement à l’augmentation du rapport de poids de réservoir souple-corps, indicatif du remodelage de tissu. L’analyse histologique révèle l’hyperplasie dans les compartiments musculaires urothelial etlisses 3.
Préparation de la suspension à cellule unique
À l’aide de données d’expression accessibles au public, l’enrichissement du tissu vésical pour les protéines de matrice extracellulaire a été déterminé (figure 2) et utilisé pour éclairer la formulation du mélange de digestion. Puisque les collagènes sont des composants clés de laparoi vésicale 11,12, nous avons d’abord cherché à déterminer le collagène le plus abondant (s) dans la vessie de souris en utilisant des ensembles de données de profilage d’ARN générés par le projet Mouse ENCODE13. Notre analyse a montré que le collagène 1A1, collagène 3A1, collagène 1A2 et collagène 6A1 sont les types de collagène les plus abondants dans la vessie de souris (Figure 2A). Nous avons également utilisé le Tabula Muris (un recueil de données de transcriptome à cellule unique de souris (Mus musculus))8 pour déterminer le niveau d’expression de l’ARNm des collagènes 1, 3, 6 et hyaluronan. Les données permettent une comparaison directe et contrôlée de l’expression des gènes dans les types de cellules partagées entre les tissus. Cette analyse a révélé que l’expression de ces composants de matrice extracellulaire est plus répandue dans les types de cellules mésenchymales plutôt que dans l’urothelium (figure 2B).
Effet de la dissociation sur la viabilité des cellules isolées de la vessie
L’analyse de cytométrie de flux a démontré que la digestion enzymatique utilisant les 4 protocoles différents a donné la viabilité de 83%, 86%, 93% ou 90%, respectivement. Ainsi, l’article 3 du protocole a été jugé le plus précieux pour la préservation de la viabilité cellulaire. Nous avons également observé qu’environ 4 % des cellules étaient nécrotiques (PI+/Annexin V-) (Figure 4A). Ces observations mettent l’accent sur l’efficacité du protocole de digestion et l’avantage qui en a résulté sur la viabilité cellulaire.
Effet des lésions médullaires sur différentes populations de cellules de la vessie
Nous avons observé une augmentation significative du nombre total de cellules dans les vessies des souris SCI par rapport aux témoins. Le modèle des parcelles à points obtenues à partir des vessies SCI était également légèrement différent compatible avec le remodelage continu de l’organe en raison d’une lésion de la moelleépinière (figure 4B: première colonne). Comparées aux contrôles, les vessies des animaux de SCI ont montré une augmentation significative des cellules CD45-positives.
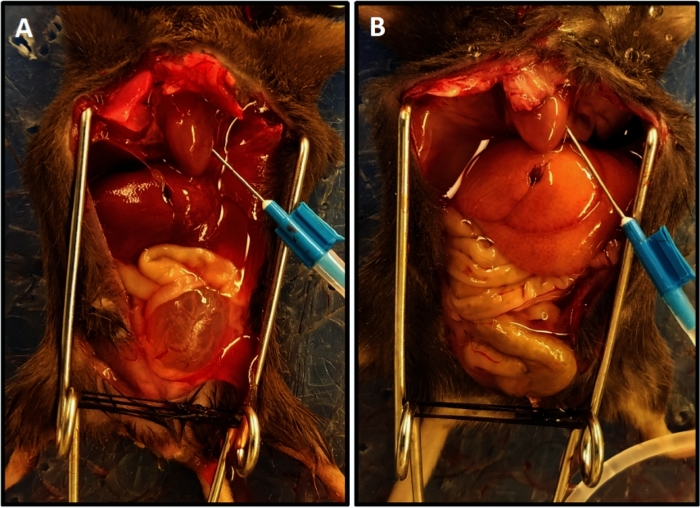
Figure 1 : Achèvement représentatif de perfusion avec la couleur allégée du foie. (A) Démontre la couleur du foie au début de la perfusion. (B) Affiche la couleur du foie allégée à la fin de la perfusion. La souris dans (A) a eu la transection de moelle épinière deux semaines avant perfusion ayant pour résultat l’hypertrophie de réservoir souple et sa saillie hors du bassin à la différence de la souris dans (B) qui n’a pas eu des dommages de moelle épinière ; dans ce cas, la vessie est petite et cachée dans le bassin. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
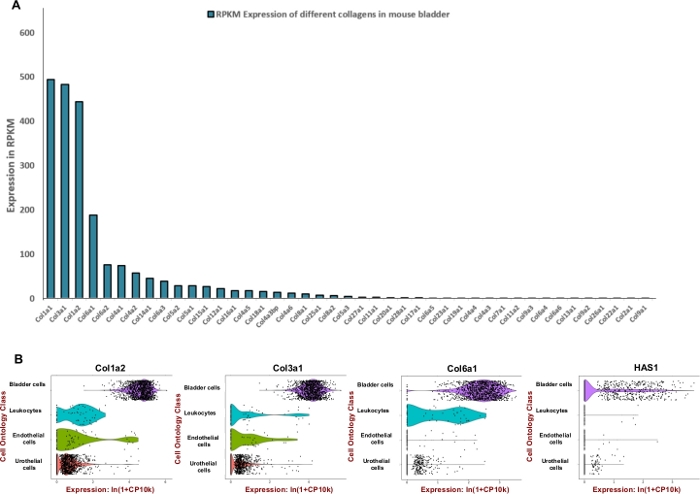
Figure 2 : Expression transcriptomique des composants de la matrice extracellulaire (ECM) dans la vessie de la souris. (A) Diagramme à barres de 43 types de collagène différents. L’expression est indiquée par Reads Per Kilobase de transcription, par million de lecture cartographiée (RPKM) (les données sont recueillies à partir de BioProject: PRJNA66167)14. (B) Parcelles de violon de l’expression des gènes dans les types cellulaires obtenus à partir de gouttelettes microfluidiques à base de 3'-end comptant dans un pool d’échantillons de vessies urinaires dissociées mâles et féminins (hommes et femmes). Les dénombrements ont été normalisés pour chaque cellule à l’aide du logarithme naturel de 1+ dénombrement par million de ln (CPM+1)8. Un pseudocomte de 1 CPM a été ajouté avant de prendre des logarithmes. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
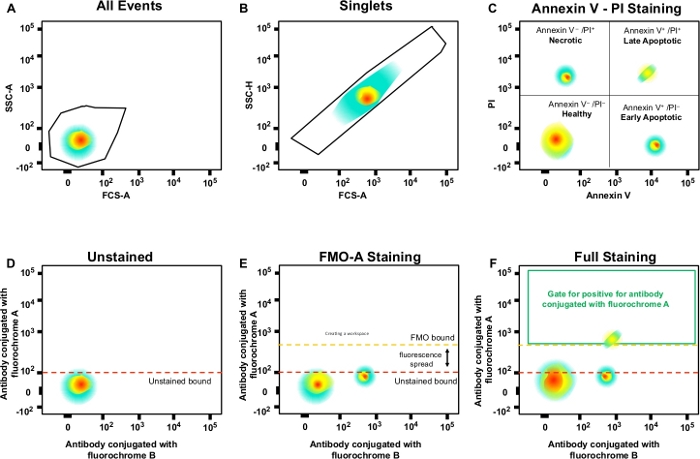
Figure 3 : Stratégie de gating et contrôles fmo pour déterminer la propagation de fluorescence. (A) Sélection de la population cellulaire. (B) Stratégie de gating pour les singlets. (C) Gating pour les cellules apoptotiques précoces et tardives utilisant l’anticorps PI et Annexin V. (D\u2012F) Une parcelle schématique de cytométrie d’écoulement multicolore (p. ex., anticorps conjugués à A, B, C, D fluorochromes + (Annexe V et IP). Ceci montre la fluorescence écartée dans l’anticorps avec le canal fluorochrome A montré par le contrôle de FMO comparé à un contrôle non taché. La ligne pointillée orange représente la limite de gation fmo comparée à la limite non tachée en rouge. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
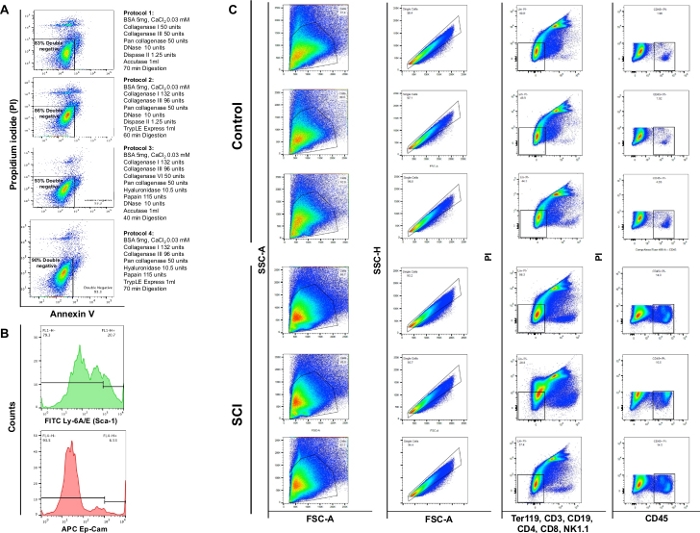
Figure 4 : Cytométrie d’écoulement de différents types de cellules dans la vessie. (A) Annexin V / PI double coloration des graphiques de flux. Les différentes combinaisons d’enzymes et de produits chimiques utilisés pour chaque protocole sont représentées devant la parcelle de viabilité correspondante. Ces données démontrent que la viabilité la plus élevée a été obtenue avec l’article 3 du protocole. (B) Histogrammes représentatifs illustrant l’intensité de Ly-6A/E (Sca-1) et CD326 (Ep-CAM) détectés dans les canaux simples. (C) Effet de sci sur la population cellulaire de la vessie de souris. Le panneau supérieur montre les résultats de la coloration sur trois vessies dissociées obtenues à partir de souris non chirurgicales témoins et le panneau inférieur montre les résultats de la coloration sur trois animaux atteints de SCI. La première colonne est la population cellulaire totale. La deuxième colonne montre la sélection de gating singlet. La troisième colonne montre la sous-population de cellules vivantes qui sont négatives pour les cellules B, les cellules T et les cellules NK. La quatrième colonne montre la coloration des cellules vivantes positives pour le CD45. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
| Composant | Montant (pour 500 mL) | Molarité |
| Nacl | 4.091 g | 140 mM |
| Kcl | 0,186 g | 5 mM |
| MgCl2 | 0,0476 g | 1 mM |
| D-Glucose | 0,9 g | 10 mM |
| Hepes | 1,19 g | 10 mM |
Tableau 1 : Composants pour la préparation de la solution de Tyrode. Les composants indiqués sont pour la préparation de la solution tyrode de 500 mL.
| Composant | Montant | Protocole section 1 | Section 2 du protocole | Section 3 du protocole | Section 4 du protocole |
| Bsa | 5 mg | Oui | Oui | Oui | Oui |
| CaCl2 | 0,03 mM | Oui | Oui | Oui | Oui |
| Collagène Type I | 132,5 unités | Oui | Oui | Oui | Oui |
| Collagène Type III | 96,4 unités | Oui | Oui | Oui | Oui |
| Collagène Type VI | 50 unités | - | - | Oui | - |
| Dnase | 10 unités | Oui | Oui | Oui | - |
| Papaïne | 115 unités | - | - | Oui | Oui |
| Pan Collagène | 50 unités | - | - | Oui | Oui |
| Hyaluronidase | 10,5 unités | - | - | Oui | Oui |
| Dispase II | 1,25 unité | Oui | Oui | - | - |
| Solution de dissociation cellulaire | 1 mL | Oui | - | Oui | - |
| Enzyme recombinante | 1 mL | - | Oui | - | Oui |
Tableau 2 : Composants pour la préparation du tampon de digestion. Les composants indiqués sont pour la préparation du mélange de digestion de 2,5 mL (1 U catalyse l’hydrolyse de 1 μmol par substrat par minute à 37 °C. Consultez la fiche de données du produit pour la définition de l’unité de chaque enzyme).
Discussion
Le modèle de lésion de moelle épinière de souris décrit ici fournit une méthode reproductible pour créer une obstruction fonctionnelle de sortie de réservoir souple due à la perte de coordination entre la contraction de réservoir souple et la relaxation externe de sphincter urétral. Ceci évoque à son tour le remodelage profond de la paroi de réservoir souple dès 2 semaines après blessure caractérisée par l’expansion des compartiments urothelial et lisses de muscle. Les étapes critiques dans la mise en œuvre du modèle SCI chez les rongeurs comprennent (i) une attention rigoureuse à l’expression manuelle de la vessie pendant la période de choc rachidien qui s’ensuit pendant 10\u201214 jours après une blessure; (ii) l’enrichissement nutritionnel pour minimiser la perte de poids; et (iii) l’atténuation du potentiel d’échaudage de l’urine, en particulier pour les expériences qui vont au-delà du retour de l’annulation réflexe. Les limitations du modèle incluent le potentiel pour l’occlusion urétrale chez les souris des caillots sanguins pendant la période de l’hématurie passagère, et en outre chez les souris mâles du coagulum de sperme suivant l’éjaculation rétrograde suivant la chirurgie.
L’approche de dissociation tissulaire décrite ici illustre l’importance de considérer les changements structurels dans les tissus qui découlent de l’insulte expérimentale, dans ce cas le remodelage significatif de tissu suivant SCI qui peut influencer des analyses en aval. Avec l’augmentation des analyses à cellules individuelles, il est essentiel de s’assurer que les différences observées dans l’expression des gènes ne sont pas simplement le résultat de perturbations induites par la dissociation, mais sont vraiment représentatives des changements biologiques sous-jacents pertinents au modèle de la maladie. L’utilisation de données d’expression accessibles au public nous a permis de modifier la formulation des tampons de digestion afin d’assurer une digestion efficace de la matrice extracellulaire tout en maximisant la viabilité. D’autres modifications qui pourraient être considérées dans les applications futures incluent l’ajout de l’actinomycine D, pour arrêter la transcription des gènes tôt immédiats qui sont sensibles au protocole de dissociation15.
La technique de pipetage est cruciale lors de la dissociation des tissus ou du transfert de cellules déjà en suspension. Pour réduire les dommages physiques aux cellules des forces de cisaillement, il est important de pipette doucement et lentement pendant la résuspension cellulaire. Il est généralement recommandé d’utiliser des pointes de pipette à alésage large. Si vous utilisez des pointes standard, il est particulièrement important de pipette suspensions cellulaires doucement pour éviter les forces de cisaillement qui autrement endommager les cellules. L’utilisation de passoires cellulaires est inévitable dans ce protocole, cependant, la concentration cellulaire peut diminuer de 20% ou plus, accompagnée d’une perte de volume de 100 μL ou plus. Nous recommandons que la concentration cellulaire soit déterminée après la tension afin d’assurer un dénombrement précis des cellules.
Dans la cytométrie de débit, les contrôles fmo fournissent une mesure de fond due à la purge du signal des pics d’émission qui se chevauchent. Il ne s’agit pas d’une mesure de liaison non spécifique des anticorps ou d’une coloration de fond qui peut être présente lorsqu’un anticorps est inclus dans ce canal. Pour tenir compte de la liaison anticorps non spécifique, il faut inclure des contrôles appropriés de l’isotype; pour la coloration de fond, il faut inclure des contrôles négatifs. Pris ensemble, ces contrôles assurent une mesure précise des populations cellulaires.
Déclarations de divulgation
Aucun conflit d’intérêts n’a été déclaré.
Remerciements
Ces travaux ont été soutenus par des subventions des National Institutes of Health (R01 DK077195 à R.M.A, R01 DK104641 à R.M.A et D.R.B). Nous reconnaissons l’apport précieux du Dr Stuart Orkin de la Division d’hématologie et d’oncologie du Boston Children’s Hospital, du Département de pédiatrie, de la Harvard Medical School et du Dana-Farber Cancer Institute. Nous reconnaissons également le soutien de Kyle Costa dans les soins postopératoires des souris, Mary Taglienti et le Dr Habiballah Shojaeisaadi (Dr Yang Shi Laboratory, Département de pédiatrie, Division de médecine néonaïne, Département de pédiatrie, Division de médecine néonaïne, Boston Children’s Hospital, Harvard Medical School) pour l’assistance technique et des discussions utiles.
matériels
| Name | Company | Catalog Number | Comments |
| 2.5 X Magnifying Loupes | |||
| 7-0 Vicryl suture, 6.5mm needle 3/8 circle | ETHICON | J546 | |
| 70 μm Cell Strainer | Thermofisher | 22363548 | |
| Accutase in BPBS, 0.5mM EDTA | Millipore | SCR005 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| APC anti-mouse CD326 (Ep-CAM), rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 118213 | |
| BB515 Rat Anti-Mouse CD45, rat monoclonal, IgG2b, κ, Clone 30-F11 | BD Biosciences | 564590 | |
| BONN Micro Dissecting Forceps, Straight, 1x2 teeth, 3.75" length, 0.3mm tip width, 0.12mm teeth | ROBOZ Surgical Instrument Company, Inc. | RS-5172 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Bovine Serum Albumin | Sigma | A9647-100G | |
| CaCl2 | Sigma | 2115-250ML | |
| CASTROVIEJO Micro Suturing Needle Holder, Straight with lock, 5.75" length | ROBOZ Surgical Instrument Company, Inc. | RS-6412 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Cell Counting Kit, 30 dual-chambered slides, 60 counts, with trypan blue | Biorad | 1450003 | |
| Cell Staining Buffer | BioLegend | 420201 | |
| Collagenase from Clostridium histolyticum | Sigma | C0130-1G | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Collagenase Type III | Worthington Biochemical Corporation | LS004182 | |
| Collagenase, Type 6 | Worthington Biochemical Corporation | LS005319 | |
| Dead Cell Apoptosis Kit with Annexin V Alexa Fluor 488 & Propidium Iodide (PI) | Thermofisher | V13241 | |
| Dispase II | Sigma | D4693-1G | |
| DNase | Sigma | DN25-1G | |
| Enrofloxacin (Baytril) | Bayer Health Care LLC, | NADA # 140-913 Approved by FDA. Lot No.: AH01CGP | 2.27% Injectable Solution |
| Falcon 15 ml conical centrifuge tubes | Fisher Scientific | 352096 | |
| Falcon 50 ml conical centrifuge tubes | Fisher Scientific | 352070 | |
| FITC anti-mouse Ly-6A/E (Sca-1) Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 122505 | |
| Hyaluronidase from sheep testes, Type II | Sigma | H2126 | |
| MACS SmartStrainers (100 µm) | Miltenyi Biotec, Inc. | 130-110-917 | |
| McPHERSON-VANNAS, Micro Dissecting Spring Scissors, Straight, 4" length, 0.15mm tip width | ROBOZ Surgical Instrument Company, Inc. | RS-5630 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Meloxicam | Patterson Veterinary | 07-891-7959 | |
| Papain | Worthington Biochemical Corporation | LS003119 | |
| PE/Cy5 anti-mouse CD19 Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 115509 | Dump Channel |
| PE/Cy5 anti-mouse CD3ε Antibody, Armenian hamster monoclonal, IgG, affinity purified | BioLegend | 100309 | Dump Channel |
| PE/Cy5 anti-mouse CD4 Antibody, rat monoclonal, IgG2b, κ, affinity purified | BioLegend | 100409 | Dump Channel |
| PE/Cy5 anti-mouse CD8a Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 100709 | Dump Channel |
| PE/Cy5 anti-mouse NK-1.1 Antibody, mouse monoclonal, IgG2a, κ, affinity purified | BioLegend | 108715 | Dump Channel |
| PE/Cy5 anti-mouse TER-119/Erythroid Cells Antibody, IgG2b, κ, affinity purified | BioLegend | 116209 | Dump Channel |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block), rat monoclonal, IgG2b, κ, Clone 2.4G2 | BD Biosciences | 553141 | |
| RBC Lysis Buffer (10X) | BioLegend | 420301 | |
| Red Blood Cell Lysis Buffer 1x | Biolegend | 420201 | |
| Screw-Cap microcentrifuge tubes, 1.5 ml | VWR | 89004-290 | |
| TC20 Automated Cell Counter | Biorad | 1450102 | |
| Triple antibiotic ointment (neomycin/polymyxin B/ bacitracin) | Patterson Veterinary | 07-893-7216 | skin protectant |
| TrypLE Select Enzyme (10X), no phenol red | Thermofisher | A1217701 | |
| Vetropolycin eye ointment | Dechra Veterinary Products | NADA # 065-016. Approved by FDA. | protect eyes during anesthesia |
Références
- Grange, C., et al. Phenotypic characterization and functional analysis of human tumor immune infiltration after mechanical and enzymatic disaggregation. Journal of Immunological Methods. 372 (1-2), 119-126 (2011).
- van den Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Seth, A., et al. The impact of discrete modes of spinal cord injury on bladder muscle contractility. BMC Urology. 13, 24 (2013).
- Doyle, C., et al. Inosine attenuates spontaneous activity in the rat neurogenic bladder through an A2B pathway. Scientific Reports. 7, 44416 (2017).
- Gheinani, A. H., et al. Characterization of miRNA-regulated networks, hubs of signaling, and biomarkers in obstruction-induced bladder dysfunction. JCI Insight. 2 (2), 89560 (2017).
- Gheinani, A. H., et al. Concordant miRNA and mRNA expression profiles in humans and mice with bladder outlet obstruction. American Journal of Clinical and Experimental Urology. 6 (6), 219-233 (2018).
- Krishna, V., et al. A contusion model of severe spinal cord injury in rats. Journal of Visualized Experiments. (78), e50111 (2013).
- The Tabula Muris Consortium. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Gray, C. J., Boukouvalas, J., Szawelski, R. J., Wharton, C. W. Benzyloxycarbonylphenylalanylcitrulline p-nitroanilide as a substrate for papain and other plant cysteine proteinases. Biochemical Journal. 219 (1), 325-328 (1984).
- Feodorova, Y., Koch, M., Bultman, S., Michalakis, S., Solovei, I. Quick and reliable method for retina dissociation and separation of rod photoreceptor perikarya from adult mice. MethodsX. 2, 39-46 (2015).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part I: architecture, development and disease. Nature Reviews Urology. 6 (11), 596-611 (2009).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part II: regenerative applications. Nature Reviews Urology. 6 (11), 612-621 (2009).
- The ENCODE Project Consortium. An integrated encyclopedia of DNA elements in the human genome. Nature. 489 (7414), 57-74 (2012).
- Yue, F., et al. A comparative encyclopedia of DNA elements in the mouse genome. Nature. 515 (7527), 355-364 (2014).
- Wu, Y. E., Pan, L., Zuo, Y., Li, X., Hong, W. Detecting Activated Cell Populations Using Single-Cell RNA-Seq. Neuron. 96 (2), 313-329 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon