Method Article
Kapillarelektrophorese Massenspektrometrie Ansätze zur Charakterisierung der protein- und metaboliten Korona, die von Nanomaterialien erfasst werden
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll zur Charakterisierung der vollständigen biomolekularen Korona, Proteine und Metaboliten, die von Nanomaterialien aus Biofluiden unter Verwendung eines Kapillarelektrophorese-Massenspektrometrie-Ansatzes gewonnen werden.
Zusammenfassung
Die Adsorption von Biomolekülen aus umgebenden biologischen Matrizen an die Oberfläche von Nanomaterialien (NMs) zur Bildung der Korona ist seit einem Jahrzehnt von Interesse. Das Interesse an der Bio-Nano-Grenzfläche ergibt sich daraus, dass die biomolekulare Korona NMs eine biologische Identität verleiht und so den Körper veranlasst, sie als "Selbst" zu identifizieren. Zum Beispiel haben frühere Studien gezeigt, dass die Proteine in der Korona in der Lage sind, mit Membranrezeptoren zu interagieren, um die zelluläre Aufnahme zu beeinflussen, und festgestellt, dass die Korona für den zellulären Transport von NMs und deren eventuelle Toxizität verantwortlich ist. Bisher hat sich die meiste Forschung auf die Proteinkorona konzentriert und die möglichen Auswirkungen der in der Korona enthaltenen Metaboliten oder synergistische Effekte zwischen Komponenten in der gesamten biomolekularen Korona übersehen. Daher zeigt diese Arbeit Methoden, um sowohl die Protein- als auch die Metabolitenkomponenten der biomolekularen Korona unter Verwendung von Bottom-up-Proteomik- und Metabolomik-Ansätzen parallel zu charakterisieren. Dazu gehören eine On-Particle-Digest der Proteinkorona mit einem Tensid zur Erhöhung der Proteinrückgewinnung und eine passive Charakterisierung der Metabolitenkorona durch Analyse von Metabolitenmatrizen vor und nach NM-Expositionen. Diese Arbeit führt die Kapillarelektrophorese – Massenspektrometrie (CESI-MS) als neue Technik zur NM-Koronacharakterisierung ein. Die hier beschriebenen Protokolle zeigen, wie CESI-MS für die zuverlässige Charakterisierung sowohl des Proteins als auch der Metabolitenkorona, die von NMs erworben werden, verwendet werden kann. Der Wechsel zu CESI-MS verringert das erforderliche Probenvolumen erheblich (im Vergleich zu herkömmlichen Flüssigkeitschromatographie-Massenspektrometrie-Ansätzen (LC-MS) mit mehreren Injektionen ab nur 5 μL Probe, was es ideal für volumenbegrente Proben macht. Darüber hinaus werden die Umweltfolgen der Analyse in Bezug auf LC-MS aufgrund der niedrigen Durchflussraten (<20 nL / min) in CESI-MS und der Verwendung von wässrigen Elektrolyten, wodurch organische Lösungsmittel überflüssig werden, reduziert.
Einleitung
Bio-Nano-Wechselwirkungen an der Schnittstelle zwischen Nanomaterial (NM)-Oberflächen und biologischen Matrizen, aus denen Biomoleküle an die NM adsorbieren, sind ein intensives Forschungsgebiet, das nanosicherheit und nanomedizinischuntermauert 1. Diese Schicht adsorbierender Biomoleküle verleiht NMs eine biologische Identität, so dass Zellen sie als "Selbst" identifizieren und anschließend die zelluläre Aufnahme, Verteilung und biologischen Endpunkte beeinflussen2,3,4. Die überwiegende Mehrheit der Bio-Nano-Studien hat sich auf die Proteine innerhalb der Korona konzentriert und gezeigt, dass Proteine quantitativ und qualitativ zwischen NMs unterschiedlicher Zusammensetzung variieren5. Diese Variation hängt sowohl von den Eigenschaften des NM wie Größe, Funktionalisierung und Material als auch von den Eigenschaften der biologischen Matrix einschließlich Zusammensetzung und Salzgehaltab 5. Ein zunehmendes Interesse an der Bio-Nano-Grenzfläche sind die Metaboliten, die an NMsadsorbieren 6. Mehrere Studien haben gezeigt, dass nm-Eigenschaften wie bei den Proteinen ein Schlüsselfaktor bei der Bestimmung der Zusammensetzung der Metaboliten in der Korona sind und dass sie die biologischen Ergebnisse der NM-Exposition beeinflussen können6,7,8.
In Studien der biomolekularen Korona gibt es vier verschiedene Phasen zu ihrer Charakterisierung, Koronabildung, isolierung der Biomoleküle innerhalb der Korona, deren Nachweis durch qualitative oder quantitative Massenspektrometrie und Identifizierung9. Bis heute wurde eine Reihe von Techniken zur Isolierung der Proteinkorona eingesetzt, einschließlich des Kochens in SDS-PAGE-Laufpuffern, Lösungsmittel- und Salzextraktionen oder der direkten Verdauung von Proteinen in situ auf der Oberfläche von NMs. In Bezug auf die Metaboliten in der Korona ist die Isolierung mit verschiedenen Methoden unter Verwendung von Lösungsmitteln oder sogar die Auflösung der als Lösungen vorgeschlagenen NMs8,10,11komplexer. Im Gegensatz zur Proteinkorona ist es jedoch unwahrscheinlich, dass ein "One Size Fits All"-Ansatz für die Isolierung von Metaboliten aus NMs gilt, da das Metabolom einen großen chemischen Raum einnimmt und die Möglichen NMs vielfältig sind. Ein alternativer Ansatz besteht darin, die biologische Matrix vor und nach der NM-Exposition mit dem Unterschied in den Metabolitenkonzentrationen zu charakterisieren, der auf die Adsorption von Metaboliten an NMs zurückzuführen ist.12
Dieser alternative Ansatz wäre auf alle Biofluide und NMs anwendbar und obwohl er doppelt so viel Analyse erfordert, bietet er folglich ein viel genaueres Maß für die Metabolitenkorona und hat kein Risiko, dass niedrige Metabolitenrückgewinnungen von der NM-Oberfläche mit einer geringen Bindung des spezifischen Metaboliten verwechselt werden.
Der zweite Schritt zur biomolekularen Koronaanalyse ist der Nachweis der Biomoleküle. Traditionell für die Proteine in der Korona war dies die Aufgabe von Nano-LC-MS, dem Arbeitspferd der Proteomik; andere Ansätze wie NMR13, 1D und 2D SDS-PAGE wurden ebenfalls angewendet. In Bezug auf den Metaboliten Corona LC-MS7wurden GC-MS8 und direkte Infusionsmassenspektrometrie verwendet14. In jüngster Zeit hat jedoch ein neuer Ansatz begonnen, an Zugkraft zu gewinnen, nämlich die Kapillarelektrophorese-Massenspektrometrie (CE-MS)11,15, und ist in NM-Laboren als eigenständige Technik zur Charakterisierung verschiedener physikalischer und chemischer Eigenschaften von NMs16vorhanden. CE-MS ist eine orthogonale Trenntechnik zu nanoLC-MS und GC-MS und ist in der Lage, den Nachweis von hochpolaren und geladenen Metaboliten zu ermöglichen17,18. Darüber hinaus eignet sich CE-MS gut für die Analyse von Proteinen und deren posttranslationalen Modifikationen wie Phosphorylierung und Glykosylierung19,20,21,22. Der letzte Schritt, die Identifizierung und Datenanalyse kann auf verschiedene Arten durchgeführt werden, je nachdem, ob ein quantitativer / qualitativer oder gezielter / ungezielter Ansatz verwendet wird, dies fällt jedoch nicht in den Zuständigkeitsbereich dieses Protokolls.
CESI-MS, eine Kombination aus CE und einer NanoESI-Schnittstelle, ist ein neuer Fortschritt in der CE-Technologie mit einer mantellosen Schnittstelle. Dies ermöglicht den direkten Anschluss von Ultra-Low-Flow CE (<20 nL/min) an ein hochauflösendes Massenspektrometer ohne Verdünnung, was zu einer deutlich verbesserten Detektionsempfindlichkeitführt 23,24,25. CESI-MS ermöglicht die Analyse volumenbegrennter Proben (< 10 μL) unter Beibehaltung einer hochempfindlichen Analyse26. CESI-MS ist auch im Vergleich zu herkömmlichen NanoLC-MS-Ansätzen mit niedriger Durchflussrate, die in der Proteomik und Metabolomik verwendet werden, in Bezug auf Reproduzierbarkeit27,28, Durchsatz und Übertragung günstig, was es zu einer aufregenden Perspektive für die vollständige biomolekulare Koronacharakterisierung macht.
Um das Potenzial von CESI-MS für die Analyse von Bio-Nano-Interaktionen hervorzuheben, beschreibt diese Arbeit die Probenvorbereitung, die erforderlich ist, um die biomolekulare NM-Korona aus einer einzigen menschlichen Plasmaprobe so zu isolieren, dass die Daten sowohl aus den Protein- als auch aus den Metabolitenaspekten der gesamten biomolekularen NM-Korona maximiert werden. Während wir über die Verwendung von menschlichem Plasma berichten, wäre dieses Protokoll für andere Bioflüssigkeiten wie Blutserum, komplettes Zellkulturmedium, Zelllysat, Zerebrospinalflüssigkeit oder Urin gleichermaßen geeignet. Die Analysen dieser beiden Komponenten (Proteine und Metaboliten) werden dann mit neutral beschichteten CESI-Kapillaren für die Proteinkorona und blanken Quarzglaskapillaren für kationische und anionische Metaboliten beschrieben.
Protokoll
Die Verwendung von Humanbiofluid wurde gemäß den IRB-Protokollrichtlinien der Universität Leiden und der Medizinischen Universität Innsbruck genehmigt. Wenn menschliche oder tierische Biofluide untersucht werden, ist eine ethische Genehmigung der Forschungseinrichtung erforderlich, die im Falle der in diesem Protokoll gezeigten Ergebnisse eingeholt wurde. Darüber hinaus sollte auch eine angemessene Berichterstattung durchgeführt werden, um Transparenz und Wiederverwendbarkeit der Daten inkünftigenArbeiten zu gewährleisten9,29,30.
1. Herstellung von Hintergrundelektrolyten (BGE)
HINWEIS: Alle Lösungsmittel sollten in einem geeigneten Abzug vorbereitet werden und für alle Schritte muss eine angemessene persönliche Schutzausrüstung verwendet werden (Laborkittel, Handschuhe und Schutzbrille). In jedem Schritt sind niedrig bindende Kunststofffläschchen erforderlich, um den Analytverlust und die Kontamination der Probe mit Salzen, die aus Glaswaren ausgelaucht werden, zu minimieren.
- Bereiten Sie täglich 10% Essigsäure BGE (v / v), pH 2,2 für die Metabolomik vor.
- In einen 10-ml-Messkolben werden 1 ml Essigsäure hinzugefügt, gefolgt von der Zugabe von entionisiertem (DI) Wasser zur markierten Linie und einer gründlichen Mischung.
- Bereiten Sie 100 mM Essigsäure, pH 2,9 täglich für die Proteomik vor.
- In einen 10-ml-Messkolben werden 57 μL Essigsäure hinzugefügt, gefolgt von der Zugabe von DI-Wasser zur markierten Linie und dem gründlichen Mischen.
2. NM-Vorbereitung
- NMs anhand der veröffentlichten Richtlinien31 , 32,33kräftig in Wasser verteilen.
HINWEIS: Bei der Entwicklung dieses Protokolls wurden 7 NMs wie folgt verwendet: 100 und 1.000 nm carboxyliertes Polystyrol wurden für Protein- bzw. Metabolitenkorona verwendet. 100 nm unmodifizierte Polystyrol-NMs, 13 nm Anatas-TiO2-NMs, die unverändert oder mit Polyacrylat- oder PVP-Polymeren beschichtet waren, und 22 nm unmodifizierte SiO2-NMs wurden sowohl für Protein- als auch für Metabolitenkoronen verwendet. Während die Methode mit diesen NMs entwickelt und demonstriert wurde, sollte beachtet werden, dass dieser Ansatz für eine Vielzahl von NM-Zusammensetzungen, -Größen, -Formen und -Morphologien anwendbar wäre. - Charakterisierung der Partikelgröße entweder mit dynamischer Lichtstreuung34,35, Einzelpartikel-induktiv gekoppelter Plasma-Massenspektrometrie36, Nanopartikel-Tracking-Analyse37oder Transmissionselektronenmikroskopie und Oberflächenladung als Zetapotential mit einem Zeta-Sizer34.
3. Biomolekulare Koronabildung
- Teilen Sie 2 ml menschliches Plasma (oder Biofluid ihrer Wahl) in 1 ml Aliquoten, eines für den Metaboliten und die Proteinkorona und das zweite für die Plasmametabolomcharakterisierung.
- 1 mg/ml NMs im menschlichen Plasma für 1 h bei 37 °C inkubieren, während sie bei 500 U/min in einem Thermomixer sanft gemischt werden. Nach der Inkubation zentrifugieren Sie die Probe bei 4.000 x g für 15 min bei 4 °C, um die NMs zu pelletieren.
- Sammeln Sie den Plasmaüberstand für die Metabolitenkoronaanalyse. Behalten Sie den NM-Protein-Korona-Komplex für die Proteinkorona-Charakterisierung bei.
4. Protein-Korona-Isolierung
- Den NM-Proteinkomplex (das Pellet) in 1 ml 10x PBS Buffer und Wirbel kräftig für 2 min resuspendieren, um ungebundene Proteine zu entfernen. Zentrifugieren Sie die PBS-Lösung bei 4.000 x g für 15 min bei 4 °C, um die NMs zu pelletieren, und entfernen Sie den Überstand vorsichtig, ohne das Pellet zu stören.
- Das Pellet in 1 ml Ammoniumbicarbonatpuffer (ABC) (100 mM, pH 8,0) und Wirbel kräftig für 2 min resuspendieren, um ungebundene Proteine und unerwünschte Salze zu entfernen. Zentrifuge bei 4.000 x g für 15 min bei 4 °C, um die NMs zu pelletieren; Entfernen und verwerfen Sie den Überstand. Wiederholen Sie diesen Schritt.
- Reduzieren Sie Proteindisulfidbindungen, indem Sie das NM-Proteinpellet in 20 μL ABC-Puffer (100 mM pH 8) mit 10 mM Dithiotherit auflösen. Inkubieren Sie die Reduktionslösung für 30 min bei 56 °C.
- Um Proteine zu verdauen, fügen Sie 2 μg Trypsin in Sequenzierungsgrad zu 20 μL ABC hinzu, das 0,1% Tensid enthält. Inkubieren Sie die Fermentlösung für 16 h bei 37 °C.
- Alkylieren Sie die Probe durch Zugabe von 20 μL Jodoacetamid bei 55 mM in 100 mM ABC und inkubieren Sie sie bei Raumtemperatur für 20 min.
- Fügen Sie 20 μL von 0,1 M HCl hinzu, um das Tensid zu spalten, und lassen Sie es 10 minuten bei Raumtemperatur stehen.
- Anreichern und Entsalzen von Peptiden mit einer C18-verpackten Entsalzungspipettenspitze.
- Die Spitze mit 80 μL 0,1% Ameisensäure 50% Acetonitril 5 mal befeuchten, mit 80 μL 0,1% Ameisensäure 5 mal reinigen, Probe 10 mal ziehen und eluieren, Probe durch Spülen von 80 μL 0,1 % Ameisensäure 5 mal entsalzen und die Probe 2 mal mit 80 μL 0,1% Ameisensäure 70% Acetonitril in ein sauberes, niedrig bindendes PCR-Röhrchen eluieren.
- Die Proben lyophilisieren und bis zur Analyse bei -20 °C lagern.
5. Metaboliten-Korona-Isolierung
- Nehmen Sie das Kontrollplasma und den Überstand aus der NM-Plasmainkubation aus Schritt 3.3 und halten Sie es während der Probenvorbereitung auf Eis.
- Nehmen Sie jeweils 50 μL in separate Durchstechflaschen und verdünnen Sie 1 zu 10 mit DI-Wasser. Nehmen Sie 50 μL jeder verdünnten Probe und wechseln Sie zu neuen Durchstechflaschen für Schritt 5.3.
- 200 μL Chloroform, 250 μL Methanol und 350 μL DI-Wasser und kräftige Wirbelmischung für 2 min hinzufügen. Zentrifuge für 10 min bei 20.800 x g bei 4 °C.
- Nehmen Sie 500 μL Überstand und filtern Sie durch einen 3 kDa Zentrifugalfilter für 2 h bei 10.000 x g bei 4 °C. Nehmen Sie 430 μL Ultrafiltrat und trocknen Sie sie in einem Geschwindigkeitssauger. Proben können nun vor der Analyse eingefroren werden.
6. Vorbereitung des CESI-MS-Systems38
HINWEIS: Überprüfen Sie vor der Installation der Kapillaren, ob der Einlass und das Auslassende der Kapillaren intakt sind und dass keine sichtbaren Brüche in der Kapillare vorhanden sind.
- Installation einer neutral beschichteten Kapillare zur Proteinkoronaanalyse39.
- Legen Sie eine neue neutral beschichtete Kapillare (90 cm Länge mit 30 μm Innendurchmesser) gemäß den Herstellerrichtlinien in das CESI-Gerät.
- Vorbereitung von CESI-Kapillaren für die proteomische Analyse.
- Spülen Sie die Trennkapillar in Vorwärtsrichtung mit 100 mM HCl für 5 min bei 100 psi und überprüfen Sie die Tröpfchenbildung am Auslass der Kapillare. Spülung der Trennkapillare mit BGE bei 100 psi für 10 min und dann DI-Wasser bei 100 psi für 30 min (dies ist nur für neue Kapillaren erforderlich).
- Spülen Sie sowohl die Trennkapillar als auch die leitfähige Kapillare mit BGE bei 90 psi für 5 min und stellen Sie sicher, dass sich Tröpfchen am Auslassende beider Kapillaren bilden.
- Spülen Sie die Trennkapillare mit DI-Wasser bei 90 psi für 10 min, dann 50 psi für 10 min mit 0,1 M HCl, gefolgt von 90 psi für 10 min mit DI-Wasser und schließlich BGE bei 90 psi für 10 min. Koppeln Sie CESI mit dem MS mit einer Nanospray-Quelle und einem Adapter, wie zuvor beschrieben38.
- Installation von blanker Quarzglaskapillare zur Metabolitenkoronacharakterisierung38.
- Legen Sie eine neue blanke Quarzglaskapillare (90 cm Länge mit einem Innendurchmesser von 30 μm) gemäß den Herstellerrichtlinien in das CESI-Gerät ein.
- Herstellung von CESI-Kapillaren für die Metabolomik-Analyse.
- Spülen Sie die Trennkapillar in Vorwärtsrichtung mit 100% MeOH bei 50 psi für 15 min und überprüfen Sie die Tröpfchenbildung am Auslass der Kapillare. Spülen Sie sowohl die Trennkapillar als auch die leitfähige Kapillare mit BGE bei 90 psi für 5 min und stellen Sie sicher, dass sich Tröpfchen am Auslass beider Kapillaren bilden.
- Spülen Sie die Trennkapillare mit DI-Wasser bei 90 psi für 10 min, dann 50 psi für 10 min mit 0,1 M NaOH, gefolgt von 90 psi für 10 min mit DI-Wasser und schließlich BGE bei 90 psi für 10 min. Koppeln Sie CESI mit dem ESI-MS mithilfe einer Nanospray-Quelle und eines Adapters, wie zuvor beschrieben. 38
7. CE-MS für die Proteinkoronaanalyse
- Proben aus Schritt 4.8 in 20 μL von 50 mM Ammoniumacetat pH 4.0 resuspendieren.
- Führen Sie 5 psi 10 s hydrodynamische Injektion der Probe durch. Getrennt mit einer 30 kV Trennspannung mit folgendem Druckgradienten: 0-10 min bei 1 psi, 10-35 min bei 1,5 psi und 35-45 min bei 5 psi mit 100 mM, pH 2,9 Essigsäure als BGE.
- Sammeln Sie Massenspektren zwischen 250-2000 m/z mit Top-10-Daten, die von der Fragmentierung abhängig sind.
- Zwischen den Proben die Kapillare mit 0,1 M HCl für 3 min bei 100 psi und 10 min 100 psi BGE für die Trennkapillare und für 3 min bei 100 psi für die leitfähige flüssige Kapillare ausspülen.
8. CESI-MS für die Metaboliten-Korona-Analyse
HINWEIS: Alle Proben müssen zweimal analysiert werden, einmal im positiven Modus für den Nachweis von Kationen und einmal im negativen Modus für den Nachweis von Anionen. Die Kontrollplasmaproben müssen mindestens 5 Mal analysiert werden.
- NM-exponierte und nicht exponierte Plasmaproben aus Schritt 5.4 in 430 μL DI-Wasser und kräftigem Wirbel für 2 min resuspendieren. Filtern Sie durch einen 0,1 μm Membranfilter.
- Nehmen Sie 95 μL Filtrat und fügen Sie 5 μL interne Standards bei 200 μM für Kationen (L-Methioninsulfon) und 400 μM für Anionen (2,2,4,4-D4-Zitronensäure) und Wirbel kräftig hinzu. Zentrifuge bei 4.000 x g bei 4 °C für 10 min vor der CESI-MS-Analyse.
- Die Probe hydrodynamisch für 30 s (Kationen) und 40 s (Anionen) bei 2 psi injizieren.
- Trennen Sie Metaboliten in 10% Essigsäure mit einer Trennspannung von 30 kV im Vorwärts- (Kationen) und Rückwärtsmodus (Anionen). Der umgekehrte Trennmodus wird mit einem Vorwärtsdruck von 0,5 psi auf die Trennkapillare unterstützt.
- Stellen Sie das Massenspektrometer ein, um Daten im positiven (Kationen) oder negativen (Anionen) Modus über den Massenbereich von 65-1000 m / z zu sammeln. Zwischen den Proben Die Kapillare mit 0,1 M HCl, 0,1 M NaOH, DI-Wasser und BGE bei 50 psi für 2 min abspülen.
Ergebnisse
Die beschriebene Methode ist die erste, die sowohl die Proteine als auch die Metaboliten in der biomolekularen NM-Korona mit derselben menschlichen Plasmaprobe charakterisiert. Diese Methode ist in der Lage, >200 Proteine und >150-Metaboliten nachzuweisen, wodurch ein möglichst umfassender Überblick über die gesamte biomolekulare Korona bestimmt werden kann, was ein besseres Verständnis der zellulären Bindung, Aufnahme und Auswirkungen von NMs ermöglicht.
Die Verwendung von CESI-MS sowohl für die Proteomik (Abbildung 1) als auch für die Metabolomik (Abbildung 2) trennung und detektion zeigt gute Trennfenster an beiden Kapillaren für jeden Ansatz.
Diese Methode ist in der Lage, zwischen den Proteinen in der Korona über eine breite Palette von NMs-Zusammensetzungen zu unterscheiden und so die Anwendbarkeit der Methoden auf NMs über ein breites Spektrum physikalischer und chemischer Eigenschaften zu demonstrieren (Tabelle 1).
Die eindeutigen Fingerabdrücke des Metaboliten Korona können auch mit dem metabolomischen Zweig dieser Methodik unterschieden werden (Abbildung 3). Obwohl dieser Ansatz einen passiven Ansatz zur Charakterisierung der NM-Metabolitenkorona verwendet, ist er immer noch in der Lage, interessante Einblicke in die Rolle von Metaboliten in der biomolekularen Korona wie die differentielle Adsorption von Isomeren zu gewinnen (Abbildung 4).
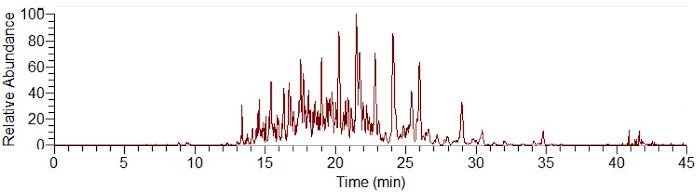
Abbildung 1: Beispiel-Elektropherogramm einer SiO2-Proteinkoronatrennung mittels CESI-MS nach einem On-Particle-Digest. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
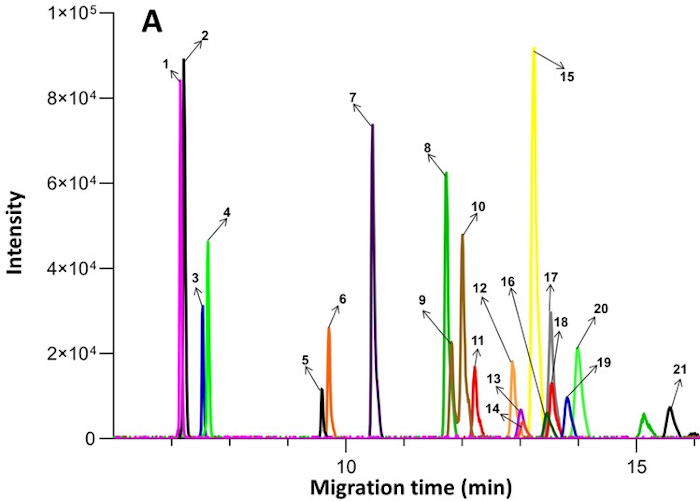
Abbildung 2: Beispiel für extrahierte Ionenelektropherogramme, die aus endogenen Verbindungen im Plasma durch CE-MS gewonnen wurden. Die nummerierten Verbindungen sind wie folgt: 1. Ornithin; 2. Lysin; 3. Arginin; 4. Histidin; 5. Kreatin; 6. Glycin; 7. Alanin; 8. Valin; 9. Isoleucin; 10. Leucin; 11. Serin; 12. Threonin; 13. Asparagin; 14. Methionin; 15. Glutamin; 16. Glutaminsäure; 17. Phenyl-D5-Alanin; 18. Phenylalanin; 19. Tyrosin; 20. Prolin; 21. Methioninsulfon (interner Standard). Veröffentlicht unter einer Open-Access-Lizenz von Creative Commons CC BY und reproduziert von Zhang et al17. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Analyse der Proteinkorona über ein Array von 6 NMs. Heatmap der Proteinklassen, die auf Kieselsäure(SiO2),Titan (TiO2), PVP-gekapptes Titan (TiO2-PVP), dispex-gekapptes Titan (TiO2-Dispex), Polystyrol und carboxyliertes Polystyrol-NMs identifiziert wurden. Prozentsätze beziehen sich auf die Häufigkeit der Proteine im Verhältnis zum Gesamtproteingehalt basierend auf der Top-3-Peptidhäufigkeit für jedes Protein. Angesichts der Beobachteten Unterschiede in den relativen Häufigkeiten von Proteinen in den verschiedenen NM-Koronen ist es klar, dass dieses vorgeschlagene Protokoll ausreichend empfindlich ist, um zwischen der Proteinkorona verschiedener NMs zu unterscheiden. Abbildung reproduziert aus einer CESI-MS-Analyse der Proteinkorona, veröffentlicht unter einem Open Access Creative Commons CC BY Lizenz11. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
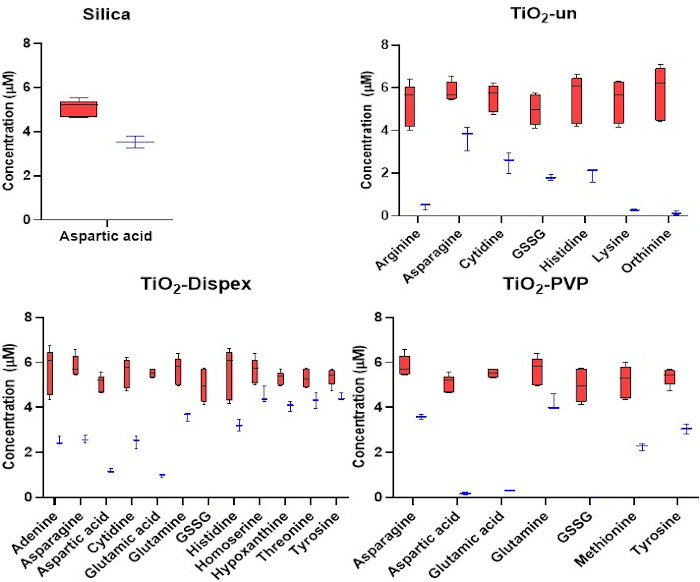
Abbildung 3: Gezielte Analyse der kationischen Metaboliten in der NM-Korona. Adsorption von Kationen anSiO2 undTiO2 NMs. Rot bezieht sich auf die Anfangskonzentration von Metaboliten, während Blau sich auf die Konzentration von Metaboliten nach einer 1 h Inkubation mit den NMs bei 37 °C bezieht. Die Verringerung der Metabolitenkonzentration in der Lösung ist das Ergebnis der Metabolitenadsorption an der NM-Oberfläche. Für die Polystyrol-NMs wurde keine signifikante Adsorption von Metaboliten beobachtet. Box-Diagramme stellen die Minimal- und Maximalwerte, Median- und Interquartilbereiche dar. Abbildung reproduziert aus einer CESI-MS-gezielten Analyse des Metaboliten Corona, die unter einer Open-Access-Creative Commons CC BY-Lizenz15veröffentlicht wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
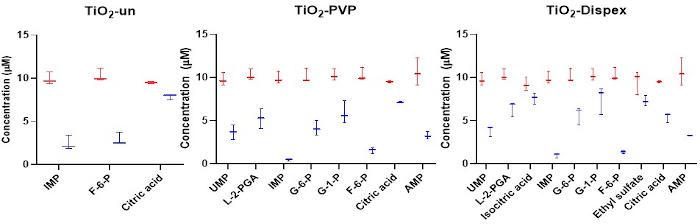
Abbildung 4: Gezielte Analyse der anionischen Metaboliten in der NM-Korona mit Fokus auf Isomerenadsorption. Die Adsorption von Anionen an eine Reihe von Titan-NMs zeigt deutliche Unterschiede zwischen verschiedenen Isomeren wie den Zuckerphosphaten. Rot bezieht sich auf die Anfangskonzentration von Metaboliten, während Blau auf die Konzentration von Metaboliten nach einer 1 h Inkubation mit dem NM bei 37 °C verweist. Die Verringerung der Metabolitenkonzentration in Lösung ist das Ergebnis der Metabolitenadsorption an der NM-Oberfläche. FürsiO2 und die Polystyrol-NMs wurde keine signifikante Adsorption von Metaboliten beobachtet. Box-Diagramme stellen die Minimal- und Maximalwerte, Median- und Interquartilsbereiche dar. Abbildung reproduziert aus einer CESI-MS-gezielten Analyse des Metaboliten Corona, die unter einer Open-Access-Lizenz von Creative Common CC BY15veröffentlicht wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Analyt | Mittlere RSD-Spitzenfläche | Mittlere RSD-Migrationszeit |
| 1928 Peptide intraday (n=3) | 15% | 0.30% |
| 27 Kationen intraday (n=16) | 5.80% | 2.20% |
| 27 Kationen intertags (n=36) | 8.60% | 1.80% |
Tabelle 2: Reproduzierbarkeit von technischen CESI-MS-Replikaten für Peptide und kationische Metaboliten. RSD: relative Standardabweichung als Maß für die Reproduzierbarkeit. Die Reproduzierbarkeit von CESI-MS in Bezug auf Spitzengebiete und Migrationszeiten ist sehr gut, wobei alle Analyten einen mittleren RSD-<15% und Migrationszeiten <2,2% aufweisen. Diese Ergebnisse zeigen das hohe Maß an Vertrauen, das den mit dieser Technik gesammelten Daten zugeschrieben werden kann, und bestätigen, dass die festgestellten Variationen eher auf echte Unterschiede in der Probenzusammensetzung (Anreicherung auf NMs) als auf analytische Variationen zurückzuführen sind. Tabelle 2 wird aus den zuvor dargestellten Ergebnissen11,15generiert.
Diskussion
Dies ist die erste Methode, die vorgeschlagen wird, um die vollständige biomolekulare Korona mit Proteinen und Metaboliten aus derselben Probe mit CESI-MS zu charakterisieren. Die Fähigkeit, sowohl die Proteine als auch die Metaboliten aus derselben Probe zu charakterisieren, wird die Datenmenge, die aus einer einzigen experimentellen Exposition gesammelt wird, signifikant erhöhen und neue Einblicke in den Prozess der Koronabildung und ihre Auswirkungen auf die Toxizität und Wirksamkeit von NMs als Nanoarzneimittel ermöglichen. Darüber hinaus ist CESI-MS eine ideale Plattform, um beide Klassen von Biomolekülen mit nur einer Erforderlichen Kapillarveränderung zu charakterisieren. Neue Methoden, die für nicht-wässriges CE entwickelt wurden, werden es ermöglichen, Lipidomik mit CE-MS40 durchzuführen, so dass es jetzt möglich ist, Proteine, Metaboliten und Lipide mit einer einzigen Plattform zu analysieren. Die derzeitigen konventionellen Ansätze würden zwei dedizierte LC-MS-Plattformen erfordern, eine für die Proteinkorona und eine für den Metaboliten Korona. Somit kann dieser Ansatz doppelt so viele Daten mit einer einzigen Analyseplattform sammeln.
Es gibt einige Vorbehalte gegen diesen Ansatz, insbesondere mit dem Metaboliten Corona, da dieses Protokoll eine indirekte Messung der Korona vorschlägt. Daher kann ein Problem auftreten, wenn die Metabolitenspiegel in hohen Konzentrationen relativ zu den NMs vorhanden sind und der anschließende Abfall der Metabolitenkonzentration in der Matrix gering ist. Anders als bei der Proteinkorona ist es jedoch unwahrscheinlich, dass ein "one size fits all" -Ansatz zur Isolierung der Metabolitenkorona entwickelt wird, da jede NM über eine einzigartige Oberflächenchemie verfügt. In Zukunft ist es jedoch wahrscheinlicher, dass NM-spezifische Ansätze zur Isolierung des Metaboliten Corona entwickelt und validiert werden; Dies gilt nur für diesen spezifischen NM. Trotzdem wird das CESI-MS weiterhin eine sehr geeignete Plattform für die Charakterisierung der polar geladenen Metaboliten sein, unabhängig davon, wie sie isoliert werden. Bemerkenswert ist auch, dass, wenn sich während der Zentrifugationsschritte, die zur Pelletierung der NMs bestimmt sind, kein Pellet bildet, eine höhere Zentrifugalkraft erforderlich sein kann; Dies tritt am ehesten bei weniger dichten NMs auf. Es ist auch wichtig, dass alle Filterschritte innerhalb des Protokolls eingehalten werden, da die Kapillaren durch die enge Bohrung der Kapillaren leicht blockiert werden können, wenn Partikel nicht ausreichend aus der Probe entfernt wurden.
Während das Protein Corona seit einigen Jahren ein intensives Forschungsgebiet ist, ist die Fähigkeit, dies mit dem Metaboliten Corona zu kombinieren, ein neues Interessengebiet fürWissenschaftler,die die Bio-Nano-Grenzflächeuntersuchen 6,14. Bisher konzentrierte sich die Mehrzahl dieser Studien auf die unpolare Lipidfraktion des Metaboliten Korona9,28. Diese aktuelle Methode ermöglicht die Charakterisierung der hochpolaren und geladenen Metaboliten in der Korona, zu denen wichtige Metaboliten gehören, die am Energiestoffwechsel, der Glykolyse und der DNA-Synthese beteiligt sind. Dadurch ist in Kombination mit dem Proteomik-Workflow eine ganzheitlichere Charakterisierung der biomolekularen Korona möglich. Dies ermöglicht eine eingehendere Analyse von Bio-Nano-Wechselwirkungen. Diese Methode ermöglicht verbesserte mechanistische Einblicke in die rezeptorvermittelte Endozytose über Protein- und Metaboliteninteraktionen mit Membranrezeptoren. Weiterhin können inter- und intrakoronale Wechselwirkungen zwischen Proteinen und kleinen Molekülen untersucht werden; So konnte kürzlich gezeigt werden, dass die Proteine in der Korona eine Schlüsselrolle bei der Rekrutierung von Metaboliten spielen15. Es ist erwähnenswert, dass die repräsentativen Ergebnisse in Abbildung 3 und Abbildung 4 eine absolute Quantifizierung von Metaboliten sind, jedoch würde ein ungezielter Ansatz mit multivariater Datenanalyse zum Vergleich aller CE-MS-Merkmale in Kontrollen im Vergleich zu exponiertem Plasma auch die Metabolitenbindung aufklären. Daher gibt es einen erheblichen Spielraum zu untersuchen, wie und welche Metaboliten und Proteine ihre jeweilige Rekrutierung in NM-Coronas beeinflussen. Diese zusätzlichen Studien können dazu beitragen, Coronas zu entwerfen, um die Verabreichung von Nanoarzneimitteln zu optimieren oder weitere Hürden für ihre Entwicklung aufzudecken, wie die Unterdrückung der pharmazeutischen Wirkung aufgrund der biomolekularen Koronablockierung oder maskierenden Targeting-Funktionalitäten.
CESI-MS mit seinen Nano-Durchflussraten von etwa 20 nL / min und dem minimalen Einsatz organischer Lösungsmittel bietet eine Verbesserung der grünen und wirtschaftlichen Referenzen gegenüber Standard-LC-MS und NanoLC-MS in Bezug auf den Lösungsmitteleinsatz, die größten Herausforderungen für Metabolomik- bzw. Proteomik-Studien. CESI-MS bietet hochreproduzierbare Ergebnisse sowohl für die Migrationszeit als auch für den Peak-Bereich, die im Vergleich zu LC-MS-basierten Methoden11,15günstig sind. Darüber hinaus ist die Übertragung im Vergleich zu nanoLC-MS bei CESI-MS kein Problem. Daher ist keine umfangreiche Systembereinigung zwischen den Probenanalysen erforderlich, was den Probendurchsatz erheblich verbessert11.
Zusammenfassend lässt sich sagen, dass der vorgeschlagene Workflow der erste ist, der einen Ansatz zur Charakterisierung sowohl der Protein- als auch der Metabolitenkomponenten der vollständigen biomolekularen Korona von NMs beschreibt. Dies erschließt einen neuen Aspekt der Bio-Nano-Interaktionen, den Metaboliten Corona, und ermöglicht so die Sammlung von doppelt so vielen Daten aus derselben Probe und ermöglicht ein vollständigeres Verständnis der Wechselwirkungen an der Bio-Nano-Grenzfläche.
Offenlegungen
J.A.T ist ein Mitarbeiter von AB Sciex UK Ltd, der als Industriepartner am ACEnano-Projekt teilnimmt, J.A.T und alle anderen Autoren haben keinen Interessenkonflikt in dieser Arbeit.
Danksagungen
A.J.C, J.A.T und I.L bestätigen Förderung durch die Europäische Kommission über horizon 2020 Projekt ACEnano (Grant No. H2020-NMBP-2016-720952). W.Z erkennt Promotionsförderung durch den China Scholarship Council (CSC, Nr. 201507060011) an. R.R. erkennt die finanzielle Unterstützung des Vidi-Zuschussprogramms der niederländischen Organisation für wissenschaftliche Forschung (NWO Vidi 723.0160330) an.
Materialien
| Name | Company | Catalog Number | Comments |
| 1,4-Dithiothreitol | Sigma | 10197777001 | |
| 2,2,4,4-D4-citric | Simga | 485438-1G | Internal standard anion |
| Ammonium Acetate >98% | Sigma | A1542 | |
| Ammonium Bicarbonate >99.5% | Sigma | 09830 | |
| Capillary cartridge coolant | Sciex | 359976 | |
| CESI 8000 instrument | Sciex | A98089 | |
| CESI Cap | Sciex | B24699 | |
| CESI Vials | Sciex | B11648 | |
| Chloroform | Sigma | 650498 | Toxic, use in a fume hood |
| Glacial Acetic acid | Sigma | A6283 | |
| Hydrochloric acid 1mol/L | Sigma | 43617 | |
| Iosoacetamide | Sigma | I1149 | |
| L-methionine sulfone | Sigma | M0876-1G | Internal standard cation |
| Methonal (LC-MS Ultra Chromasolve) | Sigma | 14262 | Use in a fume hood |
| Microvials | Sciex | 144709 | |
| nanoVials | Sciex | 5043467 | |
| Neutral Surface Cartridge 30 µM ID x 90 cm total length | Sciex | B07368 | |
| OptiMS Adapter for Sciex Nanospray III source | Sciex | B07363 | B07366 and B83386 for Thermo mass spectrometers, B85397 for Waters mass spectrometers, B86099 for Bruker mass spectrometers |
| OptiMS Fused-Silica Cartridge 30 µm ID x 90 cm total length | Sciex | B07367 | |
| Phospahte buffered saline 10x | Sigma | P7059 | |
| Pierce C18 Tips, 100 µL bed | Thermo Fisher Scientific | 87784 | |
| Polystyrene 100 nm | Polysciences Inc | 876 | |
| Polystyrene carboxylated 100 nm | Polysciences Inc | 16688 | |
| Polystyrene carboxylated 1000 nm | Polysciences Inc | 08226 | |
| Rapigest SF (surfactant) | Waters | 186001860 | |
| Sequencing Grade modified Trypsin | Promega | V5111 | |
| SiO2 Ludox TM-40 | Sigma | 420786 | |
| Sodium Hydroxide solution | Simga | 72079 | |
| TiO2 Dispex coated | Promethion particles | Bespoke particles | |
| TiO2 PVP coated | Promethion particles | Bespoke particles | |
| TiO2 uncoated | Promethion particles | Bespoke particles |
Referenzen
- Ke, P. C., Lin, S., Parak, W. J., Davis, T. P., Caruso, F. A Decade of the Protein Corona. ACS Nano. 11 (12), 11773-11776 (2017).
- Sasidharan, A., Riviere, J. E., Monteiro-Riviere, N. A. Gold and silver nanoparticle interactions with human proteins: impact and implications in biocorona formation. Journal of Materials Chemistry B. 3 (10), 2075-2082 (2015).
- Albanese, A., et al. Secreted biomolecules alter the biological identity and cellular interactions of nanoparticles. ACS Nano. 8 (6), 5515-5526 (2014).
- Lynch, I., Dawson, K. A. Protein-nanoparticle interactions. Nano Today. 3 (1-2), 40-47 (2008).
- Tenzer, S., et al. Rapid formation of plasma protein corona critically affects nanoparticle pathophysiology. Nature Nanotechnology. 8 (10), 772-781 (2013).
- Chetwynd, A. J., Lynch, I. The rise of the nanomaterial metabolite corona, and emergence of the complete corona. Environmental Science: Nano. 7 (4), 1041-1060 (2020).
- Lee, J. Y., et al. Analysis of lipid adsorption on nanoparticles by nanoflow liquid chromatography-tandem mass spectrometry. Analytical and Bioanalytical Chemistry. , 1-10 (2018).
- Pink, M., Verma, N., Kersch, C., Schmitz-Spanke, S. Identification and characterization of small organic compounds within the corona formed around engineered nanoparticles. Environmental Science: Nano. 5 (6), 1420-1427 (2018).
- Chetwynd, A. J., Wheeler, K. E., Lynch, I. Best practice in reporting corona studies: Minimum information about Nanomaterial Biocorona Experiments (MINBE). Nano Today. 28, 100758(2019).
- Zhang, H., et al. Quantitative proteomics analysis of adsorbed plasma proteins classifies nanoparticles with different surface properties and size. Proteomics. 11 (23), 4569-4577 (2011).
- Faserl, K., Chetwynd, A. J., Lynch, I., Thorn, J. A., Lindner, H. H. Corona isolation method matters: Capillary electrophoresis mass spectrometry based comparison of protein corona compositions following on-particle versus in-solution or in-gel digestion. Nanomaterials. 9 (6), 898(2019).
- Nasser, F., Lynch, I. Secreted protein eco-corona mediates uptake and impacts of polystyrene nanoparticles on Daphnia magna. Journal of Proteomics. 137, 45-51 (2016).
- Hellstrand, E., et al. Complete high-density lipoproteins in nanoparticle corona. FEBS Journal. 276 (12), 3372-3381 (2009).
- Grintzalis, K., Lawson, T. N., Nasser, F., Lynch, I., Viant, M. R. Metabolomic method to detect a metabolite corona on amino functionalised polystyrene nanoparticles. Nanotoxicology. , 1-12 (2019).
- Chetwynd, A. J., Zhang, W., Thorn, J. A., Lynch, I., Ramautar, R. The nanomaterial metabolite corona determined using a quantitative metabolomics approach: A pilot study. Small. , (2020).
- Chetwynd, A. J., Guggenheim, E. J., Briffa, S. M., Thorn, J. A., Lynch, I., Valsami-Jones, E. Current application of capillary electrophoresis in nanomaterial characterisation and its potential to characterise the protein and small molecule corona. Nanomaterials. 8 (2), 99(2018).
- Zhang, W., et al. Assessing the suitability of capillary electrophoresis-mass spectrometry for biomarker discovery in plasma-based metabolomics. Electrophoresis. , 00126(2019).
- Ramautar, R., Somsen, G. W., de Jong, G. J. CE-MS for metabolomics: Developments and applications in the period 2016-2018. Electrophoresis. 40 (1), 165-179 (2019).
- Sarg, B., Faserl, K., Lindner, H. H. Identification of novel site-specific alterations in the modification level of myelin basic protein isolated from mouse brain at different ages using capillary electrophoresis-mass spectrometry. Proteomics. 17 (19), 1700269(2017).
- Faserl, K., Sarg, B., Maurer, V., Lindner, H. H. Exploiting charge differences for the analysis of challenging post-translational modifications by capillary electrophoresis-mass spectrometry. Journal of Chromatography A. 1498, 215-223 (2017).
- Zhang, Z., Qu, Y., Dovichi, N. J. Capillary zone electrophoresis-mass spectrometry for bottom-up proteomics. TrAC - Trends in Analytical Chemistry. 108, 23-37 (2018).
- Shen, X., et al. Capillary zone electrophoresis-mass spectrometry for top-down proteomics. TrAC - Trends in Analytical Chemistry. 120, 115644(2019).
- Ramautar, R., Busnel, J. M., Deelder, A. M., Mayboroda, O. A. Enhancing the coverage of the urinary metabolome by sheathless capillary electrophoresis-mass spectrometry. Analytical Chemistry. 84 (2), 885-892 (2012).
- Faserl, K., Kremser, L., Müller, M., Teis, D., Lindner, H. H. Quantitative proteomics using ultralow flow capillary electrophoresis-mass spectrometry. Analytical Chemistry. 87 (9), 4633-4640 (2015).
- Faserl, K., Sarg, B., Kremser, L., Lindner, H. Optimization and evaluation of a sheathless capillary electrophoresis-electrospray ionization mass spectrometry platform for peptide analysis: comparison to liquid chromatography-electrospray ionization mass spectrometry. Analytical Chemistry. 83 (19), 7297-7305 (2011).
- Segers, K., et al. CE-MS metabolic profiling of volume-restricted plasma samples from an acute mouse model for epileptic seizures to discover potentially involved metabolomic features. Talanta. 217, 121107(2020).
- Chetwynd, A. J., David, A. A review of nanoscale LC-ESI for metabolomics and its potential to enhance the metabolome coverage. Talanta. 182, 380-390 (2018).
- Drouin, N., et al. Capillary electrophoresis-Mass spectrometry at trial by metabo-ring: Effective electrophoretic mobility for reproducible and robust compound annotation. Analytical Chemistry. 92 (20), 14103-14112 (2020).
- Faria, M., et al. Minimum information reporting in bio-nano experimental literature. Nature Nanotechnology. 13 (9), 777-785 (2018).
- Leong, H. S., et al. On the issue of transparency and reproducibility in nanomedicine. Nature Nanotechnology. 14 (7), 629-635 (2019).
- Kaur, I., et al. Dispersion of nanomaterials in aqueous media: Towards protocol optimization. Journal of Visualized Experiments. (130), e56074(2017).
- Bihari, P., et al. Optimized dispersion of nanoparticles for biological in vitro and in vivo studies. Particle and Fibre Toxicology. 5 (1), 1-14 (2008).
- Taurozzi, J. S., Hackley, V. A., Wiesner, M. R. Ultrasonic dispersion of nanoparticles for environmental, health and safety assessment - and recommendations. Nanotoxicology. 5 (4), 711-729 (2011).
- Lu, P. J., et al. Methodology for sample preparation and size measurement of commercial ZnO nanoparticles. Journal of Food and Drug Analysis. 26 (2), 628-636 (2018).
- Langevin, D., et al. Inter-laboratory comparison of nanoparticle size measurements using dynamic light scattering and differential centrifugal sedimentation. NanoImpact. 10, 97-107 (2018).
- Lee, S., Bi, X., Reed, R. B., Ranville, J. F., Herckes, P., Westerhoff, P. Nanoparticle size detection limits by single particle ICP-MS for 40 elements. Environmental Science and Technology. 48 (17), 10291-10300 (2014).
- Hole, P., et al. Interlaboratory comparison of size measurements on nanoparticles using nanoparticle tracking analysis (NTA). Journal of Nanoparticle Research. 15 (12), 2101(2013).
- Zhang, W., Gulersonmez, M. C., Hankemeier, T., Ramautar, R. Sheathless capillary electrophoresis-mass spectrometry for metabolic profiling of biological samples. Journal of Visualized Experiments. , e54535(2016).
- Faserl, K., Sarg, B., Lindner, H. H. Application of CE-MS for the analysis of histones and histone modifications. Methods. , (2020).
- Azab, S., Ly, R., Britz-Mckibbin, P. Robust method for high-throughput screening of fatty acids by multisegment injection-nonaqueous capillary electrophoresis-mass spectrometry with Sstringent quality control. Analytical Chemistry. 91 (3), 2329-2336 (2019).
- Zhang, X., Pandiakumar, A. K., Hamers, R. J., Murphy, C. J. Quantification of lipid corona formation on colloidal nanoparticles from lipid vesicles. Analytical Chemistry. 19 (24), 14387-14394 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten