Method Article
Abordagens de espectrometria de massa de eletroforese capilar para caracterização da proteína e corona metabólica adquirida por nanomateriais
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui apresentamos um protocolo para caracterizar a completa corona biomolecular, proteínas e metabólitos, adquiridas por nanomateriais de biofluidos usando uma eletroforese capilar – abordagem de espectrometria de massa.
Resumo
A adsorção de biomoléculas de matrizes biológicas circundantes à superfície de nanomateriais (NMs) para formar a coroa tem sido de interesse na última década. O interesse pela interface bio-nano decorre do fato de que a corona biomolecular confere uma identidade biológica aos NMs e, portanto, faz com que o corpo os identifique como "eu". Por exemplo, estudos anteriores demonstraram que as proteínas na coroa são capazes de interagir com receptores de membrana para influenciar a captação celular e estabeleceram que a coroa é responsável pelo tráfico celular de NMs e sua eventual toxicidade. Até o momento, a maioria das pesquisas se concentrou na corona proteica e ignorou os possíveis impactos dos metabólitos incluídos na coroa ou efeitos sinérgicos entre componentes na coroa biomolecular completa. Como tal, este trabalho demonstra metodologias para caracterizar tanto os componentes proteicos quanto metabólicos da coroa biomolecular utilizando abordagens proteômicas e metabolômicas de baixo para cima em paralelo. Isso inclui um digestão sobre partículas da corona proteica com um surfactante usado para aumentar a recuperação de proteínas, e uma caracterização passiva da coroa metabólito analisando matrizes metabólicas antes e depois das exposições de NM. Este trabalho introduz a eletroforese capilar – espectrometria de massa (CESI-MS) como uma nova técnica para caracterização de coroa NM. Os protocolos aqui descritos demonstram como o CESI-MS pode ser usado para a caracterização confiável tanto da proteína quanto da corona metabólito adquirida pelas NMs. A mudança para CESI-MS diminui consideravelmente o volume de amostra necessária (em comparação com a cromatografia líquida tradicional – espectrometria de massa (LC-MS) se aproxima) com múltiplas injeções possíveis de apenas 5 μL de amostra, tornando-a ideal para amostras limitadas de volume. Além disso, as consequências ambientais da análise são reduzidas em relação à LC-MS devido às baixas taxas de vazão (<20 nL/min) no CESI-MS, e ao uso de eletrólitos aquosos que eliminam a necessidade de solventes orgânicos.
Introdução
Interações bio-nano, na interface entre superfícies nanomateriais (NM) e matrizes biológicas das quais biomoléculas adsorb para o NM, é uma área intensa de pesquisa que sustenta a nanossegurança e nanomedicina1. Essa camada de biomoléculas adsorvidas confere uma identidade biológica às NMs, assim as células as identificam como "eu", influenciando posteriormente a absorção celular, distribuição e pontos finais biológicos2,3,4. A grande maioria dos estudos bio-nano se concentrou nas proteínas dentro da coroa, e demonstrou que as proteínas variam quantitativamente e qualitativamente entre NMs de diferentes composições5. Essa variação depende tanto das propriedades do NM como tamanho, funcionalização e material, além das propriedades da matriz biológica, incluindo composição e teor de sal5. Uma área crescente de interesse na interface bio-nano são os metabólitos que adsorb para NMs6. Vários estudos têm demonstrado que, assim como as proteínas, as propriedades de NM são um fator-chave na determinação da composição dos metabólitos na coroa e que podem influenciar os desfechos biológicos da exposição de NM6,7,8.
Em estudos da corona biomolecular há quatro fases distintas à sua caracterização, formação de corona, isolamento das biomoléculas dentro da coroa, sua detecção via espectrometria de massa qualitativa ou quantitativa e identificação9. Até o momento, uma série de técnicas foram adotadas para isolar a coroa proteica, incluindo a ebulição em tampão de execução SDS-PAGE, extrações de solventes e sal ou digestão direta de proteínas in situ na superfície de NMs. Em termos dos metabólitos na coroa, o isolamento é mais complexo com vários métodos utilizando solventes ou mesmo a dissolução das NMs propostas como soluções8,10,11. No entanto, ao contrário da proteína corona uma abordagem "um tamanho se encaixa em todos" é improvável de aplicar-se ao isolamento de metabólitos de NMs, devido ao amplo espaço químico ocupado pelo metabolome e a diversidade de possíveis NMs. Uma abordagem alternativa é caracterizar a matriz biológica antes e depois da exposição de NM com a diferença nas concentrações metabólicas atribuídas à adsorção de metabólitos às NMs.12
Esta abordagem alternativa seria aplicável a todos os biofluidos e NMs e, embora exija o dobro da análise, ela consequentemente oferece uma medida muito mais precisa da coroa metabólito e não tem risco de baixa recuperação metabólica da superfície NM ser confundida com baixa ligação do metabólito específico.
O segundo passo para a análise biomolecular da coroa é a detecção das biomoléculas. Tradicionalmente para as proteínas na coroa, este tem sido o mandato de nano-LC-MS, o cavalo de trabalho da proteômica; outras abordagens como NMR13, 1D e 2D SDS-PAGE também foram aplicadas. Em termos de corona metabólica LC-MS7,GC-MS8 e espectrometria de massa de infusão direta foram utilizadas14. No entanto, uma nova abordagem começou recentemente a ganhar tração, ou seja, a espectrometria de massa capilar (CE-MS)11,15 e tem estado presente nos laboratórios de NM como uma técnica autônoma para caracterizar várias propriedades físicas e químicas das NMs16. CE-MS é uma técnica de separação ortogonal para nanoLC-MS e GC-MS e é capaz de permitir a detecção de metabólitos altamente polares e carregados17,18. Além disso, a CE-MS é adequada para a análise de proteínas e suas modificações pós-transacionais, como fosforilação e glicosilação19,20,21,22. A etapa final, identificação e análise de dados podem ser realizadas de várias formas, dependendo se uma abordagem quantitativa/qualitativa ou direcionada/não direcionada está sendo utilizada, isso, no entanto, está fora do mandato deste protocolo.
CESI-MS, uma combinação de CE e uma interface nanoESI, é um avanço recente na tecnologia CE utilizando uma interface sem baia. Isso permite a conexão direta do fluxo ultra-baixo CE (<20 nL/min) a um espectrômetro de massa de alta resolução sem diluição, resultando em sensibilidade de detecção significativamente melhorada23,24,25. O CESI-MS permite que amostras limitadas de volume (< 10 μL) sejam analisadas mantendo uma análise altamente sensível26. O CESI-MS também se compara favoravelmente às abordagens tradicionais de nanoLC-MS de baixa taxa de fluxo utilizadas em proteômica e metabolômica em termos de reprodutibilidade27,28, throughput, e carry over tornando-se uma perspectiva emocionante para a caracterização completa da coroa biomolecular.
Para destacar o potencial do CESI-MS para as análises das interações bio-nano este trabalho descreve a preparação da amostra necessária para isolar a coroa biomolecular NM de uma única amostra de plasma humano de forma a maximizar os dados dos aspectos proteicos e metabólicos da coroa biomolecular completa nmolcular. Enquanto reportamos sobre o uso de plasma humano, este protocolo seria igualmente apropriado para outros biofluidos, como soro sanguíneo, meio de cultura celular completa, liseto celular, fluido cefalorraquidiano ou urina. As análises desses dois componentes (proteínas e metabólitos) serão então descritas usando capilares CESI revestidos neutros para a coroa de proteína e capilares de sílica fundidos nus para metabólitos cationicos e aniônicos.
Protocolo
O uso de biofluido humano foi aprovado de acordo com as diretrizes do protocolo IRB da Universidade de Leiden e da Universidade Médica de Innsbruck. Quando os biofluidos humanos ou animais estão sendo investigados, é necessária a aprovação ética da instituição de pesquisa, e foi obtida no caso dos resultados mostrados neste protocolo. Além disso, também devem ser realizados relatórios adequados para garantir transparência e reutilização dos dados no trabalho futuro9,29,30.
1. Preparação de eletrólitos de fundo (BGE)
NOTA: Todos os solventes devem ser preparados em um capô de fumaça adequado e equipamentos de proteção individual adequados devem ser usados para todas as etapas (casaco de laboratório, luvas e óculos). Em cada etapa, frascos plásticos de baixa ligação são necessários para minimizar a perda de analitos e a contaminação da amostra com sais lixiviados de vidro.
- Prepare 10% de ácido acético BGE (v/v), pH 2.2 diariamente para metabolômica.
- Em um frasco volumoso de 10 mL adicione 1 mL de ácido acético, seguido pela adição de água deionizada (DI) à linha marcada e mistura completa.
- Prepare ácido acético de 100 mM, pH 2.9 diariamente para proteômica.
- Em um frasco volumoso de 10 mL adicione 57 μL de ácido acético, seguido pela adição de água DI à linha marcada e mistura completa.
2. Preparação nm
- Disperse vigorosamente as NMs na água utilizando as diretrizes publicadas31,32,33.
NOTA: No desenvolvimento deste protocolo, foram utilizados 7 NMs da seguinte forma: foram utilizados 100 e 1.000 nm de poliestireno carboxilado para proteína e corona metabólito, respectivamente. NMs de poliestireno não modificado de 100 nm, 13 nm anatase TiO2 NMs que não foram modificados ou revestidos com polímeros poliacrilatos ou PVP e 22NMs não modificados foram utilizados para coroas de proteína e metabólito. Embora o método tenha sido desenvolvido e demonstrado usando esses NMs, deve-se notar que essa abordagem seria aplicável para uma ampla gama de composições, tamanhos, formas e morfologias de NM. - Caracterize o tamanho das partículas usando a dispersão de luz dinâmica34,35, uma única partícula acoplada indutivamente espectrometria de massa plasmática36,análise de rastreamento de nanopartículas37, ou microscopia eletrônica de transmissão e carga superficial como potencial zeta usando um tamanho de zeta34.
3. Formação de corona biomolecular
- Divida 2 mL de plasma humano (ou biofluido de escolha) em alíquotas de 1 mL, uma para o metabólito e corona de proteína e a segunda para caracterização metabolome plasmática.
- Incubar 1 mg/mL de NMs no plasma humano por 1 h a 37 °C enquanto mistura suavemente a 500 rpm em um termomixer. Após a incubação centrífuga a amostra a 4.000 x g por 15 min a 4 °C para pelotar os NMs.
- Colete o supernatante de plasma para análise de corona metabólito. Reter o complexo corona-proteína-NM para caracterização de proteína corona.
4. Isolamento da coroa proteica
- Resuspend o complexo de proteína NM (a pelota) em 1 mL de 10x PBS Buffer e vórtice vigorosamente por 2 min para remover proteínas desvinculadas. Centrifugar a solução PBS a 4.000 x g por 15 min a 4 °C para pelotar os NMs, e remover cuidadosamente o supernatante sem perturbar a pelota.
- Resuspenque a pelota em 1 mL de tampão de bicarbonato de amônio (ABC) (100 mM, pH 8.0) e vórtice vigorosamente por 2 min para remover proteínas desvinculadas e sais indesejados. Centrifugar a 4.000 x g por 15 min a 4 °C para pelotar os NMs; remover e descartar o supernante. Repita este passo.
- Reduzir as ligações de dissulfeto proteico dissolvendo a pelota de proteína NM em 20 μL de tampão ABC (100 mM pH 8) contendo dithiotheritol de 10 mM. Incubar a solução de redução por 30 min a 56 °C.
- Para digerir proteínas, adicione 2 μg de trippsina de grau de sequenciamento a 20 μL de ABC contendo 0,1% de surfactante. Incubar a solução de digestão por 16 h a 37 °C.
- Alquilar a amostra pela adição de 20 μL de iodoacetamida a 55 mM em 100 mM ABC e incubar à temperatura ambiente por 20 min.
- Adicione 20 μL de 0,1 M HCl para cortar o surfactante e deixe por 10 minutos em temperatura ambiente.
- Enriquecer e desaltar peptídeos usando uma ponta de pipeta desalada embalada C18.
- Molhe a ponta com 80 μL 0,1% de ácido fórmico 50% acetonitrilo 5 vezes, limpo com 80 μL 0,1% de ácido fórmico 5 vezes, elaborar e elute amostra 10 vezes, desaltar amostra de 80 μL 0,1 % ácido fórmico 5 vezes e eluto a amostra 2 vezes com 80 μL 0,1% ácido formômico 70% acetonitrilo em um tubo PCR de baixa ligação limpa.
- Lyophilize as amostras e armazene a -20 °C até a análise.
5. Isolamento da coroa metabólito
- Pegue o plasma de controle e o supernasal da incubação de plasma NM a partir do Passo 3.3 e mantenha no gelo durante a preparação da amostra.
- Pegue 50 μL de cada um em frascos separados e dilua 1 em 10 com água DI. Pegue 50 μL de cada amostra diluída e passe para novos frascos para a etapa 5.3.
- Adicione 200 clorofórmio μL, 250 μL de metanol e 350 μL de água DI e vigorosamente mistura de vórtice por 2 min. Centrifugar por 10 min a 20.800 x g a 4 °C.
- Pegue 500 μL de supernadante e filtre através de um filtro centrífugo de 3 kDa por 2 h a 10.000 x g a 4 °C. Tome 430 μL de ultrafiltrato e seque em uma vac de velocidade. As amostras já podem ser congeladas antes da análise.
6. Preparação do sistema CESI-MS38
NOTA: Antes da instalação dos capilares, verifique se a entrada e a extremidade de saída dos capilares estão intactas e se não há quebras visíveis no capilar.
- Instalação de capilar revestido neutro para análise de proteína corona39.
- Coloque um novo capilar revestido neutro (90 cm de comprimento com 30 μm de diâmetro interno) no instrumento CESI seguindo as diretrizes do fabricante.
- Preparação de capilares CESI para análise proteômica.
- Lave o capilar de separação na direção dianteira usando 100 mM de HCl por 5 min a 100 psi e verifique se há formação de gotícula na saída do capilar. Capilar de separação de flush com BGE a 100 psi por 10 min e depois dI água a 100 psi por 30 min (isso só é necessário para novos capilares).
- Lave tanto o capilar de separação quanto o capilar condutivo com BGE a 90 psi por 5 min e certifique-se de forma de gotículas na extremidade de saída de ambos os capilares.
- Lave o capilar de separação com água DI a 90 psi por 10 minutos, depois 50 psi por 10 min com 0,1 M HCl, seguido novamente por 90 psi por 10 min com água DI e finalmente BGE a 90 psi por 10 min. Casal CESI para o MS usando uma fonte de nanospray e adaptador como descrito anteriormente38.
- Instalação de capilar de sílica fundido nu para caracterização de coroa metabólito38.
- Coloque um novo capilar de sílica fundido nu (90 cm de comprimento com um diâmetro interno de 30 μm) no instrumento CESI seguindo as diretrizes do fabricante.
- Preparação de capilares CESI para análise metabolômica.
- Lave o capilar de separação na direção dianteira usando 100% MeOH a 50 psi por 15 min e verifique se há formação de gotícula na saída do capilar. Lave tanto o capilar de separação quanto o capilar condutivo com BGE a 90 psi por 5 min e as gotas se formam na saída de ambos os capilares.
- Lave o capilar de separação com água DI a 90 psi por 10 minutos, depois 50 psi por 10 min com 0,1 M NaOH, seguido novamente por 90 psi por 10 min com água DI e finalmente BGE a 90 psi por 10 min. Casal CESI para o ESI-MS usando uma fonte de nanospray e adaptador como descrito anteriormente. 38
7. CE-MS para análise de corona de proteína
- Resuspend amostras da etapa 4.8 em 20 μL de 50 mM de acetato de amônio pH 4.0.
- Realize 5 psi 10 s injeção hidrodinâmica de amostra. Separe usando uma tensão de separação de 30 kV com o seguinte gradiente de pressão: 0-10 min a 1 psi, 10-35 min a 1,5 psi e 35-45 min a 5 psi usando 100 mM, pH 2,9 ácido acético como BGE.
- Colete espectros de massa entre 250-2000 m/z com aquisição de fragmentação dependente de dados top-10.
- Entre as amostras, enxágue capilar com 0,1 M HCl por 3 min a 100 psi e 10 min 100 psi de BGE para separação capilar e por 3 min a 100 psi para o capilar líquido condutor.
8. CESI-MS para análise de corona metabólito
NOTA: Todas as amostras devem ser analisadas duas vezes, uma no modo positivo para a detecção de cáções e uma vez no modo negativo para a detecção de ânions. As amostras de plasma de controle precisam ser analisadas pelo menos 5 vezes.
- Resuspend NM amostras de plasma expostas e não expostas da etapa 5.4 em 430 μL de água DI e vigorosamente vórtice por 2 min. Filtrar através de um filtro de membrana de 0,1 μm.
- Pegue 95 μL de filtrado e adicione 5 μL de padrões internos a 200 μM para cáations (L-methionine sulfone) e 400 μM para ânions (2,2,4,4,4-D4-ácido cítrico) e vórtice vigorosamente. Centrifuuga a 4.000 x g a 4 °C por 10 minutos antes da análise CESI-MS.
- Injete amostra hidrodinamicamente para 30 s (cáations) e 40 s (ânions) a 2 psi.
- Separe metabólitos em ácido acético de 10% com uma tensão de separação de 30 kV no modo para a frente (cáations) e reverso (ânions). O modo de separação reversa é auxiliado com pressão de 0,5 psi para a frente no capilar de separação.
- Defina espectrômetro de massa para coletar dados no modo positivo (caations) ou negativo (ânions) ao longo da faixa de massa de 65-1000 m/z. Entre as amostras, enxágue capilar com 0,1 M HCl, 0,1 M NaOH, dI água e BGE a 50 psi por 2 min.
Resultados
O método descrito é o primeiro a caracterizar as proteínas e metabólitos na coroa biomolecular NM usando a mesma amostra de plasma humano. Este método é capaz de detectar >200 proteínas e metabólitos >150, permitindo assim que a visão geral mais abrangente da coroa biomolecular completa seja determinada, permitindo uma compreensão aprimorada do apego celular, absorção e impactos dos NMs.
O uso de CESI-MS tanto para proteômica (Figura 1) quanto metabolômica(Figura 2) separação e detecção mostra boas janelas de separação em ambos os capilares para cada abordagem.
Este método é capaz de distinguir entre as proteínas na coroa em uma ampla gama de composições de NMs, demonstrando assim a aplicabilidade dos métodos aos NMs em uma ampla gama de características físicas e químicas(Tabela 1).
As impressões digitais únicas da coroa metabólito também podem ser distinguidas utilizando o ramo metabolômico desta metodologia (Figura 3). Embora essa abordagem utilize uma abordagem passiva para caracterizar a coroa metabólito NM, ainda é capaz de descobrir insights interessantes sobre o papel dos metabólitos na coroa biomolecular, como a adsorção diferencial de isômeros(Figura 4).
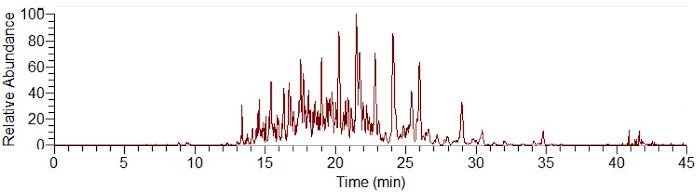
Figura 1: Eletroferograma exemplar de uma separação de coroa de proteína SiO2 usando CESI-MS após um digestão de partículas. Clique aqui para ver uma versão maior desta figura.
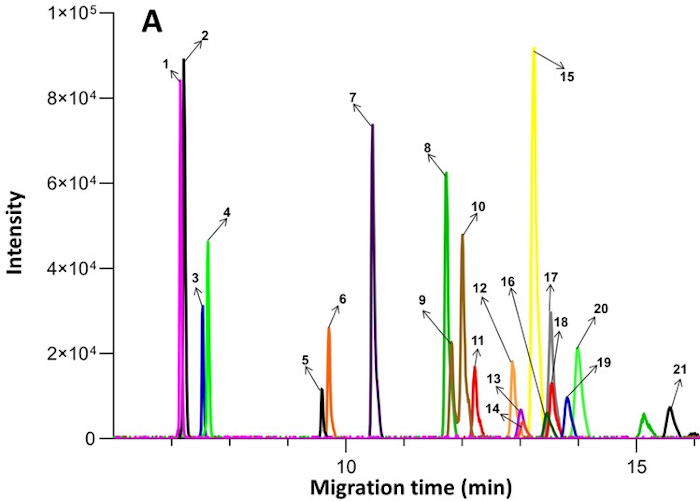
Figura 2: Exemplo de eletroferogramas de íons extraídos obtidos de compostos endógenos no plasma por CE-MS. Os compostos numerados são os seguintes: 1. Ornithine; 2. Lysine; 3. Arginina; 4. Histidina; 5. Creatina; 6. Glycine; 7. Alanine; 8. Valine; 9. Isoleucina; 10. Leucina; 11. Serino; 12. Threonine; 13. Asparagine; 14. Methionina; 15. Glutamina; 16. Ácido glutamico; 17. Phenyl-D5-alanine; 18. Fenilalanina; 19. Tyrosine; 20. Proline; 21. Sulfone de methionina (padrão interno). Publicado sob um acesso aberto Creative Commons CC BY licença e reproduzido a partir de Zhang et al17. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Análise da corona proteica em uma matriz de 6 NMs. Mapa de calor de classes proteicas identificadas em sílica (SiO2),titania (TiO2),TITIA tampada PVP (TiO2-PVP), titania tampada despex (TiO2-Dispex), poliestireno e poliestireno carboxilado NMs. As percentagens referem-se à abundância das proteínas em relação ao teor total de proteínas baseadas nos 3 peptídeos superiores para cada proteína. Dadas as diferenças observadas nas abundâncias relativas de proteínas nas diferentes coroas NM, é evidente que este protocolo proposto é suficientemente sensível para diferenciar entre a corona proteica de diferentes NMs. Figura reproduzida a partir de uma análise CESI-MS da proteína corona, publicada sob um acesso aberto Creative Commons CC BY licença11. Clique aqui para baixar esta tabela.
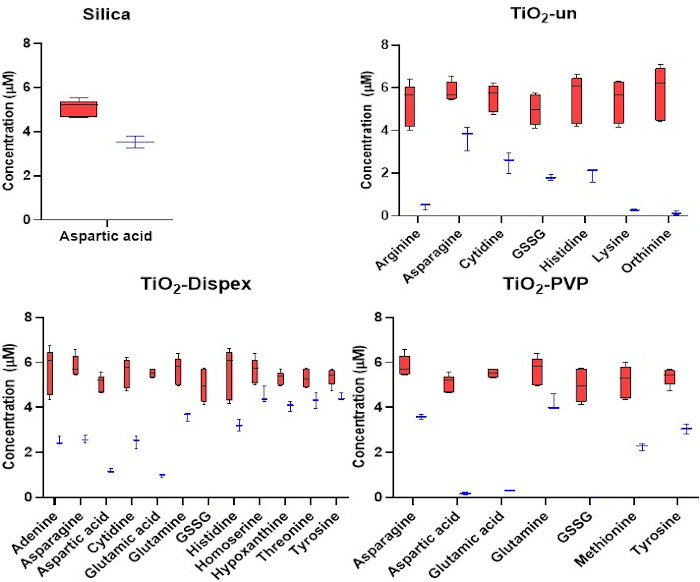
Figura 3: Análise direcionada dos metabólitos cationicos na coroa NM. Adsorção de cátions para SiO2 e TiO2 NMs. Vermelho refere-se à concentração inicial de metabólitos, enquanto azul refere-se à concentração de metabólitos após uma incubação de 1 h com os NMs a 37 °C. A redução da concentração metabólica na solução é resultado da adsorção metabólica à superfície NM. Não foi observada adsorção significativa de metabólitos para as NMs de poliestireno. As parcelas da caixa representam os valores mínimo e máximo, faixas medianas e interquartil. Figura reproduzida a partir de uma análise direcionada do CESI-MS da coroa metabólica publicada sob um acesso aberto Creative Commons CC BY licença15. Clique aqui para ver uma versão maior desta figura.
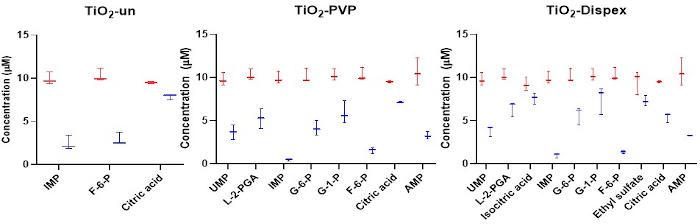
Figura 4: Análise direcionada dos metabólitos aniônicos na coroa NM com foco na adsorção de isômero. A adsorção de ânions para uma gama de NMs titania mostra diferenças claras entre vários isômeros, como os fosfatos de açúcar. Vermelho refere-se à concentração inicial de metabólitos, enquanto o azul refere-se à concentração de metabólitos após uma incubação de 1 h com o NM a 37 °C. A redução da concentração metabólica na solução é resultado da adsorção metabólica à superfície NM. Não foi observada adsorção significativa de metabólitos para o SiO2 e os NMs de poliestireno. As parcelas da caixa representam os valores mínimo e máximo, intervalos medianos e interquartis. Figura reproduzida a partir de uma análise direcionada do CESI-MS da coroa metabólica publicada sob um acesso aberto Creative Common CC BY licença15. Clique aqui para ver uma versão maior desta figura.
| Analito | Área de pico média do RSD | Tempo médio de migração do RSD |
| 1928 peptídeos intraday (n=3) | 15% | 0.30% |
| 27 ceações intra-dia (n=16) | 5.80% | 2.20% |
| 27 cation inter-day (n=36) | 8.60% | 1.80% |
Tabela 2: Reprodutibilidade de réplicas técnicas do CESI-MS para peptídeos e metabólitos caônicos. RSD: desvio padrão relativo, como medida de reprodutibilidade. A reprodutibilidade do CESI-MS em termos de picos e tempos de migração é muito boa, com todos os analitos tendo um RSD médio <15% e os tempos de migração < 2,2%. Esses resultados demonstram o alto grau de confiança que pode ser atribuído aos dados coletados por essa técnica e confirmam que as variações detectadas se devem a diferenças genuínas na composição da amostra (enriquecimento em NMs) em vez de variações analíticas. A Tabela 2 é gerada a partir de resultados apresentados anteriormente11,15.
Discussão
Este é o primeiro método proposto para caracterizar a coroa biomolecular completa incorporando proteínas e metabólitos, a partir da mesma amostra, utilizando CESI-MS. A capacidade de caracterizar tanto as proteínas quanto os metabólitos da mesma amostra aumentará significativamente a quantidade de dados coletados de uma única exposição experimental, permitindo novas percepções sobre o processo de formação de corona e seus impactos para as NMs toxicidade e eficácia como nanomedicinas. Além disso, o CESI-MS é uma plataforma ideal para caracterizar ambas as classes de biomoléculas com apenas uma mudança de capilar necessária. Seguindo em frente, novos métodos desenvolvidos para CE não aquoso permitirão que a lipidômica seja realizada usando o CE-MS40, portanto, agora é possível analisar proteínas, metabólitos e lipídios usando uma única plataforma. As abordagens convencionais atuais exigiriam duas plataformas dedicadas de LC-MS, uma para a corona de proteína e outra para a corona metabólito. Assim, essa abordagem pode coletar o dobro de dados usando uma única plataforma analítica.
Há algumas ressalvas a esta abordagem particularmente com a coroa metabólica, pois este protocolo propõe uma medição indireta da coroa. Como tal, o problema pode surgir quando os níveis de metabólito estão presentes em altas concentrações em relação aos NMs e a subsequente queda na concentração de metabólitos na matriz é pequena. No entanto, ao contrário da corona proteica, é improvável que uma abordagem "de um tamanho se encaixe em todos" para isolar a coroa metabólito será desenvolvida devido a cada NM ter químicas superficiais únicas. Daqui para frente, é mais provável que abordagens específicas de NM para isolar a coroa metabólica sejam desenvolvidas e validadas no entanto; isso será aplicável apenas a essa NM específica. Apesar disso, o CESI-MS ainda será uma plataforma altamente adequada para a caracterização dos metabólitos carregados polares, independentemente de como eles estão isolados. Também é notável que se uma pelota não se formar durante as etapas de centrifugação projetadas para pelotar os NMs, uma força centrífuga mais alta pode ser necessária; isso é mais provável de ocorrer com NMs menos densas. Também é fundamental que todas as etapas de filtragem sejam cumpridas dentro do protocolo devido ao furo estreito dos capilares que estes podem facilmente ser bloqueados se qualquer material particulado não tiver sido adequadamente eliminado da amostra.
Embora a proteína corona tenha sido uma área intensa de pesquisa por vários anos, a capacidade de combinar isso com a coroa metabólito é um novo campo de interesse para os cientistas que investigam a interface bio-nano6,14. Até o momento, a maioria desses estudos se concentrou na fração lipídica não polar da corona metabólito9,28. Este método atual permite a caracterização dos metabólitos altamente polares e carregados na coroa, que inclui metabólitos importantes envolvidos no metabolismo energético, glicolise e síntese de DNA. Como resultado, quando combinado com o fluxo de trabalho proteômico, é possível uma caracterização mais holística da coroa biomolecular. Isso permite uma análise mais aprofundada das interações bio-nano avançando. Este método permite insights mecanicistas aprimorados sobre a endocitose mediada por receptores através de interações proteicas e metabólicas com receptores de membrana. Além disso, podem ser exploradas interações inter e intra corona entre proteínas e pequenas moléculas; por exemplo, foi recentemente demonstrado que as proteínas na coroa desempenham um papel fundamental no recrutamento de metabólitos15. Vale ressaltar que os resultados representativos na Figura 3 e Figura 4 são quantificação absoluta de metabólitos, no entanto, uma abordagem não alvo usando análise de dados multivariados para comparar todas as características ce-ms em controles em comparação com plasma exposto também elucidaria a ligação metabolita. Assim, há um escopo significativo para investigar como, e quais, metabólitos e proteínas influenciam seu respectivo recrutamento em coroas NM. Esses estudos adicionais podem ajudar a projetar coronas para otimizar a entrega de nanomedicinas ou descobrir mais obstáculos ao seu desenvolvimento, como a supressão da ação farmacêutica devido ao bloqueio biomolecular da coroa ou mascarando funcionalidades de alvo.
O CESI-MS com suas taxas de fluxo em escala nano de cerca de 20 nL/min e uso mínimo de solventes orgânicos oferece uma melhoria nas credenciais verdes e econômicas em relação ao padrão LC-MS e nanoLC-MS em termos de uso de solventes, os principais desafios para estudos de metabolômica e proteômica, respectivamente. O CESI-MS oferece resultados altamente reprodutíveis tanto para o tempo de migração quanto para a área de pico, que se comparam favoravelmente com os métodos baseados em LC-MS11,15. Além disso, em comparação com o nanoLC-MS, o carry-over não é um problema no CESI-MS. Portanto, não é necessária uma limpeza extensiva do sistema entre as análises amostrais, o que melhora muito o rendimento da amostra11.
Em resumo, o fluxo de trabalho proposto é o primeiro a detalhar uma abordagem para caracterizar tanto os componentes proteicos quanto metabólicos da coroa biomolecular completa de NMs. Isso desbloqueia um novo aspecto das interações bio-nano, a corona metabolita, permitindo assim a coleta de duas vezes mais dados da mesma amostra, permitindo uma compreensão mais completa das interações na interface bio-nano.
Divulgações
J.A.T é um funcionário da AB Sciex UK Ltd que está participando como um parceiro do setor no projeto ACEnano, J.A.T e todos os outros autores não têm conflito de interesse neste trabalho.
Agradecimentos
A.J.C, J.A.T e I.L reconhecem o financiamento da Comissão Europeia via Horizon 2020 projeto ACEnano (Grant no. H2020-NMBP-2016-720952). W.Z reconhece o financiamento de doutorado do Conselho de Bolsas da China (CSC, No. 201507060011). R.R reconhece o apoio financeiro do regime de subvenção vidi da Organização Holandesa de Pesquisa Científica (NWO Vidi 723.0160330).
Materiais
| Name | Company | Catalog Number | Comments |
| 1,4-Dithiothreitol | Sigma | 10197777001 | |
| 2,2,4,4-D4-citric | Simga | 485438-1G | Internal standard anion |
| Ammonium Acetate >98% | Sigma | A1542 | |
| Ammonium Bicarbonate >99.5% | Sigma | 09830 | |
| Capillary cartridge coolant | Sciex | 359976 | |
| CESI 8000 instrument | Sciex | A98089 | |
| CESI Cap | Sciex | B24699 | |
| CESI Vials | Sciex | B11648 | |
| Chloroform | Sigma | 650498 | Toxic, use in a fume hood |
| Glacial Acetic acid | Sigma | A6283 | |
| Hydrochloric acid 1mol/L | Sigma | 43617 | |
| Iosoacetamide | Sigma | I1149 | |
| L-methionine sulfone | Sigma | M0876-1G | Internal standard cation |
| Methonal (LC-MS Ultra Chromasolve) | Sigma | 14262 | Use in a fume hood |
| Microvials | Sciex | 144709 | |
| nanoVials | Sciex | 5043467 | |
| Neutral Surface Cartridge 30 µM ID x 90 cm total length | Sciex | B07368 | |
| OptiMS Adapter for Sciex Nanospray III source | Sciex | B07363 | B07366 and B83386 for Thermo mass spectrometers, B85397 for Waters mass spectrometers, B86099 for Bruker mass spectrometers |
| OptiMS Fused-Silica Cartridge 30 µm ID x 90 cm total length | Sciex | B07367 | |
| Phospahte buffered saline 10x | Sigma | P7059 | |
| Pierce C18 Tips, 100 µL bed | Thermo Fisher Scientific | 87784 | |
| Polystyrene 100 nm | Polysciences Inc | 876 | |
| Polystyrene carboxylated 100 nm | Polysciences Inc | 16688 | |
| Polystyrene carboxylated 1000 nm | Polysciences Inc | 08226 | |
| Rapigest SF (surfactant) | Waters | 186001860 | |
| Sequencing Grade modified Trypsin | Promega | V5111 | |
| SiO2 Ludox TM-40 | Sigma | 420786 | |
| Sodium Hydroxide solution | Simga | 72079 | |
| TiO2 Dispex coated | Promethion particles | Bespoke particles | |
| TiO2 PVP coated | Promethion particles | Bespoke particles | |
| TiO2 uncoated | Promethion particles | Bespoke particles |
Referências
- Ke, P. C., Lin, S., Parak, W. J., Davis, T. P., Caruso, F. A Decade of the Protein Corona. ACS Nano. 11 (12), 11773-11776 (2017).
- Sasidharan, A., Riviere, J. E., Monteiro-Riviere, N. A. Gold and silver nanoparticle interactions with human proteins: impact and implications in biocorona formation. Journal of Materials Chemistry B. 3 (10), 2075-2082 (2015).
- Albanese, A., et al. Secreted biomolecules alter the biological identity and cellular interactions of nanoparticles. ACS Nano. 8 (6), 5515-5526 (2014).
- Lynch, I., Dawson, K. A. Protein-nanoparticle interactions. Nano Today. 3 (1-2), 40-47 (2008).
- Tenzer, S., et al. Rapid formation of plasma protein corona critically affects nanoparticle pathophysiology. Nature Nanotechnology. 8 (10), 772-781 (2013).
- Chetwynd, A. J., Lynch, I. The rise of the nanomaterial metabolite corona, and emergence of the complete corona. Environmental Science: Nano. 7 (4), 1041-1060 (2020).
- Lee, J. Y., et al. Analysis of lipid adsorption on nanoparticles by nanoflow liquid chromatography-tandem mass spectrometry. Analytical and Bioanalytical Chemistry. , 1-10 (2018).
- Pink, M., Verma, N., Kersch, C., Schmitz-Spanke, S. Identification and characterization of small organic compounds within the corona formed around engineered nanoparticles. Environmental Science: Nano. 5 (6), 1420-1427 (2018).
- Chetwynd, A. J., Wheeler, K. E., Lynch, I. Best practice in reporting corona studies: Minimum information about Nanomaterial Biocorona Experiments (MINBE). Nano Today. 28, 100758 (2019).
- Zhang, H., et al. Quantitative proteomics analysis of adsorbed plasma proteins classifies nanoparticles with different surface properties and size. Proteomics. 11 (23), 4569-4577 (2011).
- Faserl, K., Chetwynd, A. J., Lynch, I., Thorn, J. A., Lindner, H. H. Corona isolation method matters: Capillary electrophoresis mass spectrometry based comparison of protein corona compositions following on-particle versus in-solution or in-gel digestion. Nanomaterials. 9 (6), 898 (2019).
- Nasser, F., Lynch, I. Secreted protein eco-corona mediates uptake and impacts of polystyrene nanoparticles on Daphnia magna. Journal of Proteomics. 137, 45-51 (2016).
- Hellstrand, E., et al. Complete high-density lipoproteins in nanoparticle corona. FEBS Journal. 276 (12), 3372-3381 (2009).
- Grintzalis, K., Lawson, T. N., Nasser, F., Lynch, I., Viant, M. R. Metabolomic method to detect a metabolite corona on amino functionalised polystyrene nanoparticles. Nanotoxicology. , 1-12 (2019).
- Chetwynd, A. J., Zhang, W., Thorn, J. A., Lynch, I., Ramautar, R. The nanomaterial metabolite corona determined using a quantitative metabolomics approach: A pilot study. Small. , (2020).
- Chetwynd, A. J., Guggenheim, E. J., Briffa, S. M., Thorn, J. A., Lynch, I., Valsami-Jones, E. Current application of capillary electrophoresis in nanomaterial characterisation and its potential to characterise the protein and small molecule corona. Nanomaterials. 8 (2), 99 (2018).
- Zhang, W., et al. Assessing the suitability of capillary electrophoresis-mass spectrometry for biomarker discovery in plasma-based metabolomics. Electrophoresis. , 00126 (2019).
- Ramautar, R., Somsen, G. W., de Jong, G. J. CE-MS for metabolomics: Developments and applications in the period 2016-2018. Electrophoresis. 40 (1), 165-179 (2019).
- Sarg, B., Faserl, K., Lindner, H. H. Identification of novel site-specific alterations in the modification level of myelin basic protein isolated from mouse brain at different ages using capillary electrophoresis-mass spectrometry. Proteomics. 17 (19), 1700269 (2017).
- Faserl, K., Sarg, B., Maurer, V., Lindner, H. H. Exploiting charge differences for the analysis of challenging post-translational modifications by capillary electrophoresis-mass spectrometry. Journal of Chromatography A. 1498, 215-223 (2017).
- Zhang, Z., Qu, Y., Dovichi, N. J. Capillary zone electrophoresis-mass spectrometry for bottom-up proteomics. TrAC - Trends in Analytical Chemistry. 108, 23-37 (2018).
- Shen, X., et al. Capillary zone electrophoresis-mass spectrometry for top-down proteomics. TrAC - Trends in Analytical Chemistry. 120, 115644 (2019).
- Ramautar, R., Busnel, J. M., Deelder, A. M., Mayboroda, O. A. Enhancing the coverage of the urinary metabolome by sheathless capillary electrophoresis-mass spectrometry. Analytical Chemistry. 84 (2), 885-892 (2012).
- Faserl, K., Kremser, L., Müller, M., Teis, D., Lindner, H. H. Quantitative proteomics using ultralow flow capillary electrophoresis-mass spectrometry. Analytical Chemistry. 87 (9), 4633-4640 (2015).
- Faserl, K., Sarg, B., Kremser, L., Lindner, H. Optimization and evaluation of a sheathless capillary electrophoresis-electrospray ionization mass spectrometry platform for peptide analysis: comparison to liquid chromatography-electrospray ionization mass spectrometry. Analytical Chemistry. 83 (19), 7297-7305 (2011).
- Segers, K., et al. CE-MS metabolic profiling of volume-restricted plasma samples from an acute mouse model for epileptic seizures to discover potentially involved metabolomic features. Talanta. 217, 121107 (2020).
- Chetwynd, A. J., David, A. A review of nanoscale LC-ESI for metabolomics and its potential to enhance the metabolome coverage. Talanta. 182, 380-390 (2018).
- Drouin, N., et al. Capillary electrophoresis-Mass spectrometry at trial by metabo-ring: Effective electrophoretic mobility for reproducible and robust compound annotation. Analytical Chemistry. 92 (20), 14103-14112 (2020).
- Faria, M., et al. Minimum information reporting in bio-nano experimental literature. Nature Nanotechnology. 13 (9), 777-785 (2018).
- Leong, H. S., et al. On the issue of transparency and reproducibility in nanomedicine. Nature Nanotechnology. 14 (7), 629-635 (2019).
- Kaur, I., et al. Dispersion of nanomaterials in aqueous media: Towards protocol optimization. Journal of Visualized Experiments. (130), e56074 (2017).
- Bihari, P., et al. Optimized dispersion of nanoparticles for biological in vitro and in vivo studies. Particle and Fibre Toxicology. 5 (1), 1-14 (2008).
- Taurozzi, J. S., Hackley, V. A., Wiesner, M. R. Ultrasonic dispersion of nanoparticles for environmental, health and safety assessment - and recommendations. Nanotoxicology. 5 (4), 711-729 (2011).
- Lu, P. J., et al. Methodology for sample preparation and size measurement of commercial ZnO nanoparticles. Journal of Food and Drug Analysis. 26 (2), 628-636 (2018).
- Langevin, D., et al. Inter-laboratory comparison of nanoparticle size measurements using dynamic light scattering and differential centrifugal sedimentation. NanoImpact. 10, 97-107 (2018).
- Lee, S., Bi, X., Reed, R. B., Ranville, J. F., Herckes, P., Westerhoff, P. Nanoparticle size detection limits by single particle ICP-MS for 40 elements. Environmental Science and Technology. 48 (17), 10291-10300 (2014).
- Hole, P., et al. Interlaboratory comparison of size measurements on nanoparticles using nanoparticle tracking analysis (NTA). Journal of Nanoparticle Research. 15 (12), 2101 (2013).
- Zhang, W., Gulersonmez, M. C., Hankemeier, T., Ramautar, R. Sheathless capillary electrophoresis-mass spectrometry for metabolic profiling of biological samples. Journal of Visualized Experiments. , e54535 (2016).
- Faserl, K., Sarg, B., Lindner, H. H. Application of CE-MS for the analysis of histones and histone modifications. Methods. , (2020).
- Azab, S., Ly, R., Britz-Mckibbin, P. Robust method for high-throughput screening of fatty acids by multisegment injection-nonaqueous capillary electrophoresis-mass spectrometry with Sstringent quality control. Analytical Chemistry. 91 (3), 2329-2336 (2019).
- Zhang, X., Pandiakumar, A. K., Hamers, R. J., Murphy, C. J. Quantification of lipid corona formation on colloidal nanoparticles from lipid vesicles. Analytical Chemistry. 19 (24), 14387-14394 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados