Method Article
Подходы масс-спектрометрии капиллярного электрофореза для характеристики белковой и метаболитовой короны, приобретенной наноматериалами
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь представлен протокол для характеристики полной биомолекулярной короны, белков и метаболитов, приобретенных наноматериалами из биожидких с использованием подхода капиллярного электрофореза – масс-спектрометрии.
Аннотация
Адсорбция биомолекул из окружающих биологических матриц на поверхность наноматериалов (НМ) для формирования короны представляет интерес в течение последнего десятилетия. Интерес к био-наноинтерфейсу возникает из-за того, что биомолекулярная корона придает биологическую идентичность НМ и, таким образом, заставляет организм идентифицировать их как «себя». Например, предыдущие исследования продемонстрировали, что белки в короне способны взаимодействовать с мембранными рецепторами, чтобы влиять на поглощение клеток, и установили, что корона ответственна за клеточный оборот НМ и их возможную токсичность. На сегодняшний день большинство исследований были сосредоточены на белковой короне и упускали из виду возможное воздействие метаболитов, включенных в корону, или синергетические эффекты между компонентами в полной биомолекулярной короне. Таким образом, эта работа демонстрирует методологии для характеристики как белковых, так и метаболитных компонентов биомолекулярной короны с использованием параллельно восходящей протеомики и метаболомики. Это включает в себя переваривание белковой короны на частицах с поверхностно-активным веществом, используемым для увеличения восстановления белка, и пассивную характеристику короны метаболита путем анализа матриц метаболитов до и после воздействия НМ. Эта работа вводит капиллярный электрофорез – масс-спектрометрию (CESI-MS) как новую технику для характеристики короны NM. Протоколы, описанные здесь, демонстрируют, как CESI-MS может быть использован для надежной характеристики как белка, так и метаболитовой короны, приобретенной НМ. Переход на CESI-MS значительно уменьшает объем требуемого образца (по сравнению с традиционными подходами жидкостной хроматографии - масс-спектрометрии (LC-MS)) с возможностью многократных инъекций всего из 5 мкл образца, что делает его идеальным для образцов с ограниченным объемом. Кроме того, экологические последствия анализа снижаются в отношении LC-MS из-за низких скоростей потока (<20 нл/мин) в CESI-MS и использования водных электролитов, что устраняет необходимость в органических растворителях.
Введение
Био-нано взаимодействия, на границе раздела между поверхностями наноматериала (НМ) и биологическими матрицами, из которых биомолекулы адсорбируются к НМ, являются интенсивной областью исследований, лежащей в основе нанобезопасности и наномедицины1. Этот слой адсорбированных биомолекул придает биологическую идентичность НМ, таким образом, клетки идентифицируют их как «себя», впоследствии влияя на клеточное поглощение, распределение и биологические конечныеточки 2,3,4. Подавляющее большинство био-нано исследований были сосредоточены на белках в короне и продемонстрировали, что белки количественно и качественно различаются между НМ разного состава5. Это изменение зависит как от свойств НМ, таких как размер, функционализация и материал, в дополнение к свойствам биологической матрицы, включая состав и содержание соли5. Растущей областью интереса к био-наноинтерфейсу являются метаболиты, которые адсорбируются к НМ6. Несколько исследований показали, что, как и в отношении белков, свойства NM являются ключевым фактором в определении состава метаболитов в короне и что они могут влиять на биологические результаты воздействия NM6,7,8.
В исследованиях биомолекулярной короны выделяют четыре различные фазы ее характеристики: коронообразование, выделение биомолекул внутри короны, их обнаружение с помощью качественной или количественной масс-спектрометрии и идентификация9. На сегодняшний день был принят ряд методов для выделения белковой короны, включая кипячение в буфере SDS-PAGE, экстракцию растворителем и солью или прямое сбраживание белков in situ на поверхности НМ. С точки зрения метаболитов в короне, выделение является более сложным с различными методами с использованием растворителей или даже растворением НМ, предложенных в видерастворов 8,10,11. Однако, в отличие от белковой короны, подход «один размер подходит всем» вряд ли применим к выделению метаболитов из НМ из-за широкого химического пространства, занимаемого метаболомом, и разнообразия возможных НМ. Альтернативный подход заключается в характеристике биологической матрицы до и после воздействия НМ с разницей в концентрациях метаболитов, приписываемой адсорбции метаболитов к НМ.12
Этот альтернативный подход был бы применим ко всем биожидям и НМ, и, хотя он требует в два раза больше анализа, он, следовательно, предлагает гораздо более точную меру короны метаболита и не имеет риска низкого извлечения метаболитов с поверхности НМ, ошибочно принимаемого за низкое связывание конкретного метаболита.
Вторым шагом к анализу биомолекулярной короны является обнаружение биомолекул. Традиционно для белков в короне это было компетенцией нано-LC-MS, рабочей лошадки протеомики; также применялись другие подходы, такие как NMR13,1D и 2D SDS-PAGE. В терминах метаболита короны LC-MS7,GC-MS8 и прямой инфузионной масс-спектрометрии были использованы14. Тем не менее, новый подход в последнее время начал набирать обороты, а именно капиллярный электрофорез-масс-спектрометрия (CE-MS)11,15 и присутствовал в лабораториях NM в качестве автономного метода для характеристики различных физических и химических свойств НМ16. CE-MS является методом ортогонального разделения наноLC-MS и GC-MS и способен позволять обнаруживать высокополярные и заряженные метаболиты17,18. Кроме того, CE-MS хорошо подходит для анализа белков и их посттрансляционных модификаций, таких как фосфорилирование и гликозилирование19,20,21,22. Заключительный этап, идентификация и анализ данных, могут быть выполнены несколькими способами в зависимости от того, используется ли количественный / качественный или целевой / нецелевой подход, что, однако, выходит за рамки компетенции этого протокола.
CESI-MS, комбинация CE и интерфейса nanoESI, является недавним достижением в технологии CE с использованием интерфейса без оболочки. Это позволяет напрямую подключать сверхнизкий расход CE (<20 нл/мин) к масс-спектрометру высокого разрешения без разбавления, что приводит к значительному улучшению чувствительности обнаружения23,24,25. CESI-MS позволяет анализировать образцы с ограниченным объемом (< 10 мкл) при сохранении высокочувствительного анализа26. CESI-MS также выгодно отличается от традиционных подходов nanoLC-MS с низкой скоростью потока, используемых в протеомике и метаболомике с точки зрения воспроизводимости27,28,пропускной способности и переноса, что делает его захватывающей перспективой для полной характеристики биомолекулярной короны.
Чтобы подчеркнуть потенциал CESI-MS для анализа био-нано взаимодействий, в этой работе описывается пробоподготовка, необходимая для выделения биомолекулярной короны NM из одного образца плазмы человека таким образом, чтобы максимизировать данные как белкового, так и метаболитового аспектов полной биомолекулярной КОРОНЫ NM. Хотя мы сообщаем об использовании плазмы человека, этот протокол будет в равной степени подходит для других биожидкости, таких как сыворотка крови, полная клеточная культуральная среда, клеточный лизат, спинномозговая жидкость или моча. Анализ этих двух компонентов (белков и метаболитов) затем будет описан с использованием капилляров CESI с нейтральным покрытием для белковой короны и голых плавленых капилляров кремнезема для катионных и анионных метаболитов.
протокол
Использование биожидкости человека было одобрено в соответствии с руководящими принципами протокола IRB от Лейденского университета и Медицинского университета Инсбрука. Когда исследуются биожидкие животные или животные, требуется этическое одобрение от научно-исследовательского учреждения, которое было получено в случае результатов, показанных в этом протоколе. Кроме того, следует также представлять надлежащую отчетность для обеспечения прозрачности и возможности повторного использования данных в будущей работе9,29,30.
1. Получение фоновых электролитов (БГЭ)
ПРИМЕЧАНИЕ: Все растворители должны быть приготовлены в подходящем вытяжном вытяжке, и для всех этапов должны использоваться соответствующие средства индивидуальной защиты (лабрадор, перчатки и очки). На каждом этапе требуются пластиковые флаконы с низким связыванием, чтобы свести к минимуму потерю анализируемого вещества и загрязнение образца солями, выщелачиваемыми из стеклянной посуды.
- Готовят 10% уксусной кислоты BGE (v/v), pH 2,2 на ежедневной основе для метаболомики.
- В объемную колбу объемом 10 мл добавляют 1 мл уксусной кислоты с последующим добавлением деионизированной (DI) воды к маркированной линии и тщательным перемешиванием.
- Готовят 100 мМ уксусной кислоты, рН 2,9 на ежедневной основе для протеомики.
- В объемную колбу объемом 10 мл добавляют 57 мкл уксусной кислоты с последующим добавлением воды DI к отмеченной линии и тщательным перемешиванием.
2. Подготовка НМ
- Энергично рассеивайте НМ в воде, используя опубликованные руководящие принципы31,32,33.
ПРИМЕЧАНИЕ: При разработке этого протокола 7 НМ использовались следующим образом: 100 и 1000 нм карбоксилированный полистирол использовались для белка и метаболита короны соответственно. 100 нм немодифицированный полистирол НМ НМ, 13 нм анатаза TiO2 НМ, которые были немодифицированы или покрыты полиакрилатными или PVP полимерами, и 22 нм немодифицированные SiO2 НМ использовались как для белковых, так и метаболитных корон. Хотя метод был разработан и продемонстрирован с использованием этих НМ, следует отметить, что этот подход будет применим к широкому спектру НМ композиций, размеров, форм и морфологий НМ. - Охарактеризовать размер частиц с помощью динамического рассеяния света34,35,масс-спектрометрии плазменной с индуктивной связью с одной частицей36,анализа отслеживания наночастиц37или просвечивающей электронной микроскопии и поверхностного заряда в качестве дзета-потенциала с использованием дзета-сизера34.
3. Биомолекулярное коронообразование
- Разделение 2 мл плазмы человека (или биожидкости выбора) на 1 мл аликвоты, одна для метаболита и белковой короны, а вторая для характеристики метаболома плазмы.
- Инкубировать 1 мг/мл НМ в плазме человека в течение 1 ч при 37 °C, осторожно перемешивая при 500 об/мин в термомиксе. После инкубации центрифугируют образец при 4000 х г в течение 15 мин при 4 °C для гранулирования НМ.
- Соберите супернатант плазмы для анализа короны метаболита. Сохранить коронный комплекс NM-белка для характеристики белковой короны.
4. Выделение белковой короны
- Повторно суспендируют NM-белковый комплекс (гранулу) в 1 мл 10x PBS Buffer и энергично вихряют в течение 2 мин для удаления несвязанные белки. Центрифугировать раствор PBS при 4000 х г в течение 15 мин при 4 °C до гранул НМ и осторожно удалить супернатант, не нарушая гранулу.
- Повторно суспендируют гранулу в 1 мл буфера бикарбоната аммония (ABC) (100 мМ, рН 8,0) и энергично вихрь в течение 2 мин для удаления несвязанные белки и нежелательные соли. Центрифуга при 4 000 х г в течение 15 мин при 4 °C для гранулирования НМ; удалить и выбросить супернатант. Повторите этот шаг.
- Уменьшают белковые дисульфидные связи путем растворения гранул NM-белка в 20 мкл буфера ABC (100 мМ рН 8), содержащего 10 мМ дитиотеритол. Инкубировать восстановительный раствор в течение 30 мин при 56 °C.
- Для переваривания белков добавляют 2 мкг секвенирования трипсина к 20 мкл ABC, содержащего 0,1% поверхностно-активного вещества. Инкубировать раствор для переваривания в течение 16 ч при 37 °C.
- Алкилат образца путем добавления 20 мкл йодоацетамида при 55 мМ в 100 мМ АВС и инкубируют при комнатной температуре в течение 20 мин.
- Добавьте 20 мкл 0,1 М HCl для расщепления поверхностно-активного вещество и оставьте на 10 мин при комнатной температуре.
- Обогащайте и обессоливайте пептиды с помощью упакованного в упаковку C18 наконечника опреснителяющей пипетки.
- Смочите наконечник 80 мкл 0,1% муравьиной кислоты 50% ацетонитрила 5 раз, очистите 80 мкл 0,1% муравьиной кислоты 5 раз, вытяните и пролейте образец 10 раз, обессоливание образца промывкой 80 мкл 0,1 % муравьиной кислоты 5 раз и элюлирование образца 2 раза 80 мкл 0,1% муравьиной кислоты 70% ацетонитрила в чистую низкосвязывающую ПЦР-трубку.
- Лиофилизируйте образцы и храните при -20 °C до анализа.
5. Выделение метаболита короны
- Возьмите контрольную плазму и супернатант из инкубации плазмы NM с шага 3.3 и держите на льду во время пробоподготовки.
- Возьмите по 50 мкл с каждого в отдельные флаконы и разбавьте 1 из 10 водой DI. Возьмите 50 мкл каждого разбавленного образца и переместите в новые флаконы для шага 5.3.
- Добавьте 200 мкл хлороформа, 250 мкл метанола и 350 мкл DI воды и энергично вихревой смеси в течение 2 мин. Центрифуга в течение 10 мин при 20 800 х г при 4 °C.
- Возьмите 500 мкл супернатанта и процедилите через центробежный фильтр 3 кДа в течение 2 ч при 10 000 х г при 4 °C. Возьмите 430 мкл ультрафильтрата и высушите в вакууме со скоростью. Образцы теперь могут быть заморожены перед анализом.
6. Подготовка системы CESI-MS38
ПРИМЕЧАНИЕ: Перед установкой капилляров убедитесь, что входной и выходной конц капилляров неповреждены и что в капилляре нет видимых поломок.
- Установка капилляра с нейтральным покрытием для анализа белковой короны39.
- Поместите новый капилляр с нейтральным покрытием (длиной 90 см и внутренним диаметром 30 мкм) в прибор CESI в соответствии с рекомендациями производителя.
- Подготовка капилляров CESI к протеомическому анализу.
- Промывайте капилляр отделения в прямом направлении, используя 100 мМ HCl в течение 5 мин при 100 фунтов на кв. дюйм, и проверьте образование капель на выходе из капилляра. Промывка капилляра разделения С BGE при 100 psi в течение 10 мин, а затем DI вода при 100 psi в течение 30 мин (это требуется только для новых капилляров).
- Промывайте капилляр разделения и проводящий капилляр BGE при 90 psi в течение 5 минут и убедитесь, что капли образуются на выходном конце обоих капилляров.
- Промыть капилляр отделения водой DI при 90 psi в течение 10 мин, затем 50 psi в течение 10 мин с 0,1 M HCl, затем снова 90 psi в течение 10 мин с водой DI и, наконец, BGE при 90 psi в течение 10 мин. Соедините CESI с MS с помощью источника нанораскрытия и адаптера, как описаноранее 38.
- Установка голого плавленого капилляра кремнезема для характеристики метаболита короны38.
- Поместите новый голый плавленый капилляр кремнезема (длиной 90 см и внутренним диаметром 30 мкм) в прибор CESI в соответствии с рекомендациями производителя.
- Подготовка капилляров CESI для метаболомического анализа.
- Промывайте капилляр отделения в прямом направлении, используя 100% MeOH при 50 psi в течение 15 мин и проверьте образование капель на выходе из капилляра. Промывайте как капилляр разделения, так и проводящий капилляр BGE при 90 psi в течение 5 мин и обеспечьте образование капель на выходе из обоих капилляров.
- Промыть капилляр отделения водой DI при 90 фунтов на кв. дюйм в течение 10 мин, затем 50 фунтов на кв. дюйм в течение 10 мин с 0,1 М NaOH, затем снова 90 фунтов на кв. дюйм в течение 10 мин с водой DI и, наконец, BGE при 90 фунтов на кв. дюйм в течение 10 минут. Соедините CESI с ESI-MS с помощью источника нанораспролив и адаптера, как описано ранее. 38 38
7. CE-MS для анализа белковой короны
- Повторное суспендировать образцы со ступени 4,8 в 20 мкл 50 мМ ацетата аммония рН 4,0.
- Выполните 5 psi 10 с гидродинамической инъекции образца. Отделяют с помощью напряжения разделения 30 кВ со следующим градиентом давления: 0-10 мин при 1 psi, 10-35 мин при 1,5 psi и 35-45 мин при 5 psi с использованием 100 мМ, рН 2,9 уксусной кислоты в виде BGE.
- Собирайте масс-спектры в зависимости от 250-2000 м/з с помощью 10 данных, зависящих от фрагментации.
- Между образцами промывайте капилляр 0,1 M HCl в течение 3 мин при 100 psi и 10 мин 100 psi BGE для разделения капилляра и в течение 3 мин при 100 psi для проводящего жидкого капилляра.
8. CESI-MS для анализа короны метаболита
ПРИМЕЧАНИЕ: Все образцы должны быть проанализированы дважды, один раз в положительном режиме для обнаружения катионов и один раз в отрицательном режиме для обнаружения арионов. Контрольные образцы плазмы должны быть проанализированы не менее 5 раз.
- Повторно суспендирует НМ облученные и неэкспонированные образцы плазмы со ступени 5,4 в 430 мкл воды DI и энергично вихрь в течение 2 мин. Фильтр через мембранный фильтр 0,1 мкм.
- Возьмите 95 мкл фильтрата и добавьте 5 мкл внутренних эталонов при 200 мкМ для катионов (L-метионинсульфон) и 400 мкМ для ангонов (2,2,4,4-D4-лимонная кислота) и энергично вихрь. Центрифуга при 4 000 х г при 4 °C в течение 10 мин до анализа CESI-MS.
- Впрыскивайте образец гидродинамически в течение 30 с (катионов) и 40 с (ангонов) при 2 psi.
- Разделяют метаболиты в 10% уксусной кислоты с напряжением разделения 30 кВ в прямом (катионы) и обратном (анионы) режиме. Режим обратного разделения необходим при прямом давлении 0,5 psi на капилляр разделения.
- Установка масс-спектрометра для сбора данных в положительном (катионы) или отрицательном (ания) режиме в диапазоне масс 65-1000 м/з. Между образцами промывайте капилляр 0,1 M HCl, 0,1 M NaOH, водой DI и BGE при 50 фунтов на кв. дюйм в течение 2 мин.
Результаты
Описанный способ является первым, который характеризует как белки, так и метаболиты в биомолекулярной короне NM с использованием одного и того же образца плазмы человека. Этот метод способен обнаруживать белки >200 и метаболиты >150, что позволяет определить наиболее полный обзор полной биомолекулярной короны, что позволяет лучше понять клеточное присоединение, поглощение и воздействие НМ.
Использование CESI-MS как для протеомики(Рисунок 1),так и для метаболомики(Рисунок 2)разделения и обнаружения показывает хорошие окна разделения на обоих капиллярах для каждого подхода.
Этот метод способен различать белки в короне в широком диапазоне НМ композиций, демонстрируя тем самым применимость способов к НМ в широком диапазоне физических и химических характеристик(таблица 1).
Уникальные отпечатки метаболита короны также можно различить с помощью метаболомной ветви этой методологии(рисунок 3). Хотя этот подход использует пассивный подход для характеристики короны метаболита NM, он все же способен раскрыть интересные идеи о роли метаболитов в биомолекулярной короне, такие как дифференциальная адсорбция изомеров(рисунок 4).
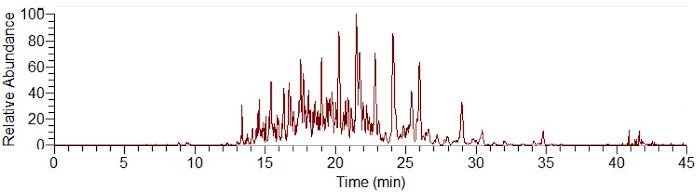
Рисунок 1: Примерная электроферограмма разделения короны белка SiO2 с использованием CESI-MS после дайджеста на частицах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
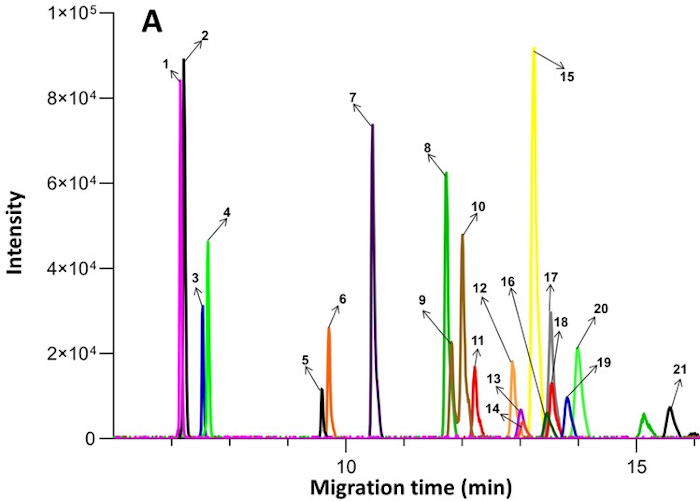
Рисунок 2: Пример экстрагированных ионных электроферограмм, полученных из эндогенных соединений в плазме методом CE-MS. Пронумерованные соединения следующие: 1. Орнитин; 2. Лизин; 3. Аргинин; 4. Гистидин; 5. Креатин; 6. Глицин; 7. Аланин; 8. Валин; 9. Изолейцин; 10. Лейцин; 11. Серин; 12. Треонин; 13. Аспарагин; 14. Метионин; 15. Глютамин; 16. Глутаминовая кислота; 17. Фенил-D5-аланин; 18. Фенилаланин; 19. Тирозин; 20. Пролин; 21. Метионинсульфон (внутренний стандарт). Опубликовано под лицензией Creative Commons CC BY в открытом доступе и воспроизведено из Zhang et al17. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Анализ белковой короны в массиве из 6 НМ. Тепловая карта классов белков, идентифицированных на кремнеземе (SiO2),титании (TiO2),PVP-капсированной титании (TiO2-PVP), диспексной крышке титана (TiO2-Dispex), полистироле и карбоксилированном полистироле НМ. Проценты относятся к обилию белков относительно общего содержания белка на основе обилия пептидов верхнего 3 для каждого белка. Учитывая различия, наблюдаемые в относительном изобилии белков в различных NM коронах, ясно, что этот предлагаемый протокол достаточно чувствителен, чтобы различать белковую корону различных НМ. Рисунок воспроизведен из анализа CESI-MS белковой короны, опубликованного под открытым доступом Creative Commons CC BY лицензией11. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
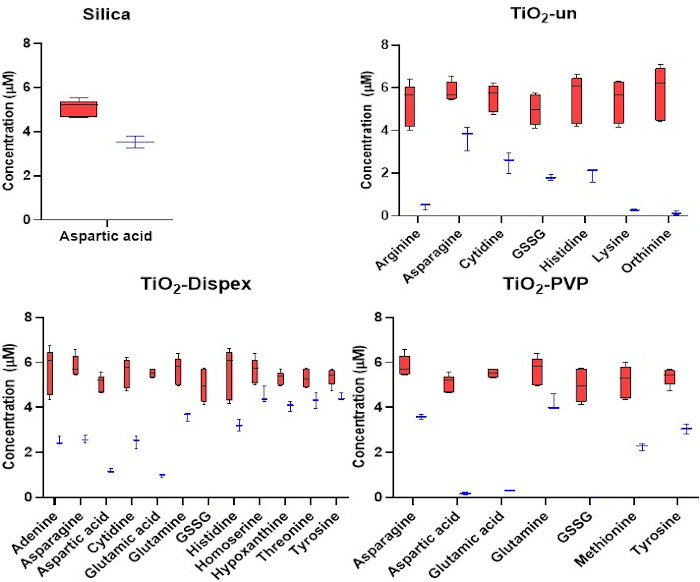
Рисунок 3: Целевой анализ катионных метаболитов в NM короне. Адсорбция катионов к SiO2 и TiO2 НМ. Красный относится к начальной концентрации метаболитов, тогда как синий относится к концентрации метаболитов после инкубации 1 ч с НМ при 37 °C. Снижение концентрации метаболита в растворе является результатом адсорбции метаболита к поверхности НМ. Для НМ полистирола не наблюдалось значимой адсорбции метаболитов. Квадратные графики представляют минимальные и максимальные значения, медианный и межквартильный диапазоны. Рисунок, воспроизведенный из целевого анализа CESI-MS метаболита короны, опубликованного под открытым доступом Creative Commons CC BY лицензии15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
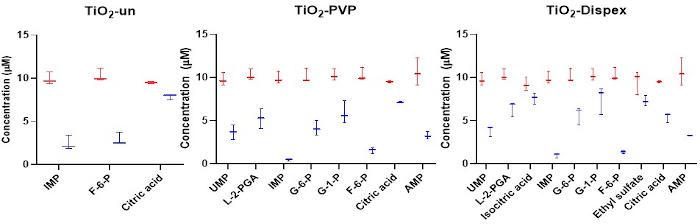
Рисунок 4: Целевой анализ анионных метаболитов в короне НМ с акцентом на адсорбцию изомеров. Адсорбция ангонов к ряду НМ титанов показывает четкие различия между различными изомерами, такими как сахарные фосфаты. Красный цвет относится к начальной концентрации метаболитов, тогда как синий относится к концентрации метаболитов после инкубации 1 ч с НМ при 37 °C. Снижение концентрации метаболита в растворе является результатом адсорбции метаболита к поверхности НМ. Для SiO2 и полистироловых НМ не наблюдалось значимой адсорбции метаболитов. Квадратные графики представляют минимальные и максимальные значения, медианный и межквартильный диапазоны. Рисунок, воспроизведенный из целевого анализа cesi-MS метаболита короны, опубликованного под лицензией Открытого доступа Creative Common CC BY15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Аналит | Средняя пиковая площадь RSD | Среднее время миграции RSD |
| 1928 пептидов внутри дня (n=3) | 15% | 0.30% |
| 27 катионов в течение дня (n=16) | 5.80% | 2.20% |
| 27 катион междневных (n=36) | 8.60% | 1.80% |
Таблица 2: Воспроизводимость технических реплик CESI-MS для пептидов и катионных метаболитов. RSD: относительное стандартное отклонение, как мера воспроизводимости. Воспроизводимость CESI-MS с точки зрения пиковых районов и времени миграции очень хорошая, при этом все анализируемые имеют средний RSD <15%, а время миграции <2,2%. Эти результаты демонстрируют высокую степень достоверности, которую можно отнести к данным, собранным с использованием этого метода, и подтверждают, что обнаруженные вариации обусловлены подлинными различиями в составе образца (обогащение на НМ), а не аналитическими вариациями. Таблица 2 получена на ранее представленныхрезультатах 11,15.
Обсуждение
Это первый способ, предложенный для характеристики полной биомолекулярной короны, включающей белки и метаболиты, из одного образца, с использованием CESI-MS. Способность характеризовать как белки, так и метаболиты из одного и того же образца значительно увеличит объем данных, собранных в результате одного экспериментального воздействия, что позволит по-новому познать процесс формирования короны и его влияние на токсичность и эффективность НМ в качестве нанолечащих средств. Кроме того, CESI-MS является идеальной платформой для характеристики обоих классов биомолекул с необходимым изменением капилляров. Двигаясь вперед, новые методы, разработанные для невозгодных CE, позволят выполнять липидомику с использованием CE-MS40, таким образом, теперь можно анализировать белки, метаболиты и липиды с использованием единой платформы. Нынешние традиционные подходы потребуют двух специализированных платформ LC-MS, одна для белковой короны и одна для метаболитовой короны. Таким образом, такой подход позволяет собирать в два раза больше данных с помощью единой аналитической платформы.
Есть некоторые предостережения к этому подходу, особенно с метаболитной короной, поскольку этот протокол предлагает косвенное измерение короны. Таким образом, проблема может возникнуть, когда уровни метаболитов присутствуют в высоких концентрациях по отношению к НМ и последующее падение концентрации метаболитов в матрице невелико. Однако, в отличие от белковой короны, маловероятно, что будет разработан подход «один размер подходит всем» к выделению метаболитовой короны из-за того, что каждый НМ имеет уникальную поверхностную химию. В дальнейшем более вероятно, что НМ-специфические подходы к выделению метаболитовой короны будут разработаны и проверены; это будет применимо только к этому конкретному НМ. Несмотря на это, CESI-MS по-прежнему будет очень подходящей платформой для характеристики полярных заряженных метаболитов независимо от того, как они выделены. Также следует отметить, что если гранула не образуется на этапах центрифугирования, предназначенных для гранулирования НМ, может потребоваться более высокая центробежная сила; это, скорее всего, произойдет с менее плотными НМ. Также крайне важно, чтобы все этапы фильтрации соблюдались в рамках протокола из-за узкого отверстия капилляров, которые могут легко блокироваться, если какие-либо твердые частицы не были адекватно удалены из образца.
В то время как белковая корона была интенсивной областью исследований в течение ряда лет, способность сочетать ее с метаболитной короной является новой областью интересов для ученых, изучающих био-наноинтерфейс6,14. На сегодняшний день большинство этих исследований сосредоточено на неполярной, липидной фракции метаболита короны9,28. Этот современный метод позволяет охарактеризовать высокополярные и заряженные метаболиты в короне, которые включают важные метаболиты, участвующие в энергетическом метаболизме, гликолизе и синтезе ДНК. В результате в сочетании с рабочим процессом протеомики возможна более целостная характеристика биомолекулярной короны. Это позволяет проводить более глубокий анализ био-нано взаимодействий в будущем. Этот метод позволяет улучшить механистическое понимание рецептор-опосредованного эндоцитоза через белковые и метаболитные взаимодействия с мембранными рецепторами. Кроме того, могут быть изучены меж- и внутрикоронакоронные взаимодействия между белками и малыми молекулами; например, недавно было показано, что белки в короне играют ключевую роль в рекрутации метаболитов15. Стоит отметить, что репрезентативные результаты на фиг.3 и Фиг.4 являются абсолютной количественной оценкой метаболитов, однако нецелевой подход с использованием многомерного анализа данных для сравнения всех признаков CE-MS в контрольной части по сравнению с облученной плазмой также прояснил бы связывание метаболитов. Таким образом, существует значительная область для изучения того, как и какие метаболиты и белки влияют на их соответствующую рекрут в КОРОНЫ НМ. Эти дополнительные исследования могут помочь разработать короны для оптимизации доставки нанолечебных препаратов или выявить дальнейшие препятствия на пути их развития, такие как подавление фармацевтического действия из-за функций блокировки или маскировки биомолекулярной короны.
CESI-MS с его наномасштабной скоростью потока около 20 нл / мин и минимальным использованием органических растворителей предлагает улучшение зеленых и экономических характеристик по сравнению со стандартными LC-MS и nanoLC-MS с точки зрения использования растворителей, основных проблем для метаболомических и протеомических исследований, соответственно. CESI-MS предлагает высоковоспроизводимые результаты как для времени миграции, так и для пиковой области, которые выгодно отличаются от методов11, 15наоснове LC-MS. Кроме того, по сравнению с nanoLC-MS, перенос не является проблемой в CESI-MS. Таким образом, не требуется обширная очистка системы между анализами образцов, что значительно повышает пропускную способность образца11.
Таким образом, предлагаемый рабочий процесс является первым, в ком подробно описывается подход к характеристике как белковых, так и метаболитных компонентов полной биомолекулярной короны НМ. Это открывает новый аспект био-нано взаимодействий, метаболитную корону, что позволяет сбор в два раза больше данных из одного образца, что позволяет более полно понять взаимодействия на био-наноинтерфейсе.
Раскрытие информации
J.A.T является сотрудником AB Sciex UK Ltd, которые участвуют в качестве отраслевого партнера в проекте ACEnano, J.A.T и все другие авторы не имеют конфликта интересов в этой работе.
Благодарности
A.J.C, J.A.T и I.L признают финансирование со стороны Европейской комиссии через проект Horizon 2020 ACEnano (Грант No. H2020-NMBP-2016-720952). W.Z признает финансирование PhD от Китайского стипендиального совета (CSC, No 201507060011). R.R признает финансовую поддержку схемы грантов Vidi Нидерландской организации научных исследований (NWO Vidi 723.0160330).
Материалы
| Name | Company | Catalog Number | Comments |
| 1,4-Dithiothreitol | Sigma | 10197777001 | |
| 2,2,4,4-D4-citric | Simga | 485438-1G | Internal standard anion |
| Ammonium Acetate >98% | Sigma | A1542 | |
| Ammonium Bicarbonate >99.5% | Sigma | 09830 | |
| Capillary cartridge coolant | Sciex | 359976 | |
| CESI 8000 instrument | Sciex | A98089 | |
| CESI Cap | Sciex | B24699 | |
| CESI Vials | Sciex | B11648 | |
| Chloroform | Sigma | 650498 | Toxic, use in a fume hood |
| Glacial Acetic acid | Sigma | A6283 | |
| Hydrochloric acid 1mol/L | Sigma | 43617 | |
| Iosoacetamide | Sigma | I1149 | |
| L-methionine sulfone | Sigma | M0876-1G | Internal standard cation |
| Methonal (LC-MS Ultra Chromasolve) | Sigma | 14262 | Use in a fume hood |
| Microvials | Sciex | 144709 | |
| nanoVials | Sciex | 5043467 | |
| Neutral Surface Cartridge 30 µM ID x 90 cm total length | Sciex | B07368 | |
| OptiMS Adapter for Sciex Nanospray III source | Sciex | B07363 | B07366 and B83386 for Thermo mass spectrometers, B85397 for Waters mass spectrometers, B86099 for Bruker mass spectrometers |
| OptiMS Fused-Silica Cartridge 30 µm ID x 90 cm total length | Sciex | B07367 | |
| Phospahte buffered saline 10x | Sigma | P7059 | |
| Pierce C18 Tips, 100 µL bed | Thermo Fisher Scientific | 87784 | |
| Polystyrene 100 nm | Polysciences Inc | 876 | |
| Polystyrene carboxylated 100 nm | Polysciences Inc | 16688 | |
| Polystyrene carboxylated 1000 nm | Polysciences Inc | 08226 | |
| Rapigest SF (surfactant) | Waters | 186001860 | |
| Sequencing Grade modified Trypsin | Promega | V5111 | |
| SiO2 Ludox TM-40 | Sigma | 420786 | |
| Sodium Hydroxide solution | Simga | 72079 | |
| TiO2 Dispex coated | Promethion particles | Bespoke particles | |
| TiO2 PVP coated | Promethion particles | Bespoke particles | |
| TiO2 uncoated | Promethion particles | Bespoke particles |
Ссылки
- Ke, P. C., Lin, S., Parak, W. J., Davis, T. P., Caruso, F. A Decade of the Protein Corona. ACS Nano. 11 (12), 11773-11776 (2017).
- Sasidharan, A., Riviere, J. E., Monteiro-Riviere, N. A. Gold and silver nanoparticle interactions with human proteins: impact and implications in biocorona formation. Journal of Materials Chemistry B. 3 (10), 2075-2082 (2015).
- Albanese, A., et al. Secreted biomolecules alter the biological identity and cellular interactions of nanoparticles. ACS Nano. 8 (6), 5515-5526 (2014).
- Lynch, I., Dawson, K. A. Protein-nanoparticle interactions. Nano Today. 3 (1-2), 40-47 (2008).
- Tenzer, S., et al. Rapid formation of plasma protein corona critically affects nanoparticle pathophysiology. Nature Nanotechnology. 8 (10), 772-781 (2013).
- Chetwynd, A. J., Lynch, I. The rise of the nanomaterial metabolite corona, and emergence of the complete corona. Environmental Science: Nano. 7 (4), 1041-1060 (2020).
- Lee, J. Y., et al. Analysis of lipid adsorption on nanoparticles by nanoflow liquid chromatography-tandem mass spectrometry. Analytical and Bioanalytical Chemistry. , 1-10 (2018).
- Pink, M., Verma, N., Kersch, C., Schmitz-Spanke, S. Identification and characterization of small organic compounds within the corona formed around engineered nanoparticles. Environmental Science: Nano. 5 (6), 1420-1427 (2018).
- Chetwynd, A. J., Wheeler, K. E., Lynch, I. Best practice in reporting corona studies: Minimum information about Nanomaterial Biocorona Experiments (MINBE). Nano Today. 28, 100758 (2019).
- Zhang, H., et al. Quantitative proteomics analysis of adsorbed plasma proteins classifies nanoparticles with different surface properties and size. Proteomics. 11 (23), 4569-4577 (2011).
- Faserl, K., Chetwynd, A. J., Lynch, I., Thorn, J. A., Lindner, H. H. Corona isolation method matters: Capillary electrophoresis mass spectrometry based comparison of protein corona compositions following on-particle versus in-solution or in-gel digestion. Nanomaterials. 9 (6), 898 (2019).
- Nasser, F., Lynch, I. Secreted protein eco-corona mediates uptake and impacts of polystyrene nanoparticles on Daphnia magna. Journal of Proteomics. 137, 45-51 (2016).
- Hellstrand, E., et al. Complete high-density lipoproteins in nanoparticle corona. FEBS Journal. 276 (12), 3372-3381 (2009).
- Grintzalis, K., Lawson, T. N., Nasser, F., Lynch, I., Viant, M. R. Metabolomic method to detect a metabolite corona on amino functionalised polystyrene nanoparticles. Nanotoxicology. , 1-12 (2019).
- Chetwynd, A. J., Zhang, W., Thorn, J. A., Lynch, I., Ramautar, R. The nanomaterial metabolite corona determined using a quantitative metabolomics approach: A pilot study. Small. , (2020).
- Chetwynd, A. J., Guggenheim, E. J., Briffa, S. M., Thorn, J. A., Lynch, I., Valsami-Jones, E. Current application of capillary electrophoresis in nanomaterial characterisation and its potential to characterise the protein and small molecule corona. Nanomaterials. 8 (2), 99 (2018).
- Zhang, W., et al. Assessing the suitability of capillary electrophoresis-mass spectrometry for biomarker discovery in plasma-based metabolomics. Electrophoresis. , 00126 (2019).
- Ramautar, R., Somsen, G. W., de Jong, G. J. CE-MS for metabolomics: Developments and applications in the period 2016-2018. Electrophoresis. 40 (1), 165-179 (2019).
- Sarg, B., Faserl, K., Lindner, H. H. Identification of novel site-specific alterations in the modification level of myelin basic protein isolated from mouse brain at different ages using capillary electrophoresis-mass spectrometry. Proteomics. 17 (19), 1700269 (2017).
- Faserl, K., Sarg, B., Maurer, V., Lindner, H. H. Exploiting charge differences for the analysis of challenging post-translational modifications by capillary electrophoresis-mass spectrometry. Journal of Chromatography A. 1498, 215-223 (2017).
- Zhang, Z., Qu, Y., Dovichi, N. J. Capillary zone electrophoresis-mass spectrometry for bottom-up proteomics. TrAC - Trends in Analytical Chemistry. 108, 23-37 (2018).
- Shen, X., et al. Capillary zone electrophoresis-mass spectrometry for top-down proteomics. TrAC - Trends in Analytical Chemistry. 120, 115644 (2019).
- Ramautar, R., Busnel, J. M., Deelder, A. M., Mayboroda, O. A. Enhancing the coverage of the urinary metabolome by sheathless capillary electrophoresis-mass spectrometry. Analytical Chemistry. 84 (2), 885-892 (2012).
- Faserl, K., Kremser, L., Müller, M., Teis, D., Lindner, H. H. Quantitative proteomics using ultralow flow capillary electrophoresis-mass spectrometry. Analytical Chemistry. 87 (9), 4633-4640 (2015).
- Faserl, K., Sarg, B., Kremser, L., Lindner, H. Optimization and evaluation of a sheathless capillary electrophoresis-electrospray ionization mass spectrometry platform for peptide analysis: comparison to liquid chromatography-electrospray ionization mass spectrometry. Analytical Chemistry. 83 (19), 7297-7305 (2011).
- Segers, K., et al. CE-MS metabolic profiling of volume-restricted plasma samples from an acute mouse model for epileptic seizures to discover potentially involved metabolomic features. Talanta. 217, 121107 (2020).
- Chetwynd, A. J., David, A. A review of nanoscale LC-ESI for metabolomics and its potential to enhance the metabolome coverage. Talanta. 182, 380-390 (2018).
- Drouin, N., et al. Capillary electrophoresis-Mass spectrometry at trial by metabo-ring: Effective electrophoretic mobility for reproducible and robust compound annotation. Analytical Chemistry. 92 (20), 14103-14112 (2020).
- Faria, M., et al. Minimum information reporting in bio-nano experimental literature. Nature Nanotechnology. 13 (9), 777-785 (2018).
- Leong, H. S., et al. On the issue of transparency and reproducibility in nanomedicine. Nature Nanotechnology. 14 (7), 629-635 (2019).
- Kaur, I., et al. Dispersion of nanomaterials in aqueous media: Towards protocol optimization. Journal of Visualized Experiments. (130), e56074 (2017).
- Bihari, P., et al. Optimized dispersion of nanoparticles for biological in vitro and in vivo studies. Particle and Fibre Toxicology. 5 (1), 1-14 (2008).
- Taurozzi, J. S., Hackley, V. A., Wiesner, M. R. Ultrasonic dispersion of nanoparticles for environmental, health and safety assessment - and recommendations. Nanotoxicology. 5 (4), 711-729 (2011).
- Lu, P. J., et al. Methodology for sample preparation and size measurement of commercial ZnO nanoparticles. Journal of Food and Drug Analysis. 26 (2), 628-636 (2018).
- Langevin, D., et al. Inter-laboratory comparison of nanoparticle size measurements using dynamic light scattering and differential centrifugal sedimentation. NanoImpact. 10, 97-107 (2018).
- Lee, S., Bi, X., Reed, R. B., Ranville, J. F., Herckes, P., Westerhoff, P. Nanoparticle size detection limits by single particle ICP-MS for 40 elements. Environmental Science and Technology. 48 (17), 10291-10300 (2014).
- Hole, P., et al. Interlaboratory comparison of size measurements on nanoparticles using nanoparticle tracking analysis (NTA). Journal of Nanoparticle Research. 15 (12), 2101 (2013).
- Zhang, W., Gulersonmez, M. C., Hankemeier, T., Ramautar, R. Sheathless capillary electrophoresis-mass spectrometry for metabolic profiling of biological samples. Journal of Visualized Experiments. , e54535 (2016).
- Faserl, K., Sarg, B., Lindner, H. H. Application of CE-MS for the analysis of histones and histone modifications. Methods. , (2020).
- Azab, S., Ly, R., Britz-Mckibbin, P. Robust method for high-throughput screening of fatty acids by multisegment injection-nonaqueous capillary electrophoresis-mass spectrometry with Sstringent quality control. Analytical Chemistry. 91 (3), 2329-2336 (2019).
- Zhang, X., Pandiakumar, A. K., Hamers, R. J., Murphy, C. J. Quantification of lipid corona formation on colloidal nanoparticles from lipid vesicles. Analytical Chemistry. 19 (24), 14387-14394 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены