Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Funktioneller transkranialer Doppler-Ultraschall zur Überwachung des zerebralen Blutflusses
In diesem Artikel
Zusammenfassung
Funktioneller transkranialer Doppler-Ultraschall ergänzt andere funktionelle Bildgebungsmodalitäten mit seiner hohen zeitlichen Auflösung der Messung von reizinduzierten Veränderungen des zerebralen Blutflusses innerhalb der basalen Hirnarterien. Dieses Methodenpapier enthält Schritt-für-Schritt-Anleitungen zur Verwendung von funktionellem transkraniellem Doppler-Ultraschall zur Durchführung eines funktionellen Bildgebungsexperiments.
Zusammenfassung
Funktioneller transkranialer Doppler-Ultraschall (fTCD) ist die Verwendung von transkraniellem Doppler-Ultraschall (TCD), um die neuronale Aktivierung zu untersuchen, die während Reizen wie körperlicher Bewegung, Aktivierung taktiler Sensoren in der Haut und Betrachtung von Bildern auftritt. Die neuronale Aktivierung wird aus einer Erhöhung der zerebralen Blutflussgeschwindigkeit (CBFV) abgeleitet, die die Region des Gehirns versorgt, die an der Verarbeitung sensorischer Eingaben beteiligt ist. Zum Beispiel verursacht die Betrachtung von hellem Licht eine erhöhte neuronale Aktivität im Okzipitallappen der Großhirnrinde, was zu einem erhöhten Blutfluss in der hinteren Hirnarterie führt, die den Okzipitallappen versorgt. Bei fTCD werden Veränderungen in CBFV verwendet, um Veränderungen des zerebralen Blutflusses (CBF) abzuschätzen.
Mit seiner hochauflösenden Messung der Blutflussgeschwindigkeiten in den wichtigsten Hirnarterien ergänzt fTCD andere etablierte funktionelle bildgebungsverfahren. Das Ziel dieses Methodenpapiers ist es, Schritt-für-Schritt-Anweisungen für die Verwendung von fTCD zur Durchführung eines funktionellen Bildgebungsexperiments zu geben. Zunächst werden die grundlegenden Schritte zur Identifizierung der mittleren Hirnarterie (MCA) und zur Optimierung des Signals beschrieben. Als nächstes wird die Platzierung einer Fixierungsvorrichtung zum Halten der TCD-Sonde während des Experiments beschrieben. Abschließend wird das atmungsaktive Experiment demonstriert, das ein konkretes Beispiel für ein funktionelles Bildgebungsexperiment mit fTCD ist.
Einleitung
In der neurowissenschaftlichen Forschung ist es oft wünschenswert, die Gehirnaktivität in Echtzeit nichtinvasiv in einer Vielzahl von Umgebungen zu überwachen. Herkömmliche funktionelle Neuroimaging-Modalitäten haben jedoch Einschränkungen, die die Fähigkeit behindern, lokalisierte und / oder schnelle Aktivitätsänderungen zu erfassen. Die wahre (nicht gejitterte, nicht retrospektive) zeitliche Auflösung der funktionellen Magnetresonanztomographie (fMRT) liegt derzeit in der Größenordnung von wenigen Sekunden1, die möglicherweise keine vorübergehenden hämodynamischen Veränderungen im Zusammenhang mit einer vorübergehenden neuronalen Aktivierung erfasst. In einem anderen Beispiel kann die funktionelle Nahinfrarotspektroskopie (fNIRS) zwar eine hohe zeitliche Auflösung (Millisekunden) und eine angemessene räumliche Auflösung aufweisen, aber nur hämodynamische Veränderungen innerhalb der Großhirnrinde untersuchen und keine Informationen über Veränderungen liefern, die in den größeren Arterien stattfinden, die das Gehirn versorgen.
Im Gegensatz dazu bezieht sich fTCD - klassifiziert als Neuroimaging-Modalität - "Bildgebung" auf die Dimensionen von Zeit und Raum und nicht auf zwei orthogonale Raumrichtungen, die in einem "Bild" vertrauter sind. fTCD liefert komplementäre Informationen zu anderen Neuroimaging-Modalitäten, indem es hämodynamische Veränderungen mit hoher zeitlicher Auflösung (typischerweise 10 ms) an genauen Stellen innerhalb der Gefäße der basalen Hirnzirkulation misst. Wie bei anderen Neuroimaging-Modalitäten kann fTCD für eine Vielzahl von Experimenten verwendet werden, wie z.B. die Untersuchung der Lateralisierung der zerebralen Aktivierung während sprachbezogener Aufgaben2,3,4, die Untersuchung der neuronalen Aktivierung als Reaktion auf verschiedene somatosensorische Reize5und die Erforschung der neuronalen Aktivierung in verschiedenen kognitiven Reizen wie Sehaufgaben6, mentale Aufgaben7und sogar Werkzeugproduktion8.
Obwohl fTCD mehrere Vorteile für den Einsatz in der funktionellen Bildgebung bietet, darunter niedrige Gerätekosten, Portabilität und erhöhte Sicherheit (im Vergleich zu Wada-Test3 oder Positronenemissionstomographie [PET]-Scans), erfordert der Betrieb einer TCD-Maschine Fähigkeiten, die durch die Praxis erworben wurden. Einige dieser Fähigkeiten, die von einem TCD-Bediener erlernt werden müssen, umfassen die Fähigkeit, verschiedene Hirnarterien zu identifizieren und die motorischen Fähigkeiten, die erforderlich sind, um die Ultraschallsonde während der Suche nach der entsprechenden Arterie präzise zu manipulieren. Das Ziel dieses Methodenpapiers ist es, eine Technik zur Verwendung von fTCD zur Durchführung eines funktionellen Bildgebungsexperiments vorzustellen. Zunächst werden die grundlegenden Schritte zur Identifizierung und Optimierung des Signals der MCA, die 80% der Gehirnhemisphäre9durchdringt, aufgelistet. Als nächstes wird die Platzierung einer Fixierungsvorrichtung zum Halten der TCD-Sonde während des Experiments beschrieben. Abschließend wird das atmungsaktive Experiment, das ein Beispiel für ein funktionelles Bildgebungsexperiment mit fTCD ist, beschrieben und repräsentative Ergebnisse gezeigt.
Protokoll
Alle Forschungen am Menschen wurden in Übereinstimmung mit dem Institutional Review Board der University of Nebraska-Lincoln durchgeführt, und die Einwilligung aller Probanden wurde nach Aufklärung eingeholt.
1. Lokalisierung des MCA-Signals durch Freihand-TCD
HINWEIS: "Freihand"-TCD bezieht sich auf den Betrieb von TCD mit einem Handaufnehmer, um ein CBFV-Signal zu finden, bevor ein fTCD-Experiment beginnt.
- TCD-Parameter einstellen
- Halten Sie die Leistung während der ersten Suche nach dem MCA auf einem relativ hohen Wert (z. B. 400 mW). Sobald das MCA-Signal lokalisiert ist, reduzieren Sie die Leistung so weit wie möglich, während Sie immer noch ein "gutes" Signal beibehalten (siehe Schritt 2.2.7).
HINWEIS: Die Verwendung einer relativ hohen Leistung während der ersten Suche verstößt nicht gegen das "As Low As Reasonably Achievable" (ALARA) -Prinzip der Exposition gegenüber akustischer Strahlung, da eine höhere Leistung es ermöglicht, das MCA-Signal schneller zu erkennen10. - Stellen Sie das Probenvolumen während der ersten Suche nach dem MCA-Signal auf 8–12 mm ein. Wenn das Signal schwer zu finden ist, erhöhen Sie die Gate-Größe, um die Intensität des Signals zu erhöhen, aber beachten Sie, dass dies das Signal von einer oder mehreren nahe gelegenen Arterien in das Signal des MCA integrieren kann.
- Stellen Sie die Verstärkung auf ein mittleres Niveau ein, mit dem Ziel, "Hintergrundgeräusche auf einem Minimum zu halten, aber vorhanden"10.
- Legen Sie den Hochpassfilter-Cutoff (normalerweise als "Schwellenwert" bezeichnet) auf 50–150 Hz fest.
- Wenn das Subjekt ein Erwachsener ist, stellen Sie die Tiefe auf 50 mm ein, was der durchschnittlichen Mittlerentiefe des M1-Segments des MCA10 entspricht (Abbildung 1).
HINWEIS: Diese Einstellung wird in den folgenden Schritten ausführlicher erläutert. Tiefeneinstellungen für Kinder sind in Tabelle 1 angegeben.
- Halten Sie die Leistung während der ersten Suche nach dem MCA auf einem relativ hohen Wert (z. B. 400 mW). Sobald das MCA-Signal lokalisiert ist, reduzieren Sie die Leistung so weit wie möglich, während Sie immer noch ein "gutes" Signal beibehalten (siehe Schritt 2.2.7).
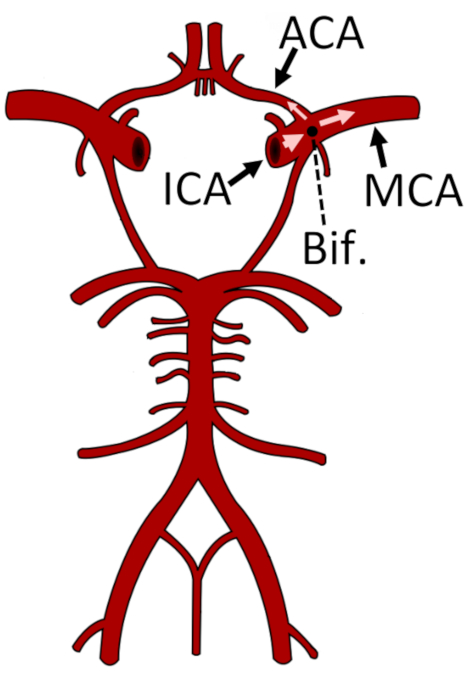
Abbildung 1: Darstellung des Kreises von Willis und der Hauptarterien des zerebralen Kreislaufsystems. Die Verzweigung des ICA in ACA und MCA ist mit einem schwarzen Kreis markiert. Das M1-Segment des MCA wird gezeigt. Diese Zahl wurde von24geändert. Abkürzungen: ACA = Arteria cerebralis anterior; Bif. = Verzweigung; ICA = Arteria carotis interna; MCA = mittlere Hirnarterie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Lokalisieren des Zeitfensters
HINWEIS: Das temporale Fenster, auch transtemporales akustisches Fenster genannt, ist ein Teil des Schädels, in dem der Knochen am dünnstenist 11, wodurch die Übertragung niederfrequenter Ultraschallenergie durch den Schädel ermöglicht wird (Abbildung 2).- Für Säuglinge und Kleinkinder befindet sich das Temporalfenster direkt vor dem Ohr (der "intertragale Raum") und über dem rostralen Rand des Jochbogens, der leicht unter der Haut zu spüren ist.
- Für Jugendliche und junge Erwachsene finden Sie das Zeitfenster über eines der Unterfenster.
HINWEIS: Das hintere Unterfenster liefert normalerweise das beste Signal (Abbildung 2). - Für Erwachsene im Alter von 30 Jahren oder älter, lokalisieren Sie das Temporalfenster direkt vor dem Ohr.
HINWEIS: Das akustische Fenster nimmt mit zunehmendem Alter aufgrund der zunehmenden Porosität des Schädelknochens ab, was dazu führt, dass einige ältere Menschen ein sehr begrenztes zeitliches Fenster haben12. Bei solchen Personen ist eine bilaterale Insonation des MCA manchmal unmöglich.
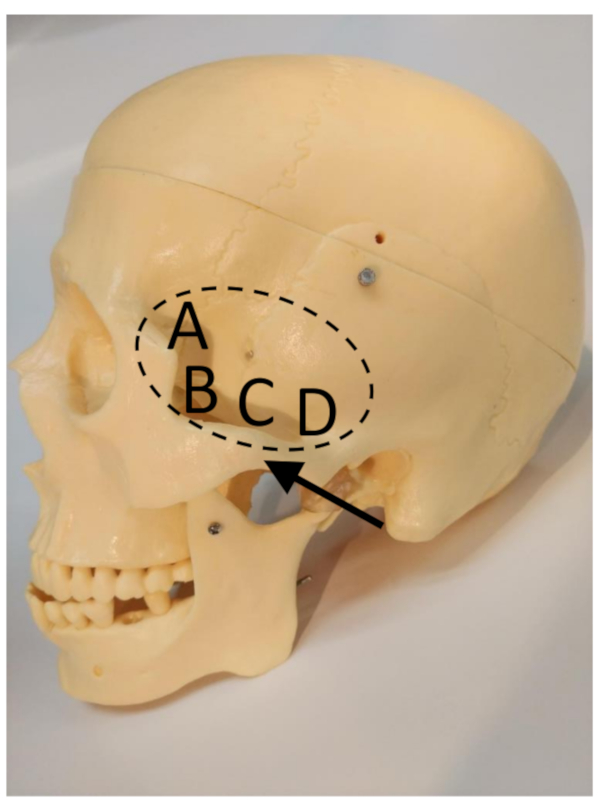
Abbildung 2: Das transtemporale Fenster (gekennzeichnet durch die gestrichelte Ellipse), der Jochbogen (Pfeil) und die Unterfenster11. (A) Vorderes Unterfenster. (B) Vorderes Unterfenster. (C) Mittleres Unterfenster. (D) Hinteres Unterfenster. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Anlegen des Wandlers
- Tragen Sie genügend Ultraschallgel auf, um die Oberfläche des Wandlers zu bedecken.
HINWEIS: Wenn es auf den Kopf gelegt wird, sollte das Gel genügend Platz abdecken, um eine Abdichtung zwischen der Kopfhaut und der Oberfläche der Dopplersonde aufrechtzuerhalten und so eine Signalunterbrechung durch Luftkopplung unter der Oberfläche der Sonde zu verhindern. - Warnen Sie das Subjekt, dass sich das Gel kalt anfühlen kann (bei Raumtemperatur).
- Platzieren Sie den Wandler auf dem Zeitfenster, das sich in Abschnitt 1.2 befand.
- Tragen Sie genügend Ultraschallgel auf, um die Oberfläche des Wandlers zu bedecken.
- Suche nach dem MCA
- Nachdem Sie den Wandler auf die Kopfhaut gelegt haben, suchen Sie nach dem MCA-Signal, das sich im Allgemeinen leicht anterior (vorwärts) und rostral (in Richtung Kopf) von der Position der anfänglichen Platzierung der Kopfhaut des Wandlersbefindet 10.
- Wenn das TCD-Spektralsignal nicht sofort offensichtlich ist, passen Sie den Winkel des Wandlers an, während Sie ihn an der gleichen Stelle relativ zur Kopfhaut halten. Winkeln Sie die Sonde langsam von rostral zu kaudal (in Richtung Füße) und nach vorne nach vorne.
HINWEIS: Abbildung 3 zeigt zwei Spektren, die aus derselben Position, aber in unterschiedlichen Winkeln aufgenommen wurden. - Wenn nach Schritt 1.4.2 immer noch ein Signal fehlt, überprüfen Sie die Farbanzeige im M-Modus auf Durchfluss im MCA in verschiedenen Tiefen (gekennzeichnet durch rote Färbung). Erhöhen oder verringern Sie die Signaltiefe in 5 mm Schritten und suchen Sie wie in Schritt 1.4.2 beschrieben. Wenn der Fluss im M-Modus, aber nicht im Dopplerspektrum sichtbar ist, erhöhen oder verringern Sie die Tiefe, bis das Strömungssignal im Dopplerspektrum sichtbar ist.
- Wenn immer noch kein zufriedenstellendes Signal erhalten wird, bewegen Sie den Wandler an eine nahe gelegene Position auf der Kopfhaut, die etwas vorderer ist, und wiederholen Sie die Schritte 1.4.1–1.4.3.
- Wenn ein optimales MCA-Signal erhalten wird, notieren Sie sich die Tiefe und die maximale Geschwindigkeit.
- Platzieren Sie mit einem waschbaren Make-up-Stift eine Markierung auf der Kopfhaut (Spurenteil des Wandlerrandes), wo das optimale Signal gefunden wurde.
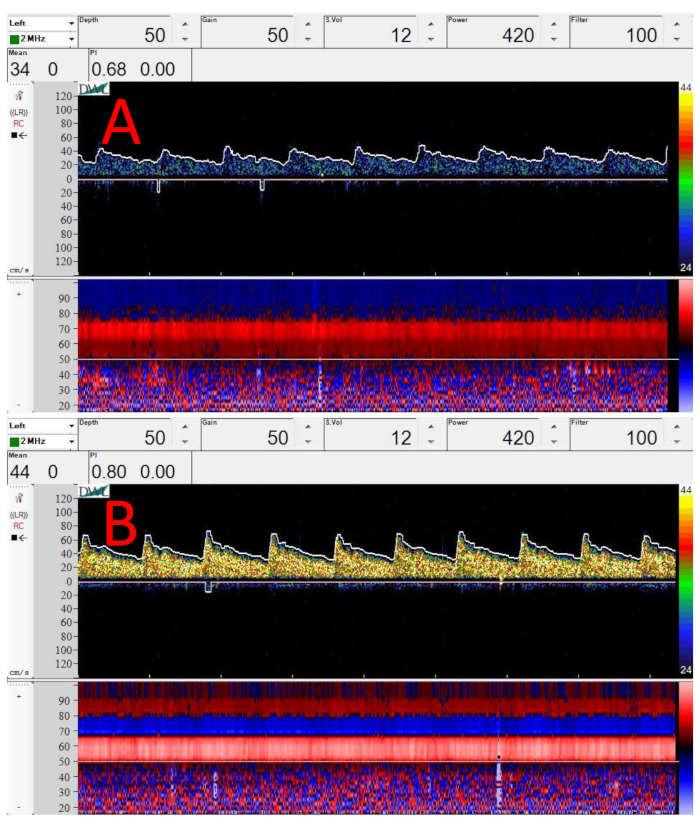
Abbildung 3: Proben-Dopplerspektren und M-Mode-Bilder vom Mittelpunkt des M1-Segments der MCA. (A) Spektrum, das direkt nach dem Auftragen des Wandlers auf das Temporalfenster direkt vor dem Ohr aufgenommen wurde. (B) Proben-Doppler-Spektrum an derselben Stelle und Tiefe wie (A). Die einzige Änderung ist, dass der Wandler leicht nach oben (überlegen) geneigt wurde. Sowohl in (A) als auch (B) Tiefe = 50 mm, Verstärkung = 50, Probenvolumen = 12 mm, Leistung = 420 mW/cm2und Filter = 100 Hz. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Suche nach der Verzweigung
HINWEIS: Das Finden der Verzweigung der Arteria carotis interna (ICA) ist wichtig, um zu bestätigen, dass die MCA die zu überwachende Arterie ist. Dieser Schritt sollte auf beiden Seiten durchgeführt werden, wenn eine bilaterale Überwachung durchgeführt wird, da die Verzweigung möglicherweise nicht auf beiden Seiten in der gleichen Tiefe liegt.- Erhöhen Sie die Tiefe, bis das Signal von der Verzweigung des ICA in mcA und ACA notiert wird (Abbildung 4), typischerweise in einer Tiefe von 51–65 mm10.
- Suchen Sie nach dem optimalen Bifurkationsspektralsignal mit dem in Schritt 1.4.2 beschriebenen Verfahren. Streben Sie immer nach dem spektralen Signal mit der höchsten Geschwindigkeit, das möglich ist10.
- Wenn ein optimales Verzweigungssignal erhalten wird, notieren Sie sich die Tiefe der Verzweigung.
- Für die bilaterale Überwachung wiederholen Sie die Abschnitte 1.1–1.4 und die Schritte 1.5.1–1.5.3 auf der anderen Seite des Kopfes.
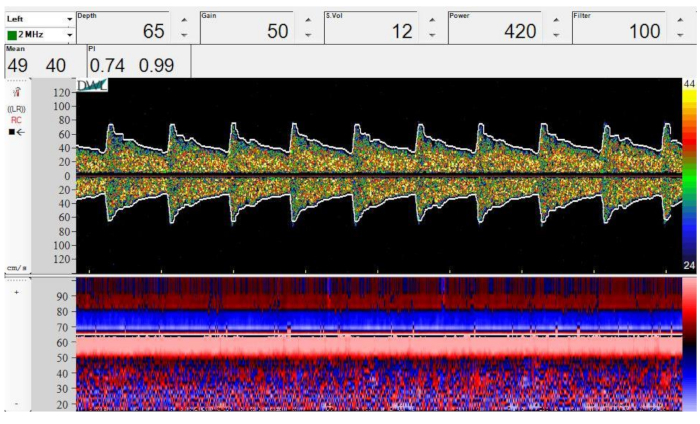
Abbildung 4: Spektrales Doppler- (oben) und M-Mode-Bild (unten) der Verzweigung des ICA in MCA und ACA. Tiefe = 65 mm, Verstärkung = 50, Probenvolumen = 12 mm, Leistung = 420 mW/cm2und Filter = 100 Hz. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Verschieben des MCA nach dem Einsetzen einer Fixiervorrichtung
HINWEIS: Für fTCD-Experimente ist es notwendig, CBFV für 10-90 min oder länger zu überwachen. Daher ist eine Fixiervorrichtung (Abbildung 5) entscheidend, um Stabilität zu gewährleisten.
- Platzieren der Fixiervorrichtung
- Passen Sie die Fixiervorrichtung (Abbildung 5) durch visuelle Inspektion an die ungefähre Kopfgröße des Probanden an.
- Alarmieren Sie das Subjekt, bevor Sie das Headset auf seinen Kopf setzen. Setzen Sie das Headset auf den Kopf des Motivs.
HINWEIS: Wenn das Subjekt langes oder dickes Haar hat, kann es notwendig sein, die Haare des Probanden zurückzubinden, abhängig von der verwendeten Fixierungsvorrichtung. - Passen Sie die Passform des Fixiergeräts an und fragen Sie das Motiv, ob das Gerät zu fest ist.
HINWEIS: Das Gerät sollte fest genug sein, dass es sich nicht bewegt, wenn es leicht gestoßen wird, sondern locker genug, dass das Motiv nicht unangenehm ist.
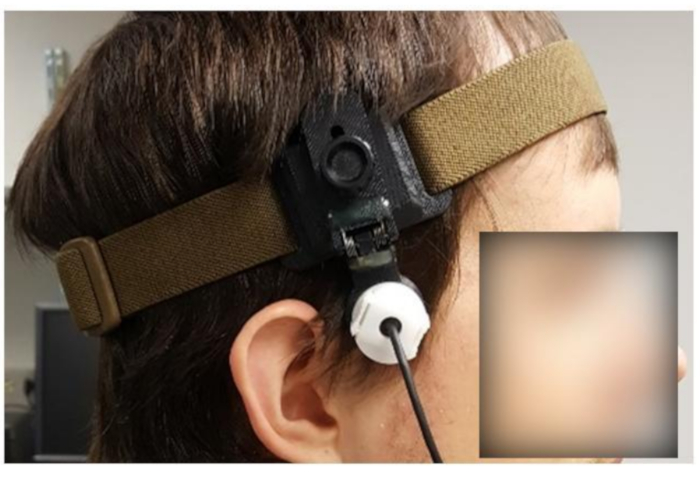
Abbildung 5: Subjekt mit benutzerdefinierter Fixiervorrichtung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Lokalisieren des MCA-Signals
- Lösen Sie den Mechanismus der Fixiervorrichtung, die den Wandler an Ort und Stelle hält (z. B. lösen Sie den Mechanismus, wie in Abbildung 5gezeigt, indem Sie einen Knopf gegen den Uhrzeigersinn drehen), damit sich der Wandler frei bewegen kann.
- Warnen Sie das Subjekt, bevor Sie Gel auf die Wandler auftragen (die bereits ab Abschnitt 2.1 vorhanden sein sollten) und dass das Gel kalt sein kann (wenn es bei Raumtemperatur gelagert wurde).
- Tragen Sie genügend Ultraschallgel auf den Schallkopf auf, um die Fläche des Wandlers zu bedecken.
- Stellen Sie die Fixiervorrichtung so ein, dass sich der Wandler über der Oberseite der markierung in Schritt 1.4.6 befindet.
- Suchen Sie nach dem optimalen MCA-Spektralsignal mit dem in den Schritten 1.4.1–1.4.3 beschriebenen Verfahren. Streben Sie immer nach dem spektralen Signal mit der höchsten Geschwindigkeit, das möglich ist10.
HINWEIS: Im Vergleich zu Freihand-TCD kann die optimale Tiefe, in der sich der MCA mit der Fixiervorrichtung befindet, geringfügig (höchstens 1–2 mm) von der Tiefe des Freihandgeräts abweichen. Dies liegt daran, dass die Fixierungsvorrichtung den Wandler etwas weiter von der Kopfhaut entfernt halten kann, während gleichzeitig eine Kopplungsgeldichtung erhalten bleibt. - Wenn das optimale MCA-Spektralsignal gefunden ist, ziehen Sie den Mechanismus der Fixierungsvorrichtung fest, um den Wandler an Ort und Stelle zu verriegeln. Beachten Sie die Tiefe und alle anderen Einstellungen.
- Verringern Sie die Leistung (siehe Schritt 1.1.1) so weit wie möglich, während Sie gleichzeitig eine spektrale Hülle beibehalten, die die maximale Geschwindigkeit genau verfolgt.
- Für die bilaterale Überwachungwiederholen Sie auf der anderen Seite die Schritte 2.2.1–2.2.7.
3. Durchführen eines Atemzugmanövers
HINWEIS: Dieser Abschnitt ist als Beispiel für ein funktionelles Experiment angegeben, das mit dem in Abschnitt 1 und Abschnitt 2 beschriebenen Versuchsaufbau durchgeführt werden kann.
- Führen Sie alle in Abschnitt 1 und Abschnitt 2 beschriebenen Schritte aus.
- Beginnen Sie mit der Aufnahme in der TCD-Software.
- Atmen Sie 3 Minuten lang normal, um eine gute Baseline-Aufnahme zu erreichen, und lassen Sie CBFV sich von früheren Experimenten oder Reizen stabilisieren.
- Countdown langsam von drei. Bitten Sie das Subjekt, nach einer normalen Inspiration mit dem Atem zu beginnen13.
HINWEIS: Der Probanden sollte nicht tief einatmen, da dies kohlendioxid in der Lunge verringern und die Wahrscheinlichkeit verringern würde, den Anstieg von CBFV aufgrund zerebrovaskulärer Reaktivität zu beobachten. Das Subjekt sollte auch vermeiden, ein Valsalva-Manöver durchzuführen, bei dem der intrathorakische Druck gegen eine gehaltene Inspiration erheblich erhöht wird14. - Platzieren Sie einen Marker in der TCD-Aufzeichnung, um den Beginn des Atmungspauses anzuzeigen.
- Lassen Sie das Subjekt den Atem für 30 s anhalten oder bis es sich nicht mehr wohl fühlt, den Atem anzuhalten.
- Wenn das Subjekt einatmet, platzieren Sie einen Marker in der TCD-Aufnahme, um das Ende des Atmungs haltend anzuzeigen.
- Setzen Sie die Überwachung von CBFV mit TCD fort und nehmen Sie mindestens 30 s nach dem Ende des Atmungspauses auf, um sicherzustellen, dass CBFV zu den Ausgangswerten zurückkehrt.
Ergebnisse
Abbildung 3 zeigt Beispiel-Dopplerspektren und Farb-M-Modi aus der Mitte des M1-Segments des MCA. Abbildung 3A,B wurden an der gleichen Position auf der Kopfhaut, aber in unterschiedlichen Winkeln aufgenommen. Beachten Sie, wie eine sehr kleine Winkeländerung, ohne die Kontaktposition auf der Kopfhautzu ändern, die Dopplersignalstärke erheblich verbessern kann, wie die höherintensive gelbe Färbung des Spektrogramms in Abbildung
Diskussion
Zu den kritischen Schritten im Protokoll gehören 1) das Finden des MCA, 2) das Platzieren des Stirnbandes und 3) das Ausführen des atmungsaktiven Manövers.
Je nach Den Probanden in der Studie können Modifikationen erforderlich sein. Zum Beispiel können Probanden mit Alzheimer-Krankheit Schwierigkeiten haben, Anweisungen zu befolgen, was die Verwendung eines Kapnographen erfordert, um die Einhaltung der atemhaltenden Anweisungen zu gewährleisten
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Dieses Projekt basiert auf Forschungen, die teilweise von der Nebraska Agricultural Experiment Station mit Mitteln aus dem Hatch Act (Accession Number 0223605) durch das USDA National Institute of Food and Agriculture unterstützt wurden.
Materialien
| Name | Company | Catalog Number | Comments |
| Aquasonic | Parker Laboratories, Inc., Fairfield, NJ, USA | 01-50 | Ultrasound Gel |
| Doppler Box X | DWL Compumedics Gmbh, Singen, Germany | Model "BoxX" | Transcranial Doppler with 2-MHz monitoring probes |
| Kimwipes | Kimberly-Clark Professional | 34256 | Delicate Task Wipers |
| Transeptic | Parker Laboratories, Inc., Fairfield, NJ, USA | 09-25 | Cleaning Spray |
Referenzen
- Buxton, R. B. The physics of functional magnetic resonance imaging (fMRI). Reports on Progress in Physics. 76 (9), 096601 (2013).
- Lohmann, H., Dräger, B., Müller-Ehrenberg, S., Deppe, M., Knecht, S. Language lateralization in young children assessed by functional transcranial Doppler sonography. NeuroImage. 24 (3), 780-790 (2005).
- Knecht, S., et al. Noninvasive determination of language lateralization by functional transcranial Doppler sonography: a comparison with the Wada test. Stroke. 29 (1), 82-86 (1998).
- Knecht, S., et al. Successive activation of both cerebral hemispheres during cued word generation. Neuroreport. 7 (3), 820-824 (1996).
- Hage, B., Way, E., Barlow, S. M., Bashford, G. R. Real-time cerebral hemodynamic response to tactile somatosensory stimulation. Journal of Neuroimaging. 28 (6), 615-620 (2018).
- Hage, B., et al. Functional transcranial Doppler ultrasound for measurement of hemispheric lateralization during visual memory and visual search cognitive tasks. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 63 (12), 2001-2007 (2016).
- Meyer, G. F., Spray, A., Fairlie, J. E., Uomini, N. T. Inferring common cognitive mechanisms from brain blood-flow lateralization data: a new methodology for fTCD analysis. Frontiers in Psychology. 5, 552 (2014).
- Uomini, N. T., Meyer, G. F. Shared brain lateralization patterns in language and Acheulean stone tool production: a functional transcranial Doppler ultrasound study. PLoS ONE. 8 (8), 72693 (2013).
- Edvinsson, L., MacKenzie, E. T., McCulloch, J. . Cerebral Blood Flow and Metabolism. , (1993).
- Alexandrov, A. V., et al. Practice standards for transcranial Doppler ultrasound: part I--test performance. Journal of Neuroimaging. 17 (1), 11-18 (2007).
- Fujioka, K. A., Douville, C. M., Newell, D. W., Aaslid, R. Anatomy and freehand examination techniques. Transcranial Doppler. , (1992).
- Alexandrov, A. V. Transcranial Doppler physics and techniques, lecture notes. American Society of Neuroimaging Conference. , (2020).
- Alwatban, M., Truemper, E. J., Al-rethaia, A., Murman, D. L., Bashford, G. R. The breath-hold acceleration index: a new method to evaluate cerebrovascular reactivity using transcranial Doppler. Journal of Neuroimaging. 28 (4), 429-435 (2018).
- Tiecks, F. P., et al. Effects of the Valsalva maneuver on cerebral circulation in healthy adults: a transcranial Doppler study. Stroke. 26 (8), 1386-1392 (1995).
- Alwatban, M., Murman, D. L., Bashford, G. Cerebrovascular reactivity impairment in preclinical Alzheimer's disease. Journal of Neuroimaging. 29 (4), 493-498 (2019).
- Twedt, M. H., et al. Most high-intensity transient signals are not associated with specific surgical maneuvers. World Journal for Pediatric and Congenital Heart Surgery. 11 (4), 401-408 (2020).
- Moehring, M. A., Spencer, M. P. Power M-mode Doppler (PMD) for observing cerebral blood flow and tracking emboli. Ultrasound in Medicine & Biology. 28 (1), 49-57 (2002).
- Poldrack, R. A. The future of fMRI in cognitive neuroscience. NeuroImage. 62 (2), 1216-1220 (2012).
- Oh, H., Custead, R., Wang, Y., Barlow, S. Neural encoding of saltatory pneumotactile velocity in human glabrous hand. PLoS ONE. 12 (8), 0183532 (2017).
- Rosner, A. O., Barlow, S. M. Hemodynamic changes in cortical sensorimotor systems following hand and orofacial motor tasks and pulsed pneumotactile stimulation. Somatosensory & Motor Research. 33 (3-4), 145-155 (2016).
- Alexandrov, A. V., et al. High rate of complete recanalization and dramatic clinical recovery during tPA infusion when continuously monitored with 2-MHz transcranial doppler monitoring. Stroke. 31 (3), 610-614 (2000).
- Watt, B. P., Burnfield, J. M., Truemper, E. J., Buster, T. W., Bashford, G. R. Monitoring cerebral hemodynamics with transcranial Doppler ultrasound during cognitive and exercise testing in adults following unilateral stroke. 2012 IEEE Engineering in Medicine and Biology Society Annual Conference Proceedings. , 2310-2313 (2012).
- Markus, H. S., Harrison, M. J. Estimation of cerebrovascular reactivity using transcranial Doppler, including the use of breath-holding as the vasodilatory stimulus. Stroke. 23 (5), 668-673 (1992).
- File:Circle of Willis en.svg. . Wikimedia Commons, the free media repository Available from: https://commons.wikimedia.org/w/index.php?title=File:Circle_of_Willis_en.svg (2020)
- Bode, H. . Pediatric Applications of Transcranial Doppler Sonography. , (1988).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten