Method Article
Erhebung kostengünstiger Methoden zur Messung von Lebensdauer und Gesundheitserwartung bei Caenorhabditis elegans
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Caenorhabditis elegans dienen als hervorragendes Modellsystem mit robusten und kostengünstigen Methoden zur Untersuchung von Gesundheit, Lebensdauer und Stressresistenz.
Zusammenfassung
Die Entdeckung und Entwicklung von Caenorhabditis elegans als Modellorganismus war einflussreich in der Biologie, insbesondere auf dem Gebiet des Alterns. Viele historische und zeitgenössische Studien haben Tausende von lebensdauerverändernden Paradigmen identifiziert, darunter genetische Mutationen, transgene Genexpression und Hormesis, eine vorteilhafte, minderwertige Exposition gegenüber Stress. Mit seinen vielen Vorteilen, darunter eine kurze Lebensdauer, eine einfache und kostengünstige Wartung und ein vollständig sequenziertes Genom mit Homologie zu fast zwei Dritteln aller menschlichen Gene, wurde C. elegans schnell als herausragendes Modell für Stress- und Alterungsbiologie übernommen. Hier werden mehrere standardisierte Methoden zur Messung von Lebensdauer und Gesundheitsspanne untersucht, die leicht in fast jede Forschungsumgebung angepasst werden können, insbesondere in solche mit begrenzter Ausrüstung und Finanzierung. Der unglaubliche Nutzen von C. elegans wird hervorgehoben und unterstreicht die Fähigkeit, leistungsstarke genetische Analysen in der alternden Biologie durchzuführen, ohne dass eine umfangreiche Infrastruktur erforderlich ist. Schließlich werden die Grenzen jeder Analyse und alternative Ansätze diskutiert, um sie zu berücksichtigen.
Einleitung
Seit der Veröffentlichung von "The genetics of Caenorhabditis elegans", einem der einflussreichsten Artikel von Sydney Brenner im Jahr 1974, gilt dieser mikroskopisch kleine Wurm als herausragendes Modellsystem zur Untersuchung biologischer Geheimnisse1. Im Jahr 1977 veröffentlichte Michael R. Klass die Methode zur Messung der Lebensdauer von C. elegans und etablierte dieses Modellsystem, um das Altern zu untersuchen2. Die Untersuchung zum Verständnis der Beziehung zwischen Stress und Langlebigkeit begann mit der Identifizierung einer einzigen Mutation im Age-1-Gen, die zu einer Verlängerung der Lebensdauer von C. elegans3 führte. Darüber hinaus haben zeitgenössische Studien andere lebensdauerverlängernde Mutationen identifiziert, die langlebige mutierte Würmer zeigten, die eine erhöhte Resistenz gegen Stress aufweisen 4,5,6. Mit seinen vielen Vorteilen, einschließlich einer kurzen Lebensdauer, einer einfachen Wartung, einem vollständig sequenzierten Genom, das Homologie zu etwa zwei Dritteln aller menschlichen krankheitsverursachenden Gene enthält, der Verfügbarkeit und Leichtigkeit der Verwendung von RNA-Interferenzbibliotheken (RNAi) und physiologischer Ähnlichkeit mit Menschen 7,8,9, wurde C. elegans schnell als hervorragendes Modell für Stress- und Alterungsbiologie übernommen.
Die vielleicht größten Vorteile von C. elegans sind seine extrem niedrigen Wartungskosten, die Leichtigkeit des Experimentierens und die Vielfalt der genetischen Werkzeuge, die für Studien zur Verfügung stehen. C. elegans werden typischerweise auf einem festen Agarmedium mit einer E. coli-Nahrungsquelle angebaut. Zwei häufig verwendete E. coli-Stämme sind Standard-OP50, ein B-Stamm, der vielleicht der am häufigsten verwendete 10 ist, und HT115, ein K-12-Stamm, der hauptsächlich für RNAi-Experimente11,12 verwendet wird. Der HT115 K-12-Stamm trägt eine Deletion in der RNAIII-RNase, einer Mutation, die für RNAi-Methoden unerlässlich ist, bei denen Plasmide verwendet werden, die dsRNA exprimieren, die einzelnen C. elegans-Genen entspricht. Die dsRNA-Fütterungsvektoren ermöglichen einen robusten Knockdown von C. elegans-Genen ohne komplexe Kreuzungen oder Genom-Editierung, da Bakterien, die diese Plasmide tragen, direkt an Nematoden verfüttert werden können. Tausende dieser bakteriellen RNAi-Vektoren existieren im HT115-Hintergrund, darunter die beliebteste Vidal-RNAi-Bibliothek mit >19.000 einzelnen RNAi-Konstrukten13 und die Ahringer-RNAi-Bibliothek mit 16.757 RNAi-Konstrukten14. Die bakteriellen Diäten OP50 und HT115 weisen jedoch große Unterschiede im Stoffwechselprofil auf, einschließlich Unterschieden bei Vitamin B1215,16. Daher wird empfohlen, alle Experimente an einer einzigen Bakterienquelle durchzuführen, wenn möglich, um Gen-Diät-Wechselwirkungen zu vermeiden, die mehrere Störfaktoren wie zuvor beschrieben einführen können17,18,19. Aufgrund seiner Leichtigkeit werden die Tiere für alle hier beschriebenen Versuchsbedingungen auf OP50 gehalten, aber alle Experimente werden wie zuvor beschrieben auf HT115 durchgeführt20. Kurz gesagt, die Tiere werden bei OP50 gehalten und nach der Synchronisation (nach dem Bleichen) auf HT115 übertragen, um die Konsistenz zwischen RNAi- und Nicht-RNAi-Experimenten zu gewährleisten. Alternativ kann auch ein RNAi-kompetenter OP50-Stamm verwendet werden, der eine ähnliche Deletion von RNAIII-RNase trägt, die im E. coli K12 HT115-Stamm gefunden wurde21.
Vielleicht ist eine große Einschränkung für RNAi-Experimente in C. elegans die Sorge um die Knockdown-Effizienz. Während die Knockdown-Effizienz über qPCR oder Western Blotting validiert werden kann, erfordern diese teure Geräte und Reagenzien und beschränken sich auf die Massenanalyse. Dies ist umso besorgniserregender, wenn man sich bestimmte Zellen wie Neuronen ansieht, die gegenüber RNAi refraktär (weniger empfindlich) sind. Während die RNAi-Effizienz in bestimmten Zellen durch Überexpression von SID-1, dem für die dsRNA-Aufnahme essentiellen Transmembranprotein, verbessert werden kann22, ist dies immer noch auf die zelltypspezifischen Expressionsmuster der für diese Konstrukte verwendeten Promotoren beschränkt, und somit sind Gen-Knockouts und -Mutationen die narrensichersten Mittel, um Genfunktionen zu erschöpfen. Über den RNAi-vermittelten Knockdown hinaus sind C. elegans auch sehr anfällig für die Genom-Editierung mit CRISPR-basierten Strategien 23,24,25 und transgener Konstruktüberexpression durch Mikroinjektionen, mit der Option, transgene Konstrukte durch Bestrahlung oder Transposon-basierte Integration zu integrieren26,27,28,29 . Diese Methoden erfordern jedoch teure Mikroinjektionsgeräte, und die hohen Kosten für Leit-RNAs oder Cas9-Enzyme können diese Methoden in Institutionen mit begrenzter Finanzierung verbieten. Stattdessen sind Tausende von transgenen Linien und Mutanten sowohl im Caenorhabditis Genetics Center (CGC) als auch im National Bioresource Project (NBRP) für ein paar Dollar erhältlich. Das NBRP bietet isolierte Mutanten für eine große Anzahl von C. elegans-Genen, einschließlich veröffentlichter und daher verifizierter Mutantenstämme, Mutanten, die aus Pilotprojekten stammen, und Mutanten, die noch charakterisiert werden müssen. Im Gegensatz dazu ist CGC ein Depot von meist veröffentlichten und etablierten C. elegans-Linien aus der Forschungsgemeinschaft. Beide verschiffen Stämme weltweit zu sehr günstigen Preisen und bieten eine Vielzahl von Optionen für diejenigen mit begrenzter Kapazität, Stämme intern zu synthetisieren.
Hier wird eine kuratierte Methodensammlung angeboten, die wahrscheinlich die kostengünstigsten Methoden zur Bestimmung von Lebensdauer und Gesundheitserwartung in C. elegans sind. Alle hier vorgestellten Methoden erfordern kostengünstige Ausrüstung und Zubehör und verwenden nur Stämme, die vom CGC leicht erhältlich sind. Vielleicht am unerschwinglichsten für Langlebigkeits- und Überlebensassays in C. elegans sind die Kosten für Nematode Growth Media (NGM) -Platten. Da C. elegans Hermaphroditen sind und sich selbst befruchten, erfordern Standard-Überlebenstests, dass erwachsene Tiere kontinuierlich von ihren Nachkommen entfernt werden, um eine Kontamination durch Nachkommen zu vermeiden. Dieser Prozess ist nicht nur zeitaufwändig, sondern kann auch teuer werden, da etwa 100 Platten pro Zustand erforderlich sind, um einen einzigen Lebensdauerassay durchzuführen. Hier stehen zwei Alternativen zur Verfügung: die Nutzung der temperaturempfindlichen keimbahnlosen Mutante glp-4(bn2) oder die chemische Sterilisation mit 5-Fluor-2'-Desoxyuridin (FUDR). glp-4 kodiert für eine Valylaminoacyl-tRNA-Synthetase, und die temperaturempfindlichen glp-4(bn2) weisen bei restriktiven Temperaturen aufgrund einer verminderten Proteintranslation einen reproduktiven Mangel auf30,31 auf. FUDR ist eine robuste Methode zur chemischen Sterilisation von C. elegans, indem die DNA-Replikation verhindert und somit die Fortpflanzung gehemmtwird 32. Obwohl FUDR für einige Labore unerschwinglich teuer sein kann, ist nur eine kleine Menge erforderlich, um Würmer chemisch zu sterilisieren, und seine Stabilität in Pulverform kann es für die meisten Gruppen machbar machen. Die Verwendung der temperaturempfindlichen glp-4 (bn2) -Mutante ist sicherlich die billigste Option, da die einzige Voraussetzung ein Inkubator ist, um die Tiere auf die restriktiven 25 ° C zu verlagern. Es ist jedoch zu beachten, dass Wachstum bei 25 °C leichten Hitzestress verursachen kann33,34. Unabhängig von der Methode kann die Verwendung steriler Tiere die Kosten für Verbrauchsmaterialien, die für altersbedingte Assays benötigt werden, erheblich senken.
Um das Altern zu untersuchen, sind Standard-Lebensdauer-Assays konventionell, da Paradigmen, die die Langlebigkeit verändern, direkte Auswirkungen auf das Altern haben. Messungen der Gesundheitsspanne und der Stresstoleranz liefern jedoch zusätzliche Informationen über die Gesundheit des Organismus. Hier werden mehrere Methoden zur Messung der Gesundheitsspanne angeboten: 1) Fruchtbarkeit als Maß für die reproduktive Gesundheit; 2) Brutgröße als Maß für die Entwicklungsgesundheit und Lebensfähigkeit der entlassenen Nachkommen; und 3) Bewegungsverhalten als Maß für Muskelfunktion und Motilität, die beide direkt mit dem Altern korrelieren. Darüber hinaus werden Assays zur Stresstoleranz angeboten: Überleben gegenüber ER-Stress, mitochondrialem / oxidativem Stress und Überleben von thermischem Stress. Tatsächlich weisen Tiere mit erhöhter Resistenz gegen ER-Stress 35,36, mitochondrialen Stress37 und thermischen Stress 38 eine erhöhte Lebensdauer auf. ER-Stress wird angewendet, indem C. elegans Tunicamycin ausgesetzt wird, das die N-verknüpfte Glykosylierung blockiert und die Ansammlung von fehlgefalteten Proteinenverursacht 39. Mitochondrialer/oxidativer Stress wird durch die Exposition gegenüber Paraquat induziert, das die Superoxidbildung speziell in den Mitochondrien40 induziert. Hitzestress wird durch die Inkubation von Tieren bei 34-37 °C33,41 angewendet. Alle hier beschriebenen Assays können mit minimaler Ausrüstung und Mitteln durchgeführt werden und bieten eine Vielzahl von Werkzeugen, um das Altern in verschiedenen Gruppen zu untersuchen.
Protokoll
1. Wachstum und Erhaltung von C. elegans
- Gießen von Nematodenwachstumsmedien (NGM) Platten
- Züchten Sie C. elegans auf Standard-Agarplatten mit Nematoden-Wachstumsmedien (NGM), bestehend aus 1 mM CaCl2, 5 μg/ml Cholesterin, 25 mM KPO 4 (pH 6,0), 1 mM MgSO4, 0,25% w/v Pepton und 51,3 mM NaCl.
- Für 1 L NGM-Agar-Platten messen Sie 2,5 g Pepton, 3,0 g NaCl und 20 g Agar in einen 1-Liter-Kolben mit einem Rührstab.
HINWEIS: Es wird empfohlen, eine bestimmte Agarquelle zu standardisieren, da wir Unterschiede in der Steifigkeit zwischen den Marken gesehen haben, die die Reproduzierbarkeit beeinträchtigen können. Hier wird ausschließlich Bacto-Agar verwendet. Darüber hinaus wird empfohlen, Agar direkt in den zu autoklavierenden Kolben zu geben, da sich Agar ohne Erhitzen nicht vollständig auflöst und das Übertragen von Agar, das Agar enthält, zu Agarverlust und Konzentrationsfehlern führt. - Fügen Sie dH2O bis zu 970 ml hinzu.
HINWEIS: 30 ml flüssige Additive nach der Sterilisation bringen das endgültige Volumen auf 1 L. In unseren Händen werden ~ 951 mL von dH2O benötigt, um 970 mL des endgültigen Volumens zu erreichen. - Sterilisieren Sie die NGM-Agar-Lösung mit einem Standard-Autoklaven oder Mediensterilisator für eine effiziente Sterilisation.
HINWEIS: Zu diesem Zeitpunkt kann steriles NGM-Agar mehrere Monate bei Raumtemperatur gelagert werden. Wenn es gelagert wird, kann NGM-Agar in einer Mikrowelle mit 15-45 s Impulsen regeneriert werden, um ein Überkochen der Lösung zu verhindern, oder in einem beheizten Wasserbad. - Lassen Sie die Lösung rühren, bis sie auf 60-75 °C abgekühlt ist. Das Rühren während des Abkühlens ist wichtig, um eine ungleichmäßige Abkühlung zu vermeiden, die dazu führen kann, dass sich etwas Agar verfestigt.
- Während die Lösung abkühlt, erhitzen Sie ein Wasserbad oder ein Perlenbad auf 65-70 °C.
- Sobald die Lösung auf 60-75 °C abgekühlt ist, fügen Sie flüssige Zusatzstoffe hinzu: 2,0 ml 0,5 M CaCl2, 1 ml 5 mg/ml Cholesterin, 25 ml 1 M KPO 4 (pH 6,0) und 0,5 MMgSO 4 (Rezepturen für alle Reagenzien siehe Tabelle 1) und lassen Sie die Lösung für ~ 5 min mischen, um ein vollständiges Mischen zu gewährleisten.
HINWEIS: Medikamente können hier auch in Platten enthalten sein (z. B. 1 ml 100 mg / ml Carbenicillin und 1 ml 1 M IPTG hinzufügen; fügen Sie 10 ml 2,5 mg / ml Tunicamycin hinzu; fügen Sie 10 ml von 400 mM Paraquat hinzu). - Tauchflasche mit NGM-Agar in einem 65-70 °C warmen Wasserbad, um zu verhindern, dass sich NGM-Agar beim Eingießen in Platten verfestigt.
- Pipette 9-11 ml Lösung in jede 60-mm-Platte oder 20-30 mL Lösung in jede 100-mm-Platte.
HINWEIS: Es wird empfohlen, das kleinste verfügbare Pipettenvolumen zu verwenden, um NGM-Lecks zu vermeiden, die durch Luftausdehnung in der Pipette verursacht werden. Das Pipettieren von 1-2 ml mehr Medien, als jeder Platte hinzugefügt werden, um eine vollständige Entleerung der Pipette zu vermeiden, hilft, die Blasenbildung zu verhindern. Alternativ können Teller direkt aus der Flasche von Hand in eine Platte gegossen werden, aber das Pipettieren wird dringend empfohlen, um Platten mit gleichem Volumen zu gewährleisten. Platten mit gleichem Volumen sind wichtig, um ähnliche Konzentrationen von Lösungen zu gewährleisten, wenn Verfahren verwendet werden, bei denen Lösungen direkt auf eine Platte aufgetragen werden (siehe Schritt 1.1.17). Gleiche Volumina ermöglichen auch eine einfache Mikroskopie, um eine ähnliche Fokusebene über Platten aufrechtzuerhalten. - Legen Sie die Pipette wieder in die erhitzte Lösung, um die Temperatur zu halten und zu verhindern, dass NGM-Agar erstarrt.
- Wiederholen Sie die beiden obigen Schritte für alle Platten.
- Lassen Sie NGM-Agar-Platten über Nacht erstarren.
- Nachdem die Platten erstarrt sind, lagern Sie die Platten bis zu 3 Monate bei 4 °C oder fahren Sie mit Schritt 1.1.14 fort, um Platten mit Bakterien zu säen. Lagern Sie Platten in versiegelten Behältern, um Feuchtigkeit zu speichern und die Plattenqualität zu erhalten.
- Züchten Sie eine OP50-Kultur in Lysogeniebrühe (LB) oder gleichwertigen Medien Ihrer Wahl für 24-48 h bei Umgebungstemperatur (~22-25 °C) oder züchten Sie eine Kultur von HT115 in LB + Antibiotika (Ampicillin / Kohlenhydrat + Tetracyclin wird für HT115 empfohlen) mit Schütteln bei 37 ° C für 12-16 h.
HINWEIS: Es wird empfohlen, OP50 bei Raumtemperatur zu züchten, da ein aggressiveres Wachstum von OP50 bei 37 ° C gefunden wurde, was die Lebensdauer von C. elegans beeinflusst. Im Gegensatz dazu hat HT115 eine langsamere Wachstumsrate und macht weniger dichte Kulturen; Daher wird empfohlen, HT115 bei 37 °C mit Schütteln zu züchten. - Ein Volumen von 100-200 μL einer gesättigten OP50/HT115-Kultur wird auf eine 60-mm-Platte oder 1 ml auf eine 100-mm-Platte ausgesät.
- Lassen Sie die Teller über Nacht auf einer Tischplatte trocknen und lassen Sie einen zusätzlichen Tag trocknen, wenn die Platten noch nass sind. Lagern Sie Platten in verschlossenen Behältern bei 4 °C für ~ 2 Monate.
- Optional: Fügen Sie Medikamente direkt auf ausgesäte NGM-Agar-Platten (z. B. 100 μL 10 mg / ml FUDR-Lösung) hinzu, um Würmer chemisch zu sterilisieren.
- Pflege der C. elegans-Bestände
- Beschriften Sie den Boden einer ausgesäten NGM-Agar-Platte ordnungsgemäß. Beschriften Sie die Kanten auf der Unterseite der Platte, um zu verhindern, dass der Lichtdurchlass von Standard-Dissektionsmikroskopen behindert wird.
- Mit einem Standard-Dissektionsmikroskop können Sie Bakterien Ihrer Wahl auf C. elegans picken.
HINWEIS: In diesem Protokoll wurde ein Pick verwendet, der aus einem 90% / 10% Platin / Iridium-Draht besteht, der am Ende einer Pasteur-Pipette aus Glas befestigt ist. - Sammeln Sie mit den Bakterien 10-20 Eier, L1-, L2- oder L3-Tiere und übertragen Sie sie auf eine neu markierte NGM-Agar-Platte.
HINWEIS: Es ist am besten, jüngere Tiere zu sammeln; Nach der Erfahrung der Autoren ermöglicht das Bewegen von 10-20 Eiern / Jungtieren bei Standard-Wildtyptieren, dass die Platte bei 15 ° C ohne Hunger wächst. Bei transgenen oder mutierten Tieren mit verminderter Fruchtbarkeit sollten mehr Tiere in die Platte gebracht werden. - Bei Tieren mit Wildtyp-Fruchtbarkeit, die bei 15 °C gezüchtet werden, sind die Schritte 1.2.1-1.2.3 alle 7 Tage zu wiederholen, um einen wöchentlichen Bestand zu halten. Bei Tieren, die bei 20 °C gezüchtet werden, wiederholen Sie die Schritte 1.2.1-1.2.3 alle 4-5 Tage, um Hunger zu verhindern.
- Synchronisieren von Würmern via Bleiche
HINWEIS: Eine vollständige, 60 mm NGM-Agarplatte (z. B. 1 Woche alte Brühplatten, die bei 15 ° C gezüchtet werden) bietet eine ausreichende Anzahl von Tieren für die meisten beschriebenen Standardassays. Im Allgemeinen wird ein gravider Erwachsener (Erwachsener voller Eier) 10-15 Eier zur Verfügung stellen42, und eine volle, 60 mm NGM-Agar-Platte hat irgendwo zwischen 100-200 gravid Erwachsene und liefert ~ 1000-2000 Eier.- Für größere Experimente, die mehr Tiere erfordern, schneiden Sie ein volles 60-mm-NGM-Agar in vier bis sechs gleiche Stücke und teilen Sie sie zur Ausdehnung auf gesäte 100-mm-Platten.
HINWEIS: Hier bezieht sich Chunking auf das Schneiden eines Stücks der NGM-Agar-Platte, die Würmer enthält, und das Bewegen des gesamten Stücks Agar + Würmer auf eine neue Platte, wurmenseitig nach unten, damit die Würmer auf die neue Platte kriechen können. Als Bezugsrahmen produzieren Tiere mit Wildtyp-Fruchtbarkeit eine volle 100-mm-Platte, wenn sie 2-3 Tage nach dem Chunking bei 20 ° C angebaut werden. - Um mit dem Sammeln der Nematoden zu beginnen, gießen Sie eine kleine Menge M9-Lösung (Tabelle 1) auf Teller mit Würmern und achten Sie darauf, die Petrischale nicht zu überfüllen. Schwenken Sie die M9-Lösung vorsichtig, um Würmer von bakteriellen Rasenflächen zu lösen.
- Sammeln Sie gravide erwachsene Würmer mit einer serologischen Pipette und achten Sie darauf, den Agar nicht mit der Pipettenspitze zu durchbohren.
HINWEIS: Serologische Glaspipetten werden empfohlen, da C. elegans dazu neigen, an Kunststoff zu haften. Wenn keine Glaspipetten verfügbar sind, wird empfohlen, mit einer größeren Anzahl von Tieren als nötig zu beginnen, da einige durch das Anhaften an Plastikpipetten verloren gehen. - Pelletieren Sie die Tiere durch Zentrifugation für 30 s bei 1.100 x g. Aspirieren Sie den Überstand.
HINWEIS: Das C. elegans Pellet ist sehr locker, also achten Sie darauf, das Pellet nicht zu schütteln oder zu stören, während Sie den Überstand absaugen. - Während die Tiere zentrifugieren, bereiten Sie 5 ml Bleichlösung pro Stamm vor (Einzelheiten zur Rezeptur siehe Tabelle 1); für 5 ml Lösung werden 1,5 ml 6%iges Natriumhypochlorit (Bleichmittel), 0,75 ml 5 M NaOH oder KOH und 2,75 ml dH 2 O gemischt.
ACHTUNG: Natriumhypochlorit und hochkonzentrierte Hydroxidlösungen sind korrosiv, daher wird empfohlen, bei der Handhabung Handschuhe und einen Laborkittel zu tragen. - 5 ml Bleichlösung in das Wurmpellet/M9-Gemisch geben.
- Überprüfen Sie die Würmer unter einem Seziermikroskop alle paar Minuten, bis alle erwachsenen Wurmkörper aufgelöst sind und nur Eier in der Mischung übrig sind. Schütteln Sie die Wurm-/Bleichmittelmischung kräftig, um den Bleichprozess zu beschleunigen.
HINWEIS: Wenn Sie Eier über einen längeren Zeitraum in einer Bleichmittelmischung belassen, werden die Eier beschädigt und die Lebensfähigkeit der Tiere beeinträchtigt. Bei Wildtyptieren dauert das Bleichen normalerweise 4-6 Minuten mit Schütteln. Daher wird empfohlen, die Tiere ab der 4-Minuten-Marke im Abstand von 30 s unter einem Mikroskop zu untersuchen. - Pelletieren Sie die Eier, indem Sie die Eier / Bleichmittelmischung für 30 s bei 1.100 x g drehen.
HINWEIS: Einige 15 ml konische Rohre haben Gradientenlinien auf der Innenseite der Röhre. Für diese Röhrchen wird empfohlen, Eier mit einer höheren Geschwindigkeit zu spinnen (z. B. 30 s bei 2.000 x g), um sicherzustellen, dass Eier zum Boden des Röhrchens pelletiert werden und nicht auf Gradientenlinien bleiben. - Saugen Sie die Bleichlösung ab.
HINWEIS: Ein Eipellet ist steifer als ein Wurmpellet, kann aber dennoch leicht gestört werden. Achten Sie also darauf, das Rohr nach dem Zentrifugieren nicht zu schütteln. - Waschen Sie die Eier, indem Sie M9-Lösung bis zu 15 ml hinzufügen und das Röhrchen vier- oder fünfmal umkehren, um sicherzustellen, dass die Eier vollständig in der M9-Lösung dispergiert sind.
- Pelleteier durch Zentrifugieren für 30 s bei 1.100 x g und Absaugen der M9-Lösung.
- Wiederholen Sie die beiden obigen Schritte für insgesamt vier Wäschen, um Bleichmittel aus der Eiermischung zu entfernen.
- Resuspendieren Sie die Eier in 100 μL bis 2 ml M9-Lösung (d. h. abhängig von der Gesamtzahl der gebleichten Würmer) nach der endgültigen Wäsche. Schütteln Sie die Eier gründlich, um die Klumpen aufzubrechen und sicherzustellen, dass das Pellet vollständig resuspendiert ist.
- Alternativ können Tiere L1 für eine engere zeitliche Synchronisation verhaftet werden; Für den L1-Arrest fügen Sie dem Eipellet M9-Lösung auf ~ 10 ml in einem 15 ml konischen Schlauch hinzu. Lassen Sie die Würmer in einem Rotator bis zu 24 h bei 20 °C oder Umgebungstemperatur drehen. L1-Tiere benötigen im Allgemeinen einen halben Tag weniger, um das Erwachsenenalter zu erreichen, verglichen mit dem in Schritt 1.3.16 beschriebenen Zeitpunkt der Eier.
- Die Eikonzentration (oder L1-Konzentration; siehe Schritt 1.3.14) wird angenähert, indem 4 μL Ei/M9-Mischung auf eine mit Bakterien besäte NGM-Platte pipettiert werden. Zählen und berechnen Sie, wie viele Eier pro μL plattiert vorhanden sind. Wiederholen Sie die Zählung drei- oder viermal, um die Annäherung zu verbessern.
HINWEIS: Durch die Annäherung an die Eikonzentration wird sichergestellt, dass genügend Tiere für eine geeignete Stichprobengröße für Experimente ohne Überplattierung plattiert werden, was zu Hunger führt. - Basierend auf der Näherung wird die entsprechende Anzahl von Eiern auf NGM-Agar-Platten geklebt, die mit Bakterien der Wahl ausgesät sind. Für OP50-Platten werden maximal 200 Tiere auf einer 60-mm-Platte und 1.000 Tiere auf einer 100-mm-Platte geklebt. Für HT115-Platten werden maximal 150 Tiere auf einer 60-mm-Platte und 600 Tiere auf einer 100-mm-Platte plattiert.
HINWEIS: Dies sind ungefähre Zahlen, die auf unseren Laborbedingungen basieren, und die Zahlen können sich je nach Dicke des Bakterienrasens ändern. Eier, die bei 15 ° C gezüchtet werden, benötigen ~ 5 Tage, um Tag 1 Erwachsenenalter zu erreichen (~ 140 Stunden, um das maximale, gravide Erwachsenenstadium der Eiablage zu erreichen). Eier, die bei 20 ° C gezüchtet werden, benötigen ~ 4 Tage, um Tag 1 Erwachsenenalter zu erreichen (~ 96 Stunden, um das maximale, gravide Erwachsenenstadium der Eiablage zu erreichen). Eier, die bei 25 ° C angebaut werden, benötigen ~ 3,5 Tage, um Tag 1 Erwachsenenalter zu erreichen (~ 62 Stunden, um das maximale, gravide Erwachsenenstadium der Eiablage zu erreichen).
- Für größere Experimente, die mehr Tiere erfordern, schneiden Sie ein volles 60-mm-NGM-Agar in vier bis sechs gleiche Stücke und teilen Sie sie zur Ausdehnung auf gesäte 100-mm-Platten.
- Eiablage als alternative Methode zur Synchronisation von C. elegans Populationen
- Wenn Bleichprotokolle nicht durchführbar sind (z. B. keine Zentrifuge verfügbar), führen Sie als alternative Methode zur Synchronisation von Populationen von C. elegans ein Eiablageverfahren durch. Denken Sie daran, dass dieses Protokoll arbeitsintensiver ist und zu geringeren Tiererträgen führt.
- Für die Eiablage legen Sie 8-12 gravide Erwachsene auf eine Standard-NGM-Agar-Platte, die mit Bakterien ihrer Wahl besät ist, und dokumentieren Sie die genaue Anzahl der Tiere, die auf einen Teller gelegt wurden.
HINWEIS: Eilegeverfahren sollten bei der Temperatur durchgeführt werden, die für Experimente verwendet wird. - Erlauben Sie den Tieren, Eier für 4-8 h zu legen.
HINWEIS: Die Dauer, in der Tiere auf dem Teller gelassen werden, kann bei Bedarf angepasst werden. Zum Beispiel kann eine größere Anzahl von Tieren für eine kürzere Eilegedauer auf einen Teller gelegt werden, wenn weniger Zeit zur Verfügung steht. C. elegans legen im Allgemeinen Eier in Schüben, die mit einer Rate von ungefähr fünf Eiern / h für Tiere mit Wildtyp-Fruchtbarkeitgeschätzt werden können 43. Befolgen Sie die Empfehlungen in Schritt 1.3.16, um zu vermeiden, dass Tiere überzogen werden. - Entfernen Sie alle erwachsenen Tiere vom Teller.
HINWEIS: Alle erwachsenen Tiere, die auf dem Teller verbleiben, legen weiterhin Eier, was zu einer nicht synchronisierten Population führt. - Legen Sie Eier bei 15 ° C für ~ 5 Tage oder 20 ° C für ~ 4 Tage, um Tag 1 Erwachsenenalter zu erreichen.
2. Messung der Langlebigkeit bei C. elegans
- Standardlebensdauer
- Bereiten Sie NGM-Agar-Platten vor, indem Sie Platten mit 100 μL Bakterien Ihrer Wahl aussäen. Stellen Sie aus Konsistenzgründen sicher, dass das gleiche Bakterium für alle Replikate verwendet wird. Da Würmer jeden Tag während der Eiablagestadien des Erwachsenenalters bewegt werden, säen Sie fünf bis sieben Sätze von NGM-Agar-Platten für die Dauer der Lebensdauer und zwei bis vier Platten pro Stamm, um Tiere bis zum Erwachsenenalter zu züchten (dh wenn acht Platten mit 15 Tieren für die Lebensspanne verwendet werden, muss man 40-56 Platten pro Bedingung säen).
- Lassen Sie die Teller vor der Lagerung über Nacht trocknen.
HINWEIS: Es wird empfohlen, die Platten bei 4 ° C zu lagern und die erforderliche Anzahl von Platten täglich aus dem Kühllager zu entfernen, um zu verhindern, dass Bakterien dicke Rasenflächen bilden, die das Bewegen / Zählen der Lebensdauer erschweren können. Stellen Sie sicher, dass die Platten vor dem Galvanisieren von Würmern aufgewärmt werden. - Sammeln Sie eine synchronisierte Population von C. elegans mit einem Standard-Bleichassay, wie in den Schritten 1.3 und 1.4 beschrieben.
- Bewegen Sie 10-15 Tage 1 erwachsene Tiere auf jeweils 8-12 Teller. Beginnen Sie für eine Standardlebensdauer mit ~ 120 Tieren, um sicherzustellen, dass die Stichprobengröße nach Zensurereignissen nicht zu weit unter 100 fällt (z. B. acht Platten mit 15 Tieren = 120 Tiere; 12 Platten mit 10 Tieren = 120 Tiere).
HINWEIS: Im aktuellen Fall sind 10-15 Tiere für die meisten Forscher eine überschaubare Zahl, obwohl sechs Platten mit 20 Tieren auch machbar sind, um die Kosten für Verbrauchsmaterialien zu senken. - Für die ersten 7-8 Tage oder bis Nachkommen nicht mehr sichtbar sind, bewegen Sie erwachsene Tiere alle 1-2 Tage von ihren Nachkommen weg.
HINWEIS: Tiere können jeden zweiten Tag bewegt werden, um Material zu sparen, aber es muss darauf geachtet werden, dass Eier / Larventiere nicht mit dem Erwachsenen übertragen werden, um eine Kontamination erwachsener Populationen mit Nachkommen zu verhindern. In dieser Studie besteht die einfachste Methode darin, Tiere jeden Tag von den Tagen 1-3 zu bewegen, wenn die Eiablage am Maximum ist, und dann für die Tage 5-8 jeden zweiten Tag zu wechseln, wenn die Eiablage minimal ist. Bei dieser Methode ist es nicht zwingend erforderlich, die Übertragung von Eiern / Larventieren während der Tage 1-3 zu verhindern, da die Erwachsenen jeden Tag bewegt werden und Eier / Larven sich nicht in 1 Tag zum Erwachsenenalter entwickeln können. - Nachdem die Tiere aufgehört haben, Nachkommen zu produzieren, bewerten Sie die Lebensspanne jeden zweiten Tag, bis alle Tiere als tot oder zensiert eingestuft wurden. Entfernen Sie alle toten oder zensierten Tiere vom Teller, um Verwirrung zu vermeiden und dasselbe Tier zu erzählen.
HINWEIS: Der Tod wird als Tiere gewertet, die keine Bewegung zeigen, wenn sie sanft mit einem Spitzhacken berührt werden. Zensur wird als Tiere bewertet, die eingetütet werden, vulvale / Darmvorsprünge aufweisen oder an die Seiten der Platte gekrochen sind, wo sie austrocknen.
- Lebensdauer mit chemischer Sterilisation mittels FUDR
- Bereiten Sie NGM-Agar-Platten vor, indem Sie Platten mit 100 μL Bakterien Ihrer Wahl aussäen. Stellen Sie aus Konsistenzgründen sicher, dass das gleiche Bakterium für alle Replikate verwendet wird. Samen Sie 8-12 Platten pro Sorte für Lebensdauerexperimente und zwei bis vier Platten pro Sorte, um Tiere bis zum Erwachsenenalter zu züchten. Lassen Sie die Teller über Nacht trocknen.
- Fügen Sie 100 μL 10 mg / ml FUDR auf die Mitte des Bakterienrasens für die 8-12 Platten hinzu, die für den Lebensdauerassay verwendet werden. Denken Sie daran, zwei bis vier Platten ohne FUDR als Starterplatten zu belassen, damit Tiere erwachsen werden können. Lassen Sie die Teller über Nacht trocknen.
ACHTUNG: FUDR blockiert die DNA-Synthese, und daher wird empfohlen, beim Umgang Handschuhe zu tragen. - Sammeln Sie eine synchronisierte Population von C. elegans mit einem Standard-Bleichassay, wie in den Schritten 1.3 und 1.4 beschrieben.
HINWEIS: Diese Tiere müssen auf Tellern ohne FUDR gezüchtet werden, da FUDR dazu führt, dass Tiere verhaften / sterben. - Bewegen Sie 10-15 Tage 1 erwachsene Tiere auf jeweils 8-12 Platten, die FUDR enthalten. Beginnen Sie für eine Standardlebensdauer mit ~ 120 Tieren, um sicherzustellen, dass die Stichprobengröße nach Zensurereignissen nicht zu weit unter 100 fällt (z. B. acht Platten mit 15 Tieren = 120 Tiere; 12 Platten mit 10 Tieren = 120 Tiere).
HINWEIS: Tiere können auch im L4-Stadium auf FUDR verschoben werden, wenn die Bildung von Nachkommen unbedingt vollständig vermieden werden muss, aber Tiere dürfen nicht zu früh bewegt werden, da dies dazu führt, dass Tiere ein höheres Risiko für vulvale / Darmvorsprünge haben und die Zensur erhöhen. - Bewerten Sie die Lebensdauer jeden zweiten Tag, bis alle Tiere als tot oder zensiert eingestuft wurden. Entfernen Sie alle toten oder zensierten Tiere vom Teller, um Verwirrung zu vermeiden und dasselbe Tier zu erzählen.
HINWEIS: Für FUDR-Lebensspannen können alle Nachkommen ignoriert werden, da sie im L1-Stadium verhaftet werden und schließlich sterben.
- Lebensdauer mit temperaturempfindlichen sterilen Mutanten
- Bereiten Sie NGM-Agar-Platten vor, indem Sie Platten mit 100 μL Bakterien Ihrer Wahl aussäen. Stellen Sie aus Konsistenzgründen sicher, dass das gleiche Bakterium für alle Replikate verwendet wird. Samen Sie 8-12 Platten pro Stamm für Lebensdauerexperimente und 2-4 Platten pro Sorte, um Tiere bis zum Erwachsenenalter zu züchten. Lassen Sie die Teller über Nacht trocknen.
- Sammeln Sie eine synchronisierte Population von C. elegans mit einem Standard-Bleichassay, wie in den Schritten 1.3 und 1.4 beschrieben. Denken Sie daran, Tiere bei der restriktiven Temperatur von 25 ° C zu züchten, um sicherzustellen, dass die Tiere steril sind.
- Bewegen Sie 10-15 Tage 1 erwachsene Tiere auf jeweils 8-12 Teller. Beginnen Sie für eine Standardlebensdauer mit ~ 120 Tieren, um sicherzustellen, dass die Stichprobengröße nach Zensurereignissen nicht zu weit unter 100 fällt (z. B. acht Platten mit 15 Tieren = 120 Tiere; 12 Platten mit 10 Tieren = 120 Tiere).
- Bewerten Sie die Lebensdauer jeden zweiten Tag, bis alle Tiere als tot oder zensiert eingestuft wurden. Entfernen Sie alle toten oder zensierten Tiere vom Teller, um Verwirrung zu vermeiden und dasselbe Tier zu erzählen.
HINWEIS: Beim Umgang mit kurzlebigen Belastungen wird empfohlen, die Lebensdauer jeden Tag zu bewerten, da die Lebensdauer bei 25 ° C viel kürzer ist und somit der Dynamikbereich begrenzt ist. Nach der Erfahrung der Autoren können Tiere nach Tag 2 wieder auf 20 ° C verschoben werden, und Tiere bleiben steril, wenn es vorzuziehen ist, die Lebensdauer bei 20 ° C zu bewerten.
3. Messung der Gesundheitsspanne bei C. elegans
- Messungen des Bewegungsverhaltens durch Thrashing
- Sammeln Sie eine synchronisierte Population von C. elegans mit einem Standard-Bleichassay, wie in den Schritten 1.3 und 1.4 beschrieben.
- Bewegen Sie eine kleine Kolonie erwachsener Würmer des Tages 1 auf eine NGM-Agar-Platte unter einem Sezierbereich auf 10-20 μL M9-Lösung. 10-15 Tiere werden als überschaubare Anzahl von Tieren empfohlen.
- Konzentrieren Sie sich jeweils auf einen Wurm und zählen Sie, wie oft die Probe in 15 s von einer konkaven zu einer konvexen Formation wechselt. Verwenden Sie einen Handzähler und einen Timer, damit der Fokus für die Dauer des Assays auf den Wurm gelegt werden kann.
HINWEIS: Ein Video der Platte kann für eine gründlichere / einfachere Analyse aufgezeichnet werden. Zum Beispiel sind Standard-Mikroskop-Okularaufsätze für die meisten Smartphones und Digitalkameras erhältlich ($ 15- $ 30), und diese sind eine großartige Option für Video-Thrashing zu niedrigen Kosten. - Wiederholen Sie Schritt 3.1.3 für die anderen Würmer in der Flüssigkeit, wobei die Gesamtmotilitätsrate für 10-15 Würmer gemittelt wird. Für einen höheren Stichprobenumfang wiederholen Sie die Schritte 3.1.2-3.1.4.
- Altern Sie Würmer auf das gewünschte Alter. Ähnliche Methoden für Lebensdauer-Assays, die in den Schritten 2.1-2.3 beschrieben sind, können für die Alterung von Würmern verwendet werden. Wiederholen Sie die Schritte 3.1.2-3.1.4, um das Thrashing im gewünschten Alter zu untersuchen.
HINWEIS: Eine alternative Methode für Schritt 3.1.2 besteht darin, ~ 30 μL oder mehr M9-Lösung zu einer Gruppe von Würmern auf einer Platte hinzuzufügen. Dies spart Zeit von der manuellen Übertragung von Würmern, obwohl es aufgrund der zufälligen Chance, wo sich die Würmer auf einer einzigen Platte befinden, keine Garantie dafür gibt, dass eine Gruppe von Würmern an einem einzigen Punkt auf der Platte verbleibt.
- Messungen der Fruchtbarkeit (Eierzahl) bei C. elegans
- Sammeln Sie eine synchronisierte Population von C. elegans mit einem Standard-Bleichassay, wie in den Schritten 1.3 und 1.4 beschrieben. Die Assays für die Eierzahl beginnen im L4-Stadium, das ~ 1 Tag vor dem Erwachsenenalter von Tag 1 liegt (~ 3 Tage bei 15 ° C oder ~ 2 Tage bei 20 ° C nach dem L1-Arrest).
- Heben Sie L4-Würmer auf separaten NGM-Agar-Platten hervor, die mit Bakterien ihrer Wahl gesät sind. Es wird empfohlen, ~ 10-15 Tiere für einen Fruchtbarkeitstest zu verwenden.
HINWEIS: Es wird empfohlen, die Bakterien der Wahl um 50% (dh keine gesättigte Kultur) zu verdünnen, um die Sichtbarkeit der Eier im Bakterienrasen zu verbessern. - Lassen Sie die Tiere über Nacht bei 20 ° C wachsen. Stellen Sie sicher, dass eine neu gesäte Charge von Tellern für den nächsten Tag bereit ist.
- Am Tag 1 des Erwachsenenalters übertragen Sie erwachsene Würmer auf frische NGM-Agar-Platten, die mit den verdünnten Bakterien ihrer Wahl gesät sind.
HINWEIS: Es wird empfohlen, frisch ausgesäte Platten zu verwenden oder die Platten bis zur Verwendung bei 4 ° C zu lagern, um dicke bakterielle Rasenflächen zu vermeiden. - Zählen Sie die Gesamtzahl der Eier, die auf jede NGM-Agarplatte gelegt werden.
HINWEIS: Um das Scannen der Platte zu erleichtern, kann ein Gitter auf den Deckel einer Platte gezeichnet und unter die Platte gelegt werden, die für Eier bewertet wird. Die Platte kann dann entlang der Gitterlinien gescannt werden, um die Orientierung beizubehalten, während die Platte bewegt wird, und um eine erneute Auszählung von Eiern zu verhindern. - Wiederholen Sie die Schritte 3.2.4-3.2.5 für 7-8 Tage oder bis Eier nicht mehr auf dem Teller sichtbar sind.
HINWEIS: Für die Tage 1-3, an denen die Eiablageraten hoch sind, wird empfohlen, die Tiere mindestens alle 12 Stunden zu bewegen und die Anzahl der Eier zweimal täglich zu untersuchen. Dies erhöht jedoch den Arbeitsaufwand und die Kosten für Verbrauchsmaterialien, so dass das Bewegen von Tieren und Messungen auf einmal pro Tag beschränkt werden kann, aber es muss darauf geachtet werden, dass alle Eier und geschlüpften Tiere ordnungsgemäß gezählt werden. Alle geschlüpften Tiere werden für die Zwecke dieses Assays als Eier gezählt.
- Messung der Brutgröße (Entwicklung) von C. elegans Nachkommen
- Sammeln Sie eine synchronisierte Population von C. elegans mit einem Standard-Bleichassay, wie in den Schritten 1.3 und 1.4 beschrieben. Die Assays für die Brutgröße beginnen im L4-Stadium, das ~ 1 Tag vor dem Erwachsenenalter von Tag 1 liegt (~ 3 Tage bei 15 ° C oder ~ 2 Tage bei 20 ° C nach L1-Arrest).
- Heben Sie L4-Würmer auf separaten NGM-Agar-Platten hervor, die mit Bakterien ihrer Wahl gesät sind. Es wird empfohlen, ~ 10-15 Tiere für einen Fruchtbarkeitstest zu verwenden.
- Lassen Sie die Tiere über Nacht bei 20 ° C wachsen. Stellen Sie sicher, dass eine neu gesäte Charge von Tellern für den nächsten Tag bereit ist.
- Am Tag 1 des Erwachsenenalters übertragen Sie erwachsene Würmer auf frische NGM-Agar-Platten, die mit Bakterien ihrer Wahl besät sind.
- Alle 12-24 Stunden (2x täglich oder 1x täglich) werden erwachsene Würmer für 7-8 Tage auf frische NGM-Agar-Platten übertragen, die mit Bakterien ihrer Wahl ausgesät sind, oder bis Nachkommen nicht mehr sichtbar sind. Bewahren Sie alle Eierteller bei 20 °C auf.
- Wiederholen Sie Schritt 3.3.5 für 7-8 Tage oder bis Nachkommen nicht mehr sichtbar sind. Bewahren Sie alle Eierteller bei 20 °C auf.
HINWEIS: Nachkommendeplatten können auch bei 15 ° C gelagert werden, um die Zeit zu verlängern, bevor sie bewertet werden müssen. - Zählen Sie zwei Tage nach der Übertragung von Würmern die entwickelten Nachkommen auf den Platten. Zählen Sie sich entwickelnde Würmer im L4-Stadium (dh 2 Tage nach dem Schlüpfen bei 20 ° C) oder früher, um sicherzustellen, dass die F2-Generation (dh Nachkommen von Nachkommen) die Ergebnisse nicht durcheinander bringt. Zählen Sie alle Würmer, die am Leben sind.
- Entfernen Sie alle Würmer von der Platte, während sie gezählt werden. Pflegen Sie die Platten für weitere 1-2 Tage, bevor Sie sie erneut bewerten, um sicherzustellen, dass Tiere mit verzögertem Schlüpfen / Entwicklung nicht übersehen werden.
- Wiederholen Sie Schritt 3.3.7 für jeden gesammelten Eierlegeteller.
HINWEIS: Die Brutgrößen-Assays können in Verbindung mit dem Eierzählungsassay (Schritt 3.2) durchgeführt werden, um den Arbeitsaufwand und die Kosten für Verbrauchsmaterialien zu minimieren, indem zwei Datensätze aus einem Experiment gesammelt werden. Dies ermöglicht auch einen direkten Vergleich der Brutgröße und der Eierzahl innerhalb derselben Tiere.
4. Messung der Stressresilienz bei C. elegans
- Messungen der ER-Stresssensitivität mit Tunicamycin
- Bereiten Sie NGM-Agar-Platten vor, indem Sie Platten mit Tunicamycin (siehe Schritt 1.1.7, HINWEIS) mit 100 μL Bakterien Ihrer Wahl aussäen.
ACHTUNG: Beim Umgang mit Tunicamycin sollten Handschuhe getragen werden. - Stellen Sie aus Konsistenzgründen sicher, dass das gleiche Bakterium für alle Replikate verwendet wird. Samen Sie 8-12 Tunicamycin-Platten pro Stamm für Überlebenstests und zwei bis vier Platten ohne Tunicamycin pro Stamm, um Tiere bis zum Erwachsenenalter zu züchten. Lassen Sie die Teller über Nacht trocknen.
- Sammeln Sie eine synchronisierte Population von C. elegans mit einem Standard-Bleichassay, wie in den Schritten 1.3 und 1.4 beschrieben.
HINWEIS: Tiere müssen bis zum Tag 1 des Erwachsenenalters auf Tellern ohne Tunicamycin gezüchtet werden, da Tiere auf Tunicamycin festhalten / sterben. - Bewegen Sie 10-15 Tage 1 erwachsene Tiere auf jeweils 8-12 Teller. Für einen Standard-Überlebensassay beginnen Sie mit ~ 120 Tieren, um sicherzustellen, dass die Stichprobengröße nach Zensurereignissen nicht zu weit unter 100 fällt (z. B. acht Platten mit 15 Tieren = 120 Tiere; 12 Platten mit 10 Tieren = 120 Tiere).
HINWEIS: Ähnlich wie FUDR-Assays können Tunicamycin-Überlebensassays durchgeführt werden, ohne Tiere zu bewegen, da Tunicamycin den Tod / den Stillstand von L1-Tieren verursacht. Bei der Durchführung einer DMSO-Kontrolle entwickeln sich jedoch Nachkommen auf DMSO-Platten, so dass Tiere täglich bewegt werden müssen oder eine Sterilisationstechnik erforderlich ist (identische Methoden, die in Abschnitt 2 für Lebensspannen verwendet werden, können für Überlebensassays verwendet werden). - Überlebensassays werden ähnlich wie die Lebensdauer bewertet. Entfernen Sie alle toten oder zensierten Tiere vom Teller, um Verwirrung zu vermeiden und dasselbe Tier zu erzählen.
HINWEIS: Obwohl es möglich ist, Tiere jeden zweiten Tag zu bewerten, da der Tod unter Tunicamycin schnell eintritt, wird empfohlen, täglich Überlebensassays zu bewerten.
- Bereiten Sie NGM-Agar-Platten vor, indem Sie Platten mit Tunicamycin (siehe Schritt 1.1.7, HINWEIS) mit 100 μL Bakterien Ihrer Wahl aussäen.
- Messungen der mitochondrialen/oxidativen Stresssensitivität mit Paraquat
- Herstellung von NGM-Agarplatten durch Aussaat von paraquathaltigen Platten (siehe Schritt 1.1.7; HINWEIS) mit 100 μL Bakterien der Wahl.
ACHTUNG: Beim Umgang mit Paraquat sollten Handschuhe getragen werden, da dies eine Gefahr für die Umwelt darstellt. Erkundigen Sie sich bei der Umweltgesundheit und -sicherheit der Institution nach den Anforderungen an die Entsorgung, da viele Forschungseinrichtungen spezifische Anweisungen zur Entsorgung von Umweltgefahren benötigen. - Stellen Sie aus Konsistenzgründen sicher, dass das gleiche Bakterium für alle Replikate verwendet wird. Samen Sie 8-12 Platten pro Stamm für Überlebenstests und zwei bis vier Platten ohne Paraquat pro Sorte, um Tiere bis zum Erwachsenenalter zu züchten. Lassen Sie die Teller über Nacht trocknen.
- Sammeln Sie eine synchronisierte Population von C. elegans mit einem Standard-Bleichassay, wie in den Schritten 1.3 und 1.4 beschrieben.
HINWEIS: Denken Sie daran, Tiere bis zum 1. Tag des Erwachsenenalters auf Tellern ohne Paraquat zu züchten. Es ist jedoch notwendig, eine Sterilisationstechnik durchzuführen oder Erwachsene von Nachkommen wegzubewegen, da sich einige Tiere auf Paraquatplatten bis zum Erwachsenenalter entwickeln können (siehe Schritte 2.2-2.3). - Bewegen Sie 10-15 Tage 1 erwachsene Tiere auf jeweils 8-12 Teller. Für einen Standard-Überlebensassay beginnen Sie mit ~ 120 Tieren, um sicherzustellen, dass die Stichprobengröße nach Zensurereignissen nicht zu weit unter 100 fällt (z. B. acht Platten mit 15 Tieren = 120 Tiere; 12 Platten mit 10 Tieren = 120 Tiere).
- Überlebensassays werden ähnlich wie die Lebensdauer bewertet. Entfernen Sie alle toten oder zensierten Tiere vom Teller, um Verwirrung zu vermeiden und dasselbe Tier zu erzählen.
HINWEIS: Obwohl es möglich ist, Tiere jeden zweiten Tag zu bewerten, da der Tod am Paraquat schnell eintritt, wird empfohlen, täglich Überlebensassays zu bewerten. Dies gilt insbesondere für die Verwendung von glp-4 (bn2) - Tieren, die bei 25 ° C gezüchtet werden, da der Tod sehr schnell eintritt.
- Herstellung von NGM-Agarplatten durch Aussaat von paraquathaltigen Platten (siehe Schritt 1.1.7; HINWEIS) mit 100 μL Bakterien der Wahl.
- Messungen der Hitzestressempfindlichkeit (Thermotoleranz) bei erhöhten Temperaturen
- Sammeln Sie eine synchronisierte Population von C. elegans mit einem Standard-Bleichassay, wie in den Schritten 1.3 und 1.4 beschrieben.
- Vorwärmen Sie NGM-Agar-Platten auf 37 ° C, bevor Sie Tiere auf Platten bringen, indem Sie die Platten für mindestens 1 Stunde in einen 37 ° C-Inkubator legen.
- Bewegen Sie 10-15 Tage 1 erwachsene Tiere auf jeweils vier bis sechs vorgewärmte Platten. Für eine Standard-Thermotoleranz beginnen Sie mit ~ 60 Tieren (z. B. vier Platten mit 15 Tieren = 60 Tiere; sechs Platten mit 10 Tieren = 60 Tieren)
- Legen Sie die Tiere in einen 37 ° C-Inkubator und bewerten Sie alle 2 Stunden den Tod. Der Tod ist definiert als Tiere, die keine Bewegung zeigen, wenn sie sanft mit einem Spitzhacken berührt werden. Entfernen Sie alle toten oder zensierten Tiere vom Teller, um Verwirrung zu vermeiden und dasselbe Tier zu erzählen.
- Stellen Sie sicher, dass die Platten für die kürzest mögliche Zeit aus dem 37 ° C-Inkubator entfernt werden, da Platten, die während der Bewertung über einen längeren Zeitraum bei Umgebungstemperatur belassen werden, die Thermotoleranzergebnisse verändern.
HINWEIS: Es wird empfohlen, jeweils nur eine Sorte herauszuziehen, um zu punkten, da sich die Temperatur des Agars in der Zeit, die benötigt wird, um eine Sorte zu erzielen, nicht dramatisch ändern sollte. - Die mediane Thermotoleranz wird im Allgemeinen in 7-9 h erreicht; Stellen Sie also einen ordnungsgemäßen Assay bei 7 h, 9 h und 11 h sicher.
HINWEIS: Während 1-5 h aufgrund der Variabilität von Inkubatoren, der Dicke der Platten und anderer Störfaktoren in jedem Labor übersprungen werden können, ist es wichtig, dass das Timing in jedem Labor sorgfältig titriert wird, wenn Zeitpunkte übersprungen werden sollen. Siehe Referenz 44 für eine vollständige Anleitung zur Thermotoleranz. - Alternativ können Sie den Thermotoleranztest bei 34 °C statt bei 37 °C durchführen.
HINWEIS: Die mediane Thermotoleranz bei 34 °C tritt viel später auf (10-14 h in dieser Studie), was es ermöglicht, Thermotoleranz-Assays spät in der Nacht (in einem Inkubator von 34 °C) vorzubereiten und die Bewertung am nächsten Tag früh zu beginnen. Dies ermöglicht ~ 8 h fortgesetztes Scoring anstelle der typischen 12-Stunden-Periode, die für einen Thermotoleranztest von 37 ° C erforderlich ist.
Ergebnisse
C. elegans sind ein hervorragender Modellorganismus für die Alterungsforschung, da eine große Mehrheit der Alterungsmechanismen beim Menschen erhalten bleibt. Wichtig ist, dass sie sehr niedrige Kosten für Wartung und Experimente mit minimalen Anforderungen an Ausrüstung und Verbrauchsmaterialien haben, was sie zu einem begehrten Modellsystem für Institutionen mit begrenzten Mitteln macht. Darüber hinaus macht eine Fülle von einfachen Assays mit flachen Lernkurven sie zu einem ausgezeichneten System für den jüngsten Ermittler mit wenig bis gar keiner Erfahrung. All diese Faktoren in Kombination mit der leistungsstarken Genetik von C. elegans , einschließlich der Leichtigkeit der Genombearbeitung, Tausenden von verfügbaren Mutanten und transgenen Tieren zu nominalen Kosten und verfügbaren RNAi-Bibliotheken für den genetischen Knockdown von praktisch jedem Gen, machen sie zu einem idealen System für Studenteneinrichtungen. Hier werden einige der kostengünstigsten Methoden zur Untersuchung des Alterns bei C. elegans untersucht, wobei der Schwerpunkt in erster Linie auf Assays mit minimalen Ausrüstungs- und Verbrauchsmaterialkosten sowie flachen Lernkurven liegt. Tatsächlich wurden die gesamten Protokolle und die Datenerhebung von Nachwuchsforschern mit < 5 Monaten Forschungserfahrung, meist Studenten, geschrieben / durchgeführt.
Langlebigkeitsstudien bei C. elegans sind aufgrund der kurzen Lebensdauer der Tiere, die zwischen 14 und 20 Tagen liegt, sehr einfach. Wichtig ist, dass die Lebensdauerassays hoch standardisiert sind und nur einen Inkubator, ein Standard-Dissektionsmikroskop, einen Standard-Wurmwähler und Verbrauchsmaterialien für die Herstellung von NGM-Agar-Platten erfordern. Der vielleicht kostenintensivste Aspekt von Lebensdauermessungen in C. elegans sind die erforderlichen Verbrauchsmaterialien. Dies liegt daran, dass C. elegans Hermaphroditen sind, die sich selbst befruchten; Daher müssen Erwachsene, die für Langlebigkeitstests verfolgt werden, täglich von den Nachkommen wegbewegt werden. Tiere können jedoch sterilisiert werden, indem sie FUDR ausgesetzt werden oder Mutanten verwenden, wie z. B. die temperaturempfindliche keimbahnlose glp-4 (bn2) -Mutante, die bei unerschwinglichen 25 ° C angebaut wird, um die Menge der erforderlichenVerbrauchsmaterialien um 30,31,32 zu reduzieren. Hier wurden Lebensdauer-Assays mit FUDR oder mit den keimbahnlosen Mutanten glp-4(bn2) durchgeführt, die ähnliche Ergebnisse zeigen wie Standardlebensdauern bei nicht sterilen Tieren. Während die Lebensspanne des Wildtyps aufgrund der Auswirkungen von FUDR45 oder Wachstum bei 25 °C auf die Lebensdauernicht identisch ist 2, zeigt das kurzlebige hsf-1-Knockdown-Tier zuverlässig eine signifikante Abnahme der Lebensdauer für alle Bedingungen (Abbildung 1). HSF-1 kodiert den Hitzeschockfaktor-1-Transkriptionsfaktor, der an der Regulation der thermischen Stressreaktion beteiligt ist, und sein Knockdown führt zu einer signifikanten Abnahme der Lebensdauer38,46.
Während die Langlebigkeit ein wichtiger Faktor ist, der in der Biologie des Alterns zu berücksichtigen ist, korreliert die Langlebigkeit oft nicht mit einer erhöhten Gesundheit, selbst bei C. elegans47. Daher bieten wir als komplementären Ansatz mehrere Methoden zur Messung der Gesundheit von Organismen an, einschließlich reproduktiver Gesundheit, Bewegungsverhalten und Stressresilienz. Die reproduktive Gesundheit kann auf zwei Arten gemessen werden. Erstens geben Messungen der Eierzahl eine direkte Messung davon, wie viele Eier von einem einzigen selbstbefruchtenden Hermaphroditen gelegt werden. Da Tiere jedoch mehr Eizellen als Spermien produzieren, werden auch einige unbefruchtete Eier gelegt, die niemals lebensfähige Nachkommen hervorbringen würden48. Um die wahre Fortpflanzungsfähigkeit eines Tieres besser zu verstehen, liefern Messungen der Brutgröße ein Maß dafür, wie viele lebensfähige Nachkommen produziert werden. Oft kann eine erhöhte Stressresilienz tatsächlich die Fortpflanzungsfähigkeit verringern, möglicherweise aufgrund der inhärenten Wirkung von wahrgenommenem Stress auf die Fortpflanzung49. In ähnlicher Weise wird bei hsf-1-Überexpressionstieren im Vergleich zu Wildtypkontrollen eine signifikante Abnahme sowohl der Anzahl der gelegten Eier als auch der Brutgröße festgestellt (Abbildung 2A, B). Tatsächlich weisen einige hsf-1-Überexpressionstiere eine vollständige Sterilität auf, was darauf hindeutet, dass die reproduktive Gesundheit umgekehrt mit der Langlebigkeit korreliert werden kann.
Während die reproduktive Gesundheit für das Verständnis der Keimbahngesundheit, der funktionellen Meiose und der Fortpflanzungsfähigkeit wichtig ist, gibt es im Allgemeinen keine direkte Korrelation zwischen Langlebigkeit und Brutgröße50. Somit wird als komplementärer Ansatz das Bewegungsverhalten als Goldstandardmethode zur Bestimmung der Lebensspanne von C. elegans im Altervon 51 Jahren angeboten. Es gibt viele Methoden, um das Bewegungsverhalten zu messen, aber die meisten Methoden erfordern ausgeklügelte Kameras, Tracking-Software oder teure Chemikalien. Im Gegensatz dazu erfordern Thrashing-Assays praktisch keine Ausrüstung, die über das hinausgeht, womit ein Standardlabor von C. elegans ausgestattet ist: Seziermikroskop, Wurmpicker, Pipette und Verbrauchsmaterialien zur Herstellung von NGM-Agar-Platten. Die Thrashing-Raten bieten eine zuverlässige Methode zur Messung der Gesundheitsspanne während des Alterns, gemessen an einer signifikanten Abnahme des Thrashings bei alten Tieren im Vergleich zu Jungtieren (Abbildung 2C).
Schließlich ist das Überleben von Stress-Assays eine zusätzliche physiologische Messung der Resilienz. Die Fähigkeit, Stressreaktionen zu aktivieren, nimmt im Allgemeinen während des Alterungsprozesses ab, wodurch Tiere weniger widerstandsfähig und anfälliger für Stress werden. So kann Stressresilienz als zuverlässiger Proxy für die Gesundheit des Organismus verwendet werden. Hier werden Methoden zur Messung der Empfindlichkeit gegenüber 1) ER-Stress als Reaktion auf die Tunicamycin-Exposition angeboten, ein chemischer Wirkstoff, der die N-verknüpfte Glykosylierung blockiert und zur Akkumulation von fehlgefalteten Proteinen in der Notaufnahme führt; 2) mitochondrialer/oxidativer Stress durch Exposition gegenüber Paraquat, einem chemischen Mittel, das die Superoxidbildung in Mitochondrien induziert; und 3) thermische Belastung durch Einwirkung erhöhter Temperaturen. Bei Tunicamycin- und Paraquat-Assays wird das Medikament während der Plattenproduktion in die NGM-Agar-Platte eingearbeitet. Bei hohen Konzentrationen von Tunicamycin entwickeln sich Nachkommen im Allgemeinen nicht, und daher müssen keine Sterilisationstechniken verwendet werden. Das hier vorgestellte Protokoll empfiehlt 25 ng / μL als Endkonzentration von Tunicamycin, aber für diejenigen mit begrenzten Mitteln zeigen 10 ng / μL auch eine signifikante Verringerung des Überlebens (Abbildung 3A). Beide Konzentrationen begrenzen die Entwicklung von Nachkommen, und daher sind keine Sterilisationsmethoden erforderlich, obwohl die DMSO-Kontrolle eine Sterilisationstechnik oder die Bewegung von Tieren auf neue Platten erfordert. Dies liegt daran, dass die Tunicamycin-Toxizität die Entwicklung von Nachkommen verhindert, aber DMSO ist praktisch ungiftig, was es den Nachkommen ermöglicht, sich vollständig zu entwickeln, wenn sie auf Tunicamycin angebaut werden.
Für Paraquat-Assays ist entweder eine Sterilisationstechnik oder eine Bewegung von Tieren erforderlich, da die Paraquat-Behandlung nicht verhindert, dass sich Nachkommen bis ins Erwachsenenalter entwickeln. Hohe Paraquatspiegel (4 mM) verkürzen die Lebensdauer signifikant, während niedrige Paraquatspiegel (0,25 mM) die Lebensdauer aufgrund einer hormetischen Wirkung erhöhen (Abbildung 3B), was mit zuvor veröffentlichten Ergebnissenübereinstimmt 52. Schließlich erfordern Thermotoleranz-Assays nur einen Inkubator, der 30-37 °C erreichen kann, und es sind keine zusätzlichen Reagenzien erforderlich. Die Überexpression von hsf-1 erhöht die Thermotoleranz bei 37 °C (Abbildung 3C), wie zuvor veröffentlicht53. Wie andere jedoch bereits und aus den vorliegenden Daten gezeigt haben, ist das Hauptproblem bei Thermotoleranz-Assays ihre Variabilität. Viele Faktoren können zur Variabilität innerhalb von Thermotoleranztests beitragen, einschließlich der Unterschiede zwischen Inkubatoren und der Zeit, die Tiere außerhalb des Inkubators verbringen, während sie jede Stunde die Thermotoleranz bewerten. Eine ausführliche Richtlinie zur Thermotoleranz finden Sie in der Referenz 41.
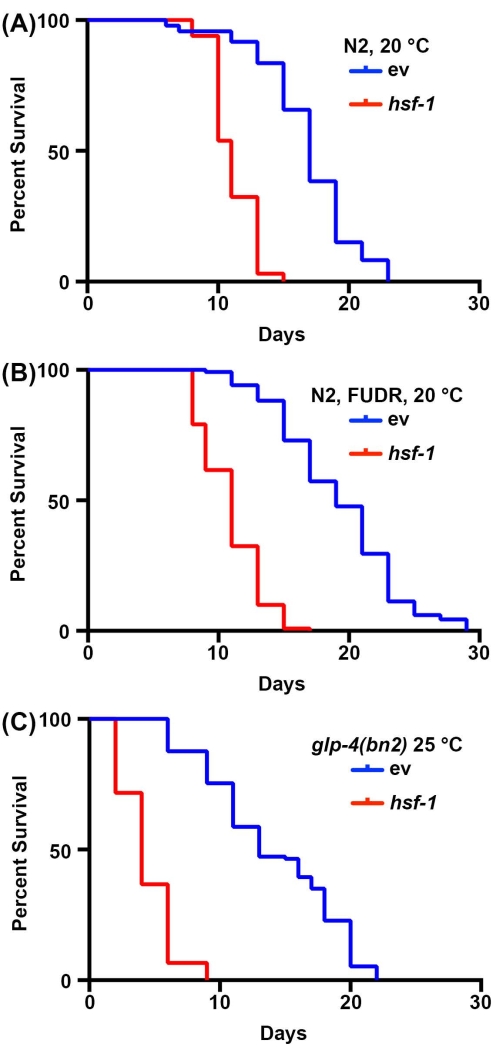
Abbildung 1: Vergleich der Lebensdauermessungen mit und ohne Sterilisation. (A) Lebensdauer von Wildtyp-N2-Nematoden, die auf NGM-Agarplatten gezüchtet werden, die mit leeren Vektor- (ev) oder hsf-1-RNAi-Bakterien bei 20 °C ausgesät sind. Die Tiere wurden an den Tagen 1, 3, 5 und 7 des Erwachsenenalters von den Nachkommen weggebracht. (B) Lebensdauer von Wildtyp-N2-Nematoden, die auf NGM-Agar-FUDR-Platten gezüchtet werden, die mit leeren Vektor- (ev) oder hsf-1-RNAi-Bakterien bei 20 °C ausgesät sind. Die Tiere wurden auf Standard-EV- oder HSF-1-RNAi-Platten bis zum Erwachsenenalter gezüchtet und dann am Tag 1 des Erwachsenenalters auf FUDR-Platten umgestellt. (C) Lebensdauer von glp-4(bn2)-mutierten Tieren, die auf NGM-Agarplatten gezüchtet werden, die mit leerem Vektor (ev) oder hsf-1 RNAi bei 25 °C gesät sind. Unter allen Bedingungen wurden die Tiere alle 2 Tage für den Tod gewertet, bis alle Tiere als tot oder zensiert registriert wurden. Tiere mit Absackung, Vorsprung oder Explosion der Vulva oder solche, die an den Seiten der Platten krochen und ausgetrocknet waren, wurden zensiert. Alle Statistiken wurden mit Log-Rank Mantel-Cox-Tests durchgeführt und sind in Tabelle 2 zu finden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
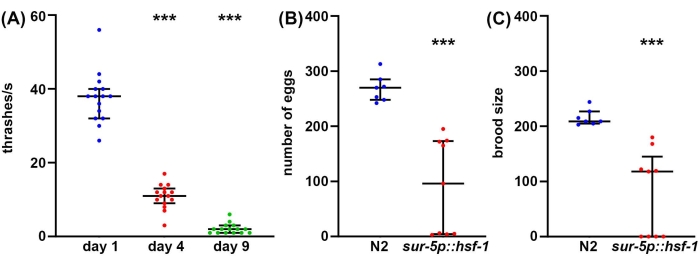
Abbildung 2: Eierzahl, Brutgröße und Thrashing als Messungen der Gesundheitsspanne . (A) Thrashing-Assays wurden an glp-4(bn2)- mutierten Tieren durchgeführt, die auf NGM-Agar-Platten gezüchtet wurden, die mit leerem Vektor bei 25 °C an Tag 1 (blau), Tag 4 (rot) und Tag 9 (grün) Tieren gesät wurden. Thrashing wurde bei Tieren in M9-Lösung auf einer NGM-Agar-Platte bewertet, Video mit einer Standard-Smartphone-Kamera aufgezeichnet, die auf einem Okular eines Standard-Sezierzielfernrohrs montiert war, und Thrashing wurde in Zeitlupe für Genauigkeit bewertet. n = 15 Tiere pro Zustand. (B) Die Eierzahl wurde bei Tieren des Wildtyps N2 (blau) und sur-5p::hsf-1 (rot) gemessen. Die Tiere wurden bei 20 ° C gezüchtet und auf frische Teller gebracht, und die Eier wurden alle 12 Stunden gezählt. Die Gesamtzahl der gelegten Eier wurde summiert. n = 7 Tiere für Wildtyp und 9 Tiere für sur-5p::hsf-1. (C) Brutuntersuchungen wurden an denselben Tieren gemessen wie (B), bei denen Eier 2 Tage lang bei 20 °C angebaut wurden, um das Schlüpfen zu ermöglichen, und alle geschlüpften Eier gezählt wurden. = p < 0,001, berechnet mit nicht-parametrischen Mann-Whitney-Tests. Jeder Punkt repräsentiert ein einzelnes Tier, und Linien stellen den Median- und Interquartilsbereich dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
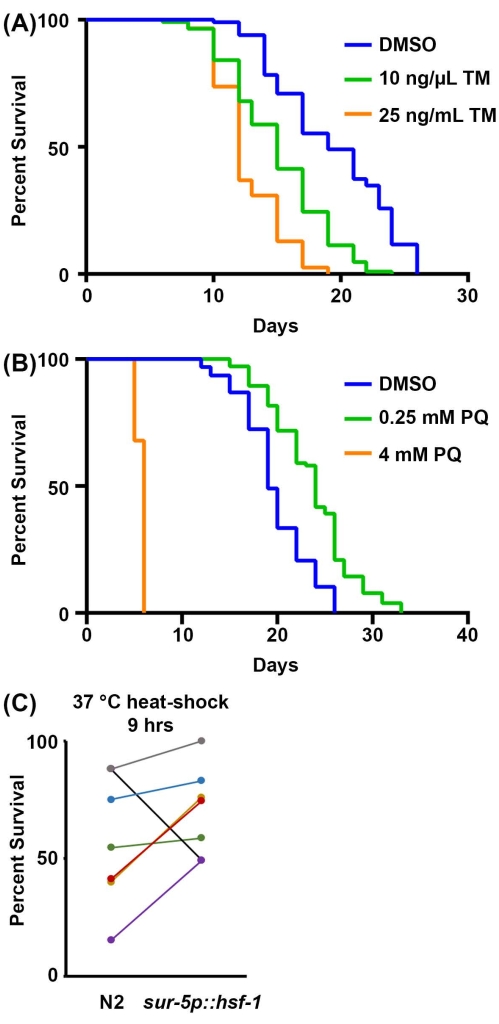
Abbildung 3: Stressresistenz als Stellvertreter für die Gesundheit des Organismus. (A) Überlebenstest von N2-Tieren, die auf dem leeren Vektor RNAi-Bakterien bei 20 °C gezüchtet wurden. Die Tiere wurden am 1. Tag des Erwachsenenalters auf Platten mit entweder 1% DMSO, 10 ng/μL Tunicamycin (TM) oder 25 ng/μL TM gebracht. (B) Überlebenstest von N2-Tieren, die auf dem leeren Vektor RNAi-Bakterien bei 20 °C gezüchtet wurden. Die Tiere wurden von der Luke an auf Platten gezüchtet, die entweder Wasser, 0,25 mM Paraquat (PQ) oder 4 mM PQ enthielten. Für A-B wurden alle 2 Tage Tiere für den Tod bewertet, bis alle Tiere als tot oder zensiert registriert wurden. Tiere mit Absackung, Vorsprung oder Explosion der Vulva oder solche, die an den Seiten der Platten krochen und ausgetrocknet waren, wurden zensiert. Alle Statistiken wurden mit Log-Rank Mantel-Cox-Tests durchgeführt (Tabelle 2). (C) Gepoolte Daten aller 37 °C Thermotoleranz-Assays für Wildtyp-N2-Tiere im Vergleich zur Überexpression von hsf-1 (sur-5p::hsf-1). Die Daten werden als Prozentsatz des Lebendigen zum Zeitpunkt = 9 h eines Thermotoleranztests dargestellt, wobei jede Zeile ein übereinstimmendes Experiment darstellt, das am selben Tag durchgeführt wurde. Die Tiere wurden auf dem leeren Vektor RNAi-Bakterien bei 20 ° C gezüchtet und am Tag 1 des Erwachsenenalters zur Untersuchung auf 37 ° C gebracht. n = 60 Tiere pro Stamm pro Replikat. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Reagenz | Rezept | ||
| Bleichmittellösung | 1,8% (v/v) Natriumhypochlorit, 0,375 M KOH | ||
| Carbenicillin | 100 mg/ml Stammlösung (1000x) in Wasser. Bei 4 °C für bis zu 6 Monate oder -20 °C für Langzeitlagerung lagern | ||
| FUDR | 10 mg/ml Lösung in Wasser. Bei -20 °C lagern. | ||
| IPTG | 1 M Lösung in Wasser. | ||
| Lysogenese Brühe (LB) | In diesem Protokoll wurde kommerzielles LB verwendet (siehe Tabelle der Materialien), aber alle Standard-LB-Hausrezepte mit Bacto-Trypton, Hefeextrakt und NaCl sind ausreichend. | ||
| M9-Lösung | 22 mM KH 2 PO 4 monobasic, 42,3 mM Na2HPO 4, 85,6 mM NaCl,1 mMMgSO 4 | ||
| Nematode Growth Media (NGM) | 1 mM CaCl 2, 5 μg/ml Cholesterin, 25 mM KPO 4 pH 6,0, 1 mM MgSO4,2% (w/v) Agar, 0,25% (w/v) Bacto-Pepton, 51,3 mM NaCl | ||
| NGM RNAi Platten | 1 mM CaCl 2, 5 μg/ml Cholesterin, 25 mM KPO 4 pH 6,0, 1 mM MgSO4,2% (w/v) Agar, 0,25% (w/v) Bacto-Pepton, 51,3 mM NaCl, 1 mM IPTG, 100 μg/ml Carbenicillin/Ampicillin. Bis zu 3 Monate bei 4°C dunkel lagern | ||
| NGM RNAi DMSO | 1 mM CaCl 2, 5 μg/ml Cholesterin, 25 mM KPO 4 pH 6,0, 1 mM MgSO4,2% (w/v) Agar, 0,25% (w/v) Bacto-Pepton, 51,3 mM NaCl, 1 mM IPTG, 100 μg/ml Carbenicillin/Ampicillin; 1% DMSO | ||
| (Kontrolle für Tunicamycin) | |||
| NGM RNAi TM | 1 mM CaCl 2, 5 μg/ml Cholesterin, 25 mM KPO 4 pH 6,0, 1 mM MgSO4,2% (w/v) Agar, 0,25% (w/v) Bacto-Pepton, 51,3 mM NaCl, 1 mM IPTG, 100 μg/ml Carbenicillin/Ampicillin; 1% DMSO, 25 ng/μL Tunicamycin | ||
| Paraquat | 400 mM Lösung in Wasser – sollte frisch zubereitet werden | ||
| Tetracyclin | 10 mg/ml Stammlösung (500x) in 100% Ethanol. Bei -20 °C lagern | ||
| Tunicamycin | 2,5 mg/ml Stammlösung in 100% DMSO. Zur Langzeitlagerung bei -80 °C lagern. Dies ist eine 100-fache Lösung (25 ng / μL Arbeitslösung) | ||
Tabelle 1. Rezepte für Reagenzien und Medien für Protokolle.
| Entsprechendes Abbildungsfeld | Belastung, Behandlung | Mediane Lebensdauer | # Todesfälle/# Insgesamt | p-Wert (Log-Rang) | |
| 1A | N2, Vektor RNAi, 20 °C | 17 | 74/120 | -- | |
| N2, hsf-1 RNAi, 20 °C | 11 | 65/120 | <0,001 | ||
| 1B | N2, Vektor RNAi, FUDR, 20 °C | 19 | 120/120 | -- | |
| N2, hsf-1 RNAi, FUDR, 20 °C | 11 | 116/120 | <0,001 | ||
| 1C | N2, glp-4(bn2), Vektor RNAi, 25 °C | 13 | 115/121 | -- | |
| N2, glp-4(bn2), hsf-1 RNAi, 25 °C | 4 | 120/120 | < 0,001 | ||
| 2A | N2, Vektor RNAi, 20 °C, 1% DMSO | 19 | 85/120 | -- | |
| N2, Vektor RNAi, 20 °C, 10 ng/μL Tunicamycin | 15 | 109/120 | <0,001 | ||
| N2, Vektor RNAi, 20 °C, 25 ng/μL Tunicamycin | 12 | 117/120 | <0,001 | ||
| 2B | N2, Vektor RNAi, 20 °C | 19 | 84/120 | -- | |
| N2, Vektor RNAi, 20 °C, 0,25 mM Paraquat | 24 | 91/120 | <0,001 | ||
| N2, Vektor RNAi, 20 °C, 4 mM Paraquat | 6 | 50/120 | <0,001 | ||
Tabelle 2. Statistiken zur Lebensdauer und Stressresilienz.
Diskussion
Die Lebensdauer, die am einfachsten als die Dauer des Lebens definiert wird, ist in den meisten Organismen ein klares binäres Phänomen - entweder lebt ein Organismus oder nicht. Die Langlebigkeit korreliert jedoch nicht immer mit der Gesundheit eines Organismus. Zum Beispiel gehören mitochondriale Hormesismodelle, bei denen die Exposition gegenüber mitochondrialem Stress die Lebensdauer dramatisch erhöht, im Allgemeinen zu den langlebigsten Tieren, zeigen jedoch ein verkümmertes Wachstum und eine verminderte Stoffwechselfunktion37,54. In ähnlicher Weise zeigen Tiere mit hyperaktiven endoplasmatischen Retikulum-Stressreaktionen auch bestimmte Verhaltensweisen und Phänotypen, die mit einer verminderten Gesundheit korreliert werden können, obwohl sie eine dramatisch verbesserte Proteinhomöostase und Lebensdaueraufweisen 36,49. Schließlich korrelieren viele Langlebigkeitsparadigmen in Modellorganismen, einschließlich erhöhter HSF-1-Funktion55, erhöhter XBP-1-Funktion 56 und veränderter FoxO-Signalgebung57, alle mit einem erhöhten Krebsrisiko, und es ist unbestreitbar, dass eine längere Lebensdauer nicht vorteilhaft ist, wenn sich ein Organismus in einem ständigen Kampf mit Krebs und anderen Gesundheitskrankheiten befindet. Daher kann die Langlebigkeit in der Alterungsbiologie kein eigenständiges Maß sein.
Daher ist das Konzept der Gesundheitsspanne ein wachsendes Feld in der alternden Biologie. Die Gesundheitsspanne, lose definiert als die Lebensphase, in der man gesund ist, ist schwieriger zu bestimmen als die Langlebigkeit. Im Gegensatz zur Langlebigkeit ist das Konzept der "Gesundheit" jedoch kompliziert, da es viele verschiedene Ablesungen der organismischen Gesundheit gibt: Auf der Ebene des Organismus gibt es Muskelfunktion / -stärke, neuronale / kognitive Funktion, reproduktive Gesundheit usw.; Auf zellulärer Ebene gibt es Proteinhomöostase, Lipidhomöostase, Glukosehomöostase, Stoffwechsel usw. Im Jahr 2014 haben alternde Biologen biologische Merkmale des Alterns definitiv mit der strukturierten Definition charakterisiert, dass es etwas sein muss, das während des Alterns natürlich zusammenbricht und experimentell so verändert werden kann, dass experimentelle Exazerbation das Altern beschleunigen und experimentelle Interventionen das Altern verlangsamen sollten. Zu diesen neun Merkmalen des Alterns gehören genomische Instabilität, Telomerabnutzung, epigenetische Veränderungen, Verlust der Proteinhomöostase (Proteostase), Stammzellerschöpfung, veränderte interzelluläre Signalgebung, mitochondriale Dysfunktion, deregulierte Nährstofferfassung und zelluläre Seneszenz58. Seitdem argumentieren zahlreiche Studien, dass andere Faktoren einbezogen werden sollten, einschließlich extrazellulärer Proteine und systemischer Physiologie wie Immunität und Entzündung59. Letztendlich schreibt die komplexe Definition der Gesundheitsspanne vor, dass die Gesundheit des Organismus mit mehreren verschiedenen Methoden gemessen wird.
Daher werden in diesem Manuskript mehrere Methoden vorgestellt, um verschiedene Aspekte der Gesundheitsspanne mit dem Nematodenmodell C. elegans zu messen. Wir untersuchen das Lokomotorverhalten mit Thrashing-Assays, die reproduktive Gesundheit anhand der Eierzahl und der Brutgröße sowie der Stressempfindlichkeit. Tatsächlich ist das Bewegungsverhalten eine Goldstandardmethode zur Messung der Gesundheitsspanne, da Organismen während des Alterns einen signifikanten Verlust an Motilität und Bewegung aufweisen51. Der Verlust des Bewegungsverhaltens kann auf mehrere Merkmale des Alterns zurückgeführt werden, da die Muskelfunktion bei C. elegans von der richtigen Proteostase 60, der mitochondrialen Dysfunktion61 und der Neuronen-Muskel-Signalgebung62 abhängt. Während sich dieses Manuskript auf eine Messung des Bewegungsverhaltens konzentriert, ist es wichtig zu beachten, dass viele andere Methoden existieren, einschließlich der Motilität von Tieren auf einer festen Agarplatte, der Reaktion auf Berührung51 und der Chemotaxis-Assays63. Diese Methoden erfordern jedoch im Allgemeinen ausgefeiltere Aufzeichnungsgeräte, die Verwendung von Wurmverfolgungssoftware oder die Verwendung teurer, gefährlicher oder flüchtiger Chemikalien, die in einigen Forschungsumgebungen unerschwinglich sein können.
Darüber hinaus werden Assays für Eierzahl und Brutgröße als Methode zur Messung der reproduktiven Gesundheit und als die einfachste Methode zur Messung der Zellteilung bei erwachsenen Würmern vorgestellt, da erwachsene Würmer postmitotisch sind und nur Keimzellen und Embryonen innerhalb eines erwachsenen Wurms eine Zellteilung durchlaufen64. Als Maß für die Zellteilung kann die reproduktive Gesundheit für die Alterungsmerkmale der zellulären Seneszenz und Stammzellerschöpfung relevant sein. Die reproduktive Gesundheit kann durch viele Faktoren beeinflusst werden, einschließlich pathogener Infektion65 oder Stressexposition49, obwohl es keine direkte Korrelation zwischen reproduktiver Gesundheit und Langlebigkeit gibt. Tatsächlich zeigen einige langlebige Tiere eine signifikante Abnahme der Brutgröße49, und es ist sogar möglich, dass es eine umgekehrte Korrelation zwischen Langlebigkeit und Brutgröße50 gibt. Dies ist kein spezifisches Phänomen von C. elegans, da bei Menschen 66, Begleithunden67 und Mäusen68 seit langem schädliche Auswirkungen der Fortpflanzung auf die Langlebigkeit beobachtet werden. Dennoch bieten wir Eierzahl und Brutgröße als zuverlässige und kostengünstige Methode zur Messung der reproduktiven Gesundheit mit dem Vorbehalt an, dass die reproduktive Gesundheit möglicherweise nicht mit der Langlebigkeit oder der Gesundheitsspanne korreliert.
Schließlich werden Überlebensassays als indirektes Maß für die Gesundheit des Organismus angeboten. Wichtig ist, dass zelluläre Stressreaktionen, einschließlich der Reaktion auf thermischen Stress69 und ER-Stress35, während des Alterungsprozesses schnell abnehmen und eine direkte Relevanz für das Alterungsmerkmal der Proteostase70,71 haben. Im Gegensatz dazu können hyperaktivierende Stressreaktionen die Lebensdauer signifikant verlängern, indem sie die Widerstandsfähigkeit gegen Stress fördern35,37,38. Während sich diese Studie auf die einfachsten und kostengünstigsten Methoden konzentriert, gibt es eine große Anzahl alternativer Methoden für Stressresilienz-Assays für Thermotoleranz41 und oxidativen Stress66, die jeweils unterschiedliche Geräte und Verbrauchsmaterialien erfordern. Über einfache Expositionsstudien gegenüber Stressoren hinaus können je nach Zugang zu Geräten andere physiologische Methoden durchgeführt werden. Zum Beispiel kann ein extrazellulärer Flussanalysator die mitochondriale Funktion und die Zellatmung überwachen73; Fluoreszenz-Dissektionsmikroskope ermöglichen Messungen von transkriptionellen Reportern zur Aktivierung der Stressantwort20; und hochauflösende zusammengesetzte oder konfokale Mikroskope können verwendet werden, um die Organellenmorphologie mit fluoreszierenden Sonden für Mitochondria74, das endoplasmatische Retikulum 75,76 und das Aktinzytoskelett 77 zu messen.
Als letzte warnende Geschichte für Messungen der Langlebigkeit, während chemische und genetische Methoden zur Sterilisation von Würmern angeboten werden, um die Kosten signifikant zu senken, ist es wichtig zu beachten, dass beide die Lebensdauer direkt beeinflussen können. Zum Beispiel wurde bereits berichtet, dass die Exposition gegenüber FUDR sowohl die Lebensdauer als auch die Thermotoleranz45 beeinflusst. Und während die glp-4 (bn2) -Mutante selbst keine direkten Auswirkungen auf die Lebensdauer hat, ist das Wachstum bei 25 ° C ein leichter Hitzestress33,34 und kann daher die Lebensdauerbeeinflussen 2. Es gibt andere Methoden zur Sterilisation von C. elegans, einschließlich auxinvermittelter Sterilität78 oder alternativer temperaturempfindlicher Spermienmangelmutanten79. Alle Methoden haben jedoch einige Vorbehalte, und es sollte darauf geachtet werden, den am wenigsten schädlichen Assay für die wissenschaftlichen Bedürfnisse jedes Labors zu verwenden. Eine letzte Einschränkung von Langlebigkeitsstudien ist die potenzielle Variabilität, die aufgrund niedriger Stichprobengrößen oder einfach durch einen objektiven Fehler des Prüfarztes auftreten kann. Dies kann umgangen werden, da neue Technologien in automatisierten Lebensdauertechnologien80 geboren werden, aber auch diese Systeme sind teuer und erfordern einige technische und rechnerische Geräte und Fähigkeiten. Letztendlich ist die Sammlung von Methoden, die hier zur Verfügung gestellt werden, ein zuverlässiger Satz von Werkzeugen, die in fast jeder Institution schnell angepasst und erlernt werden können und eine solide Grundlage für die alternde Biologie bieten.
Offenlegungen
Die Autoren erklären keine konkurrierenden finanziellen Interessen.
Danksagungen
G.G. wird von T32AG052374 und R.H.S. von R00AG065200 vom National Institute on Aging unterstützt. Wir danken dem CGC (finanziert vom NIH Office of Research Infrastructure Program P40 OD010440) für die Belastungen.
Materialien
| Name | Company | Catalog Number | Comments |
| APEX IPTG | Genesee | 18-242 | for RNAi |
| Bacto Agar | VWR | 90000-764 | for NGM plates |
| Bacto Peptone | VWR | 97064-330 | for NGM plates |
| Calcium chloride dihydrate | VWR | 97061-904 | for NGM plates |
| Carbenicillin | VWR | 76345-522 | for RNAi |
| Cholesterol | VWR | 80057-932 | for NGM plates |
| DMSO | VWR | BDH1115-1LP | solvent for drugs |
| LB Broth | VWR | 95020-778 | for LB |
| Magnesium sulfate heptahydrate | VWR | 97062-132 | for NGM plates, M9 |
| Paraquat | Sigma-Aldrich | 36541 | for oxidative/mitochondrial stress |
| Potassium Chloride | VWR | 97061-566 | for bleach soluton |
| Potassium phosphate dibasic | VWR | EM-PX1570-2 | for NGM plates |
| Potassium phosphate monobasic | VWR | EM-PX1565-5 | for M9 |
| S7E Dissecting Scope | Leica | 10450840 | Standard dissecting microscope |
| Sodium Chloride | VWR | EM-SX0420-5 | for NGM plates, M9 |
| Sodium hypochlorite | VWR | RC7495.7-32 | for bleach solution |
| Sodium phosphate dibasic | VWR | 71003-472 | for M9 |
| Tetracycline hydrochloride | VWR | 97061-638 | for RNAi |
| Tunicamycin | Sigma-Aldrich | T7765-50MG | for ER stress |
Referenzen
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Klass, M. R. Aging in the nematode Caenorhabditis elegans: major biological and environmental factors influencing life span. Mechanisms of Ageing and Development. 6 (6), 413-429 (1977).
- Friedman, D. B., Johnson, T. E. A mutation in the age-1 gene in Caenorhabditis elegans lengthens life and reduces hermaphrodite fertility. Genetics. 118 (1), 75-86 (1988).
- Kenyon, C., Chang, J., Gensch, E., Rudner, A., Tabtiang, R. A C. elegans mutant that lives twice as long as wild type. Nature. 366 (6454), 461-464 (1993).
- Lithgow, G. J., White, T. M., Melov, S., Johnson, T. E. Thermotolerance and extended life-span conferred by single-gene mutations and induced by thermal stress. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7540-7544 (1995).
- Epel, E. S., Lithgow, G. J. Stress biology and aging mechanisms: toward understanding the deep connection between adaptation to stress and longevity. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 69, 10-16 (2014).
- Luo, Y. Long-lived worms and aging. Redox Report: Communications in Free Radical Research. 9 (2), 65-69 (2004).
- Tissenbaum, H. A. Using C. elegans for aging research. Invertebrate Reproduction & Development. 59, 59-63 (2015).
- Zhang, S., Li, F., Zhou, T., Wang, G., Li, Z. Caenorhabditis elegans as a useful model for studying aging mutations. Frontiers in Endocrinology. 11, 554994 (2020).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Rual, J. -. F., et al. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome Research. 14 (10), 2162-2168 (2004).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
- Reboul, J., et al. Open-reading-frame sequence tags (OSTs) support the existence of at least 17,300 genes in C. elegans. Nature Genetics. 27 (3), 332-336 (2001).
- Lee, S. S., et al. A systematic RNAi screen identifies a critical role for mitochondria in C. elegans longevity. Nature Genetics. 33 (1), 40-48 (2003).
- Reinke, S. N., Hu, X., Sykes, B. D., Lemire, B. D. Caenorhabditis elegans diet significantly affects metabolic profile, mitochondrial DNA levels, lifespan and brood size. Molecular Genetics and Metabolism. 100 (3), 274-282 (2010).
- Revtovich, A. V., Lee, R., Kirienko, N. V. Interplay between mitochondria and diet mediates pathogen and stress resistance in Caenorhabditis elegans. PLOS Genetics. 15 (3), 1008011 (2019).
- Pang, S., Curran, S. P. Adaptive capacity to bacterial diet modulates aging in C. elegans. Cell Metabolism. 19 (2), 221-231 (2014).
- Brooks, K. K., Liang, B., Watts, J. L. The influence of bacterial diet on fat storage in C. elegans. PLOS ONE. 4 (10), 7545 (2009).
- Soukas, A. A., Kane, E. A., Carr, C. E., Melo, J. A., Ruvkun, G. Rictor/TORC2 regulates fat metabolism, feeding, growth, and life span in Caenorhabditis elegans. Genes & Development. 23 (4), 496-511 (2009).
- Bar-Ziv, R., et al. Measurements of physiological stress responses in C. Elegans. Journal of Visualized Experiments: JoVE. (159), e61001 (2020).
- Xiao, R., et al. RNAi interrogation of dietary modulation of development, metabolism, behavior, and aging in C. elegans. Cell Reports. 11 (7), 1123-1133 (2015).
- Calixto, A., Chelur, D., Topalidou, I., Chen, X., Chalfie, M. Enhanced neuronal RNAi in C. elegans using SID-1. Nature Methods. 7 (7), 554-559 (2010).
- Dickinson, D. J., Goldstein, B. CRISPR-based methods for Caenorhabditis elegans genome engineering. Genetics. 202 (3), 885-901 (2016).
- Kim, H. -. M., Colaiácovo, M. P. CRISPR-Cas9-guided genome engineering in C. elegans. Current Protocols in Molecular Biology. 129 (1), 106 (2019).
- Farboud, B., Severson, A. F., Meyer, B. J. Strategies for efficient genome editing using CRISPR-Cas9. Genetics. 211 (2), 431-457 (2019).
- Transformation and Microinjection. WormBook: The Online Review of C. elegans Biology Available from: https://www.ncbi.nlm.nih.gov/books/NBK19648/ (2006)
- Frøkjaer-Jensen, C., et al. Single-copy insertion of transgenes in Caenorhabditis elegans. Nature Genetics. 40 (11), 1375-1383 (2008).
- Kaymak, E., et al. Efficient generation of transgenic reporter strains and analysis of expression patterns in Caenorhabditis elegans using Library MosSCI. Developmental Dynamics: an Official Publication of the American Association of Anatomists. 245 (9), 925-936 (2016).
- Mariol, M. -. C., Walter, L., Bellemin, S., Gieseler, K. A rapid protocol for integrating extrachromosomal arrays with high transmission rate into the C. elegans genome. Journal of Visualized Experiments: JoVE. (82), (2013).
- Rastogi, S., et al. Caenorhabditis elegans glp-4 encodes a valyl aminoacyl tRNA synthetase. G3: Genes|Genomes|Genetics. 5 (12), 2719-2728 (2015).
- Beanan, M. J., Strome, S. Characterization of a germ-line proliferation mutation in C. elegans. Development. 116 (3), 755-766 (1992).
- Santi, D. V., McHenry, C. S. 5-Fluoro-2′-Deoxyuridylate: covalent complex with thymidylate synthetase. Proceedings of the National Academy of Sciences. 69 (7), 1855-1857 (1972).
- Lithgow, G. J., White, T. M., Hinerfeld, D. A., Johnson, T. E. Thermotolerance of a long-lived mutant of Caenorhabditis elegans. Journal of Gerontology. 49 (6), 270-276 (1994).
- Labbadia, J., Morimoto, R. I. The biology of proteostasis in aging and disease. Annual Review of Biochemistry. 84 (1), 435-464 (2015).
- Taylor, R. C., Dillin, A. XBP-1 is a cell-nonautonomous regulator of stress resistance and longevity. Cell. 153 (7), 1435-1447 (2013).
- Higuchi-Sanabria, R., et al. Divergent nodes of non-autonomous UPRER signaling through serotonergic and dopaminergic neurons. Cell Reports. 33 (10), 108489 (2020).
- Durieux, J., Wolff, S., Dillin, A. The cell-non-autonomous nature of electron transport chain-mediated longevity. Cell. 144 (1), 79-91 (2011).
- Morley, J. F., Morimoto, R. I. Regulation of longevity in Caenorhabditis elegans by heat shock factor and molecular chaperones. Molecular Biology of the Cell. 15 (2), 657-664 (2004).
- Heifetz, A., Keenan, R. W., Elbein, A. D. Mechanism of action of tunicamycin on the UDP-GlcNAc:dolichyl-phosphate Glc-NAc-1-phosphate transferase. Biochemistry. 18 (11), 2186-2192 (1979).
- Castello, P. R., Drechsel, D. A., Patel, M. Mitochondria are a major source of paraquat-induced reactive oxygen species production in the brain. The Journal of Biological Chemistry. 282 (19), 14186-14193 (2007).
- Park, H. -. E. H., Jung, Y., Lee, S. -. J. V. Survival assays using Caenorhabditis elegans. Molecules and Cells. 40 (2), 90-99 (2017).
- Gardner, M., Rosell, M., Myers, E. M. Measuring the effects of bacteria on C. Elegans behavior using an egg retention assay. Journal of Visualized Experiments: JoVE. (80), e51203 (2013).
- Waggoner, L. E., Hardaker, L. A., Golik, S., Schafer, W. R. Effect of a neuropeptide gene on behavioral states in Caenorhabditis elegans egg-laying. Genetics. 154 (3), 1181-1192 (2000).
- Zevian, S. C., Yanowitz, J. L. Methodological considerations for heat shock of the nematode Caenorhabditis elegans. Methods. 68 (3), 450-457 (2014).
- Feldman, N., Kosolapov, L., Ben-Zvi, A. Fluorodeoxyuridine improves Caenorhabditis elegans proteostasis independent of reproduction onset). PLOS ONE. 9 (1), 85964 (2014).
- Hsu, A. -. L., Murphy, C. T., Kenyon, C. Regulation of aging and age-related disease by DAF-16 and heat-shock factor. Science. 300 (5622), 1142-1145 (2003).
- Bansal, A., Zhu, L. J., Yen, K., Tissenbaum, H. A. Uncoupling lifespan and healthspan in Caenorhabditis elegans longevity mutants. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), 277-286 (2015).
- Hodgkin, J., Barnes, T. M. More is not better: brood size and population growth in a self-fertilizing nematode. Proceedings. Biological Sciences. 246 (1315), 19-24 (1991).
- Ozbey, N. P., et al. Tyramine Acts Downstream of Neuronal XBP-1s to coordinate inter-tissue UPRER activation and behavior in C. elegans. Developmental Cell. 55 (6), 754-770 (2020).
- Lee, Y., et al. Inverse correlation between longevity and developmental rate among wild C. elegans strains. Aging. 8 (5), 986-994 (2016).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nature Methods. 8 (7), 592-598 (2011).
- Lee, S. -. J., Hwang, A. B., Kenyon, C. Inhibition of respiration extends C. elegans life span via reactive oxygen species that increase HIF-1 activity. Current Biology: CB. 20 (23), 2131-2136 (2010).
- Baird, N. A., et al. HSF-1-mediated cytoskeletal integrity determines thermotolerance and life span. Science. 346 (6207), 360-363 (2014).
- Houtkooper, R. H., et al. Mitonuclear protein imbalance as a conserved longevity mechanism. Nature. 497 (7450), 451-457 (2013).
- Carpenter, R. L., Gökmen-Polar, Y. HSF1 as a cancer biomarker and therapeutic target. Current Cancer Drug Targets. 19 (7), 515-524 (2019).
- Chen, S., et al. The emerging role of XBP1 in cancer. Biomedicine & Pharmacotherapy. 127, 110069 (2020).
- Yadav, R. K., Chauhan, A. S., Zhuang, L., Gan, B. FoxO transcription factors in cancer metabolism. Seminars in Cancer Biology. 50, 65-76 (2018).
- López-Otín, C., Blasco, M. A., Partridge, L., Serrano, M., Kroemer, G. The hallmarks of aging. Cell. 153 (6), 1194-1217 (2013).
- Kennedy, B. K., et al. Geroscience: linking aging to chronic disease. Cell. 159 (4), 709-713 (2014).
- Ben-Zvi, A., Miller, E. A., Morimoto, R. I. Collapse of proteostasis represents an early molecular event in Caenorhabditis elegans aging. Proceedings of the National Academy of Sciences. 106 (35), 14914-14919 (2009).
- Hewitt, J. E., et al. Muscle strength deficiency and mitochondrial dysfunction in a muscular dystrophy model of Caenorhabditis elegans and its functional response to drugs. Disease Models & Mechanisms. 11 (12), (2018).
- Gao, S., Zhen, M. Action potentials drive body wall muscle contractions in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 108 (6), 2557-2562 (2011).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. Journal of Visualized Experiments: JoVE. (74), e50069 (2013).
- Flemming, A. J., Shen, Z. Z., Cunha, A., Emmons, S. W., Leroi, A. M. Somatic polyploidization and cellular proliferation drive body size evolution in nematodes. Proceedings of the National Academy of Sciences of the United States of America. 97 (10), 5285-5290 (2000).
- Madhu, B. J., Salazar, A. E., Gumienny, T. L. Caenorhabditis elegans egg-laying and brood-size changes upon exposure to Serratia marcescens and Staphylococcus epidermidis are independent of DBL-1 signaling. microPublication Biology. 2019, (2019).
- Westendorp, R. G., Kirkwood, T. B. Human longevity at the cost of reproductive success. Nature. 396 (6713), 743-746 (1998).
- Hoffman, J. M., Creevy, K. E., Promislow, D. E. L. Reproductive capability is associated with lifespan and cause of death in companion dogs. PLOS ONE. 8 (4), 61082 (2013).
- Garratt, M., Try, H., Smiley, K. O., Grattan, D. R., Brooks, R. C. Mating in the absence of fertilization promotes a growth-reproduction versus lifespan trade-off in female mice. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15748-15754 (2020).
- Labbadia, J., Morimoto, R. I. Repression of the heat shock response is a programmed event at the onset of reproduction. Molecular Cell. 59 (4), 639-650 (2015).
- Higuchi-Sanabria, R., Frankino, P. A., Paul, J. W., Tronnes, S. U., Dillin, A. A futile battle? Protein quality control and the stress of aging. Developmental Cell. 44 (2), 139-163 (2018).
- Dutta, N., Garcia, G., Higuchi-Sanabria, R. Hijacking cellular stress responses to promote lifespan. Frontiers in Aging. 3, (2022).
- Senchuk, M. M., Dues, D. J., Van Raamsdonk, J. M. Measuring oxidative stress in Caenorhabditis elegans: paraquat and juglone sensitivity assays. Bio-protocol. 7 (1), 2086 (2017).
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: mitochondrial function using the seahorse system. Methods in molecular biology. 1710, 285-293 (2018).
- Daniele, J. R., et al. High-throughput characterization of region-specific mitochondrial function and morphology. Scientific Reports. 7 (1), 6749 (2017).
- Xu, N., et al. The FATP1-DGAT2 complex facilitates lipid droplet expansion at the ER-lipid droplet interface. The Journal of Cell Biology. 198 (5), 895-911 (2012).
- Daniele, J. R., et al. UPRER promotes lipophagy independent of chaperones to extend life span. Science Advances. 6 (1), 1441 (2020).
- Higuchi-Sanabria, R., et al. Spatial regulation of the actin cytoskeleton by HSF-1 during aging. Molecular Biology of the Cell. 29 (21), 2522-2527 (2018).
- Kasimatis, K. R., Moerdyk-Schauwecker, M. J., Phillips, P. C. Auxin-mediated sterility induction system for longevity and mating studies in Caenorhabditis elegans. G3: Genes|Genomes|Genetics. 8 (8), 2655-2662 (2018).
- Fabian, T. J., Johnson, T. E. Production of age-synchronous mass cultures of Caenorhabditis elegans. Journal of Gerontology. 49 (4), 145-156 (1994).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten