Method Article
Étude des méthodes à faible coût pour mesurer la durée de vie et la durée de vie à Caenorhabditis elegans
Dans cet article
Résumé
Caenorhabditis elegans est un excellent système modèle avec des méthodes robustes et peu coûteuses pour étudier la durée de vie, la durée de vie et la résilience au stress.
Résumé
La découverte et le développement de Caenorhabditis elegans en tant qu’organisme modèle ont eu une influence en biologie, en particulier dans le domaine du vieillissement. De nombreuses études historiques et contemporaines ont identifié des milliers de paradigmes altérant la durée de vie, y compris les mutations génétiques, l’expression des gènes transgéniques et l’hormèse, une exposition bénéfique et de bas grade au stress. Avec ses nombreux avantages, y compris une courte durée de vie, une maintenance facile et peu coûteuse, et un génome entièrement séquencé avec homologie à près des deux tiers de tous les gènes humains, C. elegans a rapidement été adopté comme un modèle exceptionnel pour la biologie du stress et du vieillissement. Ici, plusieurs méthodes standardisées sont étudiées pour mesurer la durée de vie et la durée de vie qui peuvent être facilement adaptées à presque tous les environnements de recherche, en particulier ceux avec un équipement et des fonds limités. L’incroyable utilité de C. elegans est présentée, soulignant la capacité d’effectuer de puissantes analyses génétiques en biologie du vieillissement sans avoir besoin d’une infrastructure étendue. Enfin, les limites de chaque analyse et les approches alternatives sont discutées pour examen.
Introduction
Depuis la publication de 'The genetics of Caenorhabditis elegans', l’un des articles les plus influents de Sydney Brenner en 1974, ce ver microscopique a été considéré comme un système modèle exceptionnel pour étudier les mystères biologiques1. En 1977, Michael R. Klass a publié la méthode de mesure de la durée de vie de C. elegans et a établi ce système modèle pour étudier le vieillissement2. L’étude visant à comprendre la relation entre le stress et la longévité a commencé avec l’identification d’une seule mutation dans le gène de l’âge 1, ce qui a entraîné une prolongation de la durée de vie chez C. elegans3. En outre, des études contemporaines ont identifié d’autres mutations augmentant la durée de vie, qui ont révélé des vers mutants à longue durée de vie qui présentent une résistance accrue au stress 4,5,6. Avec ses nombreux avantages, notamment une courte durée de vie, un entretien facile, un génome complètement séquencé contenant l’homologie d’environ deux tiers de tous les gènes pathogènes humains, la disponibilité et la facilité d’utilisation des bibliothèques d’interférence ARN (ARNi) et la similitude physiologique avec les humains 7,8,9, C. elegans a rapidement été adopté comme un modèle exceptionnel pour la biologie du stress et du vieillissement.
Les plus grands avantages de C. elegans sont peut-être son coût d’entretien extrêmement faible, sa facilité d’expérimentation et la variété des outils génétiques disponibles pour les études. C. elegans est généralement cultivé sur un milieu d’agar solide avec une source de nourriture E. coli. Deux souches d’E. coli couramment utilisées sont OP50 standard, une souche B qui est peut-être la10 la plus couramment utilisée, et HT115, une souche K-12 qui est principalement utilisée pour les expériences d’ARNi11,12. La souche HT115 K-12 porte une délétion dans la RNAIII RNase, une mutation essentielle pour les méthodes aRNi, où des plasmides exprimant l’ARNd correspondant à des gènes individuels de C. elegans sont utilisés. Les vecteurs d’alimentation de l’ARNd permettent d’éliminer de manière robuste les gènes de C. elegans sans avoir besoin de croisements complexes ou d’édition du génome, car les bactéries porteuses de ces plasmides peuvent être directement nourries aux nématodes. Des milliers de ces vecteurs d’ARNi bactériens existent dans le contexte HT115, y compris la bibliothèque d’ARNi Vidal la plus populaire avec >19 000 constructions d’ARNi individuelles13 et la bibliothèque d’ARNi Ahringer avec 16 757 constructions d’ARNi14. Cependant, les régimes bactériens OP50 et HT115 présentent des différences majeures dans le profil métabolique, y compris des différences dans la vitamineB12 15,16. Par conséquent, il est recommandé d’effectuer toutes les expériences sur une seule source de bactéries, si possible, pour éviter les interactions gènes-régime alimentaire qui peuvent introduire de multiples facteurs de confusion comme décrit précédemment 17,18,19. En raison de sa facilité, les animaux sont maintenus sur OP50 pour toutes les conditions expérimentales décrites ici, mais toutes les expériences sont effectuées sur HT115 comme décrit précédemment20. En bref, les animaux sont maintenus à OP50 et transférés au HT115 après la synchronisation (après blanchiment) pour assurer la cohérence entre les expériences aRNi et non ARNi. Alternativement, une souche OP50 compétente en ARNi portant une délétion similaire de l’ARNIII RNase trouvée dans la souche E. coli K12 HT115 peut également être utilisée21.
Peut-être qu’une limitation majeure aux expériences d’ARNi chez C. elegans est le souci de l’efficacité de l’arête. Bien que l’efficacité de l’élimination puisse être validée via la qPCR ou le Western Blotting, ceux-ci nécessitent un équipement et des réactifs coûteux et se limitent à l’analyse en vrac. C’est encore plus préoccupant en regardant des cellules spécifiques, telles que les neurones, qui sont réfractaires (moins sensibles) à l’ARNi. Bien que l’efficacité de l’ARNi dans des cellules spécifiques puisse être améliorée par la surexpression de SID-1, la protéine transmembranaire essentielle à l’absorption de l’ARNd22, cela se limite toujours aux modèles d’expression spécifiques au type cellulaire des promoteurs utilisés pour ces constructions, et donc les knockouts et les mutations des gènes sont le moyen le plus infaillible d’épuiser les fonctions des gènes. Au-delà de l’élimination médiée par l’ARNi, C. elegans se prête également très bien à l’édition du génome avec des stratégies basées sur CRISPR 23,24,25 et à la surexpression de construction transgénique par microinjections, avec la possibilité d’intégrer des constructions transgéniques par irradiation ou intégration basée sur des transposons 26,27,28,29 . Cependant, ces méthodes nécessitent un équipement de micro-injection coûteux, et le coût élevé des ARN guides ou de l’enzyme Cas9 peut interdire ces méthodes dans les institutions à financement limité. Au lieu de cela, des milliers de lignées transgéniques et de mutants sont facilement disponibles pour quelques dollars à la fois au Caenorhabditis Genetics Center (CGC) et au National Bioresource Project (NBRP). Le NBRP propose des mutants isolés pour un grand nombre de gènes de C. elegans, y compris des souches mutantes publiées et donc vérifiées, des mutants dérivés de projets pilotes et des mutants qui n’ont pas encore été caractérisés. En revanche, la CCG est un dépositaire de lignes C. elegans principalement publiées et établies du milieu de la recherche. Les deux expédient des souches dans le monde entier à des tarifs très raisonnables et offrent une grande variété d’options pour ceux qui ont une capacité limitée à synthétiser des souches en interne.
Ici, une collection de méthodes organisées est proposée, qui sont susceptibles d’être les méthodes les moins coûteuses pour tester la durée de vie et la durée de vie chez C. elegans. Toutes les méthodes présentées ici nécessitent de l’équipement et des fournitures à faible coût et n’utilisent que des souches facilement disponibles auprès de la CCG. Peut-être le plus prohibitif pour les tests de longévité et de survie chez C. elegans est le coût des plaques de milieu de croissance des nématodes (NGM). Étant donné que C. elegans est hermaphrodite et autofertilisant, les tests de survie standard exigent que les animaux adultes soient continuellement éloignés de leur progéniture pour éviter la contamination par la progéniture. Non seulement ce processus prend du temps, mais il peut devenir coûteux en raison de la nécessité d’environ 100 plaques par condition pour exécuter un seul test de durée de vie. Ici, deux alternatives sont proposées : l’utilisation du mutant sans lignée germinale sensible à la température, le glp-4(bn2), ou la stérilisation chimique à l’aide de la 5-fluoro-2'-désoxyuridine (FUDR). glp-4 code pour une synthétase d’ARNt valyl aminoacyle, et les glp-4(bn2) sensibles à la température sont déficients en matière de reproduction à des températures restrictives en raison de la diminution de la traduction des protéines30,31. FUDR est une méthode robuste pour stériliser chimiquement C. elegans en empêchant la réplication de l’ADN, inhibant ainsi la reproduction32. Bien que le FUDR puisse être d’un coût prohibitif pour certains laboratoires, seule une petite quantité est nécessaire pour stériliser chimiquement les vers, et sa stabilité sous forme de poudre peut le rendre réalisable pour la plupart des groupes. L’utilisation du mutant glp-4(bn2) sensible à la température est certainement l’option la moins chère, car la seule exigence est un incubateur pour déplacer les animaux vers les 25 ° C restrictifs; cependant, il convient de noter qu’une croissance à 25 °C peut provoquer un léger stress thermique33,34. Quelle que soit la méthode, l’utilisation d’animaux stériles peut réduire considérablement les coûts des consommables nécessaires aux tests liés à l’âge.
Pour étudier le vieillissement, les tests de durée de vie standard sont conventionnels car les paradigmes qui modifient la longévité ont des impacts directs sur le vieillissement. Cependant, les mesures de la durée de vie et de la tolérance au stress présentent des informations supplémentaires sur la santé de l’organisme. Ici, plusieurs méthodes sont proposées pour mesurer la durée de la santé: 1) la fécondité en tant que mesure de la santé reproductive; 2) la taille du couvain comme mesure de la santé du développement et de la viabilité de la progéniture pondue; et 3) le comportement locomoteur en tant que mesure de la fonction musculaire et de la motilité, qui sont tous deux directement corrélés au vieillissement. De plus, des tests de tolérance au stress sont proposés: survie au stress ER, stress mitochondrial / oxydatif et survie au stress thermique. En effet, les animaux ayant une résistance accrue au stress ER35,36, au stress mitochondrial37 et au stress thermique38 présentent une durée de vie accrue. Le stress ER est appliqué en exposant C. elegans à la tunicamycine, qui bloque la glycosylation liée à l’azote et provoque l’accumulation de protéines mal repliées39. Le stress mitochondrial/oxydatif est induit par l’exposition au paraquat, qui induit la formation de superoxyde spécifiquement dans les mitochondries40. Le stress thermique est appliqué par l’incubation des animaux à 34-37 °C33,41. Tous les tests décrits ici peuvent être effectués avec un minimum d’équipement et de fonds, et offrent une variété d’outils pour étudier le vieillissement dans divers groupes.
Protocole
1. Croissance et entretien de C. elegans
- Coulée de plaques de milieux de croissance de nématodes (NGM)
- Cultivez C. elegans sur des plaques de gélose standard à 2 % avec un milieu de croissance des nématodes (NGM) composé de 1 mM de CaCl2, de 5 μg/mL de cholestérol, de 25 mM de KPO4 (pH 6,0), de 1 mM mgSO4, de 0,25 % p/v de peptone et de 51,3 mM de NaCl.
- Pour 1 L de plaques de gélose NGM, mesurez 2,5 g de peptone, 3,0 g de NaCl et 20 g de gélose dans une fiole de 1 L avec une barre d’agitation.
REMARQUE: Il est recommandé de normaliser une source de gélose spécifique, car nous avons constaté une variabilité de la rigidité entre les marques, ce qui peut affecter la reproductibilité. Ici, Bacto-Agar est strictement utilisé. De plus, il est recommandé d’ajouter de la gélose directement dans la fiole autoclavée, car la gélose ne se dissoudra pas complètement sans chauffage et le transfert de la solution contenant de la gélose entraînera une perte de gélose et des erreurs de concentration. - Ajouter dH2O jusqu’à 970 mL.
REMARQUE: 30 mL d’additifs liquides après la stérilisation porteront le volume final à 1 L. Entre nos mains, ~951 mL de dH2O seront nécessaires pour atteindre 970 mL du volume final. - Stériliser la solution de gélose NGM à l’aide d’un autoclave standard ou d’un stérilisateur à média pour une stérilisation efficace.
REMARQUE: À ce stade, la gélose stérile NGM peut être conservée pendant plusieurs mois à température ambiante. Si elle est stockée, la gélose NGM peut être régénéfiée au micro-ondes avec des impulsions de 15 à 45 s pour empêcher la solution de bouillir, ou dans un bain-marie chauffé. - Laisser remuer la solution jusqu’à ce qu’elle soit refroidie à 60-75 °C. Remuer pendant le refroidissement est important pour éviter un refroidissement inégal, ce qui peut provoquer la solidification de certaines géloses.
- Pendant que la solution refroidit, chauffer un bain-marie ou un bain de perles à 65-70 °C.
- Une fois la solution refroidie à 60-75 °C, ajouter les additifs liquides : 2,0 mL de CaCl2 de 0,5 M, 1 mL de 5 mg/mL de cholestérol, 25 mL de 1 M DEKPO4 (pH 6,0) et 0,5 M MgSO4 (voir le tableau 1 pour les recettes de tous les réactifs), et laisser mélanger la solution pendant environ 5 min pour assurer un mélange complet.
REMARQUE: Les médicaments peuvent également être inclus dans les plaques ici (par exemple, ajouter 1 mL de 100 mg / mL de carbenicilline et 1 mL de 1 M IPTG; ajouter 10 mL de 2,5 mg / mL de tunicamycine; ajouter 10 mL de paraquat de 400 mM). - Immergez le ballon contenant de la gélose NGM dans un bain-marie à 65-70 °C pour empêcher la gélose NGM de se solidifier lors du versement dans des plaques.
- Pipette 9-11 mL de solution dans chaque plaque de 60 mm, ou 20-30 mL de solution dans chaque plaque de 100 mm.
REMARQUE: Il est recommandé d’utiliser le plus petit volume de pipette disponible pour éviter les fuites de NGM causées par l’expansion de l’air dans la pipette. Le pipetage de 1 à 2 mL de plus de fluide que ce qui sera ajouté à chaque plaque pour éviter de vider complètement la pipette aidera à prévenir la formation de bulles. Alternativement, les assiettes peuvent être versées à la main directement de la bouteille dans une assiette, mais le pipetage est fortement recommandé pour garantir des plaques de volume égal. Des plaques de volume égal sont importantes pour assurer des concentrations similaires de solutions lors de l’utilisation de méthodes où les solutions sont appliquées directement sur une plaque (voir l’étape 1.1.17). Des volumes égaux permettent également une microscopie facile pour maintenir un plan focal similaire sur les plaques. - Replacez la pipette dans la solution chauffée pour maintenir la température et empêcher la gélose NGM de se solidifier.
- Répétez les deux étapes ci-dessus pour toutes les plaques.
- Laissez les plaques de gélose NGM se solidifier pendant la nuit.
- Une fois les plaques solidifiées, conserver les plaques jusqu’à 3 mois à 4 °C ou passer à l’étape 1.1.14 pour l’ensemencement des plaques contenant des bactéries. Conservez les plaques dans des contenants scellés pour aider à retenir l’humidité afin de maintenir la qualité des plaques.
- Cultiver une culture d’OP50 dans un bouillon de lysogénie (LB) ou un milieu équivalent de choix pendant 24-48 h à température ambiante (~22-25 °C) ou cultiver une culture de HT115 dans LB + antibiotiques (ampicilline/glucides + tétracycline est recommandé pour HT115) en agitant à 37 °C pendant 12-16 h.
REMARQUE: Il est recommandé de cultiver OP50 à température ambiante car une croissance plus agressive d’OP50 a été trouvée à 37 ° C, ce qui affecte la durée de vie de C. elegans . En revanche, HT115 a un taux de croissance plus lent et rend les cultures moins denses; ainsi, il est recommandé de cultiver HT115 à 37 °C en secouant. - Ensemencez un volume de 100 à 200 μL d’une culture OP50/HT115 saturée sur une plaque de 60 mm, ou 1 mL pour une plaque de 100 mm.
- Laissez les assiettes sécher pendant la nuit sur une paillasse et laissez sécher un jour supplémentaire si les assiettes sont encore humides. Conservez les assiettes dans des contenants scellés à 4 °C pendant environ 2 mois.
- Facultatif : Ajouter des médicaments directement sur les plaques de gélose NGM ensemencées (p. ex., 100 μL de solution FUDR de 10 mg/mL) pour stériliser chimiquement les vers.
- Maintien des stocks de C. elegans
- Étiquetez correctement le fond d’une plaque de gélose NGM ensemencée. Étiquetez les bords au bas de la plaque pour éviter d’obstruer le passage de la lumière sur les microscopes à dissection standard.
- À l’aide d’un microscope à dissection standard, déposez les bactéries de votre choix sur le pic C. elegans .
REMARQUE: Dans ce protocole, un pic composé d’un fil de platine / iridium à 90% / 10% attaché à l’extrémité d’une pipette Pasteur en verre a été utilisé. - À l’aide de la bactérie, collectez 10 à 20 œufs, animaux L1, L2 ou L3, et transférez-les sur une plaque de gélose NGM nouvellement étiquetée.
REMARQUE: Il est préférable de collecter des animaux plus jeunes; selon l’expérience des auteurs, pour les animaux de type sauvage standard, déplacer 10 à 20 œufs / jeunes animaux permettra à la plaque de croître à 15 ° C sans famine. Pour les animaux transgéniques ou mutants présentant une diminution de la fécondité, davantage d’animaux doivent être déplacés dans la plaque. - Pour les animaux présentant une fécondité de type sauvage et élevés à 15 °C, répétez les étapes 1.2.1 à 1.2.3 tous les 7 jours pour maintenir un stock hebdomadaire. Pour les animaux élevés à 20 °C, répétez les étapes 1.2.1 à 1.2.3 tous les 4 à 5 jours pour éviter la famine.
- Synchronisation des vers via blanchiment
REMARQUE : Une plaque d’agar NGM pleine de 60 mm (p. ex., des plaques d’élevage de 1 semaine cultivées à 15 °C) fournira un nombre suffisant d’animaux pour la plupart des essais standard décrits. Généralement, un adulte gravide (adulte plein d’œufs) fournira 10 à 15 œufs42, et une plaque complète de 60 mm de gélose NGM a entre 100 et 200 adultes gravides, fournissant environ 1000 à 2000 œufs.- Pour les expériences à plus grande échelle nécessitant plus d’animaux, coupez une gélose NGM complète de 60 mm en quatre à six morceaux égaux et coupez-les sur des plaques ensemencées de 100 mm pour l’expansion.
REMARQUE: Ici, le morcellement fait référence à la coupe d’un morceau de la plaque NGM-agar contenant des vers et au déplacement du morceau entier de gélose + vers sur une nouvelle plaque, côté ver vers le bas pour permettre aux vers de ramper sur la nouvelle plaque. Comme cadre de référence, les animaux atteints de fécondité de type sauvage produiront une plaque complète de 100 mm s’ils sont élevés à 20 ° C pendant 2 à 3 jours après le morcellement. - Pour commencer à recueillir les nématodes, versez une petite quantité de solution de M9 (tableau 1) sur des plaques contenant des vers, en prenant soin de ne pas trop remplir la boîte de Pétri. Faire tourbillonner doucement la solution M9 pour détacher les vers des pelouses bactériennes.
- Recueillez les vers adultes gravides avec une pipette sérologique, en prenant soin de ne pas percer la gélose avec la pointe de la pipette.
REMARQUE: Les pipettes sérologiques en verre sont recommandées, car C. elegans a tendance à coller au plastique. Si les pipettes en verre ne sont pas disponibles, il est recommandé de commencer avec un plus grand nombre d’animaux que nécessaire, car certains seront perdus en raison de l’adhérence aux pipettes en plastique. - Granulés les animaux par centrifugation pendant 30 s à 1 100 x g. Aspirer le surnageant.
REMARQUE: La pastille de C. elegans est très lâche, alors veillez à ne pas secouer ou perturber la pastille tout en aspirant le surnageant. - Pendant que les animaux sont centrifugés, préparer 5 mL de solution de blanchiment par souche (voir le tableau 1 pour plus de détails sur la recette); pour 5 mL de solution, mélanger 1,5 mL d’hypochlorite de sodium à 6 % (eau de Javel), 0,75 mL de NaOH ou KOH à 5 M et 2,75 mL de dH2O.
ATTENTION: L’hypochlorite de sodium et les solutions d’hydroxyde à haute concentration sont corrosifs, il est donc recommandé de porter des gants et une blouse de laboratoire lors de la manipulation. - Ajouter 5 mL de solution de blanchiment au mélange de pastilles de ver/M9.
- Vérifiez les vers sous un microscope à dissection toutes les quelques minutes jusqu’à ce que tous les corps de vers adultes aient été dissous et qu’il ne reste que des œufs dans le mélange. Agiter vigoureusement le mélange ver/eau de Javel pour accélérer le processus de blanchiment.
REMARQUE: Laisser des œufs à l’intérieur d’un mélange d’eau de Javel pendant de longues périodes endommagera les œufs et affectera la viabilité des animaux. Pour les animaux de type sauvage, le blanchiment prend généralement 4 à 6 minutes avec agitation. Ainsi, il est recommandé de vérifier les animaux au microscope à des intervalles de 30 s à partir de la marque de 4 minutes. - Mettez les œufs en granulés en faisant tourner le mélange œuf/eau de Javel pendant 30 s à 1 100 x g.
REMARQUE: Certains tubes coniques de 15 mL ont des lignes de gradient à l’intérieur du tube. Pour ces tubes, il est recommandé de faire tourner les œufs à une vitesse plus élevée (p. ex., 30 s à 2 000 x g) pour s’assurer que les œufs se granulent au fond du tube et ne restent pas sur des lignes de gradient. - Aspirer la solution de blanchiment.
REMARQUE: Un granulé d’œuf est plus rigide qu’un granulé de ver, mais peut toujours être facilement perturbé. Alors, veillez à ne pas secouer le tube après la centrifugation. - Lavez les œufs en ajoutant une solution de M9 jusqu’à 15 mL et en inversant le tube quatre ou cinq fois pour vous assurer que les œufs sont complètement dispersés dans la solution de M9.
- Œufs en granulés par centrifugation pendant 30 s à 1 100 x g et aspirer la solution de M9.
- Répétez les deux étapes ci-dessus pour un total de quatre lavages afin d’éliminer tout eau de Javel du mélange d’œufs.
- Remettre les œufs en suspension dans 100 μL à 2 mL de solution de M9 (c.-à-d. selon le nombre total de vers blanchis) après le lavage final. Bien agiter les œufs pour briser les touffes et s’assurer que le granulé est complètement remis en suspension.
- Alternativement, les animaux peuvent être arrêtés L1 pour une synchronisation temporelle plus étroite; pour l’arrêt L1, ajouter la solution M9 à la pastille d’œuf à ~10 mL dans un tube conique de 15 mL. Laissez les vers tourner dans un rotateur jusqu’à 24 h à 20 °C ou à température ambiante. Les animaux L1 mettent généralement une demi-journée de moins pour atteindre l’âge adulte par rapport au moment des œufs décrit à l’étape 1.3.16.
- Approximer la concentration d’œufs (ou concentration de L1; voir l’étape 1.3.14) en pipetant 4 μL de mélange œuf/M9 sur une plaque de NGM ensemencée de bactéries. Compter et calculer le nombre d’œufs présents par μL plaqué. Répétez le comptage trois ou quatre fois pour améliorer l’approximation.
REMARQUE: L’approximation de la concentration d’œufs garantira que suffisamment d’animaux sont plaqués pour une taille d’échantillon appropriée pour des expériences sans surplaçage, ce qui entraînera la famine. - Sur la base de l’approximation, plaquer le nombre approprié d’œufs sur des plaques de gélose NGM ensemencées avec des bactéries de choix. Pour les plaques OP50, plaquez un maximum de 200 animaux sur une plaque de 60 mm et 1 000 animaux sur une plaque de 100 mm. Pour les plaques HT115, plaquez un maximum de 150 animaux sur une plaque de 60 mm et 600 animaux sur une plaque de 100 mm.
REMARQUE: Ce sont des chiffres approximatifs basés sur nos conditions de laboratoire, et les chiffres peuvent changer en fonction de l’épaisseur de la pelouse bactérienne. Les œufs élevés à 15 °C prendront environ 5 jours pour atteindre le jour 1 de l’âge adulte (~ 140 h pour atteindre le stade maximal de ponte, gravide adulte). Les œufs cultivés à 20 °C prendront environ 4 jours pour atteindre le jour 1 de l’âge adulte (~ 96 h pour atteindre le stade maximal de ponte, gravide adulte). Les œufs élevés à 25 °C mettront environ 3,5 jours pour atteindre le jour 1 de l’âge adulte (~ 62 h pour atteindre le stade maximal de ponte et gravide de l’âge adulte).
- Pour les expériences à plus grande échelle nécessitant plus d’animaux, coupez une gélose NGM complète de 60 mm en quatre à six morceaux égaux et coupez-les sur des plaques ensemencées de 100 mm pour l’expansion.
- La ponte comme méthode alternative pour synchroniser les populations de C. elegans
- Si les protocoles de blanchiment ne sont pas réalisables (p. ex., aucune centrifugeuse disponible), comme méthode alternative pour synchroniser les populations de C. elegans, effectuer une procédure de ponte. Gardez à l’esprit que ce protocole est plus exigeant en main-d’œuvre et entraînera des rendements d’animaux plus faibles.
- Pour la ponte, placez 8 à 12 adultes gravides sur une plaque de gélose NGM standard ensemencée de bactéries de choix et documentez le nombre exact d’animaux placés sur une assiette.
REMARQUE: Les procédures de ponte doivent être effectuées à la température qui sera utilisée pour l’expérimentation. - Laissez les animaux pondre des œufs pendant 4 à 8 h.
REMARQUE: La durée pendant laquelle les animaux sont laissés dans l’assiette peut être ajustée en cas de besoin. Par exemple, un plus grand nombre d’animaux peuvent être mis dans une assiette pour une durée de ponte plus courte lorsque moins de temps est disponible. C. elegans pond généralement des œufs en rafales, ce qui peut être estimé à un taux d’environ cinq œufs/h pour les animaux ayant une fécondité de type sauvage43. Suivez les recommandations de l’étape 1.3.16 pour éviter de surplaquer les animaux. - Retirez tous les animaux adultes de l’assiette.
REMARQUE : Tous les animaux adultes laissés dans l’assiette continueront de pondre, ce qui entraînera une population non synchronisée. - Placer les œufs à 15 °C pendant ~5 jours ou à 20 °C pendant ~4 jours pour atteindre le jour 1 de l’âge adulte.
2. Mesurer la longévité chez C. elegans
- Durée de vie standard
- Préparer les plaques de gélose NGM en ensemençant des plaques contenant 100 μL de bactéries de votre choix. Pour plus de cohérence, assurez-vous que la même bactérie est utilisée dans tous les réplicats. Étant donné que les vers sont déplacés tous les jours pendant les étapes de ponte de l’âge adulte, ensemencez cinq à sept ensembles de plaques de gélose NGM pour la durée de vie, et deux à quatre plaques par souche pour élever les animaux jusqu’à l’âge adulte (c.-à-d. si vous utilisez huit plaques de 15 animaux pour la durée de vie, il faut semer 40 à 56 plaques par condition).
- Laissez les assiettes sécher pendant la nuit avant le stockage.
REMARQUE: Il est recommandé que les plaques soient entreposées à 4 ° C et que le nombre requis de plaques soit retiré quotidiennement de l’entreposage frigorifique pour empêcher les bactéries de rendre les pelouses épaisses qui peuvent rendre difficile le déplacement / comptage des durées de vie. Assurez-vous que les assiettes sont réchauffées avant de plaquer les vers. - Recueillir une population synchronisée de C. elegans à l’aide d’un essai de blanchiment standard tel que décrit aux étapes 1.3 et 1.4.
- Déplacez 10 à 15 jours 1 des animaux adultes sur 8 à 12 assiettes chacune. Pour une durée de vie standard, commencez avec environ 120 animaux pour vous assurer que la taille de l’échantillon ne tombe pas trop en dessous de 100 après des événements de censure (par exemple, huit plaques de 15 animaux = 120 animaux; 12 plaques de 10 animaux = 120 animaux).
REMARQUE: Dans le cas présent, 10 à 15 animaux sont un nombre gérable pour la plupart des enquêteurs, bien que six plaques de 20 animaux soient également réalisables pour réduire le coût des consommables. - Pendant les 7 à 8 premiers jours ou jusqu’à ce que la progéniture ne soit plus visible, éloignez les animaux adultes de leur progéniture tous les 1 à 2 jours.
REMARQUE: Les animaux peuvent être déplacés tous les deux jours pour économiser du matériel, mais il faut veiller à ce que les œufs / larves d’animaux ne soient pas transférés avec l’adulte pour éviter la contamination des populations adultes par la progéniture. Dans cette étude, la méthode la plus simple consiste à déplacer les animaux tous les jours des jours 1 à 3 lorsque la ponte est à son maximum, puis à déplacer les animaux tous les deux jours pendant les jours 5 à 8 lorsque la ponte est minimale. Avec cette méthode, il n’est pas impératif d’empêcher le transfert d’œufs / larves d’animaux pendant les jours 1 à 3, car les adultes seront déplacés tous les jours et les œufs / larves ne peuvent pas se développer à l’âge adulte en 1 jour. - Une fois que les animaux ont cessé de produire de la progéniture, marquez la durée de vie tous les deux jours jusqu’à ce que tous les animaux aient été marqués comme morts ou censurés. Retirez tous les animaux morts ou censurés de l’assiette pour éviter toute confusion et raconter le même animal.
REMARQUE: La mort est marquée comme des animaux qui ne présentent aucun mouvement lorsqu’ils sont doucement touchés avec un pic. La censure est marquée comme des animaux qui sont ensachés, présentent des protubérances vulvaires / intestinales, ou rampés sur les côtés de la plaque où ils se dessèchent.
- Durée de vie avec stérilisation chimique à l’aide de FUDR
- Préparer les plaques de gélose NGM en ensemençant des plaques contenant 100 μL de bactéries de votre choix. Pour plus de cohérence, assurez-vous que la même bactérie est utilisée dans tous les réplicats. Ensemencez 8 à 12 plaques par souche pour les expériences de durée de vie et deux à quatre plaques par souche pour élever les animaux jusqu’à l’âge adulte. Laissez les assiettes sécher pendant la nuit.
- Ajouter 100 μL de 10 mg/mL de FUDR au milieu de la pelouse bactérienne pour les 8 à 12 plaques qui seront utilisées pour le dosage de la durée de vie. N’oubliez pas de laisser deux à quatre assiettes sans FUDR comme plaques de démarrage pour permettre aux animaux de grandir jusqu’à l’âge adulte. Laissez sécher les assiettes pendant la nuit.
ATTENTION: FUDR bloque la synthèse de l’ADN, et il est donc recommandé de porter des gants lors de la manipulation. - Recueillir une population synchronisée de C. elegans à l’aide d’un essai de blanchiment standard tel que décrit aux étapes 1.3 et 1.4.
REMARQUE: Ces animaux doivent être élevés sur des assiettes sans FUDR, car FUDR provoquera l’arrestation / la mort des animaux. - Déplacez 10 à 15 jours 1 des animaux adultes sur 8 à 12 assiettes chacune contenant du FUDR. Pour une durée de vie standard, commencez avec environ 120 animaux pour vous assurer que la taille de l’échantillon ne tombe pas trop en dessous de 100 après des événements de censure (par exemple, huit plaques de 15 animaux = 120 animaux; 12 plaques de 10 animaux = 120 animaux).
REMARQUE: Les animaux peuvent également être déplacés sur FUDR au stade L4 s’il est impératif d’éviter complètement la formation de descendants, mais les animaux ne doivent pas être déplacés trop tôt car cela augmentera le risque de protubérances vulvaires / intestinales et augmentera la censure. - Marquez la durée de vie tous les deux jours jusqu’à ce que tous les animaux aient été marqués comme morts ou censurés. Retirez tous les animaux morts ou censurés de l’assiette pour éviter toute confusion et raconter le même animal.
REMARQUE: Pour les durées de vie FUDR, toute progéniture peut être ignorée car elle s’arrêtera au stade L1 et finira par mourir.
- Durée de vie à l’aide de mutants stériles sensibles à la température
- Préparer les plaques de gélose NGM en ensemençant des plaques contenant 100 μL de bactéries de votre choix. Pour plus de cohérence, assurez-vous que la même bactérie est utilisée dans tous les réplicats. Ensemencez 8 à 12 plaques par souche pour les expériences de durée de vie et 2 à 4 plaques par souche pour élever les animaux jusqu’à l’âge adulte. Laissez sécher les assiettes pendant la nuit.
- Recueillir une population synchronisée de C. elegans à l’aide d’un essai de blanchiment standard tel que décrit aux étapes 1.3 et 1.4. N’oubliez pas d’élever des animaux à la température restrictive de 25 °C pour vous assurer que les animaux sont stériles.
- Déplacez 10 à 15 jours 1 des animaux adultes sur 8 à 12 assiettes chacune. Pour une durée de vie standard, commencez avec environ 120 animaux pour vous assurer que la taille de l’échantillon ne tombe pas trop en dessous de 100 après des événements de censure (par exemple, huit plaques de 15 animaux = 120 animaux; 12 plaques de 10 animaux = 120 animaux).
- Marquez la durée de vie tous les deux jours jusqu’à ce que tous les animaux aient été marqués comme morts ou censurés. Retirez tous les animaux morts ou censurés de l’assiette pour éviter toute confusion et raconter le même animal.
REMARQUE: Lorsqu’il s’agit de souches à courte durée de vie, il est recommandé de noter les durées de vie tous les jours, car les durées de vie à 25 ° C sont beaucoup plus courtes et la plage dynamique est donc limitée. Selon l’expérience des auteurs, les animaux peuvent être ramenés à 20 ° C après le jour 2, et les animaux resteront stériles s’il est préférable de marquer des durées de vie à 20 ° C.
3. Mesure de la durée de santé chez C. elegans
- Mesures du comportement locomoteur par thrashing
- Recueillir une population synchronisée de C. elegans à l’aide d’un essai de blanchiment standard tel que décrit aux étapes 1.3 et 1.4.
- Déplacer une petite colonie de vers adultes du jour 1 sur une plaque de gélose NGM sous une lunette de dissection sur 10 à 20 μL de solution de M9. 10 à 15 animaux sont recommandés comme un nombre gérable d’animaux à compter.
- En vous concentrant sur un ver à la fois, comptez le nombre de fois que l’échantillon passe d’une formation concave à une formation convexe en 15 s. Utilisez un compteur à main et une minuterie afin que la mise au point puisse être placée sur le ver pendant toute la durée du test.
REMARQUE: Une vidéo de la plaque peut être enregistrée pour une analyse plus approfondie / plus facile. Par exemple, des accessoires d’oculaire de microscope standard sont disponibles pour la plupart des smartphones et des appareils photo numériques (15 $ à 30 $), et ce sont une excellente option pour le battage vidéo à faible coût. - Répétez l’étape 3.1.3 pour les autres vers dans le liquide, en faisant la moyenne d’un taux de motilité total pour 10 à 15 vers. Pour une taille d’échantillon plus élevée, répétez les étapes 3.1.2 à 3.1.4.
- Vieillissez les vers à l’âge désiré. Des méthodes similaires pour les tests de durée de vie décrites aux étapes 2.1 à 2.3 peuvent être utilisées pour vieillir les vers. Répétez les étapes 3.1.2 à 3.1.4 pour tester le battage aux âges souhaités.
REMARQUE: Une autre méthode pour l’étape 3.1.2 consiste à ajouter environ 30 μL ou plus de solution M9 sur un groupe de vers sur une plaque. Cela permettra de gagner du temps en évitant d’avoir à transférer manuellement les vers, bien qu’en raison du risque aléatoire d’où se trouvent les vers sur une seule plaque, il n’y a aucune garantie qu’un groupe de vers restera à un seul point de la plaque.
- Mesures de la fécondité (nombre d’œufs) chez C. elegans
- Recueillir une population synchronisée de C. elegans à l’aide d’un essai de blanchiment standard tel que décrit aux étapes 1.3 et 1.4. Les tests pour le nombre d’œufs commencent au stade L4, qui est ~ 1 jour avant le jour 1 de l’âge adulte (~ 3 jours à 15 ° C ou ~ 2 jours à 20 ° C après l’arrêt L1).
- Distinguer les vers L4 sur des plaques de gélose NGM séparées ensemencées de bactéries de choix. Il est recommandé d’utiliser environ 10 à 15 animaux pour un test de fécondité.
REMARQUE: Il est recommandé de diluer les bactéries de choix de 50% (c.-à-d. pas une culture saturée) pour améliorer la visibilité des œufs dans la pelouse bactérienne. - Laisser les animaux grandir pendant la nuit à 20 °C. Assurez-vous qu’un lot d’assiettes nouvellement ensemencé est prêt pour le lendemain.
- Au jour 1 de l’âge adulte, transférez les vers adultes sur des plaques de gélose NGM fraîches ensemencées avec les bactéries diluées de votre choix.
REMARQUE: Il est recommandé d’utiliser des assiettes fraîchement ensemencées ou de conserver les assiettes à 4 ° C jusqu’à utilisation pour éviter les pelouses bactériennes épaisses. - Comptez le nombre total d’œufs pondus sur chaque plaque de gélose NGM.
REMARQUE: Pour faciliter le balayage de la plaque, une grille peut être dessinée sur le couvercle d’une plaque et placée sous la plaque en cours de notation pour les œufs. La plaque peut ensuite être scannée le long des lignes de la grille pour maintenir l’orientation lorsque la plaque est déplacée et empêcher le recomptage des œufs. - Répétez les étapes 3.2.4 à 3.2.5 pendant 7 à 8 jours ou jusqu’à ce que les œufs ne soient plus visibles sur la plaque.
REMARQUE: Pour les jours 1-3 où les taux de ponte sont élevés, il est recommandé de déplacer les animaux au moins toutes les 12 heures et de tester le nombre d’œufs deux fois par jour. Cependant, cela augmente la quantité de travail et les coûts des consommables, et donc le déplacement des animaux et les mesures peuvent être limités à une fois par jour, mais il faut veiller à ce que tous les œufs et les animaux éclos soient comptés correctement. Tous les animaux éclos sont comptés comme des œufs aux fins de ce test.
- Mesure de la taille de la couvée (développement) de la descendance de C. elegans
- Recueillir une population synchronisée de C. elegans à l’aide d’un essai de blanchiment standard tel que décrit aux étapes 1.3 et 1.4. Les tests pour la taille de la couvée commencent au stade L4, qui est ~1 jour avant le jour 1 adulte (~3 jours à 15 °C ou ~2 jours à 20 °C après l’arrêt L1).
- Distinguer les vers L4 sur des plaques de gélose NGM séparées ensemencées de bactéries de choix. Il est recommandé d’utiliser environ 10 à 15 animaux pour un test de fécondité.
- Laisser les animaux grandir pendant la nuit à 20 °C. Assurez-vous qu’un lot d’assiettes nouvellement ensemencé est prêt pour le lendemain.
- Au jour 1 de l’âge adulte, transférez les vers adultes sur des plaques de gélose NGM fraîches ensemencées de bactéries de choix.
- Toutes les 12-24 h (2x par jour ou 1x par jour), transférer les vers adultes sur des plaques de gélose NGM fraîches ensemencées de bactéries de choix pendant 7-8 jours ou jusqu’à ce que la progéniture ne soit plus visible. Conserver toutes les assiettes contenant des œufs à 20 °C.
- Répétez l’étape 3.3.5 pendant 7 à 8 jours ou jusqu’à ce que la progéniture ne soit plus visible. Conserver toutes les assiettes contenant des œufs à 20 °C.
REMARQUE: Les plaques de progéniture peuvent également être stockées à 15 ° C pour prolonger le temps avant qu’elles ne doivent être notées. - Deux jours après le transfert des vers, comptez la progéniture développée sur les plaques. Compter les vers en développement au stade L4 (c.-à-d. 2 jours après l’éclosion à 20 °C) ou plus tôt pour s’assurer que la génération F2 (c.-à-d. la progéniture de la progéniture) ne confond pas les résultats. Comptez tous les vers vivants.
- Retirez tous les vers de la plaque au fur et à mesure qu’ils sont comptés. Conservez les plaques pendant 1 à 2 jours supplémentaires avant de les marquer à nouveau pour vous assurer que tous les animaux dont l’éclosion ou le développement est retardé ne sont pas manqués.
- Répétez l’étape 3.3.7 pour chaque assiette de ponte collectée.
REMARQUE: Les tests de taille de couvain peuvent être effectués en conjonction avec le test de comptage des œufs (étape 3.2) pour minimiser la main-d’œuvre et les coûts des consommables en collectant deux ensembles de données d’une expérience. Cela permettra également de comparer directement la taille du couvain et le nombre d’œufs chez les mêmes animaux.
4. Mesurer la résilience au stress chez C. elegans
- Mesures de la sensibilité au stress ER à l’aide de la tunicamycine
- Préparer les plaques de gélose NGM en ensemençant des plaques contenant de la tunicamycine (voir étape 1.1.7, NOTE) avec 100 μL de bactéries de choix.
ATTENTION: Des gants doivent être portés lors de la manipulation de la tunicamycine. - Pour plus de cohérence, assurez-vous que la même bactérie est utilisée dans tous les réplicats. Semer 8 à 12 plaques de tunicamycine par souche pour les tests de survie, et deux à quatre plaques sans tunicamycine par souche pour élever les animaux jusqu’à l’âge adulte. Laissez sécher les assiettes pendant la nuit.
- Recueillir une population synchronisée de C. elegans à l’aide d’un essai de blanchiment standard tel que décrit aux étapes 1.3 et 1.4.
REMARQUE: Les animaux doivent être élevés sur des assiettes sans tunicamycine jusqu’au jour 1 de l’âge adulte, car les animaux arrêteront / mourront sous tunicamycine. - Déplacez 10 à 15 jours 1 des animaux adultes sur 8 à 12 assiettes chacune. Pour les tests de survie standard, commencez par environ 120 animaux pour vous assurer que la taille de l’échantillon ne tombe pas trop en dessous de 100 après des événements de censure (par exemple, huit plaques de 15 animaux = 120 animaux; 12 plaques de 10 animaux = 120 animaux).
REMARQUE: Semblable aux tests FUDR, les tests de survie à la tunicamycine peuvent être effectués sans déplacer les animaux, car la tunicamycine provoque la mort / l’arrestation des animaux L1. Cependant, lors de la réalisation d’un contrôle du DMSO, la progéniture se développera sur des plaques de DMSO, de sorte que les animaux doivent être déplacés quotidiennement ou une technique de stérilisation sera nécessaire (des méthodes identiques utilisées à la section 2 pour les durées de vie peuvent être utilisées pour les tests de survie). - Les tests de survie sont notés de la même manière que les durées de vie. Retirez tous les animaux morts ou censurés de l’assiette pour éviter toute confusion et raconter le même animal.
REMARQUE: Bien qu’il soit possible de noter les animaux tous les deux jours, étant donné que la mort survient rapidement sous tunicamycine, il est recommandé de noter les tests de survie quotidiennement.
- Préparer les plaques de gélose NGM en ensemençant des plaques contenant de la tunicamycine (voir étape 1.1.7, NOTE) avec 100 μL de bactéries de choix.
- Mesures de la sensibilité au stress mitochondrial/oxydatif à l’aide du paraquat
- Préparer les plaques de gélose NGM en ensemençant des plaques contenant du paraquat (voir l’étape 1.1.7; NOTE) avec 100 μL de bactéries de choix.
ATTENTION : Des gants doivent être portés lors de la manipulation du paraquat car il s’agit d’un danger pour l’environnement. Vérifiez auprès de l’établissement la santé et la sécurité environnementales pour connaître les exigences en matière de rejet, car de nombreux établissements de recherche exigeront des instructions de mise au rebut spécifiques pour les dangers environnementaux. - Pour plus de cohérence, assurez-vous que la même bactérie est utilisée dans tous les réplicats. Ensemencez 8 à 12 plaques par souche pour les essais de survie et deux à quatre plaques sans paraquat par souche pour faire pousser les animaux jusqu’à l’âge adulte. Laissez les assiettes sécher pendant la nuit.
- Recueillir une population synchronisée de C. elegans à l’aide d’un essai de blanchiment standard tel que décrit aux étapes 1.3 et 1.4.
REMARQUE: N’oubliez pas de faire pousser les animaux sur des assiettes sans paraquat jusqu’au jour 1 de l’âge adulte; cependant, il est nécessaire d’effectuer une technique de stérilisation ou d’éloigner les adultes de la progéniture, car certains animaux peuvent atteindre l’âge adulte sur des plaques de paraquat (voir les étapes 2.2-2.3). - Déplacez 10 à 15 jours 1 des animaux adultes sur 8 à 12 assiettes chacune. Pour un test de survie standard, commencez par ~ 120 animaux pour vous assurer que la taille de l’échantillon ne tombe pas trop en dessous de 100 après des événements de censure (par exemple, huit plaques de 15 animaux = 120 animaux; 12 plaques de 10 animaux = 120 animaux).
- Les tests de survie sont notés de la même manière que les durées de vie. Retirez tous les animaux morts ou censurés de l’assiette pour éviter toute confusion et raconter le même animal.
REMARQUE: Bien qu’il soit possible de noter les animaux tous les deux jours, étant donné que la mort survient rapidement sur le paraquat, il est recommandé de noter les tests de survie quotidiennement. Cela est particulièrement vrai lors de l’utilisation d’animaux glp-4 (bn2) élevés à 25 ° C, car la mort se produira très rapidement.
- Préparer les plaques de gélose NGM en ensemençant des plaques contenant du paraquat (voir l’étape 1.1.7; NOTE) avec 100 μL de bactéries de choix.
- Mesures de la sensibilité au stress thermique (thermotolérance) à l’aide de températures élevées
- Recueillir une population synchronisée de C. elegans à l’aide d’un essai de blanchiment standard tel que décrit aux étapes 1.3 et 1.4.
- Préchauffer les plaques de gélose NGM à 37 °C avant de déplacer les animaux sur des plaques en plaçant des plaques dans un incubateur à 37 °C pendant au moins 1 h.
- Déplacez 10 à 15 jours 1 des animaux adultes sur quatre à six assiettes préchauffées chacune. Pour une thermotolérante standard, commencez par ~ 60 animaux (par exemple, quatre plaques de 15 animaux = 60 animaux; six plaques de 10 animaux = 60 animaux)
- Placez les animaux dans un incubateur à 37 °C et marquez la mort toutes les 2 h. La mort est définie comme des animaux qui ne présentent aucun mouvement lorsqu’ils sont doucement touchés avec un pic. Retirez tous les animaux morts ou censurés de l’assiette pour éviter toute confusion et raconter le même animal.
- Assurez-vous que les plaques sont retirées de l’incubateur à 37 °C pendant le moins de temps possible, car les plaques laissées à température ambiante pendant de longues durées pendant la notation modifieront les résultats de thermotolérants.
REMARQUE: Il est recommandé de ne retirer qu’une seule souche à la fois pour marquer, car la température de la gélose ne devrait pas changer radicalement dans le temps qu’il faut pour marquer une souche. - La thermotolérante médiane est généralement réalisée en 7-9 h; assurez-vous donc d’un dosage approprié à 7 h, 9 h et 11 h.
REMARQUE: Bien que 1 à 5 heures puissent être ignorées, en raison de la variabilité des incubateurs, de l’épaisseur des plaques et d’autres facteurs de confusion dans chaque laboratoire, il est important que le calendrier soit soigneusement titré dans chaque laboratoire si des points temporels sont prévus pour être ignorés. Voir la référence 44 pour un guide complet sur la thermotolérance. - Vous pouvez également effectuer le test de thermotolérance à 34 °C au lieu de 37 °C.
REMARQUE: La thermotolérante médiane à 34 ° C se produit beaucoup plus tard (10-14 h dans cette étude), ce qui permet de préparer les tests de thermotolérant tard dans la nuit (placés dans un incubateur à 34 ° C) et de commencer tôt le lendemain. Cela permet d’obtenir environ 8 h de notation continue plutôt que la période typique de 12 h requise pour un test de thermotolérance à 37 °C.
Résultats
C. elegans est un excellent organisme modèle pour la recherche sur le vieillissement en raison d’une grande majorité des mécanismes de vieillissement conservés chez l’homme. Il est important de noter qu’ils ont un coût très faible en maintenance et en expérimentation avec des exigences minimales en matière d’équipement et de consommables, ce qui en fait un système modèle convoité pour les institutions disposant de fonds limités. De plus, une pléthore de tests simples avec des courbes d’apprentissage peu profondes en font un excellent système, même pour le plus jeune chercheur avec peu ou pas d’expérience. Tous ces facteurs combinés à la puissante génétique de C. elegans , y compris la facilité d’édition du génome, des milliers de mutants disponibles et d’animaux transgéniques à des coûts nominaux, et les bibliothèques d’ARNi disponibles pour l’élimination génétique de pratiquement tous les gènes en font un système idéal pour les établissements de premier cycle. Ici, certaines des méthodes les moins coûteuses pour étudier le vieillissement chez C. elegans sont étudiées , en se concentrant principalement sur les essais avec un coût minimal d’équipement et de consommable, ainsi que des courbes d’apprentissage peu profondes. En fait, l’ensemble des protocoles et de la collecte de données ont été rédigés / effectués par des chercheurs juniors ayant <5 mois d’expérience en recherche, principalement des étudiants de premier cycle.
Les études de longévité chez C. elegans sont très simples en raison de la courte durée de vie des animaux, allant de 14 à 20 jours. Il est important de noter que les tests de durée de vie sont hautement standardisés et ne nécessitent qu’un incubateur, un microscope à dissection standard, un pic à vis sans fin standard et des consommables pour la préparation de plaques de gélose NGM. L’aspect le plus prohibitif des mesures de la durée de vie chez C. elegans est peut-être les consommables requis. C’est parce que C. elegans sont des hermaphrodites qui s’auto-fécondent; par conséquent, les adultes suivis pour les tests de longévité doivent être éloignés de la progéniture quotidiennement. Cependant, les animaux peuvent être stérilisés en les exposant à la FUDR ou en utilisant des mutants, tels que le mutant glp-4(bn2) sans lignée germinale sensible à la température, cultivé à une température prohibitive de 25 °C pour réduire la quantité de consommables nécessaires 30,31,32. Ici, des tests de durée de vie ont été effectués avec FUDR ou avec les mutants sans lignée germinale glp-4 (bn2), qui montrent des résultats similaires aux durées de vie standard effectuées sur des animaux non stériles. Bien que la durée de vie de type sauvage ne soit pas identique en raison des effets du FUDR45 ou de la croissance à 25 °C sur la durée de vie2, l’animal à courte durée de vie hsf-1 montre de manière fiable une diminution significative de la durée de vie pour toutes les conditions (Figure 1). hsf-1 code le facteur de transcription du facteur de choc thermique 1, qui est impliqué dans la régulation de la réponse au stress thermique, et son knockdown entraîne une diminution significative de la durée de vie38,46.
Bien que la longévité soit un facteur important à prendre en compte dans la biologie du vieillissement, souvent, la longévité n’est pas corrélée à une meilleure santé, même chez C. elegans47. Ainsi, en tant qu’approche complémentaire, nous proposons plusieurs méthodes de mesure de la santé de l’organisme, notamment la santé reproductive, le comportement locomoteur et la résilience au stress. La santé génésique peut être mesurée de deux façons. Tout d’abord, les mesures du nombre d’œufs donneront une mesure directe du nombre d’œufs pondus par un seul hermaphrodite autofertilisant. Cependant, comme les animaux produisent plus d’ovocytes que de spermatozoïdes, certains ovules non fécondés qui ne produiraient jamais de descendance viable sont également pondus48. Par conséquent, pour mieux comprendre la véritable capacité de reproduction d’un animal, les mesures de la taille de la couvée fournissent une mesure du nombre de descendants viables produits. Souvent, une résilience accrue au stress peut en fait diminuer la capacité de reproduction, potentiellement en raison de l’effet inhérent du stress perçu sur la reproduction49. De même, une diminution significative du nombre d’œufs pondus et de la taille des couvées est observée chez les animaux de surexpression hsf-1 par rapport aux témoins de type sauvage (figure 2A, B). En fait, certains animaux de surexpression de hsf-1 présentent une stérilité totale, ce qui prouve que la santé reproductive peut être inversement corrélée à la longévité.
Bien que la santé reproductive soit importante pour comprendre la santé de la lignée germinale, la méiose fonctionnelle et la capacité de reproduction, en général, il n’y a pas de corrélation directe entre la longévité et la taille de la couvée50. Ainsi, en tant qu’approche complémentaire, le comportement locomoteur est proposé comme méthode de référence pour tester C. elegans healthspan au cours du vieillissement51. Il existe de nombreuses méthodes pour mesurer le comportement locomoteur, mais la plupart des méthodes nécessitent des caméras sophistiquées, des logiciels de suivi ou des produits chimiques coûteux. En revanche, les essais de battage ne nécessitent pratiquement aucun équipement au-delà de ce dont un laboratoire C. elegans standard est équipé: microscope à dissection, pic à vis sans fin, pipette et consommables pour la fabrication de plaques de gélose NGM. Les taux de battement constituent une méthode fiable pour mesurer la durée de vie pendant le vieillissement, mesurée par une diminution significative du battage chez les animaux âgés par rapport aux jeunes animaux (figure 2C).
Enfin, les tests de survie au stress sont une mesure physiologique supplémentaire de la résilience. La capacité d’activer les réponses au stress diminue généralement au cours du processus de vieillissement, ce qui rend les animaux moins résilients et plus sensibles au stress. Ainsi, la résilience au stress peut être utilisée comme un indicateur fiable de la santé de l’organisme. Ici, des méthodes sont proposées pour étudier la sensibilité à 1) le stress ER en réponse à l’exposition à la tunicamycine, un agent chimique qui bloque la glycosylation liée à l’azote et entraîne une accumulation de protéines mal repliées dans l’ER; 2) stress mitochondrial / oxydatif par exposition au paraquat, un agent chimique qui induit la formation de superoxyde dans les mitochondries; et 3) le stress thermique dû à l’exposition à des températures élevées. Pour les tests de tunicamycine et de paraquat, le médicament est incorporé dans la plaque NGM-agar pendant la production de plaques. Pour les concentrations élevées de tunicamycine, la progéniture ne se développe généralement pas et, par conséquent, les techniques de stérilisation n’ont pas besoin d’être utilisées. Le protocole présenté ici recommande 25 ng/μL comme concentration finale de tunicamycine, mais pour ceux qui ont des fonds limités, 10 ng/μL montre également une réduction significative de la survie (Figure 3A). Les deux concentrations limitent le développement de la progéniture, et donc aucune méthode de stérilisation n’est nécessaire, bien que le contrôle du DMSO nécessitera une technique de stérilisation ou le déplacement des animaux sur de nouvelles plaques. En effet, la toxicité de la tunicamycine empêche le développement de la progéniture, mais le DMSO est pratiquement non toxique, ce qui permet à la progéniture de se développer pleinement lorsqu’elle est cultivée sur la tunicamycine.
Pour les essais de paraquat, une technique de stérilisation ou le mouvement des animaux est nécessaire car le traitement au paraquat n’empêche pas la progéniture de se développer jusqu’à l’âge adulte. Des niveaux élevés de paraquat (4 mM) raccourcissent considérablement la durée de vie, tandis que de faibles niveaux de paraquat (0,25 mM) augmentent la durée de vie en raison d’un effet hormétique (Figure 3B), ce qui correspond aux résultats publiés précédemment52. Enfin, les tests de thermotolérant ne nécessitent qu’un incubateur pouvant atteindre 30-37 °C, et aucun réactif supplémentaire n’est nécessaire. La surexpression de hsf-1 augmente la thermotolérante à 37 °C (Figure 3C) comme publié précédemment53. Cependant, comme d’autres l’ont montré précédemment et à partir des données actuelles, le problème majeur des tests de thermotolérance est leur variabilité. De nombreux facteurs peuvent contribuer à la variabilité des essais de thermotolérance, y compris les différences entre les incubateurs et le temps que les animaux passent à l’extérieur de l’incubateur tout en marquant la thermotolérante chaque heure. Pour une ligne directrice complète sur la thermotolérance, reportez-vous à la référence 41.
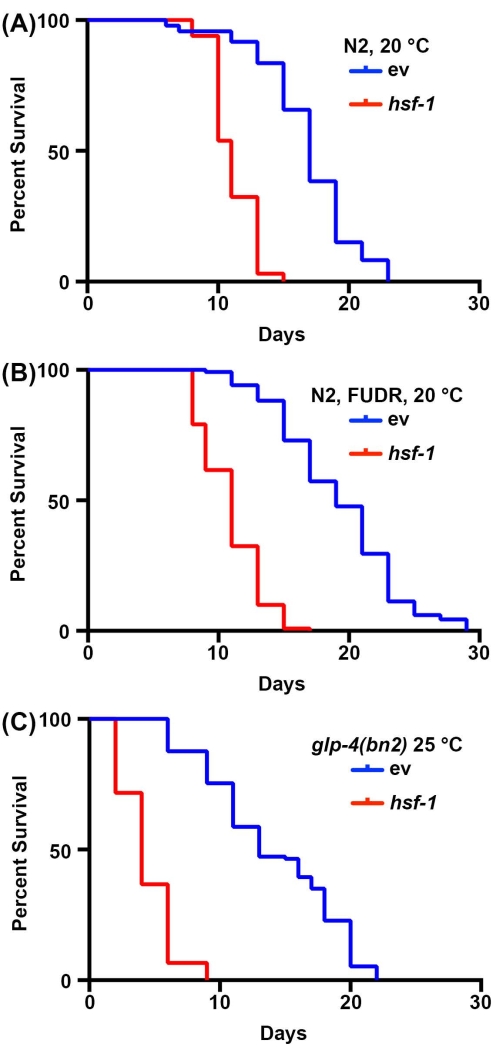
Figure 1: Comparaison des mesures de la durée de vie avec et sans stérilisation. (A) Durée de vie des nématodes N2 de type sauvage cultivés sur des plaques de gélose NGM ensemencées avec des bactéries vecteurs vides (ev) ou hsf-1 ARNi à 20 °C. Les animaux ont été éloignés de la progéniture les jours 1, 3, 5 et 7 de l’âge adulte. B) Durée de vie des nématodes N2 de type sauvage cultivés sur des plaques NGM-agar-FUDR ensemencées avec des bactéries vecteurs vides (ev) ou hsf-1 ARNi à 20 °C. Les animaux ont été élevés à l’âge adulte sur des plaques d’ARNi standard ev ou hsf-1 , puis déplacés vers des plaques FUDR le jour 1 de l’âge adulte. (C) Durée de vie des animaux mutants glp-4(bn2) élevés sur des plaques de gélose NGM ensemencées avec un vecteur vide (ev) ou un ARNi hsf-1 à 25 °C. Pour toutes les conditions, les animaux ont été marqués pour la mort tous les 2 jours jusqu’à ce que tous les animaux soient enregistrés comme morts ou censurés. Les animaux avec ensachage, saillie ou explosion de la vulve, ou ceux qui rampaient sur les côtés des plaques et desséchés étaient censurés. Toutes les statistiques ont été réalisées à l’aide de tests Log-Rank Mantel-Cox et se trouvent dans le tableau 2. Veuillez cliquer ici pour voir une version agrandie de cette figure.
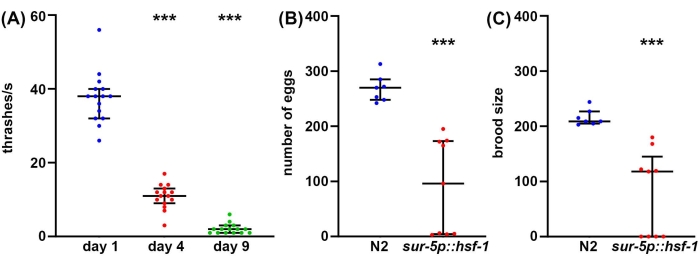
Figure 2 : Nombre d’œufs, taille du couvain et battage comme mesures de la durée de vie. (A) Des essais de battage ont été effectués sur des animaux mutants glp-4(bn2) élevés sur des plaques de gélose NGM ensemencées avec un vecteur vide à 25 °C le jour 1 (bleu), le jour 4 (rouge) et le jour 9 (vert). Le thrashing a été noté chez des animaux placés en solution M9 sur une plaque NGM-agar, la vidéo enregistrée à l’aide d’une caméra de smartphone standard montée sur un oculaire d’une lunette de dissection standard, et le thrashing a été noté au ralenti pour plus de précision. n = 15 animaux par condition. (B) Le nombre d’œufs a été mesuré chez des animaux de type sauvage N2 (bleu) et sur-5p::hsf-1 (rouge). Les animaux étaient élevés à 20 °C et placés sur des assiettes fraîches, et les œufs étaient comptés toutes les 12 h. Le nombre total d’œufs pondus a été additionné. n = 7 animaux pour le type sauvage et 9 animaux pour le sur-5p::hsf-1. (C) Les essais de couvain ont été mesurés sur les mêmes animaux que (B) où les œufs ont été élevés à 20 °C pendant 2 jours pour permettre l’éclosion, et tous les œufs éclos ont été comptés. = p < 0,001 calculé à l’aide de tests de Mann-Whitney non paramétriques. Chaque point représente un seul animal et les lignes représentent la médiane et l’interquartile. Veuillez cliquer ici pour voir une version agrandie de cette figure.
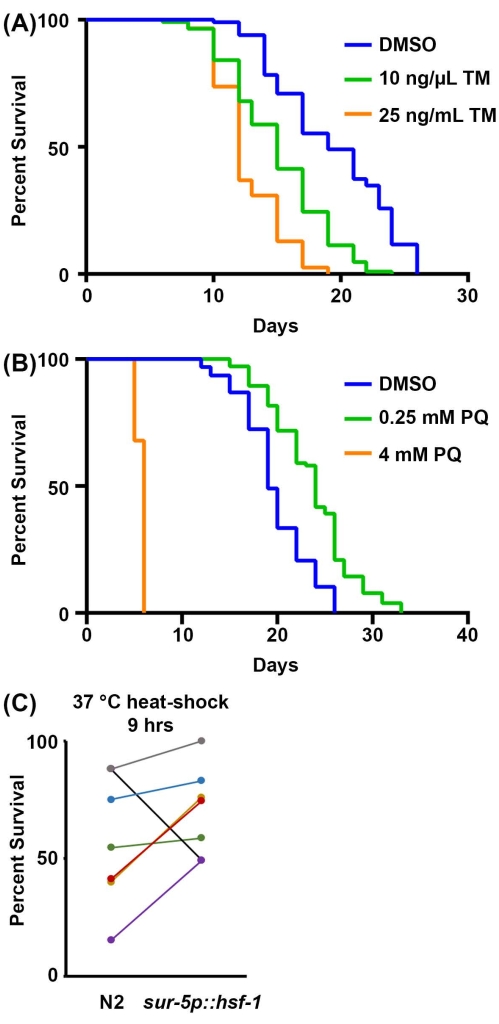
Figure 3 : Résilience au stress en tant qu’indicateur de la santé de l’organisme. (A) Essai de survie d’animaux N2 élevés sur la bactérie ARNi vecteur vide à 20 °C. Les animaux ont été déplacés vers des plaques contenant soit 1 % de DMSO, 10 ng/μL de tunicamycine (TM) ou 25 ng/μL TM au jour 1 de l’âge adulte. B) Essai de survie des animaux N2 élevés sur la bactérie ARNi vecteur vide à 20 °C. Les animaux ont été élevés à partir de l’écoutille sur des plaques contenant soit de l’eau, soit 0,25 mM de paraquat (PQ), soit 4 mM PQ. Pour A-B, les animaux ont été marqués pour la mort tous les 2 jours jusqu’à ce que tous les animaux soient enregistrés comme morts ou censurés. Les animaux avec ensachage, saillie ou explosion de la vulve, ou ceux qui rampaient sur les côtés des plaques et desséchés étaient censurés. Toutes les statistiques ont été réalisées à l’aide du test Log-Rank Mantel-Cox (tableau 2). (C) Données groupées de tous les essais de thermotolérance à 37 °C pour les animaux de type sauvage N2 par rapport à la surexpression de hsf-1 (sur-5p::hsf-1). Les données sont représentées en pourcentage vivant à l’heure = 9 h d’un test de thermotolérance, chaque ligne représentant une expérience appariée effectuée le même jour. Les animaux ont été élevés sur le vecteur vide de la bactérie ARNi à 20 °C et déplacés à 37 °C le jour 1 de l’âge adulte pour le dosage. n = 60 animaux par souche et par réplique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Réactif | Recette | ||
| Solution d’eau de Javel | Hypochlorite de sodium à 1,8 % (v/v), 0,375 M KOH | ||
| Carbenicilline | 100 mg/mL de solution mère (1000x) dans l’eau. Conserver à 4 °C jusqu’à 6 mois ou -20 °C pour un stockage à long terme | ||
| FuDR | Solution de 10 mg/mL dans l’eau. Conserver à -20 °C. | ||
| L’IPTG | Solution 1 M dans l’eau. | ||
| Bouillon de lysogénie (LB) | Dans ce protocole, la LB commerciale a été utilisée (voir tableau des matériaux), mais toutes les recettes maison LB standard utilisant de la bacto-tryptone, de l’extrait de levure et du NaCl sont suffisantes. | ||
| Solution M9 | 22 mM KH2PO4 monobasique, 42,3 mM Na2HPO4, 85,6 mM NaCl, 1 mM MgSO4 | ||
| Milieux de croissance des nématodes (NGM) | 1 mM caCl2, 5 μg/mL de cholestérol, 25 mM KPO4 pH 6,0, 1 mM MgSO4, gélose à 2 % (p/v), 0,25 % (p/v) de bacto-peptone, 51,3 mM de NaCl | ||
| Plaques ARNi NGM | 1 mM caCl2, 5 μg/mL de cholestérol, 25 mM de KPO4 pH 6,0, 1 mM MgSO4, gélose à 2 % (p/v), 0,25 % (p/v) de bacto-peptone, 51,3 mM de NaCl, 1 mM d’IPTG, 100 μg/mL de carbénicilline/ampicilline. Conserver à 4 ° C dans l’obscurité jusqu’à 3 mois | ||
| NGM ARNi DMSO | 1 mM caCl2, 5 μg/mL de cholestérol, 25 mM de KPO4 pH 6,0, 1 mM MgSO4, gélose à 2 % (p/v), 0,25 % (p/v) de bacto-peptone, 51,3 mM de NaCl, 1 mM d’IPTG, 100 μg/mL de carbénicilline/ampicilline; 1 % de DMSO | ||
| (contrôle de la tunicamycine) | |||
| NGM ARNi TM | 1 mM caCl2, 5 μg/mL de cholestérol, 25 mM de KPO4 pH 6,0, 1 mM MgSO4, gélose à 2 % (p/v), 0,25 % (p/v) de bacto-peptone, 51,3 mM de NaCl, 1 mM d’IPTG, 100 μg/mL de carbénicilline/ampicilline; 1 % de DMSO, 25 ng/μL de tunicamycine | ||
| Paraquat | Solution de 400 mM dans l’eau – doit être préparée fraîche | ||
| Tétracycline | Solution mère à 10 mg/mL (500x) dans de l’éthanol à 100 %. Conserver à -20 °C | ||
| Tunicamycine | Solution mère à 2,5 mg/mL dans du DMSO à 100 %. Conserver à -80 °C pour un stockage à long terme. Il s’agit d’une solution 100x (solution de travail 25 ng/μL) | ||
Tableau 1. Recettes pour réactifs et supports pour protocoles.
| Panneau Figure correspondant | Souche, Traitement | Durée de vie médiane | # Décès/# Total | valeur de p (Log-Rank) | |
| 1A | N2, ARNi vectoriel, 20 °C | 17 | 74/120 | -- | |
| N2, hsf-1 ARNi, 20 °C | 11 | 65/120 | <0.001 | ||
| 1B | N2, ARNi vectoriel, FUDR, 20 °C | 19 | 120/120 | -- | |
| N2, HRNi hsf-1, FUDR, 20 °C | 11 | 116/120 | <0.001 | ||
| 1C | N2, glp-4(bn2), ARNi vectoriel, 25 °C | 13 | 115/121 | -- | |
| N2, glp-4(bn2), hsf-1 ARNi, 25 °C | 4 | 120/120 | < 0,001 | ||
| 2A | N2, ARNi vectoriel, 20 °C, 1 % DMSO | 19 | 85/120 | -- | |
| N2, ARNi vecteur, 20 °C, 10 ng/μL de tunicamycine | 15 | 109/120 | <0.001 | ||
| N2, ARNi vecteur, 20 °C, 25 ng/μL de tunicamycine | 12 | 117/120 | <0.001 | ||
| 2B | N2, ARNi vectoriel, 20 °C | 19 | 84/120 | -- | |
| N2, ARNi vectoriel, 20 °C, paraquat de 0,25 mM | 24 | 91/120 | <0.001 | ||
| N2, ARNi vectoriel, 20 °C, paraquat de 4 mM | 6 | 50/120 | <0.001 | ||
Tableau 2. Statistiques sur la durée de vie et la résilience au stress.
Discussion
La durée de vie, définie plus simplement comme la durée de vie, est un phénomène binaire clair dans la plupart des organismes - soit un organisme est vivant ou ne l’est pas. Cependant, la longévité n’est pas toujours en corrélation avec la santé d’un organisme. Par exemple, les modèles d’hormèse mitochondriale où l’exposition au stress mitochondrial augmente considérablement la durée de vie sont généralement parmi les animaux ayant la plus longue durée de vie, mais présentent un retard de croissance et une diminution de la fonction métabolique37,54. De même, les animaux présentant des réponses au stress du réticulum endoplasmique hyperactif présentent également certains comportements et phénotypes qui peuvent être corrélés à une diminution de la santé, malgré une amélioration spectaculaire de l’homéostasie des protéines et de la durée de vie36,49. Enfin, de nombreux paradigmes de longévité dans les organismes modèles, y compris l’augmentation de la fonction HSF-155, l’augmentation de la fonction XBP-156 et la modification de la signalisation FoxO57, sont tous corrélés à un risque accru de cancer, et il est indiscutable qu’une durée de vie prolongée n’est pas bénéfique si un organisme est dans une lutte constante contre le cancer et d’autres maladies de santé. Par conséquent, la longévité ne peut pas être une mesure autonome en biologie du vieillissement.
Ainsi, le concept de healthspan a été un domaine en pleine croissance dans la biologie du vieillissement. La durée de santé, vaguement définie comme la période de la vie où l’on est en bonne santé, est plus difficile à déterminer que la longévité. Cependant, contrairement à la longévité, le concept de « santé » est compliqué, car il existe de nombreuses lectures différentes de la santé de l’organisme: au niveau de l’organisme, il y a la fonction / force musculaire, la fonction neuronale / cognitive, la santé reproductive, etc.; au niveau cellulaire, il y a l’homéostasie des protéines, l’homéostasie des lipides, l’homéostasie du glucose, le métabolisme, etc. En 2014, les biologistes du vieillissement ont définitivement caractérisé les caractéristiques biologiques du vieillissement avec la définition structurée qu’il doit s’agir de quelque chose qui se décompose naturellement pendant le vieillissement et peut être modifié expérimentalement de sorte que l’exacerbation expérimentale devrait accélérer le vieillissement et l’intervention expérimentale devrait ralentir le vieillissement. Ces neuf caractéristiques du vieillissement comprennent l’instabilité génomique, l’attrition des télomères, les altérations épigénétiques, la perte d’homéostasie des protéines (protéostase), l’épuisement des cellules souches, la signalisation intercellulaire altérée, le dysfonctionnement mitochondrial, la détection des nutriments dérégulée et la sénescence cellulaire58. Depuis lors, de nombreuses études soutiennent que d’autres facteurs devraient être inclus, y compris les protéines extracellulaires et la physiologie systémique telles que l’immunité et l’inflammation59. En fin de compte, la définition complexe de la durée de santé exige que la santé de l’organisme soit mesurée à l’aide de plusieurs méthodes différentes.
Par conséquent, dans ce manuscrit, plusieurs méthodes sont présentées pour mesurer divers aspects de la durée de santé à l’aide du modèle de nématode, C. elegans. Nous testons le comportement locomoteur à l’aide de tests de battement, la santé reproductive en utilisant le nombre d’œufs et la taille de la couvée, et la sensibilité au stress. En effet, le comportement locomoteur est une méthode de référence pour mesurer la durée de santé, car les organismes présentent une perte significative de motilité et de mouvement au cours du vieillissementde 51 ans. La perte du comportement locomoteur peut être attribuée à de multiples caractéristiques du vieillissement, car la fonction musculaire chez C. elegans dépend de la protéostase60 appropriée, du dysfonctionnement mitochondrial61 et de la signalisation neurone-muscle62. Bien que ce manuscrit se concentre sur une mesure du comportement locomoteur, il est important de noter qu’il existe de nombreuses autres méthodes, notamment la motilité des animaux sur une plaque de gélose solide, la réponse au toucher51 et les tests de chimiotaxie63. Cependant, ces méthodes nécessitent généralement des appareils d’enregistrement plus sophistiqués, l’utilisation d’un logiciel de suivi des vers ou l’utilisation de produits chimiques coûteux, dangereux ou volatils, qui peuvent tous être prohibitifs dans certains contextes de recherche.
En outre, les tests pour le nombre d’œufs et la taille du couvain sont présentés comme une méthode de mesure de la santé génésique et comme la méthode la plus simple pour mesurer la division cellulaire chez les vers adultes, car les vers adultes sont post-mitotiques et seules les cellules germinales et les embryons subissent une division cellulaire dans un ver adulte64. En tant que mesure de la division cellulaire, la santé reproductive peut être pertinente pour les caractéristiques de vieillissement de la sénescence cellulaire et de l’épuisement des cellules souches. La santé reproductive peut être affectée par de nombreux facteurs, y compris l’infection pathogène65 ou l’exposition au stress49, bien qu’il n’y ait pas de corrélation directe entre la santé reproductive et la longévité. En fait, certains animaux à longue durée de vie présentent une diminution significative de la taille de couvée49, et il est même possible qu’il existe une corrélation inverse entre la longévité et la taille de couvée50. Ce n’est pas un phénomène spécifique à C. elegans, car des effets néfastes de la reproduction sur la longévité ont longtemps été observés chez l’homme66, les chiens de compagnie67 et les souris68. Néanmoins, nous fournissons le nombre d’œufs et la taille des couvées comme une méthode fiable et peu coûteuse pour mesurer la santé reproductive avec la mise en garde que la santé reproductive peut ne pas être corrélée avec la longévité ou la durée de vie.
Enfin, les tests de survie sont proposés comme mesure indirecte de la santé de l’organisme. Il est important de noter que les réponses au stress cellulaire, y compris la réponse au stress thermique69 et au stressER 35, diminuent rapidement au cours du processus de vieillissement et ont une pertinence directe avec la marque de vieillissement de la protéostasie70,71. En revanche, les réponses hyperactives au stress peuvent augmenter considérablement la durée de vie en favorisant la résilience au stress 35,37,38. Bien que cette étude se concentre sur les méthodes les plus simples et les moins coûteuses, il existe un grand nombre de méthodes alternatives pour les tests de résistance au stress pour la thermotolérante41 et le stress oxydatif66, chacune nécessitant un ensemble différent d’équipements et de consommables. Au-delà des simples études d’exposition aux facteurs de stress, d’autres méthodes physiologiques peuvent être réalisées en fonction de l’accès à l’équipement. Par exemple, un analyseur de flux extracellulaire peut surveiller la fonction mitochondriale et la respiration cellulaire73; les microscopes à dissection fluorescente permettront de mesurer les rapporteurs transcriptionnels pour l’activation de la réponse au stress20; et des microscopes composés ou confocaux à haute résolution peuvent être utilisés pour mesurer la morphologie des organites avec des sondes fluorescentes pour les mitochondries74, le réticulum endoplasmique 75,76 et le cytosqueletted’actine 77.
Comme dernier avertissement pour les mesures de la longévité, bien que des méthodes chimiques et génétiques de stérilisation des vers soient proposées pour réduire considérablement les coûts, il est important de noter que les deux peuvent avoir un impact direct sur la durée de vie. Par exemple, l’exposition au FUDR a déjà eu un impact sur la durée de vie et la thermotolérabilité45. Et bien que le mutant glp-4(bn2) lui-même n’ait pas d’effets directs sur la durée de vie, la croissance à 25 °C est un léger stress thermiquede 33,34 et peut donc avoir un impact sur la durée de vie2. Il existe d’autres méthodes pour stériliser C. elegans, y compris la stérilité médiée par l’auxine78 ou d’autres mutants déficients en spermatozoïdes sensibles à la température79. Cependant, toutes les méthodes ont quelques mises en garde, et il faut prendre soin d’utiliser le test le moins préjudiciable pour les besoins scientifiques de chaque laboratoire. Une dernière limite des études de longévité est la variabilité potentielle qui peut se produire en raison de la faible taille des échantillons ou simplement d’une erreur objective de l’investigateur. Cela peut être contourné car de nouvelles technologies naissent dans les technologies de durée de vie automatisée80, mais encore une fois, ces systèmes sont coûteux et nécessitent des équipements et des compétences en ingénierie et en informatique. En fin de compte, la collection de méthodes fournies ici est un ensemble fiable d’outils qui peuvent être rapidement adaptés et appris dans presque toutes les institutions et fournissent une base solide pour la biologie du vieillissement.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt financier concurrent.
Remerciements
G.G. est soutenu par T32AG052374 et R.H.S. est soutenu par R00AG065200 du National Institute on Aging. Nous remercions la CCG (financée par le NIH Office of Research Infrastructure Program P40 OD010440) pour les souches.
matériels
| Name | Company | Catalog Number | Comments |
| APEX IPTG | Genesee | 18-242 | for RNAi |
| Bacto Agar | VWR | 90000-764 | for NGM plates |
| Bacto Peptone | VWR | 97064-330 | for NGM plates |
| Calcium chloride dihydrate | VWR | 97061-904 | for NGM plates |
| Carbenicillin | VWR | 76345-522 | for RNAi |
| Cholesterol | VWR | 80057-932 | for NGM plates |
| DMSO | VWR | BDH1115-1LP | solvent for drugs |
| LB Broth | VWR | 95020-778 | for LB |
| Magnesium sulfate heptahydrate | VWR | 97062-132 | for NGM plates, M9 |
| Paraquat | Sigma-Aldrich | 36541 | for oxidative/mitochondrial stress |
| Potassium Chloride | VWR | 97061-566 | for bleach soluton |
| Potassium phosphate dibasic | VWR | EM-PX1570-2 | for NGM plates |
| Potassium phosphate monobasic | VWR | EM-PX1565-5 | for M9 |
| S7E Dissecting Scope | Leica | 10450840 | Standard dissecting microscope |
| Sodium Chloride | VWR | EM-SX0420-5 | for NGM plates, M9 |
| Sodium hypochlorite | VWR | RC7495.7-32 | for bleach solution |
| Sodium phosphate dibasic | VWR | 71003-472 | for M9 |
| Tetracycline hydrochloride | VWR | 97061-638 | for RNAi |
| Tunicamycin | Sigma-Aldrich | T7765-50MG | for ER stress |
Références
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Klass, M. R. Aging in the nematode Caenorhabditis elegans: major biological and environmental factors influencing life span. Mechanisms of Ageing and Development. 6 (6), 413-429 (1977).
- Friedman, D. B., Johnson, T. E. A mutation in the age-1 gene in Caenorhabditis elegans lengthens life and reduces hermaphrodite fertility. Genetics. 118 (1), 75-86 (1988).
- Kenyon, C., Chang, J., Gensch, E., Rudner, A., Tabtiang, R. A C. elegans mutant that lives twice as long as wild type. Nature. 366 (6454), 461-464 (1993).
- Lithgow, G. J., White, T. M., Melov, S., Johnson, T. E. Thermotolerance and extended life-span conferred by single-gene mutations and induced by thermal stress. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7540-7544 (1995).
- Epel, E. S., Lithgow, G. J. Stress biology and aging mechanisms: toward understanding the deep connection between adaptation to stress and longevity. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 69, 10-16 (2014).
- Luo, Y. Long-lived worms and aging. Redox Report: Communications in Free Radical Research. 9 (2), 65-69 (2004).
- Tissenbaum, H. A. Using C. elegans for aging research. Invertebrate Reproduction & Development. 59, 59-63 (2015).
- Zhang, S., Li, F., Zhou, T., Wang, G., Li, Z. Caenorhabditis elegans as a useful model for studying aging mutations. Frontiers in Endocrinology. 11, 554994 (2020).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Rual, J. -. F., et al. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome Research. 14 (10), 2162-2168 (2004).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
- Reboul, J., et al. Open-reading-frame sequence tags (OSTs) support the existence of at least 17,300 genes in C. elegans. Nature Genetics. 27 (3), 332-336 (2001).
- Lee, S. S., et al. A systematic RNAi screen identifies a critical role for mitochondria in C. elegans longevity. Nature Genetics. 33 (1), 40-48 (2003).
- Reinke, S. N., Hu, X., Sykes, B. D., Lemire, B. D. Caenorhabditis elegans diet significantly affects metabolic profile, mitochondrial DNA levels, lifespan and brood size. Molecular Genetics and Metabolism. 100 (3), 274-282 (2010).
- Revtovich, A. V., Lee, R., Kirienko, N. V. Interplay between mitochondria and diet mediates pathogen and stress resistance in Caenorhabditis elegans. PLOS Genetics. 15 (3), 1008011 (2019).
- Pang, S., Curran, S. P. Adaptive capacity to bacterial diet modulates aging in C. elegans. Cell Metabolism. 19 (2), 221-231 (2014).
- Brooks, K. K., Liang, B., Watts, J. L. The influence of bacterial diet on fat storage in C. elegans. PLOS ONE. 4 (10), 7545 (2009).
- Soukas, A. A., Kane, E. A., Carr, C. E., Melo, J. A., Ruvkun, G. Rictor/TORC2 regulates fat metabolism, feeding, growth, and life span in Caenorhabditis elegans. Genes & Development. 23 (4), 496-511 (2009).
- Bar-Ziv, R., et al. Measurements of physiological stress responses in C. Elegans. Journal of Visualized Experiments: JoVE. (159), e61001 (2020).
- Xiao, R., et al. RNAi interrogation of dietary modulation of development, metabolism, behavior, and aging in C. elegans. Cell Reports. 11 (7), 1123-1133 (2015).
- Calixto, A., Chelur, D., Topalidou, I., Chen, X., Chalfie, M. Enhanced neuronal RNAi in C. elegans using SID-1. Nature Methods. 7 (7), 554-559 (2010).
- Dickinson, D. J., Goldstein, B. CRISPR-based methods for Caenorhabditis elegans genome engineering. Genetics. 202 (3), 885-901 (2016).
- Kim, H. -. M., Colaiácovo, M. P. CRISPR-Cas9-guided genome engineering in C. elegans. Current Protocols in Molecular Biology. 129 (1), 106 (2019).
- Farboud, B., Severson, A. F., Meyer, B. J. Strategies for efficient genome editing using CRISPR-Cas9. Genetics. 211 (2), 431-457 (2019).
- Transformation and Microinjection. WormBook: The Online Review of C. elegans Biology Available from: https://www.ncbi.nlm.nih.gov/books/NBK19648/ (2006)
- Frøkjaer-Jensen, C., et al. Single-copy insertion of transgenes in Caenorhabditis elegans. Nature Genetics. 40 (11), 1375-1383 (2008).
- Kaymak, E., et al. Efficient generation of transgenic reporter strains and analysis of expression patterns in Caenorhabditis elegans using Library MosSCI. Developmental Dynamics: an Official Publication of the American Association of Anatomists. 245 (9), 925-936 (2016).
- Mariol, M. -. C., Walter, L., Bellemin, S., Gieseler, K. A rapid protocol for integrating extrachromosomal arrays with high transmission rate into the C. elegans genome. Journal of Visualized Experiments: JoVE. (82), (2013).
- Rastogi, S., et al. Caenorhabditis elegans glp-4 encodes a valyl aminoacyl tRNA synthetase. G3: Genes|Genomes|Genetics. 5 (12), 2719-2728 (2015).
- Beanan, M. J., Strome, S. Characterization of a germ-line proliferation mutation in C. elegans. Development. 116 (3), 755-766 (1992).
- Santi, D. V., McHenry, C. S. 5-Fluoro-2′-Deoxyuridylate: covalent complex with thymidylate synthetase. Proceedings of the National Academy of Sciences. 69 (7), 1855-1857 (1972).
- Lithgow, G. J., White, T. M., Hinerfeld, D. A., Johnson, T. E. Thermotolerance of a long-lived mutant of Caenorhabditis elegans. Journal of Gerontology. 49 (6), 270-276 (1994).
- Labbadia, J., Morimoto, R. I. The biology of proteostasis in aging and disease. Annual Review of Biochemistry. 84 (1), 435-464 (2015).
- Taylor, R. C., Dillin, A. XBP-1 is a cell-nonautonomous regulator of stress resistance and longevity. Cell. 153 (7), 1435-1447 (2013).
- Higuchi-Sanabria, R., et al. Divergent nodes of non-autonomous UPRER signaling through serotonergic and dopaminergic neurons. Cell Reports. 33 (10), 108489 (2020).
- Durieux, J., Wolff, S., Dillin, A. The cell-non-autonomous nature of electron transport chain-mediated longevity. Cell. 144 (1), 79-91 (2011).
- Morley, J. F., Morimoto, R. I. Regulation of longevity in Caenorhabditis elegans by heat shock factor and molecular chaperones. Molecular Biology of the Cell. 15 (2), 657-664 (2004).
- Heifetz, A., Keenan, R. W., Elbein, A. D. Mechanism of action of tunicamycin on the UDP-GlcNAc:dolichyl-phosphate Glc-NAc-1-phosphate transferase. Biochemistry. 18 (11), 2186-2192 (1979).
- Castello, P. R., Drechsel, D. A., Patel, M. Mitochondria are a major source of paraquat-induced reactive oxygen species production in the brain. The Journal of Biological Chemistry. 282 (19), 14186-14193 (2007).
- Park, H. -. E. H., Jung, Y., Lee, S. -. J. V. Survival assays using Caenorhabditis elegans. Molecules and Cells. 40 (2), 90-99 (2017).
- Gardner, M., Rosell, M., Myers, E. M. Measuring the effects of bacteria on C. Elegans behavior using an egg retention assay. Journal of Visualized Experiments: JoVE. (80), e51203 (2013).
- Waggoner, L. E., Hardaker, L. A., Golik, S., Schafer, W. R. Effect of a neuropeptide gene on behavioral states in Caenorhabditis elegans egg-laying. Genetics. 154 (3), 1181-1192 (2000).
- Zevian, S. C., Yanowitz, J. L. Methodological considerations for heat shock of the nematode Caenorhabditis elegans. Methods. 68 (3), 450-457 (2014).
- Feldman, N., Kosolapov, L., Ben-Zvi, A. Fluorodeoxyuridine improves Caenorhabditis elegans proteostasis independent of reproduction onset). PLOS ONE. 9 (1), 85964 (2014).
- Hsu, A. -. L., Murphy, C. T., Kenyon, C. Regulation of aging and age-related disease by DAF-16 and heat-shock factor. Science. 300 (5622), 1142-1145 (2003).
- Bansal, A., Zhu, L. J., Yen, K., Tissenbaum, H. A. Uncoupling lifespan and healthspan in Caenorhabditis elegans longevity mutants. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), 277-286 (2015).
- Hodgkin, J., Barnes, T. M. More is not better: brood size and population growth in a self-fertilizing nematode. Proceedings. Biological Sciences. 246 (1315), 19-24 (1991).
- Ozbey, N. P., et al. Tyramine Acts Downstream of Neuronal XBP-1s to coordinate inter-tissue UPRER activation and behavior in C. elegans. Developmental Cell. 55 (6), 754-770 (2020).
- Lee, Y., et al. Inverse correlation between longevity and developmental rate among wild C. elegans strains. Aging. 8 (5), 986-994 (2016).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nature Methods. 8 (7), 592-598 (2011).
- Lee, S. -. J., Hwang, A. B., Kenyon, C. Inhibition of respiration extends C. elegans life span via reactive oxygen species that increase HIF-1 activity. Current Biology: CB. 20 (23), 2131-2136 (2010).
- Baird, N. A., et al. HSF-1-mediated cytoskeletal integrity determines thermotolerance and life span. Science. 346 (6207), 360-363 (2014).
- Houtkooper, R. H., et al. Mitonuclear protein imbalance as a conserved longevity mechanism. Nature. 497 (7450), 451-457 (2013).
- Carpenter, R. L., Gökmen-Polar, Y. HSF1 as a cancer biomarker and therapeutic target. Current Cancer Drug Targets. 19 (7), 515-524 (2019).
- Chen, S., et al. The emerging role of XBP1 in cancer. Biomedicine & Pharmacotherapy. 127, 110069 (2020).
- Yadav, R. K., Chauhan, A. S., Zhuang, L., Gan, B. FoxO transcription factors in cancer metabolism. Seminars in Cancer Biology. 50, 65-76 (2018).
- López-Otín, C., Blasco, M. A., Partridge, L., Serrano, M., Kroemer, G. The hallmarks of aging. Cell. 153 (6), 1194-1217 (2013).
- Kennedy, B. K., et al. Geroscience: linking aging to chronic disease. Cell. 159 (4), 709-713 (2014).
- Ben-Zvi, A., Miller, E. A., Morimoto, R. I. Collapse of proteostasis represents an early molecular event in Caenorhabditis elegans aging. Proceedings of the National Academy of Sciences. 106 (35), 14914-14919 (2009).
- Hewitt, J. E., et al. Muscle strength deficiency and mitochondrial dysfunction in a muscular dystrophy model of Caenorhabditis elegans and its functional response to drugs. Disease Models & Mechanisms. 11 (12), (2018).
- Gao, S., Zhen, M. Action potentials drive body wall muscle contractions in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 108 (6), 2557-2562 (2011).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. Journal of Visualized Experiments: JoVE. (74), e50069 (2013).
- Flemming, A. J., Shen, Z. Z., Cunha, A., Emmons, S. W., Leroi, A. M. Somatic polyploidization and cellular proliferation drive body size evolution in nematodes. Proceedings of the National Academy of Sciences of the United States of America. 97 (10), 5285-5290 (2000).
- Madhu, B. J., Salazar, A. E., Gumienny, T. L. Caenorhabditis elegans egg-laying and brood-size changes upon exposure to Serratia marcescens and Staphylococcus epidermidis are independent of DBL-1 signaling. microPublication Biology. 2019, (2019).
- Westendorp, R. G., Kirkwood, T. B. Human longevity at the cost of reproductive success. Nature. 396 (6713), 743-746 (1998).
- Hoffman, J. M., Creevy, K. E., Promislow, D. E. L. Reproductive capability is associated with lifespan and cause of death in companion dogs. PLOS ONE. 8 (4), 61082 (2013).
- Garratt, M., Try, H., Smiley, K. O., Grattan, D. R., Brooks, R. C. Mating in the absence of fertilization promotes a growth-reproduction versus lifespan trade-off in female mice. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15748-15754 (2020).
- Labbadia, J., Morimoto, R. I. Repression of the heat shock response is a programmed event at the onset of reproduction. Molecular Cell. 59 (4), 639-650 (2015).
- Higuchi-Sanabria, R., Frankino, P. A., Paul, J. W., Tronnes, S. U., Dillin, A. A futile battle? Protein quality control and the stress of aging. Developmental Cell. 44 (2), 139-163 (2018).
- Dutta, N., Garcia, G., Higuchi-Sanabria, R. Hijacking cellular stress responses to promote lifespan. Frontiers in Aging. 3, (2022).
- Senchuk, M. M., Dues, D. J., Van Raamsdonk, J. M. Measuring oxidative stress in Caenorhabditis elegans: paraquat and juglone sensitivity assays. Bio-protocol. 7 (1), 2086 (2017).
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: mitochondrial function using the seahorse system. Methods in molecular biology. 1710, 285-293 (2018).
- Daniele, J. R., et al. High-throughput characterization of region-specific mitochondrial function and morphology. Scientific Reports. 7 (1), 6749 (2017).
- Xu, N., et al. The FATP1-DGAT2 complex facilitates lipid droplet expansion at the ER-lipid droplet interface. The Journal of Cell Biology. 198 (5), 895-911 (2012).
- Daniele, J. R., et al. UPRER promotes lipophagy independent of chaperones to extend life span. Science Advances. 6 (1), 1441 (2020).
- Higuchi-Sanabria, R., et al. Spatial regulation of the actin cytoskeleton by HSF-1 during aging. Molecular Biology of the Cell. 29 (21), 2522-2527 (2018).
- Kasimatis, K. R., Moerdyk-Schauwecker, M. J., Phillips, P. C. Auxin-mediated sterility induction system for longevity and mating studies in Caenorhabditis elegans. G3: Genes|Genomes|Genetics. 8 (8), 2655-2662 (2018).
- Fabian, T. J., Johnson, T. E. Production of age-synchronous mass cultures of Caenorhabditis elegans. Journal of Gerontology. 49 (4), 145-156 (1994).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon