Method Article
Исследование недорогих методов измерения продолжительности жизни и продолжительности здоровья у Caenorhabditis elegans
В этой статье
Резюме
Caenorhabditis elegans служат отличной модельной системой с надежными и недорогими методами обследования продолжительности здоровья, продолжительности жизни и устойчивости к стрессу.
Аннотация
Открытие и развитие Caenorhabditis elegans как модельного организма оказало влияние на биологию, особенно в области старения. Многие исторические и современные исследования выявили тысячи парадигм, изменяющих продолжительность жизни, включая генетические мутации, трансгенную экспрессию генов и гормезис, полезное, низкосортное воздействие стресса. Благодаря своим многочисленным преимуществам, включая короткую продолжительность жизни, простое и недорогое обслуживание и полностью секвенированный геном с гомологией почти двух третей всех человеческих генов, C. elegans быстро был принят в качестве выдающейся модели для биологии стресса и старения. Здесь исследуется несколько стандартизированных методов измерения продолжительности жизни и здоровья, которые могут быть легко адаптированы практически в любой исследовательской среде, особенно с ограниченным оборудованием и средствами. Невероятная полезность C. elegans подчеркивает способность выполнять мощные генетические анализы в биологии старения без необходимости обширной инфраструктуры. Наконец, для рассмотрения обсуждаются ограничения каждого анализа и альтернативные подходы.
Введение
Со времени публикации «Генетики Caenorhabditis elegans», одной из самых влиятельных статей Сиднея Бреннера в 1974 году, этот микроскопический червь считался выдающейся модельной системой для изучения биологических тайн1. В 1977 году Майкл Р. Класс опубликовал метод измерения продолжительности жизни C. elegans и создал эту модельную систему для изучения старения2. Исследование, чтобы понять связь между стрессом и долголетием, началось с идентификации одной мутации в гене age-1, что привело к увеличению продолжительности жизни у C. elegans3. Кроме того, современные исследования выявили другие мутации, увеличивающие продолжительность жизни, которые выявили долгоживущих мутантных червей, которые проявляют повышенную устойчивость к стрессу 4,5,6. Благодаря своим многочисленным преимуществам, включая короткую продолжительность жизни, простоту обслуживания, полностью секвенированный геном, содержащий гомологию примерно для двух третей всех болезнетворных генов человека, доступность и простоту использования библиотек РНК-интерференции (РНКи) и физиологическое сходство с людьми 7,8,9, C. elegans быстро был принят в качестве выдающейся модели для биологии стресса и старения.
Возможно, самыми большими преимуществами C. elegans являются его чрезвычайно низкая стоимость обслуживания, простота экспериментов и разнообразие генетических инструментов, доступных для исследований. C. elegans обычно выращивают на твердой агаровой среде с пищевым источником E. coli. Двумя широко используемыми штаммами E. coli являются стандартный OP50, штамм B, который, пожалуй, является наиболее часто используемым10, и HT115, штамм K-12, который используется в основном для экспериментов RNAi11,12. Штамм HT115 K-12 несет делецию в RNAIII RNase, мутацию, которая необходима для методов RNAi, где используются плазмиды, экспрессирующие дцРНК, соответствующие отдельным генам C. elegans. Питающие векторы дцРНК позволяют надежно нокдаунировать гены C. elegans без необходимости сложных скрещиваний или редактирования генома, поскольку бактерии, несущие эти плазмиды, могут напрямую питаться нематодам. Тысячи из этих бактериальных векторов РНКи существуют на фоне HT115, в том числе самая популярная библиотека РНКи Видаля с >19 000 отдельных РНКи конструирует13 и библиотека РНКИ Арингера с 16 757 РНКи конструирует14. Тем не менее, бактериальные диеты OP50 и HT115 имеют значительные различия в метаболическом профиле, включая различия в витамине B1215,16. Поэтому рекомендуется проводить все эксперименты на одном источнике бактерий, если это возможно, чтобы избежать взаимодействия генов и диеты, которые могут вводить несколько смешанных факторов, как описано ранее 17,18,19. Из-за своей легкости животные содержатся на OP50 для всех экспериментальных условий, описанных здесь, но все эксперименты проводятся на HT115, как описано ранее20. Вкратце, животных поддерживают на уровне OP50 и переводят в HT115 после синхронизации (после отбеливания) для согласованности между RNAi и экспериментами без RNAi. Альтернативно, также может быть использован РНAi-компетентный штамм OP50, несущий аналогичную делецию RNAIII РНКазы, обнаруженной в штамме E. coli K12HT115.
Возможно, одним из основных ограничений экспериментов RNAi у C. elegans является проблема эффективности нокдауна. В то время как эффективность нокдауна может быть проверена с помощью qPCR или западного блоттинга, они требуют дорогостоящего оборудования и реагентов и ограничены объемным анализом. Это еще больше беспокоит, глядя на конкретные клетки, такие как нейроны, которые являются рефрактерными (менее чувствительными) к РНК. В то время как эффективность РНКи в конкретных клетках может быть повышена за счет сверхэкспрессии SID-1, трансмембранного белка, необходимого для поглощения дцРНК22, это по-прежнему ограничено специфическими для типа клеток паттернами экспрессии промоторов, используемых для этих конструкций, и, таким образом, нокауты и мутации генов являются наиболее надежными средствами истощения функций генов. Помимо РНКи-опосредованного нокдауна, C. elegans также очень поддаются редактированию генома с помощью стратегий на основе CRISPR 23,24,25 и трансгенной гиперэкспрессии конструкций через микроинъекции, с возможностью интеграции трансгенных конструкций посредством облучения или интеграции на основе транспозонов 26,27,28,29 . Однако эти методы требуют дорогостоящего микроинъекционного оборудования, а высокая стоимость направляющих РНК или фермента Cas9 может запретить эти методы в учреждениях с ограниченным финансированием. Вместо этого тысячи трансгенных линий и мутантов легко доступны за несколько долларов как в Центре генетики Кенорхабдита (CGC), так и в Национальном проекте биоресурсов (NBRP). NBRP предлагает изолированные мутанты для большого количества генов C. elegans, включая опубликованные и, следовательно, проверенные мутантные штаммы, мутанты, полученные из пилотных проектов, и мутанты, которые еще предстоит охарактеризовать. Напротив, CGC является хранилищем в основном опубликованных и установленных линий C. elegans из исследовательского сообщества. Оба они поставляют штаммы по всему миру по очень разумным ценам и предлагают широкий спектр вариантов для тех, у кого ограниченные возможности синтезировать штаммы собственными силами.
Здесь предлагается кураторская коллекция методов, которые, вероятно, будут самыми дешевыми методами анализа продолжительности жизни и продолжительности здоровья у C. elegans. Все методы, представленные здесь, требуют недорогого оборудования и расходных материалов и используют только штаммы, легко доступные из CGC. Возможно, наиболее непомерно высоким для анализов долголетия и выживания у C. elegans является стоимость пластин Nematode Growth Media (NGM). Поскольку C. elegans являются гермафродитами и самооплодотворяются, стандартные анализы выживания требуют, чтобы взрослые животные постоянно удалялись от своего потомства, чтобы избежать загрязнения от потомства. Мало того, что этот процесс занимает много времени, он может стать дорогостоящим из-за необходимости примерно 100 пластин на условие для проведения одного анализа продолжительности жизни. Здесь представлены две альтернативы: использование мутанта без зародышевой линии, glp-4(bn2), или химическая стерилизация с использованием 5-фтор-2'-дезоксиуридина (FUDR). glp-4 кодирует валилоаминоацил-тРНК-синтетазу, а чувствительные к температуре glp-4(bn2) репродуктивно дефицитны при ограничительных температурах из-за снижения трансляции белка30,31. FUDR является надежным методом химической стерилизации C. elegans путем предотвращения репликации ДНК, тем самым ингибируя размножение32. Хотя FUDR может быть непомерно дорогим для некоторых лабораторий, для химической стерилизации червей требуется лишь небольшое количество, и его стабильность в виде порошка может сделать его осуществимым для большинства групп. Использование термочувствительного мутанта glp-4(bn2), безусловно, является самым дешевым вариантом, поскольку единственным требованием является инкубатор для перемещения животных на ограничительные 25 °C; однако следует отметить, что рост при 25 °C может вызвать умеренный тепловой стресс 33,34. Независимо от способа, использование стерильных животных может значительно снизить затраты на расходные материалы, необходимые для возрастных анализов.
Для изучения старения стандартные анализы продолжительности жизни являются обычными, поскольку парадигмы, которые изменяют долголетие, оказывают непосредственное влияние на старение. Тем не менее, измерения продолжительности здоровья и стрессоустойчивости предоставляют дополнительную информацию о здоровье организма. Здесь предлагается несколько методов измерения продолжительности здоровья: 1) плодовитость как мера репродуктивного здоровья; 2) размер расплода как мера здоровья развития и жизнеспособности заложенного потомства; и 3) двигательное поведение как мера мышечной функции и моторики, которые напрямую коррелируют со старением. Кроме того, предлагаются анализы стрессоустойчивости: выживание при стрессе ER, митохондриальный / окислительный стресс и выживание при тепловом стрессе. Действительно, животные с повышенной устойчивостью к стрессу ER35,36, митохондриальномустрессу 37 и тепловому стрессу38 демонстрируют увеличенную продолжительность жизни. Эр-стресс применяется путем воздействия C. elegans на туникамицин, который блокирует N-связанное гликозилирование и вызывает накопление неправильно свернутых белков39. Митохондриальный/окислительный стресс индуцируется воздействием параквата, который индуцирует образование супероксида, особенно в митохондриях40. Тепловой стресс применяется через инкубацию животных при 34-37 °C33,41. Все описанные здесь анализы могут быть выполнены с минимальным оборудованием и средствами, и предлагают различные инструменты для изучения старения в различных группах.
протокол
1. Рост и содержание C. elegans
- Заливка пластин нематодных питательных сред (NGM)
- Выращивайте C. elegans на стандартных 2% агаровых пластинах со средой роста нематод (NGM), состоящей из 1 мМ CaCl2, 5 мкг/мл холестерина, 25 мМ KPO4 (рН 6,0), 1 мМ MgSO4, 0,25% мас./об., а также 51,3 мМ NaCl.
- Для 1 л пластин NGM-агара отмерьте 2,5 г Пептона, 3,0 г NaCl и 20 г агара в колбе объемом 1 л с перемешивающим батончиком.
ПРИМЕЧАНИЕ: Рекомендуется стандартизировать конкретный источник агара, так как мы видели различия в жесткости между марками, что может повлиять на воспроизводимость. Здесь строго используется бакто-агар. Кроме того, рекомендуется добавлять агар непосредственно в колбу, находящуюся в автоклаве, так как агар не растворится полностью без нагревания, а перенос раствора, содержащего агар, приведет к потере агара и ошибкам в концентрации. - Добавьте dH2Oдо 970 мл.
ПРИМЕЧАНИЕ: 30 мл жидких добавок после стерилизации доведут конечный объем до 1 л. В наших руках ~ 951 мл dH2O потребуется, чтобы достичь 970 мл конечного объема. - Стерилизуйте раствор NGM-агара с использованием стандартного автоклава или стерилизатора среды для эффективной стерилизации.
ПРИМЕЧАНИЕ: На данный момент стерильный NGM-агар можно хранить в течение нескольких месяцев при комнатной температуре. При хранении НГМ-агар можно реликвировать в микроволновой печи с импульсами 15-45 с, чтобы раствор не закипел, или на водяной бане с подогревом. - Дайте раствору перемешаться до тех пор, пока он не остынет до 60-75 °C. Перемешивание во время охлаждения важно для предотвращения неравномерного охлаждения, которое может привести к затвердеванию некоторого количества агара.
- Пока раствор остынет, нагрейте водяную баню или бисероплетение до 65-70 °C.
- Как только раствор остынет до 60-75 °C, добавляют жидкие добавки: 2,0 мл 0,5 MCaCl2, 1 мл 5 мг/мл холестерина, 25 мл 1 M KPO4 (рН 6,0) и 0,5 M MgSO4 (см. Таблицу 1 для рецептов для всех реагентов) и дайте раствору перемешать в течение ~5 мин для обеспечения полного перемешивания.
ПРИМЕЧАНИЕ: Препараты также могут быть включены в пластины здесь (например, добавить 1 мл 100 мг / мл карбенициллина и 1 мл 1 М IPTG; добавить 10 мл 2,5 мг / мл туникамицина; добавить 10 мл параквата 400 мМ). - Погрузите колбу, содержащую NGM-агар, в водяную баню с температурой 65-70 °C, чтобы предотвратить затвердевание NGM-агара при разливе в тарелки.
- Пипетка 9-11 мл раствора в каждую 60 мм пластину или 20-30 мл раствора в каждую 100 мм пластину.
ПРИМЕЧАНИЕ: Рекомендуется использовать наименьший доступный объем пипетки, чтобы избежать утечек NGM, вызванных расширением воздуха в пипетке. Пипетка на 1-2 мл больше среды, чем будет добавлено на каждую пластину, чтобы избежать полного опорожнения пипетки, поможет предотвратить образование пузырьков. В качестве альтернативы, тарелки могут быть вручную вылиты непосредственно из бутылки в тарелку, но настоятельно рекомендуется пипетка, чтобы обеспечить пластины с равным объемом. Пластины равного объема важны для обеспечения аналогичных концентраций растворов при использовании методов, когда растворы наносятся непосредственно поверх пластины (см. этап 1.1.17). Равные объемы также позволяют легко проводить микроскопию для поддержания аналогичной фокальной плоскости на пластинах. - Поместите пипетку обратно в нагретый раствор, чтобы поддерживать температуру и предотвратить затвердевание NGM-агара.
- Повторите два вышеуказанных шага для всех пластин.
- Дайте NGM-агаровым пластинам затвердеть в течение ночи.
- После того, как пластины затвердеют, храните пластины до 3 месяцев при 4 °C или переходите к шагу 1.1.14 для посева пластин с бактериями. Храните пластины в герметичных контейнерах, чтобы сохранить влагу для поддержания качества пластин.
- Вырастите культуру OP50 в лизогенезном бульоне (LB) или эквивалентной среде выбора в течение 24-48 ч при температуре окружающей среды (~22-25 °C) или вырастите культуру HT115 в LB + антибиотики (ампициллин / углевод + тетрациклин рекомендуется для HT115) с встряхиванием при 37 °C в течение 12-16 ч.
ПРИМЕЧАНИЕ: Рекомендуется выращивать OP50 при комнатной температуре, потому что более агрессивный рост OP50 был обнаружен при 37 ° C, что влияет на продолжительность жизни C. elegans . Напротив, HT115 имеет более медленную скорость роста и делает менее плотные культуры; таким образом, рекомендуется выращивать HT115 при 37 °C с встряхиванием. - Посейте объем 100-200 мкл насыщенной культуры OP50/HT115 на пластину 60 мм или 1 мл для пластины 100 мм.
- Дайте тарелкам высохнуть в течение ночи на столешнице и дайте дополнительный день высохнуть, если тарелки все еще влажные. Храните пластины в герметичных контейнерах при 4 °C в течение ~2 месяцев.
- Необязательно: Добавляйте препараты непосредственно на засеянные NGM-агаровые пластины (например, 100 мкл раствора FUDR 10 мг/мл) для химической стерилизации червей.
- Поддержание запасов C. elegans
- Правильно маркируйте нижнюю часть засеянной NGM-агаровой пластины. Маркировка краев на нижней части пластины, чтобы предотвратить препятствие прохождению света на стандартных рассеченных микроскопах.
- Используя стандартный микроскоп для рассечения, зачерпните бактерии по выбору на C. elegans pick.
ПРИМЕЧАНИЕ: В этом протоколе использовался кирка, состоящая из 90%/10% платиновой/иридиевой проволоки, прикрепленной к концу стеклянной пипетки Пастера. - Используя бактерии, соберите 10-20 яиц, животных L1, L2 или L3 и перенесите их на недавно помеченную семенную пластину NGM-агара.
ПРИМЕЧАНИЕ: Лучше всего собирать молодых животных; По опыту авторов, для стандартных диких животных перемещение 10-20 яиц на молодое животное позволит пластине расти при 15 °C без голодания. Для трансгенных или мутантных животных со сниженной плодовитостью в тарелку следует переместить больше животных. - Для животных с плодовитостью дикого типа и выращенных при 15 °C повторяйте шаги 1.2.1-1.2.3 каждые 7 дней для поддержания еженедельного запаса. Для животных, выращенных при 20 °C, повторяйте шаги 1.2.1-1.2.3 каждые 4-5 дней, чтобы предотвратить голодание.
- Синхронизация червей via отбеливание
ПРИМЕЧАНИЕ: Полная 60-миллиметровая NGM-агаровая пластина (например, 1-недельные пластины, выращенные при 15 °C) обеспечит достаточное количество животных для большинства описанных стандартных анализов. Как правило, одна взрослая особь (взрослая особь, полная яиц) дает 10-15 яиц.42, а полная 60-миллиметровая NGM-агаровая пластина имеет от 100 до 200 взрослых особей, обеспечивая ~ 1000-2000 яиц.- Для более масштабных экспериментов, требующих большего количества животных, нарежьте полный 60-миллиметровый NGM-агар на четыре-шесть равных частей и разрежьте их на посеянных 100-миллиметровых пластинах для расширения.
ПРИМЕЧАНИЕ: Здесь дробление относится к разрезанию куска плиты NGM-агара, содержащей червей, и перемещению всего куска агара + червей на новую пластину, червячной стороной вниз, чтобы позволить червям заползти на новую пластину. В качестве системы отсчета, животные с плодовитостью дикого типа будут производить полную пластину 100 мм, если их выращивать при 20 ° C в течение 2-3 дней после измельчения. - Чтобы начать сбор нематод, налейте небольшое количество раствора М9 (таблица 1) на тарелки, содержащие червей, следя за тем, чтобы не переполнить чашку Петри. Осторожно закрутите раствор М9, чтобы ослабить червей с бактериальных газонов.
- Собирайте гравидных взрослых червей с помощью серологической пипетки, следя за тем, чтобы не проткнуть агар кончиком пипетки.
ПРИМЕЧАНИЕ: Стеклянные серологические пипетки рекомендуются, так как C. elegans , как правило, прилипают к пластику. Если стеклянные пипетки недоступны, рекомендуется начинать с большего количества животных, чем необходимо, так как некоторые из них будут потеряны из-за прилипания к пластиковым пипеткам. - Гранулирование животных центрифугированием в течение 30 с при 1 100 х г. Аспирировать супернатанта.
ПРИМЕЧАНИЕ: Гранула C. elegans очень рыхлая , поэтому позаботьтесь о том, чтобы не встряхнуть и не нарушить гранулу во время аспирации надосадочного вещества. - Пока животные находятся на центрифугировании, приготовьте 5 мл отбеливающего раствора на штамм (подробную информацию о рецепте см. в Таблице 1 ); на 5 мл раствора смешать 1,5 мл 6% гипохлорита натрия (отбеливателя), 0,75 мл 5 М NaOH или KOH и 2,75 мл dH2O.
ВНИМАНИЕ: Гипохлорит натрия и растворы гидроксида высокой концентрации являются коррозионными, и поэтому рекомендуется носить перчатки и лабораторное покрытие при обращении. - Добавьте 5 мл отбеливающего раствора в смесь червячной гранулы/М9.
- Проверяйте червей под рассекающим микроскопом каждые несколько минут, пока все взрослые тела червей не будут растворены и в смеси не останутся только яйца. Энергично встряхните смесь червя и отбеливателя, чтобы ускорить процесс отбеливания.
ПРИМЕЧАНИЕ: Оставление яиц внутри отбеливающей смеси в течение длительных периодов времени приведет к повреждению яиц и повлияет на жизнеспособность животных. Для диких животных отбеливание обычно занимает 4-6 мин с встряхиванием. Таким образом, рекомендуется проверять животных под микроскопом с интервалом 30 с, начиная с отметки 4 мин. - Гранулируйте яйца, вращая смесь яйцо/отбеливатель в течение 30 с при 1 100 х г.
ПРИМЕЧАНИЕ: Некоторые конические трубки объемом 15 мл имеют градиентные линии на внутренней стороне трубки. Для этих трубок рекомендуется прясть яйца с более высокой скоростью (например, 30 с при 2000 х г), чтобы яйца не попадали на дно трубки и не оставались на градиентных линиях. - Аспирировать отбеливающим раствором.
ПРИМЕЧАНИЕ: Яичная гранула жестче, чем гранула червя, но все же может быть легко нарушена. Поэтому позаботьтесь о том, чтобы не встряхнуть трубку после центрифугирования. - Вымойте яйца, добавив раствор M9 до 15 мл и перевернув трубку четыре или пять раз, чтобы убедиться, что яйца полностью диспергированы в растворе M9.
- Пеллетные яйца центрифугированием в течение 30 с при 1 100 х г и аспирированием из раствора М9.
- Повторите вышеуказанные два шага в общей сложности четыре промывки, чтобы удалить любой отбеливатель из яичной смеси.
- Повторно суспендировать яйца в 100 мкл до 2 мл раствора М9 (т.е. в зависимости от общего количества обесцвеченных червей) после окончательной промывки. Тщательно встряхните яйца, чтобы разбить комочки и убедиться, что гранула полностью суспендирована.
- В качестве альтернативы, животные могут быть арестованы L1 для более жесткой временной синхронизации; для ареста L1 добавьте раствор M9 к грануле яйца до ~10 мл в конической пробирке объемом 15 мл. Позвольте червям вращаться в ротаторе до 24 ч при температуре 20 °C или окружающей среды. Животным L1 обычно требуется на полдня меньше для достижения зрелого возраста по сравнению со временем яиц, описанным на этапе 1.3.16.
- Приблизительно определить концентрацию яйца (или концентрацию L1; см. этап 1.3.14) путем пипетирования 4 мкл смеси яйцо/M9 на NGM-пластину, засеянную бактериями. Подсчитайте и подсчитайте, сколько яиц присутствует на мкл покрытого. Повторите подсчет три или четыре раза, чтобы улучшить приближение.
ПРИМЕЧАНИЕ: Приближение концентрации яиц гарантирует, что достаточное количество животных будет покрыто для соответствующего размера выборки для экспериментов без чрезмерного покрытия, что приведет к голоду. - Основываясь на приближении, нанесите соответствующее количество яиц на пластины NGM-агара, засеянные бактериями по выбору. Для пластин OP50 таблички не более 200 животных на пластине 60 мм и 1000 животных на пластине 100 мм. Для пластин HT115 наносится максимум 150 животных на пластину диаметром 60 мм и 600 животных на пластину диаметром 100 мм.
ПРИМЕЧАНИЕ: Это приблизительные цифры, основанные на наших лабораторных условиях, и цифры могут меняться в зависимости от толщины бактериального газона. Яйцам, выращенным при 15 ° C, потребуется ~ 5 дней, чтобы достичь взрослой жизни 1-го дня (~ 140 ч, чтобы достичь максимальной, гравидной взрослой стадии). Яйцам, выращенным при 20 ° C, потребуется ~ 4 дня, чтобы достичь взрослой жизни 1-го дня (~ 96 ч, чтобы достичь максимальной яйцекладущей, гравидной взрослой стадии). Яйцам, выращенным при 25 °C, потребуется ~ 3,5 дня, чтобы достичь взрослой жизни 1-го дня (~ 62 ч, чтобы достичь максимальной, гравидной взрослой стадии).
- Для более масштабных экспериментов, требующих большего количества животных, нарежьте полный 60-миллиметровый NGM-агар на четыре-шесть равных частей и разрежьте их на посеянных 100-миллиметровых пластинах для расширения.
- Яйцекладка как альтернативный метод синхронизации популяций C. elegans
- Если протоколы отбеливания невозможны (например, нет центрифуги), в качестве альтернативного метода синхронизации популяций C. elegans выполните процедуру откладывания яиц. Имейте в виду, что этот протокол является более трудоемким и приведет к снижению урожайности животных.
- Для яйцекладки поместите 8-12 взрослых особей на стандартную тарелку NGM-агара, засеянную бактериями по выбору, и задокументируйте точное количество животных, помещенных на тарелку.
ПРИМЕЧАНИЕ: Процедуры яйцекладки должны выполняться при температуре, которая будет использоваться для экспериментов. - Дайте животным отложить яйца в течение 4-8 ч.
ПРИМЕЧАНИЕ: Продолжительность пребывания животных на тарелке может быть отрегулирована при необходимости. Например, большее количество животных может быть помещено на тарелку на более короткую продолжительность яйцекладки, когда доступно меньше времени. C. elegans обычно откладывают яйца всплесками, которые могут быть оценены со скоростью приблизительно пять яиц / ч для животных с плодовитостью дикого типа43. Следуйте рекомендациям, приведенным на этапе 1.3.16, чтобы избежать чрезмерного покрытия животных. - Выньте всех взрослых животных из тарелки.
ПРИМЕЧАНИЕ: Любые взрослые животные, оставленные на тарелке, будут продолжать откладывать яйца, что приведет к несинхронизированной популяции. - Поместите яйца при 15 ° C в течение ~ 5 дней или 20 ° C в течение ~ 4 дней, чтобы достичь взрослой жизни 1-го дня.
2. Измерение долголетия в C. elegans
- Стандартный срок службы
- Приготовьте NGM-агаровые пластины путем посева пластин со 100 мкл выбранных бактерий. Для обеспечения консистенции убедитесь, что одни и те же бактерии используются во всех репликах. Поскольку черви перемещаются каждый день на этапах яйцекладки во взрослом возрасте, засевают пять-семь наборов NGM-агаровых пластин на протяжении всей жизни и от двух до четырех пластин на штамм, чтобы вырастить животных до взрослой жизни (т. Е. Если использовать восемь пластин из 15 животных для продолжительности жизни, нужно засеять 40-56 пластин на каждое условие).
- Дайте тарелкам высохнуть в течение ночи перед хранением.
ПРИМЕЧАНИЕ: Рекомендуется, чтобы пластины хранились при температуре 4 °C, а необходимое количество пластин ежедневно извлекалось из холодного хранилища, чтобы предотвратить превращение бактерий в толстые газоны, которые могут затруднить перемещение / подсчет продолжительности жизни. Убедитесь, что пластины прогреты перед нанесением покрытий червями. - Соберите синхронизированную популяцию C. elegans с помощью стандартного отбеливающего анализа, как описано в шагах 1.3 и 1.4.
- Переместите 10-15 день 1 взрослого животного на 8-12 тарелок каждая. Для стандартной продолжительности жизни начните с ~ 120 животных, чтобы гарантировать, что размер выборки не упадет слишком далеко ниже 100 после событий цензуры (например, восемь тарелок из 15 животных = 120 животных; 12 пластин из 10 животных = 120 животных).
ПРИМЕЧАНИЕ: В данном случае 10-15 животных являются управляемым числом для большинства исследователей, хотя шесть пластин из 20 животных также возможны для снижения стоимости расходных материалов. - В течение первых 7-8 дней или до тех пор, пока потомство больше не будет видно, удаляйте взрослых животных от их потомства каждые 1-2 дня.
ПРИМЕЧАНИЕ: Животных можно перемещать через день для экономии материалов, но необходимо позаботиться о том, чтобы яйца / личинки животных не переносились со взрослой особью, чтобы предотвратить загрязнение взрослых популяций потомством. В этом исследовании самым простым методом является перемещение животных каждый день с 1-3 дней, когда яйцекладка находится на максимуме, а затем переход на перемещение животных через день в течение 5-8 дней, когда яйцекладка минимальна. С помощью этого метода не обязательно предотвращать перенос яиц / личинок животных в течение 1-3 дней, так как взрослые особи будут перемещаться каждый день, а яйца / личинки не могут развиться до взрослой жизни за 1 день. - После того, как животные перестали производить потомство, оценивайте продолжительность жизни через день, пока все животные не будут оценены как мертвые или подвергнуты цензуре. Уберите всех мертвых или подвергнутых цензуре животных из тарелки, чтобы избежать путаницы и рассказа об одном и том же животном.
ПРИМЕЧАНИЕ: Смерть оценивается как животные, которые не проявляют движения при мягком прикосновении киркой. Цензура оценивается как животные, которые упакованы в мешки, демонстрируют выпячивание вульвы / кишечника или ползут по бокам тарелки, где они высыхают.
- Срок службы при химической стерилизации с использованием FUDR
- Приготовьте NGM-агаровые пластины путем посева пластин со 100 мкл выбранных бактерий. Для обеспечения консистенции убедитесь, что одни и те же бактерии используются во всех репликах. Посейте 8-12 пластин на штамм для экспериментов по продолжительности жизни и от двух до четырех пластин на штамм, чтобы вырастить животных до взрослой жизни. Дайте тарелкам высохнуть в течение ночи.
- Добавьте 100 мкл 10 мг / мл FUDR на середину бактериального газона для 8-12 пластин, которые будут использоваться для анализа продолжительности жизни. Не забудьте оставить две-четыре пластины без FUDR в качестве стартовых пластин, чтобы животные могли вырасти до зрелого возраста. Дайте тарелкам высохнуть на ночь.
ВНИМАНИЕ: FUDR блокирует синтез ДНК, и поэтому рекомендуется носить перчатки при обращении. - Соберите синхронизированную популяцию C. elegans с помощью стандартного отбеливающего анализа, как описано в шагах 1.3 и 1.4.
ПРИМЕЧАНИЕ: Эти животные должны быть выращены на тарелках без FUDR, так как FUDR приведет к аресту / смерти животных. - Переместите 10-15 день 1 взрослого животного на 8-12 пластин, содержащих FUDR. Для стандартной продолжительности жизни начните с ~ 120 животных, чтобы гарантировать, что размер выборки не упадет слишком далеко ниже 100 после событий цензуры (например, восемь тарелок из 15 животных = 120 животных; 12 пластин из 10 животных = 120 животных).
ПРИМЕЧАНИЕ: Животные также могут быть перемещены на FUDR на стадии L4, если необходимо полностью избежать образования потомства, но животные не должны перемещаться слишком рано, так как это приведет к более высокому риску выпячивания вульвы / кишечника и усилит цензуру. - Оценивайте продолжительность жизни через день, пока все животные не будут оценены как мертвые или подвергнуты цензуре. Уберите всех мертвых или подвергнутых цензуре животных из тарелки, чтобы избежать путаницы и рассказа об одном и том же животном.
ПРИМЕЧАНИЕ: Для продолжительности жизни FUDR любое потомство может быть проигнорировано, так как они будут арестованы на стадии L1 и в конечном итоге умрут.
- Продолжительность жизни с использованием чувствительных к температуре стерильных мутантов
- Приготовьте NGM-агаровые пластины путем посева пластин со 100 мкл выбранных бактерий. Для обеспечения консистенции убедитесь, что одни и те же бактерии используются во всех репликах. Посейте 8-12 пластин на штамм для экспериментов по продолжительности жизни и 2-4 пластины на штамм, чтобы вырастить животных до взрослой жизни. Дайте тарелкам высохнуть на ночь.
- Соберите синхронизированную популяцию C. elegans с помощью стандартного отбеливающего анализа, как описано в шагах 1.3 и 1.4. Не забывайте выращивать животных при ограничительной температуре 25 ° C, чтобы убедиться, что животные стерильны.
- Переместите 10-15 день 1 взрослого животного на 8-12 тарелок каждая. Для стандартной продолжительности жизни начните с ~ 120 животных, чтобы гарантировать, что размер выборки не упадет слишком далеко ниже 100 после событий цензуры (например, восемь тарелок из 15 животных = 120 животных; 12 пластин из 10 животных = 120 животных).
- Оценивайте продолжительность жизни через день, пока все животные не будут оценены как мертвые или подвергнуты цензуре. Уберите всех мертвых или подвергнутых цензуре животных из тарелки, чтобы избежать путаницы и рассказа об одном и том же животном.
ПРИМЕЧАНИЕ: При работе с короткоживущими штаммами рекомендуется оценивать продолжительность жизни каждый день, поскольку продолжительность жизни при 25 ° C намного короче, и, следовательно, динамический диапазон ограничен. По опыту авторов, животные могут быть смещены обратно к 20 ° C после 2-го дня, и животные останутся стерильными, если предпочтительно оценивать продолжительность жизни при 20 ° C.
3. Измерение размаха здоровья в C. elegans
- Измерение поведения опорно-двигательного аппарата с помощью трэшинга
- Соберите синхронизированную популяцию C. elegans с помощью стандартного отбеливающего анализа, как описано в шагах 1.3 и 1.4.
- Переместите небольшую колонию взрослых червей 1-го дня на NGM-агаровую пластину под рассекающим прицелом на 10-20 мкл раствора M9. 10-15 животных рекомендуются в качестве управляемого количества животных для подсчета.
- Ориентируясь на одного червя за раз, подсчитайте, сколько раз образец переключается с вогнутого на выпуклое образование за 15 с. Используйте счетчик рук и таймер, чтобы фокус мог быть помещен на червя на время анализа.
ПРИМЕЧАНИЕ: Видео пластины может быть записано для более тщательного/легкого анализа. Например, стандартные крепления для окуляров микроскопа доступны для большинства смартфонов и цифровых камер ($15-$30), и это отличный вариант для видео-трэшинга по низкой цене. - Повторите шаг 3.1.3 для других червей в жидкости, усреднив общую скорость подвижности для 10-15 червей. Для увеличения размера выборки повторите шаги 3.1.2-3.1.4.
- Стареют черви до желаемого возраста. Аналогичные методы анализа продолжительности жизни, описанные в шагах 2.1-2.3, могут быть использованы для старения червей. Повторите шаги 3.1.2-3.1.4 для анализа трэшинга в желаемом возрасте.
ПРИМЕЧАНИЕ: Альтернативный способ для этапа 3.1.2 заключается в добавлении ~30 мкл или более раствора M9 на группу червей на пластине. Это сэкономит время от необходимости вручную переносить червей, хотя из-за случайной вероятности того, где черви находятся на одной пластине, нет никакой гарантии, что группа червей останется в одной точке на пластине.
- Измерения плодовитости (количества яиц) у C. elegans
- Соберите синхронизированную популяцию C. elegans с помощью стандартного отбеливающего анализа, как описано в шагах 1.3 и 1.4. Анализы на количество яиц начинаются на стадии L4, которая составляет ~ 1 день до 1-го дня взрослой жизни (~ 3 дня при 15 ° C или ~ 2 дня при 20 ° C после ареста L1).
- Выделите червей L4 на отдельные NGM-агаровые пластины, засеянные бактериями по выбору. Рекомендуется использовать ~10-15 животных для анализа плодовитости.
ПРИМЕЧАНИЕ: Рекомендуется разбавлять выбранные бактерии на 50% (т.е. не насыщенную культуру), чтобы улучшить видимость яиц на бактериальном газоне. - Дайте животным расти ночью при 20 °C. Убедитесь, что недавно засеянная партия тарелок готова к следующему дню.
- На 1-й день взрослой жизни перенесите взрослых червей на свежие NGM-агаровые пластины, засеянные разбавленными бактериями по выбору.
ПРИМЕЧАНИЕ: Рекомендуется использовать свежепосеянные тарелки или хранить тарелки при 4 °C до использования, чтобы предотвратить толстые бактериальные газоны. - Подсчитайте общее количество яиц, отложенных на каждой пластине NGM-агара.
ПРИМЕЧАНИЕ: Чтобы помочь в сканировании пластины, сетка может быть нарисована на крышке тарелки и помещена под тарелку, забиваемую для яиц. Затем пластина может быть отсканирована вдоль линий сетки, чтобы поддерживать ориентацию по мере перемещения пластины и предотвращать пересчитывание любых яиц. - Повторяйте шаги 3.2.4-3.2.5 в течение 7-8 дней или до тех пор, пока яйца больше не будут видны на пластине.
ПРИМЕЧАНИЕ: В дни 1-3, когда скорость откладки яиц высока, рекомендуется перемещать животных не реже одного раза в 12 ч и анализировать количество яиц два раза в день. Тем не менее, это увеличивает объем работы и затраты на расходные материалы, и, таким образом, перемещение животных и измерения могут быть ограничены одним разом в день, но необходимо позаботиться о том, чтобы все яйца и вылупившиеся животные были подсчитаны должным образом. Любые вылупившиеся животные считаются яйцами для целей этого анализа.
- Измерение размера расплода (развития) потомства C. elegans
- Соберите синхронизированную популяцию C. elegans с помощью стандартного отбеливающего анализа, как описано в шагах 1.3 и 1.4. Анализы на размер расплода начинаются на стадии L4, что составляет ~ 1 день до 1-го дня взрослой жизни (~ 3 дня при 15 °C или ~ 2 дня при 20 °C после ареста L1).
- Выделите червей L4 на отдельные NGM-агаровые пластины, засеянные бактериями по выбору. Рекомендуется использовать ~10-15 животных для анализа плодовитости.
- Дайте животным расти ночью при 20 °C. Убедитесь, что недавно засеянная партия тарелок готова к следующему дню.
- На 1-й день взрослой жизни перенесите взрослых червей на свежие NGM-агаровые пластины, засеянные бактериями по выбору.
- Каждые 12-24 ч (2 раза в день или 1 раз в день) переносите взрослых червей на свежие NGM-агаровые пластины, засеянные бактериями по выбору, в течение 7-8 дней или до тех пор, пока потомство больше не будет видно. Держите все тарелки, содержащие яйца, при температуре 20 °C.
- Повторяйте шаг 3.3.5 в течение 7-8 дней или до тех пор, пока потомство не перестанет быть видимым. Держите все тарелки, содержащие яйца, при температуре 20 °C.
ПРИМЕЧАНИЕ: Пластины потомства также могут храниться при температуре 15 °C, чтобы продлить время, прежде чем их нужно будет забить. - Через два дня после переноса глистов подсчитайте развившееся потомство на пластинках. Подсчитайте развивающихся червей на стадии L4 (т.е. через 2 дня после вылупления при 20 °C) или раньше, чтобы гарантировать, что поколение F2 (т.е. потомство потомства) не смущает результаты. Подсчитайте всех червей, которые живы.
- Удалите всех червей с тарелки по мере их подсчета. Поддерживайте пластины в течение дополнительных 1-2 дней, прежде чем забить их снова, чтобы гарантировать, что любые животные с задержкой вылупления / развития не будут пропущены.
- Повторите шаг 3.3.7 для каждой собранной яйцекладущей пластины.
ПРИМЕЧАНИЕ: Анализы размеров расплода могут проводиться в сочетании с анализом подсчета яиц (этап 3.2) для минимизации трудозатрат и затрат на расходные материалы путем сбора двух наборов данных из одного эксперимента. Это также позволит напрямую сравнивать размер расплода и количество яиц у одних и тех же животных.
4. Измерение стрессоустойчивости у C. elegans
- Измерение чувствительности к стрессу ER с использованием туникамицина
- Приготовьте NGM-агаровые пластины путем посева пластин, содержащих туникамицин (см. этап 1.1.7, ПРИМЕЧАНИЕ) со 100 мкл выбранных бактерий.
ВНИМАНИЕ: Перчатки следует носить при обращении с туникамицином. - Для обеспечения консистенции убедитесь, что одни и те же бактерии используются во всех репликах. Посейте 8-12 туникамициновых пластин на штамм для анализа выживаемости и от двух до четырех пластин без туникамицина на штамм для выращивания животных до взрослой жизни. Дайте тарелкам высохнуть на ночь.
- Соберите синхронизированную популяцию C. elegans с помощью стандартного отбеливающего анализа, как описано в шагах 1.3 и 1.4.
ПРИМЕЧАНИЕ: Животные должны быть выращены на тарелках без туникамицина до 1-го дня взрослой жизни, так как животные будут задерживаться / умирать на туникамицине. - Переместите 10-15 день 1 взрослого животного на 8-12 тарелок каждая. Для стандартных анализов на выживание начните с ~ 120 животных, чтобы убедиться, что размер выборки не упадет слишком далеко ниже 100 после событий цензуры (например, восемь пластин из 15 животных = 120 животных; 12 пластин из 10 животных = 120 животных).
ПРИМЕЧАНИЕ: Подобно анализам FUDR, анализы выживания туникамицина могут быть выполнены без перемещения животных, так как туникамицин вызывает смерть / остановку животных L1. Однако при выполнении контроля DMSO потомство будет развиваться на пластинах DMSO, поэтому животных необходимо перемещать ежедневно или потребуется метод стерилизации (идентичные методы, используемые в разделе 2 для продолжительности жизни, могут быть использованы для анализов выживания). - Анализы на выживание оцениваются аналогично продолжительности жизни. Уберите всех мертвых или подвергнутых цензуре животных из тарелки, чтобы избежать путаницы и рассказа об одном и том же животном.
ПРИМЕЧАНИЕ: Хотя можно оценивать животных через день, поскольку смерть наступает быстро на туникамицине, рекомендуется ежедневно оценивать анализы выживаемости.
- Приготовьте NGM-агаровые пластины путем посева пластин, содержащих туникамицин (см. этап 1.1.7, ПРИМЕЧАНИЕ) со 100 мкл выбранных бактерий.
- Измерение чувствительности к митохондриальному/окислительному стрессу с использованием параквата
- Подготовьте NGM-агаровые пластины путем посева пластин, содержащих паракват (см. этап 1.1.7; ПРИМЕЧАНИЕ) со 100 мкл бактерий по выбору.
ВНИМАНИЕ: Перчатки следует носить при обращении с паракватом, так как он представляет опасность для окружающей среды. Проконсультируйтесь с экологическим здоровьем и безопасностью учреждения для требований к выбросу, так как многие научно-исследовательские учреждения потребуют конкретных инструкций по выбросу для экологических опасностей. - Для обеспечения консистенции убедитесь, что одни и те же бактерии используются во всех репликах. Посейте 8-12 пластин на штамм для анализов на выживание и от двух до четырех пластин без параквата на штамм, чтобы вырастить животных до взрослой жизни. Дайте тарелкам высохнуть в течение ночи.
- Соберите синхронизированную популяцию C. elegans с помощью стандартного отбеливающего анализа, как описано в шагах 1.3 и 1.4.
ПРИМЕЧАНИЕ: Не забывайте выращивать животных на тарелках без параквата до 1-го дня взрослой жизни; однако необходимо выполнить технику стерилизации или отодвинуть взрослых особей от потомства, так как некоторые животные могут развиваться до зрелого возраста на паракватовых пластинах (см. шаги 2.2-2.3). - Переместите 10-15 день 1 взрослого животного на 8-12 тарелок каждая. Для стандартного анализа на выживание начните с ~ 120 животных, чтобы убедиться, что размер выборки не упадет слишком далеко ниже 100 после событий цензуры (например, восемь пластин из 15 животных = 120 животных; 12 пластин из 10 животных = 120 животных).
- Анализы на выживание оцениваются аналогично продолжительности жизни. Уберите всех мертвых или подвергнутых цензуре животных из тарелки, чтобы избежать путаницы и рассказа об одном и том же животном.
ПРИМЕЧАНИЕ: Хотя можно оценивать животных через день, поскольку смерть быстро наступает на параквате, рекомендуется ежедневно оценивать анализы на выживание. Это особенно верно при использовании glp-4 (bn2) животных, выращенных при 25 ° C, так как смерть будет происходить очень быстро.
- Подготовьте NGM-агаровые пластины путем посева пластин, содержащих паракват (см. этап 1.1.7; ПРИМЕЧАНИЕ) со 100 мкл бактерий по выбору.
- Измерение чувствительности к тепловому стрессу (термотолерантности) с использованием повышенных температур
- Соберите синхронизированную популяцию C. elegans с помощью стандартного отбеливающего анализа, как описано в шагах 1.3 и 1.4.
- Предварительно нагревайте NGM-агаровые пластины до 37 °C перед перемещением животных на тарелки, помещая пластины в инкубатор с температурой 37 °C в течение не менее 1 ч.
- Переместите на 10-15 день 1 взрослое животное на четыре-шесть предварительно разогретых тарелок каждая. Для стандартной термотолерантности начните с ~ 60 животных (например, четыре пластины из 15 животных = 60 животных; шесть пластин из 10 животных = 60 животных)
- Поместите животных в инкубатор с температурой 37 °C и оцените смерть каждые 2 часа. Смерть определяется как животные, которые не проявляют движения при мягком прикосновении киркой. Уберите всех мертвых или подвергнутых цензуре животных из тарелки, чтобы избежать путаницы и рассказа об одном и том же животном.
- Убедитесь, что пластины удалены из инкубатора при температуре 37 °C в течение минимально возможного периода времени, так как пластины, которые остаются при температуре окружающей среды в течение длительного времени во время оценки, изменят результаты термотолерантности.
ПРИМЕЧАНИЕ: Рекомендуется вытаскивать только один штамм за раз, чтобы забить, так как температура агара не должна резко меняться за время, необходимое для оценки одного штамма. - Медиана термотолерантности обычно достигается через 7-9 ч; Таким образом, обеспечьте правильный анализ через 7 ч, 9 ч и 11 ч.
ПРИМЕЧАНИЕ: Хотя 1-5 ч можно пропустить из-за изменчивости инкубаторов, толщины пластин и других смешанных факторов в каждой лаборатории, важно, чтобы время тщательно титровалось в каждой лаборатории, если планируется пропустить временные точки. Смотрите ссылку 44 для полного руководства по термотолерантности. - В качестве альтернативы можно выполнить анализ термотолерантности при 34 °C вместо 37 °C.
ПРИМЕЧАНИЕ: Медиана термотолерантности при 34 °C возникает намного позже (10-14 ч в этом исследовании), что позволяет готовить анализы термотолерантности поздно ночью (помещать в инкубатор с температурой 34 °C), а подсчет баллов начинать рано на следующий день. Это обеспечивает ~ 8 ч непрерывной оценки, а не типичный 12-часовой период, необходимый для анализа термотолерантности 37 °C.
Результаты
C. elegans являются отличным модельным организмом для исследований старения из-за подавляющего большинства механизмов старения, сохраняемых у людей. Важно отметить, что они имеют очень низкую стоимость в обслуживании и экспериментировании с минимальными требованиями к оборудованию и расходным материалам, что делает их желанной модельной системой для учреждений с ограниченными средствами. Более того, множество простых анализов с неглубокими кривыми обучения делает их отличной системой даже для самого молодого исследователя с небольшим опытом или вообще без него. Все эти факторы в сочетании с мощной генетикой C. elegans , включая простоту редактирования генома, тысячи доступных мутантов и трансгенных животных по номинальным ценам, а также доступные библиотеки RNAi для генетического нокдауна практически каждого гена, делают их идеальной системой для учреждений бакалавриата. Здесь исследуются одни из самых дешевых методов изучения старения у C. elegans , ориентируясь в первую очередь на анализы с минимальным оборудованием и расходными затратами, а также на неглубокие кривые обучения. Фактически, все протоколы и сбор данных были написаны / выполнены младшими исследователями с опытом исследований < 5 месяцев, в основном студентами бакалавриата.
Исследования долголетия у C. elegans очень просты из-за короткой продолжительности жизни животных, варьирующейся от 14-20 дней. Важно отметить, что анализы продолжительности жизни высоко стандартизированы и требуют только инкубатора, стандартного рассеченного микроскопа, стандартного червячного отбора и расходных материалов для приготовления пластин NGM-агара. Возможно, самым дорогостоящим аспектом измерений продолжительности жизни в C. elegans являются необходимые расходные материалы. Это связано с тем, что C. elegans являются гермафродитами, которые самооплодотворяются; поэтому взрослые, отслеживаемые для анализа долголетия, должны быть удалены от потомства ежедневно. Тем не менее, животные могут быть стерилизованы, подвергая их воздействию FUDR или используя мутанты, такие как чувствительный к температуре мутант glp-4 (bn2) без зародышевой линии, выращенный при непомерных 25 ° C, чтобы уменьшить количество расходных материалов, необходимыхдля 30,31,32. Здесь анализы продолжительности жизни были выполнены с FUDR или с мутантами без зародышевой линии glp-4 (bn2), которые показывают результаты, аналогичные стандартным срокам жизни, выполненным на нестерильных животных. В то время как продолжительность жизни дикого типа не идентична из-за влияния FUDR45 или роста при 25 ° C на продолжительность жизни2, короткоживущее нокдаунное животное hsf-1 надежно показывает значительное снижение продолжительности жизни для всех условий (рисунок 1). hsf-1 кодирует фактор транскрипции теплового шока-1, который участвует в регуляции реакции теплового напряжения, и его нокдаун приводит к значительному снижению продолжительности жизни38,46.
Хотя долголетие является важным фактором, который следует учитывать в биологии старения, часто долголетие не коррелирует с улучшением здоровья, даже у C. elegans47. Таким образом, в качестве дополнительного подхода мы предлагаем несколько методов измерения здоровья организма, включая репродуктивное здоровье, двигательное поведение и стрессоустойчивость. Репродуктивное здоровье можно измерить одним из двух способов. Во-первых, измерения количества яиц дадут прямое измерение того, сколько яиц откладывается одним самооплодотворяющимся гермафродитом. Однако, поскольку животные производят больше ооцитов, чем сперматозоиды, некоторые неоплодотворенные яйцеклетки, которые никогда не произведут жизнеспособное потомство, такжеоткладываются 48. Поэтому, чтобы лучше понять истинную репродуктивную способность животного, измерения размера расплода обеспечивают измерение того, сколько жизнеспособного потомства произведено. Часто повышенная стрессоустойчивость может фактически снизить репродуктивную способность, потенциально из-за внутреннего влияния воспринимаемого стресса на размножение49. Аналогичным образом, значительное снижение как количества отложенных яиц, так и размера расплода обнаруживается у животных с избыточной экспрессией hsf-1 по сравнению с контрольной группой дикого типа (рисунок 2A, B). Фактически, некоторые животные с гиперэкспрессией hsf-1 демонстрируют полную стерильность, что свидетельствует о том, что репродуктивное здоровье может быть обратно коррелировано с долголетием.
Хотя репродуктивное здоровье важно для понимания здоровья зародышевой линии, функционального мейоза и репродуктивной способности, в целом нет прямой корреляции между долголетием и размером расплода50. Таким образом, в качестве дополнительного подхода локомоторное поведение предлагается в качестве метода золотого стандарта для анализа здоровья C. elegans в возрасте51 года. Существует много методов измерения поведения опорно-двигательного аппарата, но большинство методов требуют сложных камер, программного обеспечения для отслеживания или дорогостоящих химических веществ. В отличие от этого, трэшинговые анализы практически не требуют никакого оборудования, кроме того, которым оснащена стандартная лаборатория C. elegans : рассекающий микроскоп, червячный кирк, пипетка и расходные материалы для изготовления плит NGM-агара. Скорость треширования обеспечивает надежный метод измерения продолжительности здоровья во время старения, что измеряется значительным снижением метания у старых животных по сравнению с молодыми животными (рисунок 2C).
Наконец, выживание в стрессовых анализах является дополнительным физиологическим измерением устойчивости. Способность активировать стрессовые реакции обычно снижается во время процесса старения, что делает животных менее устойчивыми и более чувствительными к стрессу. Таким образом, стрессоустойчивость может быть использована в качестве надежного прокси для здоровья организма. Здесь предложены методы обследования чувствительности к 1) стрессу ER в ответ на воздействие туникамицина, химического агента, который блокирует N-связанное гликозилирование и приводит к накоплению неправильно свернутых белков в ER; 2) митохондриальный/окислительный стресс при воздействии параквата, химического агента, индуцирующего образование супероксида в митохондриях; и 3) тепловое напряжение в результате воздействия повышенных температур. Для анализа туникамицина и параквата препарат включается в NGM-агаровую пластину во время производства пластин. При высоких концентрациях туникамицина потомство обычно не развивается, и поэтому методы стерилизации использовать не нужно. Протокол, представленный здесь, рекомендует 25 нг/мкл в качестве конечной концентрации туникамицина, но для пациентов с ограниченными средствами 10 нг/мкл также показывает значительное снижение выживаемости (рисунок 3А). Обе концентрации ограничивают развитие потомства, и, следовательно, методы стерилизации не требуются, хотя контроль DMSO потребует метода стерилизации или перемещения животных на новые пластины. Это связано с тем, что токсичность туникамицина предотвращает развитие потомства, но ДМСО практически нетоксичен, что позволяет потомству полноценно развиваться при выращивании на туникамицине.
Для паракват-анализов требуется либо техника стерилизации, либо движение животных, поскольку лечение паракватом не предотвращает развитие потомства до зрелого возраста. Высокие уровни параквата (4 мМ) значительно сокращают продолжительность жизни, в то время как низкие уровни параквата (0,25 мМ) увеличивают продолжительность жизни из-за садоводческого эффекта (рисунок 3B), что согласуется с ранее опубликованными результатами52. Наконец, для анализа термотолерантности требуется только инкубатор, который может достигать 30-37 ° C, и никаких дополнительных реагентов не требуется. Сверхэкспрессия hsf-1 увеличивает термотолерантность при 37 °C (рисунок 3C), как было ранее опубликовано53. Однако, как показали другие ранее и из настоящих данных, основная проблема с анализами термотолерантности заключается в их изменчивости. Многие факторы могут способствовать изменчивости в анализах термотолерантности, включая различия между инкубаторами и временем, которое животные проводят вне инкубатора, оценивая термотолерантность каждый час. Для получения подробного руководства по термотолерантности обратитесь к ссылке 41.
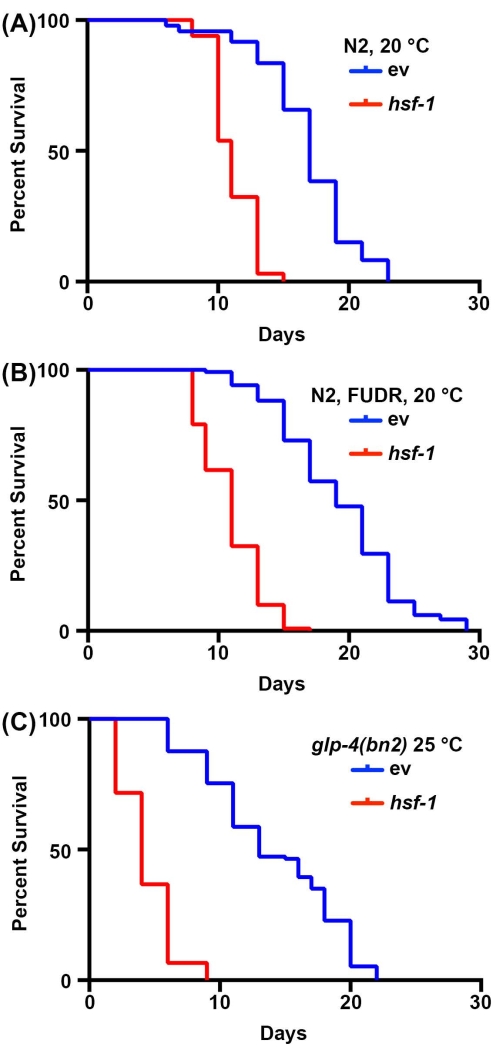
Рисунок 1: Сравнение измерений продолжительности жизни со стерилизацией и без нее. (A) Продолжительность жизни диких нематод N2 типа, выращенных на NGM-агаровых пластинах, засеянных пустыми векторными (ev) или hsf-1 РНКи бактериями при 20 °C. Животные были выведены из потомства в 1, 3, 5 и 7 дни взрослой жизни. (B) Продолжительность жизни диких нематод N2 типа, выращенных на пластинах NGM-agar-FUDR, засеянных пустыми векторными (ev) или hsf-1 RNAi бактериями при 20 °C. Животных выращивали до зрелого возраста на стандартных пластинах ev или hsf-1 RNAi, а затем перемещали на пластины FUDR на 1-й день взрослой жизни. (C) Продолжительность жизни мутантных животных glp-4(bn2), выращенных на NGM-агаровых пластинах, засеянных пустым вектором (ev) или hsf-1 RNAi при 25 °C. Для всех условий животные оценивались за смерть каждые 2 дня, пока все животные не были зарегистрированы как мертвые или подвергнуты цензуре. Животные с мешками, выпячиванием или взрывом вульвы, или те, которые ползли по бокам пластин и высыхали, подвергались цензуре. Вся статистика была выполнена с использованием тестирования Log-Rank Mantel-Cox и может быть найдена в таблице 2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
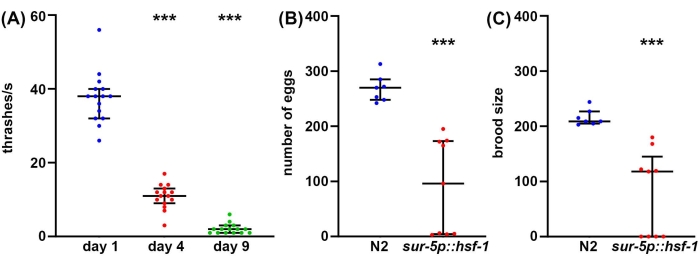
Рисунок 2: Количество яиц, размер расплода и метание в качестве измерений объема здоровья. (A) Анализы трэшинга проводились на мутантных животных glp-4(bn2), выращенных на NGM-агаровых пластинах, засеянных пустым вектором при 25 °C на 1-й день (синий), 4-й день (красный) и 9-й день (зеленый) животных. Трэшинг был оценен у животных, помещенных в раствор M9 на пластине NGM-агара, видео записано с помощью стандартной камеры смартфона, установленной на окуляре стандартного рассекающего прицела, и удар в замедленном режиме для точности. n = 15 животных на условие. (B) Количество яиц было измерено у диких животных N2 (синий) и sur-5p::hsf-1 (красный). Животных выращивали при 20 °C и перемещали на свежие тарелки, а яйца подсчитывали каждые 12 часов. Общее количество отложенных яиц было суммировано. n = 7 животных для дикого вида и 9 животных для sur-5p::hsf-1. (C) Выводковые анализы были измерены на тех же животных, что и (B), где яйца выращивались при 20 ° C в течение 2 дней, чтобы обеспечить инкубацию, и все инкубационные яйца были подсчитаны. = p < 0,001 рассчитано с использованием непараметрического тестирования Манна-Уитни. Каждая точка представляет одно животное, а линии представляют срединный и межквартильный диапазон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
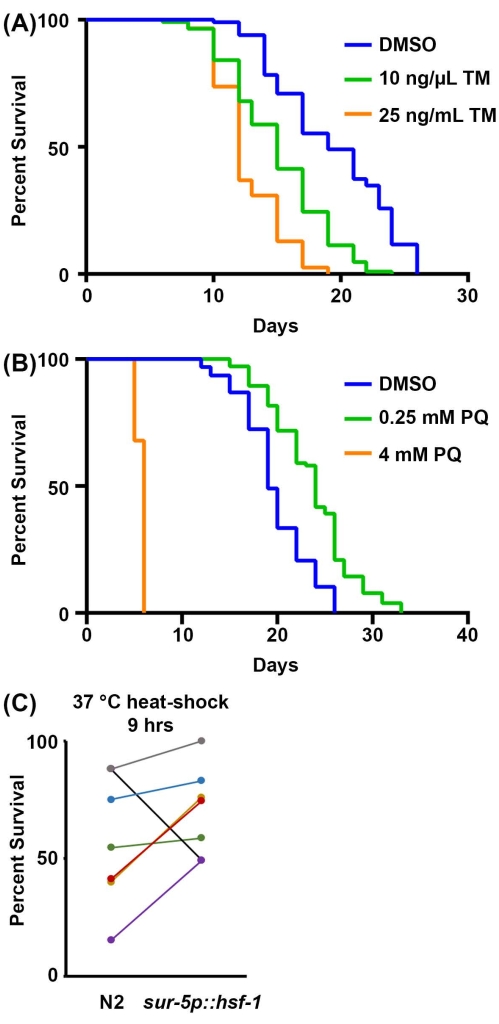
Рисунок 3: Стрессоустойчивость как прокси для здоровья организма. (A) Анализ выживаемости животных N2, выращенных на пустых векторных бактериях RNAi при 20 °C. Животных перемещали в пластины, содержащие либо 1% ДМСО, либо 10 нг/мкл туникамицина (ТМ), либо 25 нг/мкл ТМ на 1-й день взрослой жизни. (B) Анализ выживаемости животных N2, выращенных на пустых векторных бактериях RNAi при 20 °C. Животных выращивали из люка на пластинах, содержащих либо воду, либо 0,25 мМ параквата (PQ), либо 4 мМ PQ. Для A-B животные оценивались за смерть каждые 2 дня, пока все животные не были зарегистрированы как мертвые или подвергнуты цензуре. Животные с мешками, выпячиванием или взрывом вульвы, или те, которые ползли по бокам пластин и высыхали, подвергались цензуре. Вся статистика была выполнена с использованием log-Rank Mantel-Cox testing (таблица 2). (C) Объединенные данные всех анализов термотолерантности при 37°C для диких животных N2 в сравнении с гиперэкспрессией hsf-1 (sur-5p::hsf-1). Данные представлены в виде процента живого в момент времени = 9 ч анализа термотолерантности, причем каждая строка представляет собой соответствующий эксперимент, выполненный в тот же день. Животных выращивали на пустых векторных бактериях РНКи при 20 °C и перемещали до 37 °C на 1-й день взрослой жизни для анализа. n = 60 животных на штамм на репликат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Реагент | Рецепт | ||
| Отбеливающий раствор | 1,8% (об/об) гипохлорит натрия, 0,375 М КОН | ||
| Карбенициллин | 100 мг/мл спиртового раствора (1000x) в воде. Хранить при температуре 4 °C до 6 месяцев или -20 °C для длительного хранения | ||
| ФУДР | 10 мг/мл раствора в воде. Хранить при -20 °C. | ||
| ИПТГ | 1 М раствора в воде. | ||
| Лизогенный бульон (LB) | В этом протоколе использовался коммерческий LB (см. Таблицу материалов), но достаточно всех стандартных домашних рецептов LB с использованием бакто-триптона, дрожжевого экстракта и NaCl. | ||
| Решение M9 | 22 мМ KH2PO4 моноосновный, 42,3 мМ Na2HPO4, 85,6 мМ NaCl, 1 мМ MgSO4 | ||
| Среда роста нематод (NGM) | 1 мМ CaCl2, 5 мкг/мл холестерина, 25 мМ КПО4 рН 6,0, 1 мМ MgSO4, 2% (мас./об.) агара, 0,25% (мас./об.) бакто-пептон, 51,3 мМ NaCl | ||
| Плиты NGM RNAi | 1 мМ CaCl2, 5 мкг/мл холестерина, 25 мМ КПО4 рН 6,0, 1 мМ МгСО4, 2% (мас./об.) агар, 0,25% (мас./об.) бакто-пептон, 51,3 мМ NaCl, 1 мМ IPTG, 100 мкг/мл карбенициллина/ампициллина. Хранить при температуре 4 °C в темноте до 3 месяцев | ||
| НГМ РНКАЙ ДМСО | 1 мМ CaCl2, 5 мкг/мл холестерина, 25 мМ КПО4 рН 6,0, 1 мМ МгСО4, 2% (мас./об.) агар, 0,25% (мас./об.) бакто-пептон, 51,3 мМ NaCl, 1 мМ IPTG, 100 мкг/мл карбенициллина/ампициллина; 1% ДМСО | ||
| (контроль за туникамицином) | |||
| НГМ РНКАЙ ТМ | 1 мМ CaCl2, 5 мкг/мл холестерина, 25 мМ КПО4 рН 6,0, 1 мМ МгСО4, 2% (мас./об.) агар, 0,25% (мас./об.) бакто-пептон, 51,3 мМ NaCl, 1 мМ IPTG, 100 мкг/мл карбенициллина/ампициллина; 1% ДМСО, 25 нг/мкл туникамицина | ||
| Паракват | 400 мМ раствор в воде – должен быть приготовлен свежим | ||
| Тетрациклин | 10 мг/мл стокового раствора (500x) в 100% этаноле. Хранить при -20 °C | ||
| Туникамицин | 2,5 мг/мл раствора в 100% ДМСО. Хранить при температуре -80 °C для длительного хранения. Это 100-кратный раствор (рабочий раствор 25 нг/мкл) | ||
Таблица 1. Рецепты реагентов и носителей для протоколов.
| Соответствующая панель рисунков | Штамм, лечение | Средняя продолжительность жизни | # Смерти/# Всего | p-значение (Логранг) | |
| 1А | N2, векторный РНКи, 20 °C | 17 | 74/120 | -- | |
| N2, hsf-1 РНКи, 20 °C | 11 | 65/120 | <0.001 | ||
| 1Б | N2, векторный РНКи, FUDR, 20 °C | 19 | 120/120 | -- | |
| N2, hsf-1 РНКи, ФУДР, 20 °C | 11 | 116/120 | <0.001 | ||
| 1С | N2, glp-4(bn2), вектор РНКи, 25 °C | 13 | 115/121 | -- | |
| N2, glp-4(bn2), hsf-1 РНКи, 25 °C | 4 | 120/120 | < 0.001 | ||
| 2А | N2, векторный РНКи, 20 °C, 1% ДМСО | 19 | 85/120 | -- | |
| N2, вектор РНКи, 20 °C, 10 нг/мкл туникамицина | 15 | 109/120 | <0.001 | ||
| N2, вектор РНКи, 20 °C, 25 нг/мкл туникамицина | 12 | 117/120 | <0.001 | ||
| 2Б | N2, векторный РНКи, 20 °C | 19 | 84/120 | -- | |
| N2, векторный РНКи, 20 °C, паракват 0,25 мМ | 24 | 91/120 | <0.001 | ||
| N2, вектор РНКи, 20 °C, паракват 4 мМ | 6 | 50/120 | <0.001 | ||
Таблица 2. Статистика продолжительности жизни и стрессоустойчивости.
Обсуждение
Продолжительность жизни, наиболее просто определяемая как продолжительность жизни, является явным бинарным явлением в большинстве организмов - либо организм жив, либо нет. Однако долголетие не всегда коррелирует со здоровьем организма. Например, модели митохондриального гормеза, в которых воздействие митохондриального стресса резко увеличивает продолжительность жизни, как правило, являются одними из самых долгоживущих животных, но демонстрируют задержку роста и снижение метаболической функции37,54. Аналогичным образом, животные с гиперактивными реакциями на стресс эндоплазматического ретикулума также демонстрируют определенное поведение и фенотипы, которые могут быть коррелированы с ухудшением здоровья, несмотря на значительное улучшение гомеостаза белка и продолжительности жизни36,49. Наконец, многие парадигмы долголетия в модельных организмах, включая повышенную функцию HSF-155, повышенную функцию XBP-156 и измененную передачу сигналов FoxO57, коррелируют с повышенным риском развития рака, и бесспорно, что увеличение продолжительности жизни не приносит пользы, если организм находится в постоянной борьбе с раком и другими заболеваниями здоровья. Поэтому долголетие не может быть самостоятельным измерением в биологии старения.
Таким образом, концепция healthspan была растущей областью в биологии старения. Продолжительность здоровья, свободно определяемую как период жизни, в течение которого человек здоров, труднее определить, чем долголетие. Однако, в отличие от долголетия, понятие «здоровье» является сложным, поскольку существует много различных показателей здоровья организма: на уровне организма существуют мышечная функция / сила, нейронная / когнитивная функция, репродуктивное здоровье и т. Д.; на клеточном уровне различают белковый гомеостаз, липидный гомеостаз, глюкозный гомеостаз, обмен веществ и др. В 2014 году биологи старения окончательно охарактеризовали биологические признаки старения структурированным определением, что это должно быть что-то, что естественным образом разрушается во время старения и может быть экспериментально изменено таким образом, что экспериментальное обострение должно ускорить старение, а экспериментальное вмешательство должно замедлить старение. Эти девять признаков старения включают геномную нестабильность, истощение теломер, эпигенетические изменения, потерю белкового гомеостаза (протеостаза), истощение стволовых клеток, измененную межклеточную сигнализацию, митохондриальную дисфункцию, дерегулированное восприятие питательных веществ и клеточное старение58. С тех пор многочисленные исследования утверждают, что следует включить другие факторы, включая внеклеточные белки и системную физиологию, такие как иммунитет и воспаление59. В конечном счете, сложное определение healthspan требует, чтобы здоровье организма измерялось с использованием нескольких различных методов.
Поэтому в этой рукописи представлено несколько методов измерения различных аспектов здоровья с использованием модели нематоды C. elegans. Мы анализируем поведение опорно-двигательного аппарата с помощью анализов, репродуктивное здоровье с использованием количества яиц и размера расплода, а также чувствительность к стрессу. Действительно, локомоторное поведение является золотым стандартом для измерения продолжительности здоровья, поскольку организмы демонстрируют значительную потерю подвижности и движения во время старения51 года. Потеря опорно-двигательного поведения может быть отнесена к множественным признакам старения, поскольку мышечная функция у C. elegans зависит от правильного протеостаза60, митохондриальной дисфункции61 и передачи сигналов нейронами-мышцами62. Хотя эта рукопись фокусируется на одном измерении двигательного поведения, важно отметить, что существует много других методов, включая подвижность животных на твердой агаровой пластине, реакцию на прикосновение51 и анализы хемотаксиса63. Однако эти методы, как правило, требуют более сложных записывающих устройств, использования программного обеспечения для отслеживания червей или использования дорогих, опасных или летучих химических веществ, все из которых могут быть непомерно высокими в некоторых исследовательских условиях.
Кроме того, анализы на количество яйцеклеток и размер расплода представлены как метод измерения репродуктивного здоровья и как простейший метод измерения деления клеток у взрослых червей, поскольку взрослые черви являются постмитотическими и только половые клетки и эмбрионы подвергаются делению клеток у взрослого червя64. Как мера деления клеток, репродуктивное здоровье может иметь отношение к возрастным признакам клеточного старения и истощения стволовых клеток. На репродуктивное здоровье могут влиять многие факторы, включая патогенную инфекцию65 или воздействие стресса49, хотя прямой корреляции между репродуктивным здоровьем и долголетием нет. Фактически, некоторые долгоживущие животные демонстрируют значительное уменьшение размера расплода49, и даже возможно, что существует обратная корреляция между долголетием и размером расплода50. Это не является явлением , характерным для C. elegans, так как пагубное влияние размножения на долголетие уже давно наблюдается у людей66, собак-компаньонов67 и мышей68. Тем не менее, мы предоставляем подсчет яиц и размер расплода в качестве надежного и недорогого метода измерения репродуктивного здоровья с оговоркой, что репродуктивное здоровье может не коррелировать с долголетием или продолжительностью здоровья.
Наконец, анализы выживания предлагаются в качестве косвенной меры здоровья организма. Важно отметить, что клеточные стрессовые реакции, включая реакцию на тепловой стресс69 и стресс ER35, быстро снижаются во время процесса старения и имеют прямое отношение к отличительной черте старения протеостаза70,71. Напротив, гиперактивирующие стрессовые реакции могут значительно увеличить продолжительность жизни, повышая устойчивость к стрессу 35,37,38. В то время как это исследование фокусируется на самых простых и дешевых методах, существует большое количество альтернативных методов анализа стрессоустойчивости для термотолерантности41 и окислительного стресса66, каждый из которых требует различного набора оборудования и расходных материалов. Помимо простых исследований воздействия стрессоров, другие физиологические методы могут быть выполнены в зависимости от доступа к оборудованию. Например, внеклеточный анализатор потока может контролировать функцию митохондрий и клеточное дыхание73; флуоресцентные рассеченные микроскопы позволят измерять транскрипционные репортеры для активации реакции на стресс20; и компаундные или конфокальные микроскопы высокого разрешения могут быть использованы для измерения морфологии органелл с флуоресцентными зондами для митохондрий74, эндоплазматического ретикулума 75,76 и актинового цитоскелета77.
В качестве последнего предостережения для измерений долголетия, в то время как химические и генетические методы стерилизации червей предлагаются для значительного снижения стоимости, важно отметить, что оба могут напрямую влиять на продолжительность жизни. Например, ранее сообщалось, что воздействие FUDR влияет как на продолжительность жизни, так и на термотолерантность45. И хотя сам мутант glp-4(bn2) не оказывает прямого влияния на продолжительность жизни, рост при 25 °C является умеренным тепловым стрессом33,34 и, таким образом, может повлиять на продолжительность жизни2. Существуют и другие методы стерилизации C. elegans, включая ауксин-опосредованную стерильность78 или альтернативные чувствительные к температуре мутанты с дефицитом сперматозоидов79. Тем не менее, все методы имеют некоторые предостережения, и следует позаботиться о том, чтобы использовать наименее вредный анализ для научных потребностей каждой лаборатории. Одним из последних ограничений исследований долголетия является потенциальная изменчивость, которая может возникнуть из-за низких размеров выборки или просто из-за объективной ошибки исследователя. Это можно обойти, поскольку новые технологии рождаются в автоматизированных технологиях продолжительности жизни80, но опять же эти системы являются дорогостоящими и требуют некоторого инженерного и вычислительного оборудования и навыков. В конечном счете, коллекция методов, представленная здесь, представляет собой надежный набор инструментов, которые могут быть быстро адаптированы и изучены практически в любом учреждении и обеспечивают прочную основу для биологии старения.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих финансовых интересов.
Благодарности
G.G. поддерживается T32AG052374, а R.H.S. поддерживается R00AG065200 из Национального института старения. Мы благодарим CGC (финансируется Управлением исследовательской инфраструктуры NIH P40 OD010440) за штаммы.
Материалы
| Name | Company | Catalog Number | Comments |
| APEX IPTG | Genesee | 18-242 | for RNAi |
| Bacto Agar | VWR | 90000-764 | for NGM plates |
| Bacto Peptone | VWR | 97064-330 | for NGM plates |
| Calcium chloride dihydrate | VWR | 97061-904 | for NGM plates |
| Carbenicillin | VWR | 76345-522 | for RNAi |
| Cholesterol | VWR | 80057-932 | for NGM plates |
| DMSO | VWR | BDH1115-1LP | solvent for drugs |
| LB Broth | VWR | 95020-778 | for LB |
| Magnesium sulfate heptahydrate | VWR | 97062-132 | for NGM plates, M9 |
| Paraquat | Sigma-Aldrich | 36541 | for oxidative/mitochondrial stress |
| Potassium Chloride | VWR | 97061-566 | for bleach soluton |
| Potassium phosphate dibasic | VWR | EM-PX1570-2 | for NGM plates |
| Potassium phosphate monobasic | VWR | EM-PX1565-5 | for M9 |
| S7E Dissecting Scope | Leica | 10450840 | Standard dissecting microscope |
| Sodium Chloride | VWR | EM-SX0420-5 | for NGM plates, M9 |
| Sodium hypochlorite | VWR | RC7495.7-32 | for bleach solution |
| Sodium phosphate dibasic | VWR | 71003-472 | for M9 |
| Tetracycline hydrochloride | VWR | 97061-638 | for RNAi |
| Tunicamycin | Sigma-Aldrich | T7765-50MG | for ER stress |
Ссылки
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Klass, M. R. Aging in the nematode Caenorhabditis elegans: major biological and environmental factors influencing life span. Mechanisms of Ageing and Development. 6 (6), 413-429 (1977).
- Friedman, D. B., Johnson, T. E. A mutation in the age-1 gene in Caenorhabditis elegans lengthens life and reduces hermaphrodite fertility. Genetics. 118 (1), 75-86 (1988).
- Kenyon, C., Chang, J., Gensch, E., Rudner, A., Tabtiang, R. A C. elegans mutant that lives twice as long as wild type. Nature. 366 (6454), 461-464 (1993).
- Lithgow, G. J., White, T. M., Melov, S., Johnson, T. E. Thermotolerance and extended life-span conferred by single-gene mutations and induced by thermal stress. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7540-7544 (1995).
- Epel, E. S., Lithgow, G. J. Stress biology and aging mechanisms: toward understanding the deep connection between adaptation to stress and longevity. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 69, 10-16 (2014).
- Luo, Y. Long-lived worms and aging. Redox Report: Communications in Free Radical Research. 9 (2), 65-69 (2004).
- Tissenbaum, H. A. Using C. elegans for aging research. Invertebrate Reproduction & Development. 59, 59-63 (2015).
- Zhang, S., Li, F., Zhou, T., Wang, G., Li, Z. Caenorhabditis elegans as a useful model for studying aging mutations. Frontiers in Endocrinology. 11, 554994 (2020).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Rual, J. -. F., et al. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome Research. 14 (10), 2162-2168 (2004).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
- Reboul, J., et al. Open-reading-frame sequence tags (OSTs) support the existence of at least 17,300 genes in C. elegans. Nature Genetics. 27 (3), 332-336 (2001).
- Lee, S. S., et al. A systematic RNAi screen identifies a critical role for mitochondria in C. elegans longevity. Nature Genetics. 33 (1), 40-48 (2003).
- Reinke, S. N., Hu, X., Sykes, B. D., Lemire, B. D. Caenorhabditis elegans diet significantly affects metabolic profile, mitochondrial DNA levels, lifespan and brood size. Molecular Genetics and Metabolism. 100 (3), 274-282 (2010).
- Revtovich, A. V., Lee, R., Kirienko, N. V. Interplay between mitochondria and diet mediates pathogen and stress resistance in Caenorhabditis elegans. PLOS Genetics. 15 (3), 1008011 (2019).
- Pang, S., Curran, S. P. Adaptive capacity to bacterial diet modulates aging in C. elegans. Cell Metabolism. 19 (2), 221-231 (2014).
- Brooks, K. K., Liang, B., Watts, J. L. The influence of bacterial diet on fat storage in C. elegans. PLOS ONE. 4 (10), 7545 (2009).
- Soukas, A. A., Kane, E. A., Carr, C. E., Melo, J. A., Ruvkun, G. Rictor/TORC2 regulates fat metabolism, feeding, growth, and life span in Caenorhabditis elegans. Genes & Development. 23 (4), 496-511 (2009).
- Bar-Ziv, R., et al. Measurements of physiological stress responses in C. Elegans. Journal of Visualized Experiments: JoVE. (159), e61001 (2020).
- Xiao, R., et al. RNAi interrogation of dietary modulation of development, metabolism, behavior, and aging in C. elegans. Cell Reports. 11 (7), 1123-1133 (2015).
- Calixto, A., Chelur, D., Topalidou, I., Chen, X., Chalfie, M. Enhanced neuronal RNAi in C. elegans using SID-1. Nature Methods. 7 (7), 554-559 (2010).
- Dickinson, D. J., Goldstein, B. CRISPR-based methods for Caenorhabditis elegans genome engineering. Genetics. 202 (3), 885-901 (2016).
- Kim, H. -. M., Colaiácovo, M. P. CRISPR-Cas9-guided genome engineering in C. elegans. Current Protocols in Molecular Biology. 129 (1), 106 (2019).
- Farboud, B., Severson, A. F., Meyer, B. J. Strategies for efficient genome editing using CRISPR-Cas9. Genetics. 211 (2), 431-457 (2019).
- Transformation and Microinjection. WormBook: The Online Review of C. elegans Biology Available from: https://www.ncbi.nlm.nih.gov/books/NBK19648/ (2006)
- Frøkjaer-Jensen, C., et al. Single-copy insertion of transgenes in Caenorhabditis elegans. Nature Genetics. 40 (11), 1375-1383 (2008).
- Kaymak, E., et al. Efficient generation of transgenic reporter strains and analysis of expression patterns in Caenorhabditis elegans using Library MosSCI. Developmental Dynamics: an Official Publication of the American Association of Anatomists. 245 (9), 925-936 (2016).
- Mariol, M. -. C., Walter, L., Bellemin, S., Gieseler, K. A rapid protocol for integrating extrachromosomal arrays with high transmission rate into the C. elegans genome. Journal of Visualized Experiments: JoVE. (82), (2013).
- Rastogi, S., et al. Caenorhabditis elegans glp-4 encodes a valyl aminoacyl tRNA synthetase. G3: Genes|Genomes|Genetics. 5 (12), 2719-2728 (2015).
- Beanan, M. J., Strome, S. Characterization of a germ-line proliferation mutation in C. elegans. Development. 116 (3), 755-766 (1992).
- Santi, D. V., McHenry, C. S. 5-Fluoro-2′-Deoxyuridylate: covalent complex with thymidylate synthetase. Proceedings of the National Academy of Sciences. 69 (7), 1855-1857 (1972).
- Lithgow, G. J., White, T. M., Hinerfeld, D. A., Johnson, T. E. Thermotolerance of a long-lived mutant of Caenorhabditis elegans. Journal of Gerontology. 49 (6), 270-276 (1994).
- Labbadia, J., Morimoto, R. I. The biology of proteostasis in aging and disease. Annual Review of Biochemistry. 84 (1), 435-464 (2015).
- Taylor, R. C., Dillin, A. XBP-1 is a cell-nonautonomous regulator of stress resistance and longevity. Cell. 153 (7), 1435-1447 (2013).
- Higuchi-Sanabria, R., et al. Divergent nodes of non-autonomous UPRER signaling through serotonergic and dopaminergic neurons. Cell Reports. 33 (10), 108489 (2020).
- Durieux, J., Wolff, S., Dillin, A. The cell-non-autonomous nature of electron transport chain-mediated longevity. Cell. 144 (1), 79-91 (2011).
- Morley, J. F., Morimoto, R. I. Regulation of longevity in Caenorhabditis elegans by heat shock factor and molecular chaperones. Molecular Biology of the Cell. 15 (2), 657-664 (2004).
- Heifetz, A., Keenan, R. W., Elbein, A. D. Mechanism of action of tunicamycin on the UDP-GlcNAc:dolichyl-phosphate Glc-NAc-1-phosphate transferase. Biochemistry. 18 (11), 2186-2192 (1979).
- Castello, P. R., Drechsel, D. A., Patel, M. Mitochondria are a major source of paraquat-induced reactive oxygen species production in the brain. The Journal of Biological Chemistry. 282 (19), 14186-14193 (2007).
- Park, H. -. E. H., Jung, Y., Lee, S. -. J. V. Survival assays using Caenorhabditis elegans. Molecules and Cells. 40 (2), 90-99 (2017).
- Gardner, M., Rosell, M., Myers, E. M. Measuring the effects of bacteria on C. Elegans behavior using an egg retention assay. Journal of Visualized Experiments: JoVE. (80), e51203 (2013).
- Waggoner, L. E., Hardaker, L. A., Golik, S., Schafer, W. R. Effect of a neuropeptide gene on behavioral states in Caenorhabditis elegans egg-laying. Genetics. 154 (3), 1181-1192 (2000).
- Zevian, S. C., Yanowitz, J. L. Methodological considerations for heat shock of the nematode Caenorhabditis elegans. Methods. 68 (3), 450-457 (2014).
- Feldman, N., Kosolapov, L., Ben-Zvi, A. Fluorodeoxyuridine improves Caenorhabditis elegans proteostasis independent of reproduction onset). PLOS ONE. 9 (1), 85964 (2014).
- Hsu, A. -. L., Murphy, C. T., Kenyon, C. Regulation of aging and age-related disease by DAF-16 and heat-shock factor. Science. 300 (5622), 1142-1145 (2003).
- Bansal, A., Zhu, L. J., Yen, K., Tissenbaum, H. A. Uncoupling lifespan and healthspan in Caenorhabditis elegans longevity mutants. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), 277-286 (2015).
- Hodgkin, J., Barnes, T. M. More is not better: brood size and population growth in a self-fertilizing nematode. Proceedings. Biological Sciences. 246 (1315), 19-24 (1991).
- Ozbey, N. P., et al. Tyramine Acts Downstream of Neuronal XBP-1s to coordinate inter-tissue UPRER activation and behavior in C. elegans. Developmental Cell. 55 (6), 754-770 (2020).
- Lee, Y., et al. Inverse correlation between longevity and developmental rate among wild C. elegans strains. Aging. 8 (5), 986-994 (2016).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nature Methods. 8 (7), 592-598 (2011).
- Lee, S. -. J., Hwang, A. B., Kenyon, C. Inhibition of respiration extends C. elegans life span via reactive oxygen species that increase HIF-1 activity. Current Biology: CB. 20 (23), 2131-2136 (2010).
- Baird, N. A., et al. HSF-1-mediated cytoskeletal integrity determines thermotolerance and life span. Science. 346 (6207), 360-363 (2014).
- Houtkooper, R. H., et al. Mitonuclear protein imbalance as a conserved longevity mechanism. Nature. 497 (7450), 451-457 (2013).
- Carpenter, R. L., Gökmen-Polar, Y. HSF1 as a cancer biomarker and therapeutic target. Current Cancer Drug Targets. 19 (7), 515-524 (2019).
- Chen, S., et al. The emerging role of XBP1 in cancer. Biomedicine & Pharmacotherapy. 127, 110069 (2020).
- Yadav, R. K., Chauhan, A. S., Zhuang, L., Gan, B. FoxO transcription factors in cancer metabolism. Seminars in Cancer Biology. 50, 65-76 (2018).
- López-Otín, C., Blasco, M. A., Partridge, L., Serrano, M., Kroemer, G. The hallmarks of aging. Cell. 153 (6), 1194-1217 (2013).
- Kennedy, B. K., et al. Geroscience: linking aging to chronic disease. Cell. 159 (4), 709-713 (2014).
- Ben-Zvi, A., Miller, E. A., Morimoto, R. I. Collapse of proteostasis represents an early molecular event in Caenorhabditis elegans aging. Proceedings of the National Academy of Sciences. 106 (35), 14914-14919 (2009).
- Hewitt, J. E., et al. Muscle strength deficiency and mitochondrial dysfunction in a muscular dystrophy model of Caenorhabditis elegans and its functional response to drugs. Disease Models & Mechanisms. 11 (12), (2018).
- Gao, S., Zhen, M. Action potentials drive body wall muscle contractions in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 108 (6), 2557-2562 (2011).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. Journal of Visualized Experiments: JoVE. (74), e50069 (2013).
- Flemming, A. J., Shen, Z. Z., Cunha, A., Emmons, S. W., Leroi, A. M. Somatic polyploidization and cellular proliferation drive body size evolution in nematodes. Proceedings of the National Academy of Sciences of the United States of America. 97 (10), 5285-5290 (2000).
- Madhu, B. J., Salazar, A. E., Gumienny, T. L. Caenorhabditis elegans egg-laying and brood-size changes upon exposure to Serratia marcescens and Staphylococcus epidermidis are independent of DBL-1 signaling. microPublication Biology. 2019, (2019).
- Westendorp, R. G., Kirkwood, T. B. Human longevity at the cost of reproductive success. Nature. 396 (6713), 743-746 (1998).
- Hoffman, J. M., Creevy, K. E., Promislow, D. E. L. Reproductive capability is associated with lifespan and cause of death in companion dogs. PLOS ONE. 8 (4), 61082 (2013).
- Garratt, M., Try, H., Smiley, K. O., Grattan, D. R., Brooks, R. C. Mating in the absence of fertilization promotes a growth-reproduction versus lifespan trade-off in female mice. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15748-15754 (2020).
- Labbadia, J., Morimoto, R. I. Repression of the heat shock response is a programmed event at the onset of reproduction. Molecular Cell. 59 (4), 639-650 (2015).
- Higuchi-Sanabria, R., Frankino, P. A., Paul, J. W., Tronnes, S. U., Dillin, A. A futile battle? Protein quality control and the stress of aging. Developmental Cell. 44 (2), 139-163 (2018).
- Dutta, N., Garcia, G., Higuchi-Sanabria, R. Hijacking cellular stress responses to promote lifespan. Frontiers in Aging. 3, (2022).
- Senchuk, M. M., Dues, D. J., Van Raamsdonk, J. M. Measuring oxidative stress in Caenorhabditis elegans: paraquat and juglone sensitivity assays. Bio-protocol. 7 (1), 2086 (2017).
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: mitochondrial function using the seahorse system. Methods in molecular biology. 1710, 285-293 (2018).
- Daniele, J. R., et al. High-throughput characterization of region-specific mitochondrial function and morphology. Scientific Reports. 7 (1), 6749 (2017).
- Xu, N., et al. The FATP1-DGAT2 complex facilitates lipid droplet expansion at the ER-lipid droplet interface. The Journal of Cell Biology. 198 (5), 895-911 (2012).
- Daniele, J. R., et al. UPRER promotes lipophagy independent of chaperones to extend life span. Science Advances. 6 (1), 1441 (2020).
- Higuchi-Sanabria, R., et al. Spatial regulation of the actin cytoskeleton by HSF-1 during aging. Molecular Biology of the Cell. 29 (21), 2522-2527 (2018).
- Kasimatis, K. R., Moerdyk-Schauwecker, M. J., Phillips, P. C. Auxin-mediated sterility induction system for longevity and mating studies in Caenorhabditis elegans. G3: Genes|Genomes|Genetics. 8 (8), 2655-2662 (2018).
- Fabian, T. J., Johnson, T. E. Production of age-synchronous mass cultures of Caenorhabditis elegans. Journal of Gerontology. 49 (4), 145-156 (1994).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены