Method Article
Laserinduzierte Aktionspotential-ähnliche Messungen von Kardiomyozyten an Mikroelektrodenarrays für erhöhte Vorhersagbarkeit der Sicherheitspharmakologie
In diesem Artikel
Zusammenfassung
Die Kombination aus Laserporation und Mikroelektrodenarrays (MEA) ermöglicht aktionspotentialartige Aufnahmen von kultivierten Primär- und Stammzell-abgeleiteten Kardiomyozyten. Die Wellenformform bietet einen besseren Einblick in die Wirkungsweise von Testverbindungen als Standardaufzeichnungen. Es verbindet Patch-Clamp und MEA-Anzeige, um die kardiosichere Forschung in Zukunft weiter zu optimieren.
Zusammenfassung
Lebensbedrohlichen medikamenteninduzierten Herzrhythmusstörungen gehen oft verlängerte kardiale Aktionspotentiale (AP) voraus, die häufig von kleinen proarrhythmischen Membranpotentialschwankungen begleitet werden. Die Form und der zeitliche Verlauf der repolarisierenden Fraktion des AP können entscheidend für das Vorhandensein oder Fehlen von Arrhythmien sein.
Mikroelektroden-Arrays (MEA) ermöglichen einen einfachen Zugang zu kardiotoxischen Verbindungseffekten über extrazelluläre Feldpotentiale (FP). Obwohl die FP-Wellenform ein leistungsfähiges und etabliertes Werkzeug in der Forschung und der kardialen Sicherheitspharmakologie ist, lässt sie aufgrund des extrazellulären Aufzeichnungsprinzips und der daraus resultierenden intrinsischen Wechselstromfilterung (AC) nicht auf die ursprüngliche AP-Form schließen.
Ein neuartiges Gerät, das hier beschrieben wird, kann die Membran von Kardiomyozyten, die auf den MEA-Elektroden kultiviert wurden, zu mehreren Kultivierungszeitpunkten mit einem hochfokussierten Nanosekunden-Laserstrahl wiederholt öffnen. Die Laserporation führt zur Umwandlung des elektrophysiologischen Signals von FP in intrazellulärähnliche APs (laser-induced AP, liAP) und ermöglicht die Aufzeichnung transzellulärer Spannungsablenkungen. Dieser intrazelluläre Zugang ermöglicht eine bessere Beschreibung der AP-Form und eine bessere und empfindlichere Klassifizierung proarrhythmischer Potentiale als normale MEA-Aufnahmen. Dieses System ist eine revolutionäre Erweiterung der bestehenden elektrophysiologischen Methoden und ermöglicht eine genaue Bewertung der kardiotoxischen Wirkung mit allen Vorteilen von MEA-basierten Aufzeichnungen (einfache, akute und chronische Experimente, Signalausbreitungsanalyse usw.).
Einleitung
Der elektrische Beitrag eines Herzschlags resultiert aus einem komplexen und zeitlich genau abgestimmten Zusammenspiel vieler Herzkanäle und Transporter sowie der exakt abgestimmten Ausbreitung elektrischer Signale durch das Myokard1. Eine Veränderung dieser eng aufeinander abgestimmten Mechanismen (z.B. Medikamenteneinnahme) kann schwerwiegende Folgen für die Funktion des Herzens haben (d.h. lebensbedrohliche Arrhythmien)2,3. Arrhythmien sind definiert als unregelmäßige Herzschläge, die den normalen Herzrhythmus verändern, was lebensbedrohliche Folgen haben kann. Sie können entweder durch eine gestörte Initiierung einer Herzerregungswelle oder durch eine abnormale Ausbreitung der Herzerregung4 verursacht werden, was wiederum zu einer Funktionsstörung des Pumpmechanismus des Herzens führt.
Viele hochpotente Wirkstoffkandidaten müssen aufgrund ihres (pro-)arrhythmischen Potenzials in der frühen Arzneimittelentwicklungsphase von weiteren Untersuchungen ausgeschlossen werden 2,3. Sie modulieren wichtige Herzkanäle (z. B. den menschlichen Ether-a-go-go-bezogenen Genkanal [hERG]), die für die normale kardiale Aktionspotentialbildung und -beendigung sowie die anschließende Signalausbreitung verantwortlich sind5.
Pharmaunternehmen verwenden routinemäßig Patch-Clamp-Messungen oder Mikroelektroden-Arrays (MEA), um mögliche kardiotoxische Off-Target-Effekte zu untersuchen, die durch Arzneimittelkandidaten induziert werden. Patch-Clamp-Aufnahmen erlauben es, den Einfluss von Substanzen auf kardiale Ionenkanäle zu entschlüsseln und das transzelluläre kardiale Aktionspotential mit hoher räumlich-zeitlicher Auflösung zu analysieren 6,7. Nachteile dieser Technik sind jedoch ein geringer Durchsatz mit manueller Patchklemme und die begrenzte Anwendbarkeit der Automatisierung aufgrund der Abhängigkeit dieser Methode von Zellen in Suspension. Darüber hinaus können chronische Effekte aufgrund der Invasivität der Methode nicht untersucht werden. Schließlich werden typischerweise nur einzelne Zellen gleichzeitig und nicht das gesamte Herzsynzytium untersucht, was es unmöglich macht, Informationen über die Signalausbreitung zu adressieren.
Spannungsempfindliche Farbstoffe sind wertvoll für die nichtinvasive Untersuchung kardialer Aktionspotentiale und medikamenteninduzierter Arrhythmien8. Sie ermöglichen die Untersuchung sowohl der Einzelzell- als auch der Synzytiumaktivität. Nachteile dieser Methode sind zytotoxische Wirkungen entweder der Farbstoffe an sich oder des Reaktionsprodukts während der Beleuchtung. Sie werden für Akutexperimente verwendet und sind für Langzeitstudien kaum anwendbar 9,10,11. Spannungsempfindliche Proteine als Alternativen haben in den letzten Jahren erhebliche Fortschritte in Bezug auf Verwendbarkeit und Empfindlichkeit gemacht, erfordern jedoch eine genetische Veränderung der interessierenden Zellen und haben im Vergleich zu elektrophysiologischen Techniken keine hohe zeitliche Auflösung12.
Informationen aus der jüngsten CiPA-Initiative13 besagen, dass MEAs in kardialen Sicherheitsscreenings als alternativer elektrophysiologischer Ansatz weit verbreitet sind, da sie ein leistungsfähiges und etabliertes Instrument zur Untersuchung der Herzfunktion und Sicherheitspharmakologie darstellen. Kardiomyozyten werden als Synzytium direkt auf den Chips kultiviert und extrazelluläre Feldpotentiale (FPs) werden nichtinvasiv über substratintegrierte Mikroelektroden erfasst. Dieses Aufzeichnungsprinzip ermöglicht die Durchführung von Mehrdurchsatz-Screenings über mehrere Tage und eignet sich daher für die pharmazeutische Erforschung chronischer Wirkungen. Die resultierende FP-Wellenform ist eine Ableitung des intrazellulären AP14. Parameter wie die Schlagrate, die Amplitude des Anfangsteils des FP und die FP-Dauer sind leicht zugänglich15. Andere wesentliche Kriterien wie die Unterscheidung zwischen Prolongation und Triangulation des FP (ein wichtiger Marker der Proarrhythmie16,17) sind aufgrund der AC-Filterwirkung der Technik nicht zugänglich. Darüber hinaus wird die Erkennung anderer kleiner proarrhythmischer Ereignisse wie frühe und verzögerte Nachdepolarisationen (EAD bzw. DAD) aufgrund ihrer geringen Amplitude oft leicht übersehen.
Hier beschreiben wir eine Methode, um Zugang zum intrazellulären Membranpotential durch Öffnen der Membran von Kardiomyozyten zu erhalten. Das IntraCell-Gerät (im Folgenden als intrazelluläres Aufzeichnungsgerät bezeichnet) ermöglicht wiederholte Membranöffnungen von Kardiomyozyten, die auf den MEA-Elektroden kultiviert wurden, unter Verwendung eines hochfokussierten Nanosekunden-Laserstrahls über ein bestimmtes physikalisches Phänomen (Oberflächenplasmonenresonanz)18. Dadurch geht die Aufzeichnung von einem regulären FP in einen intrazellulär-ähnlichen AP (laser-induced AP, liAP) über. Das Protokoll zeigt, wie dies den Zugang zu kinetischen Aspekten der Wellenform ermöglicht, die durch die Analyse von FPs nicht einfach erfasst werden können. Diese Methode stellt eine Brücke zwischen traditionellen intrazellulären Patch-Clamp und MEA-Aufnahmen dar. Die Technologie ist daher eine leistungsstarke Erweiterung der derzeitigen Methoden zur Bewertung der kardialen Sicherheit.
Protokoll
1. Induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten-Zubereitung
HINWEIS: iCell Kardiomyozyten2 (bezeichnet als induzierte pluripotente Stammzellen [iPSCs]-abgeleitete Kardiomyozyten) wurden gemäß dem vom Lieferanten bereitgestellten Protokoll hergestellt. Das Protokoll wird im folgenden Abschnitt kurz zusammengefasst.
- Auftau- und Wartungsmedium bei 4 °C für 24 h vor der Verwendung.
- Fibronektinbeschichtung durch Auflösen von sterilem Fibronektin in sterilem Wasser in einer Konzentration von 1 mg/ml vorbereiten. Gefrieren Sie diesen Bestand in Aliquots (z. B. 25 μL pro Aliquot). Verdünnen Sie die aliquotierte Stammlösung 1:20 in steriler ausgewogener Salzlösung (dPBS) von Dulbecco.
- Beschichten Sie die Elektrodenfelder der zuvor autoklavierten MEAs unter der Laminar-Flow-Haube tröpfchenweise unter sterilen Bedingungen mit Fibronektin mit einer 10 μL Pipette. Dazu tropfen Sie 5 μL der Fibronektin-Beschichtungslösung auf die Elektrodenfelder und beobachten Sie die Bildung eines Tröpfchens auf der Elektrodenfläche. Achten Sie darauf, die empfindlichen Elektroden nicht zu berühren.
HINWEIS: Um sterile Bedingungen aufrechtzuerhalten, geben Sie den MEA-Chip in eine sterile Petrischale, bevor Sie ihn aus der Laminar-Flow-Haube entfernen. - Die beschichteten MEAs vorzugsweise 1 h bei 37 °C in einem Inkubator inkubieren.
- Das Kryovial mit den Kardiomyozyten in einem Wasserbad bei ca. 37 °C für 2 min auftauen, bis nur noch ein kleiner Eiskristall übrig ist. Übertragen Sie die Zelllösung vorsichtig in ein 50-ml-Röhrchen.
- Geben Sie 1 ml Beschichtungsmedium in das leere Kryovial. Die Lösung wird über einen Zeitraum von 90 s tropfenweise in das 50-ml-Röhrchen gegeben, um den osmotischen Schock zu reduzieren. Fügen Sie vorsichtig zusätzliche 8 mL Beschichtungsmedium in das Röhrchen ein.
- Mischen Sie die Zellsuspension vorsichtig mit einer 10-ml-Pipette. Berechnen Sie die Gesamtzahl der lebensfähigen Zellen mithilfe der automatisierten Fluoreszenzzytometrie. Die Nummer sollte nahe an der Nummer im Datenblatt des Herstellers liegen.
- Drehen Sie die Zelllösung für 3 min bei 200 x g bei Raumtemperatur herunter. Entfernen Sie den Überstand durch Absaugen mit einer Glaspipette, die an einem Pumpsystem befestigt ist. Stellen Sie die Zellzahl zwischen 6.000 und 15.000 lebensfähigen Zellen / μL ein.
HINWEIS: Die Anzahl der Zellen liegt in der Regel im oben angegebenen Bereich, kann aber je nach Anbieter variieren. - Entfernen Sie die in Schritt 1.3 aufgetragene Beschichtungslösung mit einer 10-μL-Pipette direkt vor der Zellaussaat aus dem MEA-Elektrodenbereich. Säen Sie die Zellen sofort nach der Entfernung, um ein Austrocknen der Beschichtung zu vermeiden. Dazu säen Sie die Zellen bei 4 μL sowohl für 6-Well-MEAs als auch für 1-Well-MEAs auf die Elektrodenfelder auf die gleiche Weise wie bei der Beschichtung.
- Lassen Sie die Zellen 1 h im Inkubator bei 37 °C und 5%CO2 haften, bevor Sie die Vertiefungen mit dem sterilen Beschichtungsmedium füllen, das auf ca. 37 °C bei 200 μL für 6-Well-MEA und 1 ml für Single Well-MEA unter der Laminar-Flow-Haube erhitzt wird.
- Führen Sie 48 h nach der Beschichtung unter der Laminar-Flow-Haube einen vollständigen Mediumswechsel durch. Entfernen Sie dazu das Beschichtungsmedium durch Absaugen mit einer Glaspipette, die an einem Pumpsystem befestigt ist. Anschließend werden 200 μL steriles Erhaltungsmedium, das auf 37 °C erhitzt ist, in die Vertiefungen gegeben.
- Führen Sie jeden zweiten Tag komplette Medienwechsel durch.
- Beginnen Sie mit der Messung der Zellen 5-8 Tage nach dem Auftauen. Führen Sie 2 h vor Beginn der Experimente einen vollständigen Medienwechsel durch.
2. MEA-Aufnahmen
HINWEIS: Das Gerät zur Umwandlung des FP-Signals in liAP besteht aus einem aufrechten Mikroskop und einem 1064-nm-Laser.
- Platzieren Sie das MEA-System auf dem Gerät, wobei der MEA-Chiphalter zentriert über dem Objektivloch liegt. Positionieren Sie das MEA-Setup so, dass sich das Objektiv direkt unter dem Loch des MEA-Systems befindet, damit der Laser auf die Elektroden fokussieren kann.
- Übertragen Sie den MEA-Chip mit den kultivierten Zellen 15 Minuten vor der Aufnahme aus dem Inkubator in das MEA-Setup, damit sich die Zellen von der mechanischen Störung erholen können.
- Reinigen Sie die Kontaktpads und Stifte sorgfältig mit Isopropanol und einem Wattestäbchen, um den Geräuschpegel zu senken. Setzen Sie die MEA vorsichtig in das MEA-Setup ein. Positionieren Sie den MEA-Chip mit dem Logo unten oben links (6-Well-MEA) oder mit der Referenzelektrode links (Single-Well-MEA).
- Stellen Sie die MEA systemintegrierte Heizung auf 38 °C ein. Platzieren Sie eine kleine Kammer auf dem MEA-Chip, um die Zellen ständig mit befeuchtetem Carbogen (5% CO 2 und 95% O2) zu perfundieren, um die Inkubatorbedingungen wiederherzustellen und eine Verdunstung zu verhindern.
- Schließen Sie den Deckel des Geräts. Durch den integrierten Sicherheitsschalter kann der Laser nur aktiviert werden, wenn der Deckel über dem MEA-Chip geschlossen ist. Stellen Sie den MEA-Systemfilter mit dem MEA-Konfigurationsprogramm auf 0,1 Hz oder weniger Hochpass und 3.500 Hz Tiefpass ein.
- Verwenden Sie die MC_Rack Software (Aufnahmesoftware) oder eine andere Software für die Aufnahme. Passen Sie den Eingangsbereich an Ihre Bedürfnisse an, um sicherzustellen, dass das Signal den Verstärker und die Abtastrate (z. B. 20 kHz) nicht sättigt. Nutzen Sie die Langzeitanzeigefunktion der Software, um die Aufnahme zu überprüfen.
3. Laserinduzierte Zellporation
- Nachdem Sie den MEA-Chip in das MEA-Setup eingesetzt und die Software eingerichtet haben, initialisieren Sie die Lasermechanik mit der Software FB Alps (Initialisierungssoftware).
- Klicken Sie zunächst auf die Schaltfläche Initialisierung . Am Ende der Initialisierung befindet sich der virtuelle Laserpunkt in Bohrloch D für eine 6-Well-MEA bzw. unten links für eine Single-Well-MEA.
- Bewegen Sie den virtuellen Laserpunkt mit Strg + Mausklick in die Mitte der Elektrode D5 und stellen Sie den Fokus ein. Stellen Sie den Fokus durch Strg + Scrollen mit dem Mausrad ein.
- Drücken Sie den Knopf Set P1. Der virtuelle Laserpunkt bewegt sich automatisch in Bohrloch F. Wiederholen Sie den Vorgang mit der Elektrode F5 und wählen Sie Set P2.
- Nach diesem Vorgang bewegt sich der Laserpunkt in Bohrloch B. Wiederholen Sie den gleichen Vorgang mit der Elektrode B5 und drücken Sie Set P3 in der Software. Das System ist nun ausgerichtet.
- Passen Sie die Laserleistung und die Prozesszeit an die Bedürfnisse Ihrer Zellen an. Hier wurden 40% Power und 25% Prozesszeit genutzt.
- Um den Laser zu aktivieren, klicken Sie auf die Schaltfläche Laser Off, die dann als Laser an angezeigt wird. Wechseln Sie zur Aufnahmesoftware, wählen Sie einen Dateinamen und klicken Sie auf die Schaltfläche Red Recording gefolgt von der Schaltfläche Play oben im Fenster, um die Messung aufzuzeichnen.
- Zeichnen Sie eine Baseline von 60 s auf, bevor Sie die Zellen mit dem Laser öffnen. Wechseln Sie zurück zur Initialisierungssoftware.
- Deaktivieren Sie die vom Laser auszuschließenden Elektroden auf der virtuellen Karte auf der rechten Seite mit Strg + Mausklick. Wählen Sie die gewünschten Elektroden aus, indem Sie sie in der Array-Darstellung auf der rechten Seite des Softwarefensters aktivieren.
- Um den Laser zu starten, verwenden Sie Alt + Mausklick und wählen Sie die mittlere Elektrode dieser Vertiefung aus. Dadurch wird der Laser initiiert, um die Zellen an jeder Elektrode dieser Vertiefung automatisch zu öffnen. Wiederholen Sie dies für jede Vertiefung. Der Laser öffnet dann automatisch alle zuvor aktivierten Elektroden der ausgewählten Vertiefung.
4. Umgang und Anwendung von Medikamenten
- Bereiten Sie alle Substanzen, die für Drogentests verwendet werden sollen, frisch am Tag der Messungen vor. Stellen Sie sicher, dass die endgültige Anwendungskonzentration im Medium 10-mal höher ist, um eine Verdünnung von 1:10 in den Vertiefungen zu erzielen.
- Nifedipin, E4031 und Dofetilid werden zuerst in DMSO in mM-Konzentration und dann weiter in mittlerem bis 10x der gewünschten Konzentration gelöst. Überschreiten Sie niemals eine endgültige DMSO-Konzentration von 0,1% im Bohrloch.
- Zeichnen Sie die Basisaktivität für 60 s auf. Starten Sie die laserinduzierte Poration wie in Schritt 3 des Protokolls beschrieben, was zu einer Umwandlung des FP in eine liAP-Form führt.
- Wenden Sie alle Medikamente als Einzelkonzentration pro Well an. Entfernen Sie 20 μL Medium pro Vertiefung für 6-Well-MEAs bzw. 100 μL für Single-Well-MEAs. Geben Sie je nach MEA-Typ 20 μL oder 100 μL der Stammlösung des zu messenden Arzneimittels in die Vertiefung und pipettieren Sie vorsichtig 2-3 Mal nach oben und unten. Führen Sie mindestens drei Replikationen jedes Arzneimittels und jeder Konzentration durch, um statistische Relevanz zu erreichen.
- Lassen Sie die Verbindungen 300 s einwaschen. Während dieser Zeit kann sich die liAP-Form wieder in eine FP-Form umwandeln. Induzieren Sie erneut eine laserinduzierte Poration und zeichnen Sie mögliche verbindungsinduzierte Effekte auf den liAP für weitere 60 s auf.
5. Datenexport
- Wählen Sie relevante Elektroden aus, indem Sie die Aufnahme in der Aufnahmesoftware wiedergeben. Verwenden Sie MC_DataTool, um MC_Rack Dateien in ASCII-.txt Dateien zu konvertieren.
- Klicken Sie auf Datei > MCD öffnen > Wählen Sie eine MC_Rack Datei aus. Klicken Sie auf den txt-Button (blauer Text).
- Wählen Sie eine Elektrode aus. Die ausgewählte Elektrode wird in der Liste auf der rechten Seite angezeigt.
- Klicken Sie auf Durchsuchen , um den Ordner auszuwählen und den Namen der neuen .txt Datei zu ändern. Klicken Sie auf Speichern.
- Deaktivieren Sie die exportierte Elektrode und wählen Sie die nächste zu exportierende Elektrode aus. Wiederholen Sie den Vorgang für alle Elektroden von Interesse.
6. Datenverarbeitung und statistische Auswertung
- Importieren Sie konvertierte binäre Spuren in R19. Visualisieren/analysieren Sie die Daten mit maßgeschneiderten Skripten, die die folgenden Pakete enthalten: dplyr, tidyr und ggplot220,21,22.
Ergebnisse
Das Aufzeichnungssystem, das zur Aufzeichnung der elektrischen Aktivität von kultivierten Kardiomyozyten verwendet wurde, bestand aus einem Standard-MEA-System, das mit einer Heizung und einer Kammer für Carbogen ausgestattet war, die an einen Computer angeschlossen war. Das System wurde auf das intrazelluläre Aufzeichnungsgerät gesetzt, das wiederum auf einer kleinen Antivibrationseinheit montiert war (Abbildung 1A-B).
iPSC-abgeleitete Kardiomyozyten 2 begannen spontan innerhalb von 2-3 Tagen nach dem Auftauen zu schlagen (Tage in vitro, DIV) und waren unter einem Mikroskop sichtbar. Ab DIV 4 wurde die Schlagfrequenz regelmäßig, und extrazelluläre Feldpotentiale (FP) mit Spitze-Spitze-Amplituden der depolarisierenden Komponente zwischen 1 und 5 mV konnten an den meisten Elektroden innerhalb der jeweiligen Vertiefungen der MEA-Chips nachgewiesen werden. Die elektrische Aktivität konnte in mehr als 95% der untersuchten Bohrungen nachgewiesen werden. Ab DIV 7 stieg die Wahrscheinlichkeit einer Zellablösung, was eine weitere Nutzung dieser Vertiefungen unmöglich machte.
Die Software zur Steuerung der laserinduzierten Membranöffnung erlaubt es, sowohl die Leistung als auch die Prozesszeit des Lasers einzustellen, der die Öffnung der Zellmembran nur an der zu untersuchenden Elektrode vermittelt (Abbildung 1C), während andere Elektroden in der jeweiligen Vertiefung nicht betroffen sind. Während zu konservative Einstellungen die Wellenform des FP nicht veränderten, führten zu hohe Einstellungen zu einer mutmaßlichen Verletzung der Kardiomyozyten, die durch kräftiges, aber vorübergehendes Schlagen oder Verlust des Signals angezeigt wurde. Bei Anpassung an eine Einstellung von 40% Leistung und 25% Prozesszeit, die von den Zellen gut toleriert wird, führte die Auslösung des Laserpulses zu mehrfachen Änderungen der aufgezeichneten Wellenform (siehe Abbildung 1D für eine beispielhafte Aufzeichnung). Unter diesen Bedingungen wurde makroskopisch keine Veränderung des Elektrodenmaterials beobachtet. Die aufgezeichnete Signalamplitude erhöhte sich massiv um 4,1 ± 0,41 (n = 20, Bereich 1,34-8,83), analysiert aus einer zufällig ausgewählten Teilmenge von Aufnahmen, was zu Amplituden zwischen 7 und 22 mV führte. Darüber hinaus transformierte sich die Wellenform von einer Standard-FP-Form mit schneller, biphasischer und transienter Spannungsablenkung zu Beginn, gefolgt von einer Plateauphase zurück an der Basislinie und einer kleinen Auslenkung, die das Ende des FP anzeigte, in eine Form, die näher an einem intrazellulär aufgezeichneten AP mit einem schnellen Anstieg, einer ausgedehnten depolarisierten Plateauphase und einer Repolarisationsphase mit einem Unterschreiter unterhalb der Basislinie lag (Abbildung 1E ). Wir haben diese Spannungsablenkungen als laserinduzierte AP (liAP) definiert. In den meisten Fällen war der Übergang vorübergehend und zumindest teilweise innerhalb von 5 min invertiert. Die Signalausbreitung innerhalb des kardialen Synzytiums blieb nach der liAP-Induktion unverändert (Abbildung 2), was darauf hindeutet, dass das verbleibende Synzytium nicht durch eine mögliche Schädigung durch den Laserpuls beeinflusst wurde.
Ähnlichkeiten mit intrazellulär aufgezeichneten APs ermöglichten die Extraktion von Parametern des liAP, die FPs nicht zugänglich sind (für beispielhafte Parameter siehe z.B. Abbildung 3A), vor allem die Messung der Dauer des liAP zu bestimmten Zeitpunkten (z. B. bei 20%, 50% und 90%) (Abbildung 3B), analog zu APD20/50/90, das üblicherweise für die Beschreibung von APs verwendet wird.
Als nächstes testeten wir die Reaktion der lasergeöffneten Kardiomyozyten auf häufig verwendete kardioaktive pharmakologische Werkzeugverbindungen. Ein beispielhaftes Protokolldesign ist in Abbildung 3C zu finden. Da die Transformation des liAP nicht immer während des gesamten Experiments anhielt, wurde die Anwendung der Verbindung als Einzelkonzentration pro Vertiefung und nicht kumulativ durchgeführt, um die Gesamtaufzeichnungszeit zu reduzieren. Dennoch war es notwendig, die Zellen vor dem Auftragen der Testverbindung entweder wieder zu öffnen oder einen anderen Elektrodenbereich zu öffnen.
Die Zugabe des spezifischen L-Typ Ca 2+ Kanalblockers, Nifedipin23,24, reduzierte die Plateauphase des liAP konzentrationsabhängig und verkürzte dadurch den gesamten liAP (Abbildung 4A,B). Diese Verkürzung war vergleichbar mit der Analyse von FPs von Kardiomyozyten aus unmanipulierten Elektroden (Abbildung 4C), was darauf hindeutet, dass diese Aufzeichnungsmethode im Vergleich zu klassischen FP-Aufnahmen keine nachteiligen Auswirkungen hatte.
E4031 hemmt die Repolarisation des relevanten Kv1.11 (hERG) Kaliumkanals25 und führt bei erhöhten Konzentrationen zu arrhythmischem Verhalten von Kardiomyozyten. Ähnlich wie die Analyse aus FP-Aufzeichnungen erhöhte E4031 die liAP-Dauer konzentrationsabhängig (Abbildung 5). Zusätzlich waren bei Konzentrationen von 0,01 μM und höher kleine positive Spannungsauslenkungen am Ende des liAP sichtbar. Diese Ablenkungen traten mit höheren Konzentrationen stärker hervor, was auf eine vorübergehende neue Depolarisation hindeutet, im Gegensatz zu den FPs, wo diese Ablenkungen praktisch unsichtbar waren (siehe Abbildung 5B-C, obere (FP) vs. untere (liAP) Spuren). Dieses Verhalten wird als frühe Nachdepolarisation (EAD) bezeichnet. Bei der höchsten Konzentration von 0,1 μM eskalierten diese EADs im Laufe der Zeit zu ektopischen Beats, die vorzeitige Aktionspotentiale darstellen (Abbildung 5C). Sowohl EAD als auch ektopische Beats sind Schlüsselindikatoren für proarrhythmische Aktivität. Am Ende des in Abbildung 5D gezeigten Beispiels führte die elektrische Aktivität zu arrhythmischen Schlägen. Außerdem stimmten die Konzentrations-Wirkungs-Beziehungen zwischen FP- und liAP-Aufzeichnungen überein (Abbildung 5E). Es gibt jedoch eine größere Variabilität in den FP-Daten, die sich aus der schwachen Repolarisationskomponente der FPs bei höheren Konzentrationen der Testverbindung ergibt. Es scheint die charakteristische Natur von iPSC-abgeleiteten Kardiomyozyten2 zu sein, auch unter Kontrollbedingungen unphysiologisch lange APs zu erzeugen (AP-Dauern > 700 ms). Das MEA-System wendete eine intrinsische 0,1 Hz-AC-Filterung an, die wiederum zu einer teilweise gefilterten Form des liAP führte, ohne jedoch die qualitativen Informationen über den Beginn und die Beendigung des zugrunde liegenden AP zu verdecken.
Es stellte sich heraus, dass das anfängliche Auftreten von proarrhythmischen Spannungsauslenkungen bei niedrigeren Konzentrationen in liAPs im Vergleich zu FP-Aufnahmen nachgewiesen werden konnte. In Abbildung 6 ist die Aufzeichnung der elektrischen Aktivität während der Applikation von Dofetilid in einer Konzentration von 3 μM dargestellt. Die Aufnahme wurde im selben Brunnen erhalten. Obwohl sowohl FP als auch liAP eine Dauer von etwa 2 s aufwiesen, war die FP-Wellenform unauffällig und zeigte regelmäßige repolarisierende Auslenkungen. Gleichzeitig wurden am Ende der liAPs EADs in unterschiedlichen Größenordnungen sichtbar. Diese Erhöhung der relevanten sicherheitspharmakologischen Sensitivität unterstützt die Erkenntnis, dass liAPs, die durch Oberflächenplasmonenresonanz induziert werden, eine verbesserte Qualifizierung der repolarisierenden Phase ermöglichen und dadurch helfen, mehr über die Wirkungsweise der untersuchten Testverbindungen zu erfahren.
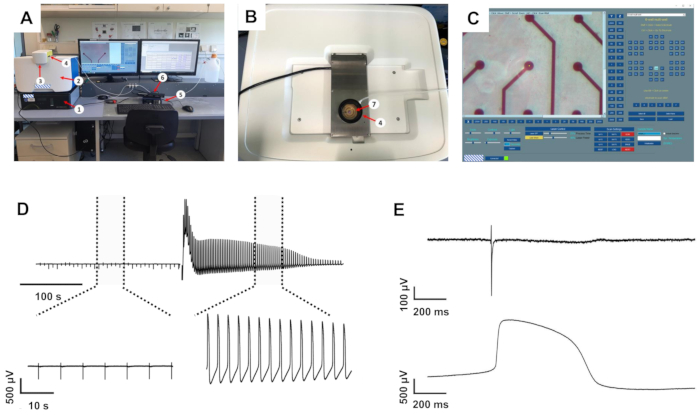
Abbildung 1: Der intrazelluläre Aufnahmeaufbau und beispielhafte Aufnahmen . (A) Setup-Übersicht. (B) Draufsicht des Aufnahmesystems mit offenem MEA-Aufnahmeverstärker. (C) Initialisierungssoftware mit der virtuellen MEA-Karte auf der rechten Seite. 1: Antivibrationstisch, 2: intrazelluläres Aufzeichnungssystem, 3: Laserschutzdeckel, 4: befeuchtete Carbogenkammer, 5: MEA-Heizsystem, 6: MEA-Schnittstellenkarte, 7: 1-Well-MEA-Chip im Aufnahmeverstärker. (D) Aufzeichnung von Beispielen von einer Elektrode vor und nach Induktion von liAPs. Oben: Aufnahme von ca. 6 min. Gepunktete Linien markieren die unten angezeigten erweiterten Bereiche. (E) Vergrößerte FP (oben) und liAP (unten). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
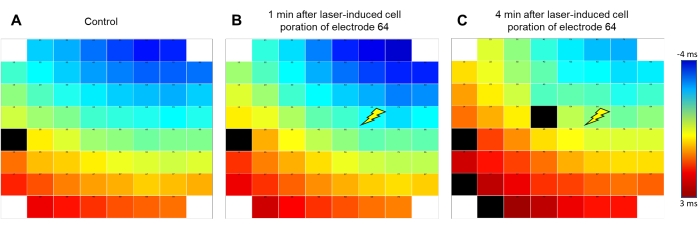
Abbildung 2: Das Signalausbreitungsmuster bleibt nach der liAP-Induktion erhalten. Falschfarbenkodierung der Signalausbreitung der Anregungswelle innerhalb des Synzytiums. Blau zeigt früh an (ab -4 ms); Rot zeigt späte Zeitpunkte (+3 ms) des an der Referenzelektrode E54 erhaltenen Signals an, wie durch den Farbbalken angezeigt. Das Signal wandert von rechts oben nach links unten des Elektrodenarrays. (A) Vor der liAP-Induktion, (B) 1 min nach der liAP-Induktion. (C) 4 min nach liAP-Induktion. Das Flash-Symbol zeigt den Laserinduktionspunkt an Elektrode 64 an. Beachten Sie, dass kein Unterschied in der Gesamtausbreitungsrichtung sichtbar ist. Schwarze Rechtecke zeigen ungültige Daten an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
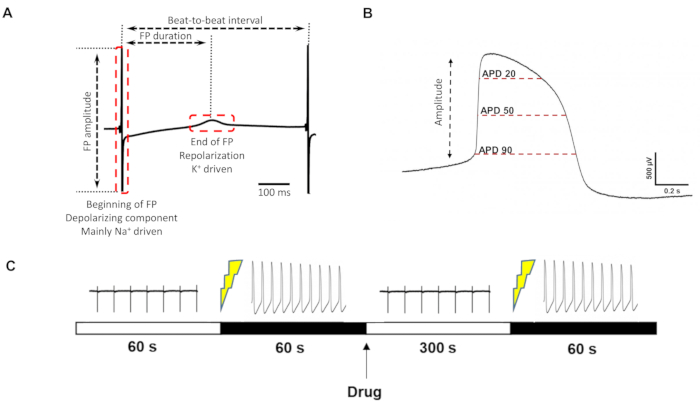
Abbildung 3: FP/liAP-Parameterdefinition und Aufzeichnungsprotokoll . (A) Parameter, die aus dem klassischen FP extrahiert werden können. (B) Zusätzliche Parameter, die von liAPs erhalten werden können. (C) Zeitplan der Drogenmessung. Von links nach rechts: Kontrollaufzeichnung für 60 s, Induktion von liAP, Aufzeichnung von liAP für 60 s, Arzneimittelanwendung, Waschzeit 300 s, Re-Induktion von liAP, Aufzeichnung von liAP für 60 s. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
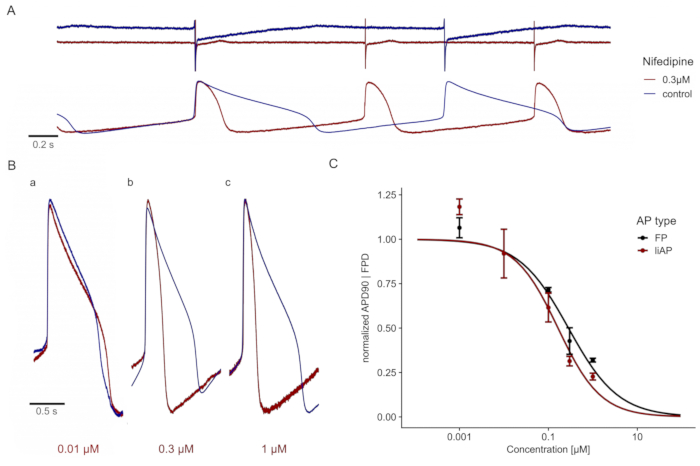
Abbildung 4: Nifedipin verkürzt die kardiale liAP konzentrationsabhängig. (A) Oben: FP-Spuren bei Kontrolle (blau) und in Gegenwart von 0,3 μM Nifedipin (rot). Leiterbahnen werden zur besseren Visualisierung mit einem Y-Achsen-Offset angezeigt. Unten: liAP-Spuren aus derselben MEA-Aufzeichnung, was zu einer Verkürzung des liAP in Kombination mit einer Erhöhung der Beat-Rate führt. (B) Überlagerung einzelner liAPs während der Kontrolle (blau) und Anwendung unterschiedlicher Nifedipinkonzentrationen (rot). a: 0,01 μM, b: 0,1 μM und c: 0,3 μM. Beachten Sie die Verkürzung der liAP-Dauer mit steigenden Konzentrationen. (C) Die Konzentrations-Wirkungs-Beziehung der Signalbreite aus FP- (schwarz) und liAP-Aufzeichnungen (rot). Die Daten stammen aus n = 3 Experimenten und werden zur Kontrolle normalisiert. Fehlerbalken geben den Standardfehler des Mittelwerts an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
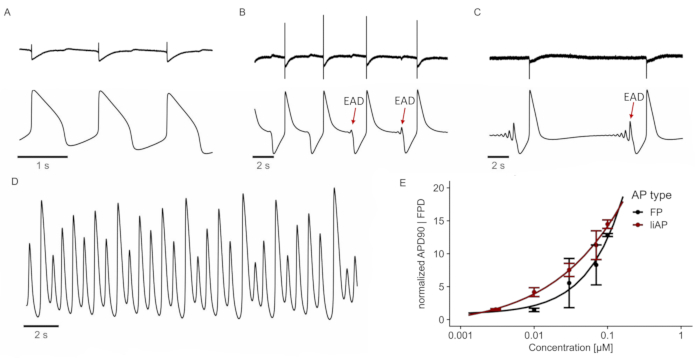
Abbildung 5: E4031 induziert (pro-) arrhythmisches Verhalten. (A) FP (oben) und liAP (unten) unter Kontrollbedingungen. (B-C) FPs und liAPs wurden zu unterschiedlichen Zeitpunkten nach Applikation von E4031 (0,1 μM) aufgezeichnet. Nach 80 s sind die ersten EADs am Ende des liAP sichtbar (B; markiert durch einen roten Pfeil). EADs wandeln sich nach 320 s in Gegenwart der Testverbindung (C) in ektopische Schläge um. (D) Nach 530 s tritt das Herzsynzytium in einen tachykarden Zustand ein. Spur dargestellt aus liAP-Aufzeichnung. (E) Konzentrations-Wirkungs-Verhältnis von FP (schwarz) und liAP (rot) Breite. Daten aus n = 4 Experimenten, normalisiert auf Kontrolle. Fehlerbalken geben den Standardfehler des Mittelwerts an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
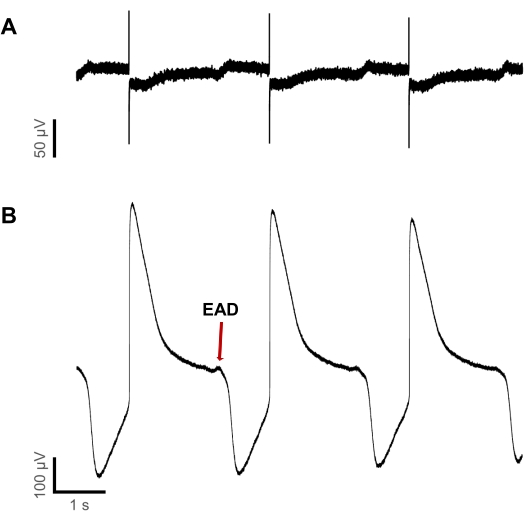
Abbildung 6: Die Detektion proarrhythmischer Ereignisse ist bei liAPs empfindlicher als bei FPs . (A) FP-Aufzeichnung und (B) liAP-Aufzeichnung innerhalb derselben Vertiefung während der Anwendung von 3 μM Dofetilid. Während EADs am Ende einiger liAPs nachweisbar sind, bleiben sie in FP-Aufzeichnungen unauffindbar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Diese innovative Methode zeigt einen neuen Weg, um in vitro die pharmakologische Modulation des kardialen Aktionspotentials während der Anwendung von kardioaktiven pharmakologischen Werkzeugverbindungen zu untersuchen.
Klassische MEA-Aufnahmen ermöglichen FP-Aufnahmen, die die Ableitung des kardialen AP14 sind. Diese indirekte Aufzeichnung verwickelt den zeitlichen Verlauf der De- und Repolarisation und eliminiert dadurch wesentliche Eigenschaften des AP. Obwohl die transzellulare Spannungsänderung eines AP typischerweise Werte von etwa 100 mV erreicht, bleibt die gesamte FP-Amplitude vergleichsweise niedrig, mit Spitzenamplituden zwischen mehreren 100 μV und niedrigen einstelligen mV-Werten. Aufgrund des Aufnahmeprinzips ist die Repolarisationsphase klein; In vielen Fällen ist es nur nachweisbar und oft von unklarer Form, was es schwierig macht, das Ende des RP zu definieren. Die Öffnung der Zellmembran ermöglicht uns den Zugang zur intrazellulären Spannung und deckt so den zeitlichen Verlauf des Herz-AP auf. Es gibt mehrere Vorteile dieser Aufnahmemethode im Vergleich zu FP-Aufnahmen. Erstens ist die Signalamplitude stärker ausgeprägt und bietet ein überlegenes Signal-Rausch-Verhältnis. Zweitens führt die Wellenform zu einer besseren Detektion der Repolarisation. Drittens trägt die Form der Repolarisationsphase Einblicke in die Wirkungsweise der Testverbindung bei, die durch die Steilheit der Signalrelaxation bereitgestellt wird. Und schließlich bietet diese Methode eine verbesserte Empfindlichkeit zum Nachweis kritischer unerwünschter Arzneimittelwirkungen, wie das in Abbildung 6 gezeigte Aufzeichnungsbeispiel für das Auftreten von EADs in der liAP, aber nicht in der FP zeigt.
Bisher gibt es zwei Möglichkeiten, Zugang zum intrazellulären AP zu erhalten. Die erste wird durch Elektroporation26,27 erreicht. Hier können kurze und starke Spannungsimpulse, die über die Aufzeichnungselektroden angelegt werden, die Zellmembran28 öffnen. Die zweite Möglichkeit ist die Membranöffnung über einen Laserpuls, wobei ein physikalisches Phänomen namens Oberflächenplasmonenresonanz genutzt wird, wie hier gezeigt. Einer der Vorteile gegenüber der Elektroporation ist die erhöhte Wahrscheinlichkeit aufeinanderfolgender Öffnungen. Durch den stark fokussierten Laserspot (1-3 μm) ist dieser Effekt sehr lokal auf die interessierende Elektrode beschränkt. Interessanterweise änderte die Initiierung des liAP nichts an der Signalausbreitung des kultivierten Synzytiums. Dies deutet darauf hin, dass, obwohl die Zellintegrität beschädigt ist, die Kardiomyozyten nicht über das Loch in der Membran zu depolarisieren scheinen.
Es gibt Einschränkungen für diese Methode. Wie bei der Elektroporation hält die Membranöffnung in den meisten Fällen nicht über den gesamten Versuchsverlauf. Die minimalen Leistungs- und Dauereinstellungen des Laserpulses, die für eine stabile Öffnung des jeweiligen Zelltyps erforderlich sind, müssen vor den Experimenten unabhängig voneinander definiert werden. Wir fanden (nicht gezeigt), dass die Parameter zwischen verschiedenen Zelltypen (in unserem Fall mehreren hiPS-abgeleiteten und primären Kardiomyozyten) drastisch variieren. Dies vermeidet unnötige Belastungen der Zellen während des Verbindungstestexperiments und führt zu zuverlässigeren und reproduzierbaren Daten. Es ist von entscheidender Bedeutung, die z-Achse anzupassen, um einen klaren Fokus auf die Zellen und die Elektroden zu erhalten. Ein unfokussiertes Kamerabild ergibt einen Laserspot, der sich auf einem suboptimalen Niveau befindet, was möglicherweise dazu führt, dass die Zellmembran nicht geöffnet werden kann. Selbst bei am besten eingestellten Parametern ist der liAP-Effekt transient und die Amplitude nimmt mit der Zeit ab. Darüber hinaus variiert der Zugang zum intrazellulären Raum der Zellen zwischen liAP-Induktionen, sowohl innerhalb aufeinanderfolgender Öffnungen an derselben Elektrode als auch zwischen Elektroden. Dies führt zu einer hohen Variabilität der liAP-Amplitude. Der Grund ist noch nicht vollständig geklärt. Mögliche Erklärungen sind mechanische Probleme wie eine Drift des Laserfokus oder eine unterschiedliche subzelluläre Lokalisation der Membranöffnung. Dies macht die Analyse von Amplitudeneffekten von Testverbindungen zu diesem Zeitpunkt kompliziert. Außerdem erfordert die Aufzeichnung der elektrischen Aktivität durch ein MEA-System eine Hochpassfilterung, um die unvermeidbare Basisliniendrift zu kompensieren. Obwohl in dem hier verwendeten System diese Filterung auf 0,1 Hz eingestellt war (die niedrigste verfügbare Filtereinstellung für dieses System), waren Filtereffekte während der Plateauphase immer noch sichtbar, was zu einem langsamen Trend der Spannungsablenkung zur Basislinie während der Plateauphase des kardialen AP führte. Besonders problematisch ist dies bei ausgedehnt langen zugrunde liegenden APs wie den hier verwendeten iCell-abgeleiteten iCell-Kardiomyozyten2 , die unter Kontrollbedingungen bereits AP >700 ms erzeugen. Die Verwendung von Systemen mit geringerer Filterung kann die Form des AP besser erhalten und einen noch besseren Zugriff auf den Zeitverlauf der Repolarisationsphase ermöglichen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Autoren danken Foresee Biosystems für die Ausleihe des IntraCell-Systems während der Studien. Sie möchten auch Hae In Chang für die technische Unterstützung danken. Diese Arbeit wurde aus dem Forschungs- und Innovationsprogramm Horizon 2020 der Europäischen Union im Rahmen der Finanzhilfevereinbarung Nr. 964518 (ToxFree), aus dem EU-Programm Horizon Europe European Innovation Council, Projekt SiMulTox (Fördervereinbarung Nr. 101057769) und aus dem Ministerium für Wirtschaft, Arbeit und Tourismus Baden-Württemberg gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 well MEA chip | Multi Channel Systems MCS GmbH | 890301 | |
| 6 well MEA chip | Multi Channel Systems MCS GmbH | 7600069 | |
| DMSO | Merck KGaA | 20-139 Sigma-Aldrich | solvent for drugs |
| Dofetilide | ALOMONE LABS ISRAEL HEADQUARTERS | D-100 | Drug-Measurement |
| dPBS | Fisher Scientific GmbH | 12037539 | Coating |
| E4031 | ALOMONE LABS ISRAEL HEADQUARTERS | E-500 | Drug-Measurement |
| Falcon | Fisher Scientific GmbH | 10788561 | |
| FB Alps version 0.5.005 | Foresee Biosystems | ||
| Fibronectin | Merck KGaA | 11051407001 | Coating |
| iCell cardiomyocytes | FUJIFILM Cellular Dynamics, Inc. (FCDI) | C1016 | |
| IntraCell | Foresee Biosystems | ||
| IntraCell | Foresee Biosystems | ||
| Isopropanol | Carl Roth GmbH + Co. KG | CN09.1 | For cleaning of MEA contact pads |
| Maintenance Medium | FUJIFILM Cellular Dynamics, Inc. (FCDI) | #M1003 | For cell-culture |
| MC_Data Tool | Multi Channel Systems MCS GmbH | Data export | |
| MC_Rack | Multi Channel Systems MCS GmbH | MEA recording | |
| MEA 2100 - 2x60 - system | Multi Channel Systems MCS GmbH | 890485 | For MEA-recordings |
| Nifedipine | Merck KGaA | N7634 Sigma-Aldrich | Drug-Measurement |
| Plating Medium | FUJIFILM Cellular Dynamics, Inc. (FCDI) | M1001 | For cell-culture |
| Tergazyme | VWR International, LLC | 1304-1 | cleaning of MEAs |
Referenzen
- Shah, M., Akar, F. G., Tomaselli, G. F. Molecular basis of arrhythmias. Circulation. 112 (16), 2517-2529 (2005).
- Bowlby, M. R., Peri, R., Zhang, H., Dunlop, J. hERG (KCNH2 or Kv11.1) K+ channels: screening for cardiac arrhythmia risk. Current Drug Metabolism. 9 (9), 965-970 (2008).
- Priest, B. T., Bell, I. M., Garcia, M. L. Role of hERG potassium channel assays in drug development. Channels (Austin). 2 (2), 87-93 (2008).
- Fenton, F., Cherry, E., Glass, L. Cardiac arrhythmia. Scholarpedia. 3 (7), 1665 (2008).
- Tisdale, J. E., et al. Drug-induced arrhythmias: A scientific statement from the American Heart Association. Circulation. 142 (15), 214-233 (2020).
- Kramer, J., et al. MICE models: superior to the HERG model in predicting Torsade de Pointes. Scientific Reports. 3, 2100 (2013).
- Rampe, D., Roy, M. -. L., Dennis, A., Brown, A. M. A mechanism for the proarrhythmic effects of cisapride (Propulsid): high affinity blockade of the human cardiac potassium channel HERG. FEBS Letters. 417 (1), 28-32 (1997).
- Girouard, S. D., Laurita, K. R., Rosenbaum, D. S. Unique properties of cardiac action potentials recorded with voltage-sensitive dyes. Journal of Cardiovascular Electrophysiology. 7 (11), 1024-1038 (1996).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Hou, J. H., Kralj, J. M., Douglass, A. D., Engert, F., Cohen, A. E. Simultaneous mapping of membrane voltage and calcium in zebrafish heart in vivo reveals chamber-specific developmental transitions in ionic currents. Frontiers in Physiology. 5, 344 (2014).
- Ronzhina, M., et al. Di-4-ANEPPS modulates electrical activity and progress of myocardial ischemia in rabbit isolated heart. Frontiers in Physiology. 12, 1-15 (2021).
- Beck, C., Gong, Y. A high-speed, bright, red fluorescent voltage sensor to detect neural activity. Scientific Reports. 9 (1), 15878 (2019).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Kovacs, G. T. A. Electronic sensors with living cellular components. Proceedings of the IEEE. 91 (6), 915-929 (2003).
- Tertoolen, L. G. J., Braam, S. R., van Meer, B. J., Passier, R., Mummery, C. L. Interpretation of field potentials measured on a multi electrode array in pharmacological toxicity screening on primary and human pluripotent stem cell-derived cardiomyocytes. Biochemical and Biophysical Research Communication. 497 (4), 1135-1141 (2018).
- Deo, M., Akwaboah, A., Tsevi, B., Treat, J. A., Cordeiro, J. M. Role of the rapid delayed rectifier K+ current in human induced pluripotent stem cells derived cardiomyocytes. Archives of Stem Cell and Therapy. 1 (1), 14-18 (2020).
- Hondeghem, L. M., Hoffmann, P. Blinded test in isolated female rabbit heart reliably identifies action potential duration prolongation and proarrhythmic drugs: importance of triangulation, reverse use dependence, and instability. Journal of Cardiovascular Pharmacology. 41 (1), 14-24 (2003).
- Dipalo, M., et al. Intracellular action potential recordings from cardiomyocytes by ultrafast pulsed laser irradiation of fuzzy graphene microelectrodes. Science Advances. 7 (15), (2021).
- . R: A language and environment for statistical computing: R Foundation for Statistical Computing Available from: https://www.r-project.org/ (2021)
- Wickham, H. . ggplot2: Elegant graphics for data analysis. , (2009).
- . tidyr: Tidy messy data: R package version 1.2.0 Available from: https://tidyr.tidyverse.org (2022)
- . dplyr: A grammar of data manipulation. R package version 1.0.6 Available from: https://tidyr.tidyverse.org (2021)
- Godfraind, T. Discovery and development of calcium channel blockers. Frontiers in Pharmacology. 8, 286 (2017).
- Vater, W., et al. Pharmacology of 4-(2'-nitrophenyl)-2,6-dimethyl-1,4-dihydropyridine-3,5-dicarboxylic acid dimethyl ester (Nifedipine, BAY a 1040). Arzneimittelforschung. 22 (1), 1-14 (1972).
- Kim, I., Boyle, K. M., Carroll, J. L. Postnatal development of E-4031-sensitive potassium current in rat carotid chemoreceptor cells. Journal of Applied Physiology. 98 (4), 1469-1477 (2005).
- Edwards, S. L., et al. A multiwell cardiac µGMEA platform for action potential recordings from human iPSC-derived cardiomyocyte constructs. Stem Cell Reports. 11 (2), 522-536 (2018).
- Fendyur, A., Spira, M. E. Toward on-chip, in-cell recordings from cultured cardiomyocytes by arrays of gold mushroom-shaped microelectrodes. Frontiers in Neuroengineering. 5, 21 (2012).
- Hayes, H. B., et al. Novel method for action potential measurements from intact cardiac monolayers with multiwell microelectrode array technology. Scientific Reports. 9 (1), 11893 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten