Method Article
Misurazioni simili al potenziale d'azione indotte dal laser di cardiomiociti su array di microelettrodi per una maggiore predittività della farmacologia di sicurezza
In questo articolo
Riepilogo
La combinazione di porzioni laser e array di microelettrodi (MEA) consente registrazioni simili a potenziali d'azione di cardiomiociti primari e derivati da cellule staminali coltivati. La forma d'onda fornisce una visione superiore della modalità d'azione dei composti di prova rispetto alle registrazioni standard. Collega patch-clamp e lettura MEA per ottimizzare ulteriormente la ricerca sulla sicurezza cardio in futuro.
Abstract
L'aritmia cardiaca indotta da farmaci pericolosa per la vita è spesso preceduta da potenziali d'azione cardiaci prolungati (AP), comunemente accompagnati da piccole fluttuazioni del potenziale proaritmico della membrana. La forma e il decorso temporale della frazione ripolarizzante dell'AP possono essere fondamentali per la presenza o l'assenza di aritmia.
Gli array di microelettrodi (MEA) consentono un facile accesso agli effetti dei composti cardiotossici tramite potenziali di campo extracellulare (FP). Sebbene sia uno strumento potente e consolidato nella ricerca e nella farmacologia della sicurezza cardiaca, la forma d'onda FP non consente di dedurre la forma AP originale a causa del principio di registrazione extracellulare e del conseguente filtraggio intrinseco a corrente alternata (AC).
Un nuovo dispositivo, descritto qui, può aprire ripetutamente la membrana dei cardiomiociti coltivati sopra gli elettrodi MEA in più punti temporali di coltivazione, utilizzando un raggio laser nanosecondo altamente focalizzato. La porzione laser consente di trasformare il segnale elettrofisiologico da FP ad AP intracellulari (AP indotto dal laser, liAP) e consente la registrazione delle deflessioni di tensione transcellulari. Questo accesso intracellulare consente una migliore descrizione della forma AP e una classificazione migliore e più sensibile dei potenziali proaritmici rispetto alle normali registrazioni MEA. Questo sistema è un'estensione rivoluzionaria dei metodi elettrofisiologici esistenti, consentendo una valutazione accurata dell'effetto cardiotossico con tutti i vantaggi delle registrazioni basate su MEA (esperimenti facili, acuti e cronici, analisi della propagazione del segnale, ecc.).
Introduzione
Il contributo elettrico di un battito cardiaco deriva da un'interazione complessa e precisamente temporizzata di molti canali cardiaci e trasportatori, nonché dalla propagazione sintonizzata con precisione dei segnali elettrici attraverso il miocardio1. L'alterazione di questi meccanismi strettamente coordinati (ad esempio, l'uso di droghe) può comportare gravi conseguenze per la funzione del cuore (cioè aritmia pericolosa per la vita)2,3. Le aritmie sono definite come battiti cardiaci irregolari che alterano il normale ritmo del cuore, che può avere conseguenze potenzialmente letali. Possono essere causati da un inizio alterato di un'ondata di eccitazione cardiaca o da una propagazione anormale dell'eccitazione cardiaca4, che a sua volta si traduce in una disfunzione del meccanismo di pompaggio del cuore.
Molti candidati farmaci altamente potenti devono essere esclusi da ulteriori indagini durante la fase iniziale di sviluppo del farmaco a causa del loro potenziale (pro-) aritmico 2,3. Modulano i canali cardiaci chiave (ad esempio, il canale genico umano correlato all'etere [hERG]) che sono responsabili della normale formazione e cessazione del potenziale d'azione cardiaco, nonché della successiva propagazionedel segnale 5.
Le aziende farmaceutiche utilizzano abitualmente misurazioni patch-clamp o array di microelettrodi (MEA) per studiare potenziali effetti cardiotossici fuori bersaglio indotti da farmaci candidati. Le registrazioni patch-clamp permettono di decifrare l'impatto delle sostanze sui canali ionici cardiaci e di analizzare il potenziale d'azione cardiaco transcellulare con alta risoluzione spazio-temporale 6,7. Tuttavia, gli svantaggi di questa tecnica includono una bassa produttività con patch-clamp manuale e una limitata applicabilità dell'automazione a causa della dipendenza di questo metodo dalle celle in sospensione. Inoltre, gli effetti cronici non possono essere studiati a causa dell'invasività del metodo. Infine, in genere solo le singole cellule vengono studiate simultaneamente piuttosto che l'intero sincizio cardiaco, rendendo impossibile indirizzare le informazioni sulla propagazione del segnale.
I coloranti sensibili alla tensione sono preziosi per studiare in modo non invasivo i potenziali d'azione cardiaci e le aritmie indotte da farmaci8. Consentono lo studio sia dell'attività a singola cellula che del sincizio. Gli svantaggi di questo metodo sono gli effetti citotossici dei coloranti di per sé o del prodotto di reazione durante l'illuminazione. Sono utilizzati per esperimenti acuti e sono difficilmente applicabili per studi a lungo termine 9,10,11. Le proteine sensibili alla tensione come alternative hanno compiuto progressi significativi negli ultimi due anni in termini di usabilità e sensibilità, ma richiedono la modificazione genetica delle cellule di interesse e mancano di un'elevata risoluzione temporale rispetto alle tecniche elettrofisiologiche12.
Le informazioni tratte dalla più recente iniziativa13 del CiPA affermano che i MEA sono ampiamente utilizzati negli screening di sicurezza cardiaca come approccio elettrofisiologico alternativo in quanto rappresentano uno strumento potente e consolidato per studiare la funzione cardiaca e la farmacologia di sicurezza. I cardiomiociti sono coltivati come sincizio direttamente sopra i chip e i potenziali di campo extracellulare (FP) vengono registrati in modo non invasivo tramite microelettrodi integrati nel substrato. Questo principio di registrazione consente di condurre screening a produttività aumentata per diversi giorni, il che li rende adatti per la ricerca farmaceutica sugli effetti cronici. La forma d'onda FP risultante è un derivato dell'AP14 intracellulare. Parametri come la frequenza di battimento, l'ampiezza della parte iniziale dell'FP e la durata dell'FP sono facilmente accessibili15. Altri criteri essenziali come la differenziazione tra prolungamento e triangolazione della FP (un importante marker di proaritmia16,17) sono inaccessibili a causa dell'effetto filtrante AC della tecnica. Inoltre, il rilevamento di altri piccoli eventi proaritmici come le postdepolarizzazioni precoci e ritardate (EAD e DAD, rispettivamente) sono spesso facilmente trascurati a causa della loro piccola ampiezza.
Qui descriviamo un metodo per ottenere l'accesso al potenziale della membrana intracellulare aprendo la membrana dei cardiomiociti. Il dispositivo IntraCell (di seguito denominato dispositivo di registrazione intracellulare) consente aperture ripetute di membrana di cardiomiociti coltivati sopra gli elettrodi MEA utilizzando un raggio laser nanosecondo altamente focalizzato attraverso uno specifico fenomeno fisico (risonanza plasmonica superficiale)18. Di conseguenza, la registrazione passa da un normale FP a un AP intracellulare (AP indotto dal laser, liAP). Il protocollo mostra come ciò consenta di accedere agli aspetti cinetici della forma d'onda che non possono essere facilmente catturati analizzando gli FP. Questo metodo rappresenta un ponte tra le tradizionali registrazioni intracellulari di patch-clamp e MEA. La tecnologia è quindi una potente estensione degli attuali metodi di valutazione della sicurezza cardiaca.
Protocollo
1. Preparazione indotta di cardiomiociti derivati da cellule staminali pluripotenti
NOTA: I cardiomiociti iCell2 (indicati come cardiomiociti derivati da cellule staminali pluripotenti indotte [iPSCs]) sono stati preparati secondo il protocollo fornito dal fornitore. Il protocollo sarà brevemente riassunto nella sezione seguente.
- Scongelamento e mezzo di manutenzione a 4 °C per 24 ore prima dell'uso.
- Preparare il rivestimento di fibronectina sciogliendo la fibronectina sterile in acqua sterile ad una concentrazione di 1 mg/ml. Congelare conservare questo materiale in aliquote (ad esempio, 25 μL per aliquota). Diluire la soluzione madre aliquotata 1:20 nella soluzione salina bilanciata sterile di Dulbecco (dPBS).
- Rivestire i campi degli elettrodi dei MEA precedentemente autoclavati sotto la cappa a flusso laminare, goccioline in condizioni sterili con fibronectina utilizzando una pipetta da 10 μL. Per questo, far cadere 5 μL della soluzione di rivestimento di fibronectina sui campi degli elettrodi e osservare la formazione di una goccia sulla parte superiore dell'area dell'elettrodo. Assicurarsi di non toccare gli elettrodi sensibili.
NOTA: Per mantenere condizioni sterili, trasferire il chip MEA in una capsula di Petri sterile prima di rimuoverlo dalla cappa a flusso laminare. - Incubare i MEA rivestiti per 1 ora a 37 °C preferibilmente in un incubatore.
- Scongelare il crioviale contenente i cardiomiociti a bagnomaria a circa 37 °C per 2 minuti fino a quando non rimane solo un piccolo cristallo di ghiaccio. Trasferire delicatamente la soluzione cellulare in un tubo da 50 ml.
- Aggiungere 1 mL di terreno di placcatura al crioviale vuoto. Trasferire la soluzione goccia per un periodo di tempo di 90 s nel tubo da 50 mL per ridurre lo shock osmotico. Aggiungere delicatamente altri 8 ml di terreno di placcatura nel tubo.
- Mescolare accuratamente la sospensione cellulare utilizzando una pipetta da 10 ml. Calcolare il numero totale di cellule vitali utilizzando la citometria a fluorescenza automatizzata. Il numero deve essere vicino al numero nella scheda tecnica fornita dal produttore.
- Centrifugare la soluzione cellulare per 3 minuti a 200 x g a temperatura ambiente. Rimuovere il surnatante mediante aspirazione utilizzando una pipetta di vetro collegata a un sistema di pompaggio. Regolare il numero di cellule tra 6.000 e 15.000 cellule vitali / μL.
NOTA: Il numero di celle è solitamente compreso nell'intervallo sopra indicato, ma può variare a seconda del rispettivo fornitore. - Rimuovere la soluzione di rivestimento applicata al punto 1.3 dall'area dell'elettrodo MEA utilizzando una pipetta da 10 μL direttamente prima della semina cellulare. Seminare le cellule immediatamente dopo la rimozione per evitare l'essiccazione del rivestimento. Per questo, seminare le cellule a goccia a 4 μL sia per MEA a 6 pozzetti che per MEA a 1 pozzetto sui campi degli elettrodi nello stesso modo in cui è stato fatto con il rivestimento.
- Lasciare che le celle aderiscano per 1 ora nell'incubatore a 37 °C e al 5% di CO2 prima di riempire i pozzetti con il mezzo di placcatura sterile riscaldato a circa 37 °C a 200 μL per MEA a 6 pozzetti e 1 mL per MEA a pozzetto singolo sotto la cappa a flusso laminare.
- Eseguire un cambio completo del fluido 48 ore dopo la placcatura sotto la cappa a flusso laminare. Per questo, rimuovere il mezzo di placcatura mediante aspirazione utilizzando una pipetta di vetro collegata a un sistema di pompaggio. Quindi, aggiungere 200 μL di mezzo di mantenimento sterile riscaldato a 37 °C nei pozzetti.
- Esegui cambi completi del mezzo a giorni alterni.
- Inizia a misurare le cellule 5-8 giorni dopo lo scongelamento. Eseguire un cambio completo del mezzo 2 ore prima di iniziare gli esperimenti.
2. Registrazioni MEA
NOTA: Il dispositivo utilizzato per trasformare il segnale FP in liAP è costituito da un microscopio verticale e da un laser a 1064 nm.
- Posizionare il sistema MEA sulla parte superiore del dispositivo con il supporto del chip MEA centrato sul foro dell'obiettivo. Posizionare la configurazione MEA in modo che l'obiettivo sia direttamente sotto il foro del sistema MEA per consentire al laser di concentrarsi sugli elettrodi.
- Trasferire il chip MEA con le cellule coltivate dall'incubatore alla configurazione MEA 15 minuti prima della registrazione, consentendo alle cellule di riprendersi dal disturbo meccanico.
- Pulire accuratamente i cuscinetti di contatto e i perni utilizzando isopropanolo e un batuffolo di cotone per ridurre i livelli di rumore. Posizionare il MEA con attenzione nella configurazione MEA. Posizionare il chip MEA con il logo in basso sul lato superiore sinistro (6-well MEA) o con l'elettrodo di riferimento a sinistra (single-well MEA).
- Impostare il riscaldamento integrato nel sistema MEA a 38 °C. Posizionare una piccola camera sopra il chip MEA per perfondere costantemente le celle con carbogeno umidificato (5% CO 2 e 95% O2) per ricreare le condizioni dell'incubatore e prevenire l'evaporazione.
- Chiudere il coperchio del dispositivo. L'interruttore di sicurezza integrato consente di attivare il laser solo se il coperchio è chiuso sul chip MEA. Impostare il filtro di sistema MEA utilizzando il programma di configurazione MEA su 0,1 Hz o meno passa-alto e 3.500 Hz passa-basso.
- Utilizzare il software MC_Rack (software di registrazione) o qualsiasi software alternativo per la registrazione. Regolare l'intervallo di ingresso in base alle proprie esigenze assicurandosi che il segnale non saturi l'amplificatore e la frequenza di campionamento (ad esempio, 20 kHz). Utilizzare la funzione di visualizzazione a lungo termine del software per controllare la registrazione.
3. Porzione cellulare indotta dal laser
- Dopo aver inserito il chip MEA nella configurazione MEA e impostato il software, inizializzare la meccanica laser utilizzando il software FB Alps (software di inizializzazione).
- Innanzitutto, fai clic sul pulsante Inizializzazione . Al termine dell'inizializzazione, il punto laser virtuale sarà nel pozzo D per un MEA a 6 pozzetti e in basso a sinistra per un MEA a pozzetto singolo, rispettivamente.
- Spostare il punto laser virtuale con Ctrl + clic del mouse al centro dell'elettrodo D5 e regolare la messa a fuoco. Regola la messa a fuoco Ctrl + scorrimento con la rotellina del mouse.
- Premere il pulsante Set P1. Il punto laser virtuale si sposterà automaticamente nel pozzo F. Ripetere il processo con l'elettrodo F5 e selezionare Set P2.
- Dopo questa procedura, il punto laser si sposterà nel pozzo B. Ripetere lo stesso processo con l'elettrodo B5 e premere Set P3 nel software. Il sistema è ora allineato.
- Regola la potenza del laser e il tempo di elaborazione in base alle esigenze delle tue cellule. Qui sono stati utilizzati il 40% di potenza e il 25% di tempo di processo.
- Per abilitare il laser, fare clic sul pulsante Laser Off , che apparirà quindi come laser on. Passare al software di registrazione, scegliere un nome file e fare clic sul pulsante Registrazione rossa seguito dal pulsante Riproduci nella parte superiore della finestra per registrare la misurazione.
- Registrare una linea di base di 60 s prima di aprire le celle con il laser. Tornare al software di inizializzazione.
- Disattiva gli elettrodi per essere esclusi dal laser sulla mappa virtuale sul lato destro usando Ctrl + clic del mouse. Selezionare gli elettrodi di interesse attivandoli sulla rappresentazione dell'array sul lato destro della finestra del software.
- Per avviare il laser, utilizzare Alt + clic del mouse e selezionare l'elettrodo centrale di questo pozzetto. Questo avvia il laser per aprire automaticamente le celle su ciascun elettrodo di questo pozzo. Ripeti per ogni pozzetto. Il laser aprirà quindi automaticamente tutti gli elettrodi precedentemente attivati del pozzetto selezionato.
4. Manipolazione e applicazione dei farmaci
- Preparare tutte le sostanze da utilizzare per i test antidroga appena il giorno delle misurazioni. Assicurarsi che la concentrazione finale di applicazione sia 10 volte superiore nel mezzo per effettuare una diluizione 1:10 nei pozzetti.
- Sciogliere Nifedipina, E4031 e Dofetilide prima in DMSO in concentrazione mM, e poi ulteriormente in mezzo a 10x della concentrazione desiderata. Non superare mai una concentrazione finale di DMSO dello 0,1% nel pozzo.
- Registrare l'attività di base per 60 s. Avviare la porzione indotta dal laser come descritto al punto 3 del protocollo, con conseguente trasformazione dell'FP in forma liAP.
- Applicare tutti i farmaci come concentrazione singola per pozzetto. Rimuovere 20 μL di mezzo per pozzetto per MEA a 6 pozzetti e 100 μL per MEA a pozzetto singolo, rispettivamente. Aggiungere 20 μL o 100 μL, a seconda del tipo di MEA, della soluzione madre del farmaco da misurare nel pozzetto e pipettare accuratamente su e giù 2-3 volte. Eseguire almeno tre repliche di ciascun farmaco e concentrazione per ottenere rilevanza statistica.
- Lasciare lavare i composti per 300 s. Durante questo periodo, la forma liAP può trasformarsi nuovamente in forma FP. Ancora una volta, indurre la porzione indotta dal laser e registrare i possibili effetti indotti dal composto sul liAP per ulteriori 60 s.
5. Esportazione dei dati
- Selezionare gli elettrodi pertinenti riproducendo la registrazione nel software di registrazione. Utilizzare MC_DataTool per convertire i file MC_Rack in file ASCII .txt.
- Fare clic su File > Apri MCD > Seleziona un file MC_Rack. Fare clic sul pulsante txt (testo blu).
- Selezionare un elettrodo. L'elettrodo selezionato verrà mostrato nell'elenco sul lato destro.
- Fare clic su Sfoglia per selezionare la cartella e modificare il nome del nuovo file .txt. Clicca su Salva.
- Deselezionate l'elettrodo esportato e selezionate l'elettrodo successivo da esportare. Ripetere la procedura per tutti gli elettrodi di interesse.
6. Trattamento dei dati e analisi statistiche
- Importare tracce binarie convertite in R19. Visualizza / analizza i dati utilizzando script personalizzati contenenti i seguenti pacchetti: dplyr, tidyr e ggplot220,21,22.
Risultati
Il sistema di registrazione utilizzato per registrare l'attività elettrica dei cardiomiociti coltivati consisteva in un sistema MEA standard dotato di un riscaldatore e di una camera per carbogeno collegata a un computer. Il sistema è stato posizionato sopra il dispositivo di registrazione intracellulare, che a sua volta è stato montato sopra una piccola unità antivibrante (Figura 1A-B).
I cardiomiociti 2 derivati da iPSC hanno iniziato a battere spontaneamente entro 2-3 giorni dallo scongelamento (giorni in vitro, DIV) ed erano visibili al microscopio. Dal DIV 4 in poi, la frequenza di battimento è diventata regolare e i potenziali di campo extracellulare (FP) con ampiezze picco-picco della componente depolarizzante tra 1 e 5 mV potevano essere rilevati sulla maggior parte degli elettrodi all'interno dei rispettivi pozzetti dei chip MEA. L'attività elettrica potrebbe essere rilevata in oltre il 95% dei pozzi in esame. Dal DIV 7 in poi, la probabilità di distacco cellulare è aumentata, rendendo impossibile un ulteriore utilizzo di questi pozzetti.
Il software per controllare l'apertura della membrana indotta dal laser consente di regolare sia la potenza che il tempo di processo del laser che media l'apertura della membrana cellulare solo sull'elettrodo in esame (Figura 1C), mentre altri elettrodi nel rispettivo pozzo non sono interessati. Mentre impostazioni troppo conservative non hanno cambiato la forma d'onda dell'FP, impostazioni troppo alte hanno provocato la lesione putativa dei cardiomiociti, indicata da battiti vigorosi ma transitori o perdita del segnale. Se regolato su un'impostazione del 40% di potenza e del 25% di tempo di processo ben tollerato dalle celle, l'attivazione dell'impulso laser ha comportato molteplici modifiche alla forma d'onda registrata (vedere la Figura 1D per una registrazione esemplare). In queste condizioni, nessuna alterazione del materiale dell'elettrodo è stata osservata macroscopicamente. L'ampiezza del segnale registrato è aumentata massicciamente di 4,1 ± 0,41 (n = 20, intervallo 1,34-8,83) volte, analizzata da un sottoinsieme di registrazioni scelte casualmente, risultando in ampiezze comprese tra 7 e 22 mV. Inoltre, la forma d'onda si è trasformata da una forma FP standard con deflessione di tensione rapida, bifasica e transitoria all'inizio, seguita da una fase di plateau indietro alla linea di base e una piccola deflessione che indica la fine dell'FP a una forma che era più vicina a un AP registrato intracellulare con un rapido aumento, una fase di plateau depolarizzata estesa e una fase di ripolarizzazione con un undershoot al di sotto della linea di base (Figura 1E ). Abbiamo definito queste deflessioni di tensione come AP indotto dal laser (liAP). Nella maggior parte dei casi, la transizione è stata transitoria e almeno parzialmente invertita entro 5 minuti. La propagazione del segnale all'interno del sincizio cardiaco è rimasta inalterata dopo l'induzione liAP (Figura 2), indicando che il sincizio rimanente non era influenzato dal potenziale danno dell'impulso laser.
Le somiglianze con gli AP registrati intracellulari hanno permesso di estrarre parametri del liAP che non sono accessibili ai FP (per parametri esemplari si veda ad es. Figura 3A), in particolare la misurazione della durata del liAP in punti temporali specifici (ad esempio, al 20%, 50% e 90%) (Figura 3B), analogamente agli APD20/50/90 comunemente usati per la descrizione degli AP.
Abbiamo poi testato la risposta dei cardiomiociti aperti al laser ai composti farmacologici cardioattivi comunemente usati. Un modello di protocollo esemplare può essere trovato nella Figura 3C. Poiché la trasformazione del liAP non è sempre persistita durante l'intero esperimento, l'applicazione del composto è stata eseguita come una singola concentrazione per pozzetto piuttosto che in modo cumulativo per ridurre il tempo di registrazione totale. Tuttavia, è stato necessario riaprire le celle o aprire un'altra area dell'elettrodo prima di applicare il composto in esame.
L'aggiunta del bloccante specifico dei canali Ca 2+ di tipo L, Nifedipina23,24, ha ridotto la fase di plateau del liAP in modo dipendente dalla concentrazione e quindi ha accorciato l'intero liAP (Figura 4A,B). Questo accorciamento era paragonabile all'analisi ottenuta da FP di cardiomiociti da elettrodi non manipolati (Figura 4C), indicando che questo metodo di registrazione non ha avuto effetti negativi rispetto alle registrazioni FP classiche.
E4031 inibisce la ripolarizzazione del canale25 del potassio Kv1.11 (hERG) e porta al comportamento aritmico dei cardiomiociti ad alte concentrazioni. Analogamente all'analisi ottenuta dalle registrazioni FP, E4031 ha aumentato la durata di liAP in modo dipendente dalla concentrazione (Figura 5). Inoltre, a concentrazioni di 0,01 μM e superiori, erano visibili piccole deflessioni di tensione positive alla fine del liAP. Queste deflessioni sono diventate più evidenti con concentrazioni più elevate, indicando una nuova depolarizzazione transitoria, a differenza degli FP, dove queste deflessioni erano praticamente invisibili (vedi Figura 5B-C, tracce superiori (FP) vs inferiori (liAP)). Questo comportamento è noto come post-depolarizzazione precoce (EAD). Alla massima concentrazione di 0,1 μM, questi EAD si sono intensificati nel tempo in battiti ectopici, che sono potenziali d'azione prematuri (Figura 5C). Sia l'EAD che i battiti ectopici sono indicatori chiave dell'attività proaritmica. Alla fine dell'esempio mostrato in Figura 5D, l'attività elettrica ha provocato un battito aritmico. Inoltre, le relazioni concentrazione-risposta visualizzate tra le registrazioni FP e liAP corrispondevano (Figura 5E). Tuttavia, vi è una variabilità più considerevole nei dati FP derivante dalla debole componente di ripolarizzazione dei FP a concentrazioni più elevate del composto in esame. Sembra essere la natura caratteristica dei cardiomiociti derivati da iPSC2 tendere a generare AP non fisiologicamente lunghi anche in condizioni di controllo (durate AP > 700 ms). Il sistema MEA ha applicato un filtraggio intrinseco a 0,1 Hz AC, che a sua volta ha prodotto una forma parzialmente filtrata del liAP, sebbene senza occludere le informazioni qualitative sull'inizio e la terminazione dell'AP sottostante.
Si è scoperto che il verificarsi iniziale di deflessioni di tensione proaritmiche poteva essere rilevato a concentrazioni inferiori nei liAP rispetto alle registrazioni FP. Nella figura 6 è mostrata la registrazione dell'attività elettrica durante l'applicazione di Dofetilide ad una concentrazione di 3 μM. La registrazione è stata ottenuta nello stesso pozzo. Sebbene sia FP che liAP mostrassero durate di circa 2 s, la forma d'onda FP era discreta, presentando regolari deflessioni ripolarizzanti. Allo stesso tempo, alla fine dei liAP, gli EAD di diverse grandezze sono diventati visibili. Questo aumento della sensibilità farmaco-di sicurezza supporta ulteriormente la scoperta che i liAP indotti dalla risonanza plasmonica di superficie consentono una migliore qualificazione della fase di ripolarizzazione e quindi aiutano a saperne di più sulla modalità d'azione dei composti in esame in esame.
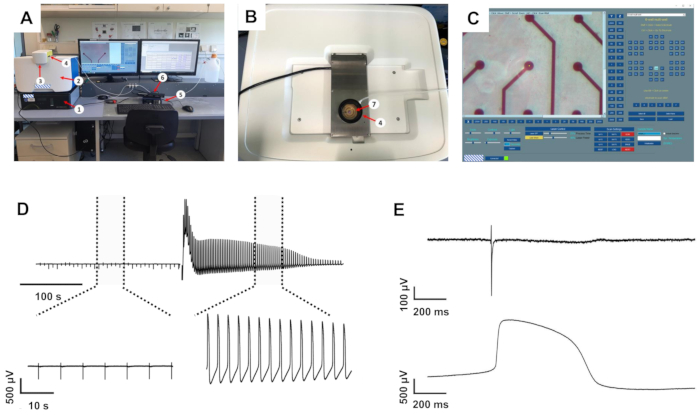
Figura 1: Configurazione della registrazione intracellulare e registrazioni esemplari . (A) Panoramica dell'installazione. (B) Vista dall'alto del sistema di registrazione con amplificatore di registrazione MEA aperto. (C) Software di inizializzazione con la mappa MEA virtuale sul lato destro. 1: tavolo antivibrante, 2: sistema di registrazione intracellulare, 3: coperchio di protezione laser, 4: camera di carbogen umidificata, 5: sistema di riscaldamento MEA, 6: scheda di interfaccia MEA, chip MEA 7: 1 pozzetto all'interno dell'amplificatore di registrazione. (D) Registrazione di esempi da un elettrodo prima e dopo l'induzione di liAP. In alto: registrazione di circa 6 min. Le linee tratteggiate segnano le aree espanse mostrate nella parte inferiore. (E) FP ingrandito (in alto) e liAP (in basso). Fare clic qui per visualizzare una versione ingrandita di questa figura.
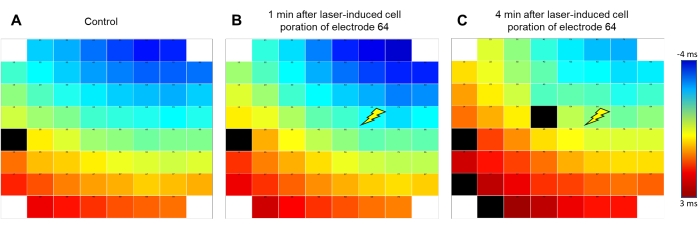
Figura 2: Il modello di propagazione del segnale rimane conservato dopo l'induzione liAP. Codifica a falsi colori della propagazione del segnale dell'onda di eccitazione all'interno del sincizio. Il blu indica presto (a partire da -4 ms); il rosso indica i punti temporali in ritardo (+3 ms) dal segnale ottenuto all'elettrodo di riferimento E54 come indicato dalla barra dei colori. Il segnale viaggia dall'alto a destra verso il basso a sinistra dell'array di elettrodi. (A) Prima dell'induzione liAP, (B) 1 minuto dopo l'induzione liAP. (C) 4 minuti dopo l'induzione liAP. Il simbolo Flash indica il punto di induzione laser all'elettrodo 64. Si noti che non è visibile alcuna differenza nella direzione di propagazione complessiva. I rettangoli neri indicano dati non validi. Fare clic qui per visualizzare una versione ingrandita di questa figura.
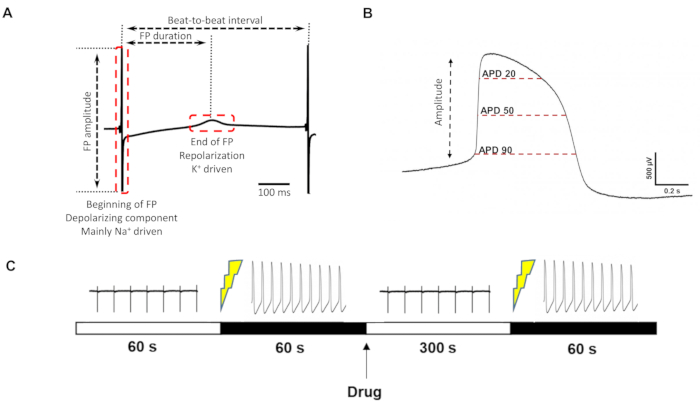
Figura 3: Definizione dei parametri FP/liAP e protocollo di registrazione . (A) Parametri che possono essere estratti dal FP classico. (B) Parametri aggiuntivi che possono essere ottenuti dai liAP. (C) Cronologia della misurazione del farmaco. Da sinistra a destra: registrazione di controllo per 60 s, induzione di liAP, registrazione di liAP per 60 s, applicazione del farmaco, tempo di lavaggio 300 s, reinduzione di liAP, registrazione di liAP per 60 s. Fare clic qui per visualizzare una versione ingrandita di questa figura.
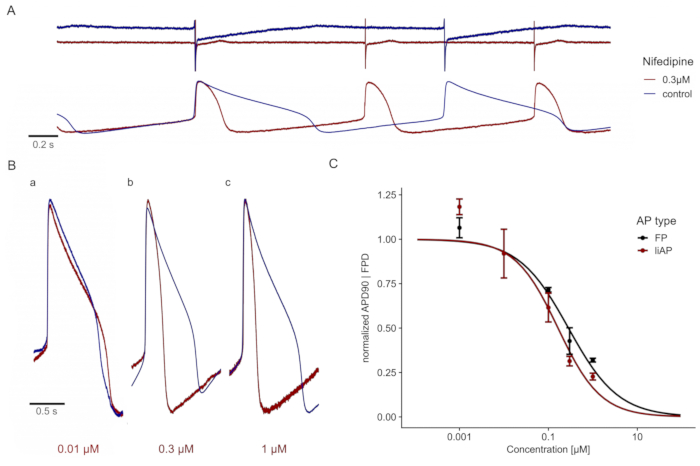
Figura 4: Nifedipina accorcia il liAP cardiaco in modo dipendente dalla concentrazione. (A) In alto: tracce di FP al controllo (blu) e in presenza di 0,3 μM di Nifedipina (rosso). Le tracce vengono visualizzate con un offset dell'asse y per una migliore visualizzazione. In basso: tracce liAP dalla stessa registrazione MEA, con conseguente accorciamento del liAP combinato con un aumento della frequenza di battitura. (B) Sovrapposizione di singoli liAP durante il controllo (blu) e applicazione di diverse concentrazioni di Nifedipina (rosso). a: 0,01 μM, b: 0,1 μM e c: 0,3 μM. Si noti l'accorciamento della durata del liAP con l'aumentare delle concentrazioni. (C) La relazione concentrazione-risposta dell'ampiezza del segnale ottenuta dalle registrazioni FP (nero) e liAP (rosso). I dati provengono da n = 3 esperimenti e normalizzati per il controllo. Le barre di errore indicano l'errore standard della media. Fare clic qui per visualizzare una versione ingrandita di questa figura.
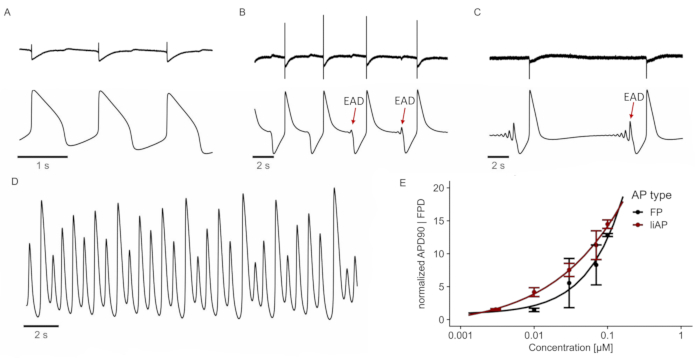
Figura 5: E4031 induce un comportamento (pro-) aritmico. (A) FP (in alto) e liAP (in basso) in condizioni di controllo. (B-C) FP e liAP sono stati registrati in diversi punti temporali dopo l'applicazione di E4031 (0,1 μM). Dopo 80 s, i primi EAD sono visibili alla fine del liAP (B; contrassegnati da una freccia rossa). Gli EAD si convertono in battiti ectopici dopo 320 s in presenza del composto in esame (C). (D) Dopo 530 s, il sincizio cardiaco entra in uno stato tachicardico. Traccia raffigurata dalla registrazione liAP. (E) Relazione concentrazione-risposta della larghezza FP (nero) e liAP (rosso). Dati da n = 4 esperimenti, normalizzati al controllo. Le barre di errore indicano l'errore standard della media. Fare clic qui per visualizzare una versione ingrandita di questa figura.
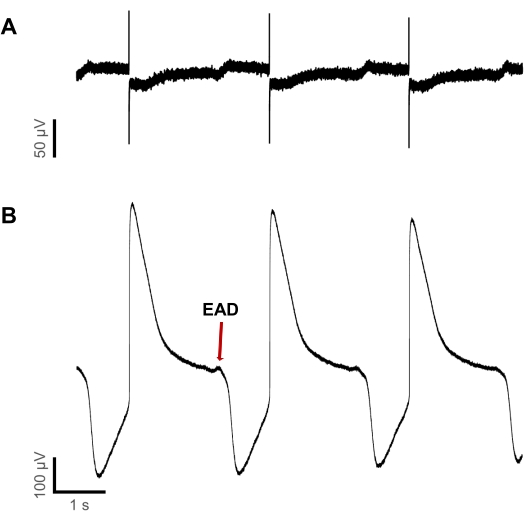
Figura 6: La rilevazione di eventi proaritmici è più sensibile nei liAP rispetto agli FP. (A) registrazione FP e (B) registrazione liAP all'interno dello stesso pozzetto durante l'applicazione di 3 μM Dofetilide. Mentre alla fine di alcuni liAP, gli EAD sono rilevabili, rimangono non rilevabili nelle registrazioni FP. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Questo metodo innovativo dimostra un nuovo modo di studiare in vitro la modulazione farmacologica del potenziale d'azione cardiaco durante l'applicazione di composti di strumenti farmacologici cardioattivi.
Le registrazioni MEA classiche consentono registrazioni FP, che sono il derivato dell'AP14 cardiaco. Questa registrazione indiretta coinvolge il corso temporale della de- e della ripolarizzazione ed elimina quindi le caratteristiche essenziali dell'AP. Inoltre, sebbene la variazione di tensione transcellulare di un AP raggiunga tipicamente valori di circa 100 mV, l'ampiezza complessiva del FP rimane relativamente bassa, con ampiezze di picco comprese tra diversi valori di 100 μV e bassi valori di mV a una cifra. A causa del principio di registrazione, la fase di ripolarizzazione è piccola; in molti casi, è semplicemente rilevabile e spesso di forma poco chiara, rendendo difficile definire la fine del FP. L'apertura della membrana cellulare ci consente di accedere alla tensione intracellulare, scoprendo così il decorso temporale dell'AP cardiaco. Ci sono molteplici vantaggi di questo metodo di registrazione rispetto alle registrazioni FP. In primo luogo, l'ampiezza del segnale è più prominente, fornendo un rapporto segnale-rumore superiore. In secondo luogo, la forma d'onda si traduce in una migliore rilevazione della ripolarizzazione. In terzo luogo, la forma della fase di ripolarizzazione fornisce informazioni sulla modalità di azione del composto di prova, fornita dalla pendenza del rilassamento del segnale. Infine, questo metodo offre una migliore sensibilità per rilevare effetti avversi critici del farmaco, dimostrata dall'esempio di registrazione visualizzato nella Figura 6 per la presenza di EAD nel liAP ma non nel FP.
Finora, ci sono due modi per ottenere l'accesso all'AP intracellulare. Il primo è ottenuto mediante elettroporazione26,27. Qui, impulsi di tensione brevi e forti applicati tramite gli elettrodi di registrazione possono aprire la membrana cellulare28. La seconda possibilità è l'apertura della membrana tramite un impulso laser, facendo uso di un fenomeno fisico chiamato risonanza plasmonica di superficie, come dimostrato qui. Uno dei vantaggi rispetto all'elettroporazione è la maggiore probabilità di aperture consecutive. A causa dello spot laser altamente focalizzato (1-3 μm) questo effetto è molto limitato localmente all'elettrodo di interesse. È interessante notare che l'inizio del liAP non ha alterato la propagazione del segnale del sincizio coltivato. Ciò indica che, sebbene l'integrità cellulare sia danneggiata, i cardiomiociti non sembrano depolarizzare attraverso il foro nella membrana.
Ci sono limitazioni a questo metodo. Come con l'elettroporazione, l'apertura della membrana, nella maggior parte dei casi, non dura per l'intero corso sperimentale. Le impostazioni minime di potenza e durata dell'impulso laser necessarie per l'apertura stabile del tipo specifico di cella di interesse devono essere definite in modo indipendente prima degli esperimenti. Abbiamo scoperto (non mostrato) che i parametri variano drasticamente tra diversi tipi di cellule (nel nostro caso, diversi cardiomiociti derivati da hiPS e primari). Ciò evita stress inutili sulle cellule durante l'esperimento di test composto e si traduce in dati più affidabili e riproducibili. È di fondamentale importanza regolare l'asse z per fornire una chiara messa a fuoco sulle celle e sugli elettrodi. Un'immagine della fotocamera sfocata produce un punto laser situato a un livello non ottimale, con conseguente incapacità di aprire la membrana cellulare. Anche con i parametri regolati meglio, l'effetto liAP è transitorio e l'ampiezza si riduce nel tempo. Inoltre, l'accesso allo spazio intracellulare delle cellule varia tra induzioni liAP, sia all'interno di aperture consecutive sullo stesso elettrodo che tra elettrodi. Ciò si traduce in un'elevata variabilità dell'ampiezza liAP. Il motivo non è ancora del tutto compreso. Le possibili spiegazioni includono problemi meccanici come una deriva del fuoco laser o una diversa localizzazione subcellulare dell'apertura della membrana. Ciò rende complicata l'analisi degli effetti di ampiezza dei composti in esame in questo momento. Inoltre, la registrazione dell'attività elettrica da parte di un sistema MEA richiede un filtraggio passa-elevato per compensare l'inevitabile deriva della linea di base. Sebbene nel sistema utilizzato qui, questo filtraggio fosse impostato su 0,1 Hz (l'impostazione di filtro più bassa disponibile per questo sistema), gli effetti di filtraggio durante la fase di plateau erano ancora visibili, con conseguente lenta tendenza della deflessione della tensione verso la linea di base durante la fase di plateau dell'AP cardiaco. Ciò è particolarmente problematico con AP sottostanti ampiamente lunghi come i cardiomiociti iCell 2 derivati da iPSCutilizzati qui , che generano già AP >700 ms in condizioni di controllo. L'utilizzo di sistemi con filtraggio inferiore può conservare meglio la forma dell'AP e consentire un accesso ancora migliore al decorso temporale della fase di ripolarizzazione.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare Foresee Biosystems per aver prestato il sistema IntraCell durante gli studi. Desiderano inoltre ringraziare Hae In Chang per l'assistenza tecnica. Questo lavoro ha ricevuto finanziamenti dal programma di ricerca e innovazione Horizon 2020 dell'Unione europea nell'ambito dell'accordo di sovvenzione n. 964518 (ToxFree), dal programma del Consiglio europeo per l'innovazione Horizon Europe dell'UE, dal progetto SiMulTox (accordo di sovvenzione n. 101057769) e dal Ministero statale del Baden-Wuerttemberg per gli affari economici, il lavoro e il turismo.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 well MEA chip | Multi Channel Systems MCS GmbH | 890301 | |
| 6 well MEA chip | Multi Channel Systems MCS GmbH | 7600069 | |
| DMSO | Merck KGaA | 20-139 Sigma-Aldrich | solvent for drugs |
| Dofetilide | ALOMONE LABS ISRAEL HEADQUARTERS | D-100 | Drug-Measurement |
| dPBS | Fisher Scientific GmbH | 12037539 | Coating |
| E4031 | ALOMONE LABS ISRAEL HEADQUARTERS | E-500 | Drug-Measurement |
| Falcon | Fisher Scientific GmbH | 10788561 | |
| FB Alps version 0.5.005 | Foresee Biosystems | ||
| Fibronectin | Merck KGaA | 11051407001 | Coating |
| iCell cardiomyocytes | FUJIFILM Cellular Dynamics, Inc. (FCDI) | C1016 | |
| IntraCell | Foresee Biosystems | ||
| IntraCell | Foresee Biosystems | ||
| Isopropanol | Carl Roth GmbH + Co. KG | CN09.1 | For cleaning of MEA contact pads |
| Maintenance Medium | FUJIFILM Cellular Dynamics, Inc. (FCDI) | #M1003 | For cell-culture |
| MC_Data Tool | Multi Channel Systems MCS GmbH | Data export | |
| MC_Rack | Multi Channel Systems MCS GmbH | MEA recording | |
| MEA 2100 - 2x60 - system | Multi Channel Systems MCS GmbH | 890485 | For MEA-recordings |
| Nifedipine | Merck KGaA | N7634 Sigma-Aldrich | Drug-Measurement |
| Plating Medium | FUJIFILM Cellular Dynamics, Inc. (FCDI) | M1001 | For cell-culture |
| Tergazyme | VWR International, LLC | 1304-1 | cleaning of MEAs |
Riferimenti
- Shah, M., Akar, F. G., Tomaselli, G. F. Molecular basis of arrhythmias. Circulation. 112 (16), 2517-2529 (2005).
- Bowlby, M. R., Peri, R., Zhang, H., Dunlop, J. hERG (KCNH2 or Kv11.1) K+ channels: screening for cardiac arrhythmia risk. Current Drug Metabolism. 9 (9), 965-970 (2008).
- Priest, B. T., Bell, I. M., Garcia, M. L. Role of hERG potassium channel assays in drug development. Channels (Austin). 2 (2), 87-93 (2008).
- Fenton, F., Cherry, E., Glass, L. Cardiac arrhythmia. Scholarpedia. 3 (7), 1665 (2008).
- Tisdale, J. E., et al. Drug-induced arrhythmias: A scientific statement from the American Heart Association. Circulation. 142 (15), 214-233 (2020).
- Kramer, J., et al. MICE models: superior to the HERG model in predicting Torsade de Pointes. Scientific Reports. 3, 2100 (2013).
- Rampe, D., Roy, M. -. L., Dennis, A., Brown, A. M. A mechanism for the proarrhythmic effects of cisapride (Propulsid): high affinity blockade of the human cardiac potassium channel HERG. FEBS Letters. 417 (1), 28-32 (1997).
- Girouard, S. D., Laurita, K. R., Rosenbaum, D. S. Unique properties of cardiac action potentials recorded with voltage-sensitive dyes. Journal of Cardiovascular Electrophysiology. 7 (11), 1024-1038 (1996).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Hou, J. H., Kralj, J. M., Douglass, A. D., Engert, F., Cohen, A. E. Simultaneous mapping of membrane voltage and calcium in zebrafish heart in vivo reveals chamber-specific developmental transitions in ionic currents. Frontiers in Physiology. 5, 344 (2014).
- Ronzhina, M., et al. Di-4-ANEPPS modulates electrical activity and progress of myocardial ischemia in rabbit isolated heart. Frontiers in Physiology. 12, 1-15 (2021).
- Beck, C., Gong, Y. A high-speed, bright, red fluorescent voltage sensor to detect neural activity. Scientific Reports. 9 (1), 15878 (2019).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Kovacs, G. T. A. Electronic sensors with living cellular components. Proceedings of the IEEE. 91 (6), 915-929 (2003).
- Tertoolen, L. G. J., Braam, S. R., van Meer, B. J., Passier, R., Mummery, C. L. Interpretation of field potentials measured on a multi electrode array in pharmacological toxicity screening on primary and human pluripotent stem cell-derived cardiomyocytes. Biochemical and Biophysical Research Communication. 497 (4), 1135-1141 (2018).
- Deo, M., Akwaboah, A., Tsevi, B., Treat, J. A., Cordeiro, J. M. Role of the rapid delayed rectifier K+ current in human induced pluripotent stem cells derived cardiomyocytes. Archives of Stem Cell and Therapy. 1 (1), 14-18 (2020).
- Hondeghem, L. M., Hoffmann, P. Blinded test in isolated female rabbit heart reliably identifies action potential duration prolongation and proarrhythmic drugs: importance of triangulation, reverse use dependence, and instability. Journal of Cardiovascular Pharmacology. 41 (1), 14-24 (2003).
- Dipalo, M., et al. Intracellular action potential recordings from cardiomyocytes by ultrafast pulsed laser irradiation of fuzzy graphene microelectrodes. Science Advances. 7 (15), (2021).
- . R: A language and environment for statistical computing: R Foundation for Statistical Computing Available from: https://www.r-project.org/ (2021)
- Wickham, H. . ggplot2: Elegant graphics for data analysis. , (2009).
- . tidyr: Tidy messy data: R package version 1.2.0 Available from: https://tidyr.tidyverse.org (2022)
- . dplyr: A grammar of data manipulation. R package version 1.0.6 Available from: https://tidyr.tidyverse.org (2021)
- Godfraind, T. Discovery and development of calcium channel blockers. Frontiers in Pharmacology. 8, 286 (2017).
- Vater, W., et al. Pharmacology of 4-(2'-nitrophenyl)-2,6-dimethyl-1,4-dihydropyridine-3,5-dicarboxylic acid dimethyl ester (Nifedipine, BAY a 1040). Arzneimittelforschung. 22 (1), 1-14 (1972).
- Kim, I., Boyle, K. M., Carroll, J. L. Postnatal development of E-4031-sensitive potassium current in rat carotid chemoreceptor cells. Journal of Applied Physiology. 98 (4), 1469-1477 (2005).
- Edwards, S. L., et al. A multiwell cardiac µGMEA platform for action potential recordings from human iPSC-derived cardiomyocyte constructs. Stem Cell Reports. 11 (2), 522-536 (2018).
- Fendyur, A., Spira, M. E. Toward on-chip, in-cell recordings from cultured cardiomyocytes by arrays of gold mushroom-shaped microelectrodes. Frontiers in Neuroengineering. 5, 21 (2012).
- Hayes, H. B., et al. Novel method for action potential measurements from intact cardiac monolayers with multiwell microelectrode array technology. Scientific Reports. 9 (1), 11893 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon