Method Article
Лазерно-индуцированные измерения потенциала действия кардиомиоцитов на микроэлектродных массивах для повышения предсказуемости фармакологии безопасности
В этой статье
Резюме
Комбинация лазерной порации и микроэлектродных массивов (MEA) позволяет регистрировать потенциал действия культивируемых первичных и производных из стволовых клеток кардиомиоцитов. Форма сигнала обеспечивает превосходное понимание способа действия тестируемых соединений, чем стандартные записи. Он связывает патч-зажим и считывание MEA для дальнейшей оптимизации исследований безопасности кардио в будущем.
Аннотация
Опасной для жизни медикаментозной сердечной аритмии часто предшествуют длительные потенциалы сердечного действия (АП), обычно сопровождающиеся небольшими колебаниями проаритмического мембранного потенциала. Форма и временной ход реполяризующей фракции АП могут иметь решающее значение для наличия или отсутствия аритмии.
Микроэлектродные массивы (MEA) обеспечивают легкий доступ к эффектам кардиотоксических соединений через потенциалы внеклеточного поля (FP). Несмотря на то, что форма сигнала FP является мощным и хорошо зарекомендовавшим себя инструментом в исследованиях и фармакологии сердечной безопасности, она не позволяет вывести первоначальную форму AP из-за принципа внеклеточной записи и результирующей внутренней фильтрации переменного тока (AC).
Новое устройство, описанное здесь, может многократно открывать мембрану кардиомиоцитов, культивируемых поверх электродов MEA в нескольких точках времени культивирования, используя высокосфокусированный наносекундный лазерный луч. Лазерная порация приводит к преобразованию электрофизиологического сигнала из FP во внутриклеточные точки доступа (лазерно-индуцированная ТОЧКА доступа, liAP) и позволяет регистрировать отклонения трансклеточного напряжения. Этот внутриклеточный доступ позволяет лучше описать форму АП и лучше и более чувствительно классифицировать проаритмические потенциалы, чем обычные записи MEA. Эта система является революционным расширением существующих электрофизиологических методов, позволяющим точно оценивать кардиотоксический эффект со всеми преимуществами записей на основе MEA (легкие, острые и хронические эксперименты, анализ распространения сигнала и т. Д.).
Введение
Электрический вклад сердцебиения является результатом сложного и точно синхронизированного взаимодействия многих сердечных каналов и транспортеров, а также точно настроенного распространения электрических сигналов через миокард1. Изменение этих тесно скоординированных механизмов (например, использование лекарств) может привести к тяжелым последствиям для функции сердца (т.е. угрожающей жизни аритмии)2,3. Аритмии определяются как нерегулярное сердцебиение, которое изменяет нормальный ритм сердца, что может иметь опасные для жизни последствия. Они могут быть вызваны либо нарушением инициации волны сердечного возбуждения, либо аномальным распространением сердечного возбуждения4, что, в свою очередь, приводит к дисфункции насосного механизма сердца.
Многие высокоактивные кандидаты на лекарства должны быть исключены из дальнейших исследований на ранней стадии разработки лекарств из-за их (про-) аритмического потенциала 2,3. Они модулируют ключевые сердечные каналы (например, канал гена, связанный с человеческим эфиром и уходом [hERG]), которые отвечают за формирование и прекращение нормального потенциала сердечного действия, а также последующее распространение сигнала5.
Фармацевтические компании регулярно используют измерения зажимов пластырей или микроэлектродные массивы (MEA) для изучения потенциальных кардиотоксических нецелевых эффектов, индуцированных кандидатами на лекарства. Патч-зажимные записи позволяют расшифровать воздействие веществ на сердечные ионные каналы и проанализировать трансклеточный потенциал сердечного действия с высоким пространственно-временным разрешением 6,7. Однако к недостаткам данной методики можно отнести низкую пропускную способность при ручном патч-зажиме и ограниченную применимость автоматики из-за зависимости этого метода от ячеек в суспензии. Кроме того, хронические эффекты не могут быть исследованы из-за инвазивности метода. Наконец, обычно одновременно изучаются только одиночные клетки, а не весь сердечный синцитий, что делает невозможным обращение к информации о распространении сигнала.
Чувствительные к напряжению красители ценны для неинвазивного исследования потенциалов сердечного действия и медикаментозных аритмий8. Они позволяют исследовать как одноклеточную, так и синцитиевую активность. Недостатками этого метода являются цитотоксические эффекты либо красителей как таковых, либо продукта реакции при освещении. Они используются для острых экспериментов и вряд ли применимы для долгосрочных исследований 9,10,11. Чувствительные к напряжению белки в качестве альтернативы достигли значительного прогресса за последние пару лет с точки зрения удобства использования и чувствительности, но требуют генетической модификации интересующих клеток и не имеют высокого временного разрешения по сравнению с электрофизиологическими методами12.
Информация из последней инициативы CiPA13 гласит, что MEA широко используются в скринингах сердечной безопасности в качестве альтернативного электрофизиологического подхода, поскольку они представляют собой мощный и хорошо зарекомендовавший себя инструмент для исследования сердечной функции и фармакологии безопасности. Кардиомиоциты культивируются в виде синцития непосредственно поверх чипов, а внеклеточные полевые потенциалы (FP) регистрируются неинвазивно через субстрат-интегрированные микроэлектроды. Этот принцип записи позволяет проводить скрининги с повышенной пропускной способностью в течение нескольких дней, что делает их пригодными для фармацевтических исследований хронических эффектов. Полученная форма сигнала FP является производной от внутриклеточного AP14. Такие параметры, как частота биения, амплитуда начальной части FP и длительность FP, легко доступны15. Другие существенные критерии, такие как дифференциация между удлинением и триангуляцией ФП (важный маркер проаритмии16,17), недоступны из-за эффекта фильтрации переменного тока метода. Кроме того, обнаружение других небольших проаритмических событий, таких как ранняя и отсроченная последеполяризация (EAD и DAD, соответственно), часто легко упускается из виду из-за их небольшой амплитуды.
Здесь описан способ получения доступа к внутриклеточному мембранному потенциалу путем вскрытия мембраны кардиомиоцитов. Устройство IntraCell (далее именуемое внутриклеточным регистрирующим устройством) позволяет повторно открывать мембраны кардиомиоцитов, культивируемых поверх электродов MEA с использованием высокосфокусированного наносекундного лазерного луча с помощью определенного физического явления (поверхностный плазмонный резонанс)18. В результате запись переходит из обычного ФП во внутриклеточную АП (лазероиндуцированная АП, лиАП). Протокол показывает, как это позволяет получить доступ к кинетическим аспектам формы сигнала, которые не могут быть легко захвачены путем анализа FP. Этот метод представляет собой мост между традиционным внутриклеточным зажимом и записями MEA. Таким образом, технология является мощным расширением современных методов оценки сердечной безопасности.
протокол
1. Препарат кардиомиоцитов на основе индуцированных плюрипотентных стволовых клеток
ПРИМЕЧАНИЕ: Кардиомиоциты iCell2 (называемые индуцированными кардиомиоцитами, полученными из плюрипотентных стволовых клеток [iPSCs]) были получены в соответствии с протоколом, предоставленным поставщиком. Краткое изложение протокола будет кратко изложено в следующем разделе.
- Оттаивание покрытия и среды для технического обслуживания при 4 °C в течение 24 ч перед использованием.
- Получают фибронектиновое покрытие путем растворения стерильного фибронектина в стерильной воде в концентрации 1 мг/мл. Заморозьте хранить этот запас в аликвотах (например, 25 мкл на аликвоту). Разбавить аликвотированный раствор 1:20 в стерильном сбалансированном солевом растворе Дульбекко (dPBS).
- Покрывайте электродные поля ранее автоклавированных MEA под ламинарным проточным капотом, по каплям в стерильных условиях фибронектином с использованием пипетки 10 мкл. Для этого опустите 5 мкл раствора фибронектина на электродные поля и наблюдайте за образованием капли поверх области электрода. Убедитесь, что вы не прикасаетесь к чувствительным электродам.
ПРИМЕЧАНИЕ: Для поддержания стерильных условий переложите чип MEA в стерильную чашку Петри, прежде чем извлекать его из ламинарной вытяжки. - Инкубировать покрытые МЭС в течение 1 ч при 37°С предпочтительно в инкубаторе.
- Разморозьте криовиал, содержащий кардиомиоциты, на водяной бане при температуре примерно 37 °C в течение 2 минут, пока не останется только немного кристалла льда. Аккуратно переложите клеточный раствор в пробирку объемом 50 мл.
- Добавьте 1 мл галь покрытой среды к пустой криовиальной. Перенесите раствор по каплям в течение 90 с в трубку объемом 50 мл, чтобы уменьшить осмотический шок. Осторожно добавьте в трубку дополнительные 8 мл галь покрытой среды.
- Тщательно перемешайте клеточную суспензию, используя пипетку объемом 10 мл. Рассчитайте общее количество жизнеспособных клеток с помощью автоматизированной флуоресцентной цитометрии. Номер должен быть близок к номеру в техническом описании, предоставленном заводом-изготовителем.
- Раскрутите клеточный раствор вниз в течение 3 мин при 200 х г при комнатной температуре. Удалите супернатант аспирацией с помощью стеклянной пипетки, прикрепленной к насосной системе. Отрегулируйте количество клеток от 6 000 до 15 000 жизнеспособных клеток/мкл.
ПРИМЕЧАНИЕ: Количество ячеек обычно находится в диапазоне, указанном выше, но может варьироваться в зависимости от соответствующего поставщика. - Удалите раствор покрытия, нанесенный на этапе 1.3, из области электрода MEA с помощью пипетки объемом 10 мкл непосредственно перед посевом клеток. Засейте клетки сразу после удаления, чтобы избежать высыхания покрытия. Для этого засейте ячейки по каплям при 4 мкл как для 6-луночных MEA, так и для 1-луночных MEA на электродные поля таким же образом, как это делается с покрытием.
- Дайте ячейкам прилипнуть в течение 1 ч в инкубаторе при 37 °C и 5% CO2 перед заполнением скважин стерильной гальванической средой, нагретой примерно до 37 °C при 200 мкл для 6-луночного МЭА и 1 мл для одной скважины MEA под ламинарной вытяжкой.
- Выполните полную смену среды через 48 ч после нанесения покрытия под ламинарным вытяжным кожухом. Для этого удалите гальваническую среду аспирацией с помощью стеклянной пипетки, прикрепленной к насосной системе. Затем добавьте в скважины 200 мкл стерильной поддерживающей среды, нагретой до 37 °C.
- Выполняйте полные изменения среды через день.
- Начинают измерять клетки через 5-8 дней после оттаивания. Выполните полную смену среды за 2 часа до начала экспериментов.
2. Записи MEA
ПРИМЕЧАНИЕ: Устройство, используемое для преобразования сигнала FP в liAP, состоит из вертикального микроскопа и лазера 1064 нм.
- Поместите систему MEA поверх устройства с держателем микросхемы MEA, центрированным над отверстием объектива. Расположите MEA так, чтобы объектив находился непосредственно под отверстием системы MEA, чтобы лазер мог фокусироваться на электродах.
- Перенесите чип MEA с культивируемыми клетками из инкубатора в установку MEA за 15 минут до записи, что позволит клеткам восстановиться после механического возмущения.
- Тщательно очистите контактные прокладки и штифты, используя изопропанол и ватный тампон, чтобы снизить уровень шума. Осторожно поместите MEA в MEA-установку. Расположите микросхему MEA с логотипом внизу с левой верхней стороны (6-луночный MEA) или с опорным электродом слева (однолуночный MEA).
- Установите нагрев, интегрированный в систему MEA, на 38 °C. Поместите небольшую камеру поверх чипа MEA, чтобы постоянно перфузировать клетки увлажненным карбогеном (5% CO2 и 95% O2), чтобы воссоздать условия инкубатора и предотвратить испарение.
- Закройте крышку устройства. Встроенный предохранительный выключатель позволяет активировать лазер только в том случае, если крышка закрыта над микросхемой MEA. Установите системный фильтр MEA с помощью программы конфигурации MEA на частоту 0,1 Гц или менее высоких частот и 3 500 Гц нижних частот.
- Используйте программное обеспечение MC_Rack (программное обеспечение для записи) или любое альтернативное программное обеспечение для записи. Отрегулируйте входной диапазон в соответствии с вашими потребностями, гарантируя, что сигнал не насыщает усилитель и частоту дискретизации (например, 20 кГц). Используйте функцию долгосрочного отображения программного обеспечения для проверки записи.
3. Лазерно-индуцированная порация клеток
- После вставки микросхемы MEA в настройку MEA и настройки программного обеспечения инициализируйте лазерную механику с помощью программного обеспечения FB Alps (программное обеспечение инициализации).
- Во-первых, нажмите на кнопку Инициализация . В конце инициализации виртуальная лазерная точка будет находиться в скважине D для 6-луночного МЭА и в левом нижнем углу для однолуночной МЭА соответственно.
- Переместите виртуальную лазерную точку с помощью Ctrl + щелчка мыши в середину электрода D5 и отрегулируйте фокус. Отрегулируйте фокус с помощью Ctrl + прокрутка с помощью колесика мыши.
- Нажмите кнопку Set P1. Виртуальная лазерная точка автоматически перейдет в скважину F. Повторите процесс с электродом F5 и выберите Set P2.
- После этой процедуры лазерная точка переместится в скважину B. Повторите тот же процесс с электродом B5 и нажмите Set P3 в программном обеспечении. Теперь система выровнена.
- Отрегулируйте мощность лазера и время обработки в соответствии с потребностями ваших клеток. Здесь было использовано 40% мощности и 25% технологического времени.
- Чтобы включить лазер, нажмите кнопку Laser Off , которая затем появится как laser on. Переключитесь на программное обеспечение для записи, выберите имя файла и нажмите кнопку Red Recording , а затем кнопку «Воспроизвести » в верхней части окна, чтобы записать измерение.
- Запишите базовую линию в 60 с перед открытием ячеек с помощью лазера. Вернитесь к программному обеспечению инициализации.
- Деактивируйте электроды, которые будут исключены лазером на виртуальной карте справа с помощью Ctrl + щелчка мышью. Выберите интересующие электроды, активировав их в представлении массива в правой части окна программного обеспечения.
- Чтобы запустить лазер, используйте Alt + щелчок мышью и выберите центральный электрод этой скважины. Это инициирует лазер для автоматического открытия ячеек на каждом электроде этой скважины. Повторите для каждой лунки. Затем лазер автоматически откроет все ранее активированные электроды выбранной скважины.
4. Обращение с наркотиками и их применение
- Подготовьте все вещества, которые будут использоваться для тестов на наркотики, заново в день измерений. Убедитесь, что конечная концентрация применения в среде в 10 раз выше, чтобы сделать разбавление 1:10 в скважинах.
- Растворяют нифедипин, Е4031 и дофетилид сначала в ДМСО в концентрации мМ, а затем далее в среде до 10x желаемой концентрации. Никогда не превышайте конечную концентрацию ДМСО 0,1% в скважине.
- Запишите базовую активность за 60 с. Запустите лазерно-индуцированную порацию, как описано на этапе 3 протокола, в результате чего FP превращается в форму liAP.
- Применяют все препараты в разовой концентрации на лунку. Удалите 20 мкл среды на скважину для 6-луночных МЭА и 100 мкл для МПС с одной скважиной, соответственно. Добавьте 20 мкл или 100 мкл, в зависимости от типа МЭА, исходного раствора препарата, подлежащего измерению, в лунку и аккуратно пипетку вверх и вниз 2-3 раза. Выполните, по крайней мере, три репликации каждого препарата и концентрации для достижения статистической значимости.
- Дайте соединениям промыться в течение 300 с. За это время форма liAP может превратиться обратно в форму FP. Опять же, индуцируйте порирование, индуцированное лазером, и регистрируйте возможные эффекты, индуцированные соединениями, на liAP в течение дополнительных 60 с.
5. Экспорт данных
- Выберите соответствующие электроды, воспроизведя запись в программном обеспечении для записи. Используйте MC_DataTool для конвертирования файлов MC_Rack в файлы .txt ASCII.
- Нажмите на Файл > Открыть MCD > Выберите файл MC_Rack. Нажмите на кнопку txt (синий текст).
- Выберите электрод. Выбранный электрод будет показан в списке с правой стороны.
- Нажмите кнопку Обзор , чтобы выбрать папку и изменить имя нового файла .txt. Нажмите кнопку Сохранить.
- Снимите флажок экспортируемого электрода и выберите следующий электрод для экспорта. Повторите процедуру для всех интересующих электродов.
6. Обработка данных и статистический анализ
- Импорт преобразованных двоичных трассировок в R19. Визуализируйте/анализируйте данные с помощью пользовательских скриптов, содержащих следующие пакеты: dplyr, tidyr и ggplot2 20,21,22.
Результаты
Система записи, используемая для записи электрической активности от культивируемых кардиомиоцитов, состояла из стандартной системы MEA, оснащенной нагревателем и камерой для карбогена, прикрепленной к компьютеру. Система была установлена поверх внутриклеточного записывающего устройства, которое, в свою очередь, было установлено поверх небольшого антивибрационного блока (рисунок 1A-B).
Кардиомиоциты2, полученные из iPSC, начали биться спонтанно в течение 2-3 дней после оттаивания (дни in vitro, DIV) и были видны под микроскопом. Начиная с DIV 4, частота биения стала регулярной, и на большинстве электродов в соответствующих скважинах микросхем MEA можно было обнаружить потенциалы внеклеточного поля (FP) с амплитудами от пика до пика деполяризующего компонента от 1 до 5 мВ. Электрическая активность может быть обнаружена более чем в 95% исследуемых скважин. Начиная с DIV 7, вероятность отсоединения клеток увеличивалась, что делало дальнейшее использование этих скважин невозможным.
Программное обеспечение для управления отверстием мембраны, индуцированной лазером, позволяет регулировать как мощность, так и время процесса лазера, который опосредует открытие клеточной мембраны только на исследуемом электроде (рисунок 1С), тогда как другие электроды в соответствующей скважине не затрагиваются. В то время как слишком консервативные настройки не изменяли форму волны FP, слишком высокие настройки привели к предполагаемому повреждению кардиомиоцитов, о чем свидетельствует энергичное, но преходящее биение или потеря сигнала. При настройке на 40% мощности и 25% времени процесса, хорошо переносимого клетками, запуск лазерного импульса приводил к множественным изменениям записанной формы сигнала (см. Рисунок 1D для примерной записи). В этих условиях макроскопически не наблюдалось изменения материала электрода. Записанная амплитуда сигнала значительно увеличилась на 4,1 ± 0,41 (n = 20, диапазон 1,34-8,83) раза, проанализированного из случайно выбранного подмножества записей, в результате чего получились амплитуды от 7 до 22 мВ. Кроме того, форма сигнала трансформировалась из стандартной формы FP с быстрым, двухфазным и переходным отклонением напряжения в начале, за которым следовала фаза плато назад на исходной линии и небольшое отклонение, указывающее на конец FP, в форму, которая была ближе к внутриклеточной зарегистрированной точке доступа с быстрым подъемом, расширенной деполяризованной фазой плато и фазой реполяризации с понижением ниже базовой линии (рисунок 1E). ). Мы определили эти отклонения напряжения как лазерно-индуцированную точки доступа (liAP). В большинстве случаев переход был преходящим и, по крайней мере, частично инвертированным в течение 5 мин. Распространение сигнала внутри сердечного синцития оставалось неизменным после индукции liAP (рисунок 2), что указывает на то, что оставшийся синцитий не был затронут потенциальным повреждением от лазерного импульса.
Сходство с внутриклеточными зарегистрированными точками доступа позволило извлекать параметры liAP, которые недоступны для FP (примерные параметры см., например, на рисунке 3A), наиболее заметным из которых является измерение длительности liAP в определенные моменты времени (например, при 20%, 50% и 90%) (рисунок 3B), аналогично APD20/50/90, обычно используемому для описания ТОП.
Затем мы проверили реакцию открытых лазером кардиомиоцитов на обычно используемые кардиоактивные фармакологические соединения. Примерный дизайн протокола можно найти на рисунке 3C. Поскольку трансформация liAP не всегда сохранялась на протяжении всего эксперимента, применение соединения выполняли как единую концентрацию на скважину, а не кумулятивным образом, чтобы сократить общее время регистрации. Тем не менее, перед нанесением исследуемого соединения необходимо было либо вновь открыть ячейки, либо открыть другую область электрода.
Добавление специфического блокатора каналов L-типа Ca2+, нифедипина23,24, уменьшало фазу плато liAP в зависимости от концентрации и тем самым укорачивало весь liAP (рисунок 4A,B). Это укорочение было сопоставимо с анализом, полученным из FP кардиомиоцитов из неуправляемых электродов (рисунок 4C), что указывает на то, что этот метод записи не имел побочных эффектов по сравнению с классическими записями FP.
Е4031 ингибирует реполяризацию соответствующего Kv1.11 (hERG) калиевого канала25 и приводит к аритмическому поведению кардиомиоцитов при повышенных концентрациях. Подобно анализу, полученному из записей FP, E4031 увеличивал продолжительность liAP в зависимости от концентрации (рисунок 5). Кроме того, при концентрациях 0,01 мкМ и выше были видны небольшие положительные отклонения напряжения в конце liAP. Эти отклонения стали более заметными с более высокими концентрациями, что указывает на переходную новую деполяризацию, в отличие от FP, где эти отклонения были практически невидимы (см. Рисунок 5B-C, верхние (FP) против нижних (liAP) следы). Это поведение известно как ранняя постдеполяризация (EAD). При самой высокой концентрации 0,1 мкМ эти ЭД со временем переросли в эктопические удары, которые являются потенциалами преждевременного действия (рисунок 5C). Как EAD, так и эктопические удары являются ключевыми показателями проаритмической активности. В конце примера, показанного на рисунке 5D, электрическая активность приводила к аритмическому биению. Кроме того, отношения концентрация-реакция-отображение между записями FP и liAP совпадали (рисунок 5E). Однако существует более значительная изменчивость данных FP в результате слабого компонента реполяризации FP при более высоких концентрациях исследуемого соединения. По-видимому, характерная природа кардиомиоцитов2, полученных из iPSC, имеет тенденцию генерировать нефизиологически длинные AP и в контролируемых условиях (продолжительность AP > 700 мс). Система MEA применила внутреннюю фильтрацию переменного тока 0,1 Гц, что, в свою очередь, привело к частично отфильтрованной форме liAP, хотя и без перекрытия качественной информации о начале и завершении базовой точки доступа.
Оказалось, что первоначальное возникновение проаритмических отклонений напряжения может быть обнаружено при более низких концентрациях в liAP по сравнению с записями FP. На фиг.6 показана регистрация электрической активности при применении дофетилида в концентрации 3 мкМ. Запись была получена в том же колодце. Хотя и FP, и liAP отображали продолжительность примерно 2 с, форма сигнала FP была ненавязчивой, представляя регулярные реполяризующие отклонения. В то же время в конце liAP стали видны EAD разных величин. Это увеличение соответствующей безопасности-фармакологической чувствительности дополнительно подтверждает вывод о том, что liAP, индуцированные поверхностным плазмонным резонансом, позволяют повысить квалификацию фазы реполяризации и тем самым помогают узнать больше о способе действия исследуемых исследуемых соединений.
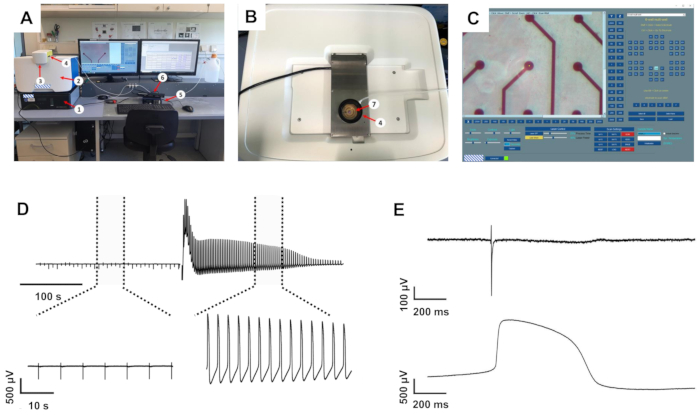
Рисунок 1: Настройка внутриклеточной записи и примерные записи. (A) Обзор настройки. (B) Вид сверху системы записи с открытым усилителем записи MEA. (C) Программное обеспечение инициализации с виртуальной картой MEA справа. 1: антивибрационная таблица, 2: внутриклеточная система записи, 3: крышка лазерной защиты, 4: увлажненная карбогенная камера, 5: система нагрева MEA, 6: интерфейсная плата MEA, 7: 1-луночная микросхема MEA внутри записывающего усилителя. (D) Примеры записи с одного электрода до и после индукции liAP. Вверху: запись продолжительностью около 6 минут. Пунктирные линии отмечают развернутые области, показанные внизу. (E) Увеличенный FP (сверху) и liAP (снизу). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
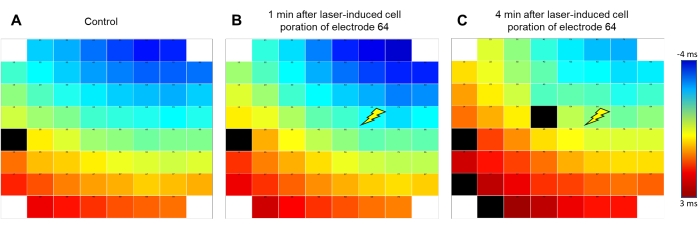
Рисунок 2: Паттерн распространения сигнала сохраняется после индукции liAP. Ложноцветное кодирование распространения сигнала волны возбуждения внутри синцития. Синим цветом обозначено раннее (начиная с -4 мс); красным цветом обозначены поздние точки времени (+3 мс) от сигнала, полученного на опорном электроде Е54, как указано цветовой полосой. Сигнал проходит от верхнего правого к левому нижнему краю электродной решетки. (A) До индукции liAP, (B) через 1 мин после индукции liAP. (C) через 4 мин после индукции liAP. Символ Вспышки указывает на точку индукции лазера на электроде 64. Обратите внимание, что никакой разницы в общем направлении распространения не видно. Черные прямоугольники указывают на недопустимые данные. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
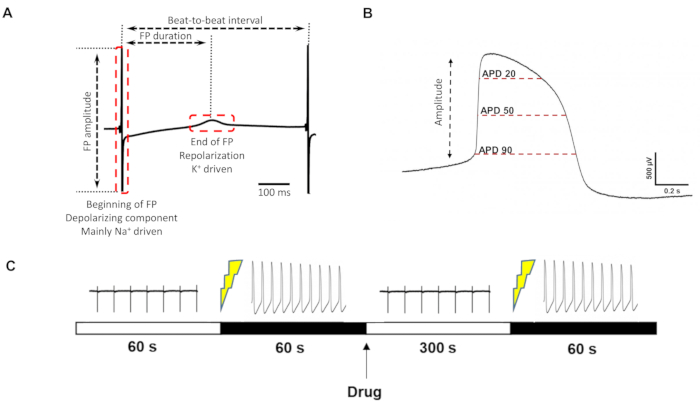
Рисунок 3: Определение параметров FP/liAP и протокол записи. (A) Параметры, которые могут быть извлечены из классического FP. (B) Дополнительные параметры, которые могут быть получены из liAP. (C) Хронология измерения лекарственных средств. Слева направо: контрольная запись в течение 60 с, индукция liAP, запись liAP в течение 60 с, применение препарата, время промывки 300 с, реиндукция liAP, запись liAP в течение 60 с. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
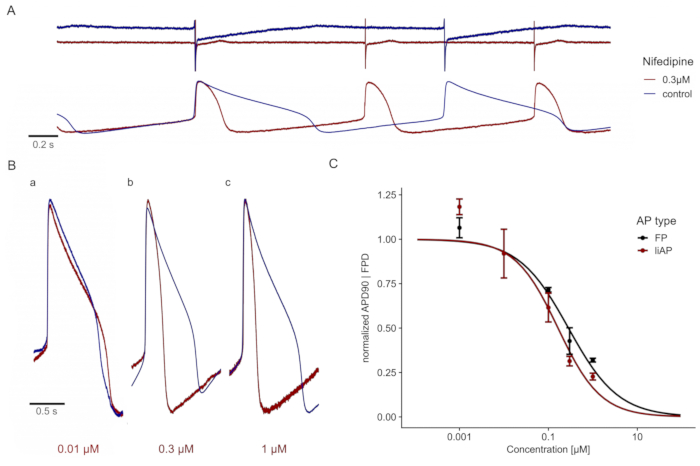
Рисунок 4: Нифедипин укорачивает сердечный liAP в зависимости от концентрации. (A) Сверху: следы FP в контроле (синий) и в присутствии 0,3 мкМ нифедипина (красный). Трассировки отображаются со смещением по оси Y для лучшей визуализации. Внизу: следы liAP от той же записи MEA, что приводит к укорочению liAP в сочетании с увеличением скорости биения. (B) Суперпозиция одиночных liAP во время контроля (синий) и применения различных концентраций нифедипина (красный). a: 0,01 мкМ, b: 0,1 мкМ и c: 0,3 мкМ. Обратите внимание на сокращение длительности liAP с увеличением концентраций. (C) Соотношение концентрация-отклик ширины сигнала, полученного из записей FP (черный) и liAP (красный). Данные взяты из n = 3 экспериментов и нормализованы для контроля. Полосы ошибок указывают на стандартную погрешность среднего значения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
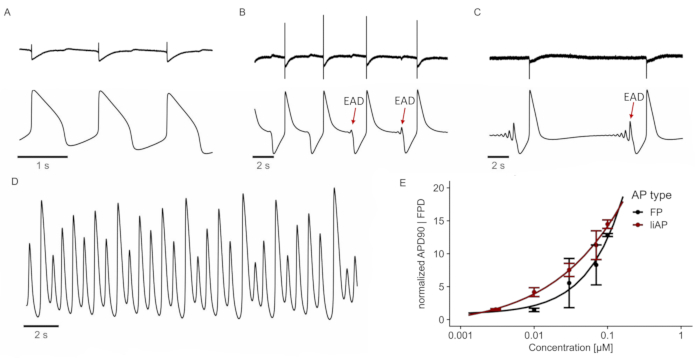
Рисунок 5: E4031 индуцирует (про-) аритмическое поведение. (A) FP (сверху) и liAP (снизу) в контрольных условиях. (Б-С) FP и liAP регистрировались в разные моменты времени после применения E4031 (0,1 мкМ). Через 80 с первые EAD видны в конце liAP (B; отмечены красной стрелкой). ЭАД превращаются в эктопические удары через 320 с в присутствии исследуемого соединения (С). (D) Через 530 с сердечный синцитий переходит в тахикардическое состояние. След, изображенный из записи liAP. (E) Соотношение концентрация-реакция ширины FP (черный) и liAP (красный). Данные из n = 4 экспериментов, нормализованных для контроля. Полосы ошибок указывают на стандартную погрешность среднего значения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
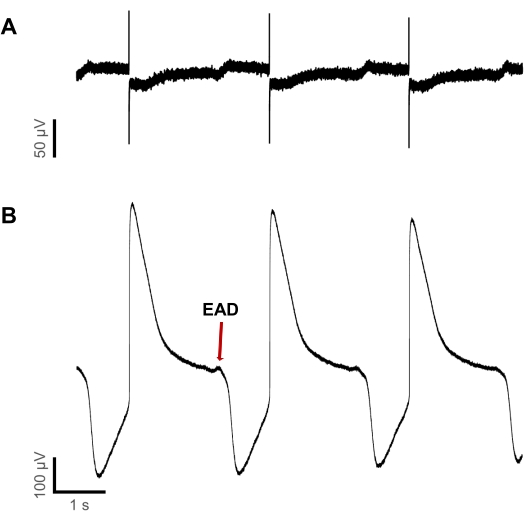
Рисунок 6: Обнаружение проаритмических событий более чувствительно в liAP, чем в FP. (A) запись FP и (B) запись liAP в одной скважине при применении 3 мкМ дофетилида. Хотя в конце некоторых liAP EAD обнаруживаются, они остаются необнаруживаемыми в записях FP. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Этот инновационный метод демонстрирует новый способ исследования in vitro фармакологической модуляции потенциала сердечного действия при применении кардиоактивных фармакологических инструментальных соединений.
Классические записи MEA позволяют записывать FP, которые являются производными сердечного AP14. Эта косвенная запись запутывает временной ход де- и реполяризации и тем самым устраняет существенные характеристики АП. Кроме того, хотя трансклеточное изменение напряжения точки доступа обычно достигает значений приблизительно 100 мВ, общая амплитуда FP остается сравнительно низкой, с пиковыми амплитудами между несколькими 100 мкВ и низкими однозначными значениями мВ. Из-за принципа записи фаза реполяризации невелика; во многих случаях он просто обнаруживается и часто имеет нечеткую форму, что затрудняет определение конца FP. Открытие клеточной мембраны позволяет получить доступ к внутриклеточному напряжению, тем самым раскрывая временной ход сердечной АП. Существует множество преимуществ этого метода записи по сравнению с записями FP. Во-первых, амплитуда сигнала более заметна, обеспечивая превосходное отношение сигнал/шум. Во-вторых, форма сигнала приводит к лучшему обнаружению реполяризации. В-третьих, форма фазы реполяризации способствует пониманию способа действия исследуемого соединения, обеспечиваемого крутизной сигнала релаксации. И, наконец, этот метод обеспечивает улучшенную чувствительность для обнаружения критических побочных эффектов лекарств, что демонстрируется примером записи, показанным на рисунке 6 для возникновения EAD в liAP, но не в FP.
Пока существует два способа получения доступа к внутриклеточной АП. Первый достигается электропорацией26,27. Здесь короткие и сильные импульсы напряжения, подаваемые через регистрирующие электроды, могут открыть клеточную мембрану28. Второй возможностью является открытие мембраны с помощью лазерного импульса, использующего физическое явление, называемое поверхностным плазмонным резонансом, как показано здесь. Одним из преимуществ по сравнению с электропорацией является повышенная вероятность последовательных открытий. Из-за высокосфокусированного лазерного пятна (1-3 мкм) этот эффект очень локально ограничен интересующим электродом. Интересно, что инициация liAP не изменила распространение сигнала культивируемого синциция. Это указывает на то, что, хотя целостность клеток повреждена, кардиомиоциты, по-видимому, не деполяризуются через отверстие в мембране.
У этого метода есть ограничения. Как и в случае с электропорацией, отверстие мембраны в большинстве случаев не длится в течение всего экспериментального курса. Минимальные настройки мощности и длительности лазерного импульса, необходимые для стабильного открытия конкретного типа интересующей ячейки, должны быть определены независимо до начала экспериментов. Мы обнаружили (не показали), что параметры резко различаются между различными типами клеток (в нашем случае несколько hiPS-производных и первичных кардиомиоцитов). Это позволяет избежать ненужной нагрузки на клетки во время эксперимента с составным тестом и приводит к более надежным и воспроизводимым данным. Крайне важно отрегулировать ось Z, чтобы обеспечить четкую фокусировку на ячейках и электродах. Несфокусированное изображение камеры дает лазерное пятно, расположенное на неоптимальном уровне, что потенциально приводит к невозможности открыть клеточную мембрану. Даже при наиболее скорректированных параметрах эффект liAP является преходящим, а амплитуда со временем уменьшается. Кроме того, доступ к внутриклеточному пространству клеток варьируется между индукциями liAP, как в последовательных отверстиях на одном и том же электроде, так и между электродами. Это приводит к высокой изменчивости амплитуды liAP. Причина еще не до конца понятна. Возможные объяснения включают механические проблемы, такие как дрейф лазерного фокуса или другая субклеточная локализация отверстия мембраны. Это усложняет анализ амплитудных эффектов исследуемых соединений на данный момент времени. Кроме того, регистрация электрической активности системой MEA требует фильтрации высоких частот для компенсации неизбежного дрейфа исходной линии. Хотя в системе, используемой здесь, эта фильтрация была установлена на 0,1 Гц (самая низкая настройка фильтра, доступная для этой системы), эффекты фильтрации во время фазы плато все еще были видны, что привело к медленной тенденции отклонения напряжения к базовой линии во время фазы плато сердечной точки доступа. Это особенно проблематично с широко длинными базовыми AP, такими как кардиомиоциты iCELL2 , полученные из iPSC, используемые здесь, которые уже генерируют AP >700 мс в контролируемых условиях. Использование систем с более низкой фильтрацией может лучше сохранить форму точки доступа и обеспечить еще лучший доступ к временному ходу фазы реполяризации.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Foresee Biosystems за кредитование системы IntraCell во время исследований. Они также хотели бы поблагодарить Hae In Chang за техническую помощь. Эта работа получила финансирование от исследовательской и инновационной программы Европейского Союза Horizon 2020 в рамках грантового соглашения No 964518 (ToxFree), от программы Европейского инновационного совета ЕС Horizon Europe, проекта SiMulTox (грантовое соглашение No 101057769) и от Государственного министерства Баден-Вюртемберга по экономическим вопросам, труду и туризму.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 well MEA chip | Multi Channel Systems MCS GmbH | 890301 | |
| 6 well MEA chip | Multi Channel Systems MCS GmbH | 7600069 | |
| DMSO | Merck KGaA | 20-139 Sigma-Aldrich | solvent for drugs |
| Dofetilide | ALOMONE LABS ISRAEL HEADQUARTERS | D-100 | Drug-Measurement |
| dPBS | Fisher Scientific GmbH | 12037539 | Coating |
| E4031 | ALOMONE LABS ISRAEL HEADQUARTERS | E-500 | Drug-Measurement |
| Falcon | Fisher Scientific GmbH | 10788561 | |
| FB Alps version 0.5.005 | Foresee Biosystems | ||
| Fibronectin | Merck KGaA | 11051407001 | Coating |
| iCell cardiomyocytes | FUJIFILM Cellular Dynamics, Inc. (FCDI) | C1016 | |
| IntraCell | Foresee Biosystems | ||
| IntraCell | Foresee Biosystems | ||
| Isopropanol | Carl Roth GmbH + Co. KG | CN09.1 | For cleaning of MEA contact pads |
| Maintenance Medium | FUJIFILM Cellular Dynamics, Inc. (FCDI) | #M1003 | For cell-culture |
| MC_Data Tool | Multi Channel Systems MCS GmbH | Data export | |
| MC_Rack | Multi Channel Systems MCS GmbH | MEA recording | |
| MEA 2100 - 2x60 - system | Multi Channel Systems MCS GmbH | 890485 | For MEA-recordings |
| Nifedipine | Merck KGaA | N7634 Sigma-Aldrich | Drug-Measurement |
| Plating Medium | FUJIFILM Cellular Dynamics, Inc. (FCDI) | M1001 | For cell-culture |
| Tergazyme | VWR International, LLC | 1304-1 | cleaning of MEAs |
Ссылки
- Shah, M., Akar, F. G., Tomaselli, G. F. Molecular basis of arrhythmias. Circulation. 112 (16), 2517-2529 (2005).
- Bowlby, M. R., Peri, R., Zhang, H., Dunlop, J. hERG (KCNH2 or Kv11.1) K+ channels: screening for cardiac arrhythmia risk. Current Drug Metabolism. 9 (9), 965-970 (2008).
- Priest, B. T., Bell, I. M., Garcia, M. L. Role of hERG potassium channel assays in drug development. Channels (Austin). 2 (2), 87-93 (2008).
- Fenton, F., Cherry, E., Glass, L. Cardiac arrhythmia. Scholarpedia. 3 (7), 1665 (2008).
- Tisdale, J. E., et al. Drug-induced arrhythmias: A scientific statement from the American Heart Association. Circulation. 142 (15), 214-233 (2020).
- Kramer, J., et al. MICE models: superior to the HERG model in predicting Torsade de Pointes. Scientific Reports. 3, 2100 (2013).
- Rampe, D., Roy, M. -. L., Dennis, A., Brown, A. M. A mechanism for the proarrhythmic effects of cisapride (Propulsid): high affinity blockade of the human cardiac potassium channel HERG. FEBS Letters. 417 (1), 28-32 (1997).
- Girouard, S. D., Laurita, K. R., Rosenbaum, D. S. Unique properties of cardiac action potentials recorded with voltage-sensitive dyes. Journal of Cardiovascular Electrophysiology. 7 (11), 1024-1038 (1996).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Hou, J. H., Kralj, J. M., Douglass, A. D., Engert, F., Cohen, A. E. Simultaneous mapping of membrane voltage and calcium in zebrafish heart in vivo reveals chamber-specific developmental transitions in ionic currents. Frontiers in Physiology. 5, 344 (2014).
- Ronzhina, M., et al. Di-4-ANEPPS modulates electrical activity and progress of myocardial ischemia in rabbit isolated heart. Frontiers in Physiology. 12, 1-15 (2021).
- Beck, C., Gong, Y. A high-speed, bright, red fluorescent voltage sensor to detect neural activity. Scientific Reports. 9 (1), 15878 (2019).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Kovacs, G. T. A. Electronic sensors with living cellular components. Proceedings of the IEEE. 91 (6), 915-929 (2003).
- Tertoolen, L. G. J., Braam, S. R., van Meer, B. J., Passier, R., Mummery, C. L. Interpretation of field potentials measured on a multi electrode array in pharmacological toxicity screening on primary and human pluripotent stem cell-derived cardiomyocytes. Biochemical and Biophysical Research Communication. 497 (4), 1135-1141 (2018).
- Deo, M., Akwaboah, A., Tsevi, B., Treat, J. A., Cordeiro, J. M. Role of the rapid delayed rectifier K+ current in human induced pluripotent stem cells derived cardiomyocytes. Archives of Stem Cell and Therapy. 1 (1), 14-18 (2020).
- Hondeghem, L. M., Hoffmann, P. Blinded test in isolated female rabbit heart reliably identifies action potential duration prolongation and proarrhythmic drugs: importance of triangulation, reverse use dependence, and instability. Journal of Cardiovascular Pharmacology. 41 (1), 14-24 (2003).
- Dipalo, M., et al. Intracellular action potential recordings from cardiomyocytes by ultrafast pulsed laser irradiation of fuzzy graphene microelectrodes. Science Advances. 7 (15), (2021).
- . R: A language and environment for statistical computing: R Foundation for Statistical Computing Available from: https://www.r-project.org/ (2021)
- Wickham, H. . ggplot2: Elegant graphics for data analysis. , (2009).
- . tidyr: Tidy messy data: R package version 1.2.0 Available from: https://tidyr.tidyverse.org (2022)
- . dplyr: A grammar of data manipulation. R package version 1.0.6 Available from: https://tidyr.tidyverse.org (2021)
- Godfraind, T. Discovery and development of calcium channel blockers. Frontiers in Pharmacology. 8, 286 (2017).
- Vater, W., et al. Pharmacology of 4-(2'-nitrophenyl)-2,6-dimethyl-1,4-dihydropyridine-3,5-dicarboxylic acid dimethyl ester (Nifedipine, BAY a 1040). Arzneimittelforschung. 22 (1), 1-14 (1972).
- Kim, I., Boyle, K. M., Carroll, J. L. Postnatal development of E-4031-sensitive potassium current in rat carotid chemoreceptor cells. Journal of Applied Physiology. 98 (4), 1469-1477 (2005).
- Edwards, S. L., et al. A multiwell cardiac µGMEA platform for action potential recordings from human iPSC-derived cardiomyocyte constructs. Stem Cell Reports. 11 (2), 522-536 (2018).
- Fendyur, A., Spira, M. E. Toward on-chip, in-cell recordings from cultured cardiomyocytes by arrays of gold mushroom-shaped microelectrodes. Frontiers in Neuroengineering. 5, 21 (2012).
- Hayes, H. B., et al. Novel method for action potential measurements from intact cardiac monolayers with multiwell microelectrode array technology. Scientific Reports. 9 (1), 11893 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены