Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Kostengünstiges elektroenzephalographisches Aufzeichnungssystem in Kombination mit einer millimetergroßen Spule zur transkraniellen Stimulation des Mäusegehirns in vivo
In diesem Artikel
Zusammenfassung
Ein kostengünstiges elektroenzephalographisches Aufzeichnungssystem in Kombination mit einer millimetergroßen Spule wird vorgeschlagen, um die transkranielle Magnetstimulation des Mäusegehirns in vivo zu steuern. Unter Verwendung herkömmlicher Schraubenelektroden mit einem speziell angefertigten, flexiblen Multielektroden-Array-Substrat kann als Reaktion auf die transkranielle Magnetstimulation eine Multi-Site-Aufzeichnung aus dem Mäusegehirn durchgeführt werden.
Zusammenfassung
Ein kostengünstiges elektroenzephalographisches (EEG) Aufzeichnungssystem wird hier vorgeschlagen, um die transkranielle Magnetstimulation (TMS) des Mäusegehirns in vivo unter Verwendung einer millimetergroßen Spule zu steuern. Unter Verwendung herkömmlicher Schraubenelektroden in Kombination mit einem speziell angefertigten, flexiblen Multielektroden-Array-Substrat kann eine Multi-Site-Aufzeichnung aus dem Mäusegehirn durchgeführt werden. Darüber hinaus erklären wir, wie eine millimetergroße Spule mit kostengünstigen Geräten hergestellt wird, die normalerweise in Laboren zu finden sind. Des Weiteren werden praktische Verfahren zur Herstellung des flexiblen Multielektroden-Array-Substrats und die chirurgische Implantationstechnik für Schraubenelektroden vorgestellt, die notwendig sind, um rauscharme EEG-Signale zu erzeugen. Obwohl die Methodik für die Aufzeichnung aus dem Gehirn eines beliebigen Kleintieres nützlich ist, konzentriert sich der vorliegende Bericht auf die Elektrodenimplementierung in einem anästhesierten Mausschädel. Des Weiteren lässt sich diese Methode leicht auf ein waches Kleintier ausdehnen, das über einen gängigen Adapter mit angebundenen Kabeln verbunden und während der Aufnahme mit einem TMS-Gerät am Kopf fixiert wird. Die vorliegende Version des EEG-TMS-Systems, das maximal 32 EEG-Kanäle (als Beispiel wird ein Gerät mit 16 Kanälen mit weniger Kanälen vorgestellt) und ein TMS-Kanalgerät umfassen kann, wird beschrieben. Darüber hinaus werden typische Ergebnisse, die durch die Anwendung des EEG-TMS-Systems bei anästhesierten Mäusen erzielt wurden, kurz beschrieben.
Einleitung
Die transkranielle Magnetstimulation (TMS) ist aufgrund ihrer nicht-/geringen Invasivität ein vielversprechendes Werkzeug für die menschliche Hirnforschung, die klinische Anwendung und die Tiermodellforschung. In der Frühphase der TMS-Anwendungen war die Messung des kortikalen Effekts als Reaktion auf Einzel- und Paarpuls-TMS bei Mensch und Tier auf den motorischen Kortex beschränkt. Der leicht messbare Output war auf motorisch evozierte Potentiale und induzierte myoelektrische Potentiale beschränkt, die den motorischenKortex 1,2 einbeziehen. Um die Gehirnregionen, die durch TMS-Modulation gemessen werden können, zu erweitern, wurde die elektroenzephalographische (EEG) Aufzeichnung mit Einzel- und Paarpuls-TMS als nützliche Methode zur direkten Untersuchung der Erregbarkeit, Konnektivität und räumlich-zeitlichen Dynamik von Bereichen im gesamten Gehirn integriert 3,4,5. So wurde die gleichzeitige Anwendung von TMS und EEG-Aufzeichnung (TMS-EEG) auf das Gehirn genutzt, um verschiedene oberflächliche kortikale Hirnareale von Mensch und Tier zu untersuchen, um intrakortikale neuronale Schaltkreise zu untersuchen (siehe Tremblay et al.6). Darüber hinaus können TMS-EEG-Systeme verwendet werden, um zusätzliche kortikale raumzeitliche Eigenschaften zu untersuchen, einschließlich der Ausbreitung von Signalen an andere kortikale Areale und der Erzeugung oszillatorischer Aktivität 7,8.
Der Wirkmechanismus von TMS im Gehirn bleibt jedoch spekulativ, da TMS nicht invasiv ist und unser Wissen über die Funktionsweise des Gehirns bei TMS-Anwendungen einschränkt. Daher sind invasive translationale Studien an Tieren, von Nagetieren bis hin zum Menschen, von entscheidender Bedeutung, um den Mechanismus der Auswirkungen von TMS auf neuronale Schaltkreise und deren Aktivität zu verstehen. Insbesondere für kombinierte TMS-EEG-Experimente an Tieren wurde ein simultanes Stimulations- und Messsystem für Kleintiere nicht intensiv entwickelt. Daher sind Experimentatoren verpflichtet, ein solches System durch Versuch und Irrtum entsprechend ihren spezifischen experimentellen Anforderungen zu konstruieren. Darüber hinaus sind Mausmodelle neben anderen in vivo Tierartenmodellen nützlich, da viele transgene und stammisolierte Mäusestämme als biologische Ressourcen zur Verfügung stehen. Daher wäre eine bequeme Methode zum Aufbau eines TMS-EEG-kombinierten Messsystems für Mäuse für viele neurowissenschaftliche Forscher wünschenswert.
In dieser Studie wird eine TMS-EEG-kombinierte Methode vorgeschlagen, die zur gleichzeitigen Stimulation und Aufzeichnung des Mausgehirns eingesetzt werden kann, dem wichtigsten transgenen Tiertyp, der in der Forschung verwendet wird, und die leicht in typischen neurowissenschaftlichen Labors konstruiert werden kann. Zunächst wird ein kostengünstiges EEG-Aufzeichnungssystem beschrieben, das konventionelle Schraubenelektroden und ein flexibles Substrat verwendet, um in jedem Experiment reproduzierbar eine Elektrodenträgerposition zuzuweisen. Zweitens wird ein Magnetstimulationssystem mit einer millimetergroßen Spule konstruiert, die in typischen Labors leicht maßgefertigt werden kann. Drittens zeichnet das TMS-EEG-kombinierte System die neuronale Aktivität als Reaktion auf Schall- und Magnetstimulation auf. Die in dieser Studie vorgestellte Methode kann die Mechanismen aufdecken, die bestimmte Erkrankungen bei Kleintieren hervorrufen, und die in den Tiermodellen erzielten Ergebnisse können auf das Verständnis der entsprechenden menschlichen Erkrankungen übertragen werden.
Protokoll
In der vorliegenden Studie wurden alle Tierversuche nach dem Leitfaden der National Institutes of Health für die Pflege und Verwendung von Versuchstieren und mit Genehmigung des Institutional Animal Care and Use Committee der Universität Hokkaido durchgeführt. Für die vorliegende Studie wurden C57BL/6J-Mäuse, zwei männliche und drei weibliche Mäuse im Alter von 8 bis 10 Wochen, verwendet. Dies ist ein Terminalverfahren. Die Tiere wurden aus einer kommerziellen Quelle bezogen (siehe Materialtabelle).
1. Flexibles zweidimensionales Array-Design und -Konstruktion
- Bereiten Sie die erforderliche Anzahl von Miniatur-Schraubelektroden (rostfrei, SUS XM7; siehe Materialtabelle) mit den folgenden strukturellen Eigenschaften für die Verwendung als EEG-Aufzeichnungs- und Referenzelektroden vor: Nenndurchmesser, Halslänge und Kopfdurchmesser von 0,6 mm, 1,5 mm bzw. 1,1 mm (Abbildung 1A).
HINWEIS: In der vorliegenden Studie wurden 16 Miniatur-Schraubenelektroden verwendet. - Bereiten Sie eine Blaupause eines gedruckten Schaltplans auf einem flexiblen Substrat vor, indem Sie die folgenden Schritte ausführen.
- Erstellen Sie ein zweidimensionales (2D) Elektrodenpad-Muster auf einem flexiblen Substrat (Gesamtgröße, 41,2 mm × 19,9 mm; siehe Materialtabelle), damit die Schraubelektroden ausgelesen werden können. Entwerfen Sie die 2D-Elektrodenanordnung. Abbildung 1B zeigt die spezifischen Anordnungen, die in dieser Studie verwendet wurden, und die relativen Koordinaten von einem Basispunkt aus (Kreuz am Ursprung markiert [0, 0]).
ANMERKUNG: In der vorliegenden Studie war die Elektrodenplatzierung in lateral-medialer (horizontaler) Richtung länger als die in rostral-kaudaler (vertikaler) Richtung, um die neuronale Aktivität im auditorischen Kortex innerhalb der Temporallappen zu erfassen (Abbildung 1B). - Achten Sie darauf, dass für die EEG-Aufzeichnungselektroden jedes Kupferpad (siehe Materialtabelle) auf dem flexiblen Substrat eine Ringform mit einem Außendurchmesser von 1,3 mm und einem Innendurchmesser von 0,8 mm aufweist (Abbildung 1C, links). Machen Sie ein kleines Loch (0,8 mm Durchmesser) in der Mitte, damit jede Schraubelektrode durch das Substrat geführt werden kann. Bei den Referenzelektroden sollte jedes Kupferpad eine quadratische Form mit einer Seitenlänge von 1,4 mm haben; Machen Sie in ähnlicher Weise ein kleines Loch (0,8 mm Durchmesser) in die Mitte, damit jede Schraube durch das quadratische Pad auf dem Substrat geführt werden kann (Abbildung 1C, rechts).
- Um als nächstes einen oberflächenmontierbaren Steckverbinder (Abbildung 1D, links) zu löten, entwerfen Sie Auslesepads (2D-Array), die zum Steckverbinder führen (Abbildung 1D, rechts). Verwenden Sie z. B. einen Steckverbinder mit 2 × 10 Pins und einem Raster von 1,27 mm zwischen benachbarten Pins (Abbildung 1D, rechts).
- Verdrahten Sie die Schraubelektrodenpads und Steckerpads sowohl mit der Oberflächen- als auch mit der Rückseitenschicht mit einer Linienbreite von 0,03 mm und einem Linienabstand von 0,03 mm (dünne Linien in Abbildung 1E).
- Um die Referenz- und Massekanäle mit dem Verstärker zu verbinden, verbinden Sie außerdem die Elektrodenpads für die Referenz- und Masseelektroden mit dem isolierten Teil an der Außenseite des flexiblen 2D-Arrays (zwei vertikale Rechtecke, die durch "G" und "HR" am unteren Rand von Abbildung 1E gekennzeichnet sind). Denken Sie nach der Bestimmung der Referenz- und Massekanäle daran, die Elektrodenpads an die entsprechenden Anschlüsse zu löten (siehe Schritt 2.1).
- Entwerfen Sie einen exponierten Bereich, der nicht mit einer Schutzschicht (Polyimidschicht) bedeckt ist, ordnungsgemäß. Legen Sie die Anschlusspads in der Oberflächenschicht frei, während Sie die Schraubelektrodenpads sowohl in der Oberflächen- als auch in der Rückschicht freilegen. Das gesamte Elektrodendesign, die Größen und das hergestellte flexible 2D-Array sind in Abbildung 1E dargestellt, und das Bild eines hergestellten Substrats ist in Abbildung 1F dargestellt.
- Im oberen Elektrodenteil (Kopfteil) des flexiblen 2D-Arrays ist darauf zu achten, dass sich der dreischichtige Aufbau von oben nach unten aus einer Gesamtdicke von 49,0 μm zusammensetzt: einer oberen Kupferschicht (12,0 μm Dicke), einer mittleren Schicht aus Kernpolyimid (25,0 μm) und einer unteren Kupferschicht (12,0 μm) (Abbildung 1G, oben).
- Ätzen Sie die Kupferschichten auf die Ober- und Unterseite des Substrats, z. B. mit Nassätzen und der Standardherstellungstechnik9.
- Stellen Sie im unteren quadratischen Pad-Teil (Verbindungsteil) des flexiblen 2D-Arrays sicher, dass der sechsschichtige Aufbau aus drei Schichten besteht, darunter eine obere Kupferschicht (12,0 μm Dicke), eine mittlere Kernpolyimidschicht (25,0 μm) und eine untere Kupferschicht (12,0 μm), die von schützenden Polyimidschichten einschließlich der oberen und unteren (beide 12,5 μm) Schichten begrenzt sind. Befestigen Sie eine 2 mm Polyimidplatte von unten als Verstärkungsmaterial (Bild 1G, unten).
Anmerkungen: Um die Flexibilität zu erhalten, wird die verstärkende Polyimidplatte nicht am Halsteil des flexiblen 2D-Arrays zwischen Kopf und Verbindungsteil montiert. - In ähnlicher Weise ätzen Sie im Verbindungsteil die Kupfer- und Polyimid-Schutzschichten auf die Oberseite mit Nassätzen und der Standardherstellungstechnik.
HINWEIS: Das Gesamtgewicht des hergestellten, flexiblen 2D-Array-Geräts, einschließlich des Steckers, beträgt 0,84 g. Nach dem Entwerfen eines Layouts für ein flexibles 2D-Array werden manchmal die Substrate eines kommerziellen Herstellers (siehe Materialtabelle) der Einfachheit halber empfohlen.
- Erstellen Sie ein zweidimensionales (2D) Elektrodenpad-Muster auf einem flexiblen Substrat (Gesamtgröße, 41,2 mm × 19,9 mm; siehe Materialtabelle), damit die Schraubelektroden ausgelesen werden können. Entwerfen Sie die 2D-Elektrodenanordnung. Abbildung 1B zeigt die spezifischen Anordnungen, die in dieser Studie verwendet wurden, und die relativen Koordinaten von einem Basispunkt aus (Kreuz am Ursprung markiert [0, 0]).
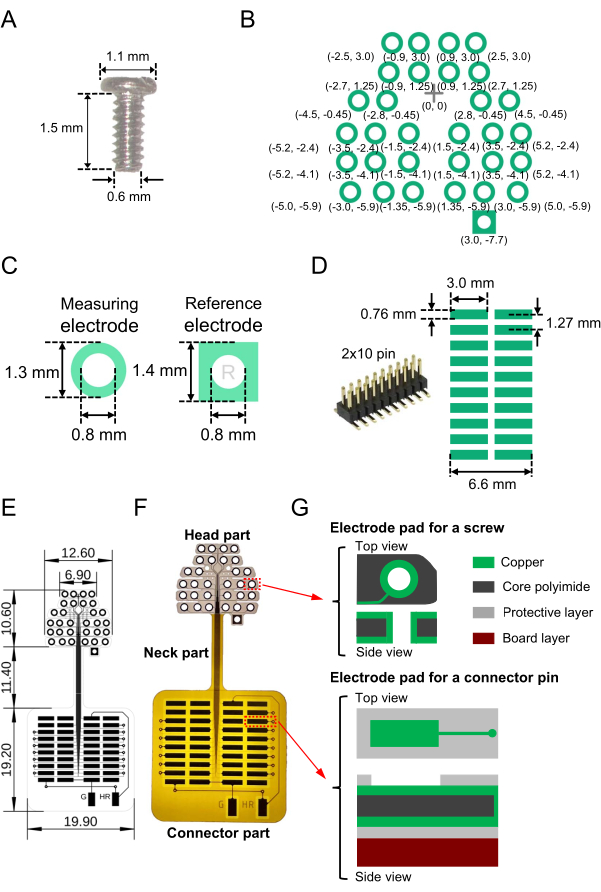
Abbildung 1: Bestandteile des flexiblen zweidimensionalen (2D) Arrays für die elektroenzephalographische (EEG) Aufzeichnung und die hergestellte Vorrichtung einschließlich des Arrays. (A) Die Miniatur-Schraubenelektrode, die in den Mausschädel eingebettet ist. (B) Die entworfenen Elektrodenpads zur Messung der Gehirnaktivität (grüne Kreise) und der Referenzkanal (Quadrat unten rechts). Die relativen Koordinaten der Elektrodenpads von einem Referenzpunkt (Kreuzmarkierung) am Ursprung (0, 0) werden angezeigt; Die Größe in Millimetern ist in Klammern angegeben. Die Mittelkoordinaten der Elektrodenpads sind symmetrisch zur vertikalen Achse, die durch die Kreuzmarkierung verläuft. (C) Die Elektrodenpads und Bohrungen für eine Aufzeichnungselektrode (links) und eine Referenzelektrode (rechts) sind dargestellt. (D) Ein oberflächenmontierbarer Steckverbinder (2 × 10 Pins), der für das flexible 2D-Array (links) und das Muster und die Größe der entworfenen Pads auf dem Substrat (rechts) verwendet wird. (E) Entworfene Blaupause mit der Größe jedes Teils in Millimetern. (F) Bild eines hergestellten Substrats, das durch den Bauplan in E gekennzeichnet ist. (G) Der Schichtaufbau des flexiblen 2D-Arrays (Kopf- und Anschlussteile). Die Drauf- und Seitenansichten der Schraubelektrodenpads (oben) und der Auslesepads (unten) sind abgebildet. Der Kopf und die Verbindungsteile bestehen aus einem dreischichtigen Aufbau (oben) bzw. einem sechsschichtigen Aufbau (unten). Zusätzlich besteht das Halsteil aus einer fünfschichtigen Struktur; Auf der Ober- und Rückseite ist eine schützende Polyimidschicht angebracht, und die verstärkende Polyimidplatte ist nicht auf dem Halsteil montiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. Adapterkonstruktion und Kanalzuordnung
- Führen Sie die Adapterkonstruktion durch, indem Sie die folgenden Schritte ausführen.
- Verteilen Sie das Lötflussmittel auf den 2- × 10-poligen SMD-Steckverbinder (Abbildung 1D, links) und die Anschlusspads des 2D-Arrays (Abbildung 1D, rechts) (siehe Materialtabelle) auf dem flexiblen Substrat.
- Löten Sie den 2- × 10-poligen SMD-Steckverbinder an die Anschlusspads. Bestätigen Sie insbesondere die Verbindung zwischen den beiden Pads im unteren Teil des 2D-Arrays und den beiden Anschlusspins, die als Referenz- und Massekanäle verwendet werden (Abbildung 2A).
- Verbinden Sie jedes der beiden Pads mit einzelnen Anschlussdrähten, um Basissignale an einen externen Punkt zu leiten (z. B. einen Massepunkt, der mit dem Massekanal des Messsystems verbunden ist; Abbildung 2A).
HINWEIS: In dieser Studie wurde jedoch eines der kreisförmigen Elektrodenpads mit Schraubelektroden anstelle einer quadratischen Elektrode im Steckerteil als Referenzelektrode verwendet. - Decken Sie die Lötstellen nach dem Löten mit Epoxidharz ab (siehe Materialtabelle), um die exponierten Stellen zu schützen und Kurzschlüsse zu vermeiden.
- Stecken Sie das Anschlusskabel und den Kopfverstärker an, indem Sie die folgenden Schritte ausführen.
- Bereiten Sie einen Schneidklemmverbinder (IDC) mit 2 × 10 Pins und einem Raster von 1,27 mm (Abbildung 2B, oben links) und ein flaches 20-poliges Flachbandkabel (siehe Materialtabelle) mit einem Raster von 0,635 mm vor (Abbildung 2B, unten links). Schneiden Sie das Flachbandkabel auf die gewünschte Länge (z.B. 40 cm) zu.
- Crimpen Sie den IDC und ein Ende des Flachbandkabels mit einer IDC-Crimpzange (Abbildung 2B, oben rechts) (siehe Materialtabelle).
- Trennen Sie jede Leitung des anderen Endes des Kabels mit einem Cutter bis ca. 15 mm vom Spitzenende ab. Entfernen Sie die Isolierung 3 mm vom Spitzenende entfernt.
- Verbinden Sie den gecrimpten IDC mit dem Flachbandkabel und dem 2- × 10-poligen Stecker, der mit dem flexiblen Substrat verlötet ist (Abbildung 2C).
- Bestätigen Sie die Übereinstimmung zwischen der Aufzeichnungselektrode und der getrennten Leitung des Kabels. Stellen Sie sicher, dass jede verwendete Leitung keinen falschen Verbindungsfehler erzeugt.
- Löten Sie die freiliegenden Kupferdrähte der einzelnen Leitungen, die dem Ausgang jeder Elektrode entsprechen, an den 20-poligen Stecker (Raster 1,25 mm) des Messsystems einschließlich des Hauptverstärkers (Abbildung 2B, unten rechts).
- Bestätigen Sie nach dem Löten die Leitung zwischen den Schraubelektrodenpads und den Steckerstiften mit einem Prüfgerät (z. B. einem LCR-Messgerät; siehe Materialtabelle).
- Decken Sie die Lötstellen mit Epoxidharz und Abschirmband ab, um sie vor Beschädigungen zu schützen und den Kontakt mit anderen Signalleitungen zu verhindern.
- Kleben Sie mit Epoxidharz einen dünnen Edelstahlstab (Durchmesser: 1,1-1,2 mm; Länge: 100 mm) auf die Rückseite des Steckerteils des 2D-Arrays auf dem flexiblen Substrat.
HINWEIS: Dieser Edelstahlstab kann während der Experimente von einem Mikromanipulatorhalter gegriffen werden (Abbildung 2C). - Bestätigen Sie abschließend die Zuordnung zwischen den Schraubenelektroden und den Signalausgangskanälen (Abbildung 2D).
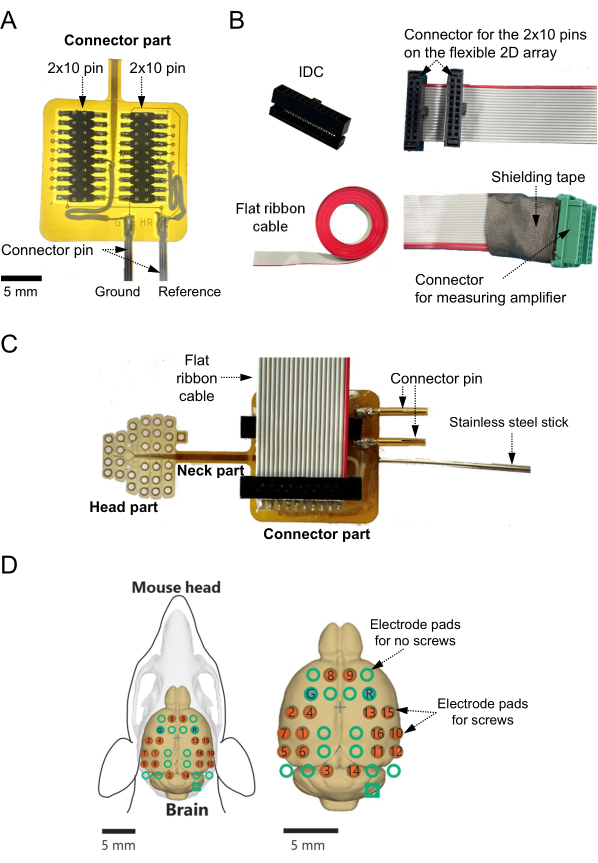
Abbildung 2: Aufbau des Adapters für ein zweidimensionales (2D) Elektrodenarray auf dem flexiblen Substrat und Aufzeichnungskanal-Mapping. (A) Im Steckerteil sind die Referenz- und Massekanäle mit Anschlussdrähten mit den unteren Elektrodenpads verbunden. Wenn die Referenz- und Massekanäle im Voraus festgelegt werden, sollten die Kanäle während der Entwurfsphase mit den entsprechenden unteren Elektrodenpads verbunden werden. In solchen Fällen ist das Anlöten von Anschlussdrähten an die Kanäle und Elektrodenpads nicht erforderlich. (B) Schneidklemmverbinder (oben links) werden an ein Ende des Flachbandkabels (unten links) gecrimpt, um den Messverstärkerstecker (oben rechts) zu verbinden. Alle Leitungen, die den zu verwendenden Kanälen entsprechen, werden an die grünen Stecker (unten rechts) angelötet. Da in diesem Fall jeder grüne Anschluss, der mit dem Kopfverstärker verbunden ist, für eine achtkanalige Messung zugewiesen ist, werden mindestens zwei Anschlüsse benötigt, um 16-Kanal-Gehirnaktivitätssignale aufzuzeichnen. Die Lötstellen sind mit Epoxidharz und Abschirmband abgedeckt, um den Kontakt mit anderen Signalleitungen zu verhindern. (C) Der Steckverbinder und das konfektionierte Kabel werden auf der Oberfläche des flexiblen 2D-Array-Substrats platziert. Der dünne Edelstahlstab wird auf der Rückseite des flexiblen Substrats befestigt. (D) Die räumlichen Positionen der Aufzeichnungskanäle auf der Oberfläche des Mausgehirns und die Kanalkarten für jeden Punkt für das Messsystem werden angezeigt. In diesem Fall gibt es 16 Aufnahmekanäle mit Schraubelektroden (rote Kreise), obwohl die Gesamtzahl der möglichen Aufnahmestellen 32 beträgt. Die anderen 16 nicht aufzeichnenden Kanäle werden ebenfalls als grüne Kreise auf der Gehirnoberfläche angezeigt. Im Mapping-Diagramm bezeichnen "G" und "R" die Kanäle, die für Masse- bzw. Referenzelektroden ausgelegt sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Tierchirurgie
- Bereiten Sie die sterile chirurgische Umgebung vor.
- Tragen Sie Schutzausrüstung, wie z. B. Latexhandschuhe, während des gesamten Versuchs mit Tieren.
- Sterilisieren Sie das stereotaktische Gerät und die chirurgischen Instrumente (siehe Materialtabelle).
- Waschen Sie die chirurgischen Instrumente nach der Sterilisation mit steriler Kochsalzlösung.
- Betäuben Sie die Tiere.
- Messen Sie das Gewicht der Maus vor der Operation. Verabreichung von Atropinsulfat (0,04 mg/kg; siehe Materialtabelle) durch intraperitoneale Injektion.
- Anästhesieren Sie die Maus durch eine intraperitoneale Injektion einer Mischung aus Medetomidin (0,3 mg/kg), Midazolam (4,0 mg/kg) und Butorphanol (5,0 mg/kg).
- Bestätigen Sie die Narkosetiefe durch das Ansprechverhalten durch Zusammendrücken des Zehs.
HINWEIS: Die Anästhesie lässt nach ca. 40 Minuten nach. Wenn die Maus auf ein Einklemmen der Zehen reagiert, verabreichen Sie die gleiche Dosis der Anästhesiemischung über eine intraperitoneale Injektion.
- Bereiten Sie sich auf die Elektrodenimplantation vor.
- Schneiden Sie die Schnurrhaare der Maus ab, um ein haptisches Gefühl zu vermeiden.
- Befeuchten Sie beide Augen mit einer Augensalbe, um ein Austrocknen zu verhindern. Schließen Sie die Augenlider, um den Sehsinn zu behindern, und halten Sie den Verschluss aufrecht, indem Sie die oberen und unteren Augenlider mit Klebeband verkleben.
- Rasieren Sie die Haare auf dem Kopf der Maus mit einer elektrischen Haarschneidemaschine. Führen Sie ein Thermometer in den Enddarm ein und halten Sie die Körpertemperatur mit einem Heizkissen auf 37 °C.
- Verabreichen Sie Lidocainhydrochlorid als topisches Lokalanästhetikum an den Teil der Mauskopfhaut, der eingeschnitten werden soll.
- Die Kopfhaut der Maus mit einem Skalpell oder einer chirurgischen Schere rostral bis kaudal einschneiden (Flächengröße: 7 × 10 mm2).
- Drücken Sie die Kopfhaut in der Nähe des eingeschnittenen Teils mit einer Pinzette zusammen und heben Sie sie an. Entfernen Sie die sichtbare Membran am Schädel mit einem Skalpell oder einer chirurgischen Schere. Brechen Sie während der Operation nicht die Blutgefäße um die Augen herum.
- Fassen Sie die Haut in der Nähe beider Zentren der Schnittlinie der Kopfhaut mit einer Pinzette und erweitern Sie den eingeschnittenen Teil, um die Oberseite des Schädels weit freizulegen.
- Bestätigen Sie die vollständige Entfernung aller Membranen auf der Oberfläche des Schädels und des Gewebes um Lambda mit einer chirurgischen Schere.
- Befeuchten Sie die Schädeloberfläche mit physiologischer Kochsalzlösung, um die Sichtbarkeit der Gehirnoberfläche unter dem Schädel zu verbessern und den Sinus transversum zu lokalisieren.
HINWEIS: Denken Sie bei der Implantation von Schraubenelektroden in den Schädel daran, diese nicht über und in den Sinus transversum einzubetten.
4. Elektrodenimplantation
- Befestigen Sie den Edelstahlstab, der am 2D-Elektrodenarray auf der Rückseite des flexiblen Substrats montiert ist, an einem Mikromanipulator. Legen Sie das flexible Substrat auf den Schädel.
- Passen Sie die Position der Kanäle (Chs) 3 und 14 (Abbildung 2D) auf dem Array so an, dass sie in den Colliculus inferior passen.
HINWEIS: Der Colliculus inferior befindet sich entlang des Sinus transversum. Wir empfehlen, die Lage des Colliculus inferior vorab anhand eines Maushirnatlas zu bestätigen. - Zeichne kleine Kreise an den Positionen von Kapitel 3, 8, 9 und 14 (Abbildung 2D) auf den Schädel mit einem Permanentmarker, um ihn als Zielmarkierungen zu verwenden.
- Trocknen Sie die Schädeloberfläche, um die Haftung am Zahnzement zu verbessern und den 2D-Elektrodenträger auf dem flexiblen Substrat elektrisch vom Mausschädel zu isolieren.
- Tragen Sie Zahnzement (ca. 1 mm Dicke; siehe Materialtabelle) auf die Schädeloberfläche auf. Warten Sie nach dem Auftragen des Zahnzements ca. 30 Minuten, bis er ausgehärtet ist.
- Richten Sie das flexible Substrat entsprechend den kleinen kreisförmigen Markierungen auf der Oberfläche des Schädels aus.
- Richten Sie die Spitze eines Dentalbohrers an jedem Elektrodenpad-Loch auf dem flexiblen Substrat aus. Bohren Sie vorsichtig durch jedes der Elektrodenpad-Löcher in den Schädel.
- Schrauben Sie jede der Miniatur-Schraubenelektroden mit einem speziellen Schraubendreher für Miniaturschrauben durch die gebohrten Löcher im Schädel.
- Crimpen Sie den Kopf der Schraubelektrode und das Elektrodenpad fest. Messen Sie schließlich den Leitwert zwischen jeder Schraubelektrode und dem Stecker mit einem Prüfgerät (z. B. einem LCR-Messgerät), um die elektrische Leitfähigkeit zu bestätigen.
5. Design und Konstruktion kleiner Spulen
- Entwerfen Sie eine Donut-förmige Scheibe (siehe Ergänzende Kodierungsdatei 1) mit einem Loch in der Mitte (Innendurchmesser: 2 mm; Außendurchmesser: 7 mm; Dicke: 1 mm) mit einer CAD-Software (Computer-Aided Design) (siehe Materialtabelle).
- Drucken Sie mit einem 3D-Drucker zwei Scheiben (Abbildung 3A, links) aus nicht hitzebeständigem Material (z. B. Polymilchsäurefilament); Nicht immer ist ein nicht hitzebeständiges Material erforderlich (siehe unten).
- Schneiden Sie einen Stab aus Permalloy-45 (Durchmesser: 2 mm; siehe Materialtabelle) zu einem kurzen Schaft (Länge: 60 mm) ab.
- Stecken Sie den Schaft in jedes Loch der beiden 3D-gedruckten Scheiben (Abbildung 3A, rechts). Platzieren Sie eine Scheibe am Ende der Welle und die andere 11 mm vom Ende entfernt, wodurch ein Abstand von 10 mm zwischen den beiden Scheiben entsteht. Verkleben Sie die Scheiben mit Sekundenkleber (siehe Materialtabelle).
- Befestigen Sie das Ende der Welle ohne Scheibe an einem Schlagschrauber (Abbildung 3B). Befestigen Sie einen kleinen Magneten an der Permalloy-45-Welle. Platzieren Sie einen Hall-Effekt-Sensor in der Nähe des Magneten 5 mm von der Welle entfernt. Schließen Sie den Hall-Effekt-Sensor an ein Datenerfassungssystem (DAQ; siehe Materialtabelle) an.
- Um die Anzahl der Windungen zu zählen, bereiten Sie ein Computerprogramm vor (siehe Materialtabelle), das die Ausgangssignale des Hall-Effekt-Sensors über das Datenerfassungssystem analysiert.
- Verbinden Sie einen dünnen Kupferdraht (Durchmesser: 0,16 mm) mit der Welle und kleben Sie ihn mit Sekundenkleber am oberen Ende des Drahtes fest.
- Wickeln Sie den Kupferdraht mit dem Schlagschrauber 1.000 Umdrehungen zwischen den beiden Scheiben auf. Obwohl die Rotationsgeschwindigkeit willkürlich ist, werden in der Regel etwa 5 Umdrehungen pro Sekunde verwendet. Kleben Sie dann mit Sekundenkleber auf den gewickelten Draht.
- Lösen Sie die beiden Scheiben von der Welle. Wenn die Scheiben stark an der Welle haften, schmelzen Sie die Scheiben mit einer Heißluftpistole.
- Decken Sie die Spule mit Epoxidharz ab, um die Oberfläche zu isolieren und zu sichern. Schneiden Sie dann den abgewickelten Wellenteil als Überschuss ab.
- Stellen Sie sicher, dass die erhaltene Spule eine Höhe von 10 mm und einen Durchmesser von 6 mm hat (Abbildung 3B, links). Für die Spulenmanipulation konstruieren Sie entweder einen Spulenhalter (Abbildung 3C, rechts) oder kleben Sie einen Edelstahlstab auf die Spule (hier nicht gezeigt).
- Messen Sie den Widerstand und die Induktivität der Spule mit einem LCR-Messgerät (siehe Materialtabelle). So hatte die hier verwendete Spule einen Gleichstromwiderstand (DC) von 18,3 Ω und eine Induktivität von 7,9 mH bei 1 kHz Wechselstromeingang (AC). Die AC-Eigenschaften (Widerstand und Induktivität) sind in Abbildung 3D dargestellt.
- Verwenden Sie einen Funktionsgenerator, um eine bipolare Rechteckwelle auf die Spule anzuwenden. Die typische Amplitude der Eingangsspannung beträgt 20 V über ein bipolares Netzteil mit 10-facher Verstärkung, gefolgt von einem 2-V-Generatorausgang. Die resultierende Wellenform ist eine bipolare Rechteckwelle mit einer ungefähren Amplitude von 20 V (d. h. einer Spitze-Spitze-Spannung von 40 V) (Abbildung 3E).
- Messen Sie die magnetische Flussdichte mit dem Hall-Effekt-Sensor und dem Datenerfassungssystem. In diesem Fall betrug beispielsweise die magnetische Flussdichte (B) der Spule 113,6 ±2,5 mT (Mittelwert ± REM), wenn der Spulenboden in Kontakt mit dem Hall-Effekt-Sensor stand (Abbildung 3F).
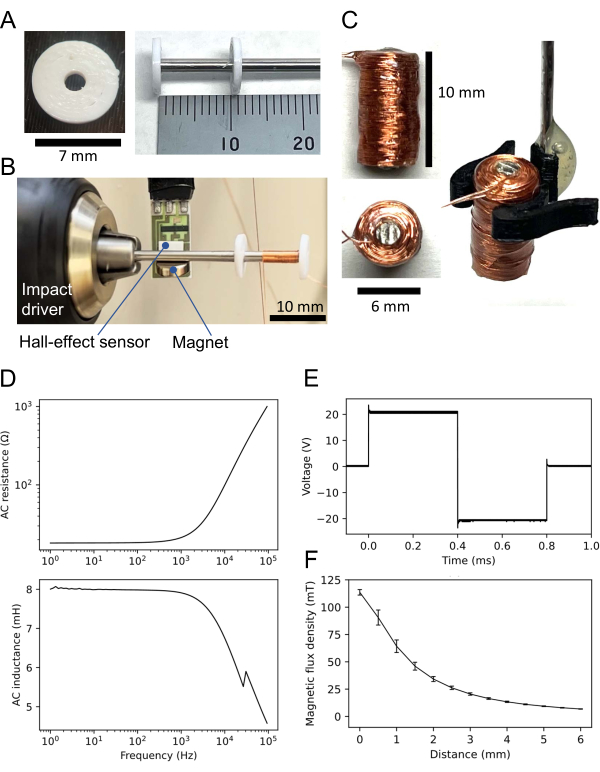
Abbildung 3: Kleine Spule für die Magnetstimulation. (A) Dreidimensionale (3D)-gedruckte Scheibe (links). Zwei identische Scheiben sind auf die Permalloy-45-Welle geklebt; Einer befindet sich am Ende des Schaftes, der andere ist 10 mm entfernt (rechts). (B) Einrichtung zum Aufwickeln der Spule. Der 60 mm Schaft mit den beiden Scheiben ist an einem Schlagschrauber befestigt. Ein Hall-Effekt-Sensor befindet sich in der Nähe des kleinen Magneten, der an der Welle befestigt ist. Der Kupferdraht wird zwischen den beiden Scheiben gewickelt. (C) Konstruierte Spule. Die Spule ist 10 mm hoch, hat einen Durchmesser von 6 mm und hat 1.000 Windungen Kupferdraht. Die rechte Seite der Abbildung zeigt die Spule, die von einem 3D-gedruckten Spulenhalter manipuliert wird. (D) Wechselstromeigenschaften der Spule, die von einem LCR-Messgerät aufgezeichnet werden: (oberer) Widerstand über Frequenz des sinusförmigen Eingangs; (unten) Induktivität versus Eingangsfrequenz. Eine typische Spule hat einen Widerstand und eine Induktivität von 21,6 bzw. 7,9 mH bei 1 kHz Wechselstromeingang. (E) Biphasische rechteckige Wellenform, die als Spuleneingang verwendet wird, der von einem Oszilloskop aufgezeichnet wird. (F) Zusammenhang zwischen der magnetischen Flussdichte und dem Abstand zwischen einer konstruierten Spule und dem Hall-Effekt-Sensor. Die magnetische Flussdichte wurde von fünf verschiedenen Hall-Effekt-Sensoren erfasst, einmal für jeden Sensor. Der Durchschnitt von fünf Messungen wird grafisch dargestellt, und Fehlerbalken stellen die Standardfehler des Mittelwerts dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
6. Signalaufzeichnungssystem und -verfahren
- Verbinden Sie das flexible 2D-Array mit dem Flachbandkabel mit dem Aufzeichnungssystem (siehe Materialtabelle).
- Befestigen Sie den auf der Spule montierten Edelstahlstab an einem Mikromanipulator (siehe Materialtabelle).
- Platzieren Sie die Spule über dem Bregma und passen Sie die Position in kaudaler Richtung an, um den Brennpunkt über dem Colliculus inferior zu lokalisieren. Der Brennpunkt des aussendenden elektrischen Feldes ist die Mittellinie des gewickelten Bereichs auf der Unterseite der Spule (d. h. 1 mm vom Rand zur Mitte).
- Bereiten Sie ein Stimulationssystem vor, das aus einem bipolaren Netzteil und einem Funktionsgenerator besteht (siehe Materialtabelle) und schließen Sie die Spule an das System an.
- Schließen Sie ein Kabel zwischen der Eingangsklemme des Funktionsgenerators und der Ausgangsklemme des Datenerfassungssystems an, um Triggersignale vom Datenerfassungssystem an den Funktionsgenerator anzulegen. Bereiten Sie ein geeignetes Computerprogramm für Triggersignale vor, um Reize auszulösen. Schließen Sie außerdem das Datenerfassungssystem an das Aufzeichnungssystem an, um die Stimulationszeiten als Zeitstempel zu speichern.
- Starten Sie den Erfassungsprozess für das Aufzeichnungssystem.
Anmerkungen: Wenn das Aufnahmesystem Rauschen aufnimmt, suchen Sie die Quelle des Rauschens und reduzieren Sie sie. - Testen Sie die Magnetstimulation, indem Sie das Stimulationssystem auslösen.
Anmerkungen: Wenn das durch die Magnetstimulation erzeugte Rauschen den Messbereich sättigt, stellen Sie den Bereich richtig ein. Vergewissern Sie sich außerdem, dass das Aufzeichnungssystem die Stimulationszeitstempel ordnungsgemäß speichert. - Beginnen Sie mit der Aufzeichnung der Antwortdaten und beginnen Sie mit den Stimulationssitzungen. Stoppen Sie die Aufnahme, wenn jede Stimulationssitzung abgeschlossen ist. Speichern Sie alle aufgezeichneten Daten für die spätere Analyse.
HINWEIS: Um beispielsweise alle Versuchsbedingungen mit fünf verschiedenen magnetischen Intensitäten durchzuführen, betrug die Gesamtzeit für alle Sitzungen etwa 75 Minuten. Der Endpunkt wurde in der Regel festgelegt, nachdem alle Aufzeichnungssitzungen beendet waren. Als die Tiere jedoch klinische Symptome wie Husten, Atemnot und Keuchen zeigten, wurde die Versuchssitzung sofort beendet. Bei der Euthanasie wurde die Enthauptung mit einer scharfen, sauberen Schere durchgeführt, während die Tiere unter Narkose standen.
7. Datenanalyse
- Filtern Sie das Breitbandsignal (RAW) mit einem Tiefpassfilter mit einer Grenzfrequenz von 200 Hz.
- Erfassen Sie gefilterte Wellenformen während eines Zeitfensters um jeden Stimulationszeitstempel. Mittelung der Signale, um die Signale des ereigniskorrelierten Potentials (ERP) zu erhalten (Abbildung 4 und Abbildung 5).
Ergebnisse
Beispielhafte EEG-Daten, die in anästhesierten C57BL/6J-Mäusen mit dem flexiblen Substrat in Kombination mit den Schraubenelektroden aufgezeichnet wurden, sind unten dargestellt.
Als typisches Beispiel werden die durchschnittlichen EEG-Wellenformen gezeigt, die als Reaktion auf Schallstimulation erzeugt werden (8 kHz Tone-Burst, 80 dB Schalldruckpegel [SPL]) für 60 Versuche mit identischen Stimuli (Abbildung 4A). Ein Schema der Zuordnung von Aufzeichnungskanäl...
Diskussion
Diese Studie befasst sich mit einem Multi-Site-EEG-Aufzeichnungssystem in Kombination mit einem Magnetstimulationssystem, das für Kleintiere, einschließlich Mäuse, entwickelt wurde. Das konstruierte System ist kostengünstig und einfach in physiologischen Labors zu konstruieren und kann deren bestehende Messaufbauten erweitern. Das chirurgische Verfahren, das notwendig ist, um Daten aus dem Maus-Aufzeichnungssystem zu erhalten, ist denkbar einfach, wenn solche Labore bereits Erfahrung mit elektrophysiologischen Standa...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde von der Murata Science Foundation, der Suzuken Memorial Foundation, der Nakatani Foundation for Advancement of Measuring Technologies in Biomedical Engineering und einem Grant-in-Aid for Exploratory Research (Fördernummer 21K19755, Japan) und für wissenschaftliche Forschung (B) (Fördernummer 23H03416, Japan) an T.T.
Materialien
| Name | Company | Catalog Number | Comments |
| 3D printer | Zhejiang Flashforge 3D Technology Co., Ltd | FFD-101 | The printer used for 3D-printing the donut-shaped disks |
| ATROPINE SULFATE 0.5 mg | NIPRO ES PHARMA CO., LTD. | - | Atropine sulfate |
| Bipolar amplifier | NF Corp. | KIT61380 | For amplifying waveforms for coil input |
| Butorphanol | Meiji Seika Pharma Co., Ltd., Tokyo, Japan | - | For anathesis of animals |
| Commercial manufacturer of flexible 2D array | p-ban.com Corp. | - | URL: https://www.p-ban.com/ |
| Computer prograom to analyze output signals | Natinal Instruments | NI-DAQ and NI-DAQmx Python | To analyze output signals from the hall-effect sensor |
| Connector | Harwin Inc. | G125-FV12005L0P | For connector to conect to the measuring system |
| Copper pad | p-ban.com Corp. | copper | Copper pad on each substrate |
| Copper wire | Kyowa Harmonet Ltd. | P644432 | The windings of the coil |
| DAQ board | National Instruments Corp. | USB-6343 | For measuring the magnitic flux density of the coil |
| Dental cement | SHOFU INC. | Quick Resin | Self-Curing Orthodontic Resin |
| ECoG electrode | NeuroNexus Inc. | HC32 | For reference to design of the flexible 2D array |
| Epoxy resin | Konishi Co. Ltd. | #16123 | For coil construction |
| Ethyl Carbamate | FUJIFILM Wako Pure Chemical Corp. | 050-05821 | For urethan anesthesia |
| Flat ribbon cable | Oki Electric Cable Co., Ltd. | FLEX-B2(20)-7/0.1 20028 5m | For cable to connect between surface-mount connector and measuring sysytem |
| flexible substrate | p-ban.com Corp. | polyimide | Baseplate of flexible substrate |
| Function generator | NF Corp. | WF1947 | For generating waveforms for coil input |
| Hall-effect sensor | Honeywell International Inc. | SS94A2D | For measuring the magnitic flux density of the coil |
| IDC crimping tool | Pro'sKit Industries Co. | 6PK-214 | To crimp the IDC and one end of the flat ribbon cable; Flat cable connector crimping tool |
| Instant glue | Konishi Co. Ltd. | #04612 | For coil construction |
| Insulation-displacement connector (IDC ) | Uxcell Japan | B07GDDG3XG | 2 × 10 pins and a 1.27 mm pitch |
| LCR meter | NF Corp. | ZM2376 | For measuring the AC properties of the coil |
| Manipulator | NARISHIGE Group. | SM-15L | For manipulating the coil |
| Medetomidine | Kobayashi Kako, Fukui, Japan | - | For anathesis of animals |
| Midazolam | Astellas Pharma, Tokyo, Japan | - | For anathesis of animals |
| Miniature screw | KOFUSEIBYO Co., Ltd. | S0.6*1.5 | For EEG-senseing and reference electrode |
| Mouse | Japan SLC, Inc. | C57BL/6J (C57BL/6JJmsSlc) | Experimental animal |
| Permalloy-45 rod | The Nilaco Corp. | 780544 | The core of the coil |
| Recording system | Plexon Inc. | OmniPlex | For EEG data acquisition |
| Stainless wire | Wakisangyo Co., Ltd. | HW-136 | For grasp by manipulator |
| Stereotaxic apparatus | NARISHIGE Group. | SR-5M-HT | To fix a mouse head |
| Surface-mount connector | Useconn Electronics Ltd. | PH127-2x10MG | For connector to mount on the flexible 2D array |
| Testing equipment (LCR meter) | NF Corp. | ZM2372 | Contact check and impedance measurements |
| White PLA filament | Zhejiang Flashforge 3D Technology Co., Ltd | PLA-F13 | The material used for 3D-printing the donut-shaped disks |
| Xylocaine Jelly 2% | Sandoz Pharma Co., Ltd. | - | lidocaine hydrochloride |
Referenzen
- Ilmoniemi, R. J., et al. Neuronal responses to magnetic stimulation reveal cortical reactivity and connectivity. Neuroreport. 8 (16), 3537-3540 (1997).
- Hallett, M. Transcranial magnetic stimulation: a primer. Neuron. 55 (2), 187-199 (2007).
- Thut, G., Pascual-Leone, A. Integrating TMS with EEG: How and what for. Brain Topography. 22 (4), 215-218 (2010).
- Ilmoniemi, R. J., Kicic, D. Methodology for combined TMS and EEG. Brain Topograpy. 22 (4), 233-248 (2010).
- Daskalakis, Z. J., Farzan, F., Radhu, N., Fitzgerald, P. B. Combined transcranial magnetic stimulation and electroencephalography: its past, present and future. Brain Research. 1463, 93-107 (2012).
- Tremblay, S., et al. Clinical utility and prospective of TMS-EEG. Clinical Neurophysiology. 130 (5), 802-844 (2019).
- Pellicciari, M. C., Veniero, D., Miniussi, C. Characterizing the cortical oscillatory response to TMS pulse. Frontiers in Cellular Neuroscience. 11, 38 (2017).
- Lin, Y. J., Shukla, L., Dugue, L., Valero-Cabre, A., Carrasco, M. Transcranial magnetic stimulation entrains alpha oscillatory activity in occipital cortex. Scientific Reports. 11 (1), 18562 (2021).
- Takahashi, S., et al. Laminar responses in the auditory cortex using a multielectrode array substrate for simultaneous stimulation and recording. IEEJ Transactions Electrical and Electronic Engineering. 14 (2), 303-311 (2019).
- Yoshikawa, T., Higuchi, H., Furukawa, R., Tateno, T. Temporal and spatial profiles of evoked activity induced by magnetic stimulation using millimeter-sized coils in the mouse auditory cortex in vivo. Brain Research. 1796, 148092 (2022).
- Tang, A. D., et al. Construction and evaluation of rodent-specific rTMS coils. Frontiers in Neural Circuits. 10, 47 (2016).
- Li, L. Controlling annealing and magnetic treatment parameters to achieve high permeabilities in 55 Ni-Fe toroid cores. IEEE Transactions on Magnetics. 37 (4), 2315-2317 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten