Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Недорогая электроэнцефалографическая регистрирующая система в сочетании с катушкой миллиметрового размера для транскраниальной стимуляции мозга мыши in vivo
В этой статье
Резюме
Предлагается недорогая электроэнцефалографическая регистрирующая система в сочетании с катушкой миллиметрового размера для управления транскраниальной магнитной стимуляцией мозга мыши in vivo. Используя обычные винтовые электроды с изготовленной на заказ гибкой подложкой из многоэлектродной матрицы, можно проводить многосайтовую запись из мозга мыши в ответ на транскраниальную магнитную стимуляцию.
Аннотация
Здесь предлагается недорогая электроэнцефалографическая (ЭЭГ) система регистрации для управления транскраниальной магнитной стимуляцией (ТМС) мозга мыши in vivo с использованием катушки миллиметрового размера. Используя обычные винтовые электроды в сочетании с изготовленной на заказ гибкой подложкой из многоэлектродной матрицы, можно выполнять многосайтовую запись из мозга мыши. Кроме того, мы объясняем, как производится катушка миллиметрового размера с использованием недорогого оборудования, обычно встречающегося в лабораториях. Также представлены практические процедуры изготовления гибкой подложки многоэлектродной матрицы и техника хирургической имплантации винтовых электродов, которые необходимы для получения малошумящих сигналов ЭЭГ. Несмотря на то, что эта методология полезна для записи данных из мозга любого мелкого животного, в настоящем докладе основное внимание уделяется внедрению электродов в анестезированный череп мыши. Кроме того, этот метод может быть легко распространен на бодрствующее мелкое животное, которое соединено привязанными кабелями через общий адаптер и закреплено устройством TMS на голове во время записи. Описан настоящий вариант системы ЭЭГ-ТМС, который может включать в себя максимум 32 канала ЭЭГ (в качестве примера представлено устройство с 16 каналами с меньшим количеством каналов) и одно канальное устройство ТМС. Кроме того, кратко сообщается о типичных результатах, полученных при применении системы ЭЭГ-ТМС к анестезированным мышам.
Введение
Транскраниальная магнитная стимуляция (ТМС) является многообещающим инструментом для науки о человеческом мозге, клинического применения и исследований на животных моделях из-за ее неинвазивности / низкой инвазивности. На ранней стадии применения ТМС измерение коркового эффекта в ответ на ТМС с одиночными и парными импульсами у людей и животных было ограничено моторной корой; Легко измеримый выход был ограничен моторными вызванными потенциалами и индуцированными миоэлектрическими потенциалами с участием моторной коры 1,2. Чтобы расширить области мозга, которые могут быть измерены с помощью модуляции ТМС, электроэнцефалографическая (ЭЭГ) запись была интегрирована с ТМС с одиночными и парными импульсами в качестве полезного метода для непосредственного изучения возбудимости, связности и пространственно-временной динамики областей по всему мозгу 3,4,5. Таким образом, одновременное применение записи ТМС и ЭЭГ (ТМС-ЭЭГ) к мозгу было использовано для зондирования различных поверхностных областей коры головного мозга людей и животных для исследования внутрикорковых нейронных цепей (см. Tremblay et al.6). Кроме того, системы ТМС-ЭЭГ могут быть использованы для изучения дополнительных корковых пространственно-временных характеристик, включая распространение сигналов в другие области коры и генерацию колебательной активности 7,8.
Тем не менее, механизм действия ТМС в головном мозге остается спекулятивным из-за неинвазивности ТМС, что ограничивает наши знания о том, как мозг функционирует во время применения ТМС. Поэтому инвазивные трансляционные исследования на животных, начиная от грызунов и заканчивая людьми, имеют решающее значение для понимания механизма воздействия ТМС на нейронные цепи и их активность. В частности, для комбинированных экспериментов ТМС-ЭЭГ на животных система одновременной стимуляции и измерения для мелких животных интенсивно не разрабатывалась. Поэтому экспериментаторы должны построить такую систему методом проб и ошибок в соответствии со своими конкретными экспериментальными требованиями. Кроме того, мышиные модели полезны среди других моделей видов животных in vivo, поскольку многие трансгенные и штаммоизолированные штаммы мышей доступны в качестве биологических ресурсов. Таким образом, удобный метод построения комбинированной измерительной системы ТМС-ЭЭГ для мышей был бы желателен для многих исследователей нейробиологии.
В этом исследовании предлагается комбинированный метод ТМС-ЭЭГ, который может быть применен для одновременной стимуляции и записи мозга мыши, который является основным типом трансгенных животных, используемых в исследованиях, и который может быть легко построен в типичных лабораториях нейробиологии. Во-первых, описывается недорогая система регистрации ЭЭГ с использованием обычных винтовых электродов и гибкой подложки для воспроизводимого назначения положения электродной решетки в каждом эксперименте. Во-вторых, система магнитной стимуляции построена с использованием катушки миллиметрового размера, которая может быть легко изготовлена на заказ в типичных лабораториях. В-третьих, комбинированная система ТМС-ЭЭГ регистрирует нейронную активность в ответ на звуковую и магнитную стимуляцию. Метод, представленный в этом исследовании, может выявить механизмы, которые вызывают специфические расстройства у мелких животных, а результаты, полученные на животных моделях, могут быть переведены для понимания соответствующих расстройств человека.
протокол
В настоящем исследовании все эксперименты на животных проводились в соответствии с Руководством Национального института здравоохранения по уходу за лабораторными животными и их использованию и с одобрения Институционального комитета по уходу за животными и их использованию Университета Хоккайдо. Для настоящего исследования были использованы мыши C57BL/6J, два самца и три самки в возрасте от 8 до 10 недель. Это терминальная процедура. Животные были получены из коммерческого источника (см. Таблицу материалов).
1. Гибкое проектирование и построение двумерного массива
- Подготовьте необходимое количество миниатюрных винтовых электродов (нержавеющих, SUS XM7; см. Таблицу материалов) со следующими структурными свойствами для использования в качестве регистрирующих и эталонных электродов ЭЭГ: номинальный диаметр, длина шеи и диаметр головки 0,6 мм, 1,5 мм и 1,1 мм соответственно (рис. 1А).
ПРИМЕЧАНИЕ: В настоящем исследовании было использовано 16 миниатюрных винтовых электродов. - Подготовьте чертеж печатной схемы на гибкой подложке, выполнив следующие действия.
- Создайте двумерный (2D) шаблон электродной площадки на гибкой подложке (весь размер, 41,2 мм × 19,9 мм; см. Таблицу материалов) для считывания винтовых электродов. Спроектируйте расположение 2D-электродов. На рисунке 1B показаны конкретные схемы, использованные в этом исследовании, и относительные координаты от исходной точки (крест, отмеченный в начале координат [0, 0]).
ПРИМЕЧАНИЕ: В настоящем исследовании для регистрации нейронной активности в слуховой коре в височных долях размещение электродов в латерально-медиальном (горизонтальном) направлении было длиннее, чем в рострально-каудальном (вертикальном) направлении (рис. 1B). - Убедитесь, что для регистрирующих электродов ЭЭГ каждая медная прокладка (см. Таблицу материалов) на гибкой подложке имеет форму кольца с наружным диаметром 1,3 мм и внутренним диаметром 0,8 мм (рис. 1C, слева). Сделайте небольшое отверстие (диаметром 0,8 мм) в центре, чтобы каждый винтовой электрод проходил через подложку. Для электродов сравнения каждая медная прокладка должна иметь квадратную форму с длиной стороны 1,4 мм; точно так же сделайте небольшое отверстие (диаметром 0,8 мм) в центре, чтобы каждый винт проходил через квадратную площадку на подложке (рис. 1C, справа).
- Затем, чтобы припаять разъем для поверхностного монтажа (рис. 1D, слева), спроектируйте контактные площадки считывания (массив 2D), ведущие к разъему (рис. 1D, справа). Например, используйте разъем с 2 × 10 контактами и шагом 1,27 мм между соседними контактами (рис. 1D, справа).
- Соедините винтовые электродные площадки и соединительные площадки, используя как поверхностный, так и задний слой с шириной линии 0,03 мм и межстрочным интервалом 0,03 мм (тонкие линии на рисунке 1E).
- Кроме того, чтобы подключить опорный канал и канал заземления к усилителю, подключите электродные площадки для электродов сравнения и заземления к изолированной части снаружи гибкой 2D-матрицы (два вертикальных прямоугольника, обозначенных буквами «G» и «HR» внизу рисунка 1E). После определения опорного канала и канала заземления не забудьте припаять контактные площадки электродов к соответствующим разъемам (см. шаг 2.1).
- Правильно спроектируйте открытую область, которая не покрыта защитным слоем (полиимидным слоем). Обнажите соединительные площадки в поверхностном слое, обнажив контактные площадки винтовых электродов как на поверхностном, так и на заднем слоях. Вся конструкция электродов, размеры и изготовленная гибкая 2D-матрица проиллюстрированы на рисунке 1E, а изображение изготовленной подложки показано на рисунке 1F.
- В верхней части электрода (головной части) гибкой 2D-матрицы убедитесь, что трехслойная структура сверху донизу состоит из следующих элементов (общая толщина 49,0 мкм): верхний медный слой (толщина 12,0 мкм), средний слой полиимида ядра (25,0 мкм) и нижний медный слой (12,0 мкм) (рис. 1G, вверху).
- Протравите слои меди на верхней и нижней поверхности подложки, например, с помощью мокрого травления и стандартной техники изготовления9.
- В нижней квадратной части площадки (соединительной части) гибкой 2D-матрицы убедитесь, что шестислойная структура состоит из трех слоев, включая верхний медный слой (толщина 12,0 мкм), полиимидный слой среднего сердечника (25,0 мкм) и нижний медный слой (12,0 мкм), которые зажаты защитными полиимидными слоями, включая верхний и нижний (оба 12,5 мкм) слои. Прикрепите полиимидную плиту толщиной 2 мм снизу в качестве армирующего материала (рис. 1G, внизу).
ПРИМЕЧАНИЕ: Для сохранения гибкости армирующая полиимидная плата не крепится к шейной части гибкого 2D-массива между головкой и соединительной частью. - Точно так же в соединительной части вытравите медный и защитный полиимидные слои сверху, используя мокрое травление и стандартную технику изготовления.
ПРИМЕЧАНИЕ: Общий вес изготовленного гибкого устройства 2D-матрицы, включая разъем, составляет 0,84 г. После разработки макета гибкого 2D-массива для удобства иногда рекомендуются подложки от коммерческого производителя (см. Таблицу материалов).
- Создайте двумерный (2D) шаблон электродной площадки на гибкой подложке (весь размер, 41,2 мм × 19,9 мм; см. Таблицу материалов) для считывания винтовых электродов. Спроектируйте расположение 2D-электродов. На рисунке 1B показаны конкретные схемы, использованные в этом исследовании, и относительные координаты от исходной точки (крест, отмеченный в начале координат [0, 0]).
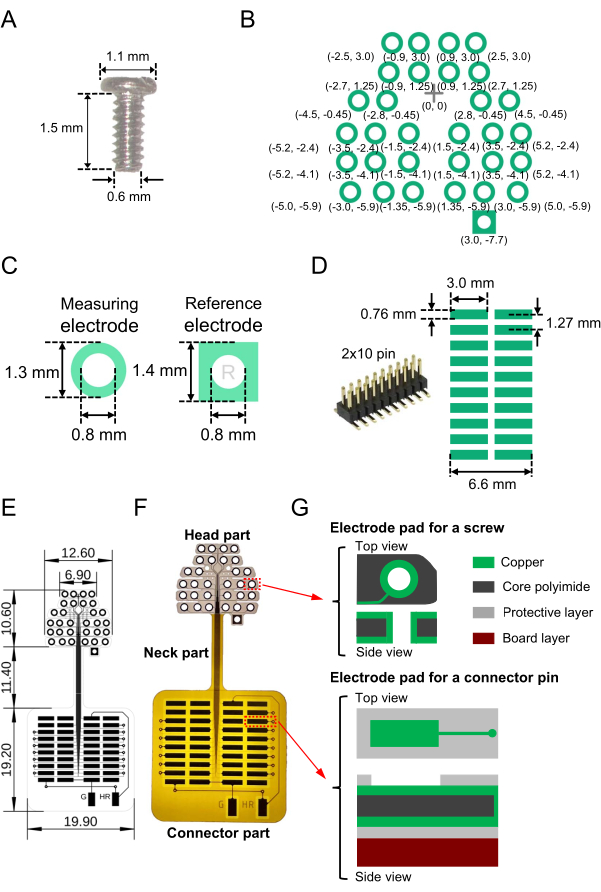
Рисунок 1: Составные части гибкой двумерной (2D) матрицы для электроэнцефалографической (ЭЭГ) регистрации и изготовленного устройства, включающего матрицу. (A) Миниатюрный винтовой электрод, встроенный в череп мыши. (B) Разработанные электродные площадки для измерения активности мозга (зеленые круги) и эталонный канал (квадрат в правом нижнем углу). Показаны относительные координаты электродных площадок от контрольной точки (поперечной метки) в начале координат (0, 0); Размер в миллиметрах проиллюстрирован в скобках. Центральные координаты электродных площадок симметричны по отношению к вертикальной оси, проходящей через поперечную метку. (C) Проиллюстрированы электродные площадки и просверленные отверстия для регистрирующего электрода (слева) и электрода сравнения (справа). (D) Разъем для поверхностного монтажа (2 × 10 контактов), используемый для гибкой 2D-матрицы (слева), а также рисунок и размер спроектированных контактных площадок на подложке (справа). (E) Разработанный чертеж с размером каждой детали в миллиметрах. (F) Изображение изготовленной подложки, указанное в чертеже, приведенном в Е. (G) Структура слоев гибкого 2D-массива (головка и соединительные детали). Проиллюстрированы вид сверху и сбоку контактных площадок винтовых электродов (вверху) и площадок считывания (внизу). Головка и соединительные части состоят из трехслойной структуры (вверху) и шестислойной структуры (внизу) соответственно. Кроме того, шейная часть состоит из пятислойной структуры; Защитный полиимидный слой монтируется на верхнюю и заднюю поверхность, а армирующая полиимидная плита не монтируется на шейную часть. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Конструкция адаптера и картографирование каналов
- Выполните сборку адаптера, выполнив следующие действия.
- Нанесите паяльный флюс на 2 × 10-контактный разъем для поверхностного монтажа (рис. 1D, слева) и соединительные площадки 2D-массива (рис. 1D, справа) (см. Таблицу материалов) на гибкую подложку.
- Припаяйте 2 × 10-контактный разъем для поверхностного монтажа к контактным площадкам. В частности, подтвердите соединение между двумя контактными площадками в нижней части 2D-матрицы и двумя контактами разъема, используемыми в качестве опорного канала и канала заземления (рис. 2A).
- Подсоедините каждую из двух площадок к отдельным подводящим проводам для подачи базовых сигналов во внешнюю точку (например, точку заземления, подключенную к каналу заземления измерительной системы; Рисунок 2А).
ПРИМЕЧАНИЕ: Однако в этом исследовании одна из круглых электродных площадок с винтовыми электродами использовалась в качестве электрода сравнения вместо квадратного электрода в соединительной части. - После пайки закройте места пайки эпоксидной смолой (см. Таблицу материалов), чтобы защитить открытые точки и предотвратить короткое замыкание.
- Закрепите соединительный кабель и головной усилитель, выполнив следующие действия.
- Подготовьте разъем для смещения изоляции (IDC) с 2 × 10 контактами и шагом 1,27 мм (рис. 2B, вверху слева) и плоский 20-контактный ленточный кабель (см. Таблицу материалов) с шагом 0,635 мм (рис. 2B, внизу слева). Отрежьте плоский ленточный кабель до необходимой длины (например, 40 см).
- Обжмите IDC и один конец плоского ленточного кабеля с помощью обжимного инструмента IDC (рис. 2B, вверху справа) (см. Таблицу материалов).
- Отделите каждую линию другого конца кабеля примерно на расстоянии до 15 мм от конца наконечника с помощью резака. Зачистите утеплитель на 3 мм от конца наконечника.
- Подсоедините обжатый IDC к плоскому ленточному кабелю и 2 × 10-контактному разъему, припаянному к гибкой подложке (рис. 2C).
- Подтвердите соответствие между записывающим электродом и отделенной линией кабеля. Убедитесь, что каждая используемая строка не приводит к ошибке неправильного подключения.
- Припаяйте оголенные медные провода отдельных линий, соответствующих выходу каждого электрода, к 20-контактному разъему (шаг 1,25 мм) измерительной системы, включая основной усилитель (рис. 2B, внизу справа).
- После пайки подтвердите проводимость между контактными площадками винтовых электродов и контактами разъема с помощью испытательного оборудования (например, измерителя LCR; см. Таблицу материалов).
- Закройте точки пайки эпоксидной смолой и экранирующей лентой, чтобы защитить их от повреждений и предотвратить контакт с другими сигнальными линиями.
- Используя эпоксидную смолу, приклейте тонкий стержень из нержавеющей стали (диаметр: 1,1-1,2 мм; длина: 100 мм) к обратной стороне соединительной части 2D-массива на гибкой подложке.
ПРИМЕЧАНИЕ: Этот стержень из нержавеющей стали можно захватить держателем микроманипулятора во время экспериментов (рис. 2C). - Наконец, подтвердите соответствие между винтовыми электродами и выходными каналами сигнала (рис. 2D).
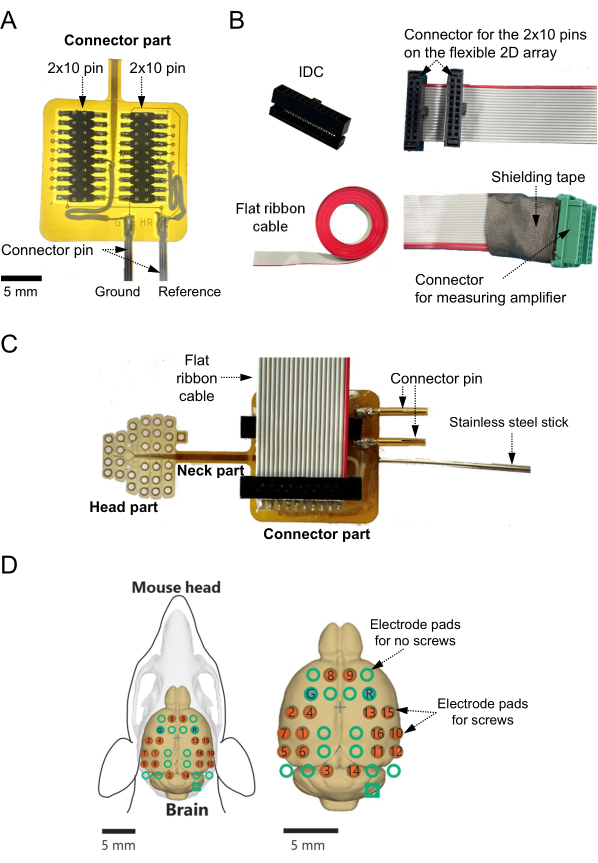
Рисунок 2: Построение адаптера для двумерной (2D) электродной решетки на гибкой подложке и отображение канала записи. (A) В соединительной части опорный и заземляющий каналы соединены с контактными площадками нижних электродов подводящими проводами. Если опорный канал и канал заземления определены заранее, каналы должны быть подключены к соответствующим контактным площадкам нижнего электрода на этапе проектирования. В таких случаях пайка подводящих проводов к каналам и электродным площадкам не нужна. (B) Разъемы смещения изоляции (вверху слева) обжимаются к одному концу плоского кабеля (внизу слева) для соединения разъема измерительного усилителя (вверху справа). Все линии, которые соответствуют каналам, которые будут использоваться, припаяны к зеленым разъемам (внизу справа). В этом случае, поскольку каждый зеленый разъем, подключенный к головному усилителю, предназначен для восьмиканального измерения, для записи 16-канальных сигналов мозговой активности необходимо как минимум два разъема. Места пайки покрыты эпоксидной смолой и экранирующей лентой для предотвращения контакта с другими сигнальными линиями. (C) Разъем и изготовленный кабель размещены на поверхности гибкой подложки 2D-матрицы. Тонкий стержень из нержавеющей стали прикреплен к задней стороне гибкой подложки. (D) Показано пространственное расположение регистрирующих каналов на поверхности мозга мыши и карты каналов для каждой точки измерительной системы. При этом имеется 16 каналов записи с винтовыми электродами (красными кружками), хотя общее количество возможных мест записи равно 32. Остальные 16 незаписывающих каналов также показаны в виде зеленых кругов на поверхности мозга. На картографическом графике «G» и «R» обозначают каналы, предназначенные для заземляющих и опорных электродов соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Хирургия животных
- Подготовьте стерильную хирургическую среду.
- Носите защитное снаряжение, такое как латексные перчатки, в течение всей экспериментальной процедуры с участием животных.
- Стерилизовать стереотаксический аппарат и хирургические инструменты (см. Таблицу материалов).
- После стерилизации хирургических инструментов промойте их стерильным физиологическим раствором.
- Обезболивайте животных.
- Измерьте вес мыши перед операцией. Вводят сульфат атропина (0,04 мг / кг; см. Таблицу материалов) путем внутрибрюшинной инъекции.
- Обезболивают мышей с помощью внутрибрюшинной инъекции смеси медетомидина (0,3 мг / кг), мидазолама (4,0 мг / кг) и буторфанола (5,0 мг / кг).
- Подтвердите глубину анестезии уровнем реакции, зажав палец ноги.
ПРИМЕЧАНИЕ: Анестезия исчезнет примерно через 40 минут. Если мышь реагирует на защемление пальца ноги, введите ту же дозу анестезирующей смеси с помощью внутрибрюшинной инъекции.
- Предварительно подготовьтесь к операции по имплантации электродов.
- Отрежьте усы мыши, чтобы предотвратить тактильные ощущения.
- Смажьте оба глаза офтальмологической мазью, чтобы предотвратить высыхание. Закройте веки, чтобы затруднить зрение, и поддерживайте закрытие, приклеивая верхнее и нижнее веко с помощью скотча.
- Сбрейте волосы на голове мыши электрическими машинками для стрижки. Вставьте термометр в прямую кишку и поддерживайте температуру тела на уровне 37 °C с помощью грелки.
- Вводите гидрохлорид лидокаина в качестве местного анестетика в ту часть кожи головы мыши, которая будет разрезана.
- Надрежьте кожу головы мыши с помощью скальпеля или хирургических ножниц в рострально-каудальном направлении (размер области: 7 × 10 мм2).
- Щипните пинцетом кожу головы возле надрезанной части и приподнимите. Удалите видимую оболочку на черепе с помощью скальпеля или хирургических ножниц. Не разрывайте кровеносные сосуды вокруг глаз во время операции.
- Обхватите щипцами кожу возле обоих центров линии разреза волосистой части головы и расширьте надрезанную часть, чтобы широко обнажить верхнюю часть черепа.
- Подтвердите полное удаление всех оболочек на поверхности черепа и тканей вокруг лямбды хирургическими ножницами.
- Смочите поверхность черепа физиологическим раствором, чтобы улучшить видимость поверхности мозга под черепом и найти поперечную пазуху.
ПРИМЕЧАНИЕ: При имплантации винтовых электродов в череп помните, что нельзя вставлять их выше и в поперечную пазуху.
4. Имплантация электродов
- Прикрепите стержень из нержавеющей стали, установленный на массиве 2D-электродов на обратной стороне гибкой подложки, к микроманипулятору. Поместите гибкую подложку на череп.
- Отрегулируйте расположение каналов (Chs) 3 и 14 (рис. 2D) на массиве, чтобы они поместились в нижней колликулусе.
ПРИМЕЧАНИЕ: Нижний колликулус расположен вдоль поперечной пазухи. Мы рекомендуем заранее подтвердить местоположение нижнего колликулуса с помощью атласа мозга мыши. - Нарисуйте небольшие круги в местах гл. 3, 8, 9 и 14 (рис. 2D) на черепе перманентным маркером, чтобы использовать его в качестве ориентиров.
- Высушите поверхность черепа, чтобы улучшить адгезию к зубному цементу и электрически изолировать массив 2D-электродов на гибкой подложке от черепа мыши.
- Нанесите зубной цемент (толщиной примерно 1 мм; см. Таблицу материалов) на поверхность черепа. После нанесения зубного цемента подождите примерно 30 минут, пока он не затвердеет.
- Выровняйте гибкую подложку в соответствии с небольшими круглыми отметинами на поверхности черепа.
- Совместите кончик стоматологической бормашины с каждым отверстием электродной прокладки на гибкой подложке. Осторожно просверлите череп через каждое из отверстий электродной прокладки.
- Вкрутите каждый из миниатюрных винтовых электродов через просверленные отверстия в черепе с помощью специальной отвертки для миниатюрных винтов.
- Плотно обжмите головку винтового электрода и электродную площадку. Наконец, измерьте проводимость между каждым винтовым электродом и разъемом с помощью испытательного оборудования (например, измерителя LCR) для подтверждения электропроводности.
5. Конструкция и конструкция малой катушки
- Спроектируйте диск в форме пончика (см. Дополнительный файл кодирования 1) с отверстием в центре (внутренний диаметр: 2 мм; наружный диаметр: 7 мм; толщина: 1 мм) с использованием программного обеспечения автоматизированного проектирования (САПР) (см. Таблицу материалов).
- С помощью 3D-принтера напечатайте два диска (рис. 3А, слева) из нетермостойкого материала (например, нить полимолочной кислоты); Нетермостойкий материал не всегда необходим (см. ниже).
- Обрежьте стержень пермаллоя-45 (диаметр: 2 мм; см. Таблицу материалов), чтобы сформировать короткий вал (длина: 60 мм).
- Вставьте вал в каждое отверстие двух дисков, напечатанных на 3D-принтере (рис. 3A, справа). Поместите один диск на конец вала, а другой на расстоянии 11 мм от конца, в результате чего расстояние между двумя дисками составит 10 мм. Склейте диски моментальным клеем (см. Таблицу материалов).
- Прикрепите конец вала без диска к ударному шуруповерту (рис. 3B). Прикрепите небольшой магнит к валу пермаллоя-45. Разместите датчик Холла рядом с магнитом на расстоянии 5 мм от вала. Подключите датчик Холла к системе сбора данных (DAQ; см. Таблицу материалов).
- Для подсчета количества витков подготовьте компьютерную программу (см. Таблицу материалов), анализирующую выходные сигналы от датчика на эффекте Холла через систему сбора данных.
- Подсоедините тонкую медную проволоку (диаметр: 0,16 мм) к валу и приклейте к верхнему концу проволоки мгновенным клеем.
- Используя ударный драйвер, намотайте медный провод на 1,000 витков между двумя дисками. Хотя скорость вращения произвольная, обычно используется примерно 5 оборотов в секунду. Затем приклейте к намотанной проволоке мгновенный клей.
- Отсоедините два диска от вала. Если диски сильно прилегают к валу, расплавьте диски с помощью тепловой пушки.
- Покройте катушку эпоксидной смолой, чтобы изолировать и закрепить поверхность. Затем отрежьте размотанную часть вала как лишнюю.
- Убедитесь, что полученная катушка имеет высоту 10 мм и диаметр 6 мм (рис. 3Б, слева). Для манипуляций с катушкой либо сконструируйте держатель катушки (рис. 3C, справа), либо прикрепите стержень из нержавеющей стали к катушке (здесь не показано).
- Измерьте сопротивление и индуктивность катушки с помощью измерителя LCR (см. Таблицу материалов). Например, используемая здесь катушка имела сопротивление постоянному току (DC) 18,3 Ω и индуктивность 7,9 мГн на входе переменного тока (AC) 1 кГц. Свойства переменного тока (сопротивление и индуктивность) показаны на рисунке 3D.
- Используйте генератор функций, чтобы подать биполярную прямоугольную волну на катушку. Типичная амплитуда входного напряжения составляет 20 В через биполярный источник питания с 10-кратным коэффициентом усиления после выхода генератора 2 В. Результирующая форма сигнала представляет собой биполярную прямоугольную волну с приблизительной амплитудой 20 В (т. е. напряжение от пика до пика 40 В) (рис. 3E).
- Измерьте плотность магнитного потока с помощью датчика на эффекте Холла и системы сбора данных. В этом случае, например, плотность магнитного потока (B) катушки составляла 113,6 ±2,5 мТл (среднее значение ± SEM), когда дно катушки соприкасалось с датчиком Холла (рис. 3F).
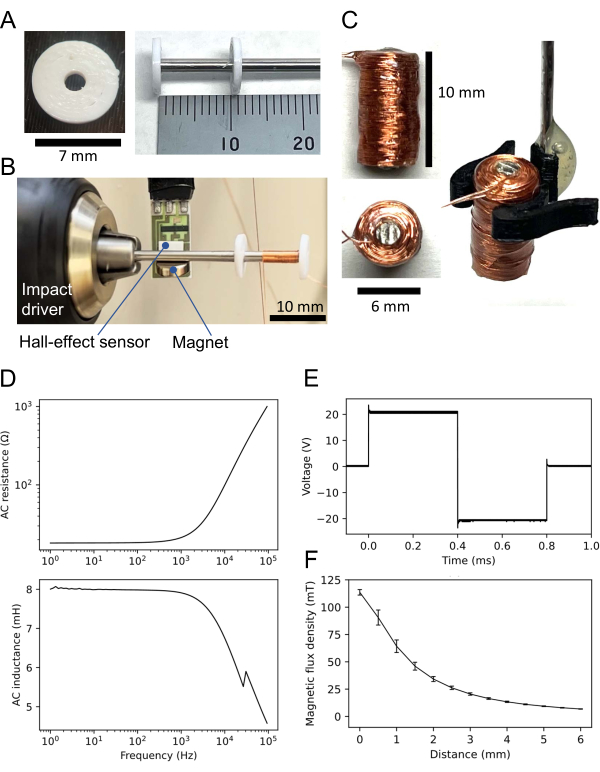
Рисунок 3: Маленькая катушка для магнитной стимуляции. (A) Трехмерный (3D) печатный диск (слева). Два одинаковых диска приклеены к валу пермаллоя-45; Один находится на конце вала, а другой на расстоянии 10 мм (справа). (B) Настройка для намотки катушки. Вал диаметром 60 мм с двумя дисками крепится к ударному шуруповерту. Датчик Холла размещается рядом с небольшим магнитом, прикрепленным к валу. Медная проволока намотана между двумя дисками. (C) Сконструированная катушка. Катушка имеет высоту 10 мм, диаметр 6 мм и 1000 витков медной проволоки. В правой части рисунка показана катушка, управляемая держателем катушки, напечатанным на 3D-принтере. (D) Свойства катушки переменного тока, регистрируемые измерителем LCR: (верхнее) сопротивление в зависимости от частоты синусоидального входа; (нижняя) индуктивность в зависимости от входной частоты. Типичная катушка имеет сопротивление и индуктивность 21,6 и 7,9 мГн соответственно при входе переменного тока 1 кГц. (E) Двухфазный прямоугольный сигнал, используемый в качестве входного сигнала катушки, регистрируемый осциллографом. F) Взаимосвязь между плотностью магнитного потока и расстоянием между сконструированной катушкой и датчиком на эффекте Холла. Плотность магнитного потока регистрировалась пятью различными датчиками Холла, по одному для каждого датчика. Среднее значение пяти измерений построено на графике, а столбцы погрешности представляют собой стандартные погрешности среднего значения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Система и порядок регистрации сигналов
- Подключите гибкий 2D-массив к системе записи (см. Таблицу материалов) с помощью плоского ленточного кабеля.
- Прикрепите стержень из нержавеющей стали, установленный на катушке, к микроманипулятору (см. Таблицу материалов).
- Поместите катушку над брегмой и отрегулируйте положение в каудальном направлении, чтобы расположить фокусную точку над нижним ключицей. Фокусом излучающего электрического поля является средняя линия области намотки на нижней поверхности катушки (т.е. 1 мм от края к центру).
- Подготовьте систему стимуляции, состоящую из биполярного источника питания и генератора функций (см. Таблицу материалов), и подключите катушку к системе.
- Подключите кабель между входной клеммой генератора функций и выходной клеммой системы сбора данных, чтобы подать триггерные сигналы на генератор функций из системы сбора данных. Подготовьте соответствующую компьютерную программу для триггерных сигналов для инициирования стимулов. Кроме того, подключите систему сбора данных к системе записи, чтобы сохранить время стимуляции в виде временных меток.
- Запустите процесс сбора данных для записывающей системы.
ПРИМЕЧАНИЕ: Если записывающая система улавливает шум, найдите источник шума и уменьшите его. - Проверьте магнитную стимуляцию, запустив систему стимуляции.
ПРИМЕЧАНИЕ: Если шум, создаваемый магнитной стимуляцией, насыщает диапазон измерения, отрегулируйте диапазон правильно. Кроме того, убедитесь, что система записи правильно сохраняет временные метки стимуляции. - Начните записывать данные ответа и начинайте сеансы стимуляции. Останавливайте запись после завершения каждого сеанса стимуляции. Сохраните все записанные данные для последующего анализа.
ПРИМЕЧАНИЕ: Например, для выполнения всех экспериментальных условий с пятью различными магнитными интенсивностями общее время, необходимое для всех сеансов, составляло около 75 минут. Конечная точка обычно определялась после окончания всех сеансов записи. Однако, когда у животных проявились клинические признаки, включая кашель, затрудненное дыхание и удушье, экспериментальный сеанс был немедленно прекращен. Для эвтаназии обезглавливание проводилось с использованием острых, чистых ножниц, в то время как животные находились под наркозом.
7. Анализ данных
- Фильтруйте широкополосный (необработанный) сигнал с помощью фильтра нижних частот с частотой среза 200 Гц.
- Собирайте отфильтрованные осциллограммы в течение временного окна вокруг каждой метки времени стимуляции. Усредните осциллограммы, чтобы получить осциллограммы, связанные с потенциалом события (ERP) (рис. 4 и рис. 5).
Результаты
Образцы данных ЭЭГ, записанные у анестезированных мышей C57BL/6J с гибкой подложкой в сочетании с винтовыми электродами, представлены ниже.
В качестве типичного примера средние формы ЭЭГ, генерируемые в ответ на звуковую стимуляцию (всплеск тона 8 кГц, уровень звукового давл...
Обсуждение
В этом исследовании рассматривается многосайтовая система регистрации ЭЭГ в сочетании с системой магнитной стимуляции, предназначенной для мелких животных, включая мышей. Сконструированная система является недорогой и легко конструируется в физиологических лабораториях и может ра?...
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Эта работа была поддержана Научным фондом Мураты, Мемориальным фондом Судзукена, Фондом Накатани по развитию измерительных технологий в биомедицинской инженерии и грантом на поисковые исследования (грант No 21K19755, Япония) и на научные исследования (B) (грант No 23H03416, Япония) для T.T.
Материалы
| Name | Company | Catalog Number | Comments |
| 3D printer | Zhejiang Flashforge 3D Technology Co., Ltd | FFD-101 | The printer used for 3D-printing the donut-shaped disks |
| ATROPINE SULFATE 0.5 mg | NIPRO ES PHARMA CO., LTD. | - | Atropine sulfate |
| Bipolar amplifier | NF Corp. | KIT61380 | For amplifying waveforms for coil input |
| Butorphanol | Meiji Seika Pharma Co., Ltd., Tokyo, Japan | - | For anathesis of animals |
| Commercial manufacturer of flexible 2D array | p-ban.com Corp. | - | URL: https://www.p-ban.com/ |
| Computer prograom to analyze output signals | Natinal Instruments | NI-DAQ and NI-DAQmx Python | To analyze output signals from the hall-effect sensor |
| Connector | Harwin Inc. | G125-FV12005L0P | For connector to conect to the measuring system |
| Copper pad | p-ban.com Corp. | copper | Copper pad on each substrate |
| Copper wire | Kyowa Harmonet Ltd. | P644432 | The windings of the coil |
| DAQ board | National Instruments Corp. | USB-6343 | For measuring the magnitic flux density of the coil |
| Dental cement | SHOFU INC. | Quick Resin | Self-Curing Orthodontic Resin |
| ECoG electrode | NeuroNexus Inc. | HC32 | For reference to design of the flexible 2D array |
| Epoxy resin | Konishi Co. Ltd. | #16123 | For coil construction |
| Ethyl Carbamate | FUJIFILM Wako Pure Chemical Corp. | 050-05821 | For urethan anesthesia |
| Flat ribbon cable | Oki Electric Cable Co., Ltd. | FLEX-B2(20)-7/0.1 20028 5m | For cable to connect between surface-mount connector and measuring sysytem |
| flexible substrate | p-ban.com Corp. | polyimide | Baseplate of flexible substrate |
| Function generator | NF Corp. | WF1947 | For generating waveforms for coil input |
| Hall-effect sensor | Honeywell International Inc. | SS94A2D | For measuring the magnitic flux density of the coil |
| IDC crimping tool | Pro'sKit Industries Co. | 6PK-214 | To crimp the IDC and one end of the flat ribbon cable; Flat cable connector crimping tool |
| Instant glue | Konishi Co. Ltd. | #04612 | For coil construction |
| Insulation-displacement connector (IDC ) | Uxcell Japan | B07GDDG3XG | 2 × 10 pins and a 1.27 mm pitch |
| LCR meter | NF Corp. | ZM2376 | For measuring the AC properties of the coil |
| Manipulator | NARISHIGE Group. | SM-15L | For manipulating the coil |
| Medetomidine | Kobayashi Kako, Fukui, Japan | - | For anathesis of animals |
| Midazolam | Astellas Pharma, Tokyo, Japan | - | For anathesis of animals |
| Miniature screw | KOFUSEIBYO Co., Ltd. | S0.6*1.5 | For EEG-senseing and reference electrode |
| Mouse | Japan SLC, Inc. | C57BL/6J (C57BL/6JJmsSlc) | Experimental animal |
| Permalloy-45 rod | The Nilaco Corp. | 780544 | The core of the coil |
| Recording system | Plexon Inc. | OmniPlex | For EEG data acquisition |
| Stainless wire | Wakisangyo Co., Ltd. | HW-136 | For grasp by manipulator |
| Stereotaxic apparatus | NARISHIGE Group. | SR-5M-HT | To fix a mouse head |
| Surface-mount connector | Useconn Electronics Ltd. | PH127-2x10MG | For connector to mount on the flexible 2D array |
| Testing equipment (LCR meter) | NF Corp. | ZM2372 | Contact check and impedance measurements |
| White PLA filament | Zhejiang Flashforge 3D Technology Co., Ltd | PLA-F13 | The material used for 3D-printing the donut-shaped disks |
| Xylocaine Jelly 2% | Sandoz Pharma Co., Ltd. | - | lidocaine hydrochloride |
Ссылки
- Ilmoniemi, R. J., et al. Neuronal responses to magnetic stimulation reveal cortical reactivity and connectivity. Neuroreport. 8 (16), 3537-3540 (1997).
- Hallett, M. Transcranial magnetic stimulation: a primer. Neuron. 55 (2), 187-199 (2007).
- Thut, G., Pascual-Leone, A. Integrating TMS with EEG: How and what for. Brain Topography. 22 (4), 215-218 (2010).
- Ilmoniemi, R. J., Kicic, D. Methodology for combined TMS and EEG. Brain Topograpy. 22 (4), 233-248 (2010).
- Daskalakis, Z. J., Farzan, F., Radhu, N., Fitzgerald, P. B. Combined transcranial magnetic stimulation and electroencephalography: its past, present and future. Brain Research. 1463, 93-107 (2012).
- Tremblay, S., et al. Clinical utility and prospective of TMS-EEG. Clinical Neurophysiology. 130 (5), 802-844 (2019).
- Pellicciari, M. C., Veniero, D., Miniussi, C. Characterizing the cortical oscillatory response to TMS pulse. Frontiers in Cellular Neuroscience. 11, 38 (2017).
- Lin, Y. J., Shukla, L., Dugue, L., Valero-Cabre, A., Carrasco, M. Transcranial magnetic stimulation entrains alpha oscillatory activity in occipital cortex. Scientific Reports. 11 (1), 18562 (2021).
- Takahashi, S., et al. Laminar responses in the auditory cortex using a multielectrode array substrate for simultaneous stimulation and recording. IEEJ Transactions Electrical and Electronic Engineering. 14 (2), 303-311 (2019).
- Yoshikawa, T., Higuchi, H., Furukawa, R., Tateno, T. Temporal and spatial profiles of evoked activity induced by magnetic stimulation using millimeter-sized coils in the mouse auditory cortex in vivo. Brain Research. 1796, 148092 (2022).
- Tang, A. D., et al. Construction and evaluation of rodent-specific rTMS coils. Frontiers in Neural Circuits. 10, 47 (2016).
- Li, L. Controlling annealing and magnetic treatment parameters to achieve high permeabilities in 55 Ni-Fe toroid cores. IEEE Transactions on Magnetics. 37 (4), 2315-2317 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены