Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Aufnahme von hyperpolarisierten 129Xe-Magnetresonanzbildern der Lungenbeatmung
In diesem Artikel
Zusammenfassung
Die hyperpolarisierte 129Xe-Magnetresonanztomographie (MRT) ist eine Methode zur Untersuchung regional aufgelöster Aspekte der Lungenfunktion. Diese Arbeit stellt einen standardisierten End-to-End-Workflow für hyperpolarisierte 129Xe-MRT der Lungenbeatmung vor, mit besonderem Augenmerk auf das Design der Pulssequenz, die 129Xe-Dosisvorbereitung, den Scan-Workflow und Best Practices für die Überwachung der Probandensicherheit.
Zusammenfassung
Die hyperpolarisierte 129Xe-MRT umfasst eine einzigartige Palette struktureller und funktioneller Lungenbildgebungstechniken. Die Standardisierung der Technik über Standorte hinweg wird angesichts der kürzlich erfolgten FDA-Zulassung von 129Xe als MR-Kontrastmittel und des zunehmenden Interesses an 129Xe MRT in Forschung und klinischen Einrichtungen immer wichtiger. Die Mitglieder des 129Xe MRI Clinical Trials Consortium (Xe MRI CTC) haben sich auf Best Practices für jeden der Schlüsselaspekte des 129Xe MRT-Workflows geeinigt, und diese Empfehlungen sind in einer kürzlich erschienenen Veröffentlichung zusammengefasst. Diese Arbeit liefert praktische Informationen zur Entwicklung eines End-to-End-Workflows für die Erfassung von 129Xe-MRT-Bildern der Lungenbeatmung gemäß den Xe-MRT-CTC-Empfehlungen. Die Vorbereitung und Verabreichung von 129Xe für MR-Studien wird diskutiert und demonstriert, wobei spezifische Themen wie die Auswahl geeigneter Gasvolumina für gesamte Studien und für einzelne MR-Scans, die Vorbereitung und Verabreichung einzelner 129Xe-Dosen sowie bewährte Verfahren zur Überwachung der Sicherheit der Probanden und der 129Xe-Verträglichkeit während der Studien behandelt werden. Wichtige technische Überlegungen zur MR werden ebenfalls behandelt, einschließlich Pulssequenztypen und optimierter Parameter, Kalibrierung des 129Xe-Flip-Winkels und der Mittenfrequenz sowie 129Xe-MRT-Beatmungsbildanalyse.
Einleitung
Die hyperpolarisierte 129Xe-MRT ist ein spannendes Werkzeug für die nicht-invasive, ortsaufgelöste Charakterisierung und Quantifizierung spezifischer Aspekte der Lungenfunktion 1,2,3. Erfassungs- und Rekonstruktionsansätze, die denen der anatomischen Protonen-MRT ähneln, liefern Bilder von inhaliertem 129Xe in der Lunge, die eine Visualisierung von nicht beatmeten Lungenregionen und eine regionsaufgelöste Quantifizierung der Beatmungsverteilung ermöglichen 4,5,6,7,8 . Fortschrittlichere Pulssequenz- und Analysetechniken liefern weitere ergänzende Informationen, einschließlich der Quantifizierung der Gasaustauscheffizienz zwischen Alveolen und Lungenkapillaren mittels spektroskopischer MRT 9,10,11,12,13 und Charakterisierung der Integrität der alveolären Mikrostruktur mittels diffusionsgewichteter MRT 14,15,16.
Inhaliertes 129Xe hat sich bei erwachsenen und pädiatrischen Probanden, einschließlich Patienten mit Lungenerkrankungen, als sicher und verträglich erwiesen17,18. Messungen der Lungenfunktion, die aus 129Xe-MRT abgeleitet wurden, haben eine Empfindlichkeit gegenüber strukturellen und funktionellen Veränderungen in vielen pulmonalen Krankheitskontexten gezeigt, einschließlich chronisch obstruktiver Lungenerkrankung 6,10,19, Mukoviszidose 20,21,22, idiopathischer Lungenfibrose 23,24,25 und Asthma 7,10,26. Angesichts der hohen Sicherheit und Verträglichkeit der 129-Xe-MRT, des Fehlens ionisierender Strahlung in der MRT im Vergleich zu anderen gängigen Bildgebungsansätzen und der hohen Reproduzierbarkeit der 129-Xe-MRT-Ergebnisse27,28 ist die 129-Xe-MRTvielversprechend, insbesondere für die präzise serielle Überwachung von Personen, die einen zeitlichen Therapieverlauf für chronische Lungenerkrankungen erhalten.
Die Sicherheit und das klinische Versprechen der 129Xe-MRT haben im Dezember 2022 zu ihrer FDA-Zulassung für die Lungenbeatmungsbildgebung bei Personen ab29 Jahren geführt. Vor diesem Hintergrund wird erwartet, dass die Anzahl der Forschungs- und klinischen Standorte, die 129Xe-MRT durchführen können (derzeit ~20 weltweit), in den kommenden Jahren erheblich zunehmen wird. Da sich die 129Xe MRT auf neue Einrichtungen ausbreitet, ist es wichtig, dass robuste methodische Ressourcen vorhanden sind, die es den Standorten ermöglichen, klinisch relevante 129Xe MRT-Techniken schnell aufzubauen und Scans durchzuführen und Ergebnisse zu erzielen, die mit denen bestehender Standorte vergleichbar sind.
In dieser Arbeit werden wir die aktuellen Best Practices für die humane hyperpolarisierte 129Xe MRT der Lungenbeatmung skizzieren, wie sie von den Mitgliedsinstitutionen des 129Xe MRI Clinical Trials Consortium (Xe MRI CTC) vereinbart und in einem kürzlich erschienenen Positionspapierzusammengefasst wurden 30. Zu den Themen gehören die Vorbereitung maßgeschneiderter Pulssequenzen, die sich ideal für einen vollständigen 129-Xe-MRT-Workflow eignen, die Vorbereitung und Verabreichung von hyperpolarisiertem 129-Xe-Gas, ein optimierter Workflow für menschliche 129-Xe-MRT-Sitzungenund Best Practices für die Überwachung der Sicherheit und des Komforts von Probanden während MRT-Sitzungen.
Protokoll
Alle Forschungen am Menschen müssen von einem institutionellen Prüfungsausschuss (IRB) genehmigt werden. Die Beteiligung des IRB ist für die behördlich zugelassene klinische Verwendung der 129-Xe-MRT nicht erforderlich. Vor der Teilnahme an einer Forschungsstudie müssen potenzielle Probanden eine genehmigte Einwilligungserklärung erhalten. Die Person, die die Einwilligung einholt, muss den Inhalt des Dokuments erläutern, einschließlich des Zwecks, der Verfahren, des Nutzens und der Risiken der Studie, muss alle Fragen beantworten und die Zustimmung des Probanden einholen, um mit der Studie fortzufahren, wie durch die Unterschrift des Probanden auf der Einwilligungserklärung dokumentiert. Bei pädiatrischen Probanden oder anderen besonderen Umständen müssen zugelassene Praktiken zur Einholung der Einwilligung befolgt werden. Das unten beschriebene Protokoll folgt den Richtlinien des IRB der University of Virginia, und die Beispielpersonen in diesem Manuskript haben die von der University of Virginia IRB genehmigten Einverständniserklärungen (IRB 13647, 16215, 16885, 19569) unterzeichnet.
1. Vorbereitung von Hardware und Pulssequenzen für 129Xe MRT
HINWEIS: Die Protokollschritte unter Schritt 1 sollten vor dem Scannen menschlicher Probanden durchgeführt werden. Sie müssen nicht für jedes Fach wiederholt werden.
- Stellen Sie sicher, dass der MRT-Scanner für den Mehrkernbetrieb einschließlich 129Xe geeignet ist.
- Stellen Sie sicher, dass die 129Xe-Hochfrequenzspule (RF) bei Bedarf über eine speziell angefertigte Spulen-zu-Scanner-Schnittstellenbox an den MRT-Scanner angeschlossen werden kann.
- Stellen Sie sicher, dass eine geeignete Software (oft als Spulendatei bezeichnet) für die Verbindung der 129Xe-HF-Spule mit dem MRT-Scanner installiert ist, falls dies vom Scannerhersteller verlangt wird.
- Bereiten Sie Pulssequenzen für die 129Xe- und 1-H-Bildgebung wie unten beschrieben vor.
- Für die 129Xe-Kalibrierung wird eine nicht lokalisierte, spektroskopische Sequenz vorbereitet, die eine Reihe von freien Induktionszerfällen (FIDs) unter Verwendung der in Tabelle 1 angegebenen Pulssequenzparameter umfasst.
ANMERKUNG: Die bei ~218 ppm (Frequenz gelöster Phasen) erfassten FIDs werden hauptsächlich zur Bestimmung von Parametern für die gelöste Phase 129Xe-MRT verwendet, die in der vorliegenden Arbeit nicht behandelt wird. Diese Parameter sind jedoch so gegeben, dass man eine einzige standardisierte 129Xe-Kalibrierung entwickeln kann, die für 129Xe-MRT-Scans jeglicher Art ausreicht. Beachten Sie außerdem, dass für Studien, die nur 129Xe-Beatmungsbildgebung umfassen, möglicherweise kein separater Kalibrierungsscan erforderlich ist, sobald der Standort ausreichende Erfahrung gesammelt hat. Die Betriebsfrequenz von 129Xe kann genau geschätzt werden, indem die vom Scanner bestimmte 1-H-Frequenz um das Verhältnis von 129Xe zu 1H gyromagnetischen Verhältnissen skaliert wird, und die Senderkalibrierung kann auf der Grundlage der gesammelten Erfahrung und des Probandengewichts geschätzt werden. - Für die 129Xe-Beatmungs-MRT ist eine zweidimensionale (2D) HF-verdorbene Gradienten-Echo-Sequenz unter Verwendung der in Tabelle 2 angegebenen Pulsfolgeparameter zu erstellen. Stellen Sie sicher, dass 129Xe als Zielkern ausgewählt ist.
- Für die konventionelle anatomische1-H-MRT ist eine Single-Shot-Turbo-/Fast-Spin-Echo-Sequenz oder eine HF-verdorbene Gradienten-Echo-Sequenz mit den in Tabelle 2 angegebenen Parametern zu erstellen.
HINWEIS: Bei 129Xe-Beatmung und 1H anatomischen Sequenzen sind FOV und Anzahl der Schichten fachspezifisch. Wählen Sie diese Parameter zu Beginn der Scansitzung so, dass eine vollständige Abdeckung der Lunge in allen drei Dimensionen gewährleistet ist.- Aktivieren Sie Phasen-Oversampling, um potenzielles Aliasing der Arme in das Bildfeld zu mindern.
- Einschränkungen der Hersteller von MRT-Scannern können den Betrieb der Single-Shot-Turbo-/schnellen Spin-Echo-Sequenz bei der empfohlenen groben Auflösung in der Ebene (4 mm x 4 mm) verhindern. Verwenden Sie in diesem Fall eine Auflösung, die ein ganzzahliger Faktor der gewünschten Auflösung ist (z. B. 2 mm x 2 mm).
HINWEIS: Der anatomische1-H-Scan kann alternativ mit einer 2D-HF-verdorbenen Gradientenechosequenz aufgenommen werden. Verwenden Sie in diesem Fall die gleichen Parameter wie die in Tabelle 2 angegebenen Parameter des Beatmungsscans, aktivieren Sie jedoch das Phasen-Oversampling, um ein Aliasing der Arme in das Bildfeld zu vermeiden.
- Für die 129Xe-Kalibrierung wird eine nicht lokalisierte, spektroskopische Sequenz vorbereitet, die eine Reihe von freien Induktionszerfällen (FIDs) unter Verwendung der in Tabelle 1 angegebenen Pulssequenzparameter umfasst.
- Überprüfen Sie den Betrieb der oben beschriebenen HF-Spulen- und Impulssequenzen, indem Sie Scans eines thermisch polarisierten 129Xe-Phantoms31 für 129Xe-Scans und eines 1-H-Phantoms für 1-H-Scans durchführen.
| Parameter | Kalibrierung | ||
| TR | 15 ms | ||
| TE | 0,45 ms (3 T), 0,8 ms (1,5 T) | ||
| HF-Impuls | Fenster sinc | ||
| HF-Dauer | 0,65 bis 0,69 ms (3 T), 1,15 bis 1,25 ms (1,5 T) | ||
| Flip-Winkel | 20° | ||
| HF-Frequenz | 218 ppm (gelöste Phase), 0 ppm (Gasphase) | ||
| Verweildauer | 39 μs | ||
| Bandbreite | 25,6 kHz | ||
| Nein. Anzahl der Proben | 256 (ohne Überabtastung, falls verwendet) | ||
| Dauer des Auslesens | 10 ms | ||
| Anzahl der FIDs | 1 Rauschen (keine HF), 499 bei gelöster Phasenfrequenz, 20 bei Gasphasenfrequenz. | ||
| Verderben von Farbverläufen | Drehmoment von mindestens 15 mT/m-ms (jede Achse, nach jedem FID) | ||
| Dauer | ~8 s | ||
Tabelle 1: Empfohlene Impulssequenzparameter für die 129Xe-Kalibrierung. Die Parameter sind für eine nicht lokalisierte, spektroskopische 129Xe-Kalibrierungspulssequenz angegeben.
| Parameter | Beatmung | Anatomisch |
| Art der Sequenz | HF-verdorbenes Gradientenecho | Single-Shot-Turbo / schnelles Spin-Echo |
| TR | <10 ms | Unendlich |
| TE | <5 ms | <50 ms |
| Echo-Abstand | N/A | 3-5 ms |
| Anregungs-Flip-Winkel | 8-12° | 90° |
| Neufokussierung des Flip-Winkels | N/A | ≥90° (höchstzulässig innerhalb der SAR-Grenzen) |
| Schichtdicke | 15 mm | 15 mm |
| Scheiben-Lücke | Nichts | Nichts |
| Slice-Ausrichtung | Koronal | Koronal |
| Reihenfolge des Schneidens | Sequentiell (anterior nach posterior) | Sequentiell (anterior nach posterior) |
| Reihenfolge der Phasencodierung | Sequenziell (von links nach rechts) | Sequenziell (von links nach rechts) |
| NEX | 1 (bis zu 7/8 partieller Fourier zulässig) | Halber Fourier |
| Asymmetrisches Echo | Erlaubt | N/A |
| Voxel-Größe | 4 x 4 x 15 mm3 | 4 x 4 x 15 mm3 |
| Abtastdauer pro Echo | 5-7 ms | 1 bis 1,5 ms |
| Scan-Dauer | 8-12 Sek. | ≤16 Sek. |
Tabelle 2: Empfohlene Pulssequenzparameter für 129Xe-Beatmung und 1H anatomische Bildgebung. Es werden Parameter für eine 2D-HF-verwöhnte schnelle Gradienten-Echo-Sequenz für die 129-Xe-Beatmungsbildgebung(erste Spalte) und eine 2D-Single-Shot-Turbo/schnelle Spin-Echo-Sequenz für dieanatomische 1-H-Bildgebung (zweite Spalte) angegeben. Beachten Sie, dass der anatomische Scan alternativ mit einer 2D-HF-verdorbenen Gradientenechosequenz aufgenommen werden kann. Verwenden Sie in diesem Fall die gleichen Parameter wie die hier angegebenen Beatmungsscan-Parameter, fügen Sie jedoch bei Bedarf Phasen-Oversampling hinzu, um Aliasing der Arme in das Bildfeld zu vermeiden. Beachten Sie auch, dass die jeweilige Methode zur Angabe der Empfängerbandbreite je nach Scannerhersteller variiert, aber dass der richtige Wert für jeden Scannerhersteller aus der angegebenen Abtastdauer pro Echo berechnet werden kann.
2. Screening und Vorbereitung der Kandidaten für die 129-Xe-MRT
- Stellen Sie sicher, dass es beim potenziellen Probanden keine Kontraindikationen für MRT gibt, indem Sie ihn mit einem MR-Sicherheitsformular untersuchen. Die ergänzende Akte 1 zeigt ein Beispielformular, das an der University of Virginia verwendet wurde.
- Stellen Sie sicher, dass der potenzielle Proband keine Ausschlusskriterien erfüllt, die für 129Xe-MRT-Untersuchungen spezifisch sind, einschließlich, aber nicht beschränkt auf: prozentual vorhergesagte FEV1 weniger als 25%, eine dekompensierte Atemwegserkrankung innerhalb der letzten 6 Wochen, Brustumfang, der größer ist als der Innenumfang der 129Xe-HF-Spule und instabile Herzerkrankungen in der Vorgeschichte.
HINWEIS: Weitere Kriterien, die nicht auf einen sofortigen Ausschluss hinweisen, aber eine sorgfältige individuelle Abwägung erfordern, sind: der Bedarf an signifikantem zusätzlichem Sauerstoff zu Studienbeginn (d. h. mehr als 3 l/min durch Nasenkanüle) und eine Vorgeschichte neurologischer Störungen mit Anomalien zu Studienbeginn. - Wenn Sie während des Bildgebungsbesuchs Lungendiffusionstests (DLCO) oder Spirometrie durchführen, weisen Sie den Probanden an, am Tag des Studienbesuchs keine kohlensäurehaltigen Getränke zu sich zu nehmen. Wenn ein Proband verschriebene Atemwegsmedikamente einnimmt, weisen Sie ihn an, die Einnahme zu verzögern oder zu unterlassen, wenn dies im Studienprotokoll vorgesehen ist.
3. Zubereitung von hyperpolarisierten 129Xe-Dosen
HINWEIS: Detaillierte Anweisungen für 129Xe-Polarisator- und Polarisationsmessstationen sind proprietär und spezifisch für jeden Anbieter. Die folgenden Anweisungen enthalten eine grundlegende Zusammenfassung für den allgemeinen Betrieb des optischen Spinaustauschpumpens 129Xe-Polarisators.
- Entscheiden Sie sich für ein Dosisvolumen für das Subjekt. Üblicherweise wird für alle Probanden ein Gesamtdosisvolumen von 1 l gewählt, und dieses Gesamtdosisvolumen ist auf dem FDA-Etikett für 129Xe MRT angegeben. Die aktuellen Xe-MRT-CTC-Empfehlungen30 deuten jedoch darauf hin, dass das Gesamtdosisvolumen (Xenon plus Stickstoff oder Helium) auf 1/5 der forcierten Vitalkapazität (FVC) des Probanden abzielen sollte, um eine angenehme Menge an Gas zum Einatmen für jeden Probanden zu gewährleisten und die Auswirkungen im Zusammenhang mit dem Lungenvolumenunterschied zwischen den Probanden zu minimieren.
- Wenn aktuelle Spirometrie-Ergebnisse für den Probanden verfügbar sind, verwenden Sie diese, um 1/5 der FVC zu bestimmen. Wenn keine Spirometrieergebnisse verfügbar sind, schätzen Sie die Gesamtlungenkapazität (TLC) des Probanden basierend auf Größe, Geschlecht und Rasse und schätzen Sie die Gesamtdosis auf 1/6 der TLC.
- Entscheiden Sie sich für ein Volumen Xenongas, das polarisiert werden soll.
HINWEIS: Die Ziel-Xenon-Volumina für jeden Dosisbeutel werden als Dosis-Äquivalent-Volumina (DE) angegeben, die konzeptionell das Äquivalentvolumen von 100 % angereichertem, 100 % polarisiertem 129-Xe-Gas angeben. Konzeptionell ist das DE-Volumen direkt proportional zum erwarteten Signal-Rausch-Verhältnis (SNR) eines 129Xe-Scans, und das empfohlene DE-Volumen ist für bestimmte 129Xe-Scantypen höher oder niedriger, basierend auf dem für diesen Scantyp erforderlichen SNR.- Berechnen Sie das DE-Volumen für eine gegebene Xenon-Dosis wie folgt32:
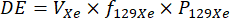
wobei VXe das Gesamtvolumen des Xenongases (alle Isotope, nicht nur 129Xe) in der Dosis, f129Xe die 129Xe-Isotopenanreicherung und P129Xe die 129Xe-Polarisation ist. - Wählen Sie die insgesamt erforderlichen DE-Volumes für den Satz von 129Xe-Scans aus, die durchgeführt werden sollen. Die empfohlenen DE-Volumina für individuelle Kalibrierungs- und Beatmungsscans betragen 75-150 ml.
HINWEIS: Für die Beatmungsbildgebung muss das SNR hoch genug sein, um robust zwischen belüfteten und nicht belüfteten Bildvoxeln unterscheiden zu können. Ein DE-Volumen von 50 ml gilt als absolutes Minimum für die Beatmungsbildgebung30 , um ein erwartetes SNR von mindestens 20 zu erreichen. Für Kalibrierungsscans kann ein DE-Volumen von nur 25 ml akzeptabel sein, wenn nur das Gasphasensignal kalibriert wird. mindestens 75 ml sollten verwendet werden, wenn sowohl die Gasphasen- als auch die gelösten Phasensignale kalibriert werden.
- Berechnen Sie das DE-Volumen für eine gegebene Xenon-Dosis wie folgt32:
- Verwenden Sie das gesamte erforderliche DE-Volumen, die bekannte isotrope Anreicherung des Xenongases von 129Xe und die geschätzte Polarisation von 129Xe basierend auf früheren Polarisationsläufen, um das gesamte erforderliche Xenongasvolumen für die Polarisation zu berechnen. Nachfolgend ist eine Beispielrechnung für einen Beatmungsscan (DE-Volumen = 75 ml) unter der Annahme einer 129Xe-Isotopenanreicherung von 85 % und einer Polarisation von 20 % dargestellt32:
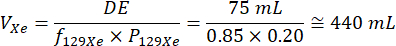
Führen Sie diese Berechnung für jede Xenon-Dosis durch, um das richtige Volumen an polarisiertem Xenongas zu bestimmen, das in jeden Dosisbeutel abgegeben werden soll.- Probanden mit niedrigem BMI (<21) haben ein höheres Risiko für tiefgreifendere Auswirkungen auf das Zentralnervensystem (ZNS) nach 129Xe-Inhalation als andere Probanden. Konsultieren Sie einen Arzt, bevor Sie Probanden mit niedrigem BMI fotografieren, und erwägen Sie, die Dosisvolumina von 129Xe zu minimieren, um diese potenziellen Probleme abzuwenden.
- Bereiten Sie den Polarisator 129Xe gemäß allen Anweisungen des Polarisatorherstellers vor.
- Die Schritte können je nach Polarisatorhersteller Folgendes umfassen: Stellen Sie sicher, dass die Stromversorgung der Helmholtz-Spule eingeschaltet ist. Evakuieren Sie den Auslassverteiler, um Verunreinigungen zu entfernen. Richten Sie den Flüssigstickstoff-Dewar um/unter dem kalten Finger ein; Schalten Sie die Laser ein und lassen Sie sie aufwärmen. Schalten Sie den Luftstrom zum Ofen ein, stellen Sie den Ofen mit dem Ofenregler auf die entsprechende Temperatur ein und lassen Sie den Ofen aufwärmen.
ACHTUNG: Flüssiger Stickstoff kann schwere Erfrierungen verursachen, wenn er mit Haut, Augen oder Kleidung in Kontakt kommt, und hochintensives Laserlicht kann Augenverletzungen verursachen, wenn es ungeschützt auf das Auge trifft. Seien Sie vorsichtig und tragen Sie bei Bedarf Schutzausrüstung.
- Die Schritte können je nach Polarisatorhersteller Folgendes umfassen: Stellen Sie sicher, dass die Stromversorgung der Helmholtz-Spule eingeschaltet ist. Evakuieren Sie den Auslassverteiler, um Verunreinigungen zu entfernen. Richten Sie den Flüssigstickstoff-Dewar um/unter dem kalten Finger ein; Schalten Sie die Laser ein und lassen Sie sie aufwärmen. Schalten Sie den Luftstrom zum Ofen ein, stellen Sie den Ofen mit dem Ofenregler auf die entsprechende Temperatur ein und lassen Sie den Ofen aufwärmen.
- Stellen Sie sicher, dass die 129Xe-Polarisationsmessstation eingeschaltet ist und die Software bereit ist, die Dosispolarisation zu messen.
- Beginnen Sie mit der Sammlung von hyperpolarisiertem 129Xe, indem Sie die folgenden Schritte ausführen.
- Starten Sie den Stickstofffluss zur kalten Fingerwärmjacke.
- Starten Sie den Xenon-Gemischfluss zum kalten Finger. Beziehen Sie sich auf die Polarisator-Leistungskurven in der Polarisatordokumentation, um die optimale Durchflussrate auszuwählen.
- Fügen Sie flüssigen Stickstoff zu dem Dewar hinzu, der den kalten Finger umgibt.
- Notieren Sie die Polarisationsstartzeit auf einem Datenblatt, um ein genaues Polarisationsvolumen zu gewährleisten.
- Sobald die Sammlung begonnen hat, passen Sie die Durchfluss- und Ofenregler an, um eine konstante Durchflussrate und Temperatur aufrechtzuerhalten, und fügen Sie bei Bedarf flüssigen Stickstoff hinzu, um den Dewar voll zu halten.
- Bereiten Sie während der Xenon-Akkumulation die Tedlar-Dosierbeutel für die Dosissammlung vor, indem Sie die Beutel mindestens 3x wiederholt mit dem Polarisationsauslassverteiler spülen und evakuieren, um Verunreinigungen und/oder depolarisierende Gase in den Beuteln zu minimieren.
- Sobald die geeignete Zeit für die Sammlung des gewünschten hyperpolarisierten 129Xe-Volumens abgelaufen ist, beenden Sie die hyperpolarisierte 129Xe-Sammlung gemäß den Anweisungen in der Polarisatordokumentation.
- Tauen Sie den gefrorenen 129Xe auf, der sich im kalten Finger niedergeschlagen hat, wie unten beschrieben.
- Befestigen Sie einen 129Xe-Dosierbeutel am Xenon-Auslass am Auslassverteiler.
- Entfernen Sie vorsichtig den Flüssigstickstoff-Dewar und ersetzen Sie ihn durch ein Auftaugefäß mit Wasser bei Raumtemperatur.
- Überwachen Sie während des Auftauens kontinuierlich den Druck, öffnen Sie das Durchflussventil vom kalten Finger bis zum Xenonauslass, sobald der Druck einen in der Polarisatordokumentation angegebenen Schwellenwert erreicht, und schließen Sie das Ventil schnell, wenn der Druck abfällt.
- Dosieren Sie auf diese Weise weiterhin sublimiertes Xenongas in den Dosisbeutel, bis die gewünschte Menge Xenon im Dosisbeutel erreicht ist.
- Fügen Sie das Puffergas (Stickstoff oder Helium) zu diesem Zeitpunkt hinzu, wenn es nicht zuvor in den Beutel gegeben wurde.
- Sobald alle gewünschten Xenon- und Puffergase in den Beutel gegeben wurden, schließen Sie schnell die Klemme am Beutelschlauch, schließen Sie das Xenon-Auslassventil und lösen Sie den Volldosisbeutel vom Polarisator.
- Bewegen Sie den Beutel sofort in das Magnetfeld, das durch das Helmholtz-Spulenpaar der Polarisationsmessstation 129Xe erzeugt wird.
VORSICHT: Im kalten Finger baut sich schnell Druck auf, wenn sich das Xenongas erwärmt und sublimiert, was zu einer potenziellen Explosionsgefahr führt, wenn sich der Druck über die sicheren Grenzen hinaus aufbaut. Befolgen Sie genau die Anweisungen für diesen Schritt in der Polarisatordokumentation und tragen Sie dabei einen Augenschutz.
- Messen und zeichnen Sie die Polarisation in jedem Dosisbeutel an der Polarisationsmessstation 129Xe gemäß den Anweisungen des Anbieters der Polarisationsmessstation auf.
- Sobald die Polarisation gemessen wurde, halten Sie 129Xe-Dosisbeutel in dem Magnetfeld, das vom Helmholtz-Spulenpaar der Polarisationsmessstation erzeugt wird, bis Sie bereit sind, dem Probanden eine Dosis zu verabreichen.
4. Vorbereitung vor dem Scan und Coaching des Probanden
HINWEIS: Es wird empfohlen, dass der Gang erst nach Abschluss der 129Xe MRT stattfinden sollte, wenn der Proband eine vollständige Untersuchung erhält, die einen sechsminütigen Gehtest beinhaltet, um zu vermeiden, dass der Proband in einer Weise ermüdet, die sich möglicherweise auf die 129Xe MRT-Ergebnisse auswirken könnte. Dies ist besonders relevant für Patienten mit Herz-Lungen-Erkrankungen.
- Vergewissern Sie sich, dass der Proband alle Anweisungen vor dem Besuch, wie in Schritt 2 beschrieben, korrekt ausgeführt hat und dass seit dem Screening des Probanden keine gesundheitlichen Veränderungen aufgetreten sind, die die Ausschlusskriterien der Studie erfüllen oder eine MRT-Kontraindikation darstellen würden.
- Führen Sie alle erforderlichen körperlichen Tests an dem Probanden durch, einschließlich eines Elektrokardiogramms (EKG); eine Sammlung von Vitalwerten wie Körpertemperatur, Herzfrequenz, Atemfrequenz, Blutsauerstoffsättigung (SpO2) und Blutdruck; Spirometrie; und ein DLCO-Test.
- Überwachen Sie diese Tests auf mögliche Warnzeichen, einschließlich niedrigemSpO 2 (<92%), erhöhtem Blutdruck oder signifikanter Abweichung der Testergebnisse von bestehenden Ausgangswerten für den Probanden.
HINWEIS: Diese Messwerte, insbesondere SpO2 zu Studienbeginn, werden überprüft, da erwartet wird, dass während der 129Xe-Inhalation eine leichte vorübergehende Sauerstoffentsättigung auftritt. Bei Patienten mit SpO2 <92% oder anderen Warnzeichen konsultieren Sie einen Arzt, um die Eignung des Probanden für 129Xe-MRT-Tests zu bestätigen und zu bestätigen, ob zwischen 129Xe-Inhalationen zusätzliches O2 verwendet werden soll. - Coachen Sie den Probanden in der korrekten 129Xe-Inhalationsprozedur, wie unten beschrieben.
- Bereiten Sie einen oder mehrere Tedlar-Beutel mit Luft vor, damit das Subjekt außerhalb des Scanners üben kann. Verwenden Sie ein Luftvolumen, das dem Gesamtvolumen an Xenon und Puffergas entspricht, das während der eigentlichen Studie aus dem Beutel eingeatmet wird.
- Bereiten Sie Nasenklammern vor, die das Subjekt während des Scannens mit angehaltenem Atem tragen kann. Befestigen Sie die Nasenklammern vor Beginn des Atemanhaltens an der Nase des Probanden (sowohl zum Üben als auch zum eigentlichen Scannen).
- Coachen Sie den Probanden bei jedem Versuch mit einem luftgefüllten Beutel und befolgen Sie dabei die folgenden Anweisungen. Der Proband sollte mit dem Einatmen des Beutels ab einem Zielvolumen der funktionellen Restkapazität beginnen. Überwachen Sie während des folgenden Verfahrens die Brust des Probanden, um sicherzustellen, dass er die Anweisungen wie angegeben ausführt.
- Halten Sie den Beutel bereit, aber verabreichen Sie ihn noch nicht dem Subjekt. Bitten Sie das Subjekt: Atmen Sie regelmäßig ein. Atme es aus. Atmen Sie regelmäßig ein. Atme es aus.
- Legen Sie den am Tedlar-Beutel befestigten Schlauch in den Mund des Probanden. Halten Sie den Beutel dort, wo der Proband einatmen kann, und öffnen Sie das Ventil. Bitten Sie das Subjekt: Atmen Sie ein. Einatmen. Einatmen.
- Sobald der Proband den gesamten Beutelinhalt eingeatmet hat, bitten Sie den Probanden: Halten Sie den Atem an. Weisen Sie den Scanner-Bediener sofort an: Go!
HINWEIS: Beim Scannen des Motivs sollte der Scannerbediener den Scan starten, wenn er Go! Diese Anweisung ist nicht für das Subjekt bestimmt (d. h. es sollte ruhig bleiben und weiterhin den Atem anhalten, wie unmittelbar zuvor angewiesen), warnt das Subjekt jedoch davor, dass das Scannen unmittelbar bevorsteht. - Warten Sie, bis der Scan abgeschlossen ist, oder während Sie üben, bis eine Zählung von 10-15 s durchgeführt wird, was der ungefähren Zeit entspricht, die ein typischer 129Xe-Scan benötigt.
- Bitten Sie das Subjekt: Atmen. Das Subjekt atmet an dieser Stelle aus. Trainieren Sie den Probanden, an dieser Stelle mehrmals tief ein- und auszuatmen, um eine schnellere Entfernung von 129Xe aus der Lunge und eine schnellere Rückkehr zur normalen Sauerstoffsättigung zu ermöglichen.
- Stellen Sie sicher, dass der Proband in der Lage ist, diese Anweisungen zuverlässig auszuführen. Erwägen Sie, Probanden auszuschließen, die nicht in der Lage sind, das gesamte Gasvolumen einzuatmen, nicht in der Lage sind, den Atem anzuhalten, oder die während des Tests während des Tests anhaltend husten.
HINWEIS: Das Ergebnis dieses Tests ist entscheidend für die Bestimmung der wahrscheinlichen Bildqualität. Diese Überprüfung der zuverlässigen Compliance der Probanden ist besonders wichtig im Zusammenhang mit der pädiatrischen Bildgebung und der Bildgebung schwerer Lungenerkrankungen, da Probanden in einer oder beiden dieser Kategorien eher Schwierigkeiten haben, das erforderliche Atemanhalten zuverlässig durchzuführen.
5. Vorbereitung des MRT-Scannerraums und Positionierung des Probanden auf dem Scanner-Patiententisch
- Stellen Sie sicher, dass jeder, der den MRT-Scannerraum betritt oder voraussichtlich betreten wird (Proband und Personal), alle metallischen und/oder elektronischen Gegenstände aus seinen Taschen und seiner Person entfernt, bevor er den Scannerraum betritt.
- Bereiten Sie die 129Xe-Westenspule vor, indem Sie sie an den Scanner anschließen und auf den Patiententisch des MRT-Scanners legen.
- Weisen Sie den Probanden an, sich in Rückenlage (oder mit dem Kopf voran in Rückenlage) auf den Patiententisch zu legen, wenn dies für die Gestaltung des Scannerraums besser geeignet ist. Legen Sie in Absprache mit dem Probanden Kissen unter Kopf, Knie usw., um sicherzustellen, dass der Proband während der gesamten Untersuchung bequem ruhig liegen kann.
- Befestigen Sie die 129Xe-Westenspule um die Brust des Subjekts. Streben Sie an, dass die Mittellinie der Spule in Kopf-Fuß-Richtung so nah wie möglich an der erwarteten Mittellinie der Lunge des Probanden bei einem angenehmen Lungenaufblasniveau liegt, um Signalreduktionen an der Peripherie der Lunge zu vermeiden.
HINWEIS: Es ist ein häufiger Fehler, die Spule zu weit in Richtung der Füße des Subjekts zu positionieren. Wenn Sie die Spule wie oben beschrieben positionieren, kann die Spule weiter in Richtung des Kopfes des Probanden gebracht werden, als naiv erwartet werden könnte. Darüber hinaus müssen die Arme des Probanden möglicherweise über dem Kopf und außerhalb der Spule positioniert werden, wenn der Brustdurchmesser des Probanden dies erfordert. Der spezifische Brustdurchmesser, ab dem diese Positionierung erforderlich ist, hängt von der spezifischen Scanner- und Spulenhardware ab. Bei kleineren Motiven können die Arme entweder über dem Kopf und außerhalb der Spule oder an den Seiten und innerhalb der Spule positioniert werden. - Stellen Sie ein MRT-sicheres Pulsoximeter neben dem Patiententisch im MRT-Scannerraum auf und verbinden Sie die Pulsoximetersonde mit dem Probanden. Stellen Sie sicher, dass das Pulsoximeter korrekt anzeigt.
- Setzen Sie eine Nasenkanüle in die Nase des Probanden ein (oder halten Sie bei einem gesunden Probanden eine im Scannerraum bereit) und schließen Sie sie an eine Sauerstoffquelle an, die verwendet wird, wenn der SpO2 des Probanden länger als 2 Minuten nach der Inhalation der Dosis um mehr als 10 % abfällt. Stellen Sie den Sauerstofftank und den Atemregler MR-sicher auf, basierend auf den örtlichen Sicherheitsrichtlinien in erreichbarer Entfernung.
- Schieben Sie den Patiententisch in den MRT-Scanner und richten Sie die Mittellinie der Spule/der Lunge des Probanden auf das Isozentrum des Scanners aus.
6. Scanvorgang
- Geben Sie in der Benutzeroberfläche des MRT-Scanners die Probandendaten ein und öffnen Sie das zuvor vorbereitete (wie in Schritt 1 beschriebene) 129Xe MRT-Protokoll.
- Stellen Sie sicher, dass 129Xe-Dosen wie in Schritt 3 beschrieben vorbereitet wurden und dass sich 129Xe-Dosisbeutel in dem Magnetfeld befinden, das vom Helmholtz-Spulenpaar der Polarisationsmessstation (oder in einem gleichwertigen Gerät) erzeugt wird, um die Depolarisationsrate von 129Xe zu minimieren.
- Führen Sie einen 1-stündigenLokalisierungsscan mit einem vom Anbieter bereitgestellten Standardprotokoll (z. B. einem Dreiebenen-Lokalisierer) durch, wie unten beschrieben.
- Weisen Sie den Probanden an, einen angenehmen, natürlichen Atemzug zu nehmen und den Atem anzuhalten. Während das Subjekt den Atem anhält, führen Sie den Lokalisierungsscan aus.
- Zeigen Sie die Ergebnisse des Lokalisierungsscans auf der MRT-Scanner-Oberfläche an. Wenn Bilder Artefakte zeigen (z. B. wenn metallhaltige Kleidung nicht entfernt wurde), beheben Sie alle Probleme und wiederholen Sie die Lokalisierung. Wenn das Sichtfeld des Lokalisierers schlecht auf das Motiv zentriert ist, positionieren Sie das Motiv neu und wiederholen Sie den Vorgang. Sobald akzeptable Lokalisierungsbilder erhalten wurden, fahren Sie mit dem nächsten Schritt fort.
- Führen Sie die ersten Anpassungen vor dem Scan für 129Xe-Scans wie unten beschrieben durch.
- Stellen Sie die anfängliche 129Xe-Mittenfrequenz ein, indem Sie die 1-H-Mittenfrequenz vom Lokalisierer durch 3,61529 dividieren (das ungefähre Verhältnis der jeweiligen gyromagnetischen Verhältnisse von 1H und 129Xe).
- Stellen Sie die anfängliche Einstellung des 129Xe-Senders basierend auf den Kalibrierungsergebnissen früherer Probanden mit ähnlichem Körperhabitus, der Skalierung basierend auf der1-H-Referenzspannung oder dem gemessenen Gewicht des Probanden ein. Details zu den Einstellungen des 129Xe-Senders sind spezifisch für den Scanner- und 129Xe-Spulenhersteller.
- Verwenden Sie die Standard-Shim-Einstellungen des Scanners für alle 129Xe-Erfassungen.
- Nachdem Sie die oben beschriebenen Einstellungen vor dem Scan durchgeführt haben, erfassen Sie den 129Xe-Kalibrierungsscan, um die 129Xe-Mittenfrequenz und die Sendereinstellungen wie unten beschrieben zu ermitteln.
- Laden Sie die 129Xe-Kalibrierungssequenz aus dem vorbereiteten Protokoll. Stellen Sie sicher, dass alle Parameter der Impulssequenz wie gewünscht sind, und stellen Sie die Einstellung für die Scanausführung so ein, dass der Scan mit einem einzigen Klick ausgeführt werden kann.
- Bringen Sie den 129Xe-Dosisbeutel, der für den 129Xe-Kalibrierungsscan vorgesehen ist, von der Polarisationsmessstation in den Scannerraum. Halten oder legen Sie den Dosierbeutel in der Nähe des Subjekts bereit; Vermeiden Sie Bereiche in der Nähe der Bohrungsöffnung, in denen sich die Magnetfeldstärke schnell ändert.
- Unterstützen Sie den Probanden beim Einatmen der 129Xe-Dosis aus dem Beutel, indem Sie das in Schritt 4 beschriebene Inhalationsverfahren befolgen.
- Führen Sie den Scan sofort aus, wenn Sie Go! signalisiert von der Person, die dem Probanden hilft.
- Überwachen Sie das Motiv, während der Scan fortgesetzt wird. Wenn die Person sichtbar ausatmet, hustet, sich bewegt usw., wiederholen Sie den Scan, wenn möglich.
- Sobald der Scan abgeschlossen ist, weisen Sie den Probanden an, frei auszuatmen und zu atmen.
- Überwachen Sie nach dem Scan die Herzfrequenz und den SpO2 des Probanden mit dem Pulsoximeter und überwachen Sie die vorübergehenden Auswirkungen des Zentralnervensystems (wie Schwindel, Benommenheit, Euphorie und Parästhesien) über verbale Kommunikation mit dem Probanden.
HINWEIS: Bei fast allen Probanden treten sehr milde ZNS-Effekte auf, die keine Intervention erfordern, mit Ausnahme von Probanden mit niedrigem Körperfettgehalt, wie in Schritt 3.2 beschrieben. - Warten Sie, bis sich Abweichungen vom Ausgangswert aufgelöst haben, bevor Sie eine weitere Dosis von 129Xe verabreichen. Wenn keine signifikanten Abweichungen vom Ausgangswert auftreten, warten Sie mindestens 2 Minuten, bevor Sie eine weitere Dosis von 129Xe verabreichen.
HINWEIS: Ein typischer Zeitverlauf der Sauerstoffentsättigung und -erholung ist wie folgt: Die Entsättigung beginnt 10-20 Herzschläge nach Abschluss der 129Xe-Inhalation, der Nadir tritt 20-30 Herzschläge nach Abschluss der Inhalation auf und die Erholung erfolgt innerhalb von 45-50 Herzschlägen nach Abschluss der Inhalation. Der größte Teil der Entsättigung verschwindet innerhalb von 30 s nach 129Xe-Inhalation und sollte in der Regel innerhalb von 2 Minuten vollständig verschwinden. Konsultieren Sie einen Arzt, wenn die anhaltende Entsättigung (mehr als 10 % des Ausgangswerts der Probanden) länger als 2 Minuten anhält, da es ratsam sein kann, keine weiteren 129Xe-Dosen zu verabreichen und/oder die Studie zu beenden.
- Führen Sie die 129Xe-Kalibrierungsanalyse wie unten beschrieben durch (z. B. mit einem eigenständigen Analysetool).
- Bestimmen Sie die Mittenfrequenz von 129Xe anhand des Spektrums der ersten Gasphasen-FIDs.
- Bestimmen Sie die Einstellung des 129Xe-Senders wie unten beschrieben.
- Passen Sie die Spitzenintensitäten der 20 Gasphasen-FIDs an die folgende Funktion30 an und lösen Sie den Flip-Winkel α auf:
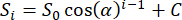
wobei Si die Größe der Signalintensität ist, die sich aus der i-tenAnregung ergibt, S0 die Größe der Signalintensität aus der ersten Anregung und C ein Rauschversatzparameter. - Sobald α erhalten ist, skalieren Sie die anfängliche Einstellung des 129Xe-Senders für nachfolgende Scans um 20°/α, unter der Annahme, dass 20° als beabsichtigter Kalibrierungsdrehwinkel verwendet wurde, wie in Tabelle 1 empfohlen.
- Passen Sie die Spitzenintensitäten der 20 Gasphasen-FIDs an die folgende Funktion30 an und lösen Sie den Flip-Winkel α auf:
- Sobald die letzten 129Xe-Einstellungen vor dem Scan vorgenommen wurden und der Proband für die nächste 129Xe-Dosis bereit ist, führen Sie den 129Xe-Beatmungsscan wie unten beschrieben durch.
- Laden Sie die 129Xe-Beatmungssequenz aus dem vorbereiteten Protokoll. Stellen Sie sicher, dass alle Impulssequenzparameter wie gewünscht sind, und stellen Sie die Einstellung für die Scanausführung so ein, dass der Scan sofort nach einem einzigen Klick beginnt.
- Wählen Sie die FOV-Größe und die Position der Mitte basierend auf den Ergebnissen der Lokalisierung aus. Streben Sie an, dass das Zentrum des Sichtfelds in allen drei Dimensionen mit dem Zentrum der Lunge übereinstimmt, und streben Sie an, dass das Sichtfeld groß genug ist, um bequem die gesamte Brusthöhle einschließlich der Gesamtheit beider Lungen aufzunehmen.
- Bringen Sie den für den 129Xe-Beatmungsscan vorgesehenen 129Xe-Dosisbeutel von der Polarisationsmessstation in den Scannerraum. Halten oder legen Sie den Dosierbeutel in der Nähe des Subjekts bereit; Vermeiden Sie Bereiche in der Nähe der Bohrungsöffnung, in denen sich die Magnetfeldstärke schnell ändert.
- Unterstützen Sie den Probanden beim Einatmen der 129Xe-Dosis aus dem Beutel, indem Sie das in Schritt 4 beschriebene Inhalationsverfahren befolgen.
- Führen Sie den Scan sofort aus, wenn Sie Go! signalisiert von der Person, die dem Probanden hilft.
- Überwachen Sie das Motiv, während der Scan fortgesetzt wird. Wenn die Person sichtbar ausatmet, hustet, sich bewegt usw., wiederholen Sie den Scan, wenn möglich.
- Sobald der Scan abgeschlossen ist, weisen Sie den Probanden an, frei auszuatmen und zu atmen.
- Überwachen Sie nach dem Scan die Herzfrequenz und den SpO2 des Probanden mit dem Pulsoximeter und überwachen Sie die vorübergehenden Auswirkungen des Zentralnervensystems (wie Schwindel, Benommenheit, Euphorie und Parästhesien) über verbale Kommunikation mit dem Probanden.
- Warten Sie, bis sich Abweichungen vom Ausgangswert aufgelöst haben, bevor Sie eine weitere Dosis von 129Xe verabreichen. Wenn keine signifikanten Abweichungen vom Ausgangswert auftreten, warten Sie mindestens 2 Minuten, bevor Sie eine weitere Dosis von 129Xe verabreichen.
- Führen Sie 1H anatomischen Scan wie unten beschrieben durch.
- Laden Sie dieanatomische 1-H-Sequenz aus dem vorbereiteten Protokoll. Stellen Sie sicher, dass alle Parameter der Impulssequenz wie gewünscht sind, und stellen Sie die Einstellung für die Scanausführung so ein, dass der Scan mit einem einzigen Klick ausgeführt werden kann.
- Bringen Sie den mit Luft gefüllten und auf das Volumen des für den Beatmungsscan 129Xe verwendeten Dosisbeutels abgestimmten Dosisbeutel in den Scannerraum.
- Helfen Sie dem Probanden beim Einatmen der Luftdosis aus dem Beutel, indem Sie das in Schritt 4 beschriebene Inhalationsverfahren befolgen.
- Führen Sie den Scan sofort aus, wenn Sie Go! signalisiert von der Person, die dem Probanden hilft.
- Überwachen Sie das Motiv, während der Scan fortgesetzt wird. Wenn die Person sichtbar ausatmet, hustet, sich bewegt usw., wiederholen Sie den Scan, wenn möglich.
- Sobald der Scan abgeschlossen ist, weisen Sie den Probanden an, frei auszuatmen und zu atmen.
7. Verfahren nach dem Scan
- Nehmen Sie die Vitalwerte des Probanden auf die gleiche Weise wie vor dem Scanvorgang vor. Wenn die Vitalwerte abnormal werden, weisen Sie den Probanden an, 30-60 Minuten zu warten und/oder bis die Vitalwerte in die Nähe der Ausgangslinie zurückkehren, bevor Sie gehen.
8. Analyse von 129Xe-MRT-Beatmungsdaten
HINWEIS: Die erfassten 129Xe-Beatmungs- und 1H-Anatomiebilder sollten automatisch auf dem MRT-Scanner-Computer unter Verwendung der Standard-Bildrekonstruktionspipeline des Herstellers rekonstruiert werden.
- Exportieren Sie 129Xe-Beatmung und 1H anatomische Scans als DICOM-Bilddateien mit dem minimal zulässigen Interpolationsgrad (idealerweise keine).
- Berechnen Sie den Prozentsatz der Lüftungsdefekte (VDP) mit Programmier- oder Bildanalysesoftware unter Verwendung der folgenden Gleichung8:
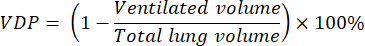
- Bestimmen Sie das belüftete Volumen durch Segmentierung von 129Xe-Beatmungsscans, entweder manuell oder mit einem von mehreren vorhandenen automatisierten Ansätzen33.
HINWEIS: Eine einfache Methode zur binarisierten Segmentierung von 129Xe-Bildern verwendet einen Schwellenwert, der wie folgt definiertist 8: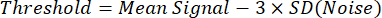
wobei "Mittelwertsignal" der Mittelwert der 129Xe-Signalintensität innerhalb eines benutzerdefinierten Interessenbereichs eines starken 129Xe-Signals in der Lunge und "SD(Rauschen)" die Standardabweichung der 129Xe-Signalintensität innerhalb eines Bereichs nahe dem Rand des Sichtfelds ist, der sich weit von der Lunge oder Luftröhre entfernt befindet. - Bestimmen Sie das Gesamtlungenvolumen durch Segmentierung von anatomischen1-H-Scans, entweder manuell oder mit vorhandenen automatisierten Ansätzen34.
- Sobald diese Segmentierungen durchgeführt wurden, berechnen Sie die entsprechenden Volumina als Anzahl der segmentierten Voxel multipliziert mit dem Bildvoxelvolumen (unter Berücksichtigung aller Interpolationen, die beim Konvertieren der Bilder in DICOM-Dateien durchgeführt werden).
- Bestimmen Sie das belüftete Volumen durch Segmentierung von 129Xe-Beatmungsscans, entweder manuell oder mit einem von mehreren vorhandenen automatisierten Ansätzen33.
Ergebnisse
Abbildung 1 zeigt repräsentative Beatmungs- und Drei-Ebenen-Lokalisierungsbilder eines gesunden Individuums. In den Beatmungsbildern kann ein hohes 129Xe-Signal in der gesamten Lunge beobachtet werden, und bei dieser Person ist keine Beatmungsstörung erkennbar.
Abbildung 2, Abbildung 3 und Abbildung 4 zeigen repräsentative Beatmungs- und anatomische Bilder von e...
Diskussion
Die oben beschriebenen Beatmungs- und anatomischen MRT-Ansätze sind so konzipiert, dass sie die Bildqualität und das SNR maximieren und gleichzeitig die Einfachheit der Implementierung beibehalten - diese Sequenzprotokolle können im Allgemeinen an die Impulssequenzen der Herstellerprodukte angepasst werden, sofern der multinukleare Betrieb aktiviert ist, und die Bilder werden automatisch auf dem Scannercomputer rekonstruiert. Ein Nachteil der hier beschriebenen 2D-Ansätze ist die Verwendung von schnittselektiven Anre...
Offenlegungen
Die Autoren J.F.M., J.P.M. und Y.M.S. nehmen an klinischen Studien teil, die von Polarean, Inc. unterstützt werden. Die Autoren J.F.M. und Y.M.S. bieten Polarean, Inc. Beratungsdienste an (weniger als 5000 USD). Autor J.P.M. erhält Forschungsunterstützung von Polarean, Inc.
Danksagungen
Diese Arbeit wurde von den National Institutes of Health (Fördernummern R01-CA172595-01, R01-HL132177, R01-HL167202, S10-OD018079 und UL1-TR003015) und von Siemens Medical Solutions finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5T or 3T human MRI scanner | Siemens | MAGNETOM Symphony (1.5T) or Vida (3T); older models fine, as long as multinuclear option is/can be installed; scanners also available from GE and Philips | |
| 129Xe hyperpolarizer | Polarean | 9820 | |
| 129Xe MRI phantom | |||
| 129Xe MRI vest coil | Clinical MR Solutions | Also available from other vendors | |
| 129Xe polarization measurement station | Polarean | 2881 | |
| 1H MRI phantom | |||
| Coil file for 129Xe MRI vest coil | Also available from other vendors for their respective coils | ||
| ECG machine | |||
| Helium buffer gas | |||
| Interface box from coil to scanner | May be built into coil, but needs to be included separately if not | ||
| Liquid nitrogen | |||
| MRI-safe pulse oximeter | Philips | Expression MR200 | |
| Nitrogen buffer gas | |||
| PFT machine | |||
| Programming/image analysis software | MATLAB | R2023a | Various other options available |
| Pulse sequence design software | Siemens | IDEA software package; also available from GE and Philips for their respective scanners | |
| Scanner multinuclear option | Siemens | Scanner integrated hardware/software package; also available from GE and Philips for their respective scanners | |
| Tedlar gas sampling bags (500, 750, 1000, 1250, 1500 mL) | |||
| Xenon gas (129Xe isotopically enriched) |
Referenzen
- Roos, J. E., McAdams, H. P., Kaushik, S. S., Driehuys, B. Hyperpolarized gas MRI: Technique and applications. Magn Reson Imaging Clin N Am. 23 (2), 217-229 (2015).
- Mugler, J. P., Altes, T. A. Hyperpolarized 129Xe MRI of the human lung. J Magn Reson Imaging. 37 (2), 313-331 (2013).
- Ebner, L., et al. The role of hyperpolarized 129xenon in MR imaging of pulmonary function. Eur J Radiol. 86, 343-352 (2017).
- He, M., Driehuys, B., Que, L. G., Huang, Y. C. T. Using hyperpolarized 129Xe MRI to quantify the pulmonary ventilation distribution. Acad Radiol. 23 (12), 1521-1531 (2016).
- Walkup, L. L., et al. Xenon-129 MRI detects ventilation deficits in paediatric stem cell transplant patients unable to perform spirometry. Eur Respir J. 53 (5), 1801779 (2019).
- Virgincar, R. S., et al. Quantitative analysis of hyperpolarized 129Xe ventilation imaging in healthy volunteers and subjects with chronic obstructive pulmonary disease. NMR Biomed. 26 (4), 424-435 (2013).
- Ebner, L., et al. Hyperpolarized 129Xenon magnetic resonance imaging to quantify regional ventilation differences in mild to moderate Asthma: A prospective comparison between semiautomated ventilation defect percentage calculation and pulmonary function tests. Invest Radiol. 52 (2), 120-127 (2017).
- Woodhouse, N., et al. Combined helium-3/proton magnetic resonance imaging measurement of ventilated lung volumes in smokers compared to never-smokers. J Magn Reson Imaging. 21 (4), 365-369 (2005).
- Mugler, J. P., et al. Simultaneous magnetic resonance imaging of ventilation distribution and gas uptake in the human lung using hyperpolarized xenon-129. Proc Natl Acad Sci U S A. 107 (50), 21707-21712 (2010).
- Qing, K., et al. Assessment of lung function in asthma and COPD using hyperpolarized 129Xe chemical shift saturation recovery spectroscopy and dissolved-phase MRI. NMR Biomed. 27 (12), 1490-1501 (2014).
- Cleveland, Z. I., et al. Hyperpolarized 129Xe MR imaging of alveolar gas uptake in humans. PLoS One. 5 (8), 12192 (2010).
- Wang, Z., et al. Using hyperpolarized 129Xe gas-exchange MRI to model the regional airspace, membrane, and capillary contributions to diffusing capacity. J Appl Physiol. 130 (5), 1398-1409 (2021).
- Guan, S., et al. 3D single-breath chemical shift imaging hyperpolarized Xe-129 MRI of healthy, CF, IPF, and COPD subjects. Tomography. 8 (5), 2574-2587 (2022).
- Ouriadov, A., et al. Lung morphometry using hyperpolarized (129) Xe apparent diffusion coefficient anisotropy in chronic obstructive pulmonary disease. Magn Reson Med. 70 (129), 1699-1706 (2013).
- Yablonskiy, D. A., Sukstanskii, A. L., Quirk, J. D., Woods, J. C., Conradi, M. S. Probing lung microstructure with hyperpolarized noble gas diffusion MRI: theoretical models and experimental results. Magn Reson Med. 71 (2), 486-505 (2014).
- Chan, H. F., Stewart, N. J., Norquay, G., Collier, G. J., Wild, J. M. 3D diffusion-weighted 129 Xe MRI for whole lung morphometry. Magn Reson Med. 79 (6), 2986-2995 (2018).
- Walkup, L. L., et al. tolerability and safety of pediatric hyperpolarized 129Xe magnetic resonance imaging in healthy volunteers and children with cystic fibrosis. Pediatr Radiol. 46 (12), 1651-1662 (2016).
- Driehuys, B., et al. Chronic obstructive pulmonary disease: safety and tolerability of hyperpolarized 129Xe MR imaging in healthy volunteers and patients. Radiology. 262 (1), 279-289 (2012).
- Myc, L., et al. Characterisation of gas exchange in COPD with dissolved-phase hyperpolarised xenon-129 MRI. Thorax. 76 (2), 178-181 (2021).
- Kaushik, S. S., et al. Measuring diffusion limitation with a perfusion-limited gas-Hyperpolarized 129Xe gas-transfer spectroscopy in patients with idiopathic pulmonary fibrosis. J Appl Physiol. 117 (6), 577-585 (2014).
- Dournes, G., et al. The clinical use of lung MRI in cystic fibrosis: What, now, how. Chest. 159 (6), 2205-2217 (2021).
- Thomen, R. P., et al. Hyperpolarized 129Xe for investigation of mild cystic fibrosis lung disease in pediatric patients. J Cyst Fibros. 16 (2), 275-282 (2017).
- Mammarappallil, J. G., Rankine, L., Wild, J. M., Driehuys, B. New developments in imaging idiopathic pulmonary fibrosis with hyperpolarized xenon magnetic resonance imaging. J Thorac Imaging. 34 (2), 136-150 (2019).
- Rankine, L. J., et al. 129Xenon gas exchange magnetic resonance imaging as a potential prognostic marker for progression of idiopathic pulmonary fibrosis. Ann Am Thorac. 17 (1), 121-125 (2020).
- Mata, J., et al. Evaluation of regional lung function in pulmonary fibrosis with xenon-129 MRI. Tomography. 7 (3), 452-465 (2021).
- Svenningsen, S., et al. Hyperpolarized (3) He and (129) Xe MRI: Differences in asthma before bronchodilation. J Magn Reson Imaging. 38 (3), 1521-1530 (2013).
- Stewart, N. J., et al. Comparison of 3He and 129Xe MRI for evaluation of lung microstructure and ventilation at 1.5T. J Magn Reson Imaging. 48 (3), 632-642 (2018).
- Hughes, P. J. C., et al. Assessment of the influence of lung inflation state on the quantitative parameters derived from hyperpolarized gas lung ventilation MRI in healthy volunteers. J Appl Physiol. 126 (1), 183-192 (2019).
- Polarean. . FDA Approves Polarean's XENOVIEWTM (xenon Xe 129 hyperpolarized) for use with MRI for the evaluation of lung ventilation. , (2022).
- Niedbalski, P. J., et al. Protocols for multi-site trials using hyperpolarized 129Xe MRI for imaging of ventilation, alveolar-airspace size, and gas exchange: A position paper from the 129Xe MRI clinical trials consortium. Magn Reson Med. 86 (6), 2966-2986 (2021).
- Bier, E. A., et al. A thermally polarized 129 Xe phantom for quality assurance in multi-center hyperpolarized gas MRI studies. Magn Reson Med. 82 (5), 1961-1968 (2019).
- He, M., et al. Dose and pulse sequence considerations for hyperpolarized 129Xe ventilation MRI. Magn Reson Imaging. 33 (7), 877-885 (2015).
- Tustison, N. J., et al. Image- versus histogram-based considerations in semantic segmentation of pulmonary hyperpolarized gas images. Magn Reson Med. 86 (5), 2822-2836 (2021).
- Tustison, N. J., et al. Convolutional neural networks with template-based data augmentation for functional lung image quantification. Acad Radiol. 26 (3), 412-423 (2019).
- Wild, J. M., et al. Comparison between 2D and 3D gradient-echo sequences for MRI of human lung ventilation with hyperpolarized 3He. Magn Reson Med. 52 (3), 673-678 (2004).
- Willmering, M. M., et al. Improved pulmonary 129 Xe ventilation imaging via 3D-spiral UTE MRI. Magn Reson Med. 84 (1), 312-320 (2020).
- Collier, G. J., et al. Single breath-held acquisition of coregistered 3D 129 Xe lung ventilation and anatomical proton images of the human lung with compressed sensing. Magn Reson Med. 82 (1), 342-347 (2019).
- Zha, W., et al. Semiautomated ventilation defect quantification in exercise-induced bronchoconstriction using hyperpolarized helium-3 magnetic resonance imaging: a repeatability study. Acad Radiol. 23 (9), 1104-1114 (2016).
- Ray, N., Acton, S. T., Altes, T. A., de Lange, E. E., Brookeman, J. R. Merging parametric active contours within homogeneous image regions for MRI-based lung segmentation. IEEE Trans Med Imaging. 22 (2), 189-199 (2003).
- Hughes, P. J. C., et al. Spatial fuzzy c-means thresholding for semiautomated calculation of percentage lung ventilated volume from hyperpolarized gas and 1 H MRI. J Magn Reson Imaging. 47 (3), 640-646 (2018).
- Tustison, N. J., et al. Ventilation-based segmentation of the lungs using hyperpolarized (3)He MRI. J Magn Reson Imaging. 34 (3), 831-841 (2011).
- Kanhere, N., et al. Correlation of lung clearance index with hyperpolarized 129Xe magnetic resonance imaging in pediatric subjects with cystic fibrosis. Am J Respir Crit Care Med. 196 (8), 1073-1075 (2017).
- Rayment, J. H., et al. Hyperpolarised 129Xe magnetic resonance imaging to monitor treatment response in children with cystic fibrosis. Eur Respir J. 53 (5), 1802188 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten