Method Article
Herstellung von Streptavidin-Affinitätsgittern für die Probenvorbereitung der Kryo-Elektronenmikroskopie
In diesem Artikel
Zusammenfassung
Ein Schritt-für-Schritt-Protokoll zur Herstellung von Streptavidin-Affinitätsgittern wird für die Verwendung in Strukturstudien anspruchsvoller makromolekularer Proben durch Kryo-Elektronenmikroskopie bereitgestellt.
Zusammenfassung
Streptavidin-Affinitätsgitter bieten Strategien zur Überwindung vieler häufig auftretender Herausforderungen bei der Probenvorbereitung in der Kryo-Elektronenmikroskopie (Kryo-EM), einschließlich Probendenaturierung und bevorzugter Orientierungen, die aufgrund der Luft-Wasser-Grenzfläche auftreten können. Streptavidin-Affinitätsgitter werden jedoch derzeit von wenigen Kryo-EM-Labors verwendet, da sie nicht im Handel erhältlich sind und einen sorgfältigen Herstellungsprozess erfordern. Zweidimensionale Streptavidin-Kristalle werden auf eine biotinylierte Lipid-Monoschicht gezüchtet, die direkt auf Standard-Kryo-EM-Gitter mit löchrigem Kohlenstoff aufgebracht wird. Die hochaffine Wechselwirkung zwischen Streptavidin und Biotin ermöglicht die anschließende Bindung von biotinylierten Proben, die während der Kryo-EM-Probenvorbereitung vor der Luft-Wasser-Grenzfläche geschützt sind. Darüber hinaus bieten diese Gitter eine Strategie zur Konzentration von Proben, die in begrenzten Mengen verfügbar sind, und zur Aufreinigung von Proteinkomplexen von Interesse direkt auf den Gittern. Hier wird ein schrittweises, optimiertes Protokoll für die robuste Herstellung von Streptavidin-Affinitätsgittern für den Einsatz in Kryo-EM- und Negativfärbeexperimenten bereitgestellt. Darüber hinaus ist ein Leitfaden zur Fehlerbehebung für häufig auftretende Herausforderungen enthalten, um die Verwendung von Streptavidin-Affinitätsgittern für die größere Kryo-EM-Gemeinschaft zugänglicher zu machen.
Einleitung
Die Elektronen-Kryomikroskopie (Kryo-EM) hat das Gebiet der Strukturbiologie revolutioniert, indem sie die makromolekulare Strukturbestimmung großer, flexibler und heterogener Proben ermöglicht, die bisher mit Röntgenkristallographie oder Kernspinresonanz nicht zugänglich waren1. Bei dieser Methode werden Makromoleküle in Lösung schockgefroren, um eine dünne Schicht Glaseis zu erzeugen, die anschließend mit einem Elektronenmikroskop abgebildet werden kann. In den letzten Jahren haben bedeutende Fortschritte sowohl bei der Mikroskophardware als auch bei der Bildverarbeitungssoftware die Probentypen, die für die hochauflösende Strukturbestimmung durch Kryo-EM geeignet sind, weiter erweitert.
Dennoch bleibt die Präparation dünner, verglaster Proben einer der kritischsten Schritte bei der makromolekularen Strukturbestimmung mittels Kryo-EM. Biologische Proben sind oft dynamisch, zerbrechlich, anfällig für Denaturierung und manchmal nur in geringen Mengen für Kryo-EM-Studien verfügbar. Während des Blotting-Prozesses interagieren diese Partikel mit der hydrophoben Luft-Wasser-Grenzfläche, was zu partikelbevorzugten Orientierungen, der Demontage fragiler Komplexe, einer teilweisen oder vollständigen Denaturierung der Probe und einer Aggregation führen kann 2,3,4. Die Verwendung von Detergenzien oder anderen Tensiden, die chemische Vernetzung und die Adsorption von Proben zur Stützung von Schichten sind gängige Strategien zur Konservierung biologischer Proben während des Gefrierprozesses. Trägerschichten wie Graphenoxid 5,6,7 oder amorpher Kohlenstoff8 dienen ebenfalls dazu, Partikel durch Adsorption auf dem Gitter zu konzentrieren, wenn die Probe in begrenzten Mengen verfügbar ist. Diese Methoden sind jedoch nicht allgemein oder zuverlässig, und die Optimierung der Netzvorbereitung kann extrem zeitaufwändig sein oder ganz scheitern.
Streptavidin-Affinitätsgitter 9,10 wurden entwickelt, um diese Mängel zu überwinden und eine milde und allgemein anwendbare Methode zur Sequestrierung des interessierenden Komplexes und zum Schutz vor der Luft-Wasser-Grenzfläche bereitzustellen. Diese Gitter verwenden ein zweidimensionales (2D) Streptavidin-Kristallgitter, das auf einer Monoschicht biotinylierter Lipide auf dem Gitter gewachsen ist. Nachdem die Proben selbst biotinyliert wurden (oft spärlich und zufällig, d.h. durchschnittlich ein Biotin pro Komplex), können sie auf das Streptavidin-beschichtete Gitter aufgetragen werden. Da die Probenadsorption auf der extrem hohen Affinität zwischen Streptavidin und Biotin beruht, können mit diesen Gittern Probenkonzentrationen von nur 10 nM verwendet werden. Kommerziell erhältliche Biotinylierungskits für Proteine und biotinylierte Primer für DNA-haltige Komplexe machen es relativ einfach, die notwendigen Biotin-Einheiten an die meisten interessierenden Proben anzubringen. Neben der Konzentration der Probe und dem Fernhalten von der schädlichen Luft-Wasser-Grenzfläche während des Blottings kann die zufällige Biotinylierung eines oder nur einiger weniger Lysinreste den Orientierungsbereich des interessierenden Moleküls auf dem Kryo-EM-Gitter erheblich verbessern, wie eine Reihe von Studiengezeigt haben 11. Während das Signal des darunter liegenden Streptavidin-Kristalls in den Rohbildern vorhanden ist, können Datenverarbeitungsschemata mit Fourier-Filterung der scharfen Bragg-Reflexionen aus dem Kristall während der frühen Datenverarbeitung leicht entfernt werden, was letztendlich hochauflösende Rekonstruktionen der interessierenden Probe ermöglicht 11,12,13. Hier wird ein optimiertes, schrittweises Protokoll für die robuste Herstellung von Streptavidin-Affinitätsgittern und die anschließende Verwendung in Kryo-EM-Experimenten bereitgestellt. Es wird erwartet, dass das bereitgestellte Protokoll über einen Zeitraum von 2 Wochen abgeschlossen wird (Abbildung 1A). Die ersten Teile des Protokolls beschreiben die Herstellung von Reagenzien, die Vorbehandlung von Gittern und die ersten Schritte der Kohlenstoffverdampfung. Als nächstes werden Anweisungen für die Herstellung der Lipidmonoschicht und das Wachstum von Streptavidinkristallen auf EM-Gittern beschrieben. Darüber hinaus werden Anweisungen für die Verwendung von Streptavidin-Affinitätsgittern in Negativfärbe-EM- und Kryo-EM-Experimenten bereitgestellt. Schließlich werden Verfahren zur Entfernung des Streptavidin-Signals aus Mikroskopaufnahmen bereitgestellt, sobald Kryo-EM-Daten erfasst wurden.
Protokoll
1. Vorbereitung der Reagenzien
- Verdünnen Sie kommerziell gekauftes Streptavidin auf eine Endkonzentration von 0,5 mg/ml in Kristallisationspuffer (50 mM HEPES pH 7,5, 150 mM KCl, 5 mM EDTA, 10% Trehalose). Stellen Sie sicher, dass die endgültige Trehalosekonzentration 10% beträgt. Aliquots von 25-50 μl in flüssigem Stickstoff schockgefrieren und bei -80 °C lagern.
- 1,2-Dipalmitoyl-sn-glycero-3-phosphoethanolamin-N-(biotinyl)natriumsalz wird in 65:35:8 v/v/v Chloroform/Methanol/Wasserlösungsmittel gelöst, um eine endgültige Lipidkonzentration von 1 mg/ml zu erhalten. Lagern Sie Einmalaliquots von 20-30 μl bei -80 °C in Glasdurchstechflaschen.
HINWEIS: Die Herstellung des Lösungsmittels ist genauer, wenn sie nach Gewicht erfolgt. Kombinieren Sie zunächst 1,85 g Reinstwasser mit 6,41 g Hochleistungs-Flüssigchromatographie-Methanol (HPLC) und fügen Sie dies zu 22,42 g Chloroform hinzu, um das Lösungsmittel herzustellen.
ACHTUNG: Bitte lesen und verstehen Sie die Sicherheitsdatenblätter der Hersteller und die empfohlenen Anweisungen für die Handhabung und Entsorgung von organischen Lösungsmitteln aus Chloroform und Methanol, bevor Sie mit diesem Protokoll beginnen. Vermeiden Sie den direkten Kontakt von Methanol mit der Haut.
2. Vorbehandlung von Gittern
- Waschen Sie Kohlefolie auf Goldgitterrosten, indem Sie zweimal in 100 % Chloroform und einmal in 100 % Ethanol tauchen. Legen Sie die Gitter zum Trocknen auf sauberes Filterpapier. Wiederholen Sie den Waschvorgang für insgesamt drei Zyklen.
HINWEIS: Reproduzierbare Erfolge wurden mit handelsüblichen Carbonfoliengittern erzielt, die einen Kohlenstofffilm aus 10-12 nm dickem Kohlenstoff (siehe Materialliste) mit Lochgrößen von 0,6-2 μm aufweisen. Kommerziell erhältliche Goldfoliengitter und hausgemachte löchrige Kohlenstoffgitter, die nach dem Nanofabrikationsprotokoll14 des Rubinstein-Labors hergestellt wurden, wurden ebenfalls erfolgreich eingesetzt. Weniger reproduzierbare Ergebnisse wurden mit kommerziell erhältlichen Gittern erzielt, die dünnere Kohlenstofffilme aufweisen. Verwenden Sie keine Kupfergitter, da Kupfer mit allen organischen Aminen reagiert, die sich in der Probe befinden können. - Nachdem die Gitter getrocknet sind, verdampfen Sie eine 2,5-5 nm dicke Kohlenstoffschicht auf die Kohlenstoffseite der löchrigen Kohlenstoffgitter. Die Kohlenstoffdicke wird mit einer Quarzkristallschichtdickenmessung gesteuert, die in den in der Materialtabelle bereitgestellten Kohlenstoffverdampfer eingebaut ist.
- Lassen Sie den neu verdampften Kohlenstoff 1 Woche lang altern (d. h. hydrophober werden).
3. Herstellung des Streptavidin-Gitters
HINWEIS: Um 2D-Streptavidin-Kristalle auf den löchrigen Kohlenstoff-EM-Gittern zu züchten, wird zunächst eine biotinylierte Lipidmonoschicht durch Langmuir-Schaefer-Transfer auf die Löcher des Kohlenstofffilms (Abbildung 1B) aufgebracht. Die Lipidmonoschicht wird nach den folgenden Schritten gebildet (Abbildung 2). Talkumpuder bildet eine Grenze zwischen dem Rizinusöl und der Petrischale, und eine dünne Schicht Rizinusöl hilft, einen konstanten Oberflächendruck aufrechtzuerhalten, wenn die Lipidmonoschicht gebildet wird. Die Seite, die den verdampften Kohlenstoff aus Schritt 2.2 enthält, wird verwendet, um die Monoschicht aufzunehmen, überschüssige Lipide werden mit Kristallisationspuffer weggewaschen und Streptavidinlösung wird zur Kristallisation auf dem Gitter inkubiert.
- Reinigen Sie den Bankbereich mit 70% Ethanol.
- Spülen Sie eine 5-μl-Glasspritze mehrmals mit Chloroform aus, um sie zu reinigen. Lassen Sie die Spritze vor Gebrauch vollständig trocknen.
- Waschen Sie kohlenstoffverdampfte Gitter erneut, d. h. kurz vor dem Gebrauch, indem Sie sie in 100 % Ethanol tauchen. Lassen Sie die Gitter auf sauberem Filterpapier trocknen.
- Waschen Sie während des Trocknens der Gitter jede Antikapillarpinzette mit 100 % Chloroform und 100 % Ethanol. Lassen Sie die Pinzette vollständig trocknen.
- Bereiten Sie auf der sauberen Seite des Parafilms drei 50-μl-Tropfen Kristallisationspuffer (50 mM HEPES pH 7,5, 150 mM KCl, 5 mM EDTA, 10% Trehalose) für jedes herzustellende Gitter vor.
- Füllen Sie den Deckel einer 35 mm unbeschichteten Petrischale mit Kristallisationspuffer (50 mM HEPES pH 7,5, 150 mM KCl, 5 mM EDTA, 10% Trehalose). Reinigen Sie die Oberfläche mit Linsenpapier.
- Streuen Sie wissenschaftliches Talkumpuder um den Umfang der Petrischale. Dies dient im nächsten Schritt als Indikator dafür, wie weit sich das Rizinusöl ausgebreitet hat. Fügen Sie genügend Talkumpuder hinzu, um eine Barriere zu schaffen, die das Rizinusöl davor schützt, den Rand der Petrischale zu berühren. Die Zugabe von zu viel Talkumpuder schränkt den verfügbaren Platz für die Herstellung der Lipidmonoschicht ein.
- Tauchen Sie eine 200-μl-Pipettenspitze in das Rizinusöl, um einen mittelgroßen Tropfen (ca. 20 μl) zu erhalten, der an der Pipettenspitze hängt. Berühren Sie diesen Tropfen mit der Oberfläche des Puffers in der Petrischale, wo er sich zu einem gleichmäßigen Film ausbreitet. Der resultierende dünne Ölfilm dient als Kolben15, der eine konstante Flächenpressung aufrechterhält, wenn eine Lipidmonoschicht gebildet wird (Schritt 3.10).
HINWEIS: Es ist wichtig, eher genug als zu wenig Rizinusöl hinzuzufügen, und es ist besser, es als einen einzigen Tropfen hinzuzufügen. Lassen Sie das Rizinusöl vollständig verteilen, bevor Sie die Lipid-Monoschicht herstellen. - Spülen Sie die 5-μl-Glasspritze ein- oder zweimal mit dem gelösten Lipid aus, bevor Sie ein Aliquot zur Verwendung aufnehmen. Vermeiden Sie die Bildung von Luftblasen im Lipid, das die Spritze füllt.
HINWEIS: Die Glasspritze wird mit gelöstem Lipid gespült, falls Restchloroform aus Schritt 3.2 verbleibt. Restchloroform kann die Qualität der resultierenden Monoschicht beeinträchtigen. - Geben Sie das kleinstmögliche Volumen (~0,5 μl) Lipid aus der Spritze ab und berühren Sie das hängende Tröpfchen vorsichtig mit der Oberfläche des Rizinusölfilms. Beachten Sie, dass die Lipidlösung den Rizinusölfilm an der Kontaktstelle durchbricht und dass die resultierende Lipidmonoschicht einen Kreis in der Mitte des dünnen Rizinusölfilms bildet.
- Fügen Sie nacheinander mehrere Tropfen Lipid hinzu oder fügen Sie mehr Lipid hinzu, nachdem Sie einige Gitter erstellt haben, aber wenn zu viel hinzugefügt wird, breitet sich das Lipid über die Grenze des Rizinusöls hinaus und in den Umfang aus, an dem das Talkumpuder und alle kontaminierenden Tenside sequestriert wurden. In diesem Fall muss der Prozess neu gestartet werden.
- Nehmen Sie ein Gitter mit einer Antikapillarpinzette auf, so dass der gerade Arm der Pinzette und die kohlenstoffverdampfte Seite des Gitters beide zur Monoschicht zeigen.
- Übertragen Sie einen Teil der Monoschicht auf den löchrigen Kohlenstoff, indem Sie die kohlenstoffverdampfte Seite des Gitters 1-2 s lang mit der Monoschicht berühren.
HINWEIS: Eine erfolgreiche Übertragung wird dadurch angezeigt, dass die Oberfläche des Gitters hydrophil wird, wodurch eine dünne, kugelförmige Pufferkappe das gesamte Gitter bedeckt, nachdem es von der Petrischale abgehoben wurde. - Berühren Sie die kugelförmige Kappe des Puffers, der nun nacheinander für jeweils 1 s am Gitter haftet, mit den drei 50-μl-Tropfen Kristallisationspuffer, die in Schritt 3.5 auf Parafilm hergestellt wurden.
HINWEIS: In diesem Schritt wird versucht, so viel wie möglich von dem überschüssigen Lipid zu entfernen, das die Oberfläche der Kugelkappe bedeckt (und nicht den ehemals hydrophoben Kohlenstofffilm), um die Bildung von Lipidvesikeln bei der Betrachtung der Proben im Elektronenmikroskop zu vermeiden. - Geben Sie vorsichtig 4 μl 0,5 mg/ml Streptavidin in die verbleibende kugelförmige Kappe des Kristallisationspuffers auf dem Gitter.
- Legen Sie den Rost in eine Feuchtigkeitskammer. Wiederholen Sie die Schritte 3.11 bis 3.14 für den gesamten Stapel von Rastern.
- Inkubieren Sie die Gitter 2 Stunden lang bei Raumtemperatur (RT) in einer Feuchtigkeitskammer, um Verdunstung zu vermeiden.
HINWEIS: Es ist wichtig, dass die Goldseite des Gitters nach dem Auftragen der Monoschicht zu keinem Zeitpunkt nass wird. - Bereiten Sie nach der 2-stündigen Inkubation einen 300-μl-Tropfen Spülpuffer (10 mM HEPES, pH 7,5, 50 mM KCl, 5 mM EDTA, 10% Trehalose) für jedes Gitter auf der sauberen Seite des Parafilms vor.
HINWEIS: Der Spülpuffer enthält 50 mM KCl anstelle von 150 mM KCl, die sich im Kristallisationspuffer befinden, der für die Schritte 3.5-3.6 verwendet wird. - Waschen Sie das überschüssige (ungebundene) Streptavidin, indem Sie das Gitter auf den 300-μl-Tropfen Spülpuffer legen. Führen Sie die Schritte 3.18 bis 3.20 jeweils für ein Raster aus. Vermeiden Sie es, die Gitter längere Zeit auf dem 300-μl-Spülpuffertropfen zu belassen.
HINWEIS: Es wird nur eine Wäsche durchgeführt, da der Streptavidin-Kristall/die Monoschicht zu diesem Zeitpunkt zerbrechlich ist. Jedes Mal, wenn ein Gitter von der Oberfläche eines Tropfens Waschpuffer abgehoben wird, wird die Flüssigkeitsbrücke zwischen dem Gitter und dem Wash-Tropfen gerissen. Zum Zeitpunkt des Bruchs wird ein transienter Druckgradient (Sogdruck) auf die selbsttragenden Monolayer-Kristalle angelegt, die die offenen Löcher des Kohlenstofffilms überspannen. Es wird erwartet, dass dieser Saugdruck ein vorübergehendes Doming des Monolayer-Kristalls verursacht, begleitet von einer Ausdehnung des von den Kristallen bedeckten Bereichs. Wenn die Vergrößerung der Fläche die Elastizitätsgrenze des Kristalls überschreitet, kann der Kristall brechen oder ungeordnet werden. - Trocknen Sie die Antikapillarpinzette sofort mit einem fusselfreien Tuch, um das Lösen des Gitters auf Filterpapier im folgenden Schritt zu erleichtern. Nehmen Sie das Gitter auf, das auf dem Tropfen Spülpuffer schwimmt, indem Sie den geknickten Arm der Antikapillarpinzette in den Tropfen stecken.
- Tupfen Sie den überschüssigen Puffer vorsichtig von der Seite mit Filterpapier ab. Legen Sie den Rost mit der Goldseite nach unten auf Filterpapier, wiederholen Sie die Schritte 3.18-3.20 für jeden Rost und lassen Sie die Gitter 15-20 Minuten trocknen.
- Nachdem die Gitter trocken sind, drehen Sie sie um, so dass die goldene Seite nun nach oben zeigt. Verdampfen Sie eine dünne Kohlenstoffschicht (ca. 0,5-2 nm dick) auf die Goldseite der Gitter.
HINWEIS: Lagern Sie Gitter bei einer konstanten Luftfeuchtigkeit, deren Wert keine Rolle zu spielen scheint, wobei zu beachten ist, dass mehrere Änderungen der relativen Luftfeuchtigkeit zu Zyklen der Ausdehnung und Kontraktion führen können. Lassen Sie die Gitter 1 Woche lang altern, bevor Sie die Kryo-EM verwenden, um beste Ergebnisse zu erzielen, da die Hydrophobie der Rückseite des Gitters für die Stabilität der Monoschicht wichtig sein kann. Gitter sind über lange Zeiträume stabil, aber nach 3 Monaten kann der Kohlenstoff auf der Rückseite weniger hydrophob werden.
4. Überprüfung der Chargenqualität des Streptavidin-Affinitätsgitters durch negative Färbung
- Bereiten Sie zwei Tropfen mit 50 μl und einen Tropfen mit 100 μl Probenpuffer (50 mM HEPES pH 7,5, 50 mM KCl, 0,5 mM TCEP) auf der sauberen Seite des Parafilms vor.
- Entfernen Sie die Trehalose und rehydrieren Sie die Streptavidin-Gitter, indem Sie die beiden 50-μl-Tropfen berühren und das Gitter 10 Minuten lang auf dem 100-μl-Tropfen Probenpuffer schwimmen lassen.
HINWEIS: Es ist am besten, die Verwendung von Reinigungsmittel während der Rehydrierung und der anschließenden Probenbindungsinkubationen zu vermeiden. Der Puffer dispergiert auf der Goldseite der Gitter und begrenzt die Effizienz der Waschungen, um überschüssige Proben zu entfernen. - Nehmen Sie das Gitter nach dem Rehydrieren mit einer Antikapillarpinzette auf, so dass sich der geknickte Arm der Antikapillarpinzette im Tropfen befindet.
- Tupfen Sie den überschüssigen Puffer vorsichtig von der Seite weg und tragen Sie schnell 4 μl der 75-100 nM Probe (optional) erneut auf.
Anmerkungen: Vermeiden Sie es, das Gitter nach der Rehydrierung trocknen zu lassen. - Inkubieren Sie die Probe 1-5 Minuten lang in einer Feuchtigkeitskammer.
HINWEIS: Konzentration und Inkubationszeiten sind probenabhängig und sollten optimiert werden. Die angegebene Probenkonzentration und Inkubationszeit sind vorgeschlagene Ausgangspunkte. - Auf der sauberen Seite von Parafilm vier Tropfen mit je 30 μl Probenpuffer und 1 % Uranylformiat-Färbung (UF) auftragen.
HINWEIS: Bitte lesen und verstehen Sie die Sicherheitsdatenblätter der Hersteller und die empfohlenen Anweisungen für die Handhabung und Entsorgung von Uranylformiat, bevor Sie diesen Schritt ausführen. Uranylformiat ist eine giftige und radioaktive Verbindung. Stellen Sie sicher, dass Sie eine vorherige institutionelle Genehmigung für die Verwendung von radioaktivem Material einholen. - Waschen Sie die ungebundene Probe weg, indem Sie jeden der vier Tropfen Probenpuffer berühren.
- Färben Sie die Probe mit Standard-Negativfärbeverfahren mit UF. Tupfen Sie den UF-Fleck vorsichtig von der Seite ab und hinterlassen Sie eine sehr dicke Fleckenschicht auf dem Gitter. Nach dem Abtupfen können weitere 0,5 μl Beize auf das Gitter aufgetragen werden, um den Fleck bei Bedarf dicker zu machen. Lassen Sie das Gitter an der Luft trocknen.
HINWEIS: Da die Streptavidin-Gitter sehr hydrophil sind, neigt die negative Färbung dazu, überall einen sehr gleichmäßigen Film zu bilden, im Gegensatz zu dem, was bei der Verwendung von glühentladungsbehandelten, kontinuierlichen Kohlenstoffgittern üblich ist. Daher wird empfohlen, einen dickeren Fleckenfilm zu hinterlassen.
5. Einfrieren von Streptavidin-Affinitätsgittern mit biotinylierten Proben
HINWEIS: Das folgende Verfahren ist für einen einseitig automatisierten Kolben vorgesehen, der einen internen Blotting-Sensor enthält (einseitiges manuelles Blotting in anderen automatisierten Tauchgeräten ist ebenfalls möglich)
- Bereiten Sie zwei Tropfen mit 50 μl und einen Tropfen mit 100 μl Probenpuffer (z. B. 50 mM HEPES pH 7,5, 50 mM KCl, 0,5 mM TCEP) auf der sauberen Seite des Parafilms vor.
- Rehydrieren Sie die Streptavidin-Gitter, indem Sie die beiden 50-μl-Tropfen berühren, und lassen Sie das Gitter 10 Minuten lang auf dem 100-μl-Tropfen Probenpuffer schwimmen.
- Nehmen Sie das Gitter nach dem Rehydrieren mit einer Antikapillarpinzette auf, so dass sich der geknickte Arm der Antikapillarpinzette im Tropfen befindet.
- Tupfen Sie den überschüssigen Puffer vorsichtig von der Seite weg und tragen Sie schnell 4 μl 75-100 nM Probe auf.
- Inkubieren Sie die Probe in einer Feuchtigkeitskammer für 1-5 Minuten.
HINWEIS: Auch hier sind Konzentration und Inkubationszeiten probenabhängig und sollten optimiert werden. Die angegebene Probenkonzentration und Inkubationszeit sind vorgeschlagene Ausgangspunkte. Bei Proben mit niedrigen Konzentrationen kann man über längere Zeiträume inkubieren und/oder die Probe mehrmals an die Gitter binden. - Bereiten Sie zwei 10-μl-Tropfen Gefrierpuffer (z. B. 50 mM HEPES pH 7,5, 50 mM KCl, 0,5 mM TCEP, 3 % Trehalose, 0,01 % NP40) auf der sauberen Seite des Parafilms vor. Nach der Inkubation wird die ungebundene Probe gewaschen, indem das Gitter mit dem ersten Tropfen des Gefrierpuffers berührt wird. Legen Sie das Gitter auf den zweiten Tropfen des Gefrierpuffers.
- Fassen Sie schnell den Rand des Gitters mit der Pinzette, die am einseitigen automatischen Kolben befestigt ist. Überschüssigen Puffer vorsichtig abtupfen und schnell 4 μl Gefrierpuffer (50 mM HEPES pH 7,5, 50 mM KCl, 0,5 mM TCEP, 3 % Trehalose, 0,01 % NP40) auf das Gitter auftragen.
- Befestigen Sie eine Pinzette am einseitig automatisierten Kolben. Die besten Ergebnisse wurden mit einem Blot-Sensor erzielt, der den Flüssigkeitstropfen auf dem Gitter mit Blot-Zeiten zwischen 4-6 s erkennt. Die Bedingungen variieren je nach verwendeter Probe und Puffer.
6. Datenverarbeitung von Kryo-EM-Filmen, die aus Streptavidin-Affinitätsgittern gesammelt wurden
Die Datenerfassung auf Streptavidin-Affinitätsgittern kann wie mit Standardgittern durchgeführt werden, und es sind keine speziellen Mikroskopeinstellungen erforderlich. Das hier beschriebene Verfahren entfernt das Streptavidin-Signal jedoch erst nach Bewegungskorrektur der Schliffbildaufnahme. Daher können Datenverarbeitungsschritte wie das Polieren von Partikeln, die auf Original-Filmbildern basieren, nicht zuverlässig durchgeführt werden. Die Streptavidin-Signalsubtraktion (erforderlich für alle Standard-Downstream-Verarbeitungen mit Ausnahme der CTF-Schätzung) erfordert hier die Matlab-Version R2014b oder neuer, die in einer Linux-Umgebung ausgeführt wird. Die Signalsubtraktion beruht auf der kristallinen Natur der Streptavidin-Schicht, die eine Peakmaskierung und damit eine Signalentfernung aus der Fourier-Transformation jeder Mikroskopaufnahme ermöglicht.
- Einrichten der Verarbeitungsskripte
- Kopieren Sie alle Dateien aus Ergänzungsdateien in einen dedizierten Ordner innerhalb des Projektverzeichnisses
- Bereiten Sie ein Verzeichnis mit dem Namen processing_scripts vor, das die folgenden Dateien enthält:
lsub.m (Ergänzende Codierungsdatei 1; das Subtraktionsskript)
process_subtration.sh (Supplemental Coding File 2; Wrapper-Skript, das alle verfügbaren Mikrographen in einer Schleife durchläuft, parallele Jobs erzeugt und die Ein- und Ausgabe verfolgt)
process_subtraction.cfg (Supplemental Coding File 3; Konfigurationsdatei, die die Parameter für den Subtraktionsjob enthält, siehe 6.2) - Bereiten Sie ein Verzeichnis mit dem Namen support_scripts vor, das die folgenden Dateien enthält:
bg_drill_hole.m (Ergänzende Codierungsdatei 4)
bg_FastSubtract_standard.m (Ergänzende Codierungsdatei 5)
bg_Pick_Amp_masked_standard.m (Ergänzende Codierungsdatei 6)
bg_push_by_rot.m (Ergänzende Codierungsdatei 7)
ReadMRC.m (Ergänzende Codierungsdatei 8)
WriteMRC.m (Ergänzende Codierungsdatei 9)
WriteMRCHeader.m (Ergänzende Codierungsdatei 10)
- Passen Sie die Konfigurationsdatei (process_subtraction.cfg) (siehe Abbildung 3) nach Bedarf an:
- Eingabe: Pfad zu dem Verzeichnis, das die bewegungskorrigierten Schliffbilder im mrc-Format enthält. Verwenden Sie entweder ein Verzeichnis oder ein Muster mit Platzhaltern (?, *).
Beispiel:
input="/Pfad/zum/project_directory/Mikrobilder/"
oder
input="/Pfad/zum/project_directory/Mikrobilder/*.mrc" - output_dir: Pfad zu dem Verzeichnis, in das die gittersubtrahierten Mikrographen geschrieben werden sollen.
- only_do_unfinished: Geben Sie (true|false) an, ob bereits vorhandene subtrahierte Schliffbilder überschrieben oder übersprungen werden sollen. Dieser Parameter ist nützlich, um das Gittersubtraktionsskript mitten in einer Mikroskopsitzung zu starten (Standard: true).
- num_parallel_jobs: Geben Sie die Anzahl der parallelen Jobs an. Diese Zahl hängt von den Hardwarespezifikationen ab, die für die Verarbeitung verwendet werden, und sollte nicht höher sein als die Anzahl der verfügbaren Kerne. Auf Systemen mit 32 Kernen und einem Netzwerk-Dateisystem wurde mit 14 parallelen Jobs eine optimale Performance erreicht. Um eine optimale Leistung zu erzielen, optimieren Sie diesen Wert mit einer Teilmenge von Mikroaufnahmen.
- Pad_Origin_X: 200 für einen K3-Detektor im Hochformat (Bildbreite < Bildhöhe) oder bei Verwendung eines quadratischen Detektors (Falcon III, Falcon IV, K2), 1000 für einen K3-Detektor im Querformat (Bildbreite > Bildhöhe). Die FFT wird in quadratischen Kästen durchgeführt und eine Polsterung ist erforderlich, wenn der Detektor nicht quadratische Abmessungen hat.
- Pad_Origin_Y: 1000 für einen K3-Detektor im Hochformat (Bildbreite < Bildhöhe), 200 bei Verwendung eines quadratischen Detektors (Falcon III, Falcon IV, K2) oder bei Verwendung eines K3-Detektors im Querformat (Bildbreite > Bildhöhe).
- Ändern Sie nicht die Inside_Radius_Ang (90) und Outside_Radius_Ang (3.0). Die Gittersubtraktion wird zwischen zwei Auflösungen durchgeführt (Einheit ist in Angström).
- Pixel_Ang: Geben Sie die Pixelgröße als Gleitkommawert an.
- Schwellenwert: Subtraktionsschwellenwert, um das Gitter durch den Hintergrund im Fourierraum zu ersetzen. Erfolgreich verwendete Werte liegen zwischen 1,4 und 1,6. Verwenden Sie 1.42 als Ausgangspunkt.
- Ändern Sie expand_pixel (10) und pad_out_opt (0) nicht. expand_pixel ist ein Durchmesserwert, der zum Maskieren von Pixeln mit Werten verwendet wird, die über dem Schwellenwert liegen. pad_out_opt ist eine Option, die entscheidet, ob ein gepolsterter Bereich in die Ausgabe einbezogen wird.
- addpath_m: Pfad zu den Supportskripts.
- path_to_matlab_bin: Pfad zum Matlab-Installationsverzeichnis des Systems.
- path_matlab_script: Pfad zum Matlab-Substraktionsskript (lsub.m ), das oben unter Schritt 6.1.2 kopiert wurde.
- Eingabe: Pfad zu dem Verzeichnis, das die bewegungskorrigierten Schliffbilder im mrc-Format enthält. Verwenden Sie entweder ein Verzeichnis oder ein Muster mit Platzhaltern (?, *).
- Führen Sie nach dem Speichern des geänderten Skripts das Skript (bash ./process_subtraction.sh ) aus, um das Streptavidin-Signal von den Eingangsmikrobildern zu subtrahieren. Das Skript kann unterbrochen und/oder neu gestartet werden, wenn der Parameter only_do_unfinished auf true gesetzt ist (siehe Schritt 6.2.3). Wenn ein Fehler auftritt, überprüfen Sie die im Bash-Skript angegebenen Parameter. Stellen Sie sicher, dass keine unbeabsichtigten Leerzeichen zwischen Parametervariablen und ihren zugewiesenen Werten vorhanden sind, da dies eine häufige Fehlerquelle ist.
- Verwenden Sie die gittersubtrahierten Bilder für die Standard-Kryo-EM-Bildverarbeitung.
Ergebnisse
Nach der Kohlenstoffverdampfung in Schritt 3.21 (in der Regel nach einer Woche) können Streptavidin-Affinitätsgitter für die Kryo-EM oder die Probenvorbereitung mit Negativfärbung gemäß den in den Schritten 4 und 5 beschriebenen Verfahren verwendet werden. Eine repräsentative Mikroskopaufnahme, die mit einem K3-Detektor auf einem Titan-Krios bei 81.000-facher Vergrößerung und einer Pixelgröße von 1,05 Å einer biotinylierten Probe aufgenommen wurde, die mit Streptavidin-Affinitätsgittern eingefroren wurde, ist in Abbildung 4A dargestellt. Die erfolgreiche Gitterbildung wird durch das kontinuierliche Gittermuster beobachtet, das im Hintergrund des Bildes erscheint. Dies kann leichter durch das Beugungsmuster beobachtet werden, das in der schnellen Fourier-Transformation (FFT) in Abbildung 4A (rechts) dargestellt ist. Nach der Datenerfassung kann das Signal, das durch das Streptavidin-Gitter zum Bild beigetragen wird, gemäß dem in Schritt 6 dieses Protokolls beschriebenen Verfahren rechnerisch maskiert werden, um eine subtrahierte Mikroskopaufnahme (Abbildung 4B) zu erzeugen, die für nachfolgende Datenverarbeitungsschritte verwendet werden kann. Die FFT in Abbildung 4B (rechts) zeigt, dass das in Abbildung 4A (rechts) beobachtete Beugungsmuster erfolgreich aus dem Originalbild entfernt wurde.
Abbildung 4C zeigt eine Beispiel-Mikroskopaufnahme, die mit einem Tecnai 12-Mikroskop bei einer 49.000-fachen Vergrößerung und einer Pixelgröße von 1,6 Å einer biotinylierten Probe aufgenommen wurde, die an Streptavidin-Affinitätsgitter gebunden und mit Uranylformiat negativ gefärbt wurde. Die Gitter wurden nach dem in Schritt 4 dieses Protokolls beschriebenen Verfahren hergestellt und hinterließen einen dickeren Fleckenfilm.
Es gibt mehrere häufige Beobachtungen, wenn das Herstellungsverfahren des Streptavidin-Gitters nicht erfolgreich ist, die im Diskussionsabschnitt und in Tabelle 1 näher beschrieben werden. Abbildung 5 zeigt mehrere Beispiele für diese Beobachtungen. Abbildung 5A zeigt eine Mikroskopaufnahme eines negativ gefärbten Streptavidin-Affinitätsgitters, das aus einer über sechs Monate alten Charge verwendet wurde. Die Monoschicht hat sich aus den Löchern in der Kohlenstofffolie der Quantifoil-Gitter mobilisiert und wird mit ähnlichen Abmessungen wie die Löcher im Gitter beobachtet. Abbildung 5B zeigt ein Beispiel für Streptavidin-Kristalle mit hoher Mosaikität, die während der Probenvorbereitung leicht gestört werden. Abbildung 5C zeigt eine repräsentative Mikroskopaufnahme aus einem Streptavidin-Affinitätsgitter, in dem die Kohlenstoffverdampfung in Schritt 3.21 zu dünn ist oder weggelassen wird. Das Streptavidin-Gitter ist während des Kryo-EM-Probenvorbereitungsprozesses fragmentiert worden. Abbildung 5D zeigt ein negativ gefärbtes Streptavidin-Affinitätsgitter, das durch Lipidvesikel kontaminiert ist, wahrscheinlich aufgrund unzureichender Waschungen während der Schritte 3.13 oder der feuchten Goldseite des Gitters während der Schritte 3.13-3.20. Im Diskussionsabschnitt und in Tabelle 1 finden Sie Strategien zur Überwindung dieser häufigen Probleme.
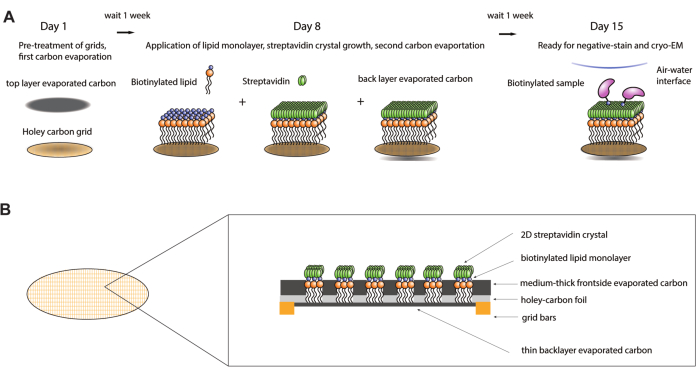
Abbildung 1: Schematische Darstellung des Herstellungsverfahrens für Streptavidin-Affinitätsgitter. (A) Überblick über die Zeitleiste des Herstellungsverfahrens für Streptavidin-Affinitätsgitter. Das gesamte Verfahren kann über zwei Wochen abgeschlossen werden, wobei zwei Kohlenstoffverdampfungsschritte und jeweils eine Woche danach erforderlich sind, damit der Kohlenstoff ausreichend altern kann. (B) Gezoomt in der Ansicht eines Gitterquadrats eines Streptavidin-Affinitätsgitters, das die Schichten zeigt, aus denen das Gitter nach Abschluss des Herstellungsprozesses besteht, einschließlich des Standard-Kryo-EM-Gitters mit Goldbarren und löchrigem Kohlenstofffilm, der ersten verdampften Kohlenstoffschicht, der Lipidmonoschicht, des 2D-Streptavidin-Kristalls und der rückseitigen verdampften Kohlenstoffträgerschicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Lipidmonoschicht und Streptavidin-Kristallisation (A) Bilder, die zeigen, wie die Lipidmonoschicht in der kleinen Petrischale erfolgreich gebildet wird, indem Talkumpuder verwendet wird, um eine Grenze für das Rizinusöl zu schaffen, die bei der Bildung der Lipidmonoschicht einen konstanten Oberflächendruck erzeugt. (B) Bilder, die zeigen, wie Streptavidin-Kristalle auf Kryo-EM-Gittern gezüchtet werden. Zuerst wird die Kohlenstoffseite der Gitter mit der Lipidmonoschicht berührt und gefolgt von drei aufeinanderfolgenden Wäschen im Kristallisationspuffer. Streptavidin wird hinzugefügt und die Gitter werden 2 Stunden lang in einer Feuchtigkeitskammer inkubiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Beispielparameter für die Datei process_subtraction.cfg zur Durchführung der Streptavidin-Gittersubtraktion aus Mikroaufnahmen (Schritt 6). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Repräsentative Ergebnisse der erfolgreichen Herstellung von Streptavidin-Affinitätsgittern. (A) Kryo-EM-Mikroskopaufnahme von biotinylierten Protein/Nukleosomen-Komplexen, hergestellt mit hausgemachten Streptavidin-Affinitätsgittern. Die FFT ist rechts dargestellt und zeigt das Beugungsmuster des Streptavidin-Kristalls. (B) Dieselbe Schliffaufnahme wie in Feld A wird nach dem Gittersubtraktionsverfahren gezeigt, um das Signal vom 2D-Streptavidin-Kristall aus dem Originalbild zu entfernen. (C) Ein Beispiel für eine Mikroskopaufnahme, die durch Negativfärbung einer biotinylierten Probe erhalten wurde, die an Streptavidin-Affinitätsgitter gebunden ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Repräsentative Ergebnisse der erfolglosen Herstellung von Streptavidin-Affinitätsgittern. (A) Mikroskopische Aufnahme, die die Mobilisierung der Streptavidin-Monoschicht aus den Gitterlöchern zeigt, wenn die Gitter älter als sechs Monate sind. (B) Mikroskopische Aufnahme mit Streptavidin-Gittern mit hoher Mosaikität, die sowohl bei Kryo-EM als auch bei der Probenvorbereitung mit Negativfärbung leicht beschädigt werden können. (C) Mikroskopische Aufnahme der Fragmentierung des Streptavidin-Gitters während der Kryo-EM-Probenvorbereitung, wenn die Kohlenstoffverdampfungsschicht in Schritt 3.21 zu dünn ist oder weggelassen wird. (D) Repräsentative Mikroskopaufnahme, die mit Lipidvesikeln kontaminiert ist, wahrscheinlich aufgrund unzureichender Waschung während der Schritte 3.13 oder der feuchten Goldseite des Gitters während der Schritte 3.13-3.20. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Leitfaden zur Fehlerbehebung zur Überwindung häufig auftretender Herausforderungen, die bei der erfolglosen Herstellung von Streptavidin-Affinitätsgittern auftreten. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Codierungsdatei 1: lsub.m Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Codierungsdatei 2: process_subtration.sh Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Codierungsdatei 3: process_subtraction.cfg Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Codierungsdatei 4: bg_drill_hole.m Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Codierungsdatei 5: bg_FastSubtract_standard.m Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Codierungsdatei 6: bg_Pick_Amp_masked_standard.m Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Codierungsdatei 7: bg_push_by_rot.m Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Codierungsdatei 8: ReadMRC.m Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Codierungsdatei 9: WriteMRC.m Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Codierungsdatei 10: WriteMRCHeader.m Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Unser Protokoll beschreibt, wie Streptavidin-Affinitätsgitter erstellt und verwendet werden und wie die Daten verarbeitet werden, die das Streptavidin-Beugungssignal enthalten. Es gibt mehrere kritische Schritte im Protokoll, die besondere Aufmerksamkeit erfordern.
Erfolglose Rasterbatches können auf mehrere häufige Fehler zurückgeführt werden. Die häufigste Fehlerquelle ist die Verwendung veralteter oder minderwertiger Reagenzien. Es ist besonders wichtig, die biotinylierte Lipidlösung genau so herzustellen, wie im Protokoll beschrieben. Darüber hinaus können Verunreinigungen, wie z. B. Waschmittelrückstände auf dem Laborgeschirr oder natürlich vorhandene Öle auf der Haut, die Qualität der Streptavidin-Kristalle und damit die Qualität der resultierenden Bilder beeinträchtigen. Es wird daher empfohlen, vor der ersten Kohlenstoffverdampfung drei Waschzyklen für die Gitter durchzuführen, um mögliche Tensidverunreinigungen beim Gitterhersteller zu entfernen (Schritt 2.1). Darüber hinaus wurde beobachtet, dass Verunreinigungen oder Verunreinigungen des Rizinusöls die Kristallbildung auf dem Gitter behindern.
Das Herstellen und Aufnehmen der Lipid-Monoschicht ist eine Aufgabe, die einige Male geübt werden sollte, um ein Gefühl für die kleinen Lipidvolumina zu bekommen. Es ist nicht ungewöhnlich, dass dieser Schritt die ersten zwei oder drei Male fehlschlägt, bevor eine adäquate Lipidmonoschicht hergestellt werden kann, was sich letztendlich in der Qualität der Streptavidin-Kristalle widerspiegelt, die in negativ gefärbten Gittern zu sehen sind (Abbildung 4C).
Es ist wichtig, die Rückseite (Goldseite, Lipidseite) des Gitters während des Gitterherstellungsprozesses (Schritte 3.12-3.20) niemals nass werden zu lassen. Falls die Rückseite nass wird, wird empfohlen, das Gitter zu entsorgen. Dies kann zum Auftreten großer Lipidvesikel führen, die die Bildqualität stören (Abbildung 5D) (Zeile 3, Tabelle 1). Lipidvesikel können auch aufgrund unzureichender Waschung nach dem Auftragen der Lipidmonoschicht beobachtet werden (Schritt 3.13). Drei aufeinanderfolgende Waschungen mit Kristallisationspuffer werden empfohlen, nachdem die Lipidmonoschicht vor der Zugabe von Streptavidin berührt wurde.
Nachdem eine dünne Kohlenstoffschicht auf Trehalose-eingebettete Gitter verdampft wurde, kann die Rückseite des Gitters nass werden, ohne die Gitterqualität zu beeinträchtigen. Beispielsweise wird eine Benetzung der Rückseite häufig beobachtet, wenn der Probenpuffer auch nur minimale Mengen an Reinigungsmittel enthält. Die Benetzung der Rückseite durch die Probe kann zu einer unspezifischen Bindung der Proben an den dünnen Kohlenstofffilm auf der Rückseite führen, was die Wirksamkeit der Verhinderung der Diffusion von Partikeln an die Luft-Wasser-Grenzfläche oder die Verwendung der Affinitätsbindung für netzgebundene Reinigungsstrategien verringert. Wenn möglich, geben Sie die Probe in Abwesenheit von Reinigungsmittel in das Gitter. Waschmittel und andere Zusätze können nachträglich während der Gitterwaschschritte oder in einem letzten Schritt vor der Verglasung hinzugefügt werden. Dies ist eine Einschränkung bei der Verwendung von Streptavidin-Affinitätsgittern; Wenn das Ziel jedoch darin besteht, die bevorzugte Orientierung zu verbessern, wurde die Probenvorbereitung mit Puffern, einschließlich Detergens, erfolgreich durchgeführt11.
Eine häufige Fehlerquelle kann auf das Alter der Gitter in Bezug auf beide Kohlenstoffverdampfungsschritte (Schritt 2.3 und Schritt 3.21) zurückgeführt werden. In diesem Protokoll beträgt die empfohlene Wartezeit 5-7 Tage nach der rückseitigen Kohlenstoffverdampfung, bevor Streptavidin-Gitter für Kryo-EM verwendet werden. Wenn Gitter zu früh nach der Herstellung verwendet werden, wurde beobachtet, dass das Gitter und die Lipidmonoschicht aus den Gitterlöchern mobilisiert werden. Eine ähnliche Beobachtung kann gemacht werden, wenn die Gitter zu alt sind und nach sechs Monaten verwendet werden (Abbildung 5A) (Zeile 1, Tabelle 1). Wir stellen die Hypothese auf, dass diese Beobachtung durch Änderungen in der Hydrophobizität des Kohlenstoffträgers erklärt wird, der zur Stabilisierung der Lipidmonoschicht und der Streptavidin-Kristalle aufgebracht wird. Darüber hinaus können Streptavidin-Gitter mosaikartig erscheinen (Abbildung 5B) (Reihe 3, Tabelle 1) und sowohl in der Negativfärbung als auch in der Kryo-EM gebrochen sein, wenn die Monoschicht auf Gitter aufgetragen wird, bei denen die erste Kohlenstoffverdampfungsschicht (Schritt 2.3) nicht ausreichend gealtert ist.
Eine weitere häufige Fehlerquelle kann auf die Zerbrechlichkeit der kristallinen Streptavidin-Monoschicht zurückgeführt werden (die Lipidmonoschicht ist selbst flüssig und kann sich reversibel ausdehnen oder komprimieren). Die rückseitige Kohlenstoffverdampfung (Schritt 3.21) sorgt für eine kritische Stabilität sowohl der Monoschicht als auch des Streptavidin-Gitters während des Probenadsorptions-, Wasch- und Kryo-EM-Blotting-Prozesses. In Ermangelung einer ausreichenden Kohlenstoffverdampfung auf der Rückseite des Gitters erscheinen Streptavidin-Gitter nach dem Blotting/Einfrieren oft fragmentiert (Abbildung 5C) (Reihe 2, Tabelle 1). In diesem Protokoll empfehlen wir die Verwendung eines einseitigen automatischen Tauchgefrierschranks für einseitiges Blotting. Diese Methode liefert hochgradig reproduzierbare Blotting-Bedingungen, die das Streptavidin-Gitter während des Gefrierprozesses erhalten und eine optimierte Optimierung der Probenapplikation und der Blotting-Parameter ermöglichen. Alternativ wurden andere automatische Tauchgefriergeräte in Kombination mit manuellem Blotting verwendet. Dazu wird die eigentliche Löschfunktion in den Geräteeinstellungen deaktiviert und das Raster stattdessen durch Greifen mit einer Pinzette, die Löschpapier hält, durch den seitlichen Eingang gewischt. Mit dieser Methode können qualitativ hochwertige Ergebnisse für Labore ohne einseitiges Blotting- und Tauchgefriergerät erzielt werden. Die Reproduzierbarkeit von Netz zu Netz ist jedoch eine Herausforderung.
Während die Verwendung von Streptavidin-Affinitätsgittern viele Vorteile hat, müssen einige Einschränkungen dieser Methode berücksichtigt werden. Aufgrund der Art des Verfahrens ist es in der Regel nicht möglich, die Qualität des Streptavidin-Gitters zu beurteilen, bis der gesamte Prozess abgeschlossen ist. Es wird empfohlen, die Qualität jeder Charge vor dem Einfrieren von Proben schnell durch negative Färbung zu überprüfen. Aufgrund des Signals, das das Streptavidin-Gitter zu den Rohbildern beiträgt, kann es in einigen Fällen schwierig sein, allein anhand der Bilder zu beurteilen, ob eine ausreichende Anzahl intakter, disperser Teilchen vorhanden ist. Aus dem gleichen Grund ist eine On-the-fly-Verarbeitung von Kryo-EM-Daten während der Datenerfassung nicht möglich, es sei denn, das Streptavidin-Signalsubtraktionsverfahren wurde in die Datenvorverarbeitungspipeline aufgenommen. Da das Streptavidin-Signal normalerweise von den bewegungskorrigierten Bildern und nicht von den Bildern selbst subtrahiert wird, kann das Bayes'sche Polieren, wie es in gängigen Software-Suiten implementiert ist, fehlschlagen, wenn die beschriebenen Subtraktionsverfahren verwendet werden. Es wird daher empfohlen, die Bewegungskorrektur in mehreren Patches durchzuführen, um die Partikelbewegung von Beginn der Datenverarbeitung an zu minimieren16.
Trotz dieser Einschränkungen bieten Streptavidin-Affinitätsgitter viele Vorteile. Zwei Hauptvorteile, die Streptavidin-Affinitätsgitter gegenüber Standard-Kryo-EM-Gittern mit offenem Loch bieten, sind ein Mittel zum Schutz von Proben vor der Luft-Wasser-Grenzfläche und zur Konzentration von Proben mit geringer Abundanz (10-100 nM) auf dem Gitter. Andere Stützschichten wie Kohlenstoff- und Graphenoxid können ebenfalls als Strategien zur Überwindung dieser Engpässe bei der Probenvorbereitung verwendet werden. In einem Beispiel waren Streptavidin-Affinitätsgitter die einzige Lösung, um eine intakte Rekonstruktion einer Protein-Nukleinsäure-Wechselwirkung zu erhalten, die mit Vernetzungsansätzen nicht kompatibel war. 12
Ein weiterer großer Vorteil, den Streptavidin-Affinitätsgitter bieten, ist eine Lösung für Proben, die an anderen Stützschichten wie Kohlenstoff oder Graphenoxid adsorbieren, mit bevorzugten Orientierungen, die die Möglichkeit einer 3D-Rekonstruktion der interessierenden Probe behindern. Die zufällige Biotinylierung von Proben mit kommerziell erhältlichen Kits ermöglicht die zufällige Bindung der interessierenden Probe an die Streptavidin-Monoschicht, um mehr potenzielle Ansichten zur Bewältigung dieser Herausforderung zu erhalten.
Darüber hinaus bieten Streptavidin-Affinitätsgitter Vorteile, die für affinitätsbasierte Gitter einzigartig sind. Die hohe Affinität und Spezifität der Streptavidin-Biotin-Wechselwirkung ermöglicht die Kopplung von Streptavidin-Affinitätsgittern mit anderen Arbeitsabläufen, an denen Biotin beteiligt ist, um interessante Komplexe zu reinigen. In einem veröffentlichten Beispiel immobilisierten die Autoren einen Komplex auf Streptavidin-Affinitätsgittern und inkubierten einen Bindungspartner unbekannter Stöchiometrie in großem Überschuss. Nach dem Abwaschen des ungebundenen Proteins wurde der korrekt zusammengesetzte Superkomplex erhalten und konnte sofort mit Kryo-EM11 analysiert werden. Eine mögliche zukünftige Anwendung könnte darin bestehen, Streptavidin-bindende Protein-Tags, das Avi-Tag-System oder Proximity-Marking-Ansätze mit Streptavidin-Affinitätsgittern zu kombinieren, um einzelne Proteine und/oder Proteinkomplexe direkt aus rekombinanten oder endogenen Quellen ohne aufwändige Standardaufreinigungsschemata zu extrahieren.
Durch die Bereitstellung dieses Protokolls sollten Labore in der Lage sein, die Herstellung von Streptavidin-Affinitätsgittern leicht zu reproduzieren und sie als häufiger verwendetes Werkzeug für die Strukturanalyse von Proteinkomplexen durch Kryo-EM zu etablieren.
Offenlegungen
Nichts.
Danksagungen
T.C. wurde durch das National Institute of General Medical Sciences Molecular Biophysics Training Grant GM-08295 und das National Science Foundation Graduate Research Fellowship unter der Fördernummer DGE 2146752 unterstützt. R.G. und B.H. wurden durch den Zuschuss R21-GM135666 des National Institute of Health unterstützt, der R.G. und B.H. Diese Arbeit wurde teilweise durch den Zuschuss R35-GM127018 des National Institute of General Medical Sciences finanziert, der an E.N. E.N. ist ein Forscher des Howard Hughes Medical Institute.
Materialien
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3- phosphoethanolamine-N-(biotinyl) sodium salt | Avanti Polar Lipids | 870285P | Comes as a powder. Dissolve at concentration of 1–10 mg/mL in chloroform/methanol/water solvent, 65:35:8 v/v and store in single use aliquots at -80 °C |
| 200 proof pure ethanol | Fisher Scientific | 07-678-005 | |
| 5 μL Hamilton Syringe | Hamilton | 87930 | 5 µL Microliter Syringe Model 75 RN, Small Removable Needle, 26 G, 2 in, point style 2 |
| Castor Oil | Sigma Adrich | 259853 | |
| Cell culture dishes untreated (35 mm) | Bio Basic | SP22146 | |
| Chloroform | Sigma Aldrich | 650471 | |
| D-(+)-Trehalose dihydrate,from starch, ≥99% | Sigma Aldrich | T9449 | |
| DUMONT Anti-Capillary Reverse (self-closing) Tweezers Biology Grade | Ted Pella | 510-5NM | |
| HPLC Grade Methanol | Fisher Scientific | A452-4 | |
| Leica EM ACE600 High Vacuum Sputter Coater | Leica | ||
| Leica EM GP2 Automatic Plunge Freezer | Leica | ||
| Quantifoil R 2/1 Au300 | Quantifoil | Q84994 | |
| Steptavidin | New England Bioscience | N7021S | Comes as 1 mg/mL solution. Dilute to final concentration of 0.5 mg /mL in crystallization bufferwith a final trehalose concentration of 10%. Can be flash frozen in 25–50 μL aliquots |
| Talcum powder | Carolina | 896060 | |
| Whatman Grade 1 filter paper | Cytiva | 1001-085 |
Referenzen
- Glaeser, R. M., Nogales, E., Chiu, W. . Single-particle Cryo-EM of Biological Macromolecules. IOP Publishing. , (2021).
- Carragher, B., et al. Current outcomes when optimizing 'standard' sample preparation for single-particle cryo-EM. Journal of Microscopy. 276 (1), 39-45 (2019).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta Crystallographica Section D-Structural Biology. 74, 560-571 (2018).
- Noble, A. J., et al. Routine single particle cryoEM sample and grid characterization by tomography. eLife. 7, e34257 (2018).
- Patel, A., Toso, D., Litvak, A., Nogales, E. Efficient graphene oxide coating improves cryo-EM sample preparation and data collection from tilted grids. bioRxiv. , (2021).
- Wang, F., et al. General and robust covalently linked graphene oxide affinity grids for high-resolution cryo-EM. Proceedings of the National Academy of Sciences. 117 (39), 24269-24273 (2020).
- Pantelic, R. S., Meyer, J. C., Kaiser, U., Baumeister, W., Plitzko, J. M. Graphene oxide: A substrate for optimizing preparations of frozen-hydrated samples. Journal of Structural Biology. 170 (1), 152-156 (2010).
- Williams, R. C., Glaeser, R. M. Ultrathin carbon support films for electron microscopy. Science. 175 (4025), 1000-1001 (1972).
- Han, B. -. G., et al. Long shelf-life streptavidin support-films suitable for electron microscopy of biological macromolecules. Journal of Structural Biology. 195 (2), 238-244 (2016).
- Han, B. -. G., et al. Electron microscopy of biotinylated protein complexes bound to streptavidin monolayer crystals. Journal of Structural Biology. 180 (1), 249-253 (2012).
- Domínguez-Martín, M. A., et al. Structures of a phycobilisome in light-harvesting and photoprotected states. Nature. 609 (7928), 835-845 (2022).
- Kasinath, V., et al. JARID2 and AEBP2 regulate PRC2 in the presence of H2AK119ub1 and other histone modifications. Science. 371 (6527), eabc3393 (2021).
- Lahiri, I., et al. 3.1 structure of yeast RNA polymerase II elongation complex stalled at a cyclobutane pyrimidine dimer lesion solved using streptavidin affinity grids. Journal of Structural Biology. 207 (3), 270-278 (2019).
- Marr, C. R., Benlekbir, S., Rubinstein, J. L. Fabrication of carbon films with ~ 500nm holes for cryo-EM with a direct detector device. Journal of Structural Biology. 185 (1), 42-47 (2014).
- Levine, M. J., Schwarz, J. A. Experimental guidelines for producing molecular assemblies by Langmuir-Blodgett techniques. Journal of Chemical Education. 65 (7), 638 (1988).
- Zheng, S. Q., et al. MotionCor2: anisotropic correction of beam-induced motion for improved cryo-electron microscopy. Nature Methods. 14 (4), 331-332 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten