Method Article
극저온 전자 현미경 시료 전처리를 위한 Streptavidin-Affinity Grid 제작
요약
streptavidin 친화성 그리드를 제작하기 위한 단계별 프로토콜은 초저온 전자 현미경에 의한 까다로운 고분자 샘플의 구조 연구에 사용할 수 있도록 제공됩니다.
초록
Streptavidin 친화성 그리드는 공기-물 계면으로 인해 발생할 수 있는 시료 변성 및 우선 배향을 포함하여 일반적으로 발생하는 많은 초저온 전자 현미경(Cryo-EM) 시료 전처리 문제를 극복하기 위한 전략을 제공합니다. 그러나 Streptavidin 친화성 그리드는 상업적으로 이용 가능하지 않고 신중한 제조 공정이 필요하기 때문에 현재 소수의 Cryo-EM 실험실에서 활용되고 있습니다. 2차원 스트렙타비딘 결정은 표준 holey-carbon Cryo-EM 그리드에 직접 적용되는 비오틴화된 지질 단층에서 성장합니다. 스트렙타비딘과 비오틴 사이의 높은 친화성 상호 작용은 Cryo-EM 시료 전처리 중 공기-물 계면으로부터 보호되는 비오틴화된 시료의 후속 결합을 가능하게 합니다. 또한 이러한 그리드는 제한된 수량으로 사용 가능한 샘플을 농축하고 그리드에서 직접 관심 단백질 복합체를 정제하기 위한 전략을 제공합니다. 여기에서는 Cryo-EM 및 음성 염색 실험에 사용하기 위한 스트렙타비딘 친화성 그리드의 견고한 제조를 위해 단계별로 최적화된 프로토콜이 제공됩니다. 또한 일반적으로 경험하는 문제에 대한 문제 해결 가이드가 포함되어 있어 더 큰 Cryo-EM 커뮤니티에서 streptavidin 친화성 그리드를 더 쉽게 사용할 수 있습니다.
서문
전자 초저온 현미경(Cryo-EM)은 이전에는 X선 결정학 또는 핵 자기 공명(nuclear magnetic resonance)으로 접근할 수 없었던 크고 유연한 이종 시료의 고분자 구조 측정을 가능하게 함으로써 구조 생물학 분야에 혁명을 일으켰습니다1. 이 방법은 용액에서 거대분자를 급속 동결하여 전자 현미경을 사용하여 나중에 이미지화할 수 있는 유리질 얼음의 얇은 층을 만드는 방식으로 작동합니다. 최근 몇 년 동안 현미경 하드웨어와 이미지 처리 소프트웨어가 크게 발전하면서 Cryo-EM에 의한 고분해능 구조 측정에 적합한 시료 유형이 더욱 확장되었습니다.
그럼에도 불구하고 얇은 유리화 시료의 준비는 Cryo-EM에 의한 고분자 구조 측정에서 가장 중요한 단계 중 하나입니다. 생물학적 시료는 종종 동적이고, 깨지기 쉬우며, 변성되기 쉬우며, 때로는 Cryo-EM 연구에 소량만 사용할 수 있습니다. 블로팅 공정 중에 이러한 입자는 소수성 공기-물 계면과 상호 작용하여 입자 선호 방향, 깨지기 쉬운 복합체의 분해, 부분 또는 전체 시료 변성 및 응집 2,3,4를 초래할 수 있습니다. 세제 또는 기타 계면활성제의 사용, 화학적 가교 및 지지층을 위한 시료 흡착은 동결 공정 중에 생물학적 시료를 보존하기 위한 일반적인 전략입니다. 그래핀 산화물 5,6,7 또는 비정질 탄소8과 같은 지지층은 샘플이 제한된 양으로 제공될 때 흡착을 통해 그리드에 입자를 농축하는 기능도 합니다. 그러나 이러한 방법은 일반적이거나 신뢰할 수 없으며 그리드 준비 최적화는 시간이 많이 걸리거나 완전히 실패할 수 있습니다.
스트렙타비딘 친화성 그리드(9,10)는 이러한 단점을 극복하고 관심 복합체를 격리하고 공기-물 계면으로부터 보호하기 위한 온화하고 일반적으로 적용 가능한 방법을 제공하기 위해 개발되었다. 이 그리드는 그리드의 비오틴화된 지질 단층에서 성장한 2차원(2D) 스트렙타비딘 결정 격자를 사용합니다. 샘플 자체가 비오틴화된 후(종종 드물게 무작위로, 복합체당 평균 하나의 비오틴을 의미함) 스트렙타비딘 코팅 그리드에 적용할 수 있습니다. 시료 흡착은 스트렙타비딘과 비오틴 사이의 매우 높은 친화력에 의존하기 때문에 이러한 그리드에는 10nM의 낮은 시료 농도를 사용할 수 있습니다. 단백질용 비오틴화 키트와 DNA 함유 복합체용 비오틴화 프라이머를 시판하면 대부분의 관심 샘플에 필요한 비오틴 부분을 비교적 쉽게 부착할 수 있습니다. 시료를 농축하고 블로팅 중 유해한 공기-물 계면으로부터 멀리 유지하는 것 외에도, 하나 또는 몇 개의 라이신 잔기의 무작위 비오틴화는 Cryo-EM 그리드에서 관심 분자의 배향 범위를 크게 개선할 수 있습니다11. 기본 스트렙타비딘 결정의 신호가 원시 이미지에 존재하지만, 결정의 날카로운 브래그 반사에 대한 푸리에 여과와 관련된 데이터 처리 체계는 초기 데이터 처리 중에 쉽게 제거될 수 있으며, 궁극적으로 관심 샘플의 고해상도 재구성을 가능하게 합니다 11,12,13. 여기에서 streptavidin 친화성 그리드의 강력한 생산과 Cryo-EM 실험에서의 후속 사용을 위해 최적화된 단계별 프로토콜이 제공됩니다. 제공된 프로토콜은 2주에 걸쳐 완료될 것으로 예상됩니다(그림 1A). 프로토콜의 첫 번째 부분에서는 시약 준비, 그리드 전처리 및 첫 번째 탄소 증발 단계를 설명합니다. 다음으로, 지질 단층의 제조 및 EM 그리드에서 스트렙타비딘 결정의 성장에 대한 지침이 설명됩니다. 또한 음성 염색 EM 및 Cryo-EM 실험에서 streptavidin 친화성 그리드를 사용하기 위한 지침이 제공됩니다. 마지막으로, Cryo-EM 데이터를 획득한 후 현미경 사진에서 스트렙타비딘 신호를 제거하기 위한 절차가 제공됩니다.
프로토콜
1. 시약의 준비
- 상업적으로 구입한 스트렙타비딘을 결정화 완충액(50mM HEPES pH 7.5, 150mM KCl, 5mM EDTA, 10% 트레할로스)에서 최종 농도 0.5mg/mL로 희석합니다. 최종 트레할로스 농도가 10%인지 확인하십시오. 액체 질소에서 25-50 μL의 부분 표본을 급속 동결하고 -80 °C에서 보관합니다.
- 1,2-디팔미토일-sn-글리세로-3-포스포에탄올아민-N-(비오티닐) 나트륨염을 65:35:8 v/v/v 클로로포름/메탄올/물 용매에 용해시켜 최종 지질 농도 1mg/mL를 만듭니다. -80 °C에서 20-30 μL의 일회용 부분 표본을 유리 바이알에 보관하십시오.
참고: 용매의 준비는 중량으로 수행하는 것이 더 정확합니다. 먼저 초순수 1.85g과 고성능 액체 크로마토그래피(HPLC) 등급 메탄올 6.41g을 결합하고 이를 클로로포름 22.42g에 첨가하여 용매를 준비합니다.
주의 : 이 프로토콜을 시작하기 전에 클로로포름 및 메탄올 유기 용제의 취급 및 폐기에 대한 제조업체의 안전 데이터 시트와 권장 지침을 읽고 이해하십시오. 메탄올이 피부에 직접 닿지 않도록 하십시오.
2. 그리드의 전처리
- 금망 그리드의 탄소 호일을 100% 클로로포름에 두 번, 100% 에탄올에 한 번 담가 세척합니다. 깨끗한 여과지 위에 그리드를 올려 말립니다. 세탁 과정을 총 3회 반복합니다.
참고: 구멍 크기가 0.6-2μm 범위인 10-12nm 두께의 탄소막(재료 목록 참조)이 있는 상업적으로 이용 가능한 탄소 호일 그리드를 사용하여 재현 가능한 성공을 거두었습니다. 루빈스타인 연구소(Rubinstein Laboratory)의 나노패브리케이션 프로토콜(nanofabrication protocol) 14 에 따라 제조된 상업적으로 이용 가능한 금박 격자 및 홈메이드 홀리-카본 격자(homemade holey-carbon grid)도 성공적으로 사용되었다. 더 얇은 탄소 필름을 가진 상업적으로 이용 가능한 그리드에서 덜 재현성 있는 결과를 얻었습니다. 구리는 샘플에 있을 수 있는 유기 아민과 반응하므로 구리 그리드를 사용하지 마십시오. - 그리드가 건조된 후 2.5-5nm 두께의 탄소 층을 구멍이 있는 탄소 그리드의 탄소 쪽으로 증발시킵니다. 탄소 두께는 재료 표 파일에 제공된 탄소 증발기에 내장된 석영 결정막 두께 측정으로 제어됩니다.
- 새로 증발된 탄소를 1주일 동안 노화(즉, 소수성이 더 높아짐)시키십시오.
3. 스트렙타비딘 격자의 제조
참고: 구멍이 뚫린 탄소 EM 그리드에서 2D 스트렙타비딘 결정을 성장시키기 위해 먼저 Langmuir-Schaefer 전달에 의해 비오틴화된 지질 단층을 탄소 필름의 구멍에 적용합니다(그림 1B). 지질 단층은 후속 단계에 따라 형성됩니다(그림 2). 활석 분말은 피마자유와 페트리 접시 사이의 경계를 만들고 피마자유의 얇은 층은 지질 단층이 형성될 때 일정한 표면 압력을 유지하는 데 도움이 됩니다. 2.2 단계에서 증발된 탄소를 포함하는 면을 사용하여 단층을 픽업하고, 과잉 지질을 결정화 완충액으로 씻어내고, 결정화를 위해 그리드에서 스트렙타비딘 용액을 배양합니다.
- 벤치 주변을 70% 에탄올로 청소하십시오.
- 5μL 유리 주사기를 클로로포름으로 여러 번 헹구어 세척합니다. 사용하기 전에 주사기를 완전히 건조시키십시오.
- 탄소 증발 그리드를 100% 에탄올에 담가 사용 직전에 다시 세척하십시오. 깨끗한 여과지에 그리드를 말리십시오.
- 그리드가 건조되는 동안 각 모세관 방지 핀셋을 100% 클로로포름과 100% 에탄올로 세척하십시오. 핀셋이 완전히 건조되도록 합니다.
- 파라필름의 깨끗한 면에 만들 각 그리드에 대해 50μL 결정화 완충액(50mM HEPES pH 7.5, 150mM KCl, 5mM EDTA, 10% 트레할로스) 3방울을 준비합니다.
- 35mm 코팅되지 않은 페트리 접시의 뚜껑을 결정화 완충액(50mM HEPES pH 7.5, 150mM KCl, 5mM EDTA, 10% 트레할로스)으로 채웁니다. 렌즈 용지로 표면을 청소하십시오.
- 페트리 접시 둘레에 과학 등급의 활석 가루를 뿌립니다. 이것은 다음 단계에서 피마자유가 얼마나 멀리 퍼졌는지를 나타내는 지표 역할을 합니다. 활석 가루를 충분히 추가하여 피마자유가 페트리 접시의 가장자리에 닿지 않도록 보호하는 장벽을 만듭니다. 활석 가루를 너무 많이 첨가하면 지질 단층을 만드는 데 사용할 수 있는 공간이 제한됩니다.
- 200 μL 피펫 팁을 피마자유에 담그면 피펫 팁에 매달려 있는 중간 크기의 방울(약 20 μL)이 나옵니다. 이 방울을 페트리 접시의 완충액 표면에 대면 퍼지면서 균일한 필름을 형성합니다. 생성된 오일 박막은 피스톤(15)의 역할을 하며, 피스톤(15)은 지질 단층이 형성될 때 일정한 표면 압력을 유지한다(단계 3.10).
알림: 피마자유가 너무 적게 첨가되기보다는 충분한 피마자유가 중요하며, 한 방울로 추가하는 것이 좋습니다. 지질 단층을 만들기 전에 피마자유가 완전히 퍼지도록 하십시오. - 5μL 유리 주사기를 용해된 지질로 한두 번 헹구고 분취액을 사용합니다. 주사기를 채우는 지질에 기포가 생기지 않도록 하십시오.
알림: 유리 주사기는 3.2단계에서 잔류 클로로포름이 남아 있는 경우 용해된 지질로 헹굽니다. 잔류 클로로포름은 생성된 단층의 품질에 영향을 미칠 수 있습니다. - 주사기에서 가능한 가장 작은 부피(~0.5μL)의 지질을 분사하고 매달린 물방울을 피마자유막 표면에 부드럽게 터치합니다. 지질 용액은 접촉 지점에서 피마자유막을 뚫고 생성된 지질 단층이 피마자유의 박막 중앙에 원을 형성한다는 점에 유의하십시오.
- 지질을 순차적으로 몇 방울 떨어뜨리거나 격자를 만든 후 지질을 더 추가하되 너무 많이 첨가하면 지질이 피마자유의 경계를 넘어 활석 분말과 오염 계면활성제가 격리된 주변으로 퍼집니다. 이 경우 프로세스를 다시 시작해야 합니다.
- 모세관 방지 핀셋으로 그리드를 집어 올려 핀셋의 직선 암과 그리드의 탄소 증발 면이 모두 단층을 향하도록 합니다.
- 그리드의 탄소 증발 면을 단층에 1-2초 동안 접촉하여 단층의 일부를 구멍이 있는 탄소로 옮깁니다.
알림: 성공적인 이동은 그리드 표면이 친수성이 되어 페트리 접시에서 들어 올린 후 얇은 구형 버퍼 캡이 전체 그리드를 덮는 것으로 표시됩니다. - 이제 그리드에 부착되는 완충액의 구형 캡을 각각 1초 동안 순차적으로 3.5단계에서 파라필름에 준비한 50μL 결정화 완충액 3방울에 접촉합니다.
참고: 이 단계는 전자 현미경에서 샘플을 볼 때 지질 소포가 형성되는 것을 방지하기 위해 구형 캡의 표면(이전의 소수성 탄소 필름이 아닌)을 덮고 있는 과도한 지질을 가능한 한 많이 제거하려고 합니다. - 4μL의 0.5mg/mL 스트렙타비딘을 그리드에 있는 결정화 완충액의 나머지 구형 캡에 조심스럽게 추가합니다.
- 그리드를 습도 챔버에 놓습니다. 전체 그리드 배치에 대해 3.11-3.14단계를 반복합니다.
- 증발을 방지하기 위해 습도 챔버 내에서 2시간 동안 실온(RT)에서 그리드를 배양합니다.
알림: 단층을 도포한 후 그리드의 금색 면이 젖지 않는 것이 중요합니다. - 2시간 배양 후 파라필름의 깨끗한 면에 있는 각 그리드에 대해 300μL 헹굼 완충액(10mM HEPES, pH 7.5, 50mM KCl, 5mM EDTA, 10% 트레할로스) 1방울을 준비합니다.
참고: 헹굼 완충액에는 3.5-3.6단계에 사용된 결정화 완충액에 있는 150mM KCl이 아닌 50mM KCl이 포함되어 있습니다. - 과잉(결합되지 않은) 스트렙타비딘을 300μL 헹굼 버퍼 방울에 올려 놓아 세척합니다. 한 번에 하나의 그리드에 대해 3.18-3.20단계를 수행합니다. 그리드를 300μL 헹굼 버퍼 드롭에 장기간 두지 마십시오.
알림: 이 시점에서 streptavidin 결정/단층이 깨지기 쉽기 때문에 한 번만 세척이 수행됩니다. 그리드가 세척 버퍼 방울의 표면에서 들어 올려질 때마다 그리드와 세척 방울 사이의 액체 다리가 파열됩니다. 파열 시 과도 압력 구배(흡입 압력)가 탄소 필름의 열린 구멍에 걸쳐 있는 자체 지지 단층 결정에 적용됩니다. 이 흡입 압력은 단층 결정의 일시적인 돔을 유발할 것으로 예상되며, 결정으로 덮인 영역의 확장이 수반됩니다. 면적의 증가가 결정의 탄성 한계를 초과하면 결정이 깨지거나 무질서해질 수 있습니다. - 보푸라기가 없는 물티슈로 모세관 방지 핀셋을 즉시 건조시켜 다음 단계에서 그리드가 여과지에 쉽게 방출되도록 합니다. 헹굼 버퍼 방울에 떠 있는 그리드를 모세관 방지 핀셋의 꼬인 팔을 방울에 찔러 넣습니다.
- 여과지로 측면에서 여분의 버퍼를 부드럽게 닦아냅니다. 금색 면이 아래로 향하게 하여 여과지에 그리드를 놓고 각 그리드에 대해 3.18-3.20단계를 반복하고 그리드를 15-20분 동안 건조시킵니다.
- 그리드가 마르면 금색 면이 위를 향하도록 뒤집습니다. 얇은 탄소 층(약 0.5-2nm 두께)을 그리드의 금 면에 증발시킵니다.
알림: 그리드를 일정한 습도에 보관하면 그 값은 중요하지 않은 것으로 보이며, 상대 습도의 여러 변화는 팽창 및 수축 주기를 초래할 것으로 예상됩니다. 그리드 뒷면의 소수성이 단층 안정성에 중요할 수 있으므로 최상의 결과를 얻으려면 Cryo-EM을 사용하기 전에 그리드를 1주일 동안 숙성시키십시오. 그리드는 오랜 기간 동안 안정적이지만 3개월 후에는 뒷면 탄소가 소수성이 낮아질 수 있습니다.
4. 음성 염색에 의한 streptavidin 친화성 그리드 배치 품질 확인
- 파라필름의 깨끗한 면에 50μL 2방울과 100μL 샘플 완충액(50mM HEPES pH 7.5, 50mM KCl, 0.5mM TCEP) 1방울을 준비합니다.
- 트레할로스를 제거하고 두 개의 50μL 방울을 만져 스트렙타비딘 그리드를 재수화하고 그리드를 100μL 샘플 버퍼 방울에 10분 동안 띄웁니다.
알림: 재수화 및 후속 샘플 바인딩 배양 중에는 세제 사용을 피하는 것이 가장 좋습니다. 완충액은 그리드의 금 쪽으로 분산되어 과도한 샘플을 제거하기 위한 세척 효율성을 제한합니다. - 수분을 보충한 후 모세관 방지 핀셋으로 그리드를 들어 올려 모세관 방지 핀셋의 꼬인 팔이 방울에 들어가도록 합니다.
- 측면에서 여분의 완충액을 부드럽게 닦아내고 4μL의 75-100nM 샘플(옵션)을 빠르게 다시 적용합니다.
알림: 수분 보충 후 그리드를 건조시키지 마십시오. - 샘플을 습도 챔버에서 1-5분 동안 배양합니다.
참고: 농축 및 배양 시간은 샘플에 따라 다르며 최적화되어야 합니다. 제공된 시료 농도 및 배양 시간은 제안된 시작점입니다. - 파라필름의 깨끗한 면에 시료 완충액과 1% 포름우라닐(UF) 염색을 각각 30μL씩 4방울씩 떨어뜨립니다.
알림: 이 단계를 수행하기 전에 우라닐 포름산염의 취급 및 폐기에 대한 제조업체의 안전 데이터 시트와 권장 지침을 읽고 이해하십시오. 우라닐 포름산염은 독성 및 방사성 화합물입니다. 방사성 물질 사용에 대한 사전 기관 승인을 받아야 합니다. - 결합되지 않은 샘플을 씻어내십시오.amp샘플 버퍼의 4방울 각각을 만집니다.
- UF를 사용한 표준 음성 염색 절차를 사용하여 샘플을 염색합니다. 측면에서 UF 얼룩을 부드럽게 닦아내고 그리드에 매우 두꺼운 얼룩 층을 남깁니다. 필요한 경우 얼룩을 더 두껍게 만들기 위해 얼룩 후 그리드에 0.5μL의 추가 얼룩을 적용할 수 있습니다. 그리드를 공기 중에서 건조시키십시오.
참고: 스트렙타비딘 그리드는 매우 친수성이기 때문에 네거티브 스테인은 글로우 방전 처리된 연속 탄소 그리드를 사용할 때 일반적으로 볼 수 있는 것과는 달리 모든 곳에서 매우 균일한 필름을 형성하는 경향이 있습니다. 결과적으로 얼룩 용액의 두꺼운 필름을 남기는 것이 좋습니다.
5. 비오틴화된 샘플로 streptavidin 친화성 그리드 동결
알림: 다음 절차는 내부 블로팅 센서가 포함된 단면 자동 플런저를 위한 것입니다(다른 자동 플런징 장치에서도 단면 수동 블런저도 가능)
- 파라필름의 깨끗한 면에 50μL 2방울과 100μL 샘플 완충액(예: 50mM HEPES pH 7.5, 50mM KCl, 0.5mM TCEP) 1방울을 준비합니다.
- 두 개의 50μL 방울을 만져 streptavidin 그리드를 재수화하고 그리드를 100μL 샘플 버퍼 방울에 10분 동안 띄웁니다.
- 수분을 보충한 후 모세관 방지 핀셋으로 그리드를 들어 올려 모세관 방지 핀셋의 꼬인 팔이 방울에 들어가도록 합니다.
- 과잉 완충액을 측면에서 부드럽게 닦아내고 4μL의 75-100nM 샘플을 빠르게 적용합니다.
- 샘플을 습도 챔버에서 1-5분 동안 배양합니다.
알림: 다시 말하지만, 농축 및 배양 시간은 샘플에 따라 다르며 최적화되어야 합니다. 제공된 시료 농도 및 배양 시간은 제안된 시작점입니다. 낮은 농도의 샘플의 경우 더 오랜 기간 동안 배양하거나 샘플을 그리드에 여러 번 바인딩할 수 있습니다. - 파라필름의 깨끗한 면에 10μL 동결 완충액(예: 50mM HEPES pH 7.5, 50mM KCl, 0.5mM TCEP, 3% 트레할로스, 0.01% NP40) 2방울을 준비합니다. 배양 후 결합되지 않은 샘플을 냉동 완충액의 첫 번째 방울까지 그리드를 만져 세척합니다. 그리드를 동결 버퍼의 두 번째 드롭에 드롭합니다.
- 한쪽 자동 플런저에 부착된 핀셋으로 그리드의 가장자리를 빠르게 잡습니다. 여분의 완충액을 부드럽게 제거하고 4μL의 동결 완충액(50mM HEPES pH 7.5, 50mM KCl, 0.5mM TCEP, 3% 트레할로스, 0.01% NP40)을 그리드에 빠르게 적용합니다.
- 단면 자동 플런저에 핀셋을 부착합니다. 최상의 결과는 4-6초 사이의 블롯 시간으로 그리드의 액체 방울을 감지하는 블롯 센서를 사용하여 얻은 것입니다. 조건은 사용된 샘플과 완충액에 따라 달라집니다.
6. streptavidin 친화성 그리드에서 수집된 Cryo-EM 동영상의 데이터 처리
streptavidin 친화성 그리드에 대한 데이터 수집은 표준 그리드와 마찬가지로 수행할 수 있으며 특별한 현미경 조정이 필요하지 않습니다. 그러나 여기에 자세히 설명된 절차는 현미경 사진의 움직임 보정 후에만 스트렙타비딘 신호를 제거합니다. 따라서 원본 동영상 프레임에 의존하는 파티클 연마와 같은 데이터 처리 단계는 안정적으로 수행할 수 없습니다. 여기서 streptavidin 신호 빼기(CTF 추정을 제외한 모든 표준 다운스트림 처리에 필요)를 수행하려면 Linux 환경에서 실행되는 Matlab 버전 R2014b 이상이 필요합니다. 신호 빼기는 스트렙타비딘 층의 결정질 특성에 의존하며, 이를 통해 피크 마스킹이 가능하므로 각 현미경 사진의 푸리에 변환에서 신호를 제거할 수 있습니다.
- 처리 스크립트 설정
- 추가 파일의 모든 파일을 프로젝트 디렉터리 내의 전용 폴더로 복사합니다.
- 다음 파일을 포함하는 processing_scripts라는 디렉터리를 준비합니다.
lsub.m (보충 코딩 파일 1, 빼기 스크립트)
process_subtration.sh (보충 코딩 파일 2, 사용 가능한 모든 현미경 사진을 반복하고, 병렬 작업을 생성하고, 입력 및 출력을 추적하는 래퍼 스크립트)
process_subtraction.cfg (보충 코딩 파일 3; 빼기 작업에 대한 매개 변수가 포함된 구성 파일, 6.2 참조) - 다음 파일을 포함하는 support_scripts라는 디렉터리를 준비합니다.
bg_drill_hole.m(보충 코딩 파일 4)
bg_FastSubtract_standard.m(보충 코딩 파일 5)
bg_Pick_Amp_masked_standard.m(보충 코딩 파일 6)
bg_push_by_rot.m(보충 코딩 파일 7)
ReadMRC.m(보충 코딩 파일 8)
WriteMRC.m(보충 코딩 파일 9)
WriteMRCHeader.m(추가 코딩 파일 10)
- 필요에 따라 구성 파일(process_subtraction.cfg, (그림 3 참조)을 조정합니다.
- 입력: mrc 형식의 모션 보정된 현미경 사진이 포함된 디렉토리의 경로입니다. 디렉터리 또는 와일드카드(?, *)를 포함한 패턴을 사용합니다.
본보기:
입력="/경로/to/project_directory/micrographs/"
또는
입력 = "/ 경로 / project_directory / 현미경 사진 / * .mrc" - output_dir: 격자를 뺀 현미경 사진을 기록해야 하는 디렉토리의 경로입니다.
- only_do_unfinished: 기존에 뺀 현미경 사진을 덮어쓰거나 건너뛰어야 하는 경우 (true|false)를 지정합니다. 이 파라미터는 현미경 세션 중간에 격자 빼기 스크립트를 시작하는 데 유용합니다(기본값: true).
- num_parallel_jobs: 병렬 작업 수를 지정합니다. 이 숫자는 처리에 사용되는 하드웨어 사양에 따라 다르며 사용 가능한 코어 수보다 크지 않아야 합니다. 32개의 코어와 네트워크 파일 시스템이 있는 시스템에서는 14개의 병렬 작업으로 최적의 성능을 달성했습니다. 최상의 성능을 위해 현미경 사진의 하위 집합으로 이 값을 최적화하십시오.
- Pad_Origin_X: 세로 방향(이미지 너비 < 이미지 높이)의 K3 검출기의 경우 200, 정사각형 검출기(Falcon III, Falcon IV, K2)의 경우 2, 가로 방향(이미지 너비 > 이미지 높이)의 K1000 검출기의 경우 3. FFT는 정사각형 상자에서 수행되며 검출기의 치수가 정사각형이 아닌 경우 패딩이 필요합니다.
- Pad_Origin_Y: 세로 방향(이미지 너비 < 이미지 높이)의 K3 검출기의 경우 1000, 정사각형 검출기(Falcon III, Falcon IV, K2)를 사용하거나 가로 방향(이미지 >너비 이미지 높이)에서 K3 검출기를 사용하는 경우 200입니다.
- Inside_Radius_Ang(90)과 Outside_Radius_Ang(3.0)을 변경하지 마십시오. 격자 빼기는 두 해상도 사이에서 수행됩니다(단위는 옹스트롬 단위임).
- Pixel_Ang: 픽셀 크기를 부동 소수점 값으로 제공합니다.
- 임계값: 격자를 푸리에 공간의 배경으로 대체하기 위한 빼기 임계값 컷오프 값입니다. 성공적으로 사용된 값은 1.4-1.6 사이입니다. 1.42를 시작점으로 사용합니다.
- expand_pixel (10)과 pad_out_opt (0)을 변경하지 마십시오. expand_pixel는 임계값 컷오프보다 높은 값을 가진 픽셀 주위를 마스킹하는 데 사용되는 지름 값입니다. pad_out_opt는 채워진 영역이 출력에 포함되는지 여부를 결정하는 옵션입니다.
- addpath_m: 지원 스크립트의 경로입니다.
- path_to_matlab_bin: 시스템의 Matlab 설치 bin 디렉터리의 경로입니다.
- path_matlab_script: 위의 6.1.2단계에서 복사한 matlab 빼기 스크립트(lsub.m)의 경로입니다.
- 입력: mrc 형식의 모션 보정된 현미경 사진이 포함된 디렉토리의 경로입니다. 디렉터리 또는 와일드카드(?, *)를 포함한 패턴을 사용합니다.
- 수정된 스크립트를 저장한 후 스크립트(bash ./process_subtraction.sh )를 실행하여 입력 현미경 사진에서 streptavidin 신호를 뺍니다. 매개 변수 only_do_unfinished가 true로 설정된 경우 스크립트를 중단하거나 다시 시작할 수 있습니다(6.2.3단계 참조). 오류가 발생하면 bash 스크립트에 지정된 매개 변수를 검토합니다. 매개변수 변수와 할당된 값 사이에 의도하지 않은 공백이 없는지 확인하십시오., 이는 실수의 일반적인 원인입니다.
- 표준 Cryo-EM 이미지 처리를 위해 격자 뺀 이미지를 사용합니다.
결과
3.21 단계에서 탄소 증발 후(보통 1주일 후) 4단계 및 5단계에 설명된 절차에 따라 streptavidin 친화성 그리드를 Cryo-EM 또는 음성 염색 시료 준비에 사용할 수 있습니다. streptavidin 친화성 그리드로 동결된 비오틴화된 샘플의 픽셀 크기 1.05Å로 81,000X 배율로 titan Krios에서 K3 검출기를 사용하여 캡처한 대표적인 현미경 사진이 그림 4A에 나와 있습니다. 성공적인 격자 형성은 이미지 배경에 나타나는 연속 격자 패턴으로 관찰됩니다. 이는 그림 4A (오른쪽)에 표시된 고속 푸리에 변환(FFT)에 나타나는 회절 패턴으로 더 쉽게 관찰할 수 있습니다. 데이터 수집 후, 이 프로토콜의 6단계에 설명된 절차에 따라 스트렙타비딘 격자에 의해 이미지에 기여하는 신호를 계산적으로 마스킹하여 후속 데이터 처리 단계에 사용할 수 있는 빼진 현미경 사진(그림 4B)을 생성할 수 있습니다. 그림 4B (오른쪽)의 FFT는 그림 4A (오른쪽)에서 관찰된 회절 패턴이 원본 이미지에서 성공적으로 제거되었음을 보여줍니다.
그림 4C 는 1.6Å의 픽셀 크기로 49,000x 배율로 Tecnai 12 현미경으로 촬영한 비오틴화된 샘플이 스트렙타비딘 친화성 그리드에 결합되고 우라닐 포름산염을 사용하여 음성으로 염색된 현미경 사진의 예를 보여줍니다. 그리드는 이 프로토콜의 4단계에 설명된 절차에 따라 준비되었으며 더 두꺼운 얼룩 필름을 남겼습니다.
스트렙타비딘 그리드 제작 절차가 성공하지 못한 경우 몇 가지 일반적인 관찰이 있으며, 이는 토론 섹션 및 표 1에 자세히 설명되어 있습니다 . 그림 5 에서는 이러한 관찰의 몇 가지 예를 보여 줍니다. 그림 5A 는 6개월 이상 된 배치에서 사용된 음성으로 염색된 스트렙타비딘 친화성 그리드의 현미경 사진을 보여줍니다. 단층은 quantifoil 그리드의 탄소 호일에 있는 구멍에서 동원되었으며 그리드의 구멍과 유사한 치수로 관찰됩니다. 그림 5B 는 시료 전처리 절차 중에 쉽게 교란되는 높은 모사이시티를 갖는 스트렙타비딘 결정의 예를 보여줍니다. 그림 5C 는 3.21 단계의 탄소 증발이 너무 얇거나 생략된 스트렙타비딘 친화성 그리드의 대표적인 현미경 사진을 보여줍니다. streptavidin 격자는 Cryo-EM 시료 전처리 공정 중에 단편화되었습니다. 그림 5D 는 3.13 단계 동안 불충분한 세척 또는 3.13-3.20 단계 동안 그리드의 금 면이 젖었기 때문에 지질 소포로 인해 오염된 음성으로 염색된 스트렙타비딘 친화성 그리드를 보여줍니다. 이러한 일반적인 문제를 극복하기 위한 전략에 대해서는 토론 섹션과 표 1 을 참조하십시오.
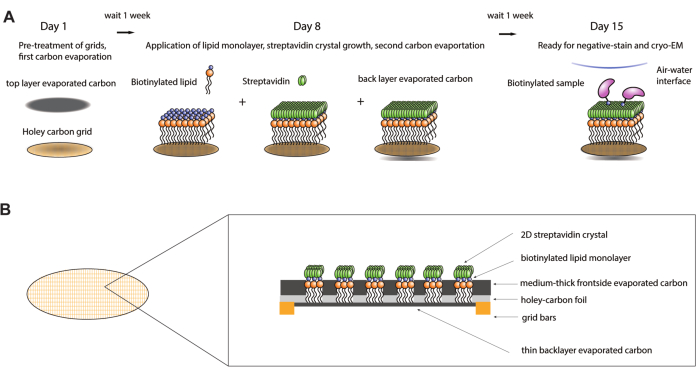
그림 1: streptavidin 친화성 그리드 제작 절차의 개략도. (A) 스트렙타비딘 친화성 그리드 제작 절차의 개요 타임라인. 전체 절차는 2주에 걸쳐 완료할 수 있으며, 탄소가 충분히 숙성될 수 있도록 두 번의 탄소 증발 단계와 각 단계 후 1주일이 필요합니다. (B) 금괴 및 구멍이 뚫린 탄소 필름이 있는 표준 Cryo-EM 그리드, 첫 번째 증발 탄소 층, 지질 단층, 2D-스트렙타비딘 결정 및 후면 증발 탄소 지지층을 포함하여 제조 공정 완료 후 그리드를 구성하는 층을 보여주는 스트렙타비딘 친화성 그리드의 그리드 사각형을 확대한 보기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 지질 단층과 스트렙타비딘 결정화(A) 지질 단층을 형성하는 동안 일정한 표면 압력을 생성하는 피마자유의 경계를 만들기 위해 활석 분말을 사용하여 작은 페트리 접시 내에서 지질 단층을 성공적으로 형성하는 방법을 보여주는 이미지. (B) Cryo-EM 그리드에서 스트렙타비딘 결정을 성장시키는 방법을 보여주는 이미지. 먼저, 그리드의 탄소 쪽을 지질 단층에 접촉시킨 후 결정화 완충액에서 3회 연속 세척합니다. 스트렙타비딘을 첨가하고 그리드를 습도 챔버에서 2시간 동안 배양합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 현미경 사진에서 streptavidin 격자 빼기를 수행하기 위한 process_subtraction.cfg 파일의 파라미터 예(6단계). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 성공적인 스트렙타비딘 친화성 그리드 제작의 대표적인 결과. (A) 홈메이드 스트렙타비딘 친화성 그리드로 준비한 비오틴화 단백질/뉴클레오솜 복합체의 Cryo-EM 현미경 사진. FFT는 오른쪽에 표시되며 스트렙타비딘 결정 회절 패턴을 보여줍니다. (B) 패널 A와 동일한 현미경 사진은 원본 이미지에서 2D 스트렙타비딘 결정의 신호를 제거하기 위한 격자 빼기 절차에 따라 표시됩니다. (C) 스트렙타비딘 친화성 그리드에 결합된 비오틴화된 샘플의 음성 염색에서 얻은 현미경 사진의 예. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 스트렙타비딘 친화성 그리드 제작에 실패한 대표적인 결과. (A) 그리드가 6개월 이상 되었을 때 그리드 구멍에서 스트렙타비딘 단층의 동원을 보여주는 현미경 사진. (B) Cryo-EM 및 음성 염색 시료 전처리 절차 중에 쉽게 손상되는 높은 mosaicity를 가진 streptavidin 격자를 보여주는 현미경 사진. (C) 단계 3.21의 탄소 증발층이 너무 얇거나 생략된 경우 Cryo-EM 시료 준비 중 스트렙타비딘 격자의 단편화를 보여주는 현미경 사진. (D) 3.13 단계 동안 불충분한 세척 또는 3.13-3.20 단계에서 그리드의 금 면이 젖어 지질 소포로 오염된 대표적인 현미경 사진. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 스트렙타비딘 친화성 그리드 제작에 실패하는 동안 일반적으로 발생하는 문제를 극복하기 위한 문제 해결 가이드. 이 표를 다운로드하려면 여기를 클릭하십시오.
보충 코딩 File 1: lsub.m 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 파일 2: process_subtration.sh 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 파일 3: process_subtraction.cfg 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 File 4: bg_drill_hole.m 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 File 5: bg_FastSubtract_standard.m 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 파일 6: bg_Pick_Amp_masked_standard.m 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 File 7: bg_push_by_rot.m 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 File 8: ReadMRC.m 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 파일 9: WriteMRC.m 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 File 10: WriteMRCHeader.m 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
당사의 프로토콜은 스트렙타비딘 친화성 그리드를 만들고 사용하는 방법과 스트렙타비딘 회절 신호가 포함된 데이터를 처리하는 방법을 설명합니다. 프로토콜에는 특별한 주의가 필요한 몇 가지 중요한 단계가 있습니다.
실패한 그리드 배치는 몇 가지 일반적인 오류로 거슬러 올라갈 수 있습니다. 오류의 가장 흔한 원인은 오래되거나 품질이 좋지 않은 시약을 사용하는 것입니다. 프로토콜에 설명된 대로 정확하게 비오틴화 지질 용액을 준비하는 것이 특히 중요합니다. 또한, 실험기구의 세제 잔류물 또는 피부에 자연적으로 존재하는 오일과 같은 불순물은 스트렙타비딘 결정의 품질에 영향을 미칠 수 있으며, 따라서 결과 이미지의 품질에 영향을 미칠 수 있습니다. 따라서 그리드 제조업체에서 계면활성제 오염 가능성을 제거하기 위해 첫 번째 탄소 증발 전에 그리드에 대해 세 번의 세척 주기를 수행하는 것이 좋습니다(2.1단계). 게다가, 피마자유의 오염 또는 불순은 격자에 결정 대형을 방해하기 위하여 관찰되었습니다.
지질 단층을 만들고 집는 것은 작은 지질 부피에 대한 느낌을 얻기 위해 몇 번 연습해야 하는 작업입니다. 이 단계가 적절한 지질 단층을 생성하기 전에 처음 두세 번 실패하는 것은 드문 일이 아니며, 이는 궁극적으로 음성으로 염색된 그리드에서 볼 수 있는 스트렙타비딘 결정의 품질에 반영됩니다(그림 4C).
그리드 제조 공정(3.12-3.20단계) 동안 그리드의 뒷면(금색 면, 지질 면)이 젖지 않도록 하는 것이 중요합니다. 뒷면이 젖었을 경우 그리드를 버리는 것이 좋습니다. 이로 인해 이미지 품질을 방해하는 큰 지질 소포가 나타날 수 있습니다(그림 5D)(행 3, 표 1). 지질 단층이 적용된 후 불충분한 세척으로 인해 지질 소포가 관찰될 수도 있습니다(단계 3.13). 스트렙타비딘을 첨가하기 전에 지질 단층을 만진 후 결정화 완충액을 사용하여 3회 세척하는 것이 좋습니다.
트레할로스가 내장된 그리드에 얇은 탄소 층이 증발한 후 그리드 뒷면은 격자 품질을 손상시키지 않고 젖을 수 있습니다. 예를 들어, 샘플 버퍼에 최소한의 세제가 포함되어 있을 때 뒷면의 습윤이 자주 관찰됩니다. 시료에 의한 후면의 습윤은 시료가 후면의 얇은 탄소 필름에 비특이적으로 결합하는 결과를 초래할 수 있으며, 이는 입자가 공기-물 계면으로 확산되는 것을 방지하거나 그리드 정제 전략에 친화성 결합을 사용하는 효과를 감소시킵니다. 가능하면 세제가 없는 상태에서 샘플을 그리드에 추가합니다. 세제 및 기타 첨가제는 그리드 세척 단계에서 추가되거나 유리화 전 마지막 단계에서 추가될 수 있습니다. 이것은 streptavidin 친화성 그리드 사용에 대한 한 가지 제한 사항입니다. 그러나, 목표가 우선 배향을 개선하는 것이라면, 세제를 포함한 완충액을 사용한 시료 전처리가 성공적으로 수행된 것이다11.
일반적인 오류의 원인은 두 탄소 증발 단계(2.3단계 및 3.21단계)와 관련된 그리드의 수명에서 찾을 수 있습니다. 이 프로토콜에서 권장되는 대기 기간은 Cryo-EM에 streptavidin 그리드를 사용하기 전에 뒷면 탄소 증발 후 5-7일입니다. 제작 후 그리드가 너무 빨리 사용되면 격자와 지질 단층이 그리드 구멍에서 동원되는 것이 관찰되었습니다. 그리드가 너무 오래되어 6개월 후에 사용된 경우에도 유사한 관찰을 할 수 있습니다(그림 5A)(행 1, 표 1). 우리는 이 관찰이 지질 단층과 스트렙타비딘 결정을 안정화하기 위해 적용되는 탄소 백킹의 소수성 변화에 의해 설명된다는 가설을 세웠습니다. 또한 streptavidin 격자는 모자이크(그림 5B)(행 3, 표 1)로 나타날 수 있으며, 첫 번째 탄소 증발층(단계 2.3)이 충분히 노화되지 않은 그리드에 단층을 적용하는 경우 음성 염색 및 Cryo-EM 모두에서 파손될 수 있습니다.
오류의 또 다른 일반적인 원인은 스트렙타비딘 결정질 단층(지질 단층은 그 자체가 유동이며 가역적으로 팽창하거나 압축될 수 있음)의 취약성으로 추적할 수 있습니다. 뒷면 탄소 증착(단계 3.21)은 시료 흡착, 세척 및 Cryo-EM 블로팅 공정 중에 단층 및 스트렙타비딘 격자 모두에 중요한 안정성을 제공합니다. 그리드 뒷면에 충분한 탄소 증발이 없는 경우 스트렙타비딘 격자는 블로팅/동결 후 조각난 것처럼 보이는 경우가 많습니다(그림 5C)(행 2, 표 1). 이 프로토콜에서는 단면 블로팅을 위해 단면 자동 플런지 냉동고를 사용하는 것이 좋습니다. 이 방법은 동결 공정 중에 streptavidin 격자를 보존하고 샘플 응용 프로그램 및 블로팅 파라미터의 간소화된 최적화를 가능하게 하는 재현성이 높은 블로팅 조건을 제공합니다. 대안적으로, 다른 자동 플런지-동결 장치들이 수동 블로팅과 함께 사용되어 왔다. 이를 위해 장치 설정에서 실제 압지 기능이 비활성화되고 대신 측면 입구를 통해 압지를 들고 있는 핀셋으로 손을 뻗어 그리드를 지웁니다. 이 방법은 단면 블로팅 및 플런지 동결 장치 없이 실험실에서 고품질 결과를 얻을 수 있습니다. 그러나 그리드 간 재현성은 어렵습니다.
streptavidin 친화도 그리드를 사용하면 많은 장점이 있지만 이 방법의 몇 가지 제한 사항을 고려해야 합니다. 절차의 특성으로 인해 일반적으로 전체 프로세스가 완료될 때까지 스트렙타비딘 격자의 품질을 평가할 수 없습니다. 샘플을 동결하기 전에 음성 염색으로 각 배치의 품질을 신속하게 스크리닝하는 것이 좋습니다. streptavidin 격자가 원시 이미지에 기여하는 신호로 인해 경우에 따라 이미지만으로는 온전하고 분산된 입자의 수가 충분한지 여부를 평가하기 어려울 수 있습니다. 같은 이유로, streptavidin 신호 빼기 절차가 데이터 전처리 파이프라인에 포함되지 않는 한 데이터 수집 중 Cryo-EM 데이터의 즉석 처리는 불가능합니다. streptavidin 신호는 일반적으로 프레임 자체가 아니라 모션 보정된 영상에서 차감되기 때문에, 널리 사용되는 소프트웨어 제품군에서 구현된 베이지안 마무리는 설명된 대로 뺄셈 절차를 사용할 때 실패할 수 있습니다. 따라서 데이터 처리의 시작부터 입자 이동을 최소화하기 위해 여러 패치에서 모션 보정을 수행하는 것이 권장된다16.
이러한 한계에도 불구하고 streptavidin 친화도 그리드는 많은 이점을 제공합니다. streptavidin 친화성 그리드가 표준 개방형 Cryo-EM 그리드에 비해 제공하는 두 가지 주요 이점은 공기-물 계면에서 시료를 보호하고 그리드에 저농도(10-100nM)의 시료를 농축하는 수단입니다. 탄소 및 산화 그래핀과 같은 다른 지지층도 이러한 시료 전처리 병목 현상을 극복하기 위한 전략으로 사용할 수 있습니다. 한 예로, 스트렙타비딘 친화도 그리드는 가교 접근법과 양립할 수 없는 단백질-핵산 상호작용의 온전한 재구성을 얻기 위한 유일한 솔루션이었습니다. 12의
스트렙타비딘 친화성 그리드가 제공하는 또 다른 주요 이점은 탄소 또는 산화그래핀과 같은 다른 지지층에 흡착되는 시료에 대한 솔루션으로, 관심 시료의 3D 재구성을 얻는 능력을 방해하는 선호 방향입니다. 시중에서 판매되는 키트를 사용하여 시료의 무작위 비오틴화를 통해 관심 시료를 스트렙타비딘 단층에 무작위로 부착하여 이 문제를 극복할 수 있는 더 많은 잠재적 관점을 얻을 수 있습니다.
또한 streptavidin 친화도 그리드는 친화도 기반 그리드에 고유한 이점을 제공합니다. 스트렙타비딘-비오틴 상호작용의 높은 친화력과 특이성은 스트렙타비딘 친화성 그리드를 비오틴과 관련된 다른 워크플로우와 결합하여 관심 복합체를 정제할 수 있도록 합니다. 발표된 한 예에서 저자는 스트렙타비딘 친화성 그리드에 복합체를 고정하고 알려지지 않은 화학량론의 결합 파트너를 과도하게 배양했습니다. 결합되지 않은 단백질을 씻어낸 후 올바르게 조립된 슈퍼 복합체를 얻었고 Cryo-EM11로 즉시 분석할 수 있었습니다. 한 가지 가능한 미래 응용 분야는 스트렙타비딘 결합 단백질 태그, Avi 태그 시스템 또는 근접 라벨링 접근법을 스트렙타비딘 친화성 그리드와 결합하여 표준 정교한 정제 계획 없이 재조합 또는 내인성 소스에서 직접 단일 단백질 및/또는 단백질 복합체를 추출하는 것입니다.
이 프로토콜을 제공함으로써 실험실은 스트렙타비딘 친화성 그리드의 제조를 쉽게 재현할 수 있어야 하며, Cryo-EM에 의한 단백질 복합체의 구조 분석에 더 일반적으로 사용되는 도구로 확립할 수 있어야 합니다.
공개
없음.
감사의 말
TC는 National Institute of General Medical Sciences 분자 생물 물리학 교육 보조금 GM-08295 및 보조금 번호 DGE 2146752에 따라 National Science Foundation 대학원 연구 펠로우십의 지원을 받았습니다. R.G.와 B.H.는 R.G.와 B.H.에게 수여된 미국 국립보건원(National Institute of Health)의 보조금 R21-GM135666의 지원을 받았습니다. 이 연구는 E.N.에게 수여된 R35-GM127018 보조금 R35-를 통해 부분적으로 자금을 지원받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3- phosphoethanolamine-N-(biotinyl) sodium salt | Avanti Polar Lipids | 870285P | Comes as a powder. Dissolve at concentration of 1–10 mg/mL in chloroform/methanol/water solvent, 65:35:8 v/v and store in single use aliquots at -80 °C |
| 200 proof pure ethanol | Fisher Scientific | 07-678-005 | |
| 5 μL Hamilton Syringe | Hamilton | 87930 | 5 µL Microliter Syringe Model 75 RN, Small Removable Needle, 26 G, 2 in, point style 2 |
| Castor Oil | Sigma Adrich | 259853 | |
| Cell culture dishes untreated (35 mm) | Bio Basic | SP22146 | |
| Chloroform | Sigma Aldrich | 650471 | |
| D-(+)-Trehalose dihydrate,from starch, ≥99% | Sigma Aldrich | T9449 | |
| DUMONT Anti-Capillary Reverse (self-closing) Tweezers Biology Grade | Ted Pella | 510-5NM | |
| HPLC Grade Methanol | Fisher Scientific | A452-4 | |
| Leica EM ACE600 High Vacuum Sputter Coater | Leica | ||
| Leica EM GP2 Automatic Plunge Freezer | Leica | ||
| Quantifoil R 2/1 Au300 | Quantifoil | Q84994 | |
| Steptavidin | New England Bioscience | N7021S | Comes as 1 mg/mL solution. Dilute to final concentration of 0.5 mg /mL in crystallization bufferwith a final trehalose concentration of 10%. Can be flash frozen in 25–50 μL aliquots |
| Talcum powder | Carolina | 896060 | |
| Whatman Grade 1 filter paper | Cytiva | 1001-085 |
참고문헌
- Glaeser, R. M., Nogales, E., Chiu, W. Single-particle Cryo-EM of Biological Macromolecules. IOP Publishing. , IOP Publishing. Bristol, UK. (2021).
- Carragher, B., et al. Current outcomes when optimizing 'standard' sample preparation for single-particle cryo-EM. Journal of Microscopy. 276 (1), 39-45 (2019).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta Crystallographica Section D-Structural Biology. 74, 560-571 (2018).
- Noble, A. J., et al. Routine single particle cryoEM sample and grid characterization by tomography. eLife. 7, e34257(2018).
- Patel, A., Toso, D., Litvak, A., Nogales, E. Efficient graphene oxide coating improves cryo-EM sample preparation and data collection from tilted grids. bioRxiv. , (2021).
- Wang, F., et al. General and robust covalently linked graphene oxide affinity grids for high-resolution cryo-EM. Proceedings of the National Academy of Sciences. 117 (39), 24269-24273 (2020).
- Pantelic, R. S., Meyer, J. C., Kaiser, U., Baumeister, W., Plitzko, J. M. Graphene oxide: A substrate for optimizing preparations of frozen-hydrated samples. Journal of Structural Biology. 170 (1), 152-156 (2010).
- Williams, R. C., Glaeser, R. M. Ultrathin carbon support films for electron microscopy. Science. 175 (4025), 1000-1001 (1972).
- Han, B. -G., et al. Long shelf-life streptavidin support-films suitable for electron microscopy of biological macromolecules. Journal of Structural Biology. 195 (2), 238-244 (2016).
- Han, B. -G., et al. Electron microscopy of biotinylated protein complexes bound to streptavidin monolayer crystals. Journal of Structural Biology. 180 (1), 249-253 (2012).
- Domínguez-Martín, M. A., et al. Structures of a phycobilisome in light-harvesting and photoprotected states. Nature. 609 (7928), 835-845 (2022).
- Kasinath, V., et al. JARID2 and AEBP2 regulate PRC2 in the presence of H2AK119ub1 and other histone modifications. Science. 371 (6527), eabc3393(2021).
- Lahiri, I., et al. 3.1 structure of yeast RNA polymerase II elongation complex stalled at a cyclobutane pyrimidine dimer lesion solved using streptavidin affinity grids. Journal of Structural Biology. 207 (3), 270-278 (2019).
- Marr, C. R., Benlekbir, S., Rubinstein, J. L. Fabrication of carbon films with ~ 500nm holes for cryo-EM with a direct detector device. Journal of Structural Biology. 185 (1), 42-47 (2014).
- Levine, M. J., Schwarz, J. A. Experimental guidelines for producing molecular assemblies by Langmuir-Blodgett techniques. Journal of Chemical Education. 65 (7), 638(1988).
- Zheng, S. Q., et al. MotionCor2: anisotropic correction of beam-induced motion for improved cryo-electron microscopy. Nature Methods. 14 (4), 331-332 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유