Method Article
Fabrication de grilles d’affinité de streptavidine pour la préparation d’échantillons de cryo-microscopie électronique
Dans cet article
Résumé
Un protocole étape par étape pour la fabrication de grilles d’affinité de la streptavidine est fourni pour une utilisation dans les études structurales d’échantillons macromoléculaires difficiles par cryo-microscopie électronique.
Résumé
Les grilles d’affinité de la streptavidine fournissent des stratégies pour surmonter de nombreux défis courants en matière de préparation des échantillons par cryo-microscopie électronique (cryo-EM), y compris la dénaturation des échantillons et les orientations préférentielles qui peuvent se produire en raison de l’interface air-eau. Les grilles d’affinité de la streptavidine, cependant, sont actuellement utilisées par quelques laboratoires de cryo-EM car elles ne sont pas disponibles dans le commerce et nécessitent un processus de fabrication minutieux. Des cristaux de streptavidine bidimensionnels sont cultivés sur une monocouche lipidique biotinylée qui est appliquée directement sur des grilles cryo-EM à trous de carbone standard. L’interaction de haute affinité entre la streptavidine et la biotine permet la liaison ultérieure d’échantillons biotinylés qui sont protégés de l’interface air-eau pendant la préparation cryo-EM des échantillons. De plus, ces grilles fournissent une stratégie pour concentrer les échantillons disponibles en quantités limitées et purifier les complexes protéiques d’intérêt directement sur les grilles. Ici, un protocole optimisé étape par étape est fourni pour la fabrication robuste de grilles d’affinité streptavidine à utiliser dans les expériences de cryo-EM et de coloration négative. De plus, un guide de dépannage est inclus pour les défis couramment rencontrés afin de rendre l’utilisation des grilles d’affinité de la streptavidine plus accessible à la communauté cryo-EM au sens large.
Introduction
La cryomicroscopie électronique (cryo-EM) a révolutionné le domaine de la biologie structurale en permettant la détermination de la structure macromoléculaire d’échantillons volumineux, flexibles et hétérogènes qui étaient auparavant inaccessibles par cristallographie aux rayons X ou par résonance magnétique nucléaire1. Cette méthode consiste à congeler rapidement des macromolécules en solution pour créer une fine couche de glace vitreuse qui peut ensuite être imagée à l’aide d’un microscope électronique. Ces dernières années, des progrès significatifs dans le matériel de microscope et les logiciels de traitement d’images ont encore élargi les types d’échantillons adaptés à la détermination de la structure à haute résolution par cryo-EM.
Néanmoins, la préparation d’échantillons minces et vitrifiés reste l’une des étapes les plus critiques de la détermination de la structure macromoléculaire par cryo-EM. Les échantillons biologiques sont souvent dynamiques, fragiles, sujets à la dénaturation, et ne sont parfois disponibles qu’en petites quantités pour les études cryo-EM. Au cours du processus de transfert, ces particules interagissent avec l’interface air-eau hydrophobe, ce qui peut entraîner des orientations préférées des particules, le désassemblage de complexes fragiles, la dénaturation partielle ou complète de l’échantillon et l’agrégation 2,3,4. L’utilisation de détergents ou d’autres tensioactifs, la réticulation chimique et l’adsorption d’échantillons sur les couches de support sont des stratégies courantes pour préserver les échantillons biologiques pendant le processus de congélation. Les couches de support telles que l’oxyde de graphène 5,6,7 ou le carbone8 amorphe ont également pour fonction de concentrer les particules sur la grille par adsorption lorsque l’échantillon est disponible en quantités limitées. Cependant, ces méthodes ne sont ni générales ni fiables, et l’optimisation de la préparation du réseau peut prendre beaucoup de temps ou échouer complètement.
Les grilles d’affinité de la streptavidine 9,10 ont été développées pour surmonter ces lacunes et fournir une méthode douce et généralement applicable pour séquestrer le complexe d’intérêt et le protéger de l’interface air-eau. Ces grilles utilisent un réseau cristallin de streptavidine bidimensionnel (2D) cultivé sur une monocouche de lipides biotinylés sur la grille. Une fois que les échantillons sont eux-mêmes biotinylés (souvent de manière clairsemée et aléatoire, c’est-à-dire une biotine par complexe en moyenne), ils peuvent être appliqués sur la grille recouverte de streptavidine. Comme l’adsorption de l’échantillon repose sur l’affinité extrêmement élevée entre la streptavidine et la biotine, des concentrations d’échantillon aussi faibles que 10 nM peuvent être utilisées avec ces grilles. Les trousses de biotinylation disponibles dans le commerce pour les protéines et les amorces biotinylées pour les complexes contenant de l’ADN permettent de fixer relativement facilement les fractions de biotine nécessaires à la plupart des échantillons d’intérêt. En plus de concentrer l’échantillon et de le tenir à l’écart de l’interface air-eau dommageable pendant le transfert, la biotinylation aléatoire d’un ou de quelques résidus de lysine peut améliorer considérablement la gamme d’orientations de la molécule d’intérêt sur la grille cryo-EM, comme l’ont démontré un certain nombre d’études11. Alors que le signal du cristal de streptavidine sous-jacent est présent dans les images brutes, les schémas de traitement des données impliquant la filtration de Fourier des réflexions de Bragg nettes du cristal peuvent être facilement supprimés lors du traitement précoce des données, permettant finalement des reconstructions à haute résolution de l’échantillon d’intérêt 11,12,13 . Ici, un protocole optimisé, étape par étape, est fourni pour la production robuste de grilles d’affinité de streptavidine et son utilisation ultérieure dans des expériences de cryo-EM. Le protocole fourni devrait être complété sur une période de 2 semaines (figure 1A). Les premières parties du protocole décrivent la préparation des réactifs, le prétraitement des grilles et les premières étapes d’évaporation du carbone. Ensuite, des instructions sont décrites pour la préparation de la monocouche lipidique et la croissance des cristaux de streptavidine sur les grilles EM. De plus, des instructions sont fournies pour l’utilisation des grilles d’affinité de la streptavidine dans les expériences EM et cryo-EM de coloration négative. Enfin, des procédures sont fournies pour éliminer le signal de la streptavidine des micrographies une fois les données cryo-EM acquises.
Protocole
1. Préparation des réactifs
- Diluer la streptavidine achetée dans le commerce jusqu’à une concentration finale de 0,5 mg/mL dans un tampon de cristallisation (50 mM HEPES pH 7,5, 150 mM KCl, 5 mM EDTA, 10 % de tréhalose). Assurez-vous que la concentration finale de tréhalose est de 10 %. Congeler des aliquotes de 25 à 50 μL dans de l’azote liquide et les conserver à -80 °C.
- Dissoudre le sel de sodium de 1,2-dipalmitoyl-sn-glycéro-3-phosphoéthanolamine-N-(biotinyle) dans un solvant de chloroforme/méthanol/eau 65 :35 :8 v/v/v pour une concentration lipidique finale de 1 mg/mL. Conserver les aliquotes à usage unique de 20 à 30 μL à -80 °C dans des flacons en verre.
REMARQUE : La préparation du solvant est plus précise si elle est effectuée en poids. Tout d’abord, combinez 1,85 g d’eau ultrapure avec 6,41 g de méthanol de qualité chromatographie liquide à haute performance (HPLC) et ajoutez le tout à 22,42 g de chloroforme pour préparer le solvant.
ATTENTION : Veuillez lire et comprendre les fiches de données de sécurité des fabricants et les instructions recommandées pour la manipulation et l’élimination des solvants organiques de chloroforme et de méthanol avant de commencer ce protocole. Évitez le contact direct du méthanol avec la peau.
2. Prétraitement des grilles
- Lavez le papier d’aluminium sur des grilles en maille d’or en plongeant deux fois dans du chloroforme à 100 % et une fois dans de l’éthanol à 100 %. Placez les grilles sur du papier filtre propre pour sécher. Répétez le processus de lavage pour un total de trois cycles.
REMARQUE : Un succès reproductible a été obtenu avec des grilles de feuille de carbone disponibles dans le commerce qui ont un film de carbone de 10 à 12 nm d’épaisseur (voir la liste des matériaux) avec des tailles de trous allant de 0,6 à 2 μm. Des grilles de feuille d’or disponibles dans le commerce et des grilles de carbone trouées faites maison préparées selon le protocole de nanofabrication14 du laboratoire Rubinstein ont également été utilisées avec succès. Des résultats moins reproductibles ont été obtenus avec des grilles disponibles dans le commerce qui ont des films de carbone plus fins. N’utilisez pas de grilles en cuivre, car le cuivre réagit avec les amines organiques qui peuvent se trouver dans l’échantillon. - Une fois les grilles sèches, évaporez une couche de carbone de 2,5 à 5 nm d’épaisseur sur le côté carbone des grilles de carbone trouées. L’épaisseur du carbone est contrôlée par la mesure de l’épaisseur du film de cristal de quartz qui est intégrée à l’évaporateur de carbone fourni dans le fichier de la table des matériaux .
- Laissez le carbone nouvellement évaporé vieillir (c’est-à-dire devenir plus hydrophobe) pendant 1 semaine.
3. Préparation du réseau de streptavidine
REMARQUE : Pour faire croître des cristaux de streptavidine 2D sur les grilles EM de carbone trouées, une monocouche lipidique biotinylée est d’abord appliquée sur les trous du film de carbone (Figure 1B) par transfert de Langmuir-Schaefer. La monocouche lipidique se forme à la suite des étapes suivantes (Figure 2). Le talc crée une frontière entre l’huile de ricin et la boîte de Pétri, et une fine couche d’huile de ricin aide à maintenir une pression de surface constante lorsque la monocouche lipidique est formée. Le côté contenant le carbone évaporé de l’étape 2.2 est utilisé pour ramasser la monocouche, les lipides en excès sont éliminés avec un tampon de cristallisation et la solution de streptavidine est incubée sur la grille pour la cristallisation.
- Nettoyez la paillasse avec de l’éthanol à 70 %.
- Rincer plusieurs fois une seringue en verre de 5 μL avec du chloroforme pour nettoyer. Laissez la seringue sécher complètement avant utilisation.
- Lavez à nouveau les grilles évaporées de carbone, c’est-à-dire juste avant utilisation, en les trempant dans de l’éthanol à 100 %. Laissez sécher les grilles sur du papier filtre propre.
- Pendant que les grilles sèchent, lavez chaque pince anticapillaire avec 100 % de chloroforme et 100 % d’éthanol. Laissez la pince à épiler sécher complètement.
- Du côté propre du parafilm, préparez trois gouttes de 50 μL de tampon de cristallisation (50 mM HEPES pH 7,5, 150 mM KCl, 5 mM EDTA, 10 % de tréhalose) pour chaque grille qui sera fabriquée.
- Remplissez le couvercle d’une boîte de Pétri non revêtue de 35 mm avec un tampon de cristallisation (50 mM HEPES pH 7,5, 150 mM KCl, 5 mM EDTA, 10 % de tréhalose). Nettoyez la surface avec du papier pour lentilles.
- Saupoudrez de talc de qualité scientifique sur le pourtour de la boîte de Pétri. Cela sert ensuite d’indicateur, à l’étape suivante, de l’étendue de la propagation de l’huile de ricin. Ajoutez suffisamment de talc pour créer une barrière qui empêche l’huile de ricin de toucher le bord de la boîte de Pétri. L’ajout d’une trop grande quantité de talc limite l’espace disponible pour fabriquer la monocouche lipidique.
- Tremper une pointe de pipette de 200 μL dans l’huile de ricin pour obtenir une goutte de taille moyenne (environ 20 μL) qui pend de la pointe de la pipette. Touchez cette goutte à la surface du tampon dans la boîte de Pétri, où elle s’étalera pour former un film uniforme. La fine pellicule d’huile qui en résulte sert de piston15, qui maintient une pression de surface constante lorsqu’une monocouche lipidique est formée (étape 3.10).
REMARQUE : Il est important d’ajouter suffisamment d’huile de ricin plutôt que trop peu, et il est préférable d’ajouter une seule goutte. Laissez l’huile de ricin se répandre complètement avant de fabriquer la monocouche lipidique. - Rincer la seringue en verre de 5 μL une ou deux fois avec le lipide dissous avant de prélever une aliquote pour l’utiliser. Évitez de créer des bulles d’air dans le lipide qui remplit la seringue.
REMARQUE : La seringue en verre est rincée avec des lipides dissous au cas où il resterait du chloroforme résiduel de l’étape 3.2. Le chloroforme résiduel peut affecter la qualité de la monocouche résultante. - Distribuer le plus petit volume possible (~0,5 μL) de lipides de la seringue et toucher doucement la gouttelette suspendue à la surface du film d’huile de ricin. Notez que la solution lipidique traverse le film d’huile de ricin au point de contact et que la monocouche lipidique résultante forme un cercle au centre de la fine pellicule d’huile de ricin.
- Ajoutez plusieurs gouttes de lipides séquentiellement ou ajoutez plus de lipides après avoir fait quelques grilles, mais si trop est ajouté, le lipide se répandra au-delà de la limite de l’huile de ricin et dans le périmètre où la poudre de talc et tout tensioactif contaminant ont été séquestrés. Si cela se produit, le processus devra être redémarré.
- Prenez une grille avec une pince anti-capillaire de sorte que le bras droit de la pince à épiler et le côté évaporé de carbone de la grille fassent tous deux face à la monocouche.
- Transférez une partie de la monocouche sur le carbone troué en touchant le côté évaporé du carbone de la grille à la monocouche pendant 1 à 2 s.
REMARQUE : Le transfert réussi est indiqué par la surface de la grille qui devient hydrophile, ce qui fait qu’un mince capuchon sphérique de tampon recouvre toute la grille après qu’elle a été retirée de la boîte de Pétri. - Touchez le capuchon sphérique du tampon qui adhère maintenant à la grille, séquentiellement pendant 1 s chacune, aux trois gouttes de 50 μL de tampon de cristallisation qui ont été préparées sur le parafilm à l’étape 3.5.
REMARQUE : Cette étape tente d’éliminer autant que possible l’excès de lipide, qui recouvre la surface de la coiffe sphérique (plutôt que le film de carbone auparavant hydrophobe), afin d’éviter la formation de vésicules lipidiques lorsque les échantillons sont observés au microscope électronique. - Ajouter délicatement 4 μL de streptavidine à 0,5 mg/mL dans le capuchon sphérique restant du tampon de cristallisation sur la grille.
- Placez la grille dans une chambre d’humidité. Répétez les étapes 3.11 à 3.14 pour l’ensemble du lot de grilles.
- Incuber les grilles à température ambiante (RT) pendant 2 h à l’intérieur d’une chambre d’humidité pour éviter l’évaporation.
REMARQUE : Il est important que le côté doré de la grille ne soit mouillé à aucun moment après l’application de la monocouche. - Après l’incubation de 2 h, préparer une goutte de 300 μL de tampon de rinçage (10 mM HEPES, pH 7,5, 50 mM KCl, 5 mM EDTA, 10 % de tréhalose) pour chaque grille du côté propre du parafilm.
REMARQUE : Le tampon de rinçage contient 50 mM de KCl au lieu de 150 mM de KCl, qui se trouve dans le tampon de cristallisation utilisé pour les étapes 3.5-3.6. - Lavez l’excès de streptavidine (non liée) en plaçant la grille sur la goutte de 300 μL de tampon de rinçage. Effectuez les étapes 3.18 à 3.20 pour une grille à la fois. Évitez de laisser les grilles sur la goutte de tampon de rinçage de 300 μL pendant de longues périodes.
REMARQUE : Un seul lavage est effectué car le cristal/monocouche de streptavidine est fragile à ce stade. Chaque fois qu’une grille est soulevée de la surface d’une goutte de tampon de lavage, le pont liquide entre la grille et la goutte de lavage est rompu. Au moment de la rupture, un gradient de pression transitoire (pression d’aspiration) est appliqué aux cristaux monocouches autoportants qui couvrent les trous ouverts du film de carbone. Cette pression d’aspiration devrait provoquer un doming transitoire du cristal monocouche, accompagné d’une expansion de la zone couverte par les cristaux. Si l’augmentation de la surface dépasse la limite élastique du cristal, le cristal peut se fracturer ou se désordonner. - Séchez immédiatement la pince anti-capillaire avec une lingette non pelucheuse pour faciliter le démoulage de la grille sur le papier filtre à l’étape suivante. Ramassez la grille flottant sur la goutte de tampon de rinçage en enfonçant le bras plié de la pince anti-capillaire dans la goutte.
- Épongez doucement l’excédent de tampon sur le côté avec du papier filtre. Placez la grille sur du papier filtre avec le côté doré vers le bas, répétez les étapes 3.18-3.20 pour chaque grille et laissez sécher les grilles pendant 15-20 min.
- Une fois les grilles sèches, retournez-les de manière à ce que le côté doré soit maintenant orienté vers le haut. Évaporer une fine couche de carbone (environ 0,5 à 2 nm d’épaisseur) sur le côté doré des grilles.
REMARQUE : Stockez les grilles à une humidité constante, dont la valeur ne semble pas avoir d’importance, en notant que de multiples changements d’humidité relative devraient entraîner des cycles d’expansion et de contraction. Laissez les grilles vieillir pendant 1 semaine avant de les utiliser par cryo-EM pour de meilleurs résultats, car l’hydrophobicité de la face arrière de la grille peut être importante pour la stabilité de la monocouche. Les grilles sont stables pendant de longues périodes, mais après 3 mois, le carbone arrière peut devenir moins hydrophobe.
4. Vérification de la qualité des lots de la grille d’affinité de la streptavidine par coloration négative
- Préparer deux gouttes de 50 μL et une goutte de 100 μL de tampon d’échantillon (50 mM HEPES pH 7,5, 50 mM KCl, 0,5 mM de PTCE) sur le côté propre du parafilm.
- Retirez le tréhalose et réhydratez les grilles de streptavidine en touchant les deux gouttes de 50 μL et laissez la grille flotter sur la goutte de 100 μL de tampon d’échantillon pendant 10 min.
REMARQUE : Il est préférable d’éviter d’utiliser du détergent pendant la réhydratation et les incubations ultérieures de liaison de l’échantillon. Le tampon se dispersera sur le côté doré des grilles et limitera l’efficacité des lavages pour éliminer les échantillons excédentaires. - Après la réhydratation, ramassez la grille avec une pince anti-capillaire de manière à ce que le bras plié de la pince anti-capillaire soit dans la goutte.
- Épongez doucement l’excès de tampon sur le côté et réappliquez rapidement 4 μL d’échantillon de 75 à 100 nM (facultatif).
REMARQUE : Évitez de laisser sécher la grille après la réhydratation. - Incuber l’échantillon dans une chambre humide pendant 1 à 5 minutes.
REMARQUE : La concentration et les temps d’incubation dépendront de l’échantillon et devraient être optimisés. La concentration de l’échantillon et le temps d’incubation fournis sont des points de départ suggérés. - Sur le côté propre du parafilm, mettre en place quatre gouttes de 30 μL chacune de tampon d’échantillon et de colorant de formiate d’uranyle (UF) à 1 %.
REMARQUE : Veuillez lire et comprendre les fiches de données de sécurité des fabricants et les instructions recommandées pour la manipulation et l’élimination du formiate d’uranyle avant d’effectuer cette étape. Le formiate d’uranyle est un composé toxique et radioactif. Assurez-vous d’obtenir au préalable l’approbation institutionnelle pour l’utilisation de matières radioactives. - Lavez l’échantillon non lié en touchant chacune des quatre gouttes de tampon d’échantillon.
- Colorer l’échantillon en utilisant les procédures standard de coloration négative avec UF. Épongez doucement la tache UF sur le côté, en laissant une couche très épaisse de tache sur la grille. Une couche supplémentaire de 0,5 μL de teinture peut être appliquée sur la grille après le tamponnage pour rendre la teinture plus épaisse si nécessaire. Laissez la grille sécher à l’air libre.
REMARQUE : Comme les grilles de streptavidine sont très hydrophiles, la coloration négative a tendance à former un film très uniforme partout, contrairement à ce que l’on voit couramment lors de l’utilisation de grilles de carbone continues traitées par décharge luminescente. Par conséquent, il est recommandé de laisser un film plus épais de solution de teinture.
5. Congélation des grilles d’affinité de la streptavidine avec des échantillons biotinylés
REMARQUE : La procédure suivante est destinée à un piston automatisé unilatéral qui contient un capteur de transfert interne (un transfert manuel unilatéral dans d’autres appareils de plongée automatisés est également possible)
- Préparer deux gouttes de 50 μL et une goutte de 100 μL de tampon d’échantillon (p. ex., 50 mM HEPES pH 7,5, 50 mM KCl, 0,5 mM de PTCE) sur le côté propre du parafilm.
- Réhydrater les grilles de streptavidine en touchant les deux gouttes de 50 μL et laisser la grille flotter sur la goutte de 100 μL de tampon d’échantillon pendant 10 min.
- Après la réhydratation, ramassez la grille avec une pince anti-capillaire de manière à ce que le bras plié de la pince anti-capillaire soit dans la goutte.
- Épongez doucement l’excès de tampon sur le côté et appliquez rapidement 4 μL d’échantillon de 75 à 100 nM.
- Incuber l’échantillon dans une chambre humide pendant 1 à 5 min.
REMARQUE : Encore une fois, la concentration et les temps d’incubation dépendront de l’échantillon et devraient être optimisés. La concentration de l’échantillon et le temps d’incubation fournis sont des points de départ suggérés. Pour les échantillons à faible concentration, on peut incuber pendant de plus longues périodes et/ou lier l’échantillon aux grilles plusieurs fois. - Préparer deux gouttes de 10 μL de tampon de congélation (p. ex., 50 mM HEPES pH 7,5, 50 mM de KCl, 0,5 mM de PTCE, 3 % de tréhalose, 0,01 % de NP40) sur le côté propre du parafilm. Après l’incubation, laver l’échantillon non lié en touchant la grille à la première goutte du tampon de congélation. Déposez la grille sur la deuxième goutte du tampon de congélation.
- Saisissez rapidement le bord de la grille avec la pince à épiler fixée au piston automatisé unilatéral. Épongez doucement l’excès de tampon et appliquez rapidement 4 μL de tampon de congélation (50 mM HEPES pH 7,5, 50 mM KCl, 0,5 mM TCEP, 3 % de tréhalose, 0,01 % NP40) sur la grille.
- Fixez la pince à épiler au piston automatisé unilatéral. Les meilleurs résultats ont été obtenus à l’aide d’un capteur de transfert qui détecte la goutte de liquide sur la grille avec des temps de transfert compris entre 4 et 6 s. Les conditions varient en fonction de l’échantillon et du tampon utilisés.
6. Traitement des données des films cryo-EM collectés à partir de grilles d’affinité de streptavidine
La collecte de données sur les grilles d’affinité de la streptavidine peut être effectuée comme avec les grilles standard, et aucun réglage spécial du microscope n’est nécessaire. Cependant, la procédure détaillée ici ne supprime le signal de la streptavidine qu’après correction de mouvement de la micrographie. Par conséquent, les étapes de traitement des données telles que le polissage des particules qui reposent sur des images de film originales ne peuvent pas être effectuées de manière fiable. La soustraction du signal de streptavidine (requise pour tous les traitements en aval standard à l’exception de l’estimation CTF) nécessite ici la version R2014b ou ultérieure de Matlab fonctionnant sur un environnement Linux. La soustraction du signal repose sur la nature cristalline de la couche de streptavidine, ce qui permet le masquage du pic et, par conséquent, la suppression du signal de la transformée de Fourier de chaque micrographie.
- Configuration des scripts de traitement
- Copiez tous les fichiers des fichiers supplémentaires dans un dossier dédié dans le répertoire du projet
- Préparez un répertoire appelé processing_scripts qui comprend les fichiers suivants :
lsub.m (Fichier de codage supplémentaire 1 ; le script de soustraction)
process_subtration.sh (Fichier de codage supplémentaire 2 ; script d’encapsulation qui boucle sur toutes les micrographies disponibles, génère des tâches parallèles et garde une trace de l’entrée et de la sortie)
process_subtraction.cfg (Fichier de codage supplémentaire 3 ; fichier de configuration contenant les paramètres de la tâche de soustraction, voir 6.2) - Préparez un répertoire appelé support_scripts qui comprend les fichiers suivants :
bg_drill_hole.m (Fichier de codage supplémentaire 4)
bg_FastSubtract_standard.m (Fichier de codage supplémentaire 5)
bg_Pick_Amp_masked_standard.m (Fichier de codage supplémentaire 6)
bg_push_by_rot.m (Fichier de codage supplémentaire 7)
ReadMRC.m (Fichier de codage supplémentaire 8)
WriteMRC.m (Fichier de codage supplémentaire 9)
WriteMRCHeader.m (Fichier de codage supplémentaire 10)
- Ajustez le fichier de configuration selon vos besoins (process_subtraction.cfg (reportez-vous à la Figure 3) selon vos besoins :
- Entrée : chemin d’accès au répertoire contenant les micrographies corrigées en mouvement au format mrc. Utilisez un répertoire ou un modèle comprenant des caractères génériques ( ?, *).
Exemple:
input="/chemin/vers/project_directory/micrographes/ »
ou
input="/chemin/vers/project_directory/micrographes/*.mrc » - output_dir : Chemin vers le répertoire dans lequel les micrographies soustraites du réseau doivent être écrites.
- only_do_unfinished : Spécifiez (vrai|faux) si les micrographies soustraites préexistantes doivent être écrasées ou ignorées. Ce paramètre est utile pour démarrer le script de soustraction de réseau au milieu d’une session de microscope (par défaut : true).
- num_parallel_jobs : Spécifiez le nombre de tâches parallèles. Ce nombre dépend des spécifications matérielles utilisées pour le traitement et ne doit pas être supérieur au nombre de cœurs disponibles. Sur les systèmes à 32 cœurs et un système de fichiers réseau, des performances optimales ont été obtenues avec 14 tâches parallèles. Pour de meilleures performances, optimisez cette valeur avec un sous-ensemble de micrographies.
- Pad_Origin_X : 200 pour un détecteur K3 en orientation portrait (largeur d’image < hauteur d’image) ou en cas d’utilisation d’un détecteur carré (Falcon III, Falcon IV, K2), 1000 pour un détecteur K3 en orientation paysage (largeur d’image > hauteur d’image). La FFT est réalisée dans des boîtes carrées et un rembourrage est nécessaire si le détecteur a des dimensions non carrées.
- Pad_Origin_Y : 1000 pour un détecteur K3 en orientation portrait (largeur < hauteur de l’image), 200 en cas d’utilisation d’un détecteur carré (Falcon III, Falcon IV, K2) ou en cas d’utilisation d’un détecteur K3 en orientation paysage (largeur > hauteur de l’image).
- Ne modifiez pas les Inside_Radius_Ang (90) et Outside_Radius_Ang (3.0). La soustraction du réseau est effectuée entre deux résolutions (l’unité est en angström).
- Pixel_Ang : Indiquez la taille en pixels sous forme de valeur à virgule flottante.
- Seuil : valeur de coupure du seuil de soustraction pour remplacer le réseau par l’arrière-plan dans l’espace de Fourier. Les valeurs utilisées avec succès sont comprises entre 1,4 et 1,6. Utilisez 1.42 comme point de départ.
- Ne modifiez pas expand_pixel (10) et pad_out_opt (0). expand_pixel est une valeur de diamètre utilisée pour masquer autour des pixels dont les valeurs sont supérieures au seuil de coupure. pad_out_opt est une option qui détermine si une zone rembourrée est incluse dans la sortie.
- addpath_m : Chemin d’accès aux scripts de support.
- path_to_matlab_bin : Chemin d’accès au répertoire bin d’installation Matlab du système.
- path_matlab_script : Chemin d’accès au script de soustraction matlab (lsub.m ) qui a été copié ci-dessus à l’étape 6.1.2.
- Entrée : chemin d’accès au répertoire contenant les micrographies corrigées en mouvement au format mrc. Utilisez un répertoire ou un modèle comprenant des caractères génériques ( ?, *).
- Après avoir enregistré le script modifié, exécutez le script (bash ./process_subtraction.sh ) pour soustraire le signal de streptavidine des micrographies d’entrée. Le script peut être interrompu et/ou redémarré si le paramètre only_do_unfinished est défini sur true (voir à l’étape 6.2.3). Si une erreur se produit, vérifiez les paramètres spécifiés dans le script bash. Assurez-vous qu’il n’y a pas d’espaces involontaires entre les variables de paramètre et les valeurs qui leur sont attribuées, car il s’agit d’une source courante d’erreurs.
- Utilisez les images soustraites du réseau pour le traitement d’images cryo-EM standard.
Résultats
Après l’évaporation du carbone à l’étape 3.21 (généralement après une semaine), les grilles d’affinité de la streptavidine peuvent être utilisées pour la cryo-EM ou la préparation d’échantillons de coloration négative en suivant les procédures décrites aux étapes 4 et 5. Une micrographie représentative capturée à l’aide d’un détecteur K3 sur un titan Krios à un grossissement de 81 000X avec une taille de pixel de 1,05 Å d’un échantillon biotinylé congelé avec des grilles d’affinité de streptavidine est présentée à la figure 4A. La formation réussie du réseau est observée par le motif de grille continu qui apparaît en arrière-plan de l’image. Cela peut être plus facilement observé par le modèle de diffraction qui apparaît dans la transformée de Fourier rapide (FFT) illustrée à la figure 4A (à droite). Après la collecte des données, en suivant la procédure décrite à l’étape 6 de ce protocole, le signal qui est fourni à l’image par le réseau de streptavidine peut être masqué par calcul pour produire une micrographie soustraite (Figure 4B) qui peut être utilisée pour les étapes ultérieures de traitement des données. La FFT de la figure 4B (à droite) montre que le diagramme de diffraction observé dans la figure 4A (à droite) a été supprimé avec succès de l’image originale.
La figure 4C montre un exemple de micrographie prise sur un microscope Tecnai 12 à un grossissement de 49 000x avec une taille de pixel de 1,6 Å d’un échantillon biotinylé lié à des grilles d’affinité de streptavidine et coloré négativement à l’aide de formiate d’uranyle. Les grilles ont été préparées en suivant la procédure décrite à l’étape 4 de ce protocole, laissant une pellicule de teinture plus épaisse.
Il existe plusieurs observations courantes lorsque la procédure de fabrication de la grille de streptavidine échoue et sont décrites plus en détail dans la section de discussion et le tableau 1. Graphique 5 montre plusieurs exemples de ces observations. La figure 5A montre une micrographie d’une grille d’affinité de streptavidine colorée négativement utilisée à partir d’un lot fabriqué à partir de six mois. La monocouche s’est mobilisée à partir des trous dans la feuille de carbone des grilles quantitatives et est observée avec des dimensions similaires aux trous de la grille. La figure 5B montre un exemple de cristaux de streptavidine qui ont une mosaïque élevée et qui sont facilement perturbés pendant les procédures de préparation des échantillons. La figure 5C montre une micrographie représentative d’une grille d’affinité de la streptavidine dans laquelle l’évaporation du carbone à l’étape 3.21 est trop mince ou omise. Le réseau de streptavidine s’est fragmenté au cours du processus de préparation des échantillons cryo-EM. La figure 5D montre une grille d’affinité de streptavidine colorée négativement qui est contaminée par des vésicules lipidiques, probablement en raison de lavages insuffisants à l’étape 3.13 ou de l’humidité du côté doré de la grille aux étapes 3.13 à 3.20. Veuillez vous référer à la section de discussion et au tableau 1 pour les stratégies permettant de surmonter ces problèmes courants.
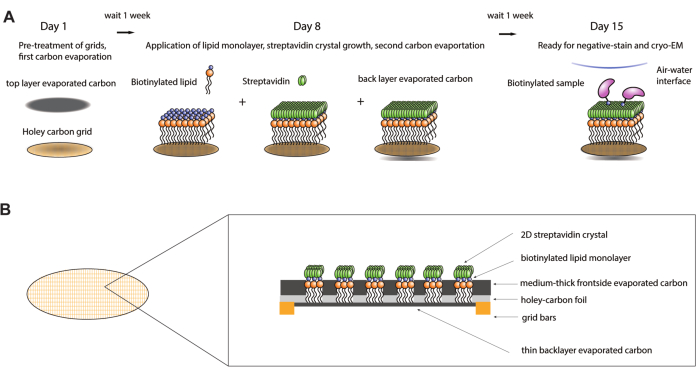
Figure 1 : Schéma de la procédure de fabrication de la grille d’affinité de la streptavidine. (A) Chronologie générale de la procédure de fabrication de la grille d’affinité de la streptavidine. L’ensemble de la procédure peut être effectué sur deux semaines, nécessitant deux étapes d’évaporation du carbone et une semaine après chacune pour permettre au carbone de vieillir suffisamment. (B) Zoom sur un carré d’une grille d’affinité streptavidine montrant les couches qui composent la grille après l’achèvement du processus de fabrication, y compris la grille cryo-EM standard avec des barres d’or et un film de carbone troué, la première couche de carbone évaporée, la monocouche lipidique, le cristal de streptavidine 2D et la couche de support de carbone évaporé à l’arrière. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Monocouche lipidique et cristallisation de la streptavidine (A) Images montrant comment former avec succès la monocouche lipidique dans la petite boîte de Pétri en utilisant du talc pour créer une limite pour l’huile de ricin qui crée une pression de surface constante tout en formant la monocouche lipidique. (B) Images montrant comment faire pousser des cristaux de streptavidine sur des grilles cryo-EM. Tout d’abord, le côté carbone des grilles est touché à la monocouche lipidique et suivi de trois lavages consécutifs dans le tampon de cristallisation. La streptavidine est ajoutée et les grilles sont incubées dans une chambre d’humidité pendant 2 h. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Exemples de paramètres pour le fichier process_subtraction.cfg permettant d’effectuer la soustraction du réseau de streptavidine à partir de micrographies (étape 6). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Résultats représentatifs de la fabrication réussie de grilles d’affinité de streptavidine. (A) Micrographie cryo-EM de complexes protéines/nucléosomes biotinylés préparés avec des grilles d’affinité de streptavidine maison. La FFT est illustrée à droite et montre le motif de diffraction des cristaux de streptavidine. (B) La même micrographie que dans le panneau A est montrée en suivant la procédure de soustraction du réseau pour supprimer le signal du cristal de streptavidine 2D de l’image originale. (C) Un exemple de micrographie obtenue à partir de la coloration négative d’un échantillon biotinylé lié à des grilles d’affinité streptavidine. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Résultats représentatifs de l’échec de la fabrication de grilles d’affinité pour la streptavidine. (A) Micrographie montrant la mobilisation de la monocouche de streptavidine à partir des trous de la grille lorsque les grilles ont plus de six mois. (B) Micrographie montrant des réseaux de streptavidine à forte mosaïcité qui sont facilement endommagés lors des procédures de cryo-EM et de préparation d’échantillons à coloration négative. (C) Micrographie montrant la fragmentation du réseau de streptavidine pendant la préparation de l’échantillon cryo-EM lorsque la couche d’évaporation du carbone à l’étape 3.21 est trop mince ou omise. (D) Micrographie représentative contaminée par des vésicules lipidiques, probablement en raison d’un lavage insuffisant à l’étape 3.13 ou de l’humidité du côté doré de la grille aux étapes 3.13 à 3.20. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Guide de dépannage pour surmonter les difficultés courantes rencontrées lors de la fabrication infructueuse de grilles d’affinité pour la streptavidine. Veuillez cliquer ici pour télécharger ce tableau.
Fichier de codage supplémentaire 1 : lsub.m Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 2 : process_subtration.sh Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 3 : process_subtraction.cfg Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 4 : bg_drill_hole.m Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 5 : bg_FastSubtract_standard.m Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 6 : bg_Pick_Amp_masked_standard.m Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 7 : bg_push_by_rot.m Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 8 : ReadMRC.m Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 9 : WriteMRC.m Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 10 : WriteMRCHeader.m Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Notre protocole décrit comment fabriquer et utiliser des grilles d’affinité de streptavidine et comment traiter les données contenant le signal de diffraction de la streptavidine. Plusieurs étapes critiques du protocole nécessitent une attention particulière.
Les lots de grille infructueux peuvent être attribués à plusieurs erreurs courantes. La source d’erreur la plus courante provient de l’utilisation de réactifs obsolètes ou de mauvaise qualité. Il est particulièrement important de préparer la solution lipidique biotinylée exactement comme décrit dans le protocole. De plus, toute impureté, telle que les résidus de détergent sur le matériel de laboratoire ou les huiles naturellement présentes sur la peau, peut affecter la qualité des cristaux de streptavidine et, par conséquent, la qualité des images résultantes. Il est donc recommandé d’effectuer trois cycles de lavage des grilles avant la première évaporation du carbone afin d’éliminer toute contamination éventuelle par le fabricant de la grille (étape 2.1). De plus, la contamination ou l’impureté de l’huile de ricin a été observée pour entraver la formation de cristaux sur la grille.
La fabrication et le ramassage de la monocouche lipidique est une tâche qui doit être pratiquée plusieurs fois pour avoir une idée des petits volumes lipidiques. Il n’est pas rare que cette étape échoue les deux ou trois premières fois avant qu’une monocouche lipidique adéquate puisse être produite, comme en témoigne la qualité des cristaux de streptavidine que l’on observe dans les grilles colorées négativement (Figure 4C).
Il est important de ne jamais laisser l’arrière (côté or, côté lipidique) de la grille se mouiller pendant le processus de fabrication de la grille (étapes 3.12-3.20). Dans le cas où l’arrière est mouillé, il est recommandé de jeter la grille. Cela peut entraîner l’apparition de grandes vésicules lipidiques qui perturbent la qualité de l’image (Figure 5D) (ligne 3, tableau 1). Des vésicules lipidiques peuvent également être observées en raison d’un lavage insuffisant après l’application de la monocouche lipidique (étape 3.13). Trois lavages ultérieurs à l’aide d’un tampon de cristallisation sont recommandés après avoir touché la monocouche lipidique avant d’ajouter de la streptavidine.
Après qu’une fine couche de carbone ait été évaporée sur des grilles intégrées au tréhalose, l’arrière de la grille peut être mouillé sans endommager la qualité du treillis. Par exemple, le mouillage de l’arrière est fréquemment observé lorsque le tampon d’échantillon contient des quantités même minimes de détergent. Le mouillage de la face arrière par l’échantillon peut entraîner une liaison non spécifique des échantillons à la fine pellicule de carbone à l’arrière, ce qui diminue l’efficacité de la prévention de la diffusion des particules à l’interface air-eau ou l’utilisation de la liaison d’affinité pour les stratégies de purification sur la grille. Si possible, ajoutez l’échantillon à la grille en l’absence de détergent. Le détergent et d’autres additifs peuvent être ajoutés ultérieurement lors des étapes de lavage de la grille ou ajoutés dans une dernière étape avant la vitrification. C’est l’une des limites à l’utilisation des grilles d’affinité de la streptavidine ; Cependant, si l’objectif est d’améliorer l’orientation préférentielle, la préparation des échantillons avec des tampons, y compris des détergents, a été effectuée avec succès11.
Une source d’erreur commune peut être attribuée à l’âge des grilles par rapport aux deux étapes d’évaporation du carbone (étape 2.3 et étape 3.21). Dans ce protocole, la période d’attente recommandée est de 5 à 7 jours après l’évaporation du carbone avant d’utiliser des grilles de streptavidine pour la cryo-EM. Lorsque les grilles sont utilisées trop tôt après la fabrication, on a observé que le réseau et la monocouche lipidique se mobilisent hors des trous de la grille. Une observation similaire peut être faite lorsque les grilles sont trop vieilles et utilisées après six mois (figure 5A) (ligne 1, tableau 1). Nous émettons l’hypothèse que cette observation s’explique par des changements dans l’hydrophobicité du support de carbone appliqué pour stabiliser la monocouche lipidique et les cristaux de streptavidine. De plus, les réseaux de streptavidine peuvent apparaître en mosaïque (figure 5B) (ligne 3, tableau 1) et brisés à la fois en coloration négative et en cryo-EM si la monocouche est appliquée sur des grilles où la première couche d’évaporation du carbone (étape 2.3) n’a pas suffisamment vieilli.
Une autre source d’erreur commune peut être attribuée à la fragilité de la monocouche cristalline de streptavidine (la monocouche lipidique est elle-même fluide et peut se dilater ou se comprimer de manière réversible). L’évaporation du carbone à l’arrière (étape 3.21) assure une stabilité critique à la fois à la monocouche et au réseau de streptavidine pendant le processus d’adsorption, de lavage et de cryo-transfert EM de l’échantillon. En l’absence d’une évaporation suffisante du carbone vers l’arrière de la grille, les réseaux de streptavidine apparaîtront souvent fragmentés après le transfert ou la congélation (figure 5C) (ligne 2, tableau 1). Dans ce protocole, nous suggérons l’utilisation d’un congélateur plongeant automatisé unilatéral pour le transfert unilatéral. Cette méthode permet d’obtenir des conditions de transfert hautement reproductibles qui préservent le réseau de streptavidine pendant le processus de congélation et permettent une optimisation rationalisée de l’application de l’échantillon et des paramètres de transfert. D’autres appareils de congélation en plongée automatisés ont également été utilisés en combinaison avec le transfert manuel. Pour ce faire, la fonction de buvard proprement dite est désactivée dans les paramètres de l’appareil, et la grille est effacée à la place en atteignant une pince à épiler tenant du papier buvard par l’entrée latérale. Cette méthode permet d’obtenir des résultats de haute qualité pour les laboratoires sans dispositif de transfert et de congélation en plongée d’un seul côté ; cependant, la reproductibilité d’une grille à l’autre est difficile.
Bien que l’utilisation de grilles d’affinité pour la streptavidine présente de nombreux avantages, certaines limites de cette méthode doivent être prises en considération. En raison de la nature de la procédure, il n’est généralement pas possible d’évaluer la qualité du réseau de streptavidine avant que l’ensemble du processus ne soit terminé. Il est suggéré de vérifier rapidement la qualité de chaque lot par coloration négative avant de congeler les échantillons. En raison du signal transmis par le réseau de streptavidine aux images brutes, il peut être difficile dans certains cas d’évaluer, à partir des images seules, s’il y a un nombre suffisant de particules intactes et dispersées. Pour la même raison, le traitement à la volée des données cryo-EM pendant l’acquisition des données n’est pas possible à moins que la procédure de soustraction du signal streptavidine n’ait été incluse dans le pipeline de prétraitement des données. Étant donné que le signal de la streptavidine est généralement soustrait des images corrigées en mouvement et non des images elles-mêmes, le polissage bayésien, tel qu’il est mis en œuvre dans les suites logicielles populaires, peut échouer lors de l’utilisation des procédures de soustraction décrites ci-dessus. Il est donc recommandé d’effectuer une correction de mouvement dans plusieurs patchs pour minimiser le mouvement des particules dès le début du traitement des données16.
Malgré ces limitations, les grilles d’affinité de la streptavidine offrent de nombreux avantages. Les grilles d’affinité de la streptavidine offrent deux avantages majeurs par rapport aux grilles cryo-EM à trou ouvert standard sont un moyen de protéger les échantillons de l’interface air-eau et de concentrer les échantillons de faible abondance (10-100 nM) sur la grille. D’autres couches de support, telles que le carbone et l’oxyde de graphène, peuvent également être utilisées comme stratégies pour surmonter ces goulots d’étranglement dans la préparation des échantillons. Dans un exemple, les grilles d’affinité de la streptavidine étaient la seule solution pour obtenir une reconstruction intacte d’une interaction protéine-acide nucléique incompatible avec les approches de réticulation. 12
Un autre avantage majeur des grilles d’affinité de la streptavidine est une solution pour les échantillons qui s’adsorbent sur d’autres couches de support, telles que l’oxyde de carbone ou de graphène, avec des orientations préférées qui entravent la capacité d’obtenir une reconstruction 3D de l’échantillon d’intérêt. La biotinylation aléatoire d’échantillons à l’aide de kits disponibles dans le commerce permet de fixer de manière aléatoire l’échantillon d’intérêt à la monocouche de streptavidine afin d’obtenir plus de vues potentielles pour surmonter ce défi.
De plus, les grilles d’affinité de la streptavidine offrent des avantages uniques aux grilles d’affinité. La haute affinité et la spécificité de l’interaction streptavidine-biotine permettent le couplage des grilles d’affinité streptavidine avec d’autres flux de travail impliquant la biotine pour purifier les complexes d’intérêt. Dans un exemple publié, les auteurs ont immobilisé un complexe sur des grilles d’affinité streptavidine et ont incubé un partenaire de liaison de stœchiométrie inconnue en grand excès. Après avoir lavé toute protéine non liée, le super-complexe correctement assemblé a été obtenu et a pu être immédiatement analysé avec la cryo-EM11. Une application future possible pourrait être de combiner des marqueurs de protéines de liaison à la streptavidine, le système Avi-tag ou des approches de marquage de proximité avec des grilles d’affinité de streptavidine pour extraire des protéines uniques et/ou des complexes protéiques directement à partir de sources recombinantes ou endogènes sans schémas de purification élaborés standard.
En fournissant ce protocole, les laboratoires devraient être en mesure de reproduire facilement la fabrication de grilles d’affinité de streptavidine et de les établir comme un outil plus couramment utilisé pour l’analyse structurale des complexes protéiques par cryo-EM.
Déclarations de divulgation
Aucun.
Remerciements
T.C. a été soutenu par la subvention de formation en biophysique moléculaire GM-08295 du National Institute of General Medical Sciences et la bourse de recherche de la National Science Foundation sous le numéro de subvention DGE 2146752. R.G. et B.H. ont été soutenus par la subvention R21-GM135666 de l’Institut national de la santé accordée à R.G. et B.H. Ce travail a été partiellement financé par la subvention R35-GM127018 du National Institute of General Medical Sciences accordée à E.N. E.N. est un chercheur de l’Institut médical Howard Hughes.
matériels
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3- phosphoethanolamine-N-(biotinyl) sodium salt | Avanti Polar Lipids | 870285P | Comes as a powder. Dissolve at concentration of 1–10 mg/mL in chloroform/methanol/water solvent, 65:35:8 v/v and store in single use aliquots at -80 °C |
| 200 proof pure ethanol | Fisher Scientific | 07-678-005 | |
| 5 μL Hamilton Syringe | Hamilton | 87930 | 5 µL Microliter Syringe Model 75 RN, Small Removable Needle, 26 G, 2 in, point style 2 |
| Castor Oil | Sigma Adrich | 259853 | |
| Cell culture dishes untreated (35 mm) | Bio Basic | SP22146 | |
| Chloroform | Sigma Aldrich | 650471 | |
| D-(+)-Trehalose dihydrate,from starch, ≥99% | Sigma Aldrich | T9449 | |
| DUMONT Anti-Capillary Reverse (self-closing) Tweezers Biology Grade | Ted Pella | 510-5NM | |
| HPLC Grade Methanol | Fisher Scientific | A452-4 | |
| Leica EM ACE600 High Vacuum Sputter Coater | Leica | ||
| Leica EM GP2 Automatic Plunge Freezer | Leica | ||
| Quantifoil R 2/1 Au300 | Quantifoil | Q84994 | |
| Steptavidin | New England Bioscience | N7021S | Comes as 1 mg/mL solution. Dilute to final concentration of 0.5 mg /mL in crystallization bufferwith a final trehalose concentration of 10%. Can be flash frozen in 25–50 μL aliquots |
| Talcum powder | Carolina | 896060 | |
| Whatman Grade 1 filter paper | Cytiva | 1001-085 |
Références
- Glaeser, R. M., Nogales, E., Chiu, W. . Single-particle Cryo-EM of Biological Macromolecules. IOP Publishing. , (2021).
- Carragher, B., et al. Current outcomes when optimizing 'standard' sample preparation for single-particle cryo-EM. Journal of Microscopy. 276 (1), 39-45 (2019).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta Crystallographica Section D-Structural Biology. 74, 560-571 (2018).
- Noble, A. J., et al. Routine single particle cryoEM sample and grid characterization by tomography. eLife. 7, e34257 (2018).
- Patel, A., Toso, D., Litvak, A., Nogales, E. Efficient graphene oxide coating improves cryo-EM sample preparation and data collection from tilted grids. bioRxiv. , (2021).
- Wang, F., et al. General and robust covalently linked graphene oxide affinity grids for high-resolution cryo-EM. Proceedings of the National Academy of Sciences. 117 (39), 24269-24273 (2020).
- Pantelic, R. S., Meyer, J. C., Kaiser, U., Baumeister, W., Plitzko, J. M. Graphene oxide: A substrate for optimizing preparations of frozen-hydrated samples. Journal of Structural Biology. 170 (1), 152-156 (2010).
- Williams, R. C., Glaeser, R. M. Ultrathin carbon support films for electron microscopy. Science. 175 (4025), 1000-1001 (1972).
- Han, B. -. G., et al. Long shelf-life streptavidin support-films suitable for electron microscopy of biological macromolecules. Journal of Structural Biology. 195 (2), 238-244 (2016).
- Han, B. -. G., et al. Electron microscopy of biotinylated protein complexes bound to streptavidin monolayer crystals. Journal of Structural Biology. 180 (1), 249-253 (2012).
- Domínguez-Martín, M. A., et al. Structures of a phycobilisome in light-harvesting and photoprotected states. Nature. 609 (7928), 835-845 (2022).
- Kasinath, V., et al. JARID2 and AEBP2 regulate PRC2 in the presence of H2AK119ub1 and other histone modifications. Science. 371 (6527), eabc3393 (2021).
- Lahiri, I., et al. 3.1 structure of yeast RNA polymerase II elongation complex stalled at a cyclobutane pyrimidine dimer lesion solved using streptavidin affinity grids. Journal of Structural Biology. 207 (3), 270-278 (2019).
- Marr, C. R., Benlekbir, S., Rubinstein, J. L. Fabrication of carbon films with ~ 500nm holes for cryo-EM with a direct detector device. Journal of Structural Biology. 185 (1), 42-47 (2014).
- Levine, M. J., Schwarz, J. A. Experimental guidelines for producing molecular assemblies by Langmuir-Blodgett techniques. Journal of Chemical Education. 65 (7), 638 (1988).
- Zheng, S. Q., et al. MotionCor2: anisotropic correction of beam-induced motion for improved cryo-electron microscopy. Nature Methods. 14 (4), 331-332 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon