Method Article
Fortgeschrittene Modellierung des abdominalen Aortenaneurysmas bei Mäusen durch Kombination von topischer Elastase und oralem ß-Aminopropionitril
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt einen methodischen chirurgischen Ansatz zur Modellierung fortgeschrittener Bauchaortenaneurysmen bei Mäusen durch eine Kombination aus direkter Applikation von Elastase auf die infrarenale Aorta und Verabreichung von ß-Aminopropionitril über das Trinkwasser.
Zusammenfassung
Das topische Elastase-Mausmodell des abdominalen Aortenaneurysmas (AAA) wird in Kombination mit ß-Aminopropionitril (BAPN)-supplementiertem Trinkwasser verbessert, um zuverlässig echte infrarenale Aneurysmen mit Verhaltensweisen zu erzeugen, die menschliche AAAs nachahmen. Die topische Anwendung von Elastase auf die Adventitia der infrarenalen Aorta führt zu einer strukturellen Schädigung der elastischen Schichten der Aortenwand und leitet die aneurysmatische Dilatation ein. Die gleichzeitige Verabreichung von BAPN, einem Lysyloxidase-Hemmer, fördert eine anhaltende Wanddegeneration, indem es die Vernetzung von Kollagen und Elastin reduziert. Diese Kombination führt zu großen AAAs, die sich progressiv ausdehnen, intraluminalen Thrombus bilden und reißen können. Die Verfeinerung chirurgischer Techniken, wie z. B. die zirkumferentielle Isolierung des gesamten infrarenalen Aortensegments, kann dazu beitragen, das Verfahren für eine konsistente und gründliche Anwendung der porzinen Pankreas-Elastase trotz unterschiedlicher Operatoren und anatomischer Unterschiede zwischen Mäusen zu standardisieren. Daher ist das Elastase/BAPN-Modell ein verfeinerter Ansatz zur chirurgischen Induktion von AAA bei Mäusen, der menschliche Aneurysmen besser rekapitulieren und zusätzliche Möglichkeiten zur Untersuchung des Aneurysmawachstums und des Rupturrisikos bieten kann.
Einleitung
Ein Aneurysma ist definiert als eine pathologische Erweiterung eines Blutgefäßes, die mehr als 50 % des gesunden Gefäßdurchmessersbeträgt 1. Obwohl abdominale Aortenaneurysmen (AAA) mit einer Inzidenz von etwa >5 % der Männer > 65 Jahren eine häufige Erkrankung in der alternden Bevölkerung sind, gibt es keine gezielten therapeutischen Strategien zur Behandlung von AAA1. Die derzeitige Behandlung von AAA beschränkt sich auf die Reduzierung von Risikofaktoren und die chirurgische Reparatur mit offener oder endovaskulärer Chirurgie auf der Grundlage des Aortendurchmessers oder der Wachstumsrate2. Die größte Gefahr von AAA ist die Aneurysmaruptur, die unbehandelt tödlich verläuft, und eine Reparatur in diesem Notfall kann ein Sterblichkeitsrisiko von über 90 % mit sich bringen1.
Die Pathophysiologie der AAA ist kompliziert, multifaktoriell und nicht vollständig verstanden3. Zu den Merkmalen der humanen AAA gehören eine echte aneurysmatische Dilatation der Aortenwand mit einer Infiltration von Entzündungszellen, das Vorhandensein eines intraluminalen Thrombus und eine progressive Dilatation, die schließlich zu einer Ruptur führt 3,4. Darüber hinaus sind AAAs mit fortgeschrittenem Alter assoziiert, haben eine Geschlechtsdominanz von 9:1 zwischen Mann und Frau und treten am häufigsten in der infrarenalen Aorta auf5. Die Modellierung aller Merkmale und Verhaltensweisen menschlicher AAAs bei Tieren bleibt eine ständige Herausforderung6.
Die derzeitige AAA-Modellierung wird hauptsächlich an Mäusen durchgeführt, und Aneurysmen werden häufig mit einer von drei Methoden induziert - durch Angiotensin II (AngII)-Infusion über eine subkutan implantierte osmotische Pumpe und durch direkte Applikation von Calciumchlorid (CaCl2) oder Elastase auf die Aorta7. Bei der letztgenannten Methode wird die porzine Pankreas-Elastase (PPE) auf ein Segment der infrarenalen Aorta aufgebracht und bewirkt einen enzymatischen Abbau von Elastinfasern innerhalb der elastischen Lamelle des Tunica-Mediums. Diese strukturelle Schädigung führt zu einer Schwächung der Aortenwand und einer Aneurysmaerweiterung nach außen. Die alleinige Verwendung von topischer Elastase führt jedoch zu relativ kleinen infrarenalen Aneurysmen, die sich im Laufe der Zeit nicht progressiv vergrößern oder reißen. In jüngerer Zeit verbesserten Lu et al. dieses Modell, indem sie ihren mit Elastase behandelten Mäusen zusätzlich β-Aminopropionitril (BAPN), einen irreversiblen Inhibitor der Lysyloxidase, verabreichten8. Durch die Verhinderung der Vernetzung von Elastin- und Kollagenfasern führt eine BAPN-Supplementierung dazu, dass sich die durch Elastase geschädigten Aorten progressiv bis zum Rupturpunkt erweitern. Das Elastase/BAPN-Modell hat zusätzlich eine höhere Inzidenzrate von AAA als das topische Elastase-Modell, und die erzeugten Aneurysmen sind ebenfalls größer und enthalten intraluminalen Thrombus8.
Im Elastase/BAPN-Modell kann der Grad der chirurgischen Dissektion und die Exposition der Aorta gegenüber Elastase den Erfolg und die Replizierbarkeit dieses Modells beeinflussen. In diesem Manuskript beschreiben wir, dass die gleichzeitige Verabreichung von BAPN-Trinkwasser und topischer Elastase-Applikation in die Aorta nach zirkumferentieller Isolierung des gesamten infrarenalen Aortensegments die Reproduzierbarkeit verbessert, anatomische Unterschiede zwischen Tieren berücksichtigt und zu einer höheren AAA-Induktionsrate, Aneurysmagrößen und Rupturinzidenz führt. In diesem Artikel beschreiben wir einen standardisierten Ansatz zur zuverlässigen Induktion von fortgeschrittenen abdominalen Aortenaneurysmen bei Mäusen unter Verwendung einer Kombination aus topischem Elastase- und BAPN-supplementiertem Wasser.
Protokoll
Tierprotokolle werden vom Institutional Animal Care and Use Committee (M005792 der University of Wisconsin-Madison genehmigt.
1. Erhaltung der Tiere
- Ziehen Sie Mäuse auf dem Standard-Erhaltungsfutter auf. Verwenden Sie erwachsene Mäuse oder junge erwachsene Mäuse (8-12 Wochen alt).
HINWEIS: Der Einsatz von erwachsenen Tieren stellt sicher, dass die Tiere ihre volle Reife erreicht haben, und begrenzt die Wahrscheinlichkeit, dass Veränderungen des Aortendurchmessers mit dem Wachstum der Tiere zusammenhängen könnten. Für diese Studie verwendeten wir männliche und weibliche C57BL/6J-Mäuse, die zum Zeitpunkt der Operation 22-24 Wochen alt waren. Lu und Kollegen beobachteten keine signifikanten Unterschiede in der aneurysmatischen Reaktion zwischen jüngeren und älteren Mäusen8. Während die meisten Aneurysmamodellierungen bei männlichen Mäusen durchgeführt werden, induziert dieses Modell erfolgreich AAAs sowohl bei männlichen als auch bei weiblichen Mäusen9. - Bestimmen Sie die Studiendauer und ordnen Sie die Tiere Behandlungs- oder Schein-(Kontroll-)Gruppen zu. Verabreichen Sie 0,2 % BAPN-Trinkwasser an Mäuse der Behandlungsgruppe und unterziehen Sie sie einer Operation mit topischer Anwendung von aktiver Elastase auf die infrarenale Aorta. Verabreichen Sie unbehandeltes Wasser, um die Tiere zu kontrollieren, und unterziehen Sie sie einer Operation durch Anwendung von denaturierter Elastase auf die infrarenale Aorta.
2. Beginn der Einnahme von mit B-Aminopropionitril (BAPN) supplementiertem Trinkwasser
- Beginnen Sie zwei Tage vor der Operation mit der Behandlung von Mäusen mit 0,2 % BAPN-Trinkwasser. Bereiten Sie BAPN-Wasser in größeren Mengen zu und lagern Sie es dunkel bei 4 °C für bis zu 28 Tage. Stellen Sie sicher, dass das BAPN-Wasser Raumtemperatur erreicht, bevor Sie es den Mäusen geben.
HINWEIS: Wir empfehlen, das BAPN-Wasser während der gesamten Dauer der Studie alle 7 Tage in den Käfigen zu ersetzen.
3. Vorbereitung des Operationsmaterials am Tag der Operation
- Schneiden Sie OP-Handschuhe in 5 mm x 10 mm große Streifen, die später zur Isolierung der Aorta vor der Behandlung mit Elastase verwendet werden. Bereiten Sie ein OP-Abdecktuch vor, indem Sie ein ~ 1,5 cm x 3 cm großes Oval in der Mitte eines OP-Abdecktuchs zuschneiden. Entfalten Sie die 2 x 2 x 2 Zoll Gaze und schneiden Sie sie in zwei Hälften, um Gazestreifen von etwa 2,5 cm x 10 cm zu erhalten, die später zum Zurückziehen des Bauchinhalts verwendet werden. Autoklavieren Sie alle chirurgischen Instrumente (siehe Materialtabelle) und richten Sie ein steriles Operationsfeld ein, wie am Beispiel in Abbildung 1 gezeigt.
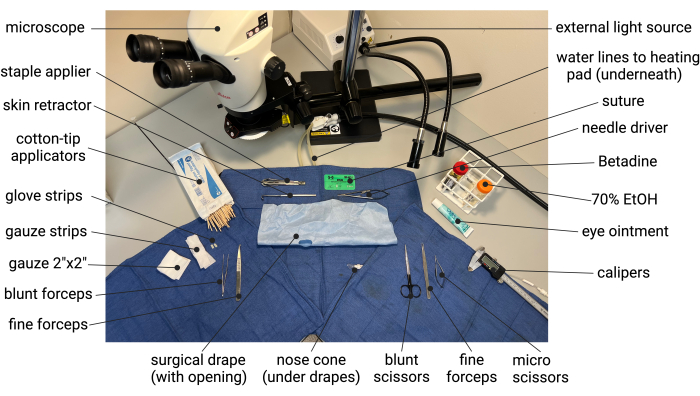
Abbildung 1: Beispiel für den Aufbau einer sterilen Chirurgie in Vorbereitung auf das Elastase/BAPN-Mausmodell von AAA. Abkürzungen: BAPN = ß-Aminopropionitril; AAA = Bauchaortenaneurysma. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Bereiten Sie einen postoperativen Erholungskäfig vor, indem Sie einen sauberen Käfig unter eine Wärmelampe stellen und Kochsalzlösung in der Nähe der Lampe platzieren, um sie auf Körpertemperatur (37 °C) zu erwärmen. Stellen Sie sicher, dass die Wärmelampe sicher so positioniert ist, dass der Rückgewinnungskäfig und die Kochsalzlösung warm sind, aber nicht über 37 °C liegen. Schalten Sie die Wasserpumpe ein, um warmes Wasser durch das Heizkissen zirkulieren zu lassen.
4. Vorbereitung der Tiere auf die Operation
- Legen Sie die Mäuse in eine Induktionskammer und betäuben Sie sie mit 5% Isofluran bei 200 mL/min mit einem elektronischen Verdampfer mit geringem Durchfluss. Wiegen Sie während der Narkose jede Maus und geben Sie 0,6 mg/kg Buprenorphin ER und 20 mg/kg Carprofen subkutan zur Analgesie. Verwenden Sie elektrische Haarschneider, um das Fell am Bauch vom Unterbauch bis zum unteren Ende des Xyphoid-Prozesses zu schneiden. Verwenden Sie Gaze oder ein Labortuch, um überschüssiges Haar abzubürsten. Bringen Sie die Mäuse in ihren Käfig zurück und warten Sie mindestens 20 Minuten, bis die Analgesie wirkt, bevor Sie mit der Operation fortfahren.
- Nach mindestens 20 Minuten seit der Verabreichung der Analgesie legen Sie die Maus in eine Anästhesie-Induktionskammer und geben Sie erneut 5% Isofluran bei 200 ml/min mit einem elektronischen Verdampfer mit niedrigem Durchfluss ab, bis die Maus sediert ist.
- Nehmen Sie die sedierte Maus aus der Induktionskammer und legen Sie sie in Rückenlage auf das Operationsfeld. Tragen Sie Augengel auf und befestigen Sie den Nasenkonus mit chirurgischem Klebeband. Reduzieren Sie das abgegebene inhalative Isofluran auf eine Erhaltungsrate von 1-2% bei 50 mL/min. Sichern Sie die Vorder- und Hinterpfoten der Maus mit chirurgischem Klebeband.
- Untersuche den Unterbauch der Maus auf die Blase. Üben Sie sanft äußeren Druck auf die Blase zwischen Daumen, Zeige- und Mittelfinger aus, um eine Blasenentleerung zu induzieren. Verwenden Sie in der Zwischenzeit ein Stück Gaze, um den Urin abzuleiten.
HINWEIS: Achten Sie darauf, das Operationsfeld nicht zu kontaminieren. - Beginnen Sie mit der Desinfektion des Bauches, indem Sie ein Peeling auf Jod- oder Chlorhexidinbasis und 70% Alkohol mit Wattestäbchen auftragen. Beginne in der Mitte des Bauches und arbeite dich in kreisenden Bewegungen 3x nach außen vor. Lassen Sie die Fläche zwischen den Anwendungen kurz trocknen.
- Prüfen Sie, ob es keine Reaktion auf das Zusammenkneifen der Zehen gibt, um sicherzustellen, dass die Anästhesie angemessen ist. Stellen Sie sicher, dass der Nasenkegel und die Gliedmaßen gesichert sind. Legen Sie ein OP-Abdecktuch über die Maus, wobei die Öffnung direkt über dem chirurgisch vorbereiteten Bauch liegt.
HINWEIS: Ziehen Sie das Tuch nicht über die Maus, um eine mögliche Kontamination zu vermeiden.
5. Chirurgische Induktion von AAA
- Eintritt in die Bauchhöhle:
- Waschen Sie sich die Hände und tragen Sie saubere Nitril- oder sterile OP-Handschuhe. Vor dem Kontakt mit dem Operationsfeld die Handschuhe immer mit 70% EtOH einsprühen und die behandschuhten Hände aneinander reiben, bis sie trocken sind.
- Verwenden Sie eine stumpfe Pinzette, um die Haut in der Mittellinie des Bauches zu halten. Machen Sie mit einer chirurgischen Schere einen kleinen Schnitt in die Haut und verlängern Sie dann den Schnitt in Längsrichtung, etwa 2-3 cm lang.
- Verwenden Sie eine Pinzette, um die Rektusmuskeln anzuheben, um die durchscheinende Linea alba zu identifizieren. Mit einer Schere durch die Linea alba in die Bauchhöhle eindringen und dann proximal und distal entlang der Linea alba ausdehnen.
- Freilegung der Bauchschlagader:
- Befeuchten Sie einen Streifen Gaze und zwei Wattestäbchen mit erwärmter Kochsalzlösung. Erzeuge eine Bauchrolle, indem du ein Ende der Gaze halb fest rollst und einen großzügigen Schwanz übrig lässt.
- Verwenden Sie einen Hautretraktor, um die rechte Bauchdecke zurückzuziehen.
- Führen Sie mit angefeuchteten Wattestäbchen eine rechtsmediale viszerale Rotation durch, indem Sie den Dünn- und Dickdarm sanft in den linken oberen Quadranten streichen und die Aorta und die untere Hohlvene (IVC) sichtbar machen. Verwenden Sie eine Bauchrolle, um den Darm außer Sichtweite zu ziehen – stecken Sie das ausgerollte Ende der Gaze unter den Darm und führen Sie dann das Schwanzende um und aus dem Körper heraus, um den Darm sanft zu wickeln. Üben Sie sanften Zug auf den Schwanz der Gaze aus, um den Darm aus dem Blickfeld zu halten. Passen Sie die Bauchrolle und den Hautretraktor an, um eine optimale Sicht auf die retroperitonealen Organe zu erhalten, wie in Abbildung 2A gezeigt.
HINWEIS: Die Bauchrolle hilft, den Darm feucht zu halten und ihn vor versehentlicher Beschädigung durch chirurgische Instrumente zu schützen. Achten Sie darauf, dass die Gaze während des Eingriffs feucht bleibt, um ein Austrocknen des Darms zu verhindern. Achten Sie darauf, den Darm nicht gewaltsam zurückzuziehen, da dies zu einem Abknicken der Arteria mesenterica superior und der Darmgefäße führen kann, was möglicherweise zu ischämischen Schäden führen kann. Achten Sie außerdem beim ersten Fegen des Dünndarms auf einen dünnen durchscheinenden Ansatz zwischen dem Dickdarm und der unteren Leber (hepatokolisches Band), der, wenn er nicht vorsichtig ist, die Leberkapsel leicht abreißen und Blutungen verursachen kann. Wenn dieses Band während des Rückzugs unter Druck steht, teile es mit einer Schere scharf.
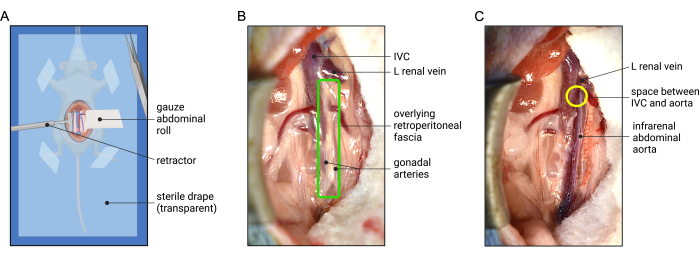
Abbildung 2: Darstellung der abdominalen Retraktion und der optimalen chirurgischen Ansicht für die Freilegung der infrarenalen Aorta der Maus. (A) Die Platzierung einer Mull-Bauchrolle hilft, die intraabdominalen Organe zurückzuziehen, während ein gegenüberliegender Retraktor bei der Visualisierung des Retroperitoneums hilft. Ein steriles OP-Tuch (transparent, um die Orientierung des Tieres zu zeigen) wird über das anästhesierte Tier gelegt, um die Sterilität zu erhalten. (B) Die retroperitoneale Faszie (grüner Kasten) überlagert die Aorta anterior. (C) Beispiel der infrarenalen Aorta nach Dissektion der retroperitonealen Faszie. Die Isolierung der Aorta von der IVC kann erreicht werden, indem man bei einem potentiellen Raum zwischen der Aorta und der IVC beginnt, der sich direkt distal der linken Nierenvene befindet, wenn sie sich anterior kreuzt (gelber Kreis). Abkürzung: IVC = Vena cava inferior Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Umfangsdissektion und Isolierung der infrarenalen Aorta:
- Vergewissern Sie sich, dass die IVC und die infrarenale Aorta vollständig sichtbar sind. Beginnen Sie mit der Freilegung der Aorta, indem Sie zuerst in die retroperitoneale (RP) Faszie eindringen und diese teilen (Abbildung 2B). Identifizieren Sie die gonadalen Arterien (Hoden oder Eierstöcke), die parallel entlang der vorderen infrarenalen Aorta verlaufen (Abbildung 2B und Abbildung 3). Verwenden Sie eine Pinzette, um die Faszie zwischen den Gonadenarterien stumpf zu teilen, und fahren Sie in Längsrichtung fort, um die Aorta anterior freizulegen (Abbildung 2C).
HINWEIS: Die RP-Faszie ist eine dünne, durchscheinende Schicht aus Bindegewebe, die die Lymphgefäße und den Plexus splanchnicus enthält. Es ist notwendig, durch die RP-Faszie zu präparieren, um die Aorta freizulegen. Präparieren Sie jedoch nicht durch das Bindegewebe der Aorta adventitia. Ein Riss in der Adventitia (weißes Bindegewebe) legt das Medium frei (erscheint hellrot), und die Aorta wird wahrscheinlich an dieser Stelle reißen, sobald Elastase aufgetragen wird. - Beginnen Sie als Nächstes, die Bauchschlagader von der IVC zu isolieren. Beginnen Sie diese Dissektion an einer kleinen Lücke zwischen der IVC und der Aorta, die sich direkt unter dem unteren Rand der linken Nierenvene befindet, wenn sie die Aorta kreuzt (Abbildung 2C). Spreizen Sie mit den Spitzen einer Pinzette die Bindegewebsfasern zwischen Aorta und IVC vorsichtig auseinander und arbeiten Sie auf dieser Höhe umlaufend um die Aorta herum weiter.
HINWEIS: Die IVC ist sehr dünnwandig und haftet durch eine feine Schicht aus fibrösem Bindegewebe eng an der Aorta. Achten Sie darauf, den Umgang mit dem IVC zu vermeiden oder den IVC so weit wie möglich zu reinigen. Das Präparieren der rechten Seite der Aorta vor der IVC (bevor die linke Seite der Aorta aus der umgebenden Muskulatur präpariert wird) hilft der Aorta, von der IVC "abzufallen". - Fahren Sie mit dem stumpfen Präparieren der Ebene zwischen Aorta und IVC fort und arbeiten Sie sich kaudal in Richtung der Aortengabelung. Stoppen Sie die weitere distale Dissektion, sobald Sie die Aortenbifurkation erreicht haben.
HINWEIS: Seien Sie besonders vorsichtig, wenn Sie um die Arteria mesenterica inferior (IMA) herum präparieren, die sich typischerweise in der Nähe des mittleren Abschnitts der infrarenalen Aorta befindet und lateral über die IVC verläuft. - Sobald der rechte Rand der Aorta von der IVC getrennt ist, kehren Sie proximal auf die Höhe der linken Nierenvene zurück. Präparieren Sie die RP-Faszie am lateralen linken Rand der Aorta und arbeiten Sie sich umlaufend vor, bis die Aorta vollständig isoliert ist. Siehe Abbildung 3 für die relevante Anatomie der retroperitonealen Dissektion.
HINWEIS: Seien Sie vorsichtig beim Präparieren hinter der Aorta, da die Lage und Anzahl der Lendenvenen und Arterien sehr unterschiedlich ist. Siehe Abbildung 4 für eine Referenz von Bereichen mit hohem Blutungsrisiko bei dieser Dissektion. - Untersuchen Sie sorgfältig, ob die Aorta so weit wie möglich von der IVC und der umgebenden Muskulatur isoliert ist, mit vorsichtiger Dissektion um die Aortensegmente, die durch die IMA und die Lendenarterien angebunden sind.
- Legen Sie einen Handschuhstreifen entlang des rechten und linken Randes der Aorta, wie in Abbildung 5A gezeigt. Versuchen Sie, so viel wie möglich von der IVC abzudecken.
- Verwenden Sie tragbare Messschieber, um den breitesten Aortendurchmesser zu messen und drei Messungen aufzuzeichnen. Besprühen Sie die Spitzen der Messschieber vor und nach den Messungen mit 70% EtOH. Vermeiden Sie den direkten Kontakt der Aorta mit den Bremssattelspitzen, um eine Kontamination zu vermeiden.
HINWEIS: Fotos mit einem kalibrierten kamerafähigen Mikroskop können ebenfalls verwendet werden.
- Vergewissern Sie sich, dass die IVC und die infrarenale Aorta vollständig sichtbar sind. Beginnen Sie mit der Freilegung der Aorta, indem Sie zuerst in die retroperitoneale (RP) Faszie eindringen und diese teilen (Abbildung 2B). Identifizieren Sie die gonadalen Arterien (Hoden oder Eierstöcke), die parallel entlang der vorderen infrarenalen Aorta verlaufen (Abbildung 2B und Abbildung 3). Verwenden Sie eine Pinzette, um die Faszie zwischen den Gonadenarterien stumpf zu teilen, und fahren Sie in Längsrichtung fort, um die Aorta anterior freizulegen (Abbildung 2C).
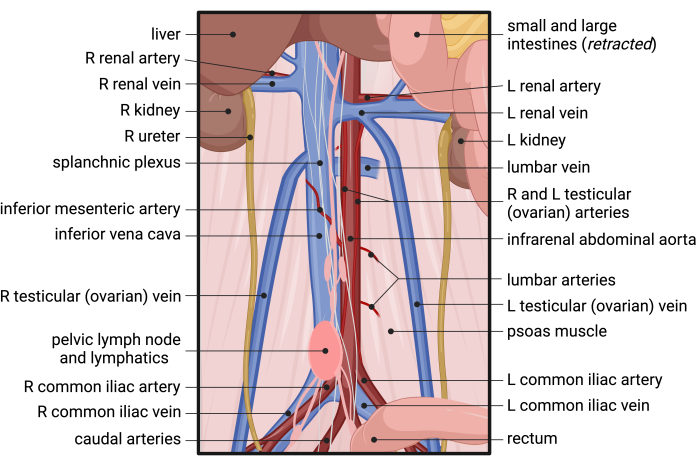
Abbildung 3: Anatomie der Blutversorgung des Unterbauchs, des Beckens und des Retroperitoneums der Maus. Abkürzungen: R = rechts; L = links. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
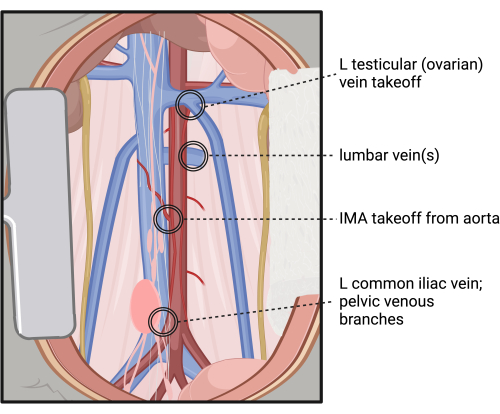
Abbildung 4: Stellen mit hohem Verletzungs- und Blutungsrisiko während der retroperitonealen Dissektion und der zirkumferentiellen Isolierung der infrarenalen Aorta. Abkürzungen: L = links; IMA = Arteria mesenterica inferior. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
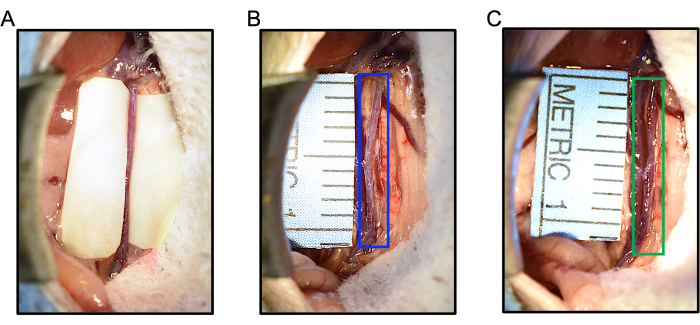
Abbildung 5: Intraoperative Reaktionen auf Elastase-Applikation oder Schein während des Elastase/BAPN-Maus-AAA-Modells. (A) Handschuhsegmente werden vor der Elastase-Applikation entlang der Aorta platziert, um die IVC und den Darm vor Elastase-Exposition zu schützen, während die Aorta in Elastase getränkt bleibt. (B) Die Anwendung von denaturierter Elastase führt nicht zu einer Erweiterung der Aorta (blauer Kasten). Der maximale Aortendurchmesser betrug zu Studienbeginn 0,627 mm, dann 0,607 mm nach 5 Minuten topischer denaturierter Elastase. (C) Die Anwendung von Elastase führt nach 5 Minuten Behandlung zu einer Aortendilatation. In diesem Beispiel erweiterte sich die Aorta (grün) von 0,607 mm auf 0,953 mm, was einer Vergrößerung des Durchmessers um 57 % entspricht. Abkürzungen: BAPN = ß-Aminopropionitril; AAA = Bauchaortenaneurysma. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Elastase Anwendung:
- Verwende ein Wattestäbchen, um überschüssiges Blut oder Flüssigkeit von der Aorta abzutupfen.
- Legen Sie als Nächstes ein 10 mm x 2 mm großes Stück trockene Gaze auf die Aorta. Verwenden Sie eine Pipette, um 5 μl Elastase abzugeben (oder denaturierte Elastase zu kontrollieren), um die Gaze und die Aorta zu sättigen. Falten Sie die Stücke des Handschuhs vorsichtig um die Aorta.
HINWEIS: Zur Herstellung von denaturierter Elastase für die Verwendung in Schein- oder Kontrollgruppen kochen Sie Elastase 30 Minuten lang bei 100 °C. - Warten Sie 5 Minuten, bis die Elastase auf die Aorta einwirkt. Während dieser Inkubationszeit wird bei Bedarf ein Teil der Spannung gelöst, die durch die Bauchrolle und den Hautretraktor ausgeübt wird.
HINWEIS: Aufgrund des Batch-Effekts mit Elastase empfehlen wir den Prüfärzten, für alle Experimente innerhalb einer bestimmten Studie dieselbe Flasche Elastase zu verwenden. Bei jeder neuen Flasche Elastase empfehlen wir, eine Dosis-Wirkungs-Beziehung durchzuführen, um sicherzustellen, dass es nicht zu einer überwältigenden Anzahl früher Rupturen (vor 4 Wochen) kommt. Die Dauer der Elastase-Anwendung kann ebenfalls zwischen 4 und 6 Minuten angepasst werden, abhängig von der Reaktion auf Elastase. - Nach 5 Minuten setzen Sie den Darmzug zurück und entfalten Sie die Stücke des Handschuhs. Spülen Sie die Bauchhöhle mit 1 ml warmer 0,9 % steriler normaler Kochsalzlösung, während Sie vorsichtig die Gaze und die Handschuhstücke von der Aorta entfernen. Nehmen Sie die Kochsalzlösung im Bauch mit 10 cm x 10 cm Gaze auf. Wiederholen Sie die Spülung des Bauches für insgesamt 3 x 3 ml.
- Verwenden Sie Messschieber, um den größten Aortendurchmesser nach der Elastase-Anwendung nachzumessen und 3x aufzuzeichnen. In Abbildung 5B,C finden Sie Beispiele für die Aortendilatation zur Behandlung mit Schein- und aktiver Elastase.
HINWEIS: Die Durchschnittswerte der drei Prä- und Post-Elastase-Messungen können verwendet werden, um die prozentuale Änderung des Aortendurchmessers während der Behandlung zu berechnen. Typischerweise kommt es unmittelbar nach der Elastase-Behandlung zu einer bemerkenswerten Dilatation von ~30-50%, die dazu beitragen kann, sicherzustellen, dass die Elastase funktionsfähig ist und die Aorta angemessen behandelt wurde. Der Durchmesser der Aorta sollte sich durch die Anwendung von denaturierter Elastase nicht ändern oder kann etwas kleiner sein (wahrscheinlich aufgrund von Krämpfen).
- Verschluss der Bauchhöhle:
- Entferne die Bauchrolle vorsichtig unter dem Darm und aus dem Körper. Tragen Sie bei Bedarf zusätzliche Kochsalzlösung auf den Darm auf, um ein Anhaften an der Bauchrolle während der Entnahme zu verhindern. Vergewissern Sie sich, dass der Darm rosa und ausreichend durchblutet erscheint.
HINWEIS: Es ist nicht notwendig, zu versuchen, den Darm wieder an seinen ursprünglichen Ort zu bringen. Wenn Sie dies versuchen, kann es zu einer Verdrehung des Darms oder inneren Hernien kommen. - Nähern Sie sich der Bauchfaszie mit einer laufenden, nicht resorbierbaren monofilen Naht 5-0 an. Verschließen Sie die Haut mit 3-4 Hautklammern.
- Entferne die Bauchrolle vorsichtig unter dem Darm und aus dem Körper. Tragen Sie bei Bedarf zusätzliche Kochsalzlösung auf den Darm auf, um ein Anhaften an der Bauchrolle während der Entnahme zu verhindern. Vergewissern Sie sich, dass der Darm rosa und ausreichend durchblutet erscheint.
6. Postoperative Tierpflege
- Platzieren Sie die Maus mit einer Wärmelampe in den Bergekäfig. Stellen Sie sicher, dass die Temperatur des Käfigs warm und nicht heiß ist.
- Verabreichen Sie einen 0,5-1 ml subkutanen Flüssigkeitsbolus mit 0,9% normaler Kochsalzlösung.
- Lassen Sie die Maus sich im erwärmten Käfig ~20 Minuten lang von selbst erholen, bis sie gemäß dem institutionellen Protokoll aktiv ist, und kehren Sie dann in einen Haltungskäfig zurück.
- Gemäß dem institutionellen Protokoll ist Carprofen 20 mg/kg 24 Stunden nach der Operation am postoperativen Tag 1 zu verabreichen und 3 Tage lang täglich zu verabreichen.
7. Aortenmessung und Gewebeentnahme
- Nach der Euthanasie mit Isofluran und Zervixluxation die Bauchhöhle wieder öffnen. Verlängern Sie den Schnitt durch das Brustbein, um Zugang zum Thorax zu erhalten. Exzitieren Sie die rechten Vorhöfe und perfundieren Sie den linken Ventrikel mit 10 ml kalter 1%iger DPBS-Lösung über 2 Minuten. Resezieren Sie die Lunge, die Leber und die Milz.
HINWEIS: Achten Sie darauf, den Darm nicht zu verletzen; Das Verschütten von magensaftresistentem Inhalt kann sich auf die Gewebeanalyse auswirken. - Legen Sie die Bauchschlagader frei und messen Sie den maximalen Durchmesser der infrarenalen Aorta, wie oben beschrieben. Fahren Sie fort, die gesamte Aorta und das Herz zu präparieren. Sobald das Herz und die Aorta isoliert sind, durchtrennen Sie alle arteriellen Äste und die Arteria iliaca communis, wobei kurze Segmente an der Aorta intakt bleiben. Platzieren Sie das Herz und die Aorta auf einem kontrastierenden Hintergrund neben einem Lineal und einem Bild.
8. Datenanalyse und Berichterstattung
- Um menschliches Versagen zu berücksichtigen, messen Sie die Aortendurchmesser mindestens 3x pro Aort, wenn Sie Messschieber verwenden, und geben Sie dann den Durchmesser als gemittelten Wert an.
- Definieren Sie AAA als eine 50%ige Zunahme des gesunden Aortendurchmessers. Achten Sie darauf, sowohl die Bruttodurchmesser der Aorta als auch die prozentuale Änderung des Durchmessers in die Studienergebnisse einzubeziehen.
Ergebnisse
In dieser Studie wurden männliche und weibliche C57BL/6J-Mäuse im Alter von 22-24 Wochen verwendet. Die infrarenalen Aorten wurden 5 Minuten lang mit 5 μl Elastase-Enzym (6,9 mg Protein/ml, 6 Einheiten/mg Protein) oder denaturierter Elastase behandelt. Mit Elastase behandelte männliche Mäuse zeigten eine Zunahme des Aortendurchmessers um 43,4 % nach 5-minütiger Exposition gegenüber Elastase im Vergleich zu unbehandelten Aortendurchmessern zu Studienbeginn, während die behandelten weiblichen Aorten um 33,6 % zunahmen (P = 0,0342). Die Aortendurchmesser von Schämchen zeigten über 5 Minuten Exposition gegenüber denaturierter Elastase relativ keine Veränderung (Männchen 0,5 %; Weibchen -2,8 %). Bei den 12 behandelten und 6 Scheinmäusen gab es keine chirurgisch bedingten Todesfälle. Die Daten der 28-Tage-Studie sind in Tabelle 1 dargestellt. Von den weiblich behandelten Mäusen starben 3 von 6 an einer AAA-Ruptur; eine am postoperativen Tag 20 und zwei am Tag 25 (Abbildung 6). Es gab keine AAA-Rupturen bei den behandelten Männchen. AAAs (definiert als eine Zunahme >50% des Aortendurchmessers zu Studienbeginn oder der Tod durch AAA-Ruptur) wurden bei allen behandelten Mäusen erfolgreich induziert (12 von 12). Nach 28 Tagen betrug der durchschnittliche AAA-Durchmesser der behandelten Männchen 2,86 ± 0,31 mm, mit einer durchschnittlichen prozentualen Veränderung von 257 ± 54 %, während die AAA-Durchmesser der überlebenden behandelten weiblichen Mäuse 3,60 ± 1,87 mm betrugen, mit einer durchschnittlichen prozentualen Veränderung von 417 ± 286 % (Abbildung 7). Scheinmäuse zeigten relativ keine Veränderung der Aortendurchmesser.
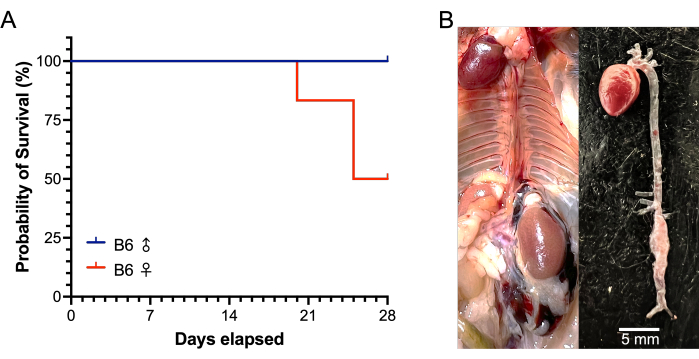
Abbildung 6: Überleben von männlichen und weiblichen B6-Mäusen während eines 28-Tage-Elastase/BAPN-Modells von AAA. (A) Bei 3 der 6 behandelten weiblichen Mäuse trat eine AAA-Ruptur auf (eine Maus nach 20 Tagen, dann zwei Mäuse nach 25 Tagen), während es bei den 6 behandelten männlichen Mäusen nach 28 Tagen keine Rupturen gab. (B) Repräsentative Bilder bei der Autopsie einer weiblichen Maus, die an einer AAA-Ruptur starb. Die AAA-Ruptur wird durch ein großes retroperitoneales Hämatom (links) und das Vorhandensein eines infrarenalen AAA mit einem Wanddefekt (rechts) demonstriert. Abkürzungen: BAPN = ß-Aminopropionitril; AAA = Bauchaortenaneurysma. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
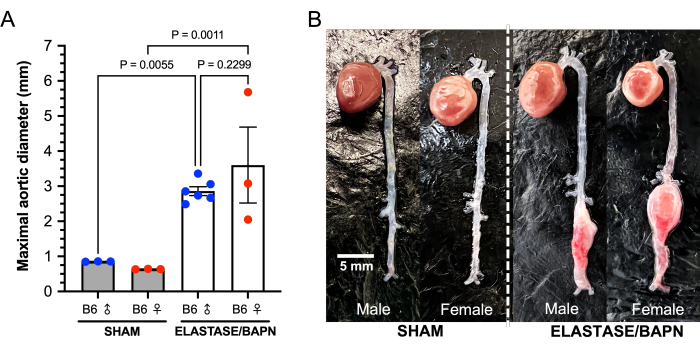
Abbildung 7: Maximale Aortendurchmesser von Elastase/BAPN- und Schein-B6-Mäusen nach 28 Tagen. (A) Behandelte Mäuse weisen nach 28 Tagen signifikant größere infrarenale Durchmesser auf als Scheinmäuse. (B) Die Kombination von Elastase und BAPN führt sowohl bei männlichen als auch bei weiblichen B6-Mäusen erfolgreich zu großen infrarenalen AAAs. Abkürzungen: BAPN = ß-Aminopropionitril; AAA = Bauchaortenaneurysma. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| 86 männlich Sham | 86 weiblich Sham | 86 männliche Elastase/8APN | 86 weibliche Elastase/8APN | |||
| Anzahl der Mäuse | 3 | 3 | 6 | 6 | ||
| Alter (Wochen) | 22,3 ± 0,0 | 22,7 ± 0,7 | 23,1 ± 0,2 | 23,2 ± 0,2 | ||
| Gewicht (g; bei der Operation) | 36,3 ± 2,5 | 23,7 ± 1,2 | 32,8 ± 1,7* | 23,7 ± 0,8 | ||
| Durchmesser der Aorta vor der Behandlung (mm) | 0,89 ± 0,02 | 0,75 ± 0,04 | 0,81 ± 0,07 | 0,73 ± 0,09 | ||
| Durchmesser der Aorta nach der Behandlung (mm) | 0,90 ± 0,03 | 0,73 ± 0,01 | 1,15 ± 0,03** | 0,98 ± 0,12** | ||
| Prozentuale Veränderung nach 5-minütiger Behandlung (%) | 0,5 ± 4,4 | -2,8 ± 5,3 | 43,4 ± 10,2*** | 33,6 ± 4,5*** | ||
| AAA-Inzidenz (%) | 0 / 3 | 0 / 3 | 6 / 6 | 6 / 6 | ||
| AAA reißt um 28 Tage | 0 / 3 | 0 / 3 | 0 / 6 | 3 / 6 | ||
| Überlebenszeit bis zu 28 Tage | 3 / 3 | 3 / 3 | 6 / 6 | 3 / 6 | ||
| Maximaler Aortendurchmesser nach 28 Tagen (mm) | 0,85 ± 0,01 | 0,64 ± 0,01 | 2,86 ± 0,31* | 3,60 ± 1,87** | ||
| Prozentuale Veränderung des Aortendurchmessers nach 28 Tagen (%) | -4 ± 2 | -16 ± 2 | 257 ± 54* | 417 ± 286** | ||
Tabelle 1: Ergebnisse eines 28-Tage-Modells des Elastase/BAPN-Mausmodells von AAA. Die Daten sind mittlere ± SD. *P<0,05, **P<0,005, ****P<0,0001 im Vergleich zu Scheinproben des gleichen Geschlechts mittels Einweg-ANOVA Fischer-Test. Abkürzungen: BAPN = ß-Aminopropionitril; AAA = Bauchaortenaneurysma.
Diskussion
Das Verständnis der komplexen Pathophysiologie der AAA ist entscheidend für die Verbesserung der Behandlung von Aortenaneurysmaerkrankungen. Während neuere Strategien aktiv entwickelt werden, um die chirurgischen Ergebnisse zu verbessern, sind AAAs in unserer alternden Gesellschaft nach wie vor weit verbreitet und Aneurysmarupturen sind nach wie vor eine der häufigsten Todesursachen in den Vereinigten Staaten10. Daher rechtfertigt der ungedeckte Bedarf an AAA-Erkennungs-, Präventions- und Behandlungsstrategien weitere grundlegende Aneurysmaforschungen11.
Tiermodelle, die die Merkmale und Verhaltensweisen menschlicher AAAs genau und effizient rekapitulieren, sind für mechanistische Studien der Aneurysma-Pathophysiologie und die Identifizierung potenzieller therapeutischer Ziele unerlässlich. Während aktuelle Tiermodelle die wichtigsten Aspekte der aneurysmatischen Veränderungen, die bei menschlichen Krankheiten auftreten, nachahmen können, repräsentiert kein einzelnes Modell die wahre Komplexität menschlicher AAAs vollständig. Derzeit sind Mäuse die am weitesten verbreitete Spezies für die AAA-Modellierung von Tieren. Forscher sollten die verschiedenen Stärken und Schwächen jedes Mausmodells für ihre jeweilige Aneurysmastudie berücksichtigen, wie sie in Übersichtsarbeiten von Daugherty et al. und Busch et al. fachmännisch beschrieben wurden12,13.
Die Verwendung von Elastase zur Induktion von AAA bei Nagetieren wurde erstmals 1990 von Anidjar et al. beschrieben14. Die Perfusion der Aorta mit porziner Pankreas-Elastase unter Verwendung einer Spritzenpumpe erzeugt eine anfängliche Dilatation zwischen etwa 50 % und 70 %, und die erweiterten Segmente weisen günstige ähnliche pathologische Merkmale menschlicher AAAs auf, wie z. B. mediale Degeneration und adventitielle Entzündung. Das klassische Perfusionsmodell ist jedoch wohl das technisch anspruchsvollste Aneurysmamodell, und die Aneurysmen, die typischerweise in der zweiten Woche gebildet werden, beginnen sich danach allmählich aufzulösen. Bhamidipati et al. zeigten dann im Jahr 2012, dass die adventielle Anwendung von Elastase auch erfolgreich ähnliche Aneurysmen induzieren kann, die in Größe15 reproduzierbarer sind. Das topische Elastase-Modell ist ein weitaus weniger anspruchsvolles Modell, das in der Aneurysmaforschung weit verbreitet ist. Weitere Methoden und Vorteile des topischen Elastasemodells werden im Methodenpapier von Xue und Kollegendiskutiert 16.
Das Elastase/BAPN-Modell der murinen AAA wurde 2017 von Lu und Kollegen entwickelt8. Die Einführung von Trinkwasser mit 0,2 % BAPN verbesserte viele der Kritikpunkte am klassischen topischen Elastase-Modell und führt nun zu Aneurysmen, die sich kontinuierlich bis zum Punkt der AAA-Ruptur ausdehnen. In ihrer Studie aus dem Jahr 2017 zeigten sie, dass Mäuse in der mit Elastase/BAPN behandelten Gruppe signifikant höhere AAA-Bildungsraten aufwiesen als in der Elastase-Gruppe (93 % vs. 65 %, P < 0,01), bei denen es sich ebenfalls um AAAs im fortgeschritteneren Stadium handelte. Über einen Zeitraum von 100 Tagen dehnten sich die AAAs in der Elastase/BAPN-Gruppe weiter auf >800 % des Ausgangsdurchmessers aus und bildeten einen intraluminalen Thrombus (53,8 %), wobei 46,2 % vor Ende des Experiments spontan rupturierten. Dieses Modell hat es Forschern ermöglicht, Faktoren zu untersuchen, die das Fortschreiten und die Stabilität des Aneurysmas im Laufe der Zeit beeinflussen können.
Berman et al. untersuchten das Elastase/BAPN-Modell weiter, indem sie die Konzentration der topischen Elastase, die Studiendauer, den Zeitpunkt der BAPN-Verabreichung und den Einfluss des Tiergeschlechts variierten9. Die Behandlung mit 5 μl höher konzentrierter Elastase (5 mg/ml oder 10 mg/ml) führte über 56 Tage zu größeren Aneurysmen als 2,5 mg/ml. Die Prävalenz der intraluminalen Thrombusbildung hing auch von der Elastasekonzentration ab, die bei 28,6 % der mit 5 mg/ml behandelten Mäusen und bei 62,5 % der mit 10 mg/ml behandelten Mäuse auftrat. Sie zeigten auch, dass das Elastase/BAPN-Modell Aneurysmen bei weiblichen Mäusen induzieren kann. Obwohl nur wenige weibliche Mäuse untersucht wurden (n=5), fanden sie heraus, dass die Aneurysmen bei weiblichen Mäusen anfälliger für Rupturen waren (2 von 5 Mäusen) und nach 56 Tagen signifikant größer waren als bei männlichen AAAs.
In diesem Artikel wollen wir eine Methode entwickeln, um eine der größten Einschränkungen der chirurgischen Modellierung zu beheben, nämlich die Variation des chirurgischen Verfahrens. Ohne einen klaren Konsens über den Grad der Dissektion und den Bereich der Aorta, der mit Elastase behandelt wird, könnten die Ergebnisse dieses Modells zwischen Tieren, Forschern und Institutionen dramatisch variieren. Wir haben zahlreiche anatomische Unterschiede zwischen Mäusen beobachtet, einschließlich der Anzahl und Größe der Lendenarterien und Venen sowie der Lage der IMA, der Abnahme der linken Gonadenvene, unter anderem, was einschränkend sein kann, wenn versucht wird, nur einen Teil oder ein bestimmtes Segment der infrarenalen Aorta zu behandeln. Hier zeigen wir, dass das zirkumferentielle Präparieren der gesamten Länge der infrarenalen Aorta von der linken Nierenarterie proximal zur Aortenbifurkation distal dazu beiträgt, trotz anatomischer Unterschiede reproduzierbare Grade der Aortenfreilegung zu erzielen und gleichzeitig den Erfolg der Aneurysma-Induktion zu erhöhen und dem Bediener klare Grenzen zu setzen. Darüber hinaus neigen die Größe und die vordere Position der IVC dazu, einen Großteil der Aorta abzudecken, was sich auf die Menge der behandelten Aorta auswirken kann, wenn sie nicht von der IVC isoliert wird. Während es notwendig ist, die retroperitoneale Faszie zu entfernen, um die Aorta freizulegen, ist es wichtig, das Bindegewebe der Adventitia nicht vollständig von der Aorta abzutrennen und eine der Medienschichten freizulegen, da dies typischerweise zu einem Bruch während der 5-minütigen Elastase-Inkubationszeit führt. Dies könnte als zusätzliche interne Kontrolle bis zum Grad der Dissektion mit diesem Modell dienen, kann jedoch bei der Einführung dieses Modells eine frustrierende Lernkurve sein. Der Bediener lernt außerdem Bereiche mit höherem Risiko kennen (Abbildung 4), die während der Operation leicht verletzt werden und zu unkontrollierbaren Blutungen führen können.
Es ist zwar wichtig, dass die Verfahrensschritte dieses Modells konsistent sind, aber die Dauer der Studie und der Zeitpunkt der Intervallsonographie können je nach Forschungsziel variieren. Die Aortendilatation beginnt unmittelbar mit der Elastase-Anwendung, doch Studien, die dieses Modell verwenden, folgen Mäusen in der Regel 28 Tage nach der Operation7, wie in diesem Beispielexperiment. Eine Verlängerung der Studiendauer sollte in Betracht gezogen werden, wenn fortgeschrittene AAAs, langfristiges Wachstum, intraluminale Thrombusbildung oder Ruptur untersucht werden.
Zusätzliche perioperative Maßnahmen, wie die Aufrechterhaltung der Körpertemperatur und des Hydratationsstatus der Tiere, können dazu beitragen, das Überleben der Tiere bei diesem invasiven Verfahren zu verbessern. Die Verwendung eines Heizkissens während der Operation und die Unterbringung in einem warmen Aufwachkäfig können helfen, Unterkühlung zu vermeiden. Kochsalzlösung sollte erwärmt werden, bevor sie zur Spülung der Bauchhöhle verwendet wird. Ein subkutaner Flüssigkeitsbolus direkt nach der Operation kann unmerkliche Flüssigkeitsverluste während der Operation ausgleichen und dem Tier helfen, während der unmittelbaren Erholungsphase eine ausreichende Flüssigkeitszufuhr aufrechtzuerhalten. Bei sorgfältiger Gewebehandhabung und einem konsequenten methodischen Ansatz kann das Elastase/BAPN-Modell von einem erfahrenen Bediener zwischen 30 min und 45 min pro Maus durchgeführt werden und zuverlässig AAA mit sehr geringen perioperativen Komplikationen produzieren.
Unsere Ergebnisse zeigen, dass die Kombination von BAPN zusätzlich zur zirkumferentiellen Dissektion der infrarenalen Aorta vor der Elastase-Applikation große, kontinuierlich expandierende AAAs mit größeren Durchmessern und Rupturinzidenz in kürzeren Zeiträumen erzeugt. In diesem Experiment wurden AAAs bei allen männlichen (6 von 6) und weiblichen (6 von 6) Mäusen, die mit aktiver Elastase behandelt wurden, erfolgreich induziert. Eine 5-minütige Elastase-Exposition führte zu einer sofortigen Vergrößerung des Aortendurchmessers um etwa 30-40%, was hilfreich ist, um eine erfolgreiche und konsistente Elastase-Anwendung in den Behandlungsgruppen zu bestätigen. Ähnlich wie Berman et al. haben wir gezeigt, dass dieses Modell AAAs bei weiblichen Mäusen induzieren kann, die auch eine stärkere Rupturreaktion als männliche Mäuse aufweisen. Die Hälfte der weiblichen Mäuse (3 von 6) riss innerhalb von 28 Tagen, verglichen mit 0 von 6 der männlichen Mäuse, jedoch wiegen weibliche Mäuse weniger als männliche. Männliche Mäuse zeigten eine Zunahme des AAA-Durchmessers um 257 % im Vergleich zu -4 % der männlichen Kontrollen, während die überlebenden Weibchen eine Zunahme des Durchmessers um 417 % zeigten, verglichen mit -16 % der weiblichen Kontrollen. Die Aortendurchmesser unterschieden sich nach 28 Tagen nicht signifikant zwischen den überlebenden männlichen und weiblichen behandelten Mäusen, was auf die höhere Anzahl von Rupturen in der weiblichen Gruppe zurückzuführen ist. Wir spekulieren, dass die Scheinmäuse am Ende der Studie kleinere Aortendurchmesser aufweisen, da die Aorta dazu neigt, sich während der ersten Dissektion leicht zu erweitern und dann nach 28 Tagen Narbengewebe zu bilden.
Das Elastase/BAPN-Modell weist gewisse Einschränkungen auf. Die zirkumferenzielle Dissektion der Aorta erfordert feine chirurgische Fähigkeiten, trägt jedoch dazu bei, die Replizierbarkeit und den Grad der Aneurysma-Induktion zu verbessern. Ähnlich wie beim topischen Elastase-Modell gibt es auch bei der Elastase-Enzymaktivität einen Batch-Effekt, was daher, wie bereits erwähnt, wichtig ist, um die gleiche Flasche Elastase für alle Tiere in einem bestimmten Experiment zu verwenden. Während die Inzidenz von intraluminalen AAA-Thromben und -Rupturen mit der Zeit und dem Schweregrad des Aneurysmas zunimmt, sind diese in diesem Modell weder garantiert noch vollständig vorhersagbar.
Zusammenfassend lässt sich sagen, dass das Elastase/BAPN-Modell sowohl bei männlichen als auch bei weiblichen Mäusen große, echte infrarenale AAAs produziert, die sich im Laufe der Zeit progressiv ausdehnen, einen intraluminalen Thrombus bilden und rupturieren können. Diese Stärken dieses Mausmodells tragen dazu bei, einige der Verhaltensweisen und Merkmale von Aneurysmen beim Menschen besser zu rekapitulieren. Obwohl es technisch schwierig ist, kann eine sorgfältige und gründliche Dissektion der Aorta die aneurysmatische Reaktion verstärken. Derzeit ist die Elastase/BAPN-Methode ein fortschrittliches Modell zur Untersuchung von infrarenalen Bauchaortenaneurysmen.
Offenlegungen
Die Autoren dieses Manuskripts haben keine Interessenkonflikte zu erklären.
Danksagungen
Diese Untersuchung wurde vom National Heart Lung and Blood Institute (NHLBI) der National Institutes of Health (NIH) unter der Nummer 1R01HL149404-01A1 (BL) und dem Ruth L. Kirschstein National Research Service Award T32 HL 007936 an das Cardiovascular Research Center (JB) der University of Wisconsin-Madison unterstützt. Die Abbildungen wurden mit Biorender.com erstellt oder bearbeitet. Die statistische Analyse wurde mit der Software GraphPad Prism 10 durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.5 L induction chamber | Kent Scientific Corporation | SOMNO-0530XXS | anesthesia induction chamber |
| 0.9% sodicum chloride injection, USP, 20 mL | Hospira | NDC 0409-4888-03 | normal saline |
| 3 mL syringe Luer-Lok Tip with BD PrecisionGlide Needle 22 G x 3/4 | BD | REF 309569 | syringe, 22 G needle |
| 3-Aminopropionitrile Fumarate | TCI | A0796 | BAPN |
| 3-Aminopropionitrile Fumarate salt | Sigma-Aldrich | A3134-25G | BAPN |
| Avant Delux gauze sponges, 2" x 2" 4-Ply | Medline | NON26224 | gauze sponges |
| Balding clipper | Whal Clipper Corporation | 8110 | hair clippers |
| betadine surgical scrub (povidone-iodine, 7.5%) | Avrio | NCD 67618-154-16 | betadine surgical scrub |
| blunt forceps | ROBOZ | RS-5130 | blunt forceps |
| Buprenorphine ER-lab | ZooPharm | BERLAB0.5 | buprenorphine |
| carprofen | Norbrook | NDC 55529-131-11 | carprofen |
| CASTROVIEJO 5.75" straight with lock | ROBOZ | RS-6412 | Castroviejo needle driver |
| cotton tipped wood applicators, 6" | Dynarex | No. 4302 | cotton tipped wood applicators |
| DESMARRES 5.5' rectractor | ROBOZ | RS-6672 | skin rectractor |
| digital caliper, 0-150 mm | World Precision Instruments | 501601 | digital caliper |
| DPBS (1x) | Gibco | 14190-144 | DPBS |
| Elastase from porcine pancrease Type I | Sigma-Aldrich | E1250-10MG | elastase >4.0 units/mg protein |
| Ethanol 200 proof | Decon Labs, Inc | 2701 | ethanol diluted to 70% |
| eye lube | Optixcare | 14716 | eye lube |
| Germinator 500 dry sterilizer | CellPoint Scientific, Inc | 5-1450 | dry bead sterilizer |
| heat therapy mat | Adroit Medical Systems | V016 | heat therapy mat |
| heat therapy pump | Adroit Medical Systems | HTP-1500 | heat therapy pump |
| isoflurane, USP | Akorn Animal Health | NCD 59399-106-01 | isoflurane |
| L-10 pipette | Rainin | LTS 0.5-10 uL | pipette |
| Low profile anesthesia mask, small | Kent Scientific Corporation | SOMNO-0801 | anesthesia nose cone |
| micro dissector scissors | ROBOZ | RS-5619 | micro dissector scissors |
| microscope | Leica | S9i | microscope |
| Nii-LED high intensity LED illuminatorLED exertnal light | Nikon Instruments, Inc | 83359 NII-LED | external dissection light |
| nylon 5-0 monofilament, black non-absorbable suture | Oasis | MV-661-V | 5-0 nylon suture |
| polyisoprene surgical gloves, GAMMEX Non-Latex PI Micro, size 7.5 | Ansell | 20685975 | non-latex surgical gloves |
| Reflex 7 mm stainless steel wound clips | CellPoint Scientific, Inc | 203-1000 | wound clips |
| scale | Ohaus | Compass CR2200 | scale |
| SomnofFlo Accessory Kit | Kent Scientific Corporation | 10-8000-71 | tubing for electronic vaporizer |
| SomnoFlo electronic vaporizer | Kent Scientific Corporation | SF2992 | low-flow electronic vaporizer |
| SomnoPath Flow Diverter | Kent Scientific Corporation | SP1016 | flow diverter for electronic vaporizer |
| SS/45 sharp forceps | ROBOZ | RS-4941 | sharp forceps |
| surgical scissors | ROBOZ | RS-6010SC | surgical scissors |
| vessel forceps | Dumont | VES 0.35 | vessel forceps |
Referenzen
- Kent, K. C. Clinical practice. Abdominal aortic aneurysms. New Engl J Med. 371 (22), 2101-2208 (2014).
- Wanhainen, A., et al. European Society for Vascular Surgery Guidelines on the management of aorto-iliac abdominal aortic aneurysms. Eur J Vasc Endocasc Surg. 57 (1), 8-93 (2019).
- Shimizu, K., Mitchell, R. N., Libby, P. Inflammation and cellular immune responses in abdominal aortic aneurysms. Arterioscler Thromb Vasc Biol. 26 (5), 987-994 (2006).
- Shen, Y. H., et al. Aortic aneurysms and dissections series. ArteriosclerThromb Vasc Biol. 40 (3), e37-e46 (2020).
- Stanley, J. C., Veith, F., Wakefield, T. W. Current Therapy in Vascular and Endovascular Surgery E-Book. Elsevier Health Sciences. , (2014).
- Morgan, S., et al. Identifying novel mechanisms of abdominal aortic aneurysm via unbiased proteomics and systems biology. Front Cardiovasc Med. 9, 889994 (2022).
- Yin, L., Kent, E. W., Wang, B. Progress in murine models of ruptured abdominal aortic aneurysm. Front Cardiovasc Med. 9, 950018 (2022).
- Lu, G., et al. A novel chronic advanced stage abdominal aortic aneurysm murine model. J Vasc Surg. 66 (1), 232-242 (2017).
- Berman, A. G., et al. Experimental aortic aneurysm severity and growth depend on topical elastase concentration and lysyl oxidase inhibition. Sci Rep. 12 (1), 99 (2022).
- Deaths, percent of total deaths, and death rates for the 15 leading causes of death in 5-year age groups, by race, and sex. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/nchs/nvss/mortality/lcwk1.htm (2015)
- Dansey, K. D., et al. Epidemiology of endovascular and open repair for abdominal aortic aneurysms in the United States from 2004 to 2015 and implications for screening. J Vasc Surg. 74 (2), 414-424 (2021).
- Daugherty, A., Cassis, L. A. Mouse models of abdominal aortic aneurysms. Arterioscler Thromb Vasc Biol. 24 (3), 429-434 (2004).
- Busch, A., et al. Translating mouse models of abdominal aortic aneurysm to the translational needs of vascular surgery. JVS Vasc Sci. 2, 219-234 (2021).
- Anidjar, S., et al. Elastase-induced experimental aneurysms in rats. Circulation. 82 (3), 973-981 (1990).
- Bhamidipati, C. M., et al. Development of a novel murine model of aortic aneurysms using peri-adventitial elastase. Surgery. 152 (2), 238-246 (2012).
- Xue, C., Zhao, G., Zhao, Y., Chen, Y. E., Zhang, J. Mouse abdominal aortic aneurysm model induced by perivascular application of elastase. J Vis Exp. (180), e63608 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten