Method Article
局所エラスターゼと経口β-アミノプロピオニトリルの組み合わせによるマウスにおける高度な腹部大動脈瘤モデリング
要約
このプロトコルは、エラスターゼを腎下大動脈に直接適用し、飲料水を通じてβ-アミノプロピオニトリルを投与することの組み合わせにより、マウスの進行性腹部大動脈瘤をモデル化するための系統的な外科的アプローチを説明しています。
要約
腹部大動脈瘤 (AAA) の局所エラスターゼ マウス モデルは、β-アミノプロピオニトリル (BAPN) を補給した飲料水と組み合わせると強化され、ヒトの AAA を模倣した行動で真の腎下動脈瘤を確実に生成します。エラスターゼを腎下大動脈の外膜に局所的に塗布すると、大動脈壁の弾性層に構造的損傷を引き起こし、動脈瘤の拡張を開始します。.リジルオキシダーゼ阻害剤であるBAPNを共投与すると、コラーゲンとエラスチンの架橋が減少することにより、持続的な壁の変性が促進されます。この組み合わせにより、大きなAAAが徐々に拡大し、管腔内血栓を形成し、破裂する可能性があります。腎下大動脈セグメント全体を円周方向に分離するなどの外科的技術を改良することは、マウス間で異なるオペレーターや解剖学的に異なるにもかかわらず、ブタ膵臓エラスターゼの一貫した徹底的な適用のための手順を標準化するのに役立ちます。したがって、エラスターゼ/BAPN モデルは、マウスで AAA を外科的に誘導するための洗練されたアプローチであり、ヒトの動脈瘤をよりよく再現し、動脈瘤の成長と破裂リスクを研究する追加の機会を提供する可能性があります。
概要
動脈瘤は、健康な血管の直径1の50%を超える血管の病理学的拡張として定義されます。腹部大動脈瘤 (AAA) は、65 歳以上の男性の約 >5% の発生率で、高齢化人口でよく遭遇する状態であるにもかかわらず、AAA1 を治療するための指向性>治療戦略はありません。AAAの現在の管理は、大動脈の直径または成長率に基づく開腹手術または血管内手術のいずれかによるリスク因子の減少と外科的修復に限定されています2。AAAの最大のリスクは動脈瘤の破裂であり、治療しないと致命的であり、この緊急の状況での修復は死亡リスクを90%以上もたらす可能性があります1。
AAAの病態生理学は複雑で、多因子性であり、完全には理解されていません3。ヒトAAAの特徴には、炎症細胞の浸潤を伴う大動脈壁の真の動脈瘤拡張、管腔内血栓の存在、および最終的な破裂につながる進行性拡張が含まれます3,4。さらに、AAAは高齢と関連しており、男性:女性の性別が9:1で優勢であり、最も一般的には腎下大動脈5に発生します。動物におけるヒトAAAのすべての特徴と行動をモデル化することは、依然として進行中の課題です6。
現在のAAAモデリングは主にマウスで行われており、動脈瘤は一般的に、皮下移植浸透圧ポンプを介したアンジオテンシンII(AngII)注入、および大動脈7への塩化カルシウム(CaCl2)またはエラスターゼの直接適用の3つの方法のいずれかを使用して誘発されます。後者の方法では、ブタの膵臓エラスターゼ (PPE) が腎下大動脈の一部に適用され、チュニカ媒体の弾性ラメラ内のエラスチン繊維の酵素分解を引き起こします。この構造的損傷は、大動脈壁の弱体化と外向きの動脈瘤拡張をもたらします。ただし、局所エラスターゼのみを使用すると、比較的小さな腎下動脈瘤が生成され、時間の経過とともに徐々に拡大または破裂することはありません。最近では、Luらは、リシルオキシダーゼの不可逆的な阻害剤であるβ-アミノプロピオニトリル(BAPN)をエラスターゼ処理マウスに追加で投与することにより、このモデルを改良しました8。エラスチン繊維とコラーゲン繊維の架橋を防ぐことにより、BAPNサプリメントはエラスターゼで損傷した大動脈を破裂するまで徐々に拡張させます。さらに、エラスターゼ/ BAPNモデルは、局所エラスターゼモデルよりもAAAの発生率が高く、生成される動脈瘤も大きく、管腔内血栓8を含んでいます。
エラスターゼ/BAPN モデルでは、外科的解剖の程度と大動脈のエラスターゼへの曝露が、このモデルの成功と再現性に影響を与える可能性があります。この原稿では、BAPN飲料水の同時投与と局所エラスターゼの同時投与 全腎下大動脈セグメントの円周方向分離後の大動脈への適用により、再現性が向上し、動物間の解剖学的違いが説明され、AAA誘導率、動脈瘤サイズ、および破裂発生率が増加することを説明しています。この記事では、局所エラスターゼとBAPNを添加した水の組み合わせを使用して、マウスの進行性腹部大動脈瘤を確実に誘導するための標準化されたアプローチについて説明します。
プロトコル
動物プロトコルは、ウィスコンシン大学マディソン校の動物管理および使用委員会(M005792)によって承認されています。
1. 動物の飼育
- 標準的なメンテナンスチャウでマウスを育てます。成体マウスまたは若年成体マウス(生後8〜12週齢)を使用してください。
注:成体を使用すると、動物が完全に成熟し、大動脈径の変化が動物の成長に関連している可能性が制限されます。この研究では、手術時に22〜24週齢の雄と雌のC57BL / 6Jマウスを利用しました。Luらは、若年マウスと高齢マウスの間で動脈瘤反応に有意差は観察されなかった8。さらに、ほとんどの動脈瘤モデリングは雄マウスで行われるが、このモデルは雄マウスと雌マウスの両方でAAAを成功裏に誘導する9。 - 試験期間を決定し、動物を治療群または偽(対照)群に割り当てます。0.2% BAPN 飲料水を治療群マウスに投与し、活性エラスターゼを腎下大動脈に局所適用して手術を受けさせます。未処理の水を投与して動物を制御し、変性エララスターゼを大動脈下に適用して手術を受けさせます。.
2. B-アミノプロピオニトリル(BAPN)を添加した飲料水の開始
- 手術の2日前に、0.2%BAPN飲料水でマウスの治療を開始します。BAPN水を大量に調製し、4°Cの暗所で最大28日間保管します。BAPN水がマウスに与える前に、室温に達していることを確認してください。
注: BAPN 水は、研究期間中 7 日ごとにケージ内で交換することをお勧めします。
3. 手術当日 材料準備
- 手術用手袋を5 mm x 10 mmのストリップにカットし、後でエラスターゼで治療する前に大動脈を分離するために使用されます。サージカルドレープの中央に~1.5cm×3cmサイズの楕円形を切って、サージカルドレープを準備します。2インチ×2インチのガーゼを広げて半分にカットし、約2.5cm×10cmのガーゼを作り、後で腹部の内容物を引っ込めるときに使用します。すべての手術器具をオートクレーブ処理し( 材料の表を参照)、 図1の例に示すように無菌の手術野を設定します。
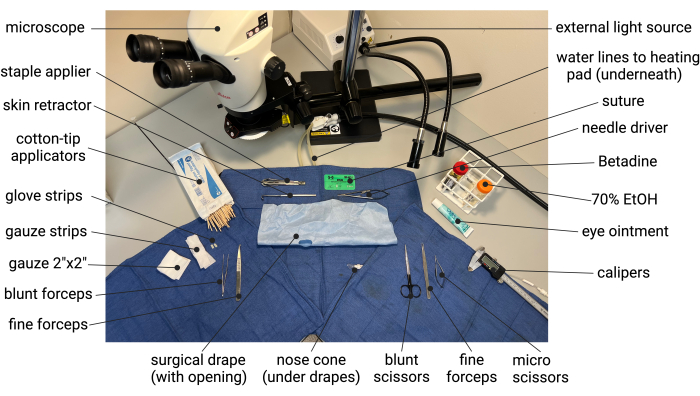
図1:AAAのエラスターゼ/BAPNマウスモデルの準備における無菌手術のセットアップ例。 略語:BAPN = ß-アミノプロピオニトリル;AAA = 腹部大動脈瘤。 この図の拡大版を表示するには、ここをクリックしてください。
- ヒートランプの下に清潔なケージを置き、生理食塩水をランプの近くに置いて体温(37°C)まで温めて、術後の回復ケージを準備します。ヒートランプが安全な位置にあることを確認し、リカバリーケージと生理食塩水が温まっているが、37°Cを超えないようにします。 ウォーターポンプをオンにして、加熱パッドに温水を循環させ始めます。
4.手術のための動物の準備
- マウスを誘導チャンバーに入れ、低流量の電子気化器を使用して 5% イソフルランを 200 mL/分で麻酔します。麻酔をかけながら、各マウスの体重を量り、鎮痛のために0.6 mg / kgのブプレノルフィンERと20 mg / kgのカルプロフェンを皮下投与します。.電動ヘアトリマーを使用して、下腹部からキシポイド突起の下腹部まで、腹部の毛皮をクリップします。ガーゼまたはラボ用ワイプを使用して、余分な髪をブラッシングします。マウスをケージに戻し、鎮痛効果が出るまで少なくとも20分待ってから手術を進めます。
- 鎮痛剤を投与してから少なくとも20分後、マウスを麻酔導入チャンバーに入れ、マウスが鎮静するまで、低流量電子気化器を使用して5%イソフルランを200 mL / minで再度送達します。.
- 鎮静剤を投与したマウスを誘導室から取り出し、手術野に仰向けに置きます。アイジェルを塗布し、ノーズコーンをサージカルテープで固定します。送達された吸入イソフルランを50mL / minで1〜2%の維持率に減らします。.マウスの前足と後足をサージカルテープで固定します。
- マウスの下腹部に膀胱がないか調べます。親指、人差し指、中指の間の膀胱にそっと外圧を加えて、排尿を誘発します。その間、ガーゼを使用して尿を吸い取ります。
注:術野を汚染しないように注意してください。 - ヨウ素ベースまたはクロルヘキシジンベースのスクラブと綿先の綿棒で70%アルコールを塗布して、腹部の消毒を開始します。腹部の中央から始めて、円を描くように3倍外側に働きます。アプリケーション間で領域を短時間乾かします。
- 麻酔が適切であることを確認するために、つま先をつまむ反応がないことを確認してください。ノーズコーンと手足が固定されていることを確認してください。マウスに外科用ドレープをかぶせ、開口部を外科的に準備した腹部の真上に置きます。
メモ: 汚染の可能性を避けるために、ドレープをマウス上でドラッグしないでください。
5. AAAの外科的導入
- 腹腔に入る:
- 手を洗い、清潔なニトリルまたは滅菌手術用手袋を着用してください。手術場に接触する前に、必ず手袋に70%のEtOHをスプレーし、手袋をはめた手を乾くまでこすり合わせてください。
- 鈍い鉗子を使用して、腹部の正中線の皮膚をテントで覆います。手術用ハサミを使用して皮膚に小さな傷をつけ、切開部を縦方向に約2〜3cmの長さに伸ばします。
- 鉗子を使用して直腸筋を持ち上げ、半透明の白筋線を特定します。はさみを使用して、リネアアルバから腹腔に入り、次にリネアアルバに沿って近位および遠位に伸ばします。
- 腹部大動脈の露出:
- ガーゼのストリップと2つの綿棒を温めた生理食塩水で湿らせます。ガーゼの一方の端を半分までしっかりと転がして腹部のロールを作成し、たっぷりとした尾を残します。
- スキンリトラクターを使用して、右腹壁を引っ込めます。
- 湿らせた綿棒を使用して、小腸と大腸を左上象限まで優しく掃くことにより、右内側内臓回転を行い、大動脈と下大静脈(IVC)を視覚化します。腹部をロールして腸を視界から外します–ガーゼの丸められた端を腸の下に押し込み、次に尾の端を体の周りに出して腸を優しく包みます。ガーゼの裾にやさしい張力をかけて、腸を視界から遠ざけます。図2Aに示すように、腹部ロールとスキンリトラクターを調整して、後腹膜器官の最適なビューを取得します。
注:腹部ロールは、腸を湿らせ、手術器具による不注意な損傷から保護するのに役立ちます。腸が乾燥するのを防ぐために、処置中はガーゼが湿ったままであることを確認してください。腸を無理に引っ込めると、上腸間膜動脈や腸管系のねじれを引き起こし、虚血性損傷を引き起こす可能性があるため、腸を引っ込めないように注意してください。また、最初に小腸を掃くときは、大腸と下肝(肝結腸靭帯)の間に薄い半透明の付着物があり、注意しないと肝臓のカプセルが簡単に引き裂かれて出血を引き起こす可能性があるので注意が必要です。引っ込め中にこの靭帯に張力がある場合は、はさみで鋭く分割します。
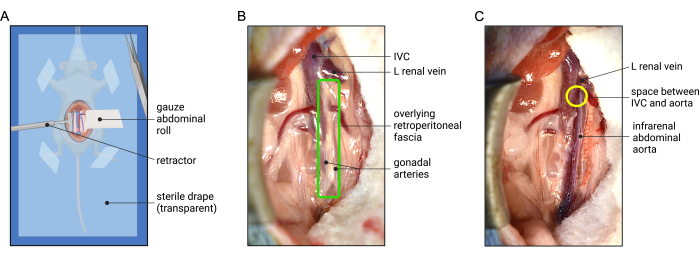
図2:腹部の収縮の表現とマウスの腎下大動脈の露出に最適な外科的見解 (A)ガーゼの腹部ロールの配置は、腹腔内臓器の収縮を助け、反対側の開創器は後腹膜の視覚化を提供するのに役立ちます。無菌の外科用ドレープ (動物の向きを示すために透明) を麻酔した動物の上に置いて、無菌性を維持します。(B)後腹膜筋膜(緑色のボックス)は、大動脈の前方に覆われています。(C)後腹膜筋膜の解剖後の腎下大動脈の例。IVCからの大動脈の分離は、大動脈と左腎静脈が前方に交差するときのちょうど遠位に位置するIVCとの間の潜在的な空間から開始することによって達成することができる(黄色の円)。略語:IVC =下大静脈。 この図の拡大版を表示するには、ここをクリックしてください。
- 腎下大動脈の円周解剖と分離:
- IVCと腎下大動脈が全見えであることを確認します。最初に後腹膜(RP)筋膜に入って分割することにより、大動脈の露出を開始します(図2B)。前腎下大動脈に沿って平行に走る性腺(精巣または卵巣)動脈を特定します(図2B および 図3)。鉗子を使用して、筋膜を性腺動脈間で鈍く分割し、縦方向に続けて大動脈を前方に露出させます(図2C)。
注:RP筋膜は、リンパ管と内臓神経叢を含む結合組織の薄くて半透明の層です。大動脈を露出させるためには、RP筋膜を通して解剖する必要があります。ただし、大動脈外膜の結合組織を通して解剖しないでください。.外膜(白い結合組織)の裂け目は媒体を露出させ(真っ赤に見えます)、エラスターゼが適用されると、大動脈はこの部位で破裂する可能性があります。 - 次に、IVCから腹部大動脈を分離し始めます。この解剖は、IVCと大動脈の間の小さな隙間から開始し、大動脈を横切る左腎静脈の下端のすぐ下にあります(図2C)。鉗子の先端を使用して、大動脈とIVCの間の結合組織繊維を穏やかに広げ、このレベルで大動脈の周りを円周方向に働き続けます。
注:IVCは非常に薄肉で、繊維状結合組織の細かい層によって大動脈に密着しています。IVCの取り扱いやIVCのクリーニングは極力避けるように注意してください。最初にIVCから大動脈の右側を解剖すると(周囲の筋肉組織から大動脈の左側を解剖する前に)、大動脈がIVCから「離れる」のに役立ちます。 - 大動脈とIVCの間の平面を単刀直入に解剖し続け、大動脈分岐部に向かって尾側に働きかけます。大動脈分岐部に到達したら、それ以上の遠位解離を停止します。
注:通常、腎下大動脈の中央部近くに位置し、IVCを横切って横方向に移動する下腸間膜動脈(IMA)の周囲を解剖する場合は、特に注意してください。 - 大動脈の右端がIVCから分離したら、左腎静脈のレベルまで近位に戻ります。.大動脈の左端の外側からRP筋膜を解剖し、大動脈が完全に分離されるまで円周方向に働きかけます。後腹膜解離の関連する解剖学については、 図3 を参照してください。
注:腰椎静脈と動脈の位置と数に大きなばらつきがあるため、大動脈の後ろを解剖することに注意してください。この解剖による出血のリスクが高い領域の参照については、 図4 を参照してください。 - 大動脈がIVCおよび周囲の筋肉組織から可能な限り円周方向に分離されていることを注意深く検査し、IMAと腰動脈によってつながれた大動脈セグメントの周りを慎重に解剖します。.
- 図5Aに示すように、大動脈の右端と左端に沿って手袋のストリップを置きます。IVCをできるだけ多くカバーするようにしてください。
- ハンドヘルドノギスを使用して、最も広い大動脈径を測定し、3つの測定値を記録します。測定の前後に、キャリパーの先端に70%EtOHをスプレーします。汚染を防ぐために、大動脈をキャリパーの先端に直接接触させないでください。
注意: キャリブレーションされたカメラ対応顕微鏡を使用した写真も利用できます。
- IVCと腎下大動脈が全見えであることを確認します。最初に後腹膜(RP)筋膜に入って分割することにより、大動脈の露出を開始します(図2B)。前腎下大動脈に沿って平行に走る性腺(精巣または卵巣)動脈を特定します(図2B および 図3)。鉗子を使用して、筋膜を性腺動脈間で鈍く分割し、縦方向に続けて大動脈を前方に露出させます(図2C)。
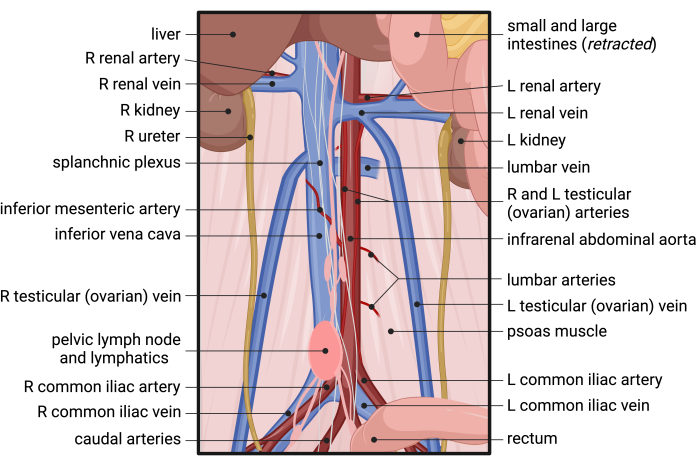
図3:マウスの下腹部、骨盤、および後腹膜への血液供給の解剖学的構造。 略語:R =右;L =左。 この図の拡大版を表示するには、ここをクリックしてください。
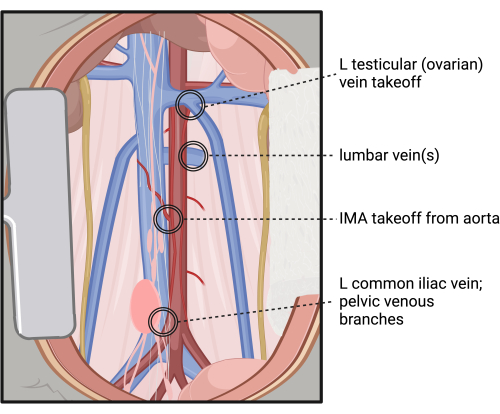
図4:後腹膜解離および腎下大動脈の円周的隔離中に損傷および出血のリスクが高い部位。 略語:L =左;IMA = 下腸間膜動脈。 この図の拡大版を表示するには、ここをクリックしてください。
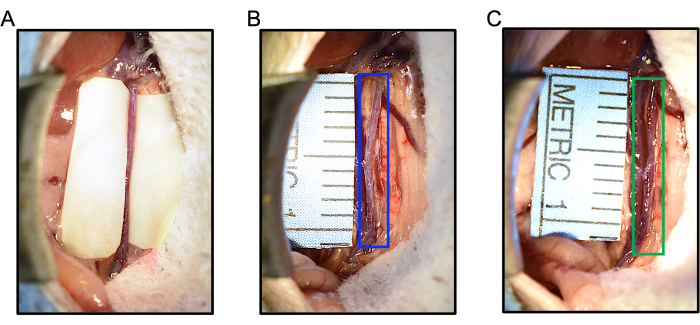
図5:エラスターゼ/BAPNマウスAAAモデル中のエラスターゼの適用または偽物に対する術中の反応 (A) 大動脈をエラスターゼに浸したまま、IVCと腸をエラスターゼへの曝露から保護するために、エラスターゼの適用前に大動脈の長さに沿って手袋のセグメントが配置されます (B) 変性エララスターゼの適用は大動脈の拡張を引き起こさない (青いボックス)。最大大動脈径はベースラインで 0.627 mm を測定し、5 分間の局所変性エラスターゼ後に 0.607 mm を測定しました。(C)エラスターゼの適用は、治療の5分後に大動脈拡張を引き起こします。この例では、大動脈(緑)が0.607 mmから0.953 mmに拡張し、直径が57%増加しました。略語:BAPN = ß-アミノプロピオニトリル;AAA = 腹部大動脈瘤。 この図の拡大版を表示するには、ここをクリックしてください。
- エラスターゼアプリケーション:
- 綿の先端の綿棒を使用して、大動脈から余分な血液や体液を軽くたたきます。
- 次に、大動脈の上に10mm×2mmの乾燥ガーゼを置きます。ピペットを使用して5μLのエラスターゼ(または変性エラスターゼを制御)を分注し、ガーゼと大動脈を飽和させます。手袋の部分を大動脈の周りにそっと折ります。
注:偽グループまたは対照グループで使用するための変性エラスターゼを調製するには、エラスターゼを100°Cで30分間煮沸します。 - エラスターゼが大動脈に作用するまで5分間待ちます。この潜伏期間中、必要に応じて、腹部ロールと皮膚リトラクターによって置かれた緊張の一部を解放します。
注: エラスターゼのバッチ効果により、研究者は、特定の研究内のすべての実験に同じボトルのエラスターゼを使用することをお勧めします。エラスターゼの新しいボトルごとに、(4週間前)早期破裂の圧倒的な数がないことを確認するために、用量反応を実行することをお勧めします。.エラスターゼの塗布時間は、エラスターゼへの反応に応じて4〜6分の間で調整することもできます。 - 5分後、腸の収縮をリセットし、手袋の部分を広げます。1 mLの温かい0.9%滅菌生理食塩水で腹腔を洗浄し、大動脈からガーゼと手袋片を慎重に取り除きます。.腹部の生理食塩水を10 cm x 10 cmのガーゼで吸収します。腹部の洗浄を合計3 x 3 mL繰り返します。
- ハンドヘルドキャリパーを使用して、エラスターゼ適用後の最も広い大動脈径を再測定し、3倍を記録します。偽および活性型エラスターゼによる治療への大動脈拡張の例については、 図5B、C を参照してください。
注:エラスターゼの前後の3つの測定値の平均を使用して、治療による大動脈径の変化率を計算できます。通常、エラスターゼ処理の直後には30~50%の顕著な拡張が見られ、これはエラスターゼが機能し、大動脈が適切に治療されたことを確認するのに役立ちます。大動脈の直径は、変性エラスターゼの適用によって変化しないか、わずかに小さく測定される場合があります(おそらくけいれんから)。.
- 腹腔の閉鎖:
- 腹部ロールを腸の下から体外に慎重に取り外します。必要に応じて、除去中に腹部のロールにくっつかないように、腸に追加の生理食塩水を適用します。.腸がピンク色に見え、適切に灌流されていることを確認してください。
注:腸を元の位置に戻す必要はありません。そうしようとすると、腸のねじれや内ヘルニアのリスクがあります。 - 実行中の5-0非吸収性モノフィラメント縫合糸を使用して腹部筋膜を再近似します。3〜4個のスキンステープルでスキンを閉じます。
- 腹部ロールを腸の下から体外に慎重に取り外します。必要に応じて、除去中に腹部のロールにくっつかないように、腸に追加の生理食塩水を適用します。.腸がピンク色に見え、適切に灌流されていることを確認してください。
6. 術後の動物のケア
- マウスをヒートランプ付きのリカバリーケージに入れます。ケージの温度が熱くなく、暖かくなっていることを確認してください。
- 0.9%生理食塩水の0.5〜1mLの皮下液ボーラスを投与します。.
- マウスが施設のプロトコルに従って活動するまで、温めたケージ内で ~20 分間自然に回復させた後、ハウジングケージに戻ります。
- 施設のプロトコルに従って、術後 1 日目の手術後 24 時間でカルプロフェン 20 mg/kg を投与し、毎日 3 日間継続します。
7. 大動脈測定と組織採取
- イソフルランと子宮頸部脱臼による安楽死に続いて、腹腔を再開します。胸骨を通して切開部を伸ばして胸部にアクセスします。右心房を切除し、左心室に10mLの冷たい1%DPBS溶液を2分間かけて灌流します。.肺、肝臓、脾臓を切除します。
注:腸を傷つけないように注意してください。腸内容物のこぼれは、組織分析に影響を与える可能性があります。 - 腹部大動脈を露出させ、上記のように腎下大動脈の最大直径を測定します。大動脈全体と心臓を解剖し続けます。心臓と大動脈が分離されたら、すべての動脈枝と総腸骨動脈を切断し、大動脈の短いセグメントを無傷のままにします。心臓と大動脈を、定規と画像の隣の対照的な背景に置きます。
8. データ分析とレポーティング
- 人為的ミスを考慮するために、ハンドヘルドノギスを使用する場合は、大動脈の直径をそれぞれ少なくとも3倍測定し、その直径を平均値として報告します。
- AAAは、健康な大動脈径が50%増加すると定義します。研究結果には、総大動脈直径と直径の変化率の両方を必ず含めてください。
結果
この研究では、22〜24週齢の雄と雌のC57BL / 6Jマウスが使用されました。腎下心筋を5μLのエラスターゼ酵素(6.9 mgタンパク質/ mL、6ユニット/ mgタンパク質)または変性エラスターゼで5分間処理しました。.エラスターゼで治療された雄マウスは、治療されていないベースライン大動脈直径と比較して、エラスターゼへの5分間の曝露後に大動脈直径が43.4%増加したことを示しましたが、治療された雌の大動脈は33.6%増加しました(P = 0.0342)。.偽物の大動脈径は、変性エラスターゼへの5分間の曝露で比較的変化を示さなかった(男性0.5%;女性-2.8%)。治療を受けた12匹と偽マウス6匹の間で外科的に関連する死亡はなかった。28日間の試験のデータを 表1に示します。治療を受けた雌マウスのうち、6匹中3匹がAAA破裂で死亡しました。術後 20 日目に 1 つ、25 日目に 2 つ (図 6)。治療を受けた男性の間でAAA破裂はありませんでした。AAA(ベースライン大動脈径の>50%の増加またはAAA破裂による死亡と定義)は、治療されたすべてのマウス(12匹中12匹)で成功裏に誘導されました。28日後、治療を受けた雄の平均単四径は2.86 ± 0.31 mmで、平均変化率は257±54%でしたが、生存した治療を受けた雌マウスのAAA直径は3.60 ± 1.87 mmで、平均変化率は417±286%でした(図7)。偽マウスは、大動脈径に比較的変化を示さなかった。
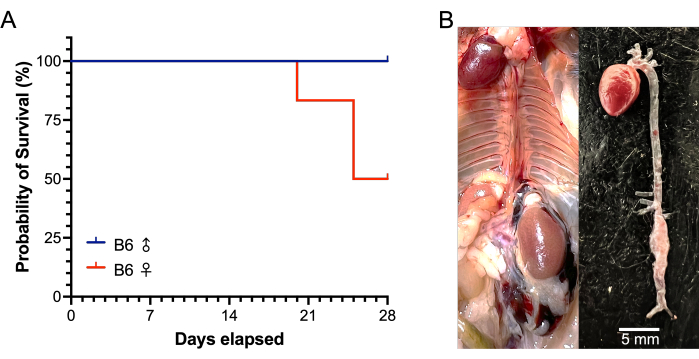
図6:AAAの28日間エラスターゼ/ BAPNモデル中のB6マウスの雄と雌の生存。 (A)AAA破裂は、治療した雌マウス6匹中3匹(20日で1匹、25日で2匹)で発生しましたが、28日で6匹の雄マウスに破裂はありませんでした。(B)AAA破裂により死亡した雌マウスの剖検時の代表的な画像。AAA破裂は、大きな後腹膜血腫(左)と壁欠損のある腎下AAAの存在(右)によって示されます。略語:BAPN = ß-アミノプロピオニトリル;AAA = 腹部大動脈瘤。 この図の拡大版を表示するには、ここをクリックしてください。
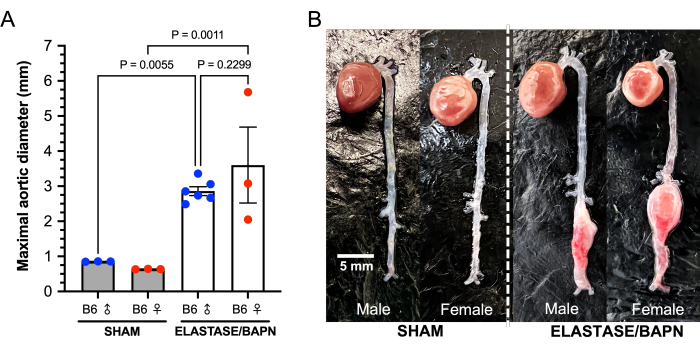
図7:28日目のエラスターゼ/BAPNマウスと偽の雄と雌のB6マウスの最大大動脈径 (A)治療したマウスは、偽マウスと比較して28日目で有意に大きな腎下径を示します。(B)エラスターゼとBAPNの組み合わせは、雄と雌の両方のB6マウスで大きな腎下AAAを成功裏に産生します。略語:BAPN = ß-アミノプロピオニトリル;AAA = 腹部大動脈瘤。 この図の拡大版を表示するには、ここをクリックしてください。
| 86 男性 シャム | 86人の女性シャム | 86オスエラスターゼ/ 8APN | 86 メス エラスターゼ/8APN | |||
| マウスの数 | 3 | 3 | 6 | 6 | ||
| 年齢(週) | 22.3 ± 0.0 | 22.7 ± 0.7 | 23.1 ± 0.2 | 23.2 ± 0.2 | ||
| 重量(g;手術時) | 36.3 ± 2.5 | 23.7 ± 1.2 | 32.8 ± 1.7* | 23.7 ± 0.8 | ||
| 治療前の大動脈径(mm) | 0.89±0.02 | 0.75±0.04 | 0.81±0.07 | 0.73 ± 0.09 | ||
| 治療後の大動脈径(mm) | 0.90±0.03 | 0.73 ± 0.01 | 1.15 ± 0.03** | 0.98 ± 0.12** | ||
| 5分治療後の変化率(%) | 0.5 ± 4.4 | -2.8 ± 5.3 | 43.4 ± 10.2*** | 33.6 ± 4.5*** | ||
| AAA発生率(%) | 0 / 3 | 0 / 3 | 6 / 6 | 6 / 6 | ||
| AAAは28日で破裂します | 0 / 3 | 0 / 3 | 0 / 6 | 3 / 6 | ||
| 28日までの生存期間 | 3 / 3 | 3 / 3 | 6 / 6 | 3 / 6 | ||
| 28日での最大大動脈径(mm) | 0.85±0.01 | 0.64±0.01 | 2.86 ± 0.31* | 3.60 ± 1.87** | ||
| 28日での大動脈径の変化率(%) | -4±2 | -16±2 | 257±54* | 417 ± 286** | ||
表1:AAAのエラスターゼ/ BAPNマウスモデルの28日間モデルの結果。. データは、SD±平均値です。*P<0.05、**P<0.005、***P<0.0001を、一元配置分散分析(ANOVA)による同性の偽と比較したものです。略語:BAPN = ß-アミノプロピオニトリル;AAA = 腹部大動脈瘤。
ディスカッション
AAAの複雑な病態生理学を理解することは、大動脈瘤疾患の管理を改善するために重要です。手術結果を改善するための新しい戦略が積極的に開発されていますが、AAAは依然として高齢化社会で蔓延しており、動脈瘤の破裂は依然として米国の主要な死因です10。したがって、AAAの検出、予防、および治療戦略における満たされていないニーズは、さらなる基礎的な動脈瘤研究を正当化します11。
ヒトAAAの特徴と行動を正確かつ効率的に再現する動物モデルは、動脈瘤の病態生理学の機構研究や潜在的な治療標的の特定に不可欠です。現在の動物モデルは、ヒトの疾患で発生する動脈瘤の変化の主要な側面を模倣することができますが、ヒトAAAの真の複雑さを完全に表す単一のモデルはありません。現在、マウスは動物のAAAモデリングで最も広く受け入れられている種です。研究者は、DaughertyらやBuschらのレビューで専門的に説明されているような、特定の動脈瘤研究のために、各マウスモデルのさまざまな長所と短所を考慮する必要があります12,13。
げっ歯類にAAAを誘導するためのエラスターゼの使用は、1990年にAnidjarらによって最初に記載されました14。シリンジポンプを使用してブタ膵臓エラスターゼで大動脈を灌流すると、およそ50%から70%の初期拡張が生じ、拡張したセグメントは、内側変性や外膜炎症など、ヒトAAAの同様の病理学的特徴を良好に示します。しかし、従来の灌流モデルは、間違いなく最も技術的に困難な動脈瘤モデルであり、通常は2週目までに形成される動脈瘤は、その後徐々に解消し始めます。その後、2012年にBhamidipatiらは、エラスターゼの外来性適用も、サイズ15でより再現性の高い同様の動脈瘤を成功裏に誘導できることを実証しました。はるかに難易度の低いモデルである局所エラスターゼモデルは、動脈瘤研究で広く採用されました。局所エラスターゼモデルのその他の方法論と利点については、Xue らによる方法論文16 で説明されています。
マウスAAAのエラスターゼ/ BAPNモデルは、2017年にLuと同僚によって開発されました8。0.2% BAPN 飲料水の導入により、従来の局所エラスターゼ モデルの多くの批評が改善され、現在では AAA 破裂のポイントまで継続的に拡大する動脈瘤が生成されています。2017年の研究では、エラスターゼ/BAPN処理群のマウスは、より進行したAAA群であるエラスターゼ群と比較して、AAA形成率が有意に高いことを示しました(93%対65%、P < 0.01)。100日間の研究期間にわたって、エラスターゼ/ BAPNグループのAAAは、ベースライン直径>800%まで拡張し続け、管腔内血栓(53.8%)を形成し、実験が終了する前に46.2%が自然に破裂しました。このモデルにより、研究者は動脈瘤の進行と安定性に時間の経過とともに影響を与える可能性のある要因を調査することができました。
Bermanらは、局所エラスターゼの濃度、研究期間、BAPN投与のタイミング、および動物の性別の影響を変化させることにより、エラスターゼ/ BAPNモデルをさらに調査しました9。5 μLの高濃度エラスターゼ(5 mg / mLまたは10 mg / mL)による処理では、56日間で2.5 mg / mLよりも大きな動脈瘤が生成されました。.管腔内血栓形成の有病率は、5 mg / mLで処理されたマウスの28.6%、10 mg / mLで処理されたマウスの62.5%で発生したエラスターゼ濃度にも依存していました。.また、エラスターゼ/BAPNモデルが雌マウスに動脈瘤を誘発できることも示しました。研究された雌マウスはごくわずかでしたが(n = 5)、雌の動脈瘤は破裂しやすく(5匹中2匹)、56日目に雄のAAAよりも有意に大きかったことがわかりました。
この論文では、外科的モデリングの最大の制限の1つである外科的処置のバリエーションに対処する方法を提供することを目指しています。剥離の程度とエラスターゼで治療された大動脈の面積について明確なコンセンサスが得られない場合、このモデルの結果は動物、研究者、および施設間で劇的に異なる可能性があります。マウス間では、腰部動脈や静脈の数や大きさ、IMAの位置、左性腺静脈の離陸など、数多くの解剖学的変化が観察されており、これは腎下大動脈の一部または特定の部分のみを治療しようとする場合に制限される可能性があります。ここでは、左腎動脈から大動脈分岐部まで遠位に左腎動脈下大動脈の全長を円周方向に解剖すると、解剖学的な違いにもかかわらず、動脈瘤誘導の成功率を高め、オペレーターに明確な境界を提供しながら、再現性のある程度の大動脈曝露を提供するのに役立つことを示しています。さらに、IVCのサイズとより前方の位置は大動脈の大部分を覆う傾向があり、IVCから分離されていない場合、治療される大動脈の量に影響を与える可能性があります。大動脈を露出させるためには後腹膜筋膜を切除する必要がありますが、大動脈から外膜の結合組織を完全に解剖して培地層を露出させないことが重要です。これは、このモデルによる解剖の程度に対する追加の内部制御として機能する可能性がありますが、このモデルを採用する際にはイライラする学習曲線になる可能性があります。オペレーターはさらに、手術中に簡単に怪我をし、制御不能な出血につながる可能性のあるリスクの高い領域(図4)を学びます。
このモデルの手続き手順が一貫していることは重要ですが、研究の期間とインターバル超音波検査のタイミングは、研究の目的によって異なります。大動脈拡張はエラスターゼの適用ですぐに始まりますが、このモデルを使用した研究では、この例の実験のように、手術後28日間マウスを観察するのが一般的です7。進行したAAA、長期成長、管腔内血栓形成、または破裂を研究する際には、研究期間の延長を考慮する必要があります。
動物の体温や水分補給状態の維持など、周術期のさらなる対策は、この侵襲的な処置の動物の生存率を向上させるのに役立ちます。手術中や温かいリカバリーケージへの装着時に温熱パッドを使用すると、低体温症を防ぐことができます。生理食塩水は、腹腔の洗浄に使用する前に温める必要があります。手術直後の皮下輸液ボーラスは、手術中の感覚に欠ける体液の損失を説明することができ、動物が即時の回復段階で適切な水分補給を維持するのに役立ちます。慎重な組織の取り扱いと一貫した系統的なアプローチにより、エラスターゼ/BAPNモデルは、経験豊富なオペレーターがマウスあたり30分から45分で実施でき、周術期合併症が非常に少ないAAAを確実に生成できます。
私たちの結果は、エラスターゼの適用前に腎下大動脈の円周方向の解剖に加えてBAPNの組み合わせが、より大きな、継続的に拡大するAAAを生成し、より大きな直径とより短い期間で破裂の発生率を生成することを示しています。この実験では、活性型エラスターゼで処理したすべての雄(6匹中6匹)および雌(6匹中6匹)にAAAを成功裏に誘導しました。5分間のエラスターゼ曝露により、大動脈径が約30〜40%即座に増加し、治療グループ間でのエラスターゼの適用が成功し、一貫していることを確認するのに役立ちます。Bermanらと同様に、このモデルは雌マウスでAAAを誘導できることを示しました。これは、雌マウスも雄よりも大きな破裂応答を示します。雌マウスの半数(6匹中3匹)は28日以内に破裂したのに対し、雄は6匹中0匹でしたが、メスマウスの体重はオスよりも軽いです。雄マウスはAAA直径の増加を257%示したのに対し、雄の対照群は-4%であったのに対し、生き残った雌は417%の直径増加を示したのに対し、雌の対照群は-16%であった。大動脈径は、雌群の破裂数が多かったため、28日目に生存した雄と雌の治療マウスの間で有意差はありませんでした。偽マウスは、最初の解剖中に大動脈がわずかに拡張する傾向があり、その後 28 日までに瘢痕組織を形成する傾向があるため、研究の終わりまでに大動脈径が小さくなると推測しています。
エラスターゼ/BAPNモデルには一定の制限があります。大動脈の円周方向の解剖には、優れた外科的技術が必要ですが、再現性と動脈瘤誘導の程度を改善するのに役立ちます。局所エラスターゼモデルと同様に、エラスターゼ酵素活性にもバッチ効果があり、これは前述のように、特定の実験ですべての動物に同じエラスターゼのボトルを利用することが重要です。AAA管腔内血栓と破裂の発生率は時間とともに増加し、動脈瘤の重症度は増加しますが、これらは保証されておらず、このモデルでは完全に予測可能ではありません。
要約すると、エラスターゼ/BAPNモデルは、雄マウスと雌マウスの両方で大きな真の腎下AAAを産生し、時間の経過とともに徐々に拡大し、管腔内血栓を形成し、破裂する可能性があります。このマウスモデルのこれらの長所は、ヒトの動脈瘤の行動と特性の一部をより適切に再現するのに役立ちます。技術的には困難ですが、大動脈を慎重かつ徹底的に解剖することで、動脈瘤の反応を増強することができます。現在、エラスターゼ/BAPN 法は、腎下腹部大動脈瘤を研究するための高度なモデルです。
開示事項
この原稿の著者は、宣言すべき利益相反はありません。
謝辞
この調査は、米国国立衛生研究所(NIH)の国立心肺血液研究所(NHLBI)の1R01HL149404-01A1(BL)と、ウィスコンシン大学マディソン心臓血管研究センター(JB)のRuth L. Kirschstein National Research Service Award T32 HL 007936の支援を受けました。フィギュアは Biorender.com で作成または編集されました。統計解析は、GraphPad Prism 10ソフトウェアを使用して実行しました。
資料
| Name | Company | Catalog Number | Comments |
| 0.5 L induction chamber | Kent Scientific Corporation | SOMNO-0530XXS | anesthesia induction chamber |
| 0.9% sodicum chloride injection, USP, 20 mL | Hospira | NDC 0409-4888-03 | normal saline |
| 3 mL syringe Luer-Lok Tip with BD PrecisionGlide Needle 22 G x 3/4 | BD | REF 309569 | syringe, 22 G needle |
| 3-Aminopropionitrile Fumarate | TCI | A0796 | BAPN |
| 3-Aminopropionitrile Fumarate salt | Sigma-Aldrich | A3134-25G | BAPN |
| Avant Delux gauze sponges, 2" x 2" 4-Ply | Medline | NON26224 | gauze sponges |
| Balding clipper | Whal Clipper Corporation | 8110 | hair clippers |
| betadine surgical scrub (povidone-iodine, 7.5%) | Avrio | NCD 67618-154-16 | betadine surgical scrub |
| blunt forceps | ROBOZ | RS-5130 | blunt forceps |
| Buprenorphine ER-lab | ZooPharm | BERLAB0.5 | buprenorphine |
| carprofen | Norbrook | NDC 55529-131-11 | carprofen |
| CASTROVIEJO 5.75" straight with lock | ROBOZ | RS-6412 | Castroviejo needle driver |
| cotton tipped wood applicators, 6" | Dynarex | No. 4302 | cotton tipped wood applicators |
| DESMARRES 5.5' rectractor | ROBOZ | RS-6672 | skin rectractor |
| digital caliper, 0-150 mm | World Precision Instruments | 501601 | digital caliper |
| DPBS (1x) | Gibco | 14190-144 | DPBS |
| Elastase from porcine pancrease Type I | Sigma-Aldrich | E1250-10MG | elastase >4.0 units/mg protein |
| Ethanol 200 proof | Decon Labs, Inc | 2701 | ethanol diluted to 70% |
| eye lube | Optixcare | 14716 | eye lube |
| Germinator 500 dry sterilizer | CellPoint Scientific, Inc | 5-1450 | dry bead sterilizer |
| heat therapy mat | Adroit Medical Systems | V016 | heat therapy mat |
| heat therapy pump | Adroit Medical Systems | HTP-1500 | heat therapy pump |
| isoflurane, USP | Akorn Animal Health | NCD 59399-106-01 | isoflurane |
| L-10 pipette | Rainin | LTS 0.5-10 uL | pipette |
| Low profile anesthesia mask, small | Kent Scientific Corporation | SOMNO-0801 | anesthesia nose cone |
| micro dissector scissors | ROBOZ | RS-5619 | micro dissector scissors |
| microscope | Leica | S9i | microscope |
| Nii-LED high intensity LED illuminatorLED exertnal light | Nikon Instruments, Inc | 83359 NII-LED | external dissection light |
| nylon 5-0 monofilament, black non-absorbable suture | Oasis | MV-661-V | 5-0 nylon suture |
| polyisoprene surgical gloves, GAMMEX Non-Latex PI Micro, size 7.5 | Ansell | 20685975 | non-latex surgical gloves |
| Reflex 7 mm stainless steel wound clips | CellPoint Scientific, Inc | 203-1000 | wound clips |
| scale | Ohaus | Compass CR2200 | scale |
| SomnofFlo Accessory Kit | Kent Scientific Corporation | 10-8000-71 | tubing for electronic vaporizer |
| SomnoFlo electronic vaporizer | Kent Scientific Corporation | SF2992 | low-flow electronic vaporizer |
| SomnoPath Flow Diverter | Kent Scientific Corporation | SP1016 | flow diverter for electronic vaporizer |
| SS/45 sharp forceps | ROBOZ | RS-4941 | sharp forceps |
| surgical scissors | ROBOZ | RS-6010SC | surgical scissors |
| vessel forceps | Dumont | VES 0.35 | vessel forceps |
参考文献
- Kent, K. C. Clinical practice. Abdominal aortic aneurysms. New Engl J Med. 371 (22), 2101-2208 (2014).
- Wanhainen, A., et al. European Society for Vascular Surgery Guidelines on the management of aorto-iliac abdominal aortic aneurysms. Eur J Vasc Endocasc Surg. 57 (1), 8-93 (2019).
- Shimizu, K., Mitchell, R. N., Libby, P. Inflammation and cellular immune responses in abdominal aortic aneurysms. Arterioscler Thromb Vasc Biol. 26 (5), 987-994 (2006).
- Shen, Y. H., et al. Aortic aneurysms and dissections series. ArteriosclerThromb Vasc Biol. 40 (3), e37-e46 (2020).
- Stanley, J. C., Veith, F., Wakefield, T. W. Current Therapy in Vascular and Endovascular Surgery E-Book. Elsevier Health Sciences. , (2014).
- Morgan, S., et al. Identifying novel mechanisms of abdominal aortic aneurysm via unbiased proteomics and systems biology. Front Cardiovasc Med. 9, 889994 (2022).
- Yin, L., Kent, E. W., Wang, B. Progress in murine models of ruptured abdominal aortic aneurysm. Front Cardiovasc Med. 9, 950018 (2022).
- Lu, G., et al. A novel chronic advanced stage abdominal aortic aneurysm murine model. J Vasc Surg. 66 (1), 232-242 (2017).
- Berman, A. G., et al. Experimental aortic aneurysm severity and growth depend on topical elastase concentration and lysyl oxidase inhibition. Sci Rep. 12 (1), 99 (2022).
- Deaths, percent of total deaths, and death rates for the 15 leading causes of death in 5-year age groups, by race, and sex. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/nchs/nvss/mortality/lcwk1.htm (2015)
- Dansey, K. D., et al. Epidemiology of endovascular and open repair for abdominal aortic aneurysms in the United States from 2004 to 2015 and implications for screening. J Vasc Surg. 74 (2), 414-424 (2021).
- Daugherty, A., Cassis, L. A. Mouse models of abdominal aortic aneurysms. Arterioscler Thromb Vasc Biol. 24 (3), 429-434 (2004).
- Busch, A., et al. Translating mouse models of abdominal aortic aneurysm to the translational needs of vascular surgery. JVS Vasc Sci. 2, 219-234 (2021).
- Anidjar, S., et al. Elastase-induced experimental aneurysms in rats. Circulation. 82 (3), 973-981 (1990).
- Bhamidipati, C. M., et al. Development of a novel murine model of aortic aneurysms using peri-adventitial elastase. Surgery. 152 (2), 238-246 (2012).
- Xue, C., Zhao, G., Zhao, Y., Chen, Y. E., Zhang, J. Mouse abdominal aortic aneurysm model induced by perivascular application of elastase. J Vis Exp. (180), e63608 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved