n- Butyllithium Titration
Überblick
Quelle: Vy M. Dong und Diane Le, Department of Chemistry, University of California, Irvine, CA
Dieses Experiment zeigt eine einfache Technik zu titrieren und erhalten eine genaue Konzentration des Organolithium Reagenz, n- Butyllithium (n- BuLi). Organolithium Reagenzien sind extrem Luft und Feuchtigkeit empfindlich und Sorgfalt getroffen werden, um die Qualität des Reagens zu erhalten, so dass es in einer Reaktion erfolgreich eingesetzt werden kann. Die n- BuLi Titration Experimente sollten regelmäßig durchgeführt werden, um genaue Konzentrationen vor dem Gebrauch in einer chemischen Reaktion zu erhalten. Anschließend zeigen wir die Zugabe von betitelten n- BuLi, Benzaldehyd.
Grundsätze
Organolithium Reagenzien sind Verbindungen, die eine C−Li Bindung und sehr starke Basen. Weil Organolithiums extrem Luft - und feuchtigkeitsempfindlicher sind, muss angemessene darauf geachtet werden, diese Reagenzien zu behandeln. Sie sind empfindlich gegenüber Säuren, ätzende und oft pyrophor. n- BuLi, ein Alkyllithium ist in der Regel bei niedrigen Temperaturen (unter 0 ° C) und als Lösung in Kohlenwasserstoffen wie Hexanes gespeichert. N- BuLi kann als Basis oder nucleophil je nach Reaktionsbedingungen verwendet werden. Darüber hinaus kann es bei Halogen-Lithium Austausch Reaktionen zur Aryl oder Vinyl Lithium-Reagenzien zu generieren, die sofort mit einem Elektrophil reagieren können. Darüber hinaus n- BuLi ist allgemein verwendet als Initiator bei der Polymerisation von Dienes in Elastomeren verwendet.
Titration ist ein verbreitetes quantitative analytische Verfahren zur Bestimmung einer unbekannten Konzentration eines Analyten durch eine bekannte Konzentration von einem Titriermittel hinzufügen, bis die Reaktion Abschluss erreicht, was durch eine Farbveränderung angezeigt wird. In diesem Experiment werden wir demonstrieren die Titration von n -BuLi und berechnen seine Konzentration mit Diphenylacetic Säure als das Titriermittel, die eine stabile, solide und leicht abgewogen werden kann. Bei der Reaktion von n- BuLi mit Diphenylacetic Säure, die Lösung wird eine dunkelgelbe Farbe am Endpunkt der Titration und Indikator ist also nicht erforderlich (Abbildung 1). Durch die präzise Messvolumen von n- BuLi verwendet, um die Diphenylacetic Säure zu verbrauchen, berechnen wir das Molarity der Reaktion. Dieses Experiment sollte dreimal wiederholt werden, um eine durchschnittliche Messung zu erhalten.
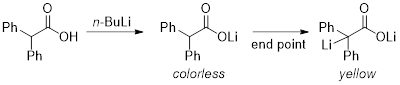
Abbildung 1: Reaktion der n- BuLi mit Diphenylacetic Säure.
Verfahren
1. Vorbereitung des Titriermittel
- Fügen Sie in eine Flamme getrocknet Rundboden-Kolben ausgestattet mit Stir Bar unter N2Diphenylacetic Säure (250 mg, 1.18 Mmol) und wasserfreies THF (5 mL).
2. Titration von n- BuLi
- Berechnen Sie die ungefähre Menge an n- BuLi-Lösung (Hexanes) benötigt, um die Diphenylacetic Säure zu verbrauchen. Mit einer Spritze langsam hinzufügeneine Lösung von n- BuLi tropfenweise. Das Reaktionsgemisch wird vorübergehend Vergilben und eine farblose Lösung mit jedem zurückfallen.
- Fügen Sie der Lösung von n- BuLi tropfenweise bis das Reaktionsgemisch eine dunkelgelbe Farbe bleiben weiterhin. Dies wird der Endpunkt der Reaktion sein.
- Wiederholen Sie die Titration 3 X zu einem durchschnittlichen Volumen von n- BuLi verwendet.
3. Berechnung des Molarity
- Die Maulwürfe von n- BuLi in der Titration verwendeten entsprechen die Maulwürfe der Diphenylacetic Säure in der Reaktion verwendet. Da die Maulwürfe von Diphenylacetic Säure ist bekannt, die Berechnung der Konzentration von n- BuLi ist durch folgende Gleichung gegeben: Mmol Diphenylacetic Säure/mL n- BuLi = Molarity n- BuLi-Lösung.
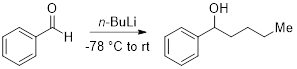
(4) Zugabe von n- BuLi, Benzaldehyd (Abbildung 2)
- Hinzufügen einer Flamme getrocknet Rundboden-Kolben ausgestattet mit Stir Bar unter N2, wasserfreies THF (30 mL) und Benzaldehyd (3 Mmol, 1 Äquiv). Abkühlen der Lösung auf −78 ° C.
- Hinzufügen von n- BuLi (1.1 Äquiv) und lassen Sie die warme Reaktion auf Raumtemperatur.
- Fügen Sie gesättigte NH4Cl (AQ, 10 mL), um die Reaktion zu stillen und die wässrige Schicht mit Diethylether (2 x 25 mL) zu extrahieren.
- Waschen Sie die kombinierten organischen Schichten mit Wasser (2 x 15 mL) und Sole (1 x 20 mL).
- Trocken mit Na2SO4, filtern, und konzentrieren sich die kombinierten organischen Schichten unter vermindertem Druck, das Produkt zu leisten.
Abbildung 2. Zugabe von n - BuLi, Benzaldehyd.
Ergebnisse
Repräsentative Ergebnisse für die Titration von n- BuLi für Verfahren 1-3
| Prozedurschritt | Farbe des Reaktionsgemisches |
| 1.1 | Farblos |
| 2.1 | Gelb, dann farblos |
| 2.2 | Tiefes gelb |
| 3.1 | 1.18 Mmol Diphenylacetic Säure/1 mL n- BuLi = 1,18 M n- BuLi in Hexanes |
Tabelle 1. Repräsentative Ergebnisse für Verfahren 1–3.
Anwendung und Zusammenfassung
In diesem Experiment haben wir bewiesen, wie man die Konzentration einer n- BuLi-Lösung mithilfe von Diphenylacetic Säure ermitteln. Wir haben auch eine Reaktion durchgeführt, durch das Hinzufügen von n- BuLi, Benzaldehyd.
Genaue Konzentrationen von n- BuLi sind wichtig für die erfolgreiche Bewerbung in einer Reihe von Reaktionen. n- BuLi ist allgemein verwendet in Lithium-Halogen-Austausch-Reaktionen, Aryllithium oder Vinyllithium Reagenzien vorzubereiten, die anschließend in C-C-Bindung bilden Reaktionen verwendet werden kann. Darüber hinaus kann es als Basis oder nucleophil, je nach Reaktionsbedingungen verwendet werden.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
n- Butyllithium Titration
Organic Chemistry II
48.1K Ansichten

Reinigung der Glaswaren
Organic Chemistry II
123.9K Ansichten

Nucelophile Substitution
Organic Chemistry II
99.6K Ansichten

Reduktionsmittel
Organic Chemistry II
43.2K Ansichten

Grignard-Reaktion
Organic Chemistry II
149.3K Ansichten

Dean-Stark-Falle
Organic Chemistry II
100.7K Ansichten

Ozonolyse von Alkenen
Organic Chemistry II
67.2K Ansichten

Organokatalyse
Organic Chemistry II
17.0K Ansichten

Palladiumkatalysierte Kreuzkupplungsreaktionen
Organic Chemistry II
34.7K Ansichten

Festphasen-Synthese
Organic Chemistry II
41.3K Ansichten

Hydrierung
Organic Chemistry II
49.7K Ansichten

Polymerisation
Organic Chemistry II
94.9K Ansichten

Schmelzpunkt
Organic Chemistry II
150.1K Ansichten

Infrarot-Spektroskopie
Organic Chemistry II
216.2K Ansichten

Polarimeter
Organic Chemistry II
100.3K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten