Infrarot-Spektroskopie
Überblick
Quelle: Vy M. Dong und Zhiwei Chen, Department of Chemistry, University of California, Irvine, CA
Dieses Experiment wird die Verwendung von Infrarot (IR) Spektroskopie (auch bekannt als Schwingungs-Spektroskopie) demonstrieren, um die Identität einer unbekannten Verbindung zu erhellen, durch die Ermittlung der Functional group(s) vorhanden. IR-Spektren erhält man über eine IR-Spektrometer mit der abgeschwächte Totalreflexion (ATR) Sampling-Technik mit einer ordentlich Probe des unbekannten.
Grundsätze
Eine kovalente Bindung zwischen zwei Atomen kann als zwei Objekte mit Massen m1 und m2 betrachtet werden, die mit einer Feder verbunden sind. Natürlich, diese Bindung erstreckt und mit eine bestimmte Schwingungsfrequenz komprimiert. Diese Frequenz 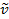 ergibt sich aus Gleichung 1, wo k ist die Kraftkonstante des Frühlings, c ist die Lichtgeschwindigkeit und µ ist die reduzierte Masse (Gleichung 2). Die Frequenz wird in der Regel gemessen in Spektrometern, die inverse Zentimeter (cm-1) ausgedrückt sind.
ergibt sich aus Gleichung 1, wo k ist die Kraftkonstante des Frühlings, c ist die Lichtgeschwindigkeit und µ ist die reduzierte Masse (Gleichung 2). Die Frequenz wird in der Regel gemessen in Spektrometern, die inverse Zentimeter (cm-1) ausgedrückt sind.
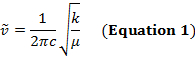
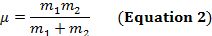
Aus Gleichung 1ist die Frequenz proportional zur Stärke der Feder und umgekehrt proportional zu den Massen der Objekte. Also C-H, N-H und O-H-Bindungen haben höhere Frequenzen als C-C und C-O-Bindungen, dehnen, da Wasserstoff eine leichte Atom ist. Doppel- und Dreifachbindungen können als stärkere Federn betrachtet werden, so dass eine C-O-Doppelbindung Dehnung häufiger als eine einzelne Bindung C-O hat. Infrarot-Licht ist elektromagnetische Strahlung mit Wellenlängen von 700 nm bis 1 mm, was die relative Klebkräfte entspricht. Wenn ein Molekül Infrarot-Licht mit einer Frequenz, die die natürliche Schwingungsfrequenz einer kovalenten Bindung entspricht absorbiert, erzeugt die Energie aus der Strahlung eine Erhöhung der Amplitude der Schwingung Anleihe. Wenn die Elektronegativitätsdifferenz (die Tendenz, Elektronen zu gewinnen) der beiden Atome in einer kovalenten Bindung sind sehr unterschiedlich, eine Ladungstrennung auftritt, die Ergebnisse in ein Dipolmoment. Beispielsweise in eine C-O-Doppelbindung (Carbonylgruppe) Zeit die Elektronen mehr um das Sauerstoffatom als das Kohlenstoffatom weil Sauerstoff mehr wissenschaftlich als Carbon ist. Daher gibt es eine net Dipolmoment wiederum eine negative Partialladung auf Sauerstoff und eine positive Partialladung auf Kohlenstoff. Auf der anderen Seite muss eine symmetrische Alkinen nicht net Dipolmoment, weil die zwei einzelnen Dipolmomente auf jeder Seite sich gegenseitig aufheben. Die Intensität der Infrarot-Absorption ist proportional zu der Änderung in das Dipolmoment, wenn die Anleihe erstreckt oder komprimiert. Daher eine Carbonylgruppe-Strecke wird eine intensive Band in der IR zeigen, und eine symmetrische interne Alkinen zeigt eine kleine, wenn nicht unsichtbar, Band Dehnung des C-C-Dreifachbindung (Abbildung 1). Tabelle 1 zeigt einige charakteristische Absorption Frequenzen. Abbildung 2 zeigt das IR-Spektrum eine Hantzsch Ester. Beachten Sie die Spitze bei 3.343 cm-1 für den N-H einzelne Bindung und der Peak bei 1.695 cm-1 für die Carbonyl-Gruppen. In diesem Experiment ist die ATR-Sampling-Technik verwendet, wo das Infrarotlicht der Probe reflektiert, die in Kontakt mit einer ATR-Kristall ist mehrere Male. In der Regel werden Materialien mit einem hohen Brechungsindex wie Germanium und Zink metallisches verwendet. Diese Methode ermöglicht es, feste oder flüssige Analyten ohne weitere Vorbereitung direkt zu untersuchen.
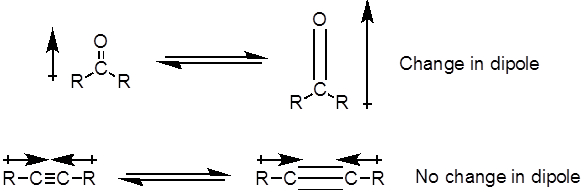
Abbildung 1: Diagramm C–O Doppel- und C-C Dreifachbindung Strecken und die daraus resultierende Veränderung in das Dipolmoment.
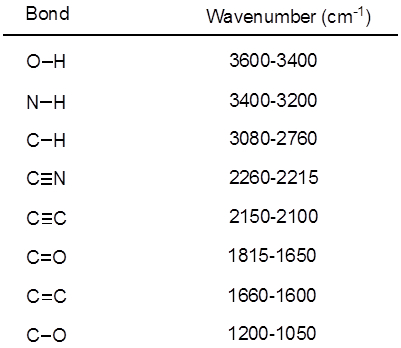
Tabelle 1. Charakteristischen IR-Frequenzen der kovalenten Bindungen in organischen Molekülen vorhanden.
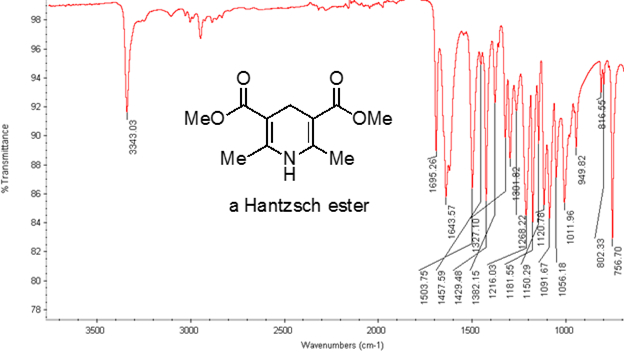
Abbildung 2. IR-Spektrum eine Hantzsch Ester.
Verfahren
- Schalten Sie den IR-Spektrometer und lassen Sie es zum Aufwärmen.
- Erhalten einer unbekannten Probe des Kursleiters und notieren Sie die Buchstaben und das Aussehen der Probe.
- Ein Hintergrund-Spektrum zu sammeln.
- Mit einem Metallspatel, legen Sie eine kleine Menge der Probe unter der Sonde.
- Drehen Sie die Sonde, bis es einrastet.
- Notieren Sie das IR-Spektrum der unbekannten Probe.
- Wiederholen Sie bei Bedarf um eine gute Qualität zu erhalten Spektrum.
- Notieren Sie die Absorption Frequenzen bezeichnend für die funktionelle Gruppen vorhanden.
- Reinigen Sie die Sonde mit Aceton.
- Schalten Sie das Spektrometer.
- Analysieren Sie die erhaltenen Spektrum. Abbildung 3 zeigt die möglichen Kandidaten für die unbekannte Probe. Geben Sie die wahrscheinliche Identifizierung der unbekannten Probe.

Abbildung 3. Das Diagramm zeigt die möglichen Identitäten des unbekannten.
Ergebnisse
Tabelle 2: Aussehen und beobachteten IR-Frequenzen der Verbindungen aufgelistet Abbildung 3.
| Compound-Reihe | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Aussehen | klare Flüssigkeit | weißer Körper | klare Flüssigkeit | klare Flüssigkeit | klare Flüssigkeit | klare Flüssigkeit | gelbe Flüssigkeit | weißer Körper | weißer Körper | klare Flüssigkeit |
| Beobachteten Frequenzen (cm-1) | 1691, 1601, 1450, 1368, 1266 |
2773, 2730, 1713, 1591, 1576 |
2940, 2867, 1717, 1422, 1347 |
3026, 2948, 2920, 1605, 1496 |
2928, 2853, 1450, 904, 852 |
3926, 3315, 2959, 2120, 1461 |
3623, 3429, 3354, 2904, 1601 |
3408, 3384, 3087, 1596, 1496 |
3226, 2966, 1598, 1474, 1238 |
3340, 2959, 2861, 1468, 1460 |
Anwendung und Zusammenfassung
In diesem Experiment haben wir gezeigt, wie eine unbekannte Probe anhand seiner charakteristischen IR-Spektrum zu identifizieren. Verschiedene funktionelle Gruppen geben verschiedene streckende Frequenzen, die die Identifizierung der funktionellen Gruppen vorhanden.
Wie in diesem Experiment gezeigt, ist IR-Spektroskopie ein nützliches Werkzeug für die Chemiker zu identifizieren und zu charakterisieren, ein Molekül. Neben der organischen Chemie hat IR-Spektroskopie nützliche Anwendungen in anderen Bereichen. In der pharmazeutischen Industrie wird diese Technik für quantitative und qualitative Analyse von Drogen verwendet. In der Ernährungswissenschaft dient der IR-Spektroskopie, Fette und Öle zu studieren. Zu guter Letzt IR-Spektroskopie wird verwendet, um die Zusammensetzung der Treibhausgase, d. h., CO2, CO, Messen CH4und N2O bei Anstrengungen zur globalen Klimaveränderungen zu verstehen.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Infrarot-Spektroskopie
Organic Chemistry II
215.3K Ansichten

Reinigung der Glaswaren
Organic Chemistry II
123.7K Ansichten

Nucelophile Substitution
Organic Chemistry II
99.6K Ansichten

Reduktionsmittel
Organic Chemistry II
43.1K Ansichten

Grignard-Reaktion
Organic Chemistry II
149.1K Ansichten

n- Butyllithium Titration
Organic Chemistry II
48.0K Ansichten

Dean-Stark-Falle
Organic Chemistry II
100.6K Ansichten

Ozonolyse von Alkenen
Organic Chemistry II
67.1K Ansichten

Organokatalyse
Organic Chemistry II
16.9K Ansichten

Palladiumkatalysierte Kreuzkupplungsreaktionen
Organic Chemistry II
34.5K Ansichten

Festphasen-Synthese
Organic Chemistry II
41.1K Ansichten

Hydrierung
Organic Chemistry II
49.6K Ansichten

Polymerisation
Organic Chemistry II
94.4K Ansichten

Schmelzpunkt
Organic Chemistry II
150.0K Ansichten

Polarimeter
Organic Chemistry II
100.1K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten