Antibiotika-Empfindlichkeitstests: Epsilometertests zur Bestimmung der MHK-Werte von zwei Antibiotika und zur Bewertung der Antibiotika-Synergie
Überblick
Quelle: Anna Bläckberg1, Rolf Lood1
1 Institut für Klinische Wissenschaften Lund, Abteilung für Infektionsmedizin, Biomedical Center, Universität Lund, 221 00 Lund Schweden
Die Kenntnis der Wechselwirkungen zwischen Antibiotika und Bakterien ist wichtig, um zu verstehen, wie Mikroben Antibiotikaresistenzen entwickeln. 1928 entdeckte Alexander Fleming Penicillin, ein Antibiotikum, das seine antibakterielle Funktion ausübt, indem es die Zellwandregeneration stört (1). In der Folge wurden weitere Antibiotika mit unterschiedlichen Wirkmechanismen entdeckt, darunter Medikamente, die die DNA-Replikation und die Proteintranslation in Bakterien hemmen; in den letzten Jahren wurden jedoch keine neuen Antibiotika entwickelt. Die Resistenz gegen aktuelle Antibiotika hat zugenommen, was zu schweren Infektionskrankheiten führt, die nicht wirksam behandelt werden können (2). Hier beschreiben wir verschiedene Methoden zur Beurteilung der Antibiotikaresistenz in Bakterienpopulationen. Jede dieser Methoden funktioniert, unabhängig vom Wirkmechanismus der verwendeten Antibiotika, weil der bakterielle Tod das gemessene Ergebnis ist. Antibiotikaresistenzen werden nicht nur schnell spezifisch durch Krankenhäuser verbreitet, sondern auch in der gesamten Gesellschaft. Um solche Resistenzmittel zu untersuchen, wurden verschiedene Methoden entwickelt, darunter der Epsilometer-Test (E-Test) und der Brühverdünnungstest (3).
Der E-Test ist eine etablierte Methode und ein kostengünstiges Werkzeug, das Minimale hemmende Konzentration (MIC) Daten quantifiziert, die niedrigste Konzentration eines antimikrobiellen, das das sichtbare Wachstum eines Mikroorganismus hemmt. Je nach verwendetem Bakterienstamm und Antibiotika kann der MIC-Wert zwischen unter g/ml und >1000 g/ml (4) variieren. Der E-Test wird mit einem Kunststoffstreifen mit einem vordefinierten Antibiotikagradienten durchgeführt, der mit der MIC-Messskala in g/ml bedruckt ist. Dieser Streifen wird direkt auf die Agarmatrix übertragen, wenn er auf die geimpfte Agarplatte aufgetragen wird. Nach der Inkubation ist entlang des Streifens eine symmetrische elliptische Hemmungszone sichtbar, da das Bakterienwachstum verhindert wird. MIC wird durch den Hemmbereich definiert, der endpunkt ist, an dem die Ellipse den Streifen schneidet. Eine weitere gängige Methode zur Bestimmung von MIC ist die Mikrobrühe-Verdünnungsmethode. Mikrobrühe Verdünnung enthält verschiedene Konzentrationen des antimikrobiellen Mittels zu einem Brühe Medium mit geimpften Bakterien hinzugefügt. Nach der Inkubation ist MIC definiert als die niedrigste Konzentration von Antibiotika, die sichtbares Wachstum verhindert (5). Es ist auch eine quantitative Methode und kann auf mehrere Bakterien angewendet werden. Zu den Nachteilen dieser Methode gehören die Möglichkeit von Fehlern bei der Herstellung der Konzentrationen der Reagenzien und die große Anzahl von Reagenzien, die für das Experiment erforderlich sind. Die Messung der Antibiotikaresistenz ist sowohl aus klinischer als auch aus Forschungssicht unerlässlich, und diese In-vitro-Methoden zur Untersuchung von Resistenzen werden im Folgenden diskutiert und vorgestellt.
Das Resistenzprofil für ein bestimmtes Bakterium kann angewendet werden, um die Antibiotikabehandlung zu optimieren, um festzustellen, ob ein Patient von einer Kombinationsbehandlung im Vergleich zur Einzeltherapie profitieren würde. Für die Verwendung von mehr als einem Antibiotikum zu einem zeitpunkt, ist es zwingend notwendig, ihre Wechselwirkungen miteinander zu kennen und, wenn sie eine additive, synergistische oder antagonistische Wirkung haben. Eine additive Wirkung kann gesehen werden, wenn die gemeinsame Wirkung der Antibiotika der Wirksamkeit der einzelnen Antibiotika in einer gleichen Dosis gegeben entspricht. Synergien zwischen Antibiotika hingegen sind vorhanden, wenn die gemeinsame Wirkung der Antibiotika stärker ist, als wenn das Medikament allein verabreicht würde (6). Die Anwendung von Kombinationen antimikrobieller Behandlungwird in Kombinationen wird verwendet, um das Auftreten von antimikrobiellen Resistenzen zu vermeiden, um die Wirkung der individuellen Antibiotikabehandlung zu verstärken (7). Die Kenntnis des Antagonismus ist ebenso wichtig, um eine unnötige Verwendung von antimikrobiellen Kombinationen zu verhindern. Die E-Test-Methodik bietet einfache und mehrere Möglichkeiten, mögliche Synergien und Antagonism zwischen verschiedenen antimikrobiellen Wirkstoffen zu bestimmen. Um der Verbreitung antibiotikaresistenter Krankheitserreger zu begegnen, ist die Kenntnis möglicher synergistischer und antagonistischer Mechanismen bestimmter Antibiotika wichtig, was zu klinischer Wirksamkeit und dem Kampf gegen die Multipharmaresistenz führt.
Die Bestimmung von Synergien mittels E-Tests kann in zwei allgemeine Ansätze unterteilt werden: Kreuz- und Nicht-Kreuztests. Während beide Synergietests auf den Vorkenntnissen einzelner MIC-Werte beruhen, unterscheiden sich beide Ansätze in Methodik und konzeptionellem Ansatz leicht. In einem nicht-kreuz-Synergie-Test wird das erste Antibiotikum in dem zu testenden Paar auf eine MitBakterien geimpfte Agarplatte gelegt. Nachdem die Antibiotika aus dem ersten Streifen die Platte eininfundierten (z. B. nach 1 Stunde), wird der Streifen entfernt und ein neuer Streifen mit dem zweiten Antibiotikum wird genau an der gleichen Stelle wie das erste platziert, wobei sichergestellt ist, dass die beiden einzelnen MIC-Werte auf jedem ot sie. Die resultierende Hemmzone kann dann wie oben beschrieben analysiert und Synergien auf der Grundlage der Gleichung 1 berechnet werden.
Gleichung 1 - Fraktionelle hemmende Konzentrationen (FIC)
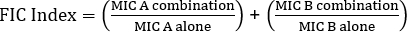
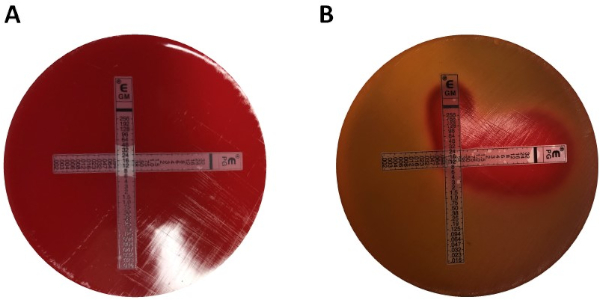
Werte >0,5 zeigt Synergien.
Während der Prüfer mit einfach zu analysierenden Platten belohnt wird, ist die Methode aufgrund des Streifenwechsels sowie der Notwendigkeit, zwei Platten pro Experiment zu verwenden, etwas mühsam und zeitaufwändig. Stattdessen wird oft ein Kreuztest eingesetzt. Anstatt die beiden verschiedenen E-Teststreifen anschließend übereinander (nach Entfernung des ersten) hinzuzufügen, werden beide gleichzeitig, jedoch in Form eines Kreuzes (90° Winkel) platziert, wobei die beiden zuvor ermittelten MIC-Werte den 90°-Winkel bilden. Durch diesen Ansatz wird nur eine Platte pro Synergietest benötigt, sowie weniger Arbeit, so dass es eine bevorzugte Wahl ist, obwohl es etwas schwieriger zu analysieren ist. Die neuen MIC-Werte im kombinierten Antibiotika-Ansatz können als modifizierte Hemmzonen visualisiert werden, nach denen Synergien durch Gleichung 1 bestimmt werden können.
Winkel) platziert, wobei die beiden zuvor ermittelten MIC-Werte den 90°-Winkel bilden. Durch diesen Ansatz wird nur eine Platte pro Synergietest benötigt, sowie weniger Arbeit, so dass es eine bevorzugte Wahl ist, obwohl es etwas schwieriger zu analysieren ist. Die neuen MIC-Werte im kombinierten Antibiotika-Ansatz können als modifizierte Hemmzonen visualisiert werden, nach denen Synergien durch Gleichung 1 bestimmt werden können.
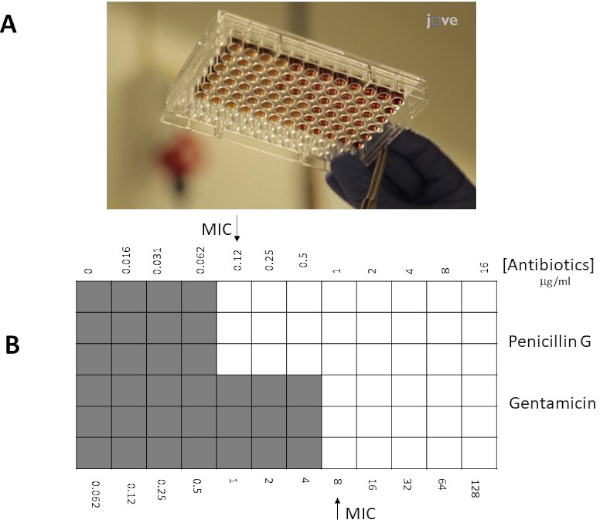
Anstatt einen Agar-Platten-Ansatz zu verwenden, kann ein Mikrobrühe-Ansatz aufgrund seiner höheren Flexibilität oft bevorzugt sein (z. B. die Fähigkeit, bestimmte Konzentrationen von Antibiotika außerhalb der Grenzen eines E-Teststreifens zu wählen). Darüber hinaus werden Mikrobrühe-Tests vorgeschlagen, empfindlicher zu sein, da antibiotika bereits in einer flüssigen Lösung verteilt werden, nicht abhängig von der Dissoziation innerhalb einer festen Phase (Agarplatte). Brunnen in einer 96-Well-Mikroplatte werden mit einer festgelegten Anzahl von Bakterien geimpft (106 cfu/ml: die Bakterienkonzentration kann durch OD600 nm-Messungen, Trübungsnormen oder durch Diespread-Beschichtung von Proben aus 10-fachen bakteriellen seriellen Verdünnungen geschätzt werden), und Antibiotika in verschiedenen Verdünnungen werden den Brunnen zugesetzt. In ähnlicher Weise wird MIC als Schnittpunkt (gut/punkt) mit der niedrigsten Konzentration von Antibiotika bestimmt, die das sichtbare Wachstum von Bakterien hemmt.
Experimentelles Ziel
- Das folgende Projekt beschreibt Strategien zur Bestimmung der MIC-Werte von Penicillin G und Gentamicin der Streptococcus-Gruppe G durch zwei verschiedene Methoden, E-Test und Mikrobrühe-Verdünnung. Für den E-Test wurden Mueller-Hinton-Agarplatten, die mit Streptococcus-Gruppe G geimpft wurden, in Kombination mit Gradientenstreifen von Penicillin G und/oder Gentamicin verwendet; während MH-Brühe mit 50% lysiertem Pferdeblut und 20 mg/ml -NAD zusammen mit Streptococcus-Gruppe G in einem Mikrobrühe-Ansatz mit löslichen Antibiotika verwendet wurden.
Materialien
- Bakterielle Kolonien auf einer Blutagarplatte, gelagert <7 Tage in 4°C
- Blut-Agar-Platten
- 0.5 McFarland Standard
- 1% BaCl2
- 1% H2SO4
- Salinerohr (2 ml)
- Baumwolle gekippt Applikator
- Mueller-Hinton AgarPlatten (MHA-Platten)
- MH-Brühe mit 50% lysiertem Pferdeblut und 20 mg/ml -NAD (MH-F)
- E-Test Penicillin/Gentamicin (oder Antibiotika von Interesse) (BioMerieux, Marcy l'Etoile, Frankreich, Schweden)
- Antibiotika Penicillin/Gentamicin (oder Antibiotika von Interesse (Pulver/Lösung))
Hinweis: Die spezifischen Medien, die für das Bakterienwachstum verwendet werden, können für verschiedene Arten variieren.
Verfahren
1. Epsilometer-Tests (E-Tests)
-
gliederung
- Handschuhe und laborator
- Bereiten Sie den Arbeitsplatz bereit, indem Sie ihn mit 70% Ethanol sterilisieren
- Sammeln Mueller-Hinton Agar Platten (MHA Platten)
-
Vorbereitung eines McFarland Trübungsstandards Nr. 0,5
- Bereiten Sie eine 1%ige Lösung von Bariumchlorid (BaCl2) vor:
1 Gramm wasserfreies Bariumchlorid (BaCl2) in 100 ml dest
- Bereiten Sie eine 1%ige Lösung von Bariumchlorid (BaCl2) vor:
Ergebnisse
MIC-Werte im E-Test
In Abbildung 1 wurden einzelne MIC-Werte als 0,094 g/ml für Penicillin G und 8 g/ml für Gentamicin identifiziert. Bei Synergietests zeigten beide einen MIC-Wert für Penicillin G von 0,064 g/ml(Abbildungen 2, 3), während Gentamicin für Kreuz- und Nicht-Kreuztests einen MIC 4 g/ml hatte. Beachten Sie, dass aufgrund der unterschiedlichen Inkubationszeiten der Streifen in den beiden Einstellungen eine leichte Diskrepanz zw...
Anwendung und Zusammenfassung
Antibiotikaresistenz ist ein weltweites Gesundheitsproblem. Um Resistenzmechanismen von Mikroben zu bestimmen, sind Methoden, die auf Synergie und Antagonismus mit verschiedenen Antibiotika testen, von entscheidender Bedeutung. Die E-Test-Methode ist schnell, einfach zu replizieren, und kann verwendet werden, um jedes synergistische Potenzial von Kombinationstherapien zu untersuchen. Die Brühe-Verdünnungsmethode kann auch bewertet werden, um die bakterizide Aktivität vorherzusagen. Um die Resistenzmechanismen verschie...
Referenzen
- Tan SY, Tatsumura Y. Alexander Fleming (1881-1955): Discoverer of penicillin. Singapore Medical Journal. 56 (7):366-7. (2015)
- Aminov RI. A brief history of the antibiotic era: lessons learned and challenges for the future. Frontiers in Microbiology. 1:134. (2010)
- Pankey GA, Ashcraft DS, Dornelles A. Comparison of 3 E-test (®) methods and time-kill assay for determination of antimicrobial synergy against carbapenemase-producing Klebsiella species. Diagnostic Microbiology and Infectious Disease. 77 (3):220-6. (2013)
- EUCAST: European Committee On Antimicrobial Susceptibility Testing (www.eucast.org).
- Wiegand I, Hilpert K, Hancock RE. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2):163-75. (2008)
- Doern CD, When does 2 plus 2 equal 5? A review of antimicrobial synergy testing. Journal of Clinical Microbiology. 52 (12):4124-28. (2014)
- Worthington RJ, Melander C. Combination approaches to combat multi-drug resistant bacteria. Trends in Biotechnology. 31 (3):177-84. (2013)
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Antibiotika-Empfindlichkeitstests: Epsilometertests zur Bestimmung der MHK-Werte von zwei Antibiotika und zur Bewertung der Antibiotika-Synergie
Microbiology
93.9K Ansichten

Erstellen einer Winogradsky-Säule: Eine Methode zur Anreicherung der mikrobiellen Spezies in einer Sedimentprobe
Microbiology
129.9K Ansichten

Serielle Verdünnungen und Ausplattieren: Auszählung von Mikrobiom
Microbiology
317.2K Ansichten

Anreicherungskulturen: Kultivieren von aeroben und anaeroben Mikroben auf selektiven und differenziellen Medien
Microbiology
132.2K Ansichten

Reinkulturen und Streak-Plating: Isolierung einzelner Bakterienkolonien aus einer gemischten Probe
Microbiology
166.4K Ansichten

16S rRNA-Sequenzierung: Eine PCR-basierte Technik zur Identifizierung bakterieller Arten
Microbiology
189.7K Ansichten

Wachstumskurven: Erzeugen von Wachstumskurven mit Hilfe von koloniebildenden Einheiten und Messungen der optischen Dichte
Microbiology
298.0K Ansichten

Mikroskopie und Färbungen: Gram-, Kapsel- und Endosporenfärbung
Microbiology
364.1K Ansichten

Plaque-Assay: Eine Methode zur Bestimmung des Virustiters als Plaque bildende Einheiten (PFU)
Microbiology
186.5K Ansichten

Transformation von E. coli-Zellen mit einem adaptierten Calciumchlorid-Verfahren
Microbiology
87.1K Ansichten

Konjugation: Eine Methode zur Übertragung der Ampicillinresistenz vom Spender auf den Empfänger E. coli
Microbiology
38.4K Ansichten

Phagen-Transduktion: Eine Methode zur Übertragung der Ampicillinresistenz von einem Spender auf den Empfänger E. coli
Microbiology
29.2K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten