Mikroskopie und Färbungen: Gram-, Kapsel- und Endosporenfärbung
Quelle: Rhiannon M. LeVeque1, Natalia Martin1, Andrew J. Van Alst1, und Victor J. DiRita1
1 Department of Microbiology and Molecular Genetics, Michigan State University, East Lansing, Michigan, Vereinigte Staaten von Amerika
Bakterien sind verschiedene Mikroorganismen, die fast überall auf der Erde vorkommen. Viele Eigenschaften helfen, sie voneinander zu unterscheiden, einschließlich, aber nicht beschränkt auf Gram-Färbung Art, Form und Anordnung, Produktion von Kapsel, und Bildung von Sporen. Um diese Eigenschaften zu beobachten, kann man Lichtmikroskopie verwenden; Einige bakterielle Eigenschaften (z. B. Größe, fehlende Färbung und Brechungseigenschaften) machen es jedoch schwierig, Bakterien nur mit einem Lichtmikroskop zu unterscheiden (1, 2). Färben von Bakterien ist notwendig, wenn Bakterientypen mit Lichtmikroskopie unterschieden werden. Die beiden Haupttypen von Lichtmikroskopen sind einfach und zusammengesetzt. Der Hauptunterschied zwischen ihnen ist die Anzahl der Linsen, die verwendet werden, um das Objekt zu vergrößern. Einfache Mikroskope (z. B. eine Lupe) haben nur eine Linse, um ein Objekt zu vergrößern, während zusammengesetzte Mikroskope mehrere Linsen haben, um die Vergrößerung zu verbessern (Abbildung 1). Zusammengesetzte Mikroskope haben eine Objektivlinse in der Nähe des Objekts, die Licht sammelt, um ein Bild des Objekts zu erstellen. Dies wird dann durch das Okular (Augenlinse) vergrößert, das das Bild vergrößert. Die Kombination von Objektiv und Okular ermöglicht eine höhere Vergrößerung als die Verwendung einer einzigen Linse allein. In der Regel verfügen Verbundmikroskope über mehrere Objektivlinsen mit unterschiedlichen Leistungen, um eine unterschiedliche Vergrößerung zu ermöglichen (1, 2). Hier werden wir die Visualisierung von Bakterien mit Gramflecken, Kapselflecken und Endosporenflecken diskutieren.

Abbildung 1: Ein typisches Zusammengesetzten Mikroskop. Die wichtigsten Teile des Mikroskops sind beschriftet.
Der Gram-Fleck, der 1884 vom dänischen Bakteriologen Hans Christian Gram (1) entwickelt wurde, unterscheidet Bakterien anhand der Zusammensetzung der Zellwand (1, 2, 3, 4). Kurz gesagt, wird ein bakterielles Abstrich auf einem Mikroskopschlitten platziert und dann wärmefixiert, um die Zellen am Dia zu haften und sie leichter zu akzeptieren, Flecken zu akzeptieren (1). Die wärmefeste Probe ist mit Crystal Violet gefärbt und verwandelt die Zellen violett. Die Rutsche wird mit einer Jodlösung gespült, die das Kristallviolett an der Zellwand fixiert, gefolgt von einem Decolorizer (ein Alkohol), um jedes nicht fixierte Kristallviolett wegzuwaschen. Im letzten Schritt wird ein Gegenfleck, Safranin, zu den Farbzellen rot hinzugefügt (Abbildung 2). Gram-positive Bakterien färben lila aufgrund der dicken Peptidoglykan-Schicht, die nicht leicht durch den Decolorizer durchdrungen wird; Gram-negative Bakterien, mit ihrer dünneren Peptidhundlykanschicht und höherem Lipidgehalt, destain mit dem Decolorizer und sind rot gefleckt, wenn Safranin hinzugefügt wird (Abbildung 3). Die Gramfärbung wird verwendet, um Zellen in zwei Typen (Gram-positiv und Gram-negativ) zu unterscheiden und ist auch nützlich, um Zellform (Kugeln oder Koks, Stäbe, gekrümmte Stäbe und Spiralen) und Anordnung (einzelne Zellen, Paare, Ketten, Gruppen und Cluster) zu unterscheiden (1, 3) .
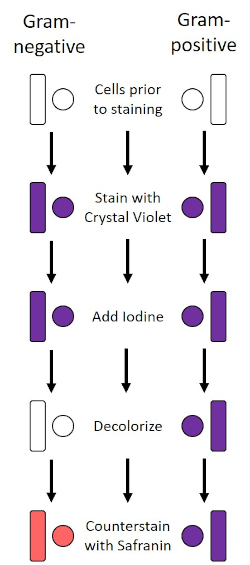
Abbildung 2: Schematic des Gram Staining Protocol. Die linke Spalte zeigt, wie gramnegative Bakterien bei jedem Schritt des Protokolls reagieren. Die rechte Spalte zeigt, wie grampositive Bakterien reagieren. Gezeigt werden auch zwei typische bakterielle Zellformen: die Bazillen (oder Stäbe) und die Kokzien (oder Kugeln).
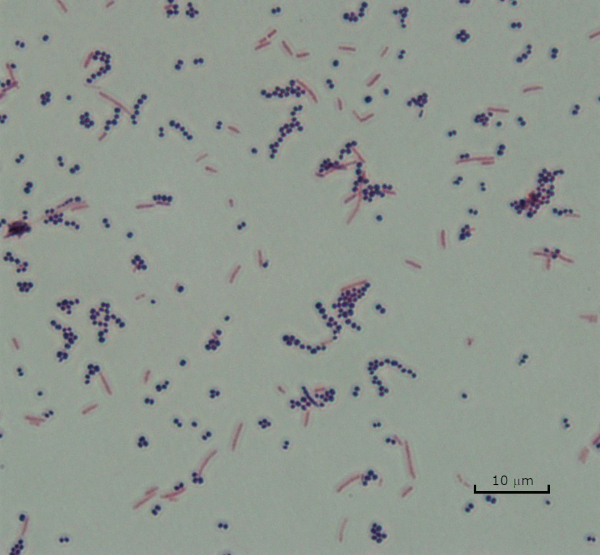
Abbildung 3: Gram Staining Ergebnisse. Ein Gram-Fleck einer Mischung aus Staphylococcus aureus (Gram-positive lila Kokzi) und Escherichia coli (Gram-negative rote Stäbe).
Einige Bakterien produzieren eine extrazelluläre viskose äußere Schicht, die als Kapsel bezeichnet wird (3, 5). Kapseln sind Schutzstrukturen mit verschiedenen Funktionen, einschließlich, aber nicht beschränkt auf die Haftung an Oberflächen und anderen Bakterien, Schutz vor Austrocknung und Schutz vor Phagozytose. Kapseln bestehen in der Regel aus Polysacchariden, die mehr als 95% Wasser enthalten, aber einige können Polyalkohole und Polyame enthalten (5). Aufgrund ihrer meist nicht-ionischen Zusammensetzung und der Tendenz, Flecken abzustoßen, funktionieren einfache Färbemethoden nicht mit Kapsel; Stattdessen verwendet die Kapselfärbung eine negative Färbetechnik, die die Zellen und den Hintergrund färbt und die Kapsel als klaren Halo um die Zellen lässt (1, 3) (Abbildung 4). Kapselfärbung beinhaltet verschmieren eine bakterielle Probe in einen sauren Fleck auf einem Mikroskop-Dia. Im Gegensatz zur Gram-Färbung wird der bakterielle Abstrich während eines Kapselflecks nicht wärmefixiert. Wärmefixierung kann die Kapsel stören oder dehydrieren, was zu falschen Negativen führt (5). Darüber hinaus kann die Wärmefixierung Zellen schrumpfen, was zu einer Lichtung um die Zelle führt, die als Kapsel verwechselt werden kann, was zu falschen Positivmeldungen führt (3). Der saure Fleck färbt den Diahintergrund; Während nacheinem Grundfleck, Crystal Violet, die Bakterienzellen selbst färbt, so dass die Kapsel unbefleckt bleibt und als klarer Halo zwischen den Zellen und dem Diahintergrund erscheint (Abbildung 5). Traditionell wurde Indientinte als saurer Fleck verwendet, da diese Partikel nicht in die Kapsel eindringen können. Daher ist weder die Kapsel noch die Zelle durch Indische Tinte gefärbt; stattdessen ist der Hintergrund befleckt. Kongo Rot, Nigrosin oder Eosin kann anstelle von Indien Tinte verwendet werden. Kapselfärbung kann Ärzten helfen, bakterielle Infektionen zu diagnostizieren, wenn sie Kulturen aus Patientenproben betrachten und geeignete Patientenbehandlungen leiten. Häufige Krankheiten, die durch verkapselte Bakterien verursacht werden, sind Lungenentzündung, Meningitis und Salmonellose.
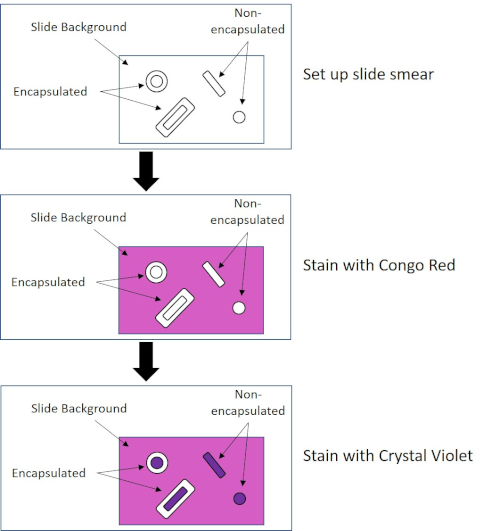
Abbildung 4: Schematic des Capsule Staining Protocol. Das obere Panel zeigt den Diaabstrich vor jeder Fleckenanwendung an. Die mittlere Tafel zeigt, wie die Rutsche und Bakterien nach dem primären Fleck, Congo Red, aussehen. Das letzte Panel zeigt, wie die Rutsche und Bakterien nach dem Gegenfleck Crystal Violet aussehen.
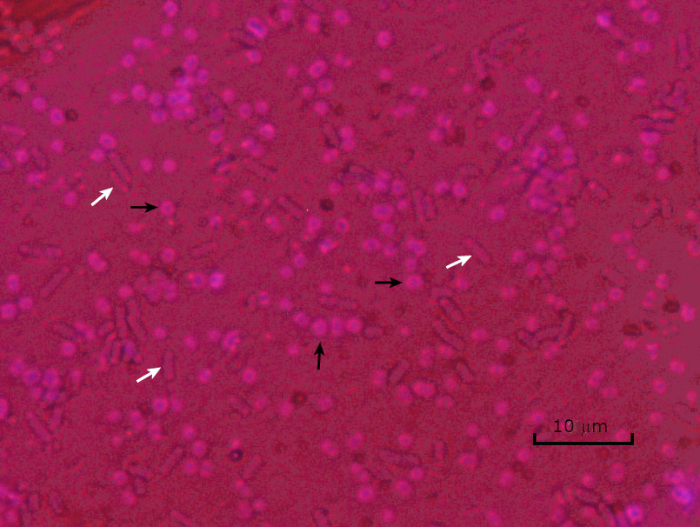
Abbildung 5: Capsule Staining Ergebnisse. Kapselfärbung von verkapselten Acinetobacter baumannii (mit schwarzen Pfeilen bezeichnet) und nicht verkapselter Escherichia coli (mit weißen Pfeilen bezeichnet). Beachten Sie, dass der Hintergrund dunkel ist und A. baumannii Zellen violett gefärbt sind. Die Kapsel um A. baumannii Zellen ist als Halo offensichtlich, während E. coli keinen Halo hat.
Unter widrigen Bedingungen (z. B. Nährstoffbegrenzung, extreme Temperaturen oder Dehydrierung) produzieren einige Bakterien Endosporen, metabolisch inaktive Strukturen, die gegen physikalische und chemische Schäden resistent sind (1, 2, 8, 9). Endosporen ermöglichen es dem Bakterium, harte Bedingungen zu überleben, indem es das genetische Material der Zellen schützt; sobald die Bedingungen für das Wachstum günstig sind, keimen Sporen, und das Bakterienwachstum setzt sich fort. Endosporen sind mit Standard-Färbetechniken schwer zu färben, da sie undurchlässig für Farbstoffe sind, die typischerweise für die Färbung verwendet werden (1, 9). Die Technik, die routinemäßig verwendet wird, um Endosporen zu färben, ist die Schaeffer-Fulton-Methode (Abbildung 6),die den primären Fleck Malachite Green verwendet, einen wasserlöslichen Fleck, der relativ schwach an zelluläres Material bindet, und Wärme, damit der Fleck brechen kann. durch den Kortex der Sporen (Abbildung 7). Diese Schritte färben die wachsenden Zellen (im Kontext der Endosporenbiologie als vegetative Zellen bezeichnet) sowie Endosporen und freie Sporen (die nicht mehr innerhalb der früheren Zellhülle). Vegetative Zellen werden mit Wasser gewaschen, um Malachitgrün zu entfernen; Endosporen behalten den Fleck durch Erhitzen der Malachitgrün innerhalb der Sporen. Schließlich werden die vegetativen Zellen mit Safranin konterkariert, um sie zu visualisieren (Abbildung 8). Die Färbung von Endosporen hilft, Bakterien in Sporenformer und Nicht-Sporen-Former zu differenzieren, und bestimmt, ob Sporen in einer Probe vorhanden sind, die, wenn vorhanden, bei der Keimung zu einer bakteriellen Kontamination führen könnte.
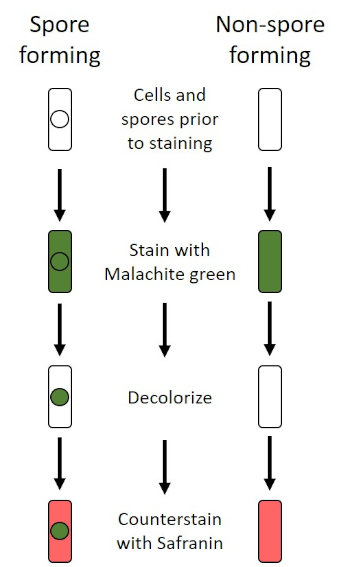
Abbildung 6: Schematic des Endospore Staining Protocol. Die linke Spalte zeigt, wie sporenbildende Bakterien bei jedem Schritt des Protokolls reagieren. Die rechte Spalte zeigt, wie nicht sporenbildende Bakterien reagieren.
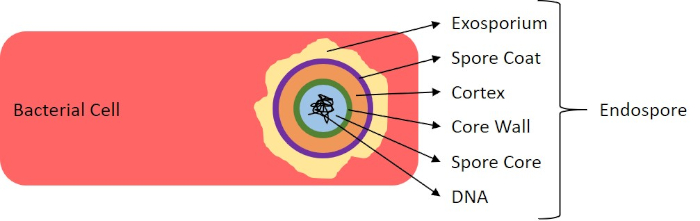
Abbildung 7: Diagramm der Endosporenstruktur. Bakterielle Zelle, die eine Endospore mit den verschiedenen Sporenstrukturen enthält.
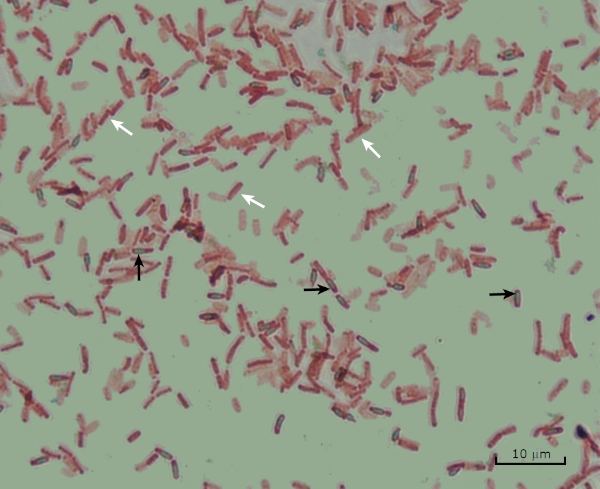
Abbildung 8: Endospore Färbung Ergebnisse. Eine typische Färbung von Endosporen von Bacillus subtilis. Die vegetativen Zellen (mit den weißen Pfeilen bezeichnet) sind rot gefärbt, während die Endosporen (mit den schwarzen Pfeilen bezeichnet) grün gebeizt sind.
1. Gram Färbung
-
gliederung
- Tragen Sie Handschuhe und einen nicht brennbaren Labormantel, da Farbstoffe Hände und Kleidung färben.
- Ein Bunsenbrenner wird verwendet, um die Bakterien zu erwärmen. Achten Sie beim Arbeiten mit Flammen auf; binden Sie lange Haare zurück.
- Es werden handelsübliche Gram-Farbstoffreagenzien verwendet.
- Reinigen Sie Mikroskopschlitten mit Labortüchern.
-
protokoll
- Pipetten Sie 10 L Phosphat gepufferte Koch- oder Kulturbrühe auf Demrutschen.
- Schmieren Sie eine Bakterienkolonie in die Flüssigkeit, um eine dünne gleichmäßige Schicht zu produzieren.
Hinweis: Verwenden Sie keine Kulturen, die älter als 24 Stunden sind, da zu alte Bakterien Veränderungen in ihrer Zellwand haben könnten, die die Gram-Fleckenergebnisse beeinflussen (1, 4). - Vollständig lufttrockene Rutsche.
- Einmal getrocknet, wärmefixBakterien durch vorbei gleiten durch die Flamme (Bakterien Seite nach oben) 4-5 mal.
Hinweis: Halten Sie die Folie nicht zu lange in der Flamme oder Sie können die Bakterienzellen verzerren (1). - Arbeiten über das Waschbecken, halten Sie die Rutschebene und verwenden Grams Crystal Violet, um die wärmefesten Bakterien vollständig zu decken, lassen Sie 45 Sekunden stehen.
- Spülen Sie überschüssiges Crystal Violet, indem Sie die Rutsche in einem Winkel halten und einen sanften, indirekten Wasserstrom auf die Rutsche spritzen und sie über die gefärbten Bakterien herunterlaufen lassen. Spritzen Sie wasser nicht direkt auf die Bakterien.
- Halten Sie wieder Rutschebene, tragen Sie Grams Jodlösung auf, um die gefärbten Bakterien vollständig zu bedecken, lassen Sie 45 Sekunden stehen.
- Spülen Sie überschüssiges Jod wie in Schritt 1.2.6 oben.
- Während Sie die Folie in einem Winkel halten, fügen Sie ein paar Tropfen Decolorizer auf die Folie, so dass es über die gefärbten Bakterien rieseln, nur bis der Ablauf klar ist; in der Regel ca. 5 Sekunden. Sofort mit Wasser abspülen, wie in Schritt 1.2.6 oben.
Hinweis: Dies ist ein wichtiger Schritt im Protokoll. Wenn Decolorizer zu lang oder nicht lang genug rieseln kann, führt dies zu einer falschen Gram-Färbung (4). - Halten Sie die Rutschstufe wieder, tragen Sie Grams Safranin auf, um die Bakterien vollständig zu bedecken, lassen Sie 45 Sekunden stehen.
- Spülen Sie überschüssiges Safranin wie in Schritt 1.2.6 oben.
- Blot, nicht reiben, überschüssiges Wasser von Rutsche mit Papiertüchern.
- Untersuchen Sie das Dia auf dem Mikroskop mit Öl-Immersion mit einem 100X Objektiv.
-
Ergebnisse und Datenanalyse
- Gram-positive Bakterien färben violett.
- Gram-negative Bakterien färben rot.
- Form (Koks, Bazillen, gekrümmte Stäbe, Spiralen) von Bakterien werden sichtbar sein.
- Die Anordnung von Bakterienzellen (einzelne Zellen, gepaarte Zellen, Zellketten, Cluster, Gruppierungen) wird sichtbar.
2. Kapselfärbung
-
gliederung
- Tragen Sie Handschuhe und einen Labormantel als Farbstoffe Flecken Hände und Kleidung.
- Um 1% Crystal Violet Lösung vorzubereiten, mischen 0,25 Gramm Crystal Violet mit 25 ml destilliertem Wasser, bis es gelöst ist.
- Um 1% Kongo Rote Lösung vorzubereiten, mischen 0,25 Gramm Kongo rot mit 25 ml destilliertem Wasser, bis gelöst.
- Reinigen Sie Dias mit Labortüchern.
-
protokoll
- Platz 10 L Kongo Rot auf Rutsche.
- Mit einer Pipettenspitze eine Bakterienkolonie in den Farbstoff schmieren, um eine dünne gleichmäßige Schicht zu erzeugen.
- Vollständig lufttrockenes Dia mit Farbstoff/Zell-Mischung, 5-7 Minuten.
Hinweis: Nicht erhitzen fix, da das Erhitzen die Kapsel dehydrieren oder verzerren kann. - Den Abstrich mit 1% Crystal Violet für 1 Minute überfluten.
- Spülen Sie überschüssigeflecken, indem Sie die Rutsche in einem Winkel halten und einen sanften, indirekten Wasserstrom auf die Rutsche spritzen und sie über die gefärbten Bakterien herunterlaufen lassen. Spritzen Sie wasser nicht direkt auf die Bakterien.
- Halten Sie die Rutsche in einem 45-Grad-Winkel, bis sie vollständig luftgetrocknet ist.
- Untersuchen Sie den Abstrich am Mikroskop unter Öl-Eintauchen mit einem 100-Fach-Objektiv.
-
Ergebnisse und Datenanalyse
- Bakterielle Zellen färben violett.
- Hintergrund der Folie wird dunkel färben.
- Kapseln werden ein klarer Halo um Zellen vor einem dunklen Hintergrund sein.
3. Endospore Färbung (Schaeffer-Fulton-Methode)
-
gliederung
- Tragen Sie Handschuhe und einen nicht brennbaren Labormantel, um Hände und Kleidung vor Farbstoffen und Flammen zu schützen.
- Ein Bunsenbrenner wird verwendet, um die Bakterien zu erwärmen. Achten Sie beim Arbeiten mit Flammen auf; binden Sie lange Haare zurück.
- Um 0,5% Malachit grüne Lösung vorzubereiten, mischen 0,125 Gramm Malachit Grün mit 25 ml destilliertem Wasser, bis gelöst.
- Verwenden Sie die handelsübliche Safranin-Reagenzlösung von Gram.
- Reinigen Sie Dias mit Labortüchern.
-
protokoll
- Pipetten Sie 10 l Phosphat gepufferte Kochung (PBS) oder Kulturbrühe auf Folie.
- Mit aseptischer Technik schmieren Sie eine Bakterienkolonie in die Flüssigkeit, um eine dünne gleichmäßige Schicht zu produzieren.
Hinweis: Endosporen bilden sich in der Regel nicht in jungen Zellen, daher wird empfohlen, die Kultur zwischen 18 und 36 Stunden alt zu sein (9). - Vollständig lufttrockene Rutsche.
- Wärmefix, indem Dia (Bakterien Seite nach oben) durch Flamme 4-5 mal passieren.
- Um den Farbstoff einzudämmen, legen Sie ein Stück Linsenpapier (geschnitten, um den bakteriellen Abstrich zu passen) über die Hitze festen Abstrich.
- Sättigen Sie Linsenpapier mit Malachite Green Lösung.
- Legen Sie Schieben Sie auf Becher mit kochendem Wasser auf einer heißen Platte, und Dampfgleiten für 5 Minuten, halten Linsenpapier feucht durch Hinzufügen von mehr Farbstoff einen Tropfen zu einer Zeit auf eine Zeit wie nötig.
Hinweis: Vermeiden Sie Überhitzung und Austrocknen der Farbstofflösung. - Entfernen Sie das Dia aus dem Becher, entfernen und entsorgen Linsenpapier, lassen Sie das Dia 2 Minuten abkühlen.
- Halten Sie die Rutsche in einem Winkel, spülen Sie gründlich, indem Sie einen sanften, indirekten Wasserstrom auf die Rutsche spritzen, so dass es über Abstriche abfließen kann.
- Halten Sie Rutschhöhe, Flutabstrich mit Safranin, lassen Sie 1 Minute stehen.
- Spülen Sie überschüssiges Safranin wie in Schritt 3.2.9 oben.
- Lufttrocknen lassen.
- Untersuchen Sie das Dia auf dem Mikroskop unter Öl-Eintauchen mit einem 100X Objektiv.
-
Ergebnisse und Datenanalyse
- Sporen färben grün.
- Vegetative Zellen färben rot.
- Einige vegetative Zellen enthalten Sporen; die Zellen färben rot, während die Endosporen grün färben.
Bakterien weisen Unterscheidungsmerkmale auf, die bei ihrer Identifizierung helfen können. Einige dieser Eigenschaften können durch Färbung und Lichtmikroskopie beobachtet werden. Drei Färbetechniken, die für die Beobachtung dieser Eigenschaften nützlich sind, sind Gram-Färbung, Kapselfärbung und Endospore-Färbung. Jede Technik identifiziert unterschiedliche Eigenschaften von Bakterien und kann verwendet werden, um Ärzten zu helfen, Behandlungen für Patienten zu empfehlen, potenzielle Verunreinigungen in Proben oder Lebensmitteln zu identifizieren und die Probensterilität zu überprüfen.
- Black, J. G. Microbiology Principles and Explorations, 4th edition. Prentice-Hall, Inc., Upper Saddle River, New Jersey. (1999)
- Madigan, M. T. and J. M. Martinko. Brock Biology of Microorganisms, 11th edition. Pearson Prentice Hall, Upper Saddle River, New Jersey. (2006).
- Leboffe, M. J., and B. E. Pierce. A Photographic Atlas for the Microbiology Laboratory, 2nd ed. Morton Publishing Company, Englewood, Colorado. (1996).
- Smith, A. C. and M. A. Hussey. Gram stain protocols. Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.2886. (2005).
- Hughes, R. B. and A. C. Smith. Capsule Stain Protocols Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.3041. (2007).
- Anthony, E. E. Jr. A note on capsule staining. Science 73(1890):319-320 (1931).
- Finegold, S. M., W. J. Martin, and E. G. Scott. Bailey and Scott's Diagnostic Microbiology, 5th edition. The C. V. Mosby Company, St. Louis, Missouri. (1978).
- Gerhardt, P., R. G. E. Murray, W. A. Wood, and N. R. Krieg. Methods for general and molecular bacteriology. ASM Press, Washington, DC. (1994).
- Hussey, M. A. and A. Zayaitz. Endospore Stain Protocol. Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.3112. (2007).
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Mikroskopie und Färbungen: Gram-, Kapsel- und Endosporenfärbung
Microbiology
362.1K Ansichten

Erstellen einer Winogradsky-Säule: Eine Methode zur Anreicherung der mikrobiellen Spezies in einer Sedimentprobe
Microbiology
127.6K Ansichten

Serielle Verdünnungen und Ausplattieren: Auszählung von Mikrobiom
Microbiology
312.8K Ansichten

Anreicherungskulturen: Kultivieren von aeroben und anaeroben Mikroben auf selektiven und differenziellen Medien
Microbiology
131.6K Ansichten

Reinkulturen und Streak-Plating: Isolierung einzelner Bakterienkolonien aus einer gemischten Probe
Microbiology
165.4K Ansichten

16S rRNA-Sequenzierung: Eine PCR-basierte Technik zur Identifizierung bakterieller Arten
Microbiology
187.4K Ansichten

Wachstumskurven: Erzeugen von Wachstumskurven mit Hilfe von koloniebildenden Einheiten und Messungen der optischen Dichte
Microbiology
291.6K Ansichten

Antibiotika-Empfindlichkeitstests: Epsilometertests zur Bestimmung der MHK-Werte von zwei Antibiotika und zur Bewertung der Antibiotika-Synergie
Microbiology
93.3K Ansichten

Plaque-Assay: Eine Methode zur Bestimmung des Virustiters als Plaque bildende Einheiten (PFU)
Microbiology
185.2K Ansichten

Transformation von E. coli-Zellen mit einem adaptierten Calciumchlorid-Verfahren
Microbiology
86.0K Ansichten

Konjugation: Eine Methode zur Übertragung der Ampicillinresistenz vom Spender auf den Empfänger E. coli
Microbiology
37.9K Ansichten

Phagen-Transduktion: Eine Methode zur Übertragung der Ampicillinresistenz von einem Spender auf den Empfänger E. coli
Microbiology
28.8K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten