Una solución que contiene cantidades apreciables de un par ácido-base conjugado débil se denomina solución tampón o amortiguador. Las soluciones tampón resisten un cambio en el pH cuando se añaden pequeñas cantidades de un ácido fuerte o una base fuerte. Una solución de ácido acético y acetato de sodio es un ejemplo de un amortiguador que consiste en un ácido débil y su sal: CH3COOH (ac) + CH3COONa (ac). Un ejemplo de un tampón que consiste en una base débil y su sal es una solución de amoníaco y cloruro de amonio: NH3 (ac) + NH4Cl (ac).
Cómo funcionan los amortiguadores
Para ilustrar la función de una solución tampón o amortiguador, considere una mezcla de cantidades aproximadamente iguales de ácido acético y acetato de sodio. La presencia de un par ácido-base conjugado débil en la solución imparte la capacidad de neutralizar cantidades modestas de ácido fuerte o base añadidos. Por ejemplo, al añadir una base fuerte a esta solución se neutralizará el ion hidronio y se desplazará el equilibrio de ionización del ácido acético hacia la derecha, restaurando parcialmente la concentración reducida de H3O+:
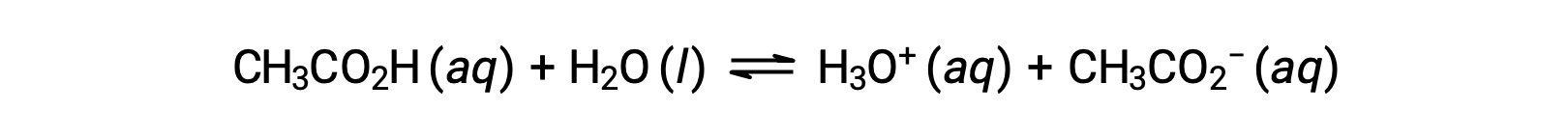
Asimismo, al añadir un ácido fuerte a esta solución tampón se neutralizará el ión acetato, desplazando el equilibrio de ionización anterior hacia la derecha y restaurando la [H3O+] cerca de su valor original. La figura 1 proporciona una ilustración gráfica de los cambios en la solución tampón cuando se añaden ácidos y bases fuertes. La acción amortiguadora de la solución es esencialmente el resultado de la conversión del ácido y la base fuerte añadidos en el ácido y la base débil que conforman el par conjugado del amortiguador. El ácido y la base más débiles experimentan sólo una ligera ionización, en comparación con la ionización completa del ácido y la base fuerte. El pH de la solución, por lo tanto, cambia mucho menos drásticamente que en una solución sin tampón.
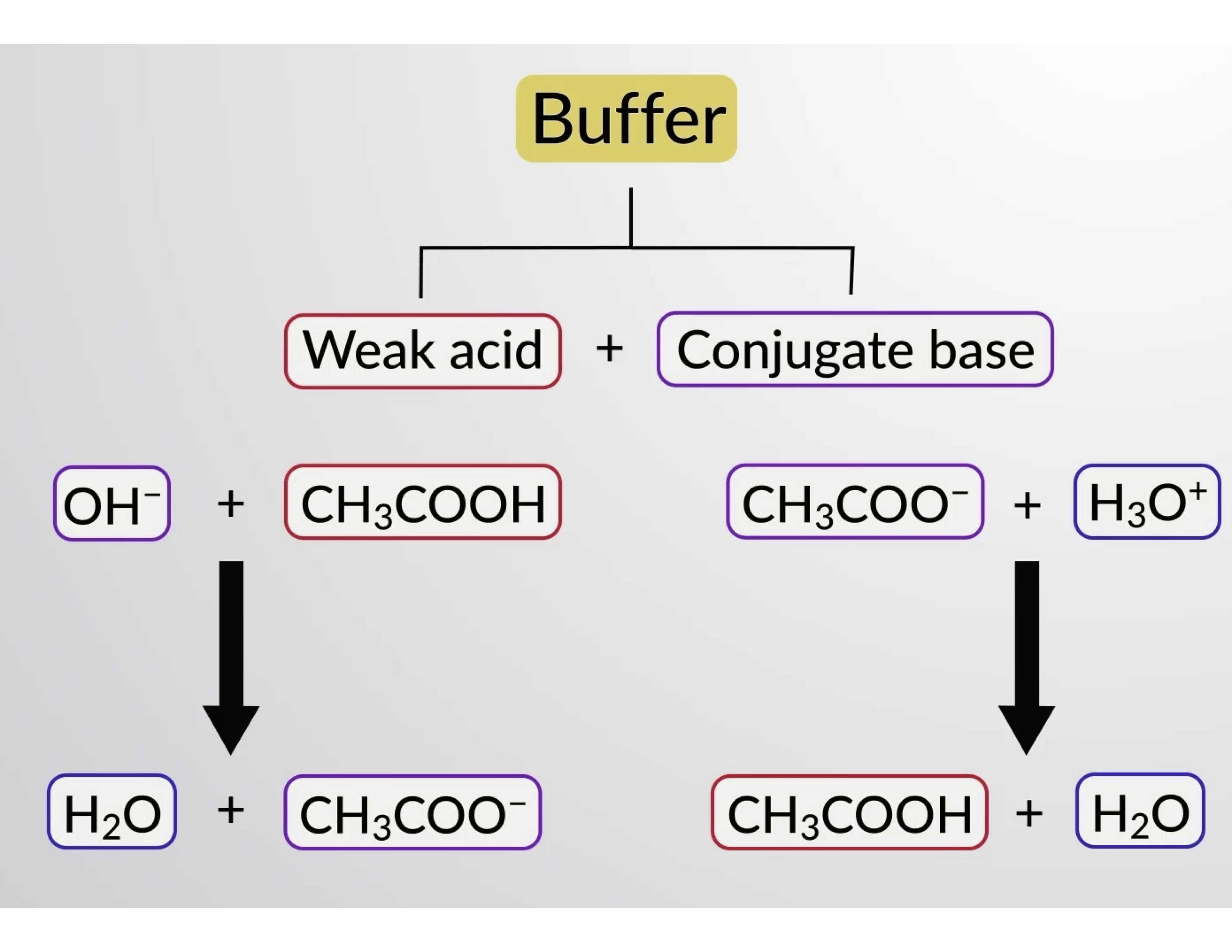
Figura 1.Acción amortiguadora en una mezcla de ácido acético y sal de acetato.
Este texto es adaptado de Openstax, Química 2e, Sección 14.6: Amortiguadores.
Del capítulo 16:

Now Playing
16.2 : Amortiguadores
Equilibrio ácido-base y de solubilidad
162.6K Vistas

16.1 : Efecto del Ion Común
Equilibrio ácido-base y de solubilidad
40.3K Vistas

16.3 : Ecuación de Henderson-Hasselbalch
Equilibrio ácido-base y de solubilidad
67.3K Vistas

16.4 : Calculando los Cambios de pH en una Solución Amortiguadora
Equilibrio ácido-base y de solubilidad
52.0K Vistas

16.5 : Efectividad de un Amortiguador
Equilibrio ácido-base y de solubilidad
47.9K Vistas

16.6 : Cálculos de Titulación: Ácido Fuerte - Base Fuerte
Equilibrio ácido-base y de solubilidad
28.3K Vistas

16.7 : Cálculos de Titulación: Ácido Débil - Base Débil
Equilibrio ácido-base y de solubilidad
42.8K Vistas

16.8 : Indicadores
Equilibrio ácido-base y de solubilidad
47.3K Vistas

16.9 : Titulación de un Ácido Poliprótico
Equilibrio ácido-base y de solubilidad
95.2K Vistas

16.10 : Equilibrio de Solubilidad
Equilibrio ácido-base y de solubilidad
50.3K Vistas

16.11 : Factores que Afectan la Solubilidad
Equilibrio ácido-base y de solubilidad
32.6K Vistas

16.12 : Formación de Iones Complejos
Equilibrio ácido-base y de solubilidad
22.8K Vistas

16.13 : Precipitación Iónica
Equilibrio ácido-base y de solubilidad
27.2K Vistas

16.14 : Análisis Cualitativo
Equilibrio ácido-base y de solubilidad
19.3K Vistas

16.15 : Curvas de Titulación Ácido-Base
Equilibrio ácido-base y de solubilidad
124.4K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados