16.4 : Calculando los Cambios de pH en una Solución Amortiguadora
Un tampón puede evitar una caída repentina o un aumento en el pH de una solución después de la adición de un ácido o una base fuerte hasta su capacidad de amortiguación; sin embargo, la adición de un ácido o una base fuerte da lugar a un ligero cambio en el pH de la solución. El pequeño cambio de pH puede calcularse determinando el cambio resultante en la concentración de los componentes del tampón, es decir, un ácido débil y su base conjugada o viceversa. Las concentraciones obtenidas mediante estos cálculos estequiométricos pueden utilizarse para determinar el pH final de la solución mediante la ecuación de Henderson-Hasselbalch o una tabla ICE.
Por ejemplo, una solución tamponada contiene 0,65 mol de ácido fórmico y de formiato de sodio. Como aquí la concentración del ácido débil y su base conjugada es la misma, el pH de la solución es igual al pKa del ácido débil, que es 3,74 en este caso. Si se añaden 0,50 M de HNO3 a esta solución, los cambios resultantes en la concentración del ácido fórmico y del formiato de sodio pueden determinarse mediante cálculos estequiométricos, como se muestra en la siguiente tabla.
| H+ (ac) | HCOO− (ac) | HCOOH (ac) | |
| Antes de la adición (M) | ~0,00 mol | 0,65 mol | 0,65 mol |
| Adición (M) | 0,050 mol | - | - |
| Después de la adición (M) | ~0,00 mol | 0,60 mol | 0,70 mol |
El pH final de la solución puede determinarse introduciendo las concentraciones modificadas de ácido fórmico y de formiato de sodio en la ecuación de Henderson-Hasselbalch.
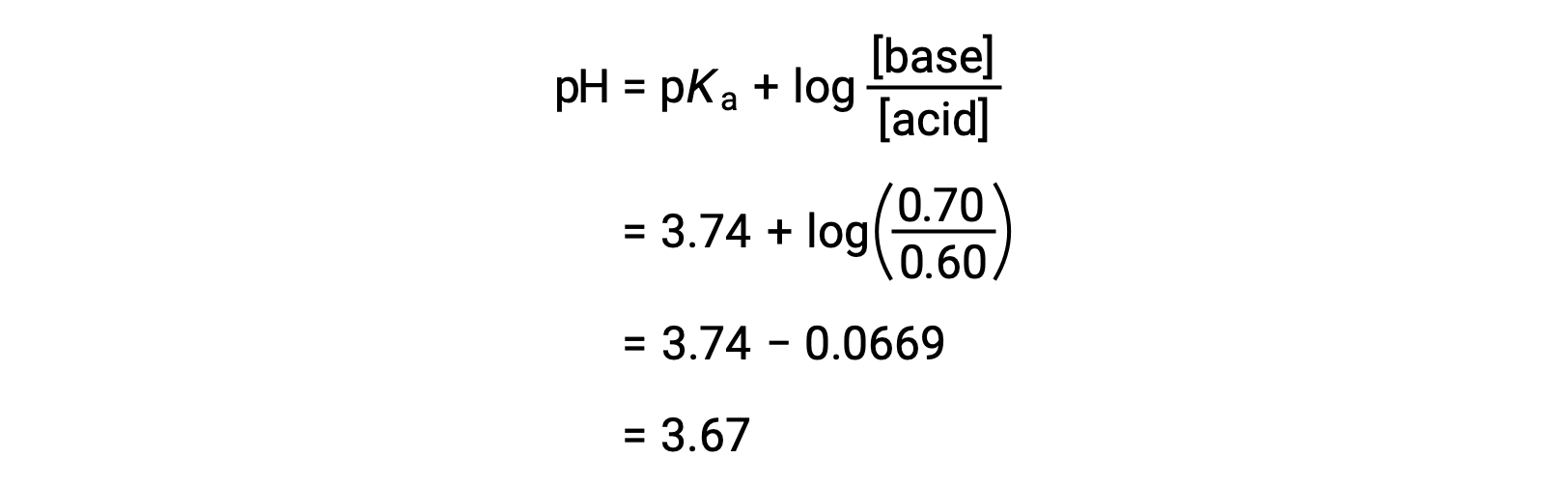
Así, la adición de 0,05 mol de HNO3 reduce el pH de la solución de 3,74 a 3,67.
Asimismo, si se añaden 0,10 mol de NaOH a la misma solución, los cambios resultantes en la concentración del ácido fórmico y del formiato de sodio pueden determinarse mediante cálculos estequiométricos, como se muestra en la tabla siguiente.
| OH− (ac) | HCOOH (ac) | HCOO− (ac) | H2Ol) | |||||
| Antes de la adición (M) | ~0,00 mol | 0,65 mol | 0,65 mol | - | ||||
| Adición (M) | 0,10 mol | - | - | Después de la adición (M) | ~0,00 mol | 0,55 mol | 0,75 mol | - |
El pH final de la solución puede determinarse introduciendo las concentraciones cambiadas de ácido fórmico y de formiato de sodio en la ecuación de Henderson-Hasselbalch.
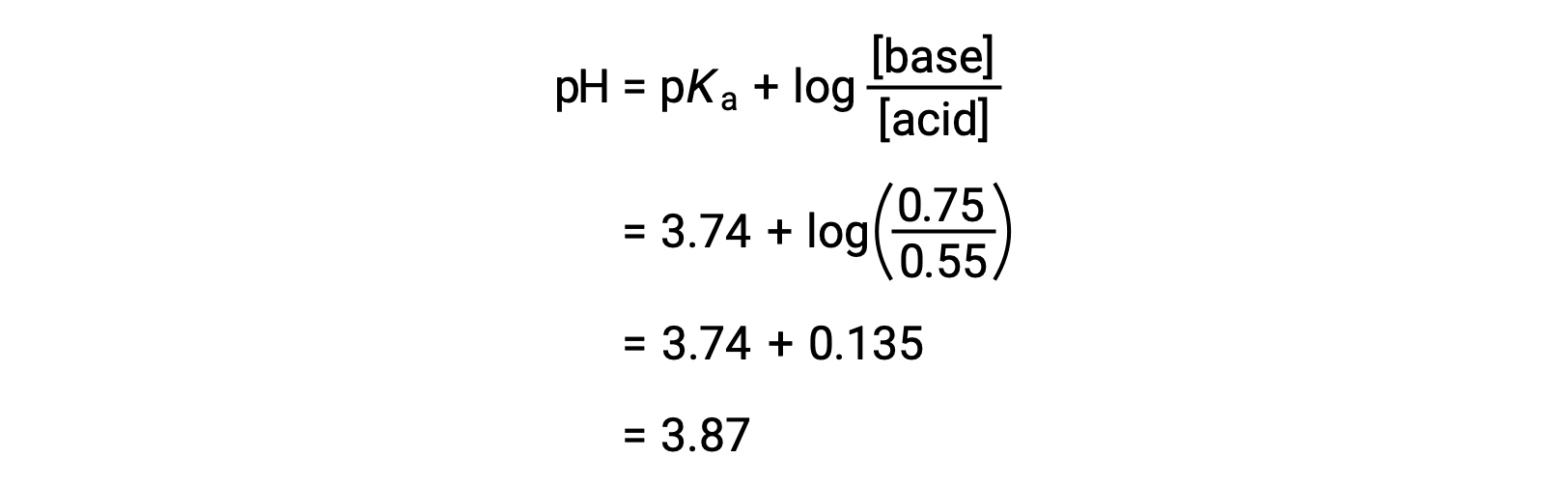
Así, la adición de 0,10 mol de NaOH aumenta el pH de la solución de 3,74 a 3,87.
Del capítulo 16:

Now Playing
16.4 : Calculando los Cambios de pH en una Solución Amortiguadora
Equilibrio ácido-base y de solubilidad
52.6K Vistas

16.1 : Efecto del Ion Común
Equilibrio ácido-base y de solubilidad
41.0K Vistas

16.2 : Amortiguadores
Equilibrio ácido-base y de solubilidad
163.5K Vistas

16.3 : Ecuación de Henderson-Hasselbalch
Equilibrio ácido-base y de solubilidad
68.2K Vistas

16.5 : Efectividad de un Amortiguador
Equilibrio ácido-base y de solubilidad
48.4K Vistas

16.6 : Cálculos de Titulación: Ácido Fuerte - Base Fuerte
Equilibrio ácido-base y de solubilidad
29.0K Vistas

16.7 : Cálculos de Titulación: Ácido Débil - Base Débil
Equilibrio ácido-base y de solubilidad
43.8K Vistas

16.8 : Indicadores
Equilibrio ácido-base y de solubilidad
47.8K Vistas

16.9 : Titulación de un Ácido Poliprótico
Equilibrio ácido-base y de solubilidad
95.7K Vistas

16.10 : Equilibrio de Solubilidad
Equilibrio ácido-base y de solubilidad
52.0K Vistas

16.11 : Factores que Afectan la Solubilidad
Equilibrio ácido-base y de solubilidad
33.0K Vistas

16.12 : Formación de Iones Complejos
Equilibrio ácido-base y de solubilidad
23.2K Vistas

16.13 : Precipitación Iónica
Equilibrio ácido-base y de solubilidad
27.5K Vistas

16.14 : Análisis Cualitativo
Equilibrio ácido-base y de solubilidad
21.5K Vistas

16.15 : Curvas de Titulación Ácido-Base
Equilibrio ácido-base y de solubilidad
126.5K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados