16.4 : 緩衝液中のpHの変化の計算
緩衝剤は、その緩衝能まで強酸または強塩基を加えても溶液pHの急激な低下または上昇を防ぐことができます。しかしながら、そのような強酸または強塩基の添加は、溶液のわずかなpH変化をもたらします。このわずかなpH変化は、結果として生じる緩衝成分、すなわち弱酸とその共役塩基、またはその逆の濃度変化を求めることで算出できます。これらの化学量論的な計算で得られた濃度は、ヘンダーソン-ハッセルバルヒ式またはICE表を使用して、溶液’の最終的なpHを決定するために使用することができます。
例えば、0.65 molのギ酸とギ酸ナトリウムを含む緩衝液を考えます。ここでは弱酸とその共役塩基の濃度が同じなので、溶液のpHは弱酸のpKaに等しく、この場合は3.74となります。この溶液に0.05 molのHNO3を加えた際のギ酸およびギ酸ナトリウムの濃度変化は、化学量論的計算によって下表のように求められます。
| H+ (aq) | HCOO− (aq) | HCOOH (aq) | |
| 添加前 (M) | ~0.00 mol | 0.65 mol | 0.65 mol |
| 添加量 (M) | 0.050 mol | - | - |
| 添加後 (M) | ~0.00 mol | 0.60 mol | 0.70 mol |
その後、ヘンダーソン・ハッセルバルヒ式にギ酸とギ酸ナトリウムの新たな濃度を代入することで、溶液の最終的なpHを求めることができます。
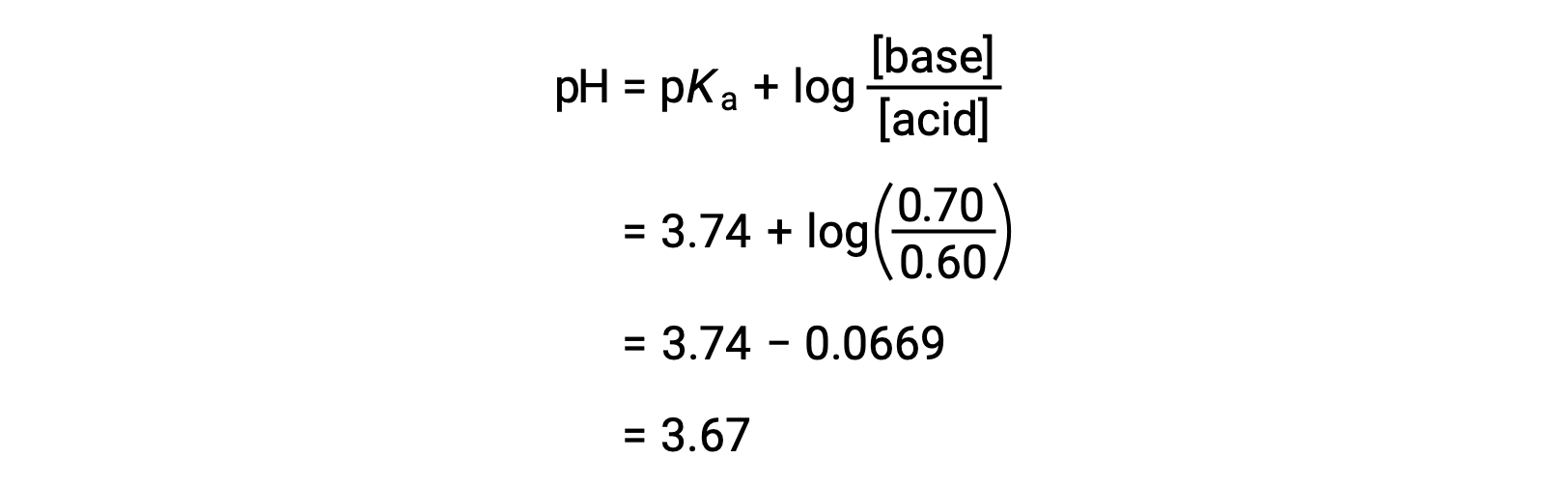
このように、0.05 molのHNO3 を加えることにより、溶液のpHは3.74から3.67に低下します。
同様に、同じ溶液に0.10 molのNaOHを加えた場合、ギ酸とギ酸ナトリウムの濃度の変化は、化学量論的計算によって下表のように求めることができます。
| OH− (aq) | HCOOH (aq) | HCOO− (aq) | H2O (l) | |
| 添加前 (M) | ~0.00 mol | 0.65 mol | 0.65 mol | - |
| 添加量 (M) | 0.10 mol | - | - | - |
| 添加後 (M) | ~0.00 mol | 0.55 mol | 0.75 mol | - |
その後、ヘンダーソン・ハッセルバルヒ式にギ酸とギ酸ナトリウムの新たな濃度を代入することで、溶液の最終的なpHを求めることができます。
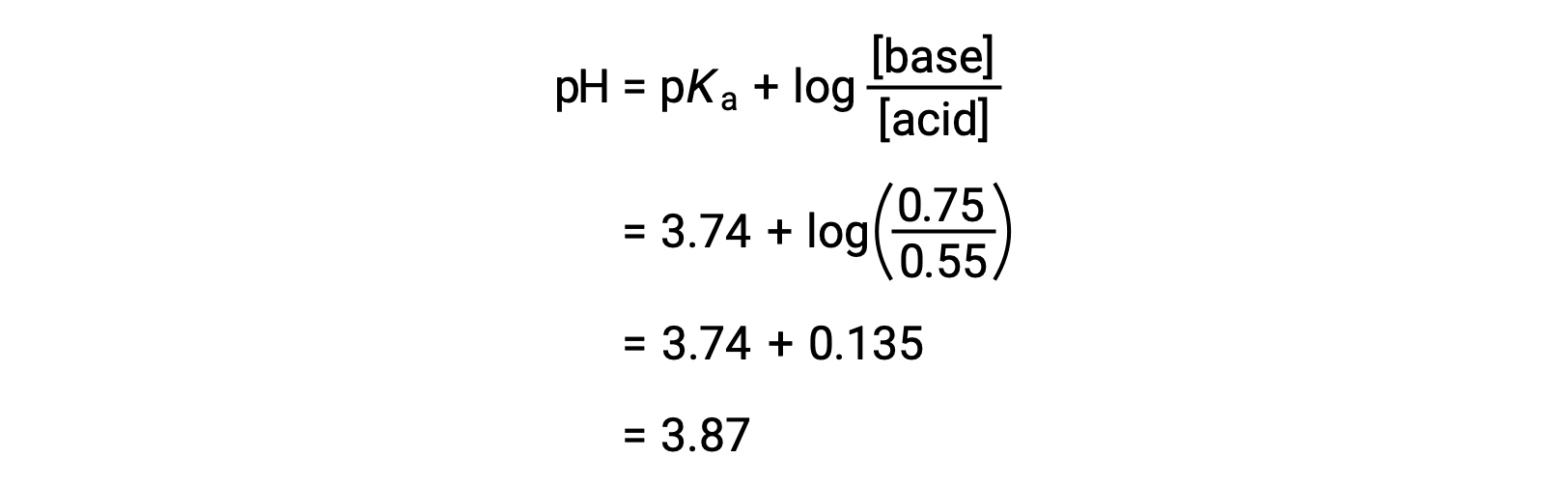
したがって、0.10 molのNaOHを加えると、溶液のpHは3.74から3.87に上昇します。
章から 16:

Now Playing
16.4 : 緩衝液中のpHの変化の計算
酸塩基と溶解度平衡
52.8K 閲覧数

16.1 : 共通イオン効果
酸塩基と溶解度平衡
41.1K 閲覧数

16.2 : 緩衝液
酸塩基と溶解度平衡
163.7K 閲覧数

16.3 : ヘンダーソン-ハッセルバルヒ式
酸塩基と溶解度平衡
68.4K 閲覧数

16.5 : 緩衝液の有効性
酸塩基と溶解度平衡
48.6K 閲覧数

16.6 : 滴定計算:強酸-強塩基
酸塩基と溶解度平衡
29.2K 閲覧数

16.7 : 滴定計算:弱酸-弱塩基
酸塩基と溶解度平衡
43.9K 閲覧数

16.8 : 指示薬
酸塩基と溶解度平衡
48.0K 閲覧数

16.9 : 多価酸の滴定
酸塩基と溶解度平衡
95.9K 閲覧数

16.10 : 溶解平衡
酸塩基と溶解度平衡
52.2K 閲覧数

16.11 : 溶解性に影響する因子
酸塩基と溶解度平衡
33.2K 閲覧数

16.12 : 錯体イオンの形成
酸塩基と溶解度平衡
23.4K 閲覧数

16.13 : イオンの沈殿
酸塩基と溶解度平衡
27.7K 閲覧数

16.14 : 定性分析
酸塩基と溶解度平衡
22.0K 閲覧数

16.15 : 酸塩基滴定曲線
酸塩基と溶解度平衡
126.8K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved