16.4 : Calcolo delle variazioni di pH in una soluzione tampone
Un tampone può prevenire un improvviso calo o aumento del pH di una soluzione dopo l'aggiunta di un acido forte o di una base fino alla sua capacità di buffering; tuttavia, tale aggiunta di un acido o di una base forte si traducono in un leggero cambiamento di pH della soluzione. La piccola variazione di pH può essere calcolata determinando la variazione risultante nella concentrazione dei componenti tampone, cioè un acido debole e la sua base coniugata o viceversa. Le concentrazioni ottenute utilizzando questi calcoli stechiometrici possono essere utilizzate per determinare il pH finale della soluzione usando l'equazione di Henderson-Hasselbalch o una tabella ICE.
Ad esempio, una soluzione tamponata contiene 0,65 mol di acido formico e formato sodio. Poiché la concentrazione dell'acido debole e della sua base coniugata è la stessa qui, il pH della soluzione è uguale al pKa dell'acido debole, che è 3,74 in questo caso. Se in questa soluzione viene aggiunto 0,05 mol HNO3, le variazioni risultanti nella concentrazione dell'acido formico e del formato sodio possono essere determinate mediante calcoli stechiometrici, come mostrato nella tabella seguente.
| H+ (aq) | HCOO− (aq) | HCOOH (aq) | |
| Prima dell'aggiunta (M) | ~0,00 mol | 0,65 mol | 0,65 mol |
| Addizione (M) | 0,050 mol | - | - |
| Dopo l'addizione (M) | ~0,00 mol | 0,60 mol | 0,70 mol |
Il pH finale della soluzione può quindi essere determinato collegando concentrazioni modificate di acido formico e formato sodio nell'equazione di Henderson-Hasselbalch.
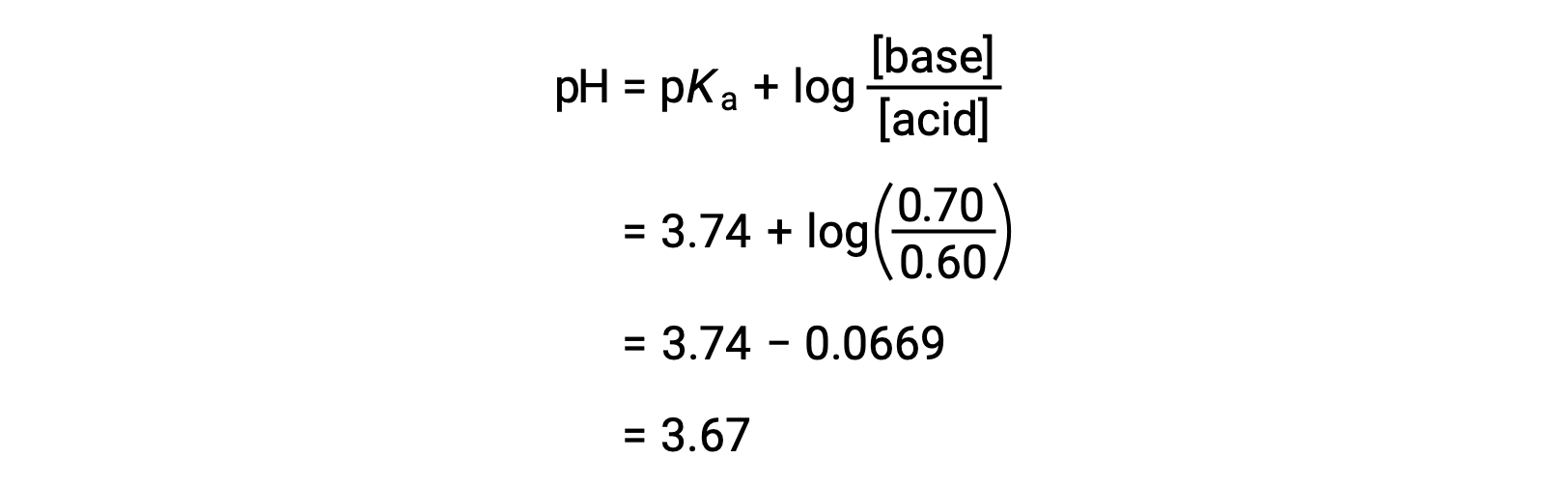
Pertanto, l'aggiunta di 0,05 mol di HNO3 riduce il pH della soluzione da 3,74 a 3,67.
Analogamente, se nella stessa soluzione viene aggiunto 0,10 mol NaOH, le variazioni risultanti nella concentrazione dell'acido formico e del formato sodio possono essere determinate mediante calcoli stechiometrici, come mostrato nella tabella seguente.
| OH− (aq) | HCOOH (aq) | HCOO− (aq) | H2O (l) | |
| Prima dell'aggiunta (M) | ~0,00 mol | 0,65 mol | 0,65 mol | - |
| Addizione (M) | 0,10 mol | - | - | - |
| Dopo l'addizione (M) | ~0,00 mol | 0,55 mol | 0,75 mol | - |
Il pH finale della soluzione può quindi essere determinato collegando concentrazioni modificate di acido formico e formato sodio nell'equazione di Henderson-Hasselbalch.
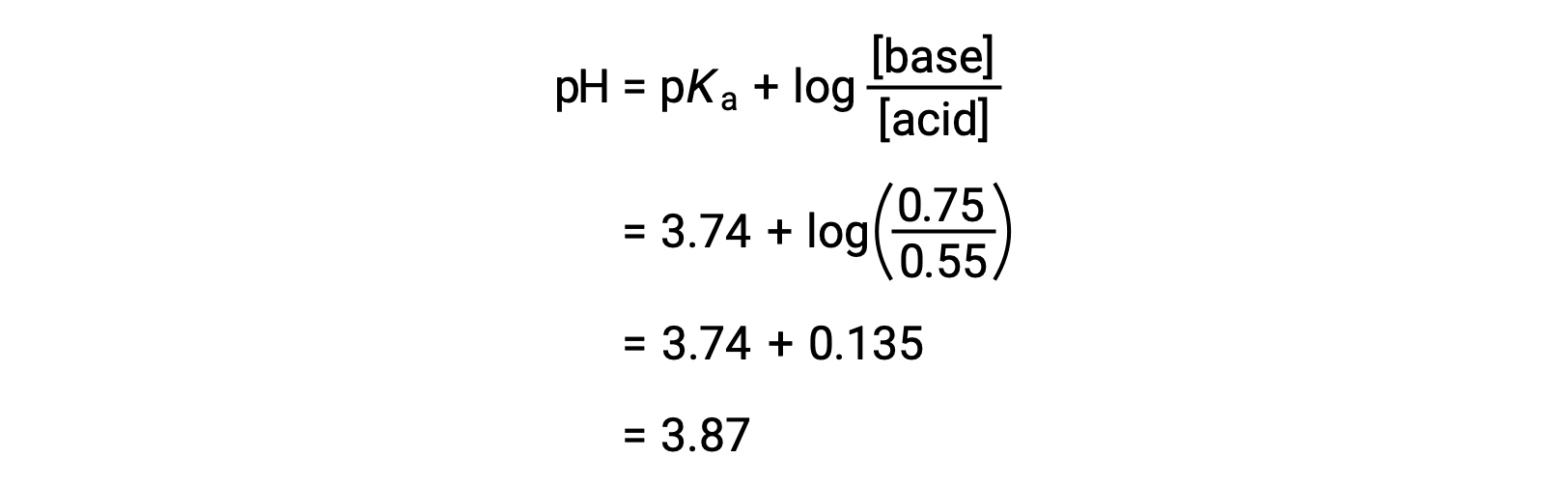
Pertanto, l'aggiunta di NaOH da 0,10 mol aumenta il pH della soluzione da 3,74 a 3,87.
Dal capitolo 16:

Now Playing
16.4 : Calcolo delle variazioni di pH in una soluzione tampone
Equilibri acido-base e di solubilità
52.9K Visualizzazioni

16.1 : Effetto ionico comune
Equilibri acido-base e di solubilità
41.2K Visualizzazioni

16.2 : Buffer
Equilibri acido-base e di solubilità
163.7K Visualizzazioni

16.3 : Equazione di Henderson-Hasselbalch
Equilibri acido-base e di solubilità
68.4K Visualizzazioni

16.5 : Efficacia del buffer
Equilibri acido-base e di solubilità
48.7K Visualizzazioni

16.6 : Calcoli di titolazione: acido forte - base forte
Equilibri acido-base e di solubilità
29.2K Visualizzazioni

16.7 : Calcoli di titolazione: acido debole - base debole
Equilibri acido-base e di solubilità
43.9K Visualizzazioni

16.8 : Indicatori
Equilibri acido-base e di solubilità
48.1K Visualizzazioni

16.9 : Titolazione di un acido poliprotico
Equilibri acido-base e di solubilità
95.9K Visualizzazioni

16.10 : Equilibrio di solubilità
Equilibri acido-base e di solubilità
52.2K Visualizzazioni

16.11 : Fattori che influenzano la solubilità
Equilibri acido-base e di solubilità
33.2K Visualizzazioni

16.12 : Formazione di ioni complessi
Equilibri acido-base e di solubilità
23.4K Visualizzazioni

16.13 : Precipitazione di ioni
Equilibri acido-base e di solubilità
27.7K Visualizzazioni

16.14 : Analisi qualitativa
Equilibri acido-base e di solubilità
22.0K Visualizzazioni

16.15 : Curve di titolazione acido-base
Equilibri acido-base e di solubilità
126.9K Visualizzazioni