Un tipo de química ácido-base de Lewis implica la formación de un ion complejo (o un complejo de coordinación) que comprende un átomo central, típicamente un catión de metal de transición, rodeado de iones o moléculas llamadas ligandos. Estos ligandos pueden ser moléculas neutras como el H2O o el NH3, o iones como el CN− o el OH−. A menudo, los ligandos actúan como bases de Lewis, donando un par de electrones al átomo central. Este tipo de reacciones ácido-base de Lewis son ejemplos de una amplia subdisciplina llamada química de coordinación—el tema de otro capítulo en este texto.
La constante de equilibrio para la reacción de un ion metálico con uno o más ligandos para formar un complejo de coordinación se denomina constante de formación (Kf) (a veces llamada constante de estabilidad). Por ejemplo, el ion complejo [Cu(CN)2]− es producido por la reacción
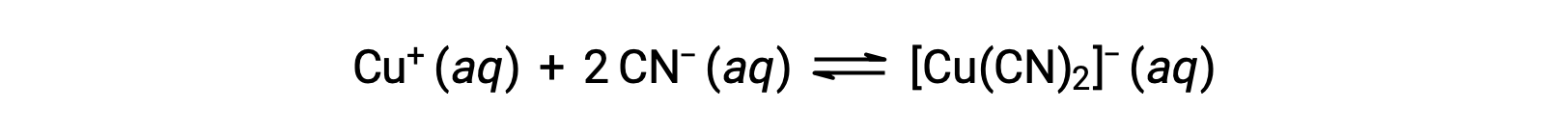
La constante de formación para esta reacción es
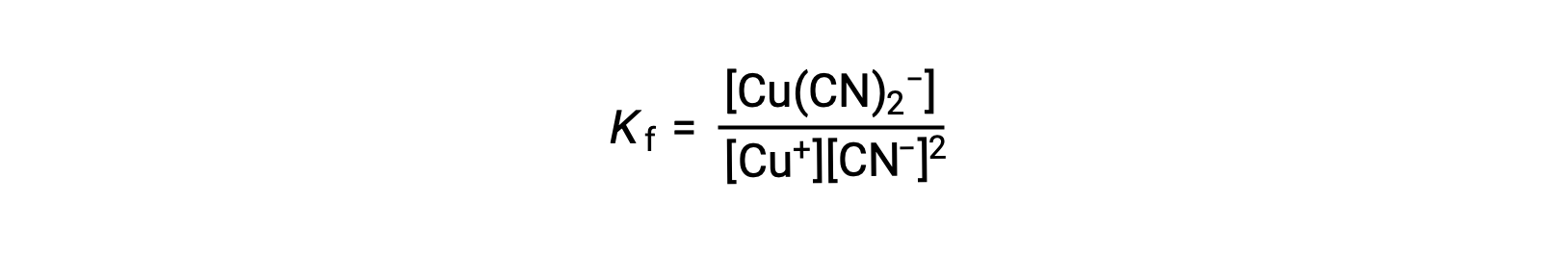
Alternativamente, se puede considerar la reacción inversa (descomposición del ion complejo), en cuyo caso la constante de equilibrio es una constante de disociación (Kd). Según la relación entre las constantes de equilibrio para las reacciones recíprocas descritas, la constante de disociación es la inversa matemática de la constante de formación, Kd = Kf−1.
Como ejemplo de disolución mediante formación de iones complejos, considere lo que sucede cuando se agrega amoníaco acuoso a una mezcla de cloruro de plata y agua. El cloruro de plata se disuelve ligeramente en agua, dando una pequeña concentración de Ag+ ([Ag+] = 1,3 × 10−5 M):
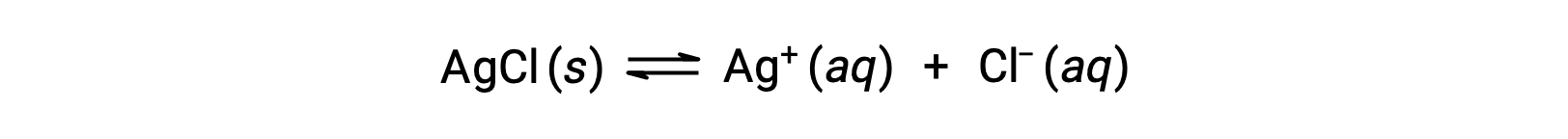
Sin embargo, si NH3 está presente en el agua, el ion complejo, [Ag(NH3)2]+, puede formarse de acuerdo con la ecuación:
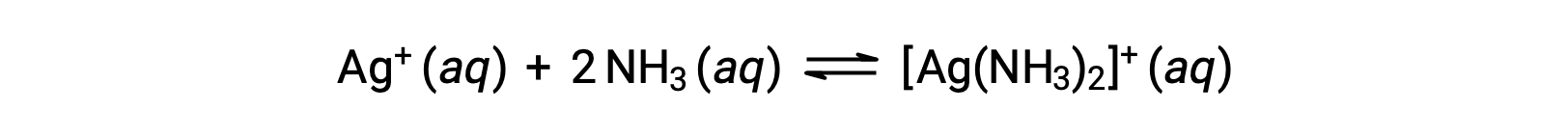
Este texto es adaptado de Openstax, Química 2e, Sección 15.2: Ácidos y bases de Lewis.
Del capítulo 16:

Now Playing
16.12 : Formación de Iones Complejos
Equilibrio ácido-base y de solubilidad
22.8K Vistas

16.1 : Efecto del Ion Común
Equilibrio ácido-base y de solubilidad
40.3K Vistas

16.2 : Amortiguadores
Equilibrio ácido-base y de solubilidad
162.6K Vistas

16.3 : Ecuación de Henderson-Hasselbalch
Equilibrio ácido-base y de solubilidad
67.3K Vistas

16.4 : Calculando los Cambios de pH en una Solución Amortiguadora
Equilibrio ácido-base y de solubilidad
52.0K Vistas

16.5 : Efectividad de un Amortiguador
Equilibrio ácido-base y de solubilidad
47.9K Vistas

16.6 : Cálculos de Titulación: Ácido Fuerte - Base Fuerte
Equilibrio ácido-base y de solubilidad
28.3K Vistas

16.7 : Cálculos de Titulación: Ácido Débil - Base Débil
Equilibrio ácido-base y de solubilidad
42.8K Vistas

16.8 : Indicadores
Equilibrio ácido-base y de solubilidad
47.3K Vistas

16.9 : Titulación de un Ácido Poliprótico
Equilibrio ácido-base y de solubilidad
95.2K Vistas

16.10 : Equilibrio de Solubilidad
Equilibrio ácido-base y de solubilidad
50.3K Vistas

16.11 : Factores que Afectan la Solubilidad
Equilibrio ácido-base y de solubilidad
32.6K Vistas

16.13 : Precipitación Iónica
Equilibrio ácido-base y de solubilidad
27.2K Vistas

16.14 : Análisis Cualitativo
Equilibrio ácido-base y de solubilidad
19.3K Vistas

16.15 : Curvas de Titulación Ácido-Base
Equilibrio ácido-base y de solubilidad
124.4K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados