Isomerismo en los complejos
Los isómeros son diferentes especies químicas que tienen la misma fórmula química. El isomerismo estructural de los compuestos de coordinación puede dividirse en dos subcategorías, los isómeros de enlace y los isómeros de la esfera de coordinación.
Los isómeros de enlace ocurren cuando el compuesto de coordinación contiene un ligando que puede unirse al centro de metal de transición a través de dos átomos diferentes. Por ejemplo, el ligando CN− puede unirse a través del átomo de carbono o a través del átomo de nitrógeno. Del mismo modo, SCN− se puede enlazar a través del átomo de azufre o nitrógeno. En la Figura 1 se muestran algunos ligandos diferentes capaces de ligandos isomerismo de enlace. La nomenclatura de los ligandos capaces de hacer isomerismo de enlace depende del átomo donante que se une con el ión metálico. Por ejemplo, un ligando CN− unido a través del átomo de carbono se llama ciano, mientras que el mismo ligando unido a través del átomo de nitrógeno se llama isocyano.
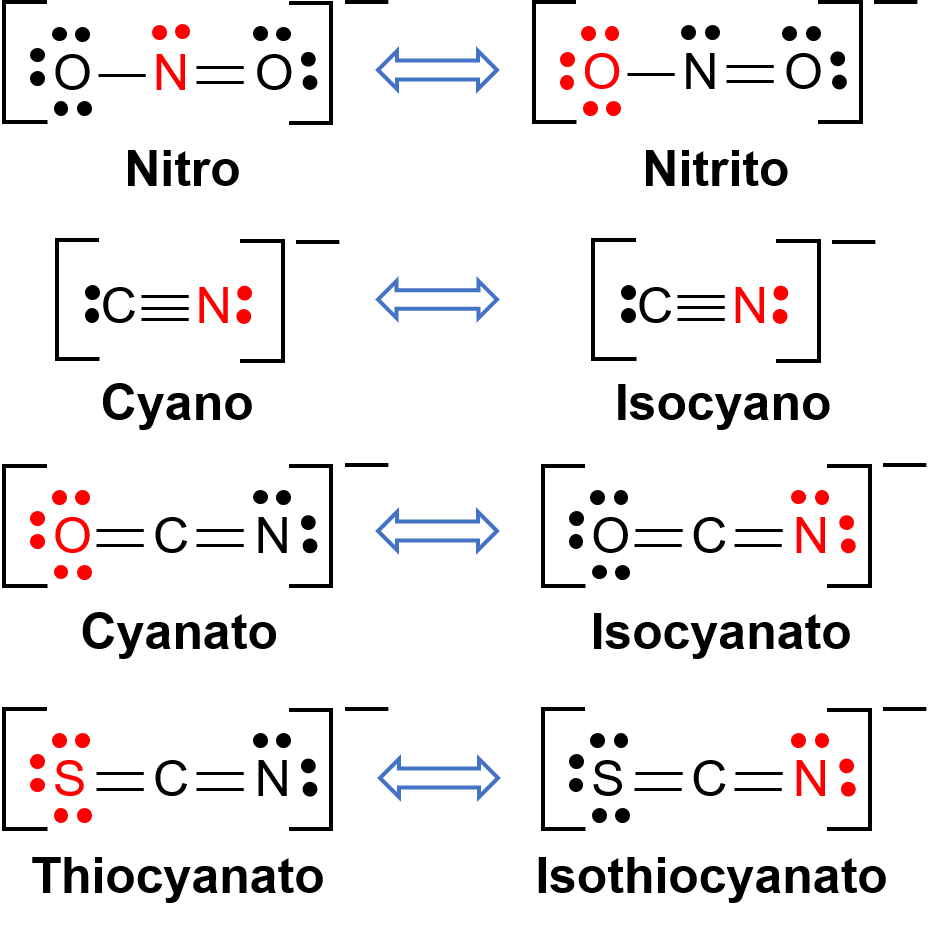
Figura 1.Lista de diferentes ligandos capaces de hacer isomerismo de enlace. En la molécula del ligando, el átomo en rojo se une al átomo central de metal.
Los isómeros de la esfera de coordinación (o isómeros de ionización) se producen cuando un ligando aniónico en la esfera de coordinación interna se sustituye por el contraión de la esfera de coordinación externa. Un ejemplo sencillo de dos isómeros de esfera de coordinación son [CoCl6][Br] y [CoCl5Br][CL].
Este texto es adaptado de Openstax, Química 2e, Section19.2: Química de Coordinación de los Metales de Transición.
Tags
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
