20.5 : Isomerismo Estrutural
Isomerismo em Complexos
Isómeros são espécies químicas diferentes que têm a mesma fórmula química. O isomerismo estrutural dos compostos de coordenação pode ser dividido em duas subcategorias, os isómeros de ligação e os isómeros de esfera de coordenação.
Isómeros de ligação ocorrem quando o composto de coordenação contém um ligando que se pode ligar ao centro de metal de transição através de dois átomos diferentes. Por exemplo, o ligando CN− pode ligar-se através do átomo de carbono ou através do átomo de azoto. Da mesma forma, SCN− pode ligar-se através do átomo de enxofre ou de azoto. Alguns ligandos diferentes capazes de isomerismo de ligação são mostrados na Figura 1. A nomenclatura dos ligandos capazes de isomerismo de ligação depende de qual átomo dador é ligado ao ião metálico. Por exemplo, um ligando CN− ligado através do átomo de carbono é chamado de ciano, enquanto que o mesmo ligando ligado através de um átomo de azoto é chamado isociano.
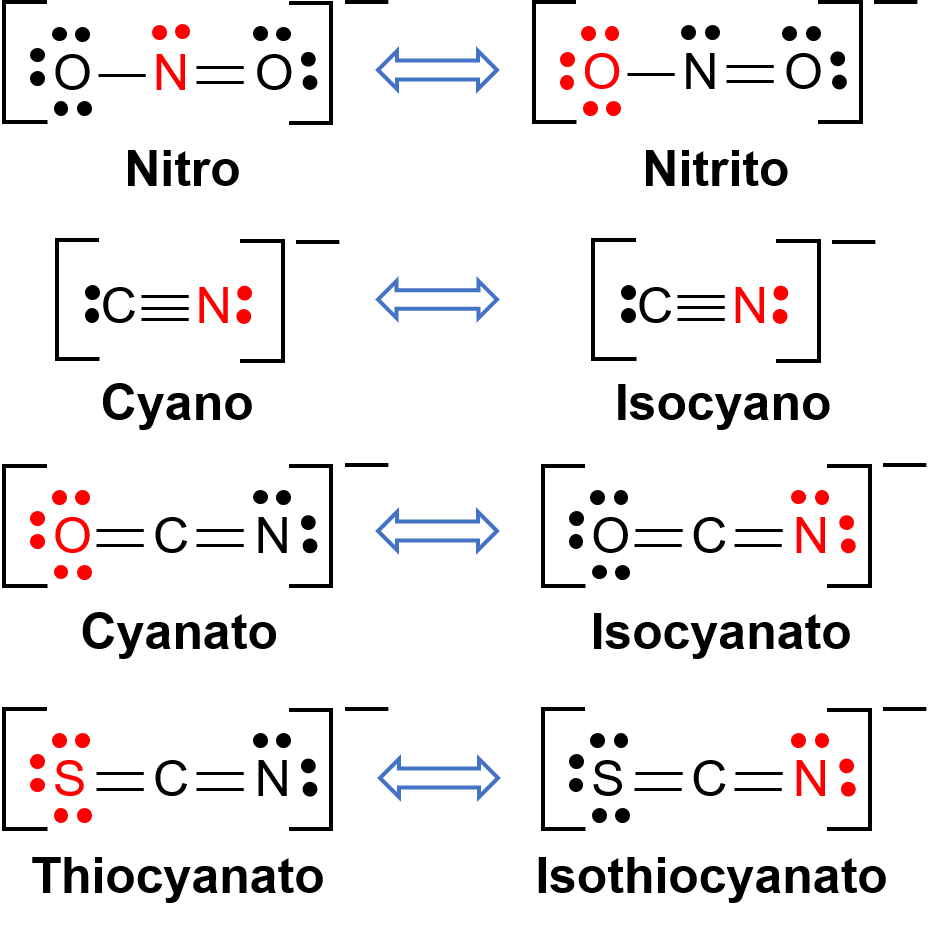
Figura 1. Lista de ligandos diferentes capazes de isomerismo de ligação. Na molécula do ligando, o átomo a vermelho liga-se ao átomo central de metal.
Isómeros de esfera de coordenação (ou isómeros de ionização) ocorrem quando um ligando aniónico na esfera de coordenação interior é substituído pelo contra-ião da esfera de coordenação exterior. Um exemplo simples de dois isómeros de esfera de coordenação são [CoCl6][Br] e [CoCl5Br][Cl].
Este texto é adaptado de Openstax, Chemistry 2e, Section19.2: Coordination Chemistry of Transition Metals.
Tags
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
