Komplekslerde İzomerizm
İzomerler, aynı kimyasal formüle sahip farklı kimyasal türlerdir. Koordinasyon bileşiklerinin yapısal izomerizmi, bağlantı izomerleri ve koordinasyon küresi izomerleri olmak üzere iki alt kategoriye ayrılabilir.
Bağlantı izomerleri, koordinasyon bileşiği iki farklı atomdan geçiş metali merkezine bağlanabilen bir ligand içerdiğinde ortaya çıkar. Örneğin, CN−ligand karbon atomu veya azot atomu ile bağlanabilir. Benzer şekilde, SCN− kükürt veya azot atomu ile bağlanabilir. Bağlantı izomerizmine sahip birkaç farklı ligand Şekil 1'de gösterilmiştir. İzomerizmi bağlayabilen ligandların isimlendirilmesi, hangi donör atomunun metal iyonu ile bağlandığına bağlıdır. Örneğin, bir karbon atomundan bağlanan bir CN− ligandına siyano denir ve bir azot atomundan bağlanan aynı ligand izosiyano olarak adlandırılır.
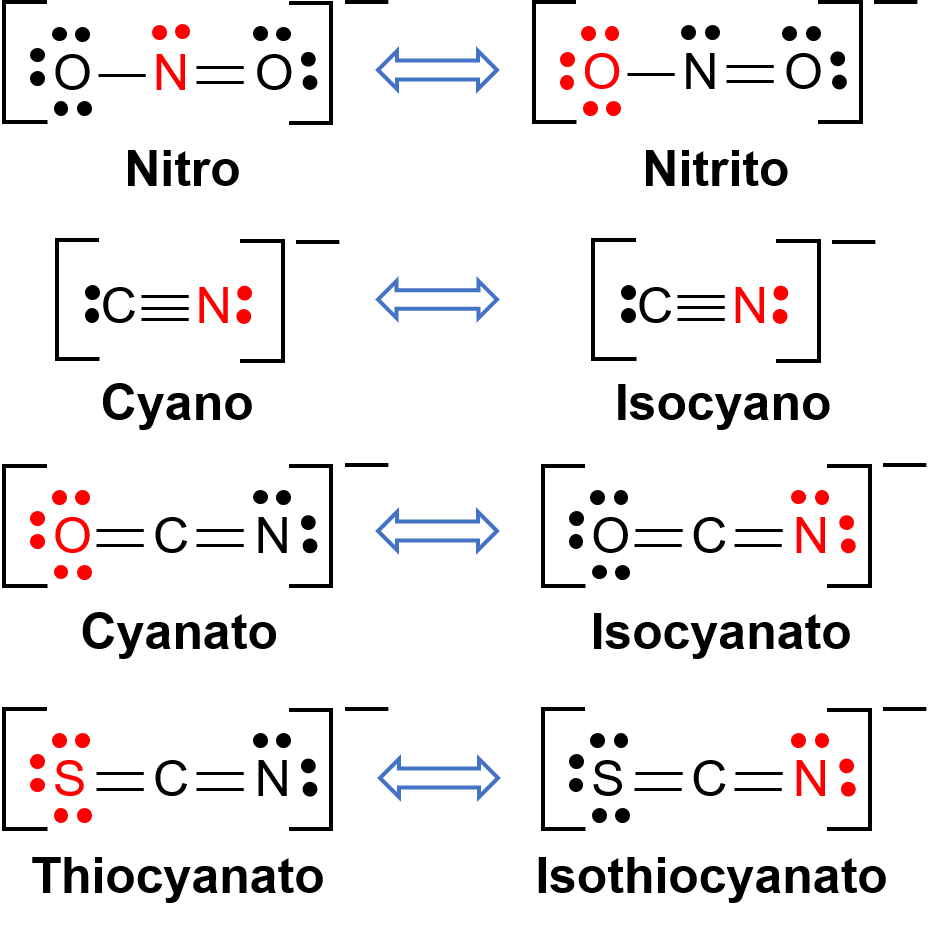
Şekil 1. Bağlantı izomerizmi yapabilen farklı ligandların listesi. Ligand molekülünde, kırmızıdaki atom merkezi metal atoma bağlanır.
Koordinasyon küresi izomerleri (veya iyonlaşma izomerleri), iç koordinasyon alanındaki bir anyonik ligand dış koordinasyon küresinden gelen karşı iyonla değiştirildiğinde ortaya çıkar. İki koordinasyon küresi izomerinin basit bir örneği [CoCl6][Br] ve [CoCl5Br][Cl]'dir.
Bu metin bu kaynaktan uyarlanmıştır: Openstax, Chemistry 2e, Section19.2: Coordination Chemistry of Transition Metals.
Etiketler
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır
