Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Tinción de las proteínas en geles con Coomassie G-250, sin ácido disolvente orgánico y el acético
En este artículo
Resumen
Un protocolo corto para la tinción de proteínas con Coomassie Brilliant Blue (CBB) G-250 en geles de poliacrilamida se describe sin el uso de disolventes orgánicos o en ácido acético como en los procedimientos clásicas de tinción con CBB.
Resumen
En los protocolos clásicos de proteínas tinción con Coomassie Brilliant Blue (CBB), las soluciones con un alto contenido de disolventes orgánicos tóxicos e inflamables (metanol, etanol o 2-propanol) y ácido acético se utilizan para la fijación, tinción y decoloración de las proteínas en un gel de SDS después -PAGE. Para acelerar el procedimiento, el calentamiento de la solución de tinción en el horno de microondas por un corto período de tiempo se utiliza con frecuencia. Esto usualmente resulta en la evaporación de metanol tóxicos o peligrosos, etanol o 2-propanol y un fuerte olor a ácido acético en el laboratorio que deben evitarse por motivos de seguridad. En un protocolo publicado originalmente en dos solicitudes de patente por EM Wondrak (US2001046709 (A1), US6319720 (B1)), una composición alternativa de la solución de tinción se describe en la que no solvente orgánico o ácido se utiliza. El CBB se disuelve en agua bidestilada (60-80mg de CBB G-250 por litro) y 35 mM HCl se agrega como el único compuesto otros en la solución de tinción. El CBB staning del gel se realiza después de SDS-PAGE y minuciosamente del gel en agua bidestilada. Al calentar el gel durante el lavado y la tinción de pasos, el proceso puede terminar más rápido y no compunds tóxicos o peligrosos se evapora. La tinción de las proteínas ocurre ya dentro de 1 minuto después de calentar el gel en solución de tinción y se desarrolla completamente después de 15-30 minutos con un fondo azul que es un poco desteñido por completo por el lavado prolongado del gel teñido con agua bidestilada, sin afectar a la proteína manchado bandas.
Protocolo
Parte 1: Preparación de la solución de tinción CBB
- 60-80 mg de CBB G-250 se disuelven en 1 litro de agua bidestilada por agitación durante 2-4 horas. Por último, 3 ml de HCl concentrado, se añade a la solución de color azul oscuro con agitación durante un minuto y se almacena en la oscuridad para su uso posterior. La solución se puede almacenar durante varias semanas hasta varios meses sin perder su eficacia manchas.
- HCl concentrado debe ser manejado con el cuidado habitual und usada bajo una campana de humos. La solución final será aproximadamente a pH 2, por lo que se debe utilizar guantes y cualquier contacto con la piel debe ser evitado.
Parte 2: SDS-PAGE
- Alícuotas apropiadas de muestras de proteínas se mezclan con tampón de carga a una concentración final de tampón de carga 1x. Usamos tampón de carga 2x 125mm Tris/H3PO4 (pH 7,5 a 25 ° C), 2 mM EDTA, SDS al 4%, DTT 200 mM, azul de bromofenol 0,02% y el 50% de glicerol. Otros tampones de carga para SDS-PAGE se puede usar también.
- Las muestras de proteínas se calientan durante unos 5 minutos antes de la carga. Mientras tanto, la cámara de electroforesis en gel se prepara para la carrera. Usamos NuPAGE prefabricados 12.04% © Bis-Tris geles (Invitrogen) en un SureLock XCell ® Mini-Cell (Invitrogen), con economía de mercado-buffer como el funcionamiento de amortiguación, pero cualquier otro gel y el sistema de electroforesis se puede utilizar también.
- Las muestras de proteínas se cargan en el gel y la electroforesis en una duración de 50 minutos a 220V.
Parte 3: La tinción del gel
- El gel cassette está desmontada y el gel en una caja para los pasos posteriores de lavado.
- Cerca de 100 ml de agua bidestilada se añade el gel y se calienta en el microondas durante 30 segundos. Calefacción debe detenerse antes de la ebullición se produce. La caja con el gel se coloca en un agitador durante 3-5 min. y este paso de lavado se repite dos veces con agua fresca.
- Suficiente solución de tinción CBB se añade a cubrir el gel en la caja y la caja se calienta en el microondas durante 10 segundos. sin hervir. La caja con el gel se coloca en un agitador para el acabado de la tinción. Ya después de 1 minuto, las bandas de proteínas se puede observar, después de 15-30 min. la tinción es lo suficientemente fuerte como en la mayoría de los casos.
- La solución colorante se escurre y 50-100 ml de agua bidestilada, se añade con el fin de destain aún más la luz de fondo azul del gel en un agitador. El agua puede ser sustituida por agua dulce para la decoloración más si es necesario.
- El gel puede ser escaneado, fotografiado o secas para almacenamiento a largo plazo
Parte 4: Resultados del representante:
Ver fig. 1 para un gel teñido correctamente siguiendo el procedimiento descrito.
Ver fig. 2 para un gel que no se ha lavado el tiempo suficiente antes de la tinción y coloración residual SDS inhibe eficiente. Tenga en cuenta que los carriles marcador (*) contienen la misma cantidad de proteínas marcadoras.

Fig. 1: Representante manchadas gel después de cargar las muestras de una purificación de proteínas (*: marcador de peso molecular).
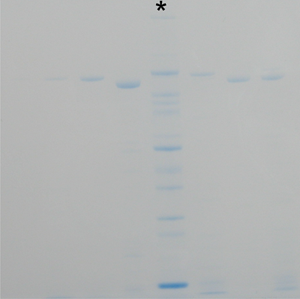
Fig. 2: CBB gel de colores que no se ha lavado el tiempo suficiente antes de la tinción CBB. Las bandas de proteínas aparecen más débiles (nótese que el carril * marcador contiene la misma cantidad de proteínas como en la fig. 1).
Discusión
- Los pasos de lavado son fundamentales para la tinción eficiente de las proteínas. Una reducción del tiempo de lavado por debajo de 2 min o disminución del volumen de agua (<50 ml) puede dar lugar a bandas de proteínas pálido azul, muy probablemente debido a una mayor cantidad de residuos SDS en el gel.
- Si las proteínas van a ser analizados por espectrometría de masas, los pasos de calentamiento en el horno de microondas debe ser omitido, el tiempo para el lavado del gel extendido a unos 10 minutos en cada paso y el...
Divulgaciones
Agradecimientos
Nos gustaría agradecer la asistencia técnica de Inés Racke.
Materiales
| Name | Company | Catalog Number | Comments |
| Coomassie Brilliant Blue G-250 | AppliChem | A3480 | any other CBB G-250 could be used as well |
| Concentrated HCl |
Referencias
- Wondrak, E. M. Process for fast visualization of protein. US patent. , (2001).
- Wondrak, E. M. Solution for fast visualization of protein. US patent. , (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados